一种动物骨颗粒脱蛋白的方法与流程
1.本发明属于医用材料技术领域,具体涉及一种动物骨颗粒脱蛋白的方法。
背景技术:
2.骨移植手术应用于骨科临床已有多年的历史,自体骨移植作为植骨的金标准,在临床上有着很好的愈合效果。自体骨多取自患者腓骨或髋骨,取骨量有限,患者承受二次手术的痛苦,自体骨移植应用因此而受限。
3.为了解决骨移植的问题,人们使用人工骨、同种异体骨、异种异体骨等材料,代替自体骨移植用于临床治疗。人工骨材料多为经1000℃以上高温煅烧后的羟基磷灰石晶体或经化学反应合成的β
‑
磷酸三钙或硫酸钙晶体,但其无法模拟天然骨材料复杂的微观结构,天然骨中
‑‑‑‑
尤其是以弱结晶形式存在的少量碳酸盐,其对于骨的降解性有着重要的影响。因而人工骨材料的降解性一直是制约其临床应用的瓶颈。
4.同种异体骨来源于人尸体骨,制备过程中只需除去脂肪和部分蛋白(主要是抗原性物质),经消毒灭菌即可。由于未完全除去蛋白,所以同种骨的抗压性强,材料与人体的组织相容性好,植入后免疫排斥轻,骨诱导性能也相对较好。但由于捐赠者的年龄差异,可用于骨移植的骨源十分有限,且同种骨有一定的病毒感染风险。
5.异种异体骨多为牛骨或猪骨,由于与人体骨结构相似,且来源广泛,应用前景良好。最具代表性的牛骨产品即bio
‑
oss骨粉——选取牛股骨末端,通过甲苯索氏抽提脱脂,乙二胺溶液脱蛋白处理,160℃干燥后经350℃低温煅烧可得无机松质骨颗粒。由于使用了煅烧工艺,bio
‑
oss骨粉中的羟基磷灰石部分结晶,导致骨材料抗压性较差,仅适用于口腔、颌面骨等部位的骨缺损,而对于缺损部位较大、需要一定力学强度支持的骨缺损修复,并无理想的临床应用。
6.新鲜骨中引起免疫反应的物质,主要是非胶原蛋白及骨细胞膜表面的糖蛋白、脂肪。如何有效地破坏细胞表面抗原,除去抗原性物质,获得低免疫原性的异种骨材料是异种骨制备工艺中的重点。在现有技术中,去抗原的方法主要有深低温冷冻,化学试剂(如甲醇/氯仿混合溶液)、表面活性剂(sds,triton等)、蛋白酶处理以及高温煅烧等。高温煅烧可完全除去抗原及有机质成分,但由于完全去除有机质,骨材料的抗压性能较差,仅具有骨传导性,失去了诱导性,无法应用于骨科的缺损修复中;而使用化学试剂或酶处理,对于抗原性较高的异种骨来说,无法有效的去除抗原,植入体内后会有免疫排斥的风险。
技术实现要素:
7.针对现有技术存在的问题,本发明提供一种动物骨颗粒脱蛋白的方法,能够有效去除异体骨颗粒中的非胶原蛋白及骨细胞膜表面的糖蛋白,并能有效保持骨材料的抗压性能及骨传导性。
8.本发明的目的是通过以下技术方案来实现的:一方面,提供一种动物骨颗粒脱蛋白的方法,其特征在于,包含以下步骤:
1)取脱脂后的动物骨颗粒,加入到过氧化氢中,静止12
‑
24h,弃去过氧化氢,置于纯化水中振荡清洗3
‑
6次,75
‑
100℃干燥5
‑
7h,过14目筛,获得过筛后的动物骨颗粒;2)将所述过筛后的动物骨颗粒加入乙二胺溶液中加热至微沸,然后在100
‑
125℃保持7
‑
9h,弃去废液,加入纯化水中振荡清洗3次,重复该步骤两次;3)将步骤2)获得的动物骨颗粒使用纯化水在密闭容器中清洗15次,使用注射用水清洗2次,清洗过程 3
‑
6min/次,清洗期间翻转容器,弃掉废液,获得脱蛋白骨颗粒。
9.优选地,步骤2)中,所述脱脂骨颗粒与过氧化氢的质量比为1:(2~4),例如,1:2,1:3,1:4;所述脱脂骨颗粒与所述纯化水的质量比为1:(2~4),例如,1:2、1:3、1:4。
10.优选地,步骤2)中,所述过筛后的动物骨颗粒加入乙二胺浓度为70%
‑
100%,例如,70%,85%, 100%。
11.优选地,步骤2)中,所述过筛后的骨颗粒与所述乙二胺溶液的质量比为1:(2.0~6.0)。,例如,1:2.0、1:3、1:4、1:5、1:6。
12.优选地,步骤3)中,所述骨颗粒与所述纯化水的质量比为1:20;所述骨颗粒与所述注射用水的质量比为1:20。
13.优选地,所述动物骨颗粒由牛股骨或猪骨制备而成。
14.相对于现有技术,本发明的有益效果如下:本发明提供的动物骨颗粒脱蛋白的方法,采用过氧化氢和乙二胺溶液联合脱蛋白,并通过纯化水反复振荡清洗,注射用水反复翻转清洗,有效去除了抗原性物质,并且同时避免了通过高温煅烧,导致骨颗粒的抗压性能较差、诱导性降低的问题,通过本发明提供的制备方法获得的动物骨颗粒保留了良好的抗压性能和诱导性。
15.本发明所述动物骨颗粒是由动物股骨去除有机质后制备而成,具有类人骨的三维网状微观孔隙结构,有助于植入处新骨的形成与生长,随着骨组织的修复,破骨细胞和成骨细胞将部分改变无机骨的结构。天然可生物降解的、具有良好生物相容性和细胞亲和性的多糖大分子物质作为载体,增强了无机骨颗粒与缺损部位的粘附,随着骨组织的修复,动物骨颗粒在人体内逐步降解并被吸收,无需二次手术取出,生物相容性良好。
附图说明
16.图1a为本产品放大50倍的sem 图;图1b为本产品放大500倍的sem 图,图2为本发明实施例1制备的骨修复材料的micro ct 三维重建图;图3a为发明实施例1制备的骨修复材料50倍sem图;图3b为发明实施例1制备的骨修复材料5000倍sem图;图4为不同制备方法对骨止血材料的抗压强度影响分析图;图5a为实验组术后第 6 周骨修复材料修复效果图;图5b为实验组术后第 6 周骨修复材料修复效果图;图5c为实验组术后第 6 周骨修复材料修复效果图;图5d为对照组术后第 24 周骨修复材料修复效果图;图6 为sd大鼠颅骨缺损修复试验8周后micro ct 观察图;图7 为sd大鼠骨缺损修复区域像素ct值检测结果;
图8a为sd大鼠骨缺损修复术后8周he染色观察实验组骨再生状态;图8b为sd大鼠骨缺损修复术后8周he染色观察对照组骨再生状态;图9a为犬牙槽骨缺损照片;图9b为本发明实施例1的骨修复材料填充牙槽骨缺损照片;图10a为实验组犬牙槽骨填充修复病理切片masson三色染色结果;图10b为对照组犬牙槽骨填充修复病理切片masson三色染色结果;图11a为术后第 8 周实验组和对照组骨体积分数对比图;图11b为术后第 8 周实验组和对照组骨小梁厚度对比图;图12a为实验组组织学观察照片;图12b为对照组组织学观察照片;图13a为实施例7中sd 大鼠骨髓间充质细胞在本产品表面的黏附状态图;图13b为实施例7中骨髓间充质细胞在本产品及合成羟基磷灰石上增殖情况对比图;图14a为使用本产品2周后sd大鼠皮下组织学he染色图;图14b为使用本产品4周后sd大鼠皮下组织学he染色图;图14c为使用本产品6周后sd大鼠皮下组织学he染色图;图14d为使用本产品8周后sd大鼠皮下组织学he染色图;图14e为使用本产品12周后sd大鼠皮下组织学he染色图。
具体实施例
17.下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
18.实施例1本实施例提供一种骨修复材料的制备方法,包含以下步骤:1)取动物骨颗粒,使用异丙醇和纯化水反复交替振荡清洗3
‑
6次,获得脱脂骨颗粒,所述动物骨颗粒与异丙醇的质量比为1:2.5;2)将所述脱脂骨颗粒加入过氧化氢中,静止12
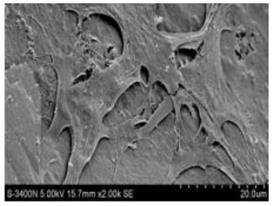
‑
24h,弃去过氧化氢,置于纯化水中振荡清洗3
‑
6次,75
‑
100℃干燥5
‑
7h,过14目筛,获得过筛后的骨颗粒;3)将所述过筛后的骨颗粒加入70%
‑
100%乙二胺溶液中加热至微沸,然后在100
‑
125℃保持7
‑
9h,弃去废液,加入纯化水中振荡清洗3次,重复步骤3)两次;4)将步骤3)获得的骨颗粒使用纯化水清洗15次,使用注射用水清洗2次,清洗过程 3
‑
6min/次,清洗期间翻转容器,弃掉废液,获得脱蛋白骨颗粒;5)取透明质酸钠凝胶与所述脱蛋白骨颗粒,按照质量比10:6 混合均匀,封口,静置4
‑
6min,冻干,获得所述骨修复材料。
19.在一些实施例中,所述透明质酸钠凝胶浓度为3%~8%。
20.在一些实施例中,所述透明质酸钠凝胶与所述脱蛋白骨颗粒的质量比为10:5或10:7。
21.在一些实施例中,步骤1)中,所述动物骨颗粒与异丙醇的质量比为1:2或1:3,所述动物骨颗粒与所述纯化水的质量比为1:3。
22.在一些实施例中,步骤2)中,所述脱脂骨颗粒与过氧化氢的质量比为1:(2~4),例如,1:2,1:3,1:4;所述脱脂骨颗粒与所述纯化水的质量比为1:(2~4),例如,1:2、1:3、1:4。
23.在一些实施例中,步骤3)中,所述过筛后的骨颗粒与所述乙二胺溶液的质量比为1:(2~6),例如,1:2、1:3、1:4、1:5、1:6。
24.在一些实施例中,步骤4)中,所述骨颗粒与所述纯化水的质量比为1:20;所述骨颗粒与所述注射用水的质量比为1:20。
25.在一些实施例中,步骤5)中,所述明质酸钠凝胶由以下方法配置而成:称量透明质酸钠5~8g,加注射用水至 100g,搅拌至透明质酸钠均匀分散,于 2~8℃密封静置 3~16h,继续搅拌至凝胶透明、无肉眼可见颗粒。
26.实施例2本实施例提供一种动物骨颗粒脱蛋白的方法,其特征在于,包含以下步骤:1)取脱脂后的动物骨颗粒,加入到过氧化氢中,静止12
‑
24h,弃去过氧化氢,置于纯化水中振荡清洗3
‑
6次,75
‑
100℃干燥5
‑
7h,过14目筛,获得过筛后的动物骨颗粒;2)将所述过筛后的动物骨颗粒加入70%
‑
100%的乙二胺溶液中加热至微沸,然后在100
‑
125℃保持7
‑
9h,弃去废液,加入纯化水中振荡清洗3次,重复该步骤两次;3)将步骤2)获得的动物骨颗粒使用纯化水在密闭容器中清洗15次,使用注射用水清洗2次,清洗过程 3
‑
6min/次,清洗期间翻转容器,弃掉废液,获得脱蛋白骨颗粒。
27.在一些实施例中,步骤2)所述脱脂骨颗粒与过氧化氢的质量比为1:(2~4),例如,1:2,1:3,1:4;所述脱脂骨颗粒与所述纯化水的质量比为1:(2~4),例如,1:2、1:3、1:4。
28.在一些实施例中,步骤3)所述过筛后的骨颗粒与所述乙二胺溶液的质量比为1:(2~6),例如,1:2、1:3、1:4、1:5、1:6。
29.在一些实施例中,步骤4)所述骨颗粒与所述纯化水的质量比为1:20;所述骨颗粒与所述注射用水的质量比为1:20。
30.在一些实施例中,步骤5)所述透明质酸钠凝胶由以下方法配置而成:称量透明质酸钠5~8g,加注射用水至 100g,搅拌至透明质酸钠均匀分散,于 2~8℃密封静置 3~16h,继续搅拌至凝胶透明、无肉眼可见颗粒。
31.实施例3对实施例1制备的骨修复材料(以下简称;本产品)的孔隙结构进行分析,具体如下:如图1a
‑
图1b所示,图1a为本产品放大50倍的sem 图,图1b为本产品放大500倍的sem 图,由图1a
‑
图1b可以看出,具有多孔网状结构的透明质酸钠均匀的分布在骨修复材料表面,有利于延长骨修复材料在术点的停留时间,有利于成骨细胞的增殖、分化和迁移。
32.同时,透明质酸钠具有良好的亲水性,使得骨修复材料具有良好的可塑性。由 micro ct 三维重建后,见图2,进行骨形态结构分析,获得骨体积分数 (bv/tv),孔隙率即等于 1
‑ꢀ
bv/tv
×
100%。通过 6 个约 5mm 见方的样本的分析,本产品的孔隙率约为 76.42
±
8.52%。而松质骨的孔隙率一般在 70~80%之间,本产品的孔隙率 micro ct 分析结果符合松质骨的孔隙率要求。由图3a
‑
3b可见,本产品保持了天然骨的骨小梁和贯通的多级孔隙空间结构,包括骨小梁周围的大孔和骨小梁上的中孔,并且是互通孔结构。大孔尺寸约 200~600μm 左右,中孔约 50~100μm。还可见羟基磷灰石晶体以弱结晶形态精细地存在,以及精细微晶间的微孔,微孔尺寸<1μm。弱结晶的羟基磷灰石和多孔结构使得本产品具有高比表
周处死动物,取颅骨标本进行 micro ct 骨密度检测及组织学观察。
39.3)犬牙槽骨缺损修复模型及植入实验以 6 只成年犬下颌骨右侧作为实验侧,下颌骨左侧为对照侧,分别建立牙槽骨缺损模型:用高速涡轮牙钻机磨制出直径为 8mm 深 6mm 的骨缺损区,其中 4 只犬骨缺损区位于下颌第 4前磨牙、第 1 磨牙牙槽间隔处,2 只犬骨缺损区位于下颌第 1 磨牙根分歧处。实验侧植入本产品骨修复材料,并使其呈散状颗粒,不予加压,使颗粒与骨面平齐,覆盖生物膜并缝合;对照侧不植入任何材料。术后常规喂养 8 周后处死动物。通过大体标本观察并记录实验侧与对照侧牙槽骨愈合情况,取病理标本进行光镜检查。
40.2.实验结果1)兔颅骨缺损修复实验组:术后第 6 周,骨修复材料颗粒周围有大量新骨形成。术后第 12 周,骨缺损区新骨已达中心区,部分连接成片,已改建成板层骨,骨修复材料颗粒大多被新生骨包围。术后第 24 周,新生骨成熟度进一步提高,见图5a、5b、5c,。空白对照组:术后第 24 周,大部分缺损区仍为纤维结缔组织,见图 5d。术后 6 周时,新骨生成率约为 13.27%左右,材料剩余率约为27.45%左右;术后 12 周时,新骨生成率约为 26.73%左右,材料剩余率约为 24.62%左右;术后 24 周时,新骨生成率约为 35.54%左右,材料剩余率约为 19.83%左右,见表1。通过计算新骨面积和剩余材料的面积,可见随着修复时间的延长,新骨生成逐渐增多,植骨材料缓慢降解。
41.表1 实验组的新骨生成率和材料剩余率(%,n=6)时间新骨生成率材料剩余率6周13.27
±
3.6827.45
±
5.3912周26.73
±
5.2224.62
±
4.3424周35.54
±
4.8519.83
±
5.172)sd 大鼠颅骨缺损修复sd 大鼠颅骨缺损修复试验 8 周,经 micro ct 观察发现,骨缺损区域已愈合,而对照组(未修复组)未见骨愈合见图6。术后 8 周使用 micro ct 通过像素 ct 值分析骨修复区域及周围正常骨的骨密度,比较两者的差异,检测结果见图7。术后 8 周修复区域的骨密度几乎接近正常骨的骨密度,两组之间无显著差异(f
‑
检验,p>0.05)。术后 8 周通过 he 染色观察实验组与对照组骨再生状态,结果显示,如图8a
‑
8b所示,实验组的新生骨量显著多于对照组,由于个体差异,实验组之间新生骨量也有明显不同,对照组均未出现明显的新骨生成。
42.3)犬牙槽骨缺损修复6 只犬软组织愈合均良好,牙龈色、形、质均正常,未见充血、肿胀及糜烂等炎症反应。
43.牙槽骨愈合情况,见图9a
‑
9b。多个部位的牙槽骨缺损愈合情况没有显著差异。本产品中骨修复材料填充组牙槽骨表面平整,骨再生良好。通过组织学切片观察,发现本产品填充组骨壁和正常侧相当,骨质密度较大,未修复组也有骨组织再生,但骨壁高度与正常侧相比较低,骨质空隙较多,骨质密度小。同时,在 8 周时,实验组和对照组的缺损顶部仍然
可以发现生物膜残留,实验组中没有明显的纤维结缔组织长入牙槽骨缺损区域,见图10a。而对照组,有明显的纤维组织长入缺损区域,见图10b。
44.实施例7本实施例为对骨修复材料对拔牙创愈合作用的研究。牙拔除术后拔牙创愈合改建的过程中常发生局部牙槽骨的吸收,导致牙槽骨高度降低,厚度变薄,从而影响后期义齿修复,更不利于种植体植入。为了解决这类问题,常需要作前庭沟加深术或牙槽骨增高术等,以获得必要的牙槽骨外形。但这些手术方法创伤较大、增加了患者的痛苦,且都是在牙槽骨萎缩后采取的补救措施,效果往往并不满意。因此如何促进拔牙创的愈合并减少失牙后牙槽骨吸收是目前口腔颌面外科研究的重要问题之一。近年国内外出现了一些预防牙槽骨吸收的方法,但因各自存在的不足难以在临床推广应用。拔牙窝理想的愈合状态是拔牙后形成的骨缺损完全被新骨充满,创口表面被软组织黏膜完全封闭。拔牙后填充骨移植材料有利于牙槽骨的重建,对于后期种植体的稳定具有重要意义。本实验通过使用本产品填充拔牙后有单壁骨缺损的拔牙窝,来检测本产品对于牙槽骨保留的作用。
45.1.试验方法2~3 岁成年家犬 6 只,体重 15.0~17.5kg,健康。购自西安第四军医大学实验动物中心。以 6 只成年犬下颌骨右侧作为实验侧,下颌骨左侧为对照侧,分别拔除两侧对称磨牙。实验侧植入本品中的骨修复材料,不予加压,使骨修复材料与骨面平齐,使用本品中的生物膜覆盖;对照侧不植入任何材料,生物膜覆盖后缝合。术后常规喂养 8 周后处死动物。通过大体标本观察并记录实验侧与对照侧牙槽骨愈合情况,取病理标本进行光镜检查,通过micro ct 对比两个实验组之间骨量及骨小梁厚度差异,通过组织学切片观察组织形态。同时于术后2周、4周和8周抽血,进行血钙血磷检测,考察材料是否会引起动物钙磷代谢水平的变化。
46.2.结果术后第 8 周,两组拔牙处软组织均覆盖良好,未见充血、肿胀及糜烂等炎症反应。实验组: bv/tv %=81.99
±
3.12 ,骨小梁厚度为 0.492mm
±
0.033mm 。空白对照组:bv/tv %=63.44
±
3.34,骨小梁厚度为 0.251mm
±
0.061mm,见图11a
‑
11b。组织学观察结果显示,空白组缺损处新骨形成量较少,以软组织为主,实验组骨修复程度非常好,新骨已经连续融合在一起,见图12a和图12b.实施例8 细胞相容性的研究本产品修复骨缺损的过程中,具有成骨能力的细胞在产品表面上正常贴附、生长和增殖是成功修复骨缺损的关键步骤,所以本产品能否为细胞提供一个适宜的空间结构,供种子细胞生长,是评价此材料能否作为骨修复材料的重要指标,为此,我们通过体外观察骨髓间充质细胞在本产品表面的贴附及增殖情况、成纤维细胞与本产品共培养中的细胞状态,评价其在细胞水平的生物相容性。
47.1.试验方法1)sd 大鼠骨髓间充质细胞在本产品表面的黏附研究在超净台无菌取下双下肢并剪除皮毛,置于含75%乙醇的平皿中,更换器械及超净台,剔除股骨、胫骨周围肌肉组织等,磷酸盐缓冲液反复冲洗。剪去骨干的两端,暴露骨髓腔,用7号针头穿刺两侧骨端,用5ml注射器抽取4ml含体积分数为10%胎牛血清的dmem培养
基冲出骨髓。800转/分离心5分钟,使用α
‑
mem培养液重悬沉淀,再次800转/分离心5分钟。吹打,过筛,离心后,换入α
‑
mem培养液重悬沉淀。放置37℃、5%co2孵箱内培养,4小时换液一次,洗去未贴壁细胞。放置37℃、5%co2孵箱内培养,1
‑
2d换液一次。将第3代骨髓间充质细胞接种在本产品表面,加入α
‑
mem培养液,放置37℃、5%co2孵箱内培养。24小时后,3%戊二醛固定接种细胞的本产品,冻干后,扫描电子显微镜观察细胞生长情况。
48.2)骨髓间充质细胞在本产品上的增殖能力研究在超净台无菌取下双下肢并剪除皮毛,置于含75%乙醇的平皿中,更换器械及超净台,剔除股骨、胫骨周围肌肉组织等,用磷酸盐缓冲液反复冲洗。剪去骨干的两端,暴露骨髓腔,用7号针头穿刺两侧骨端,用5ml注射器抽取4ml含体积分数为10%胎牛血清的dmem培养基冲出骨髓。800转/分离心5分钟,使用α
‑
mem培养液重悬沉淀,再次800转/分离心5分钟。吹打,过筛,离心后,换入α
‑
mem培养液重悬沉淀。放置37℃、5%co2孵箱内培养,4小时换液一次,洗去未贴壁细胞。放置37℃、5%co2孵箱内培养,1
‑
2天换液一次。
49.将第3代骨髓间充质细胞接种在本产品及合成羟基磷灰石生物陶瓷表面,加入α
‑
mem培养液,放置37℃、5%co2孵箱内培养。1
‑
5天每24小时使用mtt检测细胞的数量,绘制细胞生长曲线。
50.3)成纤维细胞与本产品共培养研究将人成纤维细胞接种到 6 孔板上,孔板内放入 3
‑
5 粒本产品颗粒。分别于 0、24、48、96小时观察本产品颗粒与周围细胞接触面的细胞状态及细胞外基质形成情况。
51.结果将骨髓间充质细胞接种到本产品,24 小时后扫描电子显微镜观察发现细胞均黏附到支架材料上,可见骨髓间充质细胞伸展状态良好,参考图13a。骨髓间充质细胞在本产品及合成羟基磷灰石上增殖情况,mtt染料法检测骨髓间充质细胞在1
‑
5天细胞数量的变化,反应细胞在两种材料表面的增殖情况,参考图13b。
52.在本实验中,为观察本产品对骨髓间充质细胞的亲和性,让骨髓间充质细胞直接接种在本产品表面进行体外培养,扫描电子显微镜结果表明细胞能在材料表面黏附、生长,并且生长状态良好。通过1
‑
5天的细胞数量的测定,比较了骨髓间充质细胞在本产品表面与合成羟基磷灰石表面的增殖情况,结果显示,细胞在骨诱导煅烧骨表面的黏附效率与增殖效率都高于合成的羟基磷灰石材料。说明本产品对细胞正常的代谢过程没有影响,细胞相容性好。
53.本实验结果说明制备的本产品具有优异的细胞相容性,可以提供骨髓间充质生长的底物,利于成骨类细胞的黏附和生长,同时本产品与人类成纤维细胞共培养中细胞状态良好,细胞外基质分泌充分。说明本产品具有良好的细胞相容性。
54.实施例9 组织相容性研究1)实验方法sd大鼠10只(鼠龄5周,雌雄不限),均以1%戊巴比妥钠35mg/kg体重经腿部肌肉内注射麻醉,取俯卧位固定于手术台上。背部两侧备皮,碘伏消毒,铺巾。在背胸腰段脊柱两侧各作2个切口,钝性分离皮下组织,形成4个皮下腔隙,横向间距2cm,纵向间距2cm。植入本产品材料,并分层缝合皮下和皮肤。无压力包扎,饲养,术后3天青霉素40万单位/天,肌注。分别于术后2、4、6、8周和12周各取4块材料,福尔马林固定,脱钙48h,流水冲洗24h,常规石蜡
包埋切片,进行he染色观察。
55.2)结果大体观察:2周组材料体外可触及,轮廓清晰,材料被周围组织包裹,纤维膜较薄,取材组织块结构松散,易与材料分离。4周材料于体外仍可触及,周围组织包裹形成的纤维膜较厚,剥离后可见纤维结缔组织长入材料孔隙内。6、8周材料与周围组织紧密结合,材料呈块状,硬度较大,材料与周围组织的分界面开始有细微凹陷出现。12周材料周围有大量微血管形成,材料与周围组织贴附紧密。各组材料周围组织均无坏死、脓肿。组织学检查:如图14a
‑
14e所示,2周组材料与周围组织形成的组织块结构疏松,伴成纤维细胞增生,炎性细胞浸润以中性粒细胞、淋巴细胞和浆细胞为主。4周组植入材料中有疏松结缔组织长入,材料与周围组织形成的组织块较2周组致密,仍以中性粒细胞和淋巴细胞浸润为主。6周时炎性细胞数量明显减少,8周组材料与周围组织呈现良好的生物相容性,未见明显的炎性细胞存在,材料周围有血管形成。12周组材料有降解趋势,材料周围有多处血管形成,材料周围有成纤维细胞生长,未见炎性细胞。各组均未见组织变性、坏死。
56.3)结论本实验将本产品埋入sd大鼠皮下,检测其组织相容性,观察长达12周。植入皮下的本产品未发现异物排斥反应。在植入的初期,由于伤口的急性炎症反应,有中性粒细胞和淋巴细胞浸润,但随着时间的延长,炎性细胞数量显著减少,6周时已达到良好的生物相容性。说明本产品具有较好的组织相容性。
57.由此可见本产品无免疫原性,组织相容性良好,能被机体组织整合,材料的疏松多孔结构能够引导新生血管形成,足以支持新生骨组织再生与重建。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1