包含朊病毒蛋白质特异性抗体的药物组合物的制作方法
1.本发明涉及一种包含朊病毒蛋白质特异性抗体的药物组合物。
背景技术:
2.大肠癌是世界上常见的癌症,在当今死亡原因排名中位列第三。大肠癌的发病原因是散发性的,公知为与遗传以及环境因素有关,环境因素中饮食要素以及生活习惯起着决定性作用。但是,如果在大肠癌早期的非转移性阶段被诊断时,公知为是一种能够被治愈的疾病,其5年内的生存率也高达90%以上。
3.然而,淋巴结转移时,可能会转移至其他脏器,5年内的生存率会减少至10%以下。近期的几项研究暗示着,分子靶向治疗和早期诊断为大肠癌治疗的潜在措施。因此,抑制大肠癌的机制以及与其相应的新靶标,对于有效增进抗癌治疗效果以及改善患者的生活来说非常重要。
4.正常的朊病毒蛋白质(prpc)是神经细胞中经常表达的糖蛋白,以调整细胞分化、细胞移动以及神经物质交换。近期的研究报告显示,朊病毒蛋白质可以促进未被抑制的癌细胞增殖、肿瘤生长以及转移。另,通过用于确认结肠癌、直肠癌、腺瘤、乳腺癌以及神经母细胞瘤等癌症患者的有害后遗症的有效生物标志物来提出朊病毒蛋白质。其中,生物标志物是指利用蛋白质、dna、rna、细胞代谢物质来获知体内变化的指标。
5.特别地,据研究报告记载,朊病毒蛋白质在耐药癌细胞、癌干细胞过表达。由这种研究报告可知,朊病毒蛋白质为对包含大肠癌的多种癌症具有好效果的靶标。因此,类似于朊病毒蛋白质的糖蛋白虽不是药物治疗上的有效靶标,但我们需要一种可以有效抑制朊病毒蛋白质的活性并能够增加抗癌药物敏感性的方法。
6.另,据近期报道,肿瘤所分泌的外泌体包含还未确定的多种蛋白质或者微rna。来源于肿瘤的外泌体可以直接参与肿瘤或者通过体内血液来影响主要身体器官的组织,这种影响是指肿瘤复发、肿瘤转移、肿瘤的抗癌药物耐药性的诱发、血管组织的结合能力降低导致的肿瘤细胞渗透环境的造成等多种作用。
技术实现要素:
7.技术问题
8.本发明是为了解决如上所述的问题而提出的,提供一种通过抑制朊病毒蛋白质的体内活性来提高抗癌药物的敏感性的癌症治疗用药物组合物。
9.技术方案
10.本发明是为了解决如上所述技术问题而提出的,提供一种包含朊病毒蛋白质特异性抗体的癌症治疗用药物组合物。
11.本发明的癌症治疗用药物组合物还包含选自由抗癌药物、化疗药物、毒素、放射性同位素以及细胞毒性酶组成的组中的一个及以上,所述抗癌药物为选自由5-氟尿嘧啶(5fu)抗癌药物以及奥沙利铂(oxalaplatin)抗癌药物组成的组中的一个及以上。
12.在一个例子中,本发明提供一种癌症治疗用药物组合物,该药物组合物包含复合体,所述复合体结合有:结合在朊病毒蛋白质抗原决定簇的靶标;以及选自由所述组由抗癌药物、化疗药物、毒素、放射性同位素以及细胞毒性酶组成的组中的一个及以上。
13.发明效果
14.本发明的包含朊病毒蛋白质特异性抗体的药物组合物能够提高抗癌药物的敏感性从而提高抗癌治疗效果。
附图说明
15.图1以及图2是显示根据实施例1的结果的相片以及图谱。
16.图3以及图4是显示根据实施例2的结果的相片以及图谱。
17.图5以及图6是显示根据实施例3的结果的相片。
18.图7以及图8是显示根据实施例4的结果的相片以及图谱。
19.图9以及图10是显示根据实施例5的结果的图片。
20.图11至图13是显示根据实施例6的结果的相片以及图谱。
21.图14以及图15是显示根据实施例7的实验模型以及结果的图谱以及相片。
22.图16以及图17是显示根据实施例8的结果的图谱。
23.图18是显示根据实施例9的实验模型以及结果的图谱以及相片。
具体实施方式
24.根据一实施例,本发明提供一种包含朊病毒蛋白质特异性抗体的癌症治疗用药物组合物。
25.本发明的癌症治疗用药物组合物还包含选自由抗癌药物、化疗药物、毒素、放射性同位素以及细胞毒性酶组成的组中的一个及以上,所述抗癌药物为选自5-氟尿嘧啶(5fu)抗癌药物以及奥沙利铂抗癌药物组成的组中的一个及以上。
26.在一个例子中,本发明提供一种癌症治疗用药物组合物,该药物组合物包含复合体,所述复合体结合有:结合在朊病毒蛋白质抗原决定簇的靶标;选自由所述组由抗癌药物、化疗药物、毒素、放射性同位素以及细胞毒性酶组成的组中的一个及以上。
27.以下,通过实施例对本发明进行详细地说明。但是,下述实施例以及实验例仅仅是为了对本发明进行示例,本发明的内容并不被下述实施例以及实验例所限定。
28.准备例1
29.大肠癌患者的血浆样本的准备
30.从韩国人体资源银行获得匿名大肠癌患者的血浆样本,获得的样本中包括患者的有限信息(年龄、性别、病理学的肿瘤状态、抗癌药物治疗病历)。本实验以及临床试料的信息是在韩国人体资源银行伦理委员会的承认下实施的。
31.准备例2
32.具有抗癌药物耐药性的大肠癌细胞株的培养法
33.获得了具有人类常见大肠癌细胞株snu-c5/wt和5fu抗癌药物耐药性的人类大肠癌细胞株snu-c5/5fur、具有奥沙利铂抗癌药物耐药性的人类大肠癌细胞株snu-c5/oxr,并从康奈尔医学院(new york,ny,usa)的医学专业steven m lipkin教授获得了人类大肠癌
干细胞[s707;cancer stem cell(csc)]。snu-c5相关细胞株是使用10%的含有胎牛血清的rpmi培养基并在37℃恒温箱中存在有5%的co2的条件下进行培养。大肠癌干细胞是与含有非必需氨基酸(赛默飞世尔科技,thermo fisher scientific)、丙酮酸钠(赛默飞世尔科技)、青链霉素双抗(赛默飞世尔科技)、b27添加物(赛默飞世尔科技)、n2添加物(赛默飞世尔科技)、40μg/ml的肝素(西格玛奥德里奇)、20ng/ml的成纤维细胞生长因子(赛默飞世尔科技)、40ng/ml的表皮生长因子(赛默飞世尔科技)的添加物一起使用dmem/f12培养基并在37℃恒温箱中存在有5%的co2的条件下进行培养。
[0034]
准备例3
[0035]
具有抗癌药物耐药性的大肠癌细胞株的成球培养法
[0036]
为了将常见大肠癌细胞株(snu-c5/wt)和具有抗癌药物耐药性的大肠癌细胞株(snu-c5/5fur,snu-c5/oxr)以及大肠癌干细胞株进行成球培养,使用6孔超低簇板进行细胞悬浮培养。培养中,使用增殖培养液(参考准备例2)培养之后,在37℃、5%的co2条件下进行培养。
[0037]
大肠癌细胞株的成球是在培养之后的第7天时形成。各细胞株的成球是利用光学显微镜来确认以及检测。
[0038]
准备例4
[0039]
抗癌药物耐药性细胞的低氧培养法
[0040]
将5fu抗癌药物耐药性细胞株(snu-c5/5fur)在增殖培养液(参考准备例2)中进行培养,并在低氧培养室中暴露在2%的o2、5%的co2、n2平衡的低氧环境下且在37℃下培养24小时。在附图中,是否低氧培养是通过标记为正常氧环境(标记为n)、低氧环境(标记为h)来区分。
[0041]
准备例5
[0042]
外泌体提取法
[0043]
将5fu抗癌药物耐药性细胞株(snu-c5/5fur)在低氧环境下培养48小时之后,收集培养基,以400g离心分离10分钟,并去除细胞和其以外的碎片(debris),使用0.45μm针头式过滤器来准备培养基。为了从培养基容易地提取外泌体,使用100kda mwco超滤装置对培养基以2000g离心分离20分钟来进行离心分离,以对培养基进行浓缩。使用条件培养基外泌体提取试剂盒对浓缩的培养基提取外泌体。在8ml的培养基中,放入溶液a、b和c搅拌10分钟进行反应之后,以3000g离心分离15分钟,将微丸溶化于溶液r之后,在柱l以700g离心分离5分钟,以在管中获得粗胞外囊泡。然后,在粗胞外囊泡中放入溶液b和c之后,搅拌15分钟来进行反应,以3000g离心分离5分钟来获得微丸,将其溶化于溶液r之后,以300g离心分离5分钟来获得纯化的外泌体。
[0044]
准备例6
[0045]
免疫印迹试验(western blot)分析
[0046]
从来源于5fu抗癌药物耐药性细胞株(snu-c5/5fur)的外泌体中提取蛋白质,对细胞蛋白质(20μg蛋白质)使用十二烷基硫酸钠聚丙烯酰胺凝胶电泳法进行电泳,并在硝酸纤维素膜上印迹。然后,使用tbs-t[10mm tris-hcl(ph 7.6),150mm nacl以及0.05%tween-20]洗涤所述膜之后,使用5%的脱脂牛奶封闭1小时,然后使用初级抗体(prpc,cd81,cd63)进行培养。然后,将膜与结合在过氧化物酶的次级抗体一起进行培养。对条带进行化学发光
检测试剂(增强化学发光,enhanced chemiluminescence)处理,x光胶片(x-ray film)经感光通过显影来进行确认。
[0047]
准备例7
[0048]
利用流式细胞仪(荧光激活细胞分选技术;facs)的外泌体分析
[0049]
如暴露于正常或者低氧环境的来源于5fu抗癌药物耐药性细胞株(snu-c5/5fur)的外泌体一样,分别将cd81或者cd63抗体(附着有荧光物质pe的facs用抗体)在常温下培养30分钟之后,利用流式细胞仪进行检测。
[0050]
准备例8
[0051]
侵袭试验法
[0052]
用暴露于正常或者低氧环境的来源于抗癌药物耐药性细胞株(snu-c5/5fur,snu-c5/oxr)的外泌体来处理抗癌药物耐药性细胞株(snu-c5/5fur,snu-c5/oxr)或者血管内皮前体细胞(endothelial progenitor cell,epc)之后,涂抹在基质胶(50μl)包被的8μm孔插入式培养板上。
[0053]
然后,低室板(low chamber plate)上放入生长培养基,插入式培养板上放入去除血清的培养基,在37℃恒温箱中存在有5%的co2的条件下培养24小时。
[0054]
然后,去除所有培养基之后,将存在于插入式培养板上的细胞在4%的多聚甲醛溶液中细胞固定1小时,然后在结晶紫染色液中细胞染色5分钟,再进行光学显微镜拍摄。
[0055]
准备例9
[0056]
伤口愈合试验法
[0057]
使用约1mm厚度的细胞刮刀(cell scraper),去除细胞培养板(cell culture plate)上附着的血管内皮前体细胞。然后,使用pbs洗涤3次,用暴露于正常或者低氧环境的来源于5fu抗癌药物耐药性细胞株(snu-c5/5fur)的外泌体或者朊病毒蛋白质靶标小干扰性rna(prnp sirna)或者非靶标sirna(scrambled sirna;si-con)处理的来源于snu-c5/5fur的外泌体来处理血管内皮前体细胞,然后,在37℃恒温箱中存在有5%的co2的条件下培养24小时。然后,通过光学显微镜检测从1mm缩短的24小时之后的距离。
[0058]
准备例10
[0059]
血管生成抗体阵列-膜测试
[0060]
购买附着有血管生成相关因子抗体(共43个靶标)的膜(abcam;ab193655),执行斑点印迹分析。使用的蛋白质样本为用暴露于正常或者低氧环境的来源于5fu抗癌药物耐药性细胞株(snu-c5/5fur)的外泌体或者朊病毒蛋白质特异性sirna(si-prnp)或者非靶标sirna(si-con)处理的来源于snu-c5/5fur的外泌体来处理的血管内皮前体细胞,外泌体处理之后在37℃恒温箱中存在有5%的co2的条件下培养24小时,再从细胞获得整体蛋白质样本。
[0061]
准备例11
[0062]
罗丹明-葡聚糖染色
[0063]
用暴露于正常或者低氧环境的来源于5fu抗癌药物耐药性细胞株(snu-c5/5fur)的外泌体(2μg;每周2次,共2周)进行小鼠尾静脉注射,在活检3小时之前用罗丹明-葡聚糖(100mg/kg)进行小鼠尾静脉注射。然后,活检取出小鼠的肝、肺组织。对取出的组织进行冰冻组织切片法来制备组织切片,然后,进行dapi染色后通过共焦显微镜进行图片拍摄。
[0064]
准备例12
[0065]
肿瘤形成动物模型
[0066]
将暴露于正常或者低氧环境的来源于5fu抗癌药物耐药性细胞株(snu-c5/5fur)的外泌体处理的常见大肠癌细胞株snu-c5/wt(5
×
106细胞)移植到小鼠的皮下层,从一周之后肿瘤大小形成为8~10mm3体积开始,通过小鼠尾静脉给药5fu(30mg/kg)和朊病毒蛋白质抗体。药物给药期间为每周2次共给药4周。
[0067]
准备例13
[0068]
肿瘤转移动物模型
[0069]
将暴露于正常或者低氧环境的来源于5fu抗癌药物耐药性细胞株(snu-c5/5fur)的外泌体处理的常见大肠癌细胞株snu-c5/wt(1
×
106细胞)移植到小鼠的脾脏,从一周之后开始,通过小鼠尾静脉给药。给药期间为每周2次共给药7周。然后,进行活检以确认小鼠肝转移的肿瘤。
[0070]
准备例14
[0071]
免疫组织荧光染色
[0072]
将肿瘤形成动物模型以及肿瘤转移动物模型中活检的组织(肿瘤组织,肝转移肿瘤组织)固定在4%的多聚甲醛,且石蜡包埋之后进行组织切片。对切片的组织使用细胞增殖相关因子ki67、细胞凋亡相关因子活化半胱氨酸蛋白酶-3、血管内皮细胞的细胞-细胞紧密连接相关蛋白质zo-1、毛细血管标志物cd31来进行荧光染色,使用dapi对组织的细胞核进行荧光染色。然后,利用共焦荧光显微镜进行图片拍摄。
[0073]
实施例1
[0074]
大肠癌患者的血浆内朊病毒蛋白质表达确认以及具有抗癌药物耐药性大肠癌细胞株的三维球体形成能力
[0075]
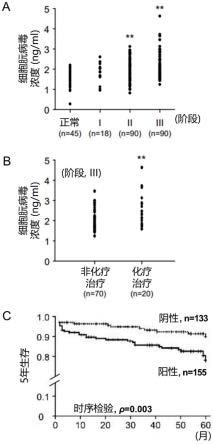
图1a中对大肠癌患者根据大肠癌的进展状态来进行分类,根据各大肠癌的进展阶段(阶段ⅰ、ⅱ、ⅲ),对朊病毒蛋白质的表达通过朊病毒蛋白质特异性酶联免疫吸附试验(elisa)进行检测。结果显示,随着癌症的进展阶段升高,患者血浆内的朊病毒蛋白质的表达会增加。
[0076]
图1b中对大肠癌进展为3阶段(阶段ⅲ)的患者根据是否进行药物治疗来分类,通过elisa来检测他们的血浆内的朊病毒蛋白质表达。结果显示,具有获得过药物治疗的病历患者的血浆内朊病毒蛋白质的表达有增加。
[0077]
图1c中根据大肠癌患者的大肠癌组织内的朊病毒蛋白质是否表达来进行分类,并检测他们的5年内的生存率。结果显示,大肠癌组织内的朊病毒蛋白质表达增加的患者,5年内的生存率减少。
[0078]
图2是在具有抗癌药物耐药性的大肠癌细胞株(snu-c5/5fur,snuc-c5/oxr)以及大肠癌干细胞株(csc)中根据朊病毒蛋白质的表达与否来分离细胞,并通过根据朊病毒蛋白质的表达与否的三维球体试验法来确认癌细胞的肿瘤形成能力。结果确认,朊病毒蛋白质表达高的大肠癌细胞可以促进球体的形成。
[0079]
因此,图1和图2的结果表示大肠癌细胞中朊病毒蛋白质的表达与否会提高肿瘤形成能力。
[0080]
实施例2
[0081]
从5fu抗癌药物耐药性细胞株提取的外泌体和外泌体内包含的朊病毒蛋白质的确认以及对大肠癌细胞的影响
[0082]
图3的a是从5fu抗癌药物耐药性细胞株中提取的外泌体,通过冷冻电子显微镜来确认提取的外泌体是否在200μm以下的图片。
[0083]
图3的b是通过流式细胞分析仪来对提取的外泌体检测作为外泌体标志物的cd81和cd63。
[0084]
图3的c是通过免疫印迹试验分析来确认提取的外泌体中朊病毒蛋白质的表达和作为外泌体标志物的cd81和cd63。
[0085]
结果显示,将5fu抗癌药物耐药性细胞株在低氧培养时,外泌体内的朊病毒蛋白质的表达增加。但是,通过prnp sirna来抑制5fu抗癌药物耐药性细胞株蛋白质的表达时,结果是,即使将5fu抗癌药物耐药性细胞株在低氧培养,也不能增加外泌体内的朊病毒蛋白质的表达。
[0086]
图4是用正常或者低氧培养的抗癌药物耐药性细胞株(snu-c5/5fur,snu-c5/oxr)和大肠癌干细胞株(csc)中分别提取的外泌体对应地针对暴露于一般正常氧环境下的抗癌药物耐药性细胞株(snu-c5/5fur,snu-c5/oxr)和大肠癌干细胞株(csc)进行处理时,确认的大肠癌细胞株的三维球体形成能力。图4的a中用暴露于正常或者低氧环境下的snu-c5/5fur中提取的外泌体来对暴露于一般正常氧环境下的snu-c5/5fur进行处理,图4的b中用暴露于正常或者低氧环境下的snu-c5/oxr中提取的外泌体来对暴露于一般正常氧环境下的snu-c5/oxr进行处理,图4的c中用暴露于正常或者低氧环境下的csc中提取的外泌体来对暴露于一般正常氧环境下的csc进行处理。
[0087]
朊病毒蛋白质的表达高的外泌体(h-5fur-exo,h-oxr-exo以及h-csc-exo)处理的组均相比于朊病毒蛋白质的表达低的外泌体(n-5fur-exo,n-oxr-exo以及n-csc-exo)处理的组,作为肿瘤形成能力的三维球体形成能力增加。但是,用处理了朊病毒蛋白质靶标sirna(si-prnp)且低氧环境培养的抗癌药物耐药性大肠癌细胞株(snu-c5/5fur,snu-c5/oxr)和大肠癌干细胞株中提取的不具有朊病毒蛋白质的外泌体(si-prnp+h-5fur-exo,si-prnp+h-oxr-exo以及si-prnp+h-csc-exo)来进行处理的组的情况下,没有提高大肠癌细胞株的三维球体形成能力。但是,作为si-prnp的对照组,用处理了什么样的蛋白质都抑制不了的非靶标sirna(si-con)的低氧培养的抗癌药物耐药性大肠癌细胞株(snu-c5/5fur,snu-c5/oxr)和大肠癌干细胞株中提取的外泌体(si-con+h-5fur-exo,si-con+h-oxr-exo以及si-con+h-csc-exo)来处理的组,则仍能够提高大肠癌细胞株的三维球体形成能力。
[0088]
实施例3
[0089]
低氧培养的抗癌药物耐药性细胞株中提取的外泌体对大肠癌细胞的浸润能力的影响
[0090]
图5中通过侵袭试验来确认用正常或者低氧培养的抗癌药物耐药性细胞株中提取的外泌体处理的大肠癌细胞株(snu-c5/5fur,snu-c5/oxr)的浸润能力提高。
[0091]
*结果显示,用低氧培养的抗癌药物耐药性细胞株中提取的外泌体(h-5fur-exo,h-oxr-exo)来处理的组,能够增加大肠癌细胞株的浸润能力。但是,用朊病毒蛋白质抑制的外泌体(si-prnp+h-5fur-exo,si-prnp+h-oxr-exo)来处理的组,则不能提高大肠癌细胞株的浸润能力。
[0092]
图6是通过光学显微镜对正常或者低氧培养的抗癌药物耐药性细胞株中提取的外泌体处理的大肠癌细胞株的形态学变化进行拍摄的图片。为了细胞的移动,用正常或者低氧培养的抗癌药物耐药性细胞株中提取的外泌体(h-5fur-exo,h-oxr-exo)处理的大肠癌细胞株的细胞形态变为星形或者放射状的形态。但是,针对朊病毒蛋白质抑制的外泌体(si-prnp+h-5fur-exo,si-prnp+h-oxr-exo)处理的组,并没有发生用于细胞运动性提高的细胞形态的变化。
[0093]
实施例4
[0094]
低氧培养的抗癌药物耐药性细胞株中提取的外泌体对血管内皮前体细胞的影响
[0095]
图7的a中用正常或者低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体来处理血管内皮前体细胞之后,为了确认细胞的移动能力而进行细胞迁移试验。
[0096]
图7的b中用正常或者低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体来处理血管内皮前体细胞之后,为了确认细胞的移动能力而进行侵袭试验。
[0097]
结果显示,用低氧环境下培养的5fu抗癌药物耐药性细胞株中提取的外泌体(h-5fur-exo)处理的组中,血管内皮前体细胞的运动能力提高。但是,用朊病毒蛋白质抑制的外泌体(si-prnp+h-5fur-exo)处理的组中,没能够提高血管内皮前体细胞的运动能力。
[0098]
图8的a是用低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体来处理血管内皮前体细胞之后,通过血管生成抗体阵列-膜测试来检测血管内皮前体细胞内的血管形成因子表达程度的结果。
[0099]
图8的b是用低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体来处理血管内皮前体细胞之后,将通过血管生成抗体阵列-膜测试来检测血管内皮前体细胞内的血管形成因子表达程度的结果变更为统计数据的图谱。
[0100]
结果显示,用低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体(h-5fur-exo)处理的血管内皮前体细胞中,血管形成因子的(angiogenin,egf,ena-78,bfgf,mcp-1)表达增加。但是,用朊病毒蛋白质抑制的外泌体(si-prnp+h-5fur-exo)处理的血管内皮前体细胞中,没能够增加血管形成因子的表达。
[0101]
这种结果意味着,大肠癌中分泌的朊病毒蛋白质中的外泌体能够增加形成血管的血管内皮细胞的运动性,并促进血管的形成。
[0102]
实施例5
[0103]
低氧培养的抗癌药物耐药性细胞株中提取的外泌体对小动物实验的影响
[0104]
图9是显示将正常或者低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体给药到小鼠时,外泌体对身体器官组织结合力的影响的确认结果。将外泌体每周2次共给药4周之后,在活检3小时之前将罗丹明-葡聚糖给药到小鼠尾静脉。罗丹明-葡聚糖的特征是会浸透到身体器官组织结合力变弱的部分。该图9是通过荧光显微镜拍摄来确认的。图9a是小鼠的肝组织、图9b是小鼠的肺组织的拍摄图片。
[0105]
结果可知,给药低氧培养的抗癌药物耐药性细胞株中提取的外泌体(h-5fur-exo)的实验用小鼠的肝和肺的组织结合力变弱,因此,确认了罗丹明-葡聚糖有浸透到组织中。这种结果表明,低氧培养的抗癌药物耐药性细胞株中提取的外泌体可以弱化身体器官组织的结合力。但是,朊病毒蛋白质抑制的外泌体(si-prnp+h-5fur-exo)对身体器官组织的结合力没能起到任何作用,因此,罗丹明-葡聚糖没有浸透到组织中。
[0106]
图10中,通过荧光显微镜拍摄来确认,将正常或者低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体给药到实验用小鼠时,外泌体对存在于血管组织的细胞-细胞紧密连接相关蛋白质zo-1的影响。该图10中,血管用cd31进行荧光染色。图10a是小鼠的肝组织,图10b是小鼠的肺组织的拍摄图片。
[0107]
结果确认,用低氧培养的抗癌药物耐药性细胞株中提取的外泌体(h-5fur-exo)能减少存在于血管细胞组织的zo-1蛋白质的表达。zo-1蛋白质表达的减少意味着组织的细胞-细胞结合力降低,因此,该结果意味着,来源于大肠癌的外泌体可以弱化肝和肺中存在的血管组织的细胞-细胞结合力。
[0108]
实施例6
[0109]
利用朊病毒蛋白质靶抗体和抗癌药物组合剂来确认抑制大肠癌肿瘤的形成
[0110]
分别制备了不具有抗癌药物耐药性的常见大肠癌细胞株群(pbs)、针对不具有抗癌药物耐药性的常见大肠癌细胞株将5fu抗癌药物(30mg/kg)用3次蒸馏水稀释来每周2次共腹腔内给药7周的群(仅5-fu)、针对不具有抗癌药物耐药性的常见大肠癌细胞株用低氧培养的抗癌药物耐药性细胞株中提取的外泌体处理的群(h-5fur-exo)、针对不具有抗癌药物耐药性的常见大肠癌细胞株用低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体处理之后再将5fu抗癌药物(30mg/kg)用3次蒸馏水稀释来每周2次共腹腔内给药7周的群(h-5fur-exo+5-fu)、针对不具有抗癌药物耐药性的常见大肠癌细胞株用低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体处理之后再将朊病毒蛋白质靶抗体(5mg/kg)和5fu抗癌药物(30mg/kg)用3次蒸馏水稀释来每周2次共腹腔内给药7周的群(h-5fur-exo+5-fu+anti-prp)以及针对不具有抗癌药物耐药性的常见大肠癌细胞株用低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体处理之后再将朊病毒蛋白质靶抗体(5mg/kg)用3次蒸馏水稀释来每周2次共腹腔内给药7周的群(h-5fur-exo+anti-prp)。
[0111]
该实施例6中使用的朊病毒蛋白质靶抗体是美国默克公司的产品号mab1562的产品。
[0112]
其结果,图11的a是显示肿瘤状态的图片。图11的b是显示形成的肿瘤体积分布的图谱。根据此结果,用低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体处理的常见大肠癌细胞株群(h-5fur-exo)相比于常见大肠癌细胞株(pbs)单独群显示出更高的肿瘤形成能力。
[0113]
另外,用低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体处理的常见大肠癌细胞株群由于生成了抗癌药物耐药性从而用5fu抗癌药物(h-5fur-exo+5-fu)单独处理时,表中显示出没有有效抑肿瘤的形成。但是,针对用低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体处理的常见大肠癌细胞株群将朊病毒蛋白质靶抗体(5mg/kg)和5fu抗癌药物(30mg/kg)用3次蒸馏水稀释的制造物来给药的群(h-5fur-exo+5-fu+anti-prp),有效抑制了肿瘤形成。这种结果表示,与针对不具有抗癌药物耐药性的常见大肠癌细胞株单独群进行5fu抗癌药物处理的群(仅5-fu)的结果非常类似,由此能够证明,本发明制造的朊病毒蛋白质靶抗体(5mg/kg)和5fu抗癌药物(30mg/kg)的组合物可以提升具有抗癌药物耐药性的大肠癌的治疗效果。
[0114]
图12的a中为了肿瘤细胞的细胞增殖确认而通过细胞增殖相关因子ki67的荧光染色来进行确认。
[0115]
结果显示,针对用低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体处理的常见大肠癌细胞株给药5fu抗癌药物的群(h-5fur-exo+5-fu),即使给药了5fu抗癌药物也没能减少肿瘤细胞的增殖能力。但是,针对用来源于低氧培养的5fu抗癌药物耐药性细胞株的外泌体处理的常见大肠癌细胞株群将朊病毒蛋白质靶抗体(5mg/kg)和5fu抗癌药物(30mg/kg)用3次蒸馏水稀释的制造物来给药的群(h-5fur-exo+5-fu+anti-prp),显示出肿瘤组织内癌细胞的细胞增殖率显著减少。
[0116]
图12的b中对用于确认细胞凋亡的活化半胱氨酸蛋白酶-3进行组织荧光染色并通过共焦荧光显微镜来进行确认。
[0117]
结果显示,针对用低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体处理的常见大肠癌细胞株群将朊病毒蛋白质靶抗体(5mg/kg)和5fu抗癌药物(30mg/kg)用3次蒸馏水稀释的制造物来给药的群(h-5fur-exo+5-fu+anti-prp),活化半胱氨酸蛋白酶-3的表达显著增加。
[0118]
这种结果表示,与针对不具有抗癌药物耐药性的常见大肠癌细胞株单独群进行5fu抗癌药物处理的群(仅5-fu)的结果非常类似,由此意味着,本发明制造的朊病毒蛋白质靶抗体(5mg/kg)和5fu抗癌药物(30mg/kg)的组合物可以促进具有抗癌药物耐药性的大肠癌的细胞凋亡。
[0119]
图13中在肿瘤组织内的血管中通过组织荧光染色法确认了,针对用低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体处理的常见大肠癌细胞株群将朊病毒蛋白质靶抗体(5mg/kg)和5fu抗癌药物(30mg/kg)用3次蒸馏水稀释的制造物来给药的群(h-5fur-exo+5-fu+anti-prp),肿瘤形成动物模型的肿瘤组织中可以维持细胞-细胞紧密连接相关因子zo-1的表达。
[0120]
实施例7
[0121]
朊病毒蛋白质靶抗体和抗癌药物组合剂的利用对大肠癌肿瘤转移的影响
[0122]
该实施例7中使用的朊病毒蛋白质靶抗体是美国默克公司的产品号mab1562的产品。
[0123]
图14的a是图示,对不具有抗癌药物耐药性细的常见大肠癌细胞株(snu-c5/wt)处理低氧培养的5fu抗癌药物耐药性细胞株中提取的外泌体之后,移植到实验用鼠的脾脏来建立肿瘤转移动物模型。然后,一周之后将朊病毒蛋白质靶抗体(5mg/kg)和5fu抗癌药物(30mg/kg)用3次蒸馏水稀释来每周2次共腹腔内给药7周的方法。
[0124]
图14的b是显示移植到小鼠脾脏的癌细胞转移到小鼠肝的拍摄图片。
[0125]
结果显示,针对用来源于低氧培养的5fu抗癌药物耐药性细胞株的外泌体处理的常见大肠癌细胞株(h-5fur-exo),肝转移很活跃。但是,针对用来源于低氧培养的5fu抗癌药物耐药性细胞株的外泌体处理的常见大肠癌细胞株进行朊病毒蛋白质靶抗体(5mg/kg)和5fu抗癌药物(30mg/kg)组合物给药的群(h-5fur-exo+5-fu+anti-prp),肝转移能力减少。
[0126]
图15是通过组织荧光染色确认了,针对用来源于低氧培养的5fu抗癌药物耐药性细胞株的外泌体处理的常见大肠癌细胞株进行朊病毒蛋白质靶抗体(5mg/kg)和5fu抗癌药物(30mg/kg)组合物给药的群(h-5fur-exo+5-fu+anti-prp),转移到肿瘤转移小动物模型的肝的用来源于低氧培养的5fu抗癌药物耐药性细胞株的外泌体处理的常见大肠癌细胞株
的肿瘤组织,可以维持血管细胞的细胞-细胞紧密连接相关因子zo-1的表达。
[0127]
因此意味着,本实施例中朊病毒蛋白质的血管细胞的结合力弱化,从而大肠癌的转移很活跃,当抑制朊病毒蛋白质时,可以抑制大肠癌的转移。
[0128]
实施例8
[0129]
朊病毒蛋白质靶抗体和抗癌药物组合剂对抗癌药物耐药性大肠癌的细胞周期的影响
[0130]
该实施例8中使用的朊病毒蛋白质靶抗体是美国圣克鲁斯生物技术公司的产品号sc-393165的产品。
[0131]
图16的a是对不具有抗癌药物耐药性的常见大肠癌细胞株(snu-c5/wt)用10ng/ml、50ng/ml、100ng/ml以及200ng/ml浓度的朊病毒蛋白质靶抗体处理时,评价细胞增殖能力的细胞周期分析。
[0132]
图16的b是对具有抗癌药物耐药性的大肠癌细胞株(snu-c5/5fur)用10ng/ml、50ng/ml、100ng/ml以及200ng/ml浓度的朊病毒蛋白质靶抗体处理时,评价细胞增殖能力的细胞周期分析。
[0133]
其结果确认,随着朊病毒蛋白质靶抗体的浓度增加,大肠癌细胞周期s期减少。
[0134]
图17的a是对不具有抗癌药物耐药性的常见大肠癌细胞株(snu-c5/wt)进行5fu抗癌药物(10μm)处理、朊病毒蛋白质靶抗体(200ng/ml)处理、5fu抗癌药物和朊病毒蛋白质靶抗体合并处理时,评价细胞增殖能力的细胞周期分析。
[0135]
图17的b是对具有抗癌药物耐药性的大肠癌细胞株(snu-c5/5fur)进行5fu抗癌药物(10、50、100μm)处理、朊病毒蛋白质靶抗体(200ng/ml)处理以及5fu抗癌药物(10、50、100μm)和朊病毒蛋白质靶抗体(200ng/ml)合并处理时,评价细胞增殖能力的细胞周期分析。该图17的b是由于抗癌药物耐药性细胞而使用了多种浓度的5fu抗癌药物来确认抗癌药物敏感性提升了多少的确认结果。
[0136]
其结果确认,进行了朊病毒蛋白质靶抗体合并处理的实验群相比于进行5fu单独处理群更能抑制细胞周期s期。特别是,针对具有5fu抗癌药物耐药性大肠癌细胞株(snu-c5/5fur),具有5fu抗癌药物的抗癌药物耐药性浓度10、50、100μm中,与朊病毒蛋白质靶抗体同时进行处理时,细胞周期s期最多减少至1/3。
[0137]
这种结果显示,朊病毒蛋白质靶抗体能够提升对5fu的抗癌药物的敏感性,从而抑制细胞的增殖。
[0138]
实施例9
[0139]
朊病毒蛋白质靶抗体和抗癌药物组合剂对大肠癌形成的影响
[0140]
该实施例9中使用的朊病毒蛋白质靶抗体是美国圣克鲁斯生物技术公司的产品号sc-393165的产品。
[0141]
图18的a是将不具有抗癌药物耐药性的常见大肠癌细胞株(snu-c5/wt)移植到小鼠以制作肿瘤形成动物模型,并对给药抗癌药物5fu和朊病毒蛋白质靶抗体的实验方法进行说明的示图。
[0142]
图18的b是显示将不具有抗癌药物耐药性的常见大肠癌细胞株(snu-c5/wt)移植到小鼠以制作肿瘤形成动物模型,并用5fu和朊病毒蛋白质靶抗体进行合并处理时,形成的肿瘤的结果。
[0143]
这种结果显示,用5fu和朊病毒蛋白质靶抗体以10mg/kg或者100mg/kg的量合并处理的肿瘤形成动物模型群相比于用5fu单独给药的群肿瘤的大小更减小。由此,肿瘤形成模型中使用朊病毒蛋白质靶抗体时,抗癌药物的敏感性提高且抗癌治疗效果提升。
[0144]
如上所述,参考附图对本发明优选实施例进行了说明,但是可以理解的是,本领域技术人员在不超出权利要求书中记载的本发明的思想以及领域范围内,可以对本发明进行多种修改以及变更。
[0145]
工业实用性
[0146]
本发明的包含朊病毒蛋白质特异性抗体的癌症治疗用药物组合物可以在产生抗癌药物耐用性的癌细胞中也能使抗癌药物的效果起到敏感作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1