可注射抗菌温敏纳米复合水凝胶敷料及其制备方法和应用
1.本发明属于生物医用材料技术领域,涉及一种可注射抗菌温敏纳米复合水凝胶敷料及其制备方法和应用。
背景技术:
2.皮肤作为人体预防外界侵害的第一个屏障,容易受到各种类型的损伤,例如挫伤,烧伤,割裂伤等。这些伤口导致皮肤结构受损,损害了皮肤的防御功能。尽管皮肤具备一定的自我修复能力,但在结构受损较为严重时,漫长的修复过程对人体十分不利。同时,各种微生物,特别是细菌带来的感染也对伤口的修复起到阻碍作用,受细菌感染的伤口容易产生过度的不良炎症反应,影响皮肤的修复,导致微生物入侵人体内部。大规模的感染和严重的并发症甚至威胁到患者生命,也给医疗卫生体系带来严沉重的负担。因此,开发一种具有抵抗耐药菌感染的抗菌性伤口敷料有十分重要的临床意义。
3.近年来,已经开发出各种水凝胶敷料来处理皮肤创伤,天然产物伤口敷料和人工合成高分子伤口敷料是最常用的备选产物。与其它类型的敷料相比,水凝胶敷料具有可提供湿润的组织接触环境,细胞相容性较好,不易与组织黏连,更换时可避免二次损伤等优点。尽管这些水凝胶可以在一定程度上促进创面的愈合,但这些敷料大多数都不具有抗菌能力。少数水凝胶敷料通过负载特定的抗生素或药物以获得抗菌能力,但一些新型耐药细菌的出现,在一定程度上限制了这类通过药物进行抗菌的水凝胶敷料在临床上的应用。此外,传统水凝胶敷料机械性能较差,容易产生裂痕或破损,导致无法有效覆盖伤口;而其材料本质也呈现生物惰性,无法有效地促进伤口愈合。因此,开发理想的生物活性伤口敷料以应对皮肤创伤和细菌感染并促进伤口愈合,仍然是一个挑战。
技术实现要素:
4.为了克服上述现有技术中,水凝胶敷料不能同时满足较好的生物相容性、抗菌性能性和强度的缺点,本发明的目的在于提供一种可注射抗菌温敏纳米复合水凝胶敷料及其制备方法和应用。
5.为了达到上述目的,本发明采用以下技术方案予以实现:
6.一种可注射抗菌温敏纳米复合水凝胶敷料,可注射抗菌温敏纳米复合水凝胶敷料为upy功能化的pegsd聚合物。
7.一种可注射抗菌温敏纳米复合水凝胶敷料的制备方法,包括如下步骤:
8.步骤1)将聚乙二醇和癸二酸混合,得到癸二酸封端聚乙二醇聚合物;
9.将upy与六亚甲基二异氰酸酯混合,得到upy-hdi;
10.步骤2)将癸二酸封端聚乙二醇聚合物、丙三醇和二氢咖啡酸混合,得到 pegsd预聚物;
11.步骤3)将pegsd预聚物与upy-hdi混合进行接枝反应,得到upy功能化的pegsd聚合物;
12.步骤4)将upy功能化的pegsd聚合物进行热溶解,之后与硫化铜纳米颗粒混合,得到可注射抗菌温敏纳米复合水凝胶敷料。
13.优选地,步骤1)中,聚乙二醇和癸二酸的质量比为(0.5~3):(0.1~1);
14.upy与六亚甲基二异氰酸酯的摩尔比为(0.5~2):(5~10);
15.步骤2)中,癸二酸封端聚乙二醇、丙三醇和二氢咖啡酸的质量比为(0.5~2): (0.1~0.5):(0.1~0.5);
16.步骤3)中,pegsd预聚物与upy-hdi质量比为(120~70):(0.5~20)。
17.优选地,步骤4)的具体操作为:
18.将upy功能化的pegsd聚合物均匀加热溶解于去离子水中,得到浓度为300 mg/ml~1000mg/ml的pegsdu聚合物混合液;
19.将硫化铜纳米颗粒超声分散到去离子水中,得到浓度为0.5mg/ml~12mg/ml 的硫化铜分散液;
20.将pegsdu聚合物混合液与硫化铜纳米颗粒分散液和去离子水混合,得到混合液;混合液中pegsdu聚合物的浓度为100mg/ml~1000mg/ml、硫化铜纳米颗粒的浓度为0.5mg/ml~4mg/ml;
21.将混合液振荡混匀后冷却,得到可注射抗菌温敏纳米复合水凝胶敷料。
22.优选地,步骤1)中,癸二酸与聚乙二醇反应时的温度条件为120~160℃,反应时间为12~48h;
23.upy与六亚甲基二异氰酸酯混合时的反应温度条件为60~110℃,反应时间为 10~30h;
24.步骤2)中,反应时的温度条件为120~160℃,反应时间为12~72h;
25.步骤3)中,接枝反应的温度条件为60~100℃,反应时间为10~40h。
26.优选地,步骤1)~步骤3)中的反应都是在氮气或惰性气体的氛围中进行的。
27.优选地,步骤1)中,聚乙二醇的平均分子量为200~8000。
28.优选地,步骤4)的具体反应条件为:
29.加热溶解的温度条件为50~100℃;超声分散的功率为100~500w,超声时间为1~5h;冷却条件为4~40℃,冷却时间为1~5h。
30.一种可注射抗菌温敏纳米复合水凝胶敷料在生物医药领域中的应用,可注射抗菌温敏纳米复合水凝胶敷料在抑制大肠杆菌和耐甲氧西林金黄色葡萄球菌中的应用。
31.与现有技术相比,本发明具有以下有益效果:
32.本发明公开了一种可注射抗菌温敏纳米复合水凝胶敷料,该水凝胶敷料可以很好地覆盖皮肤表面伤口,提供湿润的环境;其中,亲水的聚乙二醇链段和疏水的癸二酸链段相结合,能够形成可控持续缓释药物的胶束,胶束能够包裹一些疏水的药物或纳米颗粒,增强疏水性药物或纳米颗粒的递送,从而更好地发挥其作用,促进伤口愈合,其形成的水凝胶网络同时也可以负载亲水性的药物,并对其进行缓释。
33.本发明公开了一种可注射抗菌温敏纳米复合水凝胶敷料的制备方法,选择了具有良好生物相容性的聚乙二醇作为制备水凝胶的基础成分,通过在聚乙二醇上接枝癸二酸,得到癸二酸封端的聚乙二醇,再将其与丙三醇和二氢咖啡酸熔融缩聚,在癸二酸封端的聚乙二醇上,得到接枝有二氢咖啡酸的聚(癸二酸甘油酯)
ꢀ‑
co-聚乙二醇聚合物(pegsd)作为
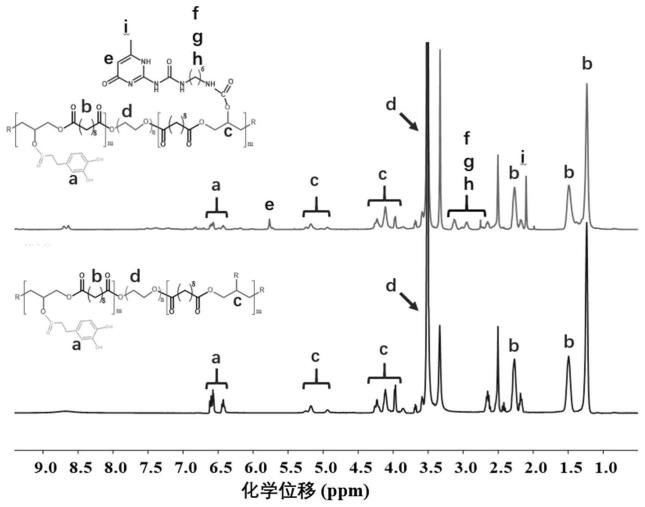
水凝胶的主要原料。聚乙二醇具有良好的生物相容性,是一类重要的用于形成生物医用材料的原料;而二氢咖啡酸的引入不仅提高了pegsd组织黏附性能,还可以赋予其出色的抗氧化性质,同时二氢咖啡酸还可以与硫化铜表面形成金属配位交联,进一步增强物理凝胶的强度,这种硫化铜的引入赋予水凝胶出色的抗菌性能和光热效应。upy已经被证明可以对一些高分子材料进行功能化,提高材料的机械强度和赋予材料自愈合性能,本发明将upy与六亚甲基二异氰酸酯反应物(upy-hdi)作为水凝胶前驱体的多氢键功能单元,将其接枝到pegsd主链上,得到pegsd-upy聚合物(pegsdu),再加入硫化铜纳米颗粒进行超声分散,得到拥有快速自愈合的upy(嘧啶酮)功能化的可注射抗菌温敏纳米复合水凝胶敷料(pegsdu@cus)。
34.利用本发明方法制得的水凝胶敷料在全切口皮肤损伤模型中,通过评估伤口愈合率,该水凝胶敷料展示出优于商用敷料(tegaderm
tm
)的治疗效果,同时当该水凝胶敷料负载硫化铜纳米颗粒时,展示出优异的皮肤创面愈合的治疗效果和抗菌效果。同时,负载硫化铜纳米颗粒之后的水凝胶可以在生理条件下有效地释放纳米颗粒,发挥其在增强胶原沉积和上皮重构,改善软组织修复等多方面的作用。此外,水凝胶具有稳定的流变学特性,具有可调控的力学性能,温度相应性,优异的自愈合性能,生物相容性,光热抗菌性以及固有的抗菌性能等。因此,该系列多功能水凝胶敷料在促进皮肤伤口愈合领域有着良好的应用前景。
35.进一步地,本发明中的二氢咖啡酸具有邻苯二酚结构,因而拥有良好的抗氧化性,可以清除伤口附近过量的氧自由基,防止伤口进一步氧化损伤,此外,二氢咖啡酸的儿茶酚基团还可以与组织界面形成多种物理作用,赋予材料粘附性,使得材料在生理条件下不易脱落。二氢咖啡酸还能赋予材料与金属络合的能力,使得硫化铜纳米颗粒在水凝胶中稳定的良好分散,同时可以抑制铜离子的突释。
36.进一步地,upy-hdi可以交联pegsdu枝化聚合物,赋予材料四重氢键交联的动态网络,使材料具有良好的机械性能和优异的自愈合性能,使得材料可以进行动态自我修复,防止其在使用的过程中断裂。此外,经upy-hdi交联的 pegsdu材料还具有剪切变稀的性质,使得材料易于注射,可以覆盖各种形状不规则的伤口。
37.进一步地,硫化铜纳米颗粒具有促进血管生成的作用,可刺激血管内皮细胞的增殖,促进肉芽组织形成相关的细胞迁移,进而加速软组织创伤的修复。此外,硫化铜纳米颗粒具有光热性能和抗菌性能,其可以通过与细菌直接接触或光热处理来实现杀菌,此时细菌不会产生抗药性。另一方面,硫化铜纳米颗粒可以穿透细菌的细胞壁,通过释放铜离子发挥抗菌作用,同时,纳米颗粒具有较大的比表面积,可以在较低的浓度下达到良好的杀菌效果。
附图说明
38.图1为本发明实施例1制得的pegsd和pegsd-upy的核磁共振氢谱图;
39.图2(a)为本发明实施例4制得的pegsd预聚物,pegsd-upy,cus和 pegsdu@cus分散在去离子水中的紫外-可见吸收光谱图;图2(b)为pegsd 预聚物和不同upy接枝含量的pegsdu水凝胶分散在去离子水中的紫外-可见吸收光谱图;
40.图3(a)为本发明实施例4制得的不同梯度pegsdu水凝胶在升温条件下的流变特性,图3(b)为本发明实施例4制得的pegsdu水凝胶在降温条件下的流变特性,图3(c)为本发
明实施例4制得的pegsdu水凝胶在25摄氏度下的流变特性,图3(d)为本发明实施例4制得的pegsdu水凝胶在37摄氏度下的流变特性;
41.图4为本发明实施例5制得的pegsdu@cus水凝胶冷冻干燥后的扫描电镜微观形貌图;
42.图5为本发明实施例5制得的pegsdu@cus水凝胶的溶胀率;
43.图6(a)为本发明实施例5制得的pegsdu@cus水凝胶在25摄氏度下的流变特性,图6(b)为本发明实施例5制得的pegsdu@cus水凝胶在37摄氏度下的流变特性;
44.图7(a)为本发明实施例5制得的pegsdu@cus水凝胶的应变,图7(b) 为本发明实施例5制得的pegsdu@cus水凝胶的自愈合性,图7(c)为本发明实施例5制得的pegsdu@cus水凝胶的剪切变稀性能;
45.图8为本发明实施例5制得的pegsdu@cus水凝胶的氧自由基清除率;
46.图9为本发明实施例5制得的pegsdu@cus水凝胶的溶血率评估;
47.图10为本发明实施例5制得的pegsdu@cus水凝胶的细胞相容性评估
48.图11(a)为本发明实施例5制得的pegsdu@cus水凝胶体外接触抗大肠杆菌的效率,图11(b)为本发明实施例5制得的pegsdu@cus水凝胶体外接触抗耐甲氧西林金黄色葡萄球菌的效率,图11(c)为本发明实施例5制得的 pegsdu@cus水凝胶体外光热抗大肠杆菌的效率,图11(d)为本发明实施例5 制得的pegsdu@cus水凝胶体外光热抗耐甲氧西林金黄色葡萄球菌的效率。
具体实施方式
49.下面结合附图对本发明做进一步详细描述:
50.实施例1
51.pegsd-upy12@cus2水凝胶敷料的制备:将40g聚乙二醇(peg,平均分子量2000)和16.13g癸二酸(sa)混合搅拌,在140℃,氮气气氛中反应24h,再抽气降低体系气压至5kpa,在140℃,氮气气氛中反应1h,得到癸二酸封端的聚乙二醇;在癸二酸封端的聚乙二醇中加入5.77g丙三醇,7.64g二氢咖啡酸,混合搅拌,在140℃,氮气气氛中反应24h,再抽气降低体系气压至5kpa,在 140℃,氮气气氛中反应1h,得到pegsd预聚物;将0.766g upy和7.138g六亚甲基二异氰酸酯(hdi)混合物搅拌,在100℃,氮气气氛中反应24h。反应结束后将产物沉淀用正戊烷洗涤3次,真空干燥,得到upy-hdi;将88g的pegsd 预聚物和12g的upy-hdi混合搅拌,在80℃,氮气气氛中反应24h,得到 pegsd-upy12聚合物,将pegsd-upy12聚合物加热溶解于70℃的去离子水中,配制成300mg/ml的pegsd-upy12聚合物溶液;将硫化铜(cus)纳米颗粒分散到去离子水中,以500w功率超声2h使其分散均匀,获得浓度为12mg/ml 的cus纳米颗粒分散液;将cus纳米颗粒分散液与70℃的pegsd聚合物溶液混合,使其中pegsd聚合物的终浓度为250mg/ml,cus纳米颗粒的终浓度为 2mg/ml,充分振荡混匀后冷却至室温即可获得pegsd-upy12@cus2水凝胶敷料。
52.实施例2
53.将实施例1中的peg与sa的质量比分别控制在(0.5:1)、(1:1)、(2:1)、 (3:1),其他条件同实施例1,即可获得pegs(s0.5)d-upy12@cus2、pegs (s1)d-upy12@cus2、pegs(s2)d-upy12@cus2、pegs(s3)d-upy12@cus2 水凝胶敷料。
54.实施例3
55.将实施例1中的丙三醇与二氢咖啡酸的比例分别控制在(3:1)、(1:1)、(1: 3)、(1:4),其他条件同实施例1,即可获得pegsd(d0.25)-upy12@cus2、 pegsd(d0.5)-upy12@cus2、pegsd(d0.75)-upy12@cus2、pegsd(d0.8)
ꢀ‑
upy12@cus2水凝胶敷料。
56.实施例4
57.将实施例1中的pegsd预聚物和upy-hdi的比例分别控制在(97:3)、(94: 6)、(91:9)、(85:15),其他条件同实施例1,即可获得pegsd-upy3@cus2,、 pegsd-upy6@cus2、pegsd-upy9@cus2、pegsd-upy15@cus2水凝胶敷料。
58.实施例5
59.将实施例1中的cus纳米颗粒的终浓度分别控制在0.5mg/ml、1mg/ml、3mg/ml、4mg/ml,其他条件同实施例1,即可获得pegsd-upy12@cus0.5、 pegsd-upy12@cus1、pegsd-upy12@cus3、pegsd-upy12@cus4水凝胶敷料。
60.实施例6
61.将实施例1中的pegsd-upy12聚合物溶液终浓度分别控制在100mg/ml、 200mg/ml、400mg/ml、500mg/ml,其他条件同实施例1,即可获得 pegsd-upy12(10%)@cus2、pegsd-upy12(20%)@cus2、pegsd-upy12 (40%)@cus2、pegsd-upy12(50%)@cus2水凝胶敷料。
62.对实施例1制备的pegsd预聚物和pegsd-upy聚合物进行核磁共振测试。结果如图1所示,相比pegsd预聚物,pegsd-upy聚合物的核磁共振氢谱显示出upy独有的特征峰,说明upy已经被成功地接枝在聚合物上。
63.对上述实施例4制备的pegsd预聚物,pegsd-upy聚合物,cus纳米颗粒和pegsd-upy@cus水凝胶进行紫外-可见吸收光谱分析,进一步证明upy接枝情况和cus纳米颗粒的掺入情况。结果如图2(a)所示,随着接枝upy浓度的提高,样品在280nm左右的特征吸收峰增强;图2(b)显示,相比于没有掺入 cus纳米颗粒的样品,掺入了cus纳米颗粒的样品在400nm左右出现了特征吸收峰,说明cus纳米颗粒被成功引入。
64.对上述实施例4制备的pegsd-upy聚合物在不同温度条件下进行流变学性能测试,结果如图3所示,在一定浓度范围内,随着聚合物中接枝的upy增加,聚合物的最终强度(储存模量)逐渐增加;且如图3(a)所示,在测试温度由4 摄氏度升温至55摄氏度的情况下,随着温度上升,聚合物的强度下降,表示该聚合物可以响应温度变化,在高温时强度减弱,便于移除;图3(b)显示,在测试温度由55摄氏度降温至4摄氏度的情况下,随着温度下降,聚合物的强度上升,说明该聚合物在常温时可以保持一定的强度,不易断裂损坏。图3(c),(d) 显示了在25摄氏度和37摄氏度的情况下,聚合物的变频率力学性能,随着聚合物中接枝的upy增加,聚合物的最终强度提高。表明本发明制备的水凝胶有良好的力学性能。
65.利用扫描电子显微镜观察实施例5制备的水凝胶的微观形貌,结果如图4所示,水胶敷料表现出贯穿多孔的结构,孔的直径大概分布在80-200μm。该结果说明本发明制备的水凝胶敷料具有良好的孔隙结构。
66.通过溶胀率来衡量上述实施例5制备的不同梯度的pegsd-upy@cus水凝胶敷料的保水性能,如图5所示,随着水凝胶中cus纳米颗粒的增加,水凝胶的溶胀率逐渐增加,表明本发明制备的水凝胶有良好的保水性能。
67.对上述实施例5制备的pegsdu@cus水凝胶在不同温度条件下进行流变学性能测
试,结果如图6(a),(b)所示,显示了在25摄氏度和37摄氏度的情况下,pegsdu@cus水凝胶的变频率力学性能,在一定浓度范围内,随着聚合物中接枝的cus纳米颗粒的增加,聚合物的最终强度(储存模量)逐渐增加。
68.对上述实施例5制备的pegsdu@cus2.0水凝胶进行自愈合和剪切变稀性能测试,结果如图7(a),(b)所示,当应力大于其断裂临界点时,水凝胶的存储模量低于其耗损模量,水凝胶结构坍塌,而当应变力减少时,水凝胶的存储模量又迅速回升,水凝胶结构又恢复正常,如此反复改变外力3次,水凝胶依旧可以表现出良好的自愈合性能,说明该水凝胶的自愈合性能稳定且优异。图7(c) 显示,当剪切速率增加时,水凝胶粘度显著下降,表明本发明制备的水凝胶有很好的剪切变稀特性,易于注射。
69.对上述实施例5制备的pegsdu@cus2.0水凝胶进行自由基清除实验,如图 8所示,当水凝胶浓度增加到200μg/ml时,约90%的自由基都被清除,表明本发明制备的水凝胶有良好的抗氧化活性。
70.利用小鼠血细胞对上述实施例5制备的pegsdu@cus水凝胶的溶血率进行测试,将小鼠血液中的红细胞分离出来与不同浓度的冷冻凝胶分散液在37℃下孵育1h,离心后测试上清液吸光度并计算溶血率,将0.1%triton x-100用作阳性对照,将pbs用作阴性对照。结果如图9所示,上述制备的pegsdu@cus水凝胶中cus纳米颗粒的浓度不超过3mg/ml时,均呈现出低于5%的溶血率。这表明利用本发明制备方法制备的水凝胶敷料样品均呈现出较好的血液相容性。
71.利用小鼠成纤维细胞(l929)测试上述实施例5制备的pegsdu@cus水凝胶的细胞相容性。使用dmem培养基在37℃,5%co2下浸泡pegsdu@cus,孵育24小时后获得水凝胶的萃取液。不同浓度的萃取液和细胞培养24小时后,测试细胞活力。结果如图10所示,当cus纳米颗粒浓度从0.5mg/ml增加到3 mg/ml时,均表现出较高的细胞活力。这说明本发明制备的水凝胶敷料样品均呈现出较好的细胞相容性
72.利用大肠杆菌和耐甲氧西林金黄色葡萄球菌,在不同条件下来测试上述实施例5制备的pegsdu@cus水凝胶的体外接触抗菌能力。将水凝胶放入10
6 cfu/ml细菌溶液中,加入水凝胶并在37℃的自动振荡器上孵育4小时,之后取出细菌溶液,接种在培养平板上,使用不添加水凝胶的细菌溶液用作阳性对照。如图11(a),(b)所示,在cus纳米颗粒的浓度到达2mg/ml后,对大肠杆菌和耐甲氧西林金黄色葡萄球菌的体外接触抗菌率均接近100%,证明 pegsdu@cus水凝胶具有优异的体外接触抗菌性能。利用nir照射测试pegsdu@cus水凝胶的光热抗菌能力。将水凝胶放入106cfu/ml细菌溶液中,加入水凝胶并使用nir光照射(1.0w/cm2),维持不同的照射时间,之后取出细菌溶液测试其活力。如图11(c),(d)所示,在照射时间大于3分钟后,含有 2mg/ml cus纳米颗粒的水凝胶对大肠杆菌和耐甲氧西林金黄色葡萄球菌的体外接触抗菌率均接近100%,证明pegsdu@cus2.0水凝胶具有优异的光热抗菌性能。
73.实施例7
74.将实施例1中的peg的分子量分别控制在1000、4000、6000、8000其他条件同实施例1,即可获得peg1000sd-upy12@cus2、peg4000sd-upy12@cus2、 peg6000sd-upy12@cus2、peg8000sd-upy12@cus2水凝胶敷料。
75.实施例8
76.将实施例1中的peg与sa的质量比分别控制在(0.5:0.1)、(0.5:0.8)、 (2:0.1)、(3:0.1)、(3:0.5),其他条件同实施例1,即可获得不同sa含量的 pegsd-upy12@cus2水凝胶敷料。
77.实施例9
78.将实施例1中的丙三醇与二氢咖啡酸的比例分别控制在(1:3)、(1:5)、(5: 1)、(5:3)、(5:2)、(5:4)、(4:5)其他条件同实施例1,即可获得不同二氢咖啡酸含量的pegsd-upy12@cus2水凝胶敷料。
79.实施例10
80.将实施例1中的pegsd预聚物和upy-hdi的比例分别控制在(120:0.5)、 (120:20)、(70:0.5)、(70:20)、(75:19)、(115:1),其他条件同实施例1,即可获得不同upy含量的pegsd-upy@cus2水凝胶敷料。
81.实施例11
82.将实施例1中的cus纳米颗粒的终浓度分别控制在0.8mg/ml、1.2mg/ml、2.4mg/ml、3.6mg/ml,其他条件同实施例1,即可获得不同硫化铜含量的 pegsd-upy12@cus水凝胶敷料。
83.实施例12
84.将实施例1中的pegsd-upy12聚合物溶液终浓度分别控制在600mg/ml、 700mg/ml、800mg/ml、900mg/ml、1000mg/ml,其他条件同实施例1,即可获得不同pegsdu含量的pegsd-upy12@cus2水凝胶敷料。
85.对上述实施例制得的可注射抗菌温敏纳米复合水凝胶敷料均进行了核磁共振测试、紫外-可见吸收光谱分析、微观形貌分析(sem)、溶胀率测试、力学性能测量、抗菌实验、自愈合和剪切变稀性能测试,结果均表明本发明方法制备得到的可注射抗菌温敏纳米复合水凝胶敷料,具有稳定的流变学特性,具有可调控的力学性能,温度相应性,优异的自愈合性能,生物相容性,光热抗菌性以及固有的抗菌性能。
86.上述实施例表明,本发明可以通过调节upy-hdi的用量,pegsd-upy聚合物的浓度,cus纳米颗粒的用量以制备不同种类的可注射抗菌温敏纳米复合水凝胶敷料,以此类方法制备的水凝胶具有可注射性,应对各种情况的皮肤损伤;此外,制备的水凝胶展现出良好的机械性能,粘附性能和自愈合性能,在使用的过程中不易脱落或断裂,其同时具有优异的抗菌性,光热性和抗氧化性,能有效防止伤口感染并减少伤口所受的氧化应激损伤。
87.综上所述,本发明制备的可注射抗菌温敏纳米复合水凝胶具有较好的可注射性,粘附性和自愈合性,其中,pegsd-upy高分子链具有的剪切变稀性质使得其能够非常方便地通过常用注射器进行注射,在注射结束后又可恢复其较好的机械性能,保护伤口并为伤口提供湿润的环境,不易脱落、断裂而且能够适应不规则伤口;具有抗菌性和光热性能,可以防止伤口感染;具有抗氧化性,可以预防伤口周围的组织受氧化损伤;水凝胶中的cus纳米颗粒可通过与细菌直接接触或光热处理来实现杀菌,此时细菌不会产生抗药性,进一步保护伤口,为其提供良好的修复环境;此外,cus纳米颗粒能够促进伤口附近的血管再生和肉芽组织形成,加快相关细胞的增殖和组织的修复。因此,本发明制备的水凝胶敷料能够应用在皮肤伤口修复,包括感染伤口医疗护理等方面。
88.以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按
照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1