青风藤果实萃取物及其制备方法和应用
本申请属于中药技术领域,尤其涉及一种青风藤果实萃取物及其制备方法和应用。
背景技术:
痤疮是一种皮肤病,病程周期长,可引发毛囊炎,常发病于脸部、胸部和背部等。其发病机理比较复杂,与多重原因有关,除与内分泌、免疫、皮脂过度分泌和毛囊角化过度等因素有关外,微生物学上分析认为与痤疮丙酸杆菌等厌氧菌和表皮葡萄球菌、金黄色葡萄球菌等需氧细菌的混合感染密切相关。
目前,通常采用西药或中药来治疗痤疮,例如西药采用抗生素、红霉素、四环素等,但是细菌会对西药产生耐药性,导致久治不愈,并且患者容易对西药产生依赖性。而中药对痤疮的治疗效果相对较差。
技术实现要素:
鉴于背景技术中存在的问题,本申请提供一种青风藤果实萃取物及其制备方法和应用,旨在中药治疗痤疮效果较差的问题。
为了达到上述目的,第一方面,本申请实施例提供一种青风藤果实萃取物的制备方法,包括以下步骤:提供新鲜的青风藤果实;将青风藤果实进行粉碎处理后,将其过滤并保留清液,得到青风藤果实粗提液;萃取青风藤果实粗提液,得到青风藤果实萃取物。
根据本申请的一个实施例,采用有机溶剂对青风藤果实粗提液进行萃取,其中,有机溶剂选自乙酸乙酯和正丁醇中的至少一种。
根据本申请的一个实施例,萃取青风藤果实粗提液,包括:采用乙酸乙酯对青风藤果实粗提液进行萃取。
根据本申请的一个实施例,萃取青风藤果实粗提液,包括:采用乙酸乙酯逐级萃取青风藤果实粗提液,将逐级萃取后得到的萃取相溶液合并,合并后回收萃取相溶液中的乙酸乙酯。
根据本申请的一个实施例,萃取青风藤果实粗提液之后,还包括:将萃取后的青风藤果实粗提液减压旋干,以回收部分萃取溶剂,并得到青风藤果实萃取浓缩液;加热青风藤果实萃取浓缩液,以回收剩余的萃取溶剂。
根据本申请的一个实施例,将萃取后的青风藤果实粗提液减压旋干,包括:于55℃~65℃下,将青风藤果实粗提液于45~55r/min下真空旋蒸18~22min。
根据本申请的一个实施例,将青风藤果实进行粉碎处理后,将其过滤并保留清液,得到青风藤果实粗提液之后,还包括:浓缩处理青风藤果实粗提液。
根据本申请的一个实施例,浓缩处理青风藤果实粗提液包括:于52℃~68℃下,将青风藤果实粗提液于45~65r/min下真空旋蒸1.8~2.2h。
第二方面,本申请实施例提供一种青风藤果实萃取物,由本申请第一方面的任一实施例的制备方法制备得到。
本申请第三方面提供一种青风藤果实萃取物在治疗痤疮领域的应用,其中,青风藤果实萃取物采用本申请第二方面实施例提供的青风藤果实萃取物。
根据本申请实施例的制备方法,萃取得到的青风藤果实萃取物具有较优异的抑菌能力,尤其是对表皮葡萄球菌、痤疮丙酸杆菌和金黄色葡萄球菌具有优异的抑菌效果。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对本发明实施例中所需要使用的附图作简单地介绍,显而易见地,下面所描述的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据附图获得其他的附图。
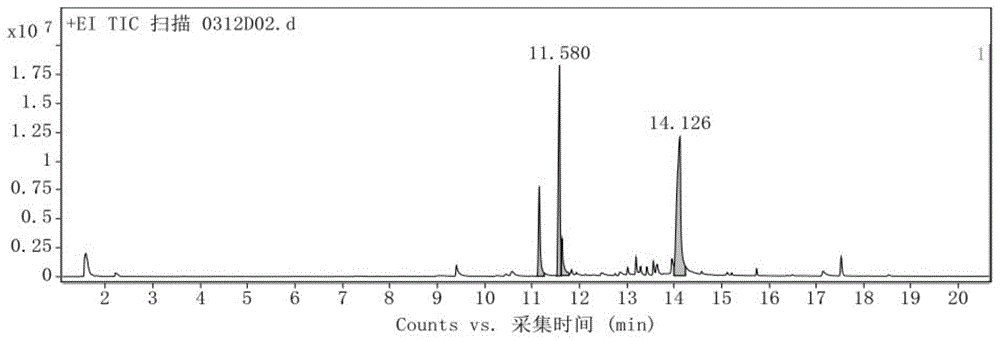
图1是根据本申请实施例提供的青风藤果实萃取物碘分离物质的总离子流图;
图2是根据本申请实施例提供的保留时间为11.156min物质的ei-ms质谱图;
图3是根据本申请实施例提供的保留时间为11.580min物质的ei-ms质谱图;
图4是根据本申请实施例提供的保留时间为14.126min物质的ei-ms质谱图;
图5是根据本申请实施例提供的青风藤果实萃取物对微生物的时间动力学曲线;
图6是根据本申请实施例提供的青风藤果实萃取物作用下的微生物生长曲线图。
具体实施方式
为了使本申请的发明目的、技术方案和有益技术效果更加清晰,以下结合具体实施例对本申请进行详细说明。应当理解的是,本说明书中描述的实施例仅仅是为了解释本申请,并非为了限定本申请。
为了简便,本文仅明确地公开了一些数值范围。然而,任意下限可以与任何上限组合形成未明确记载的范围;以及任意下限可以与其它下限组合形成未明确记载的范围,同样任意上限可以与任意其它上限组合形成未明确记载的范围。此外,尽管未明确记载,但是范围端点间的每个点或单个数值都包含在该范围内。因而,每个点或单个数值可以作为自身的下限或上限与任意其它点或单个数值组合或与其它下限或上限组合形成未明确记载的范围。
在本文的描述中,需要说明的是,除非另有说明,“以上”、“以下”为包含本数,“一种或多种”中“多种”的含义是两个以上。
本申请的上述发明内容并不意欲描述本申请中的每个公开的实施方式或每种实现方式。如下描述更具体地举例说明示例性实施方式。在整篇申请中的多处,通过一系列实施例提供了指导,这些实施例可以以各种组合形式使用。在各个实例中,列举仅作为代表性组,不应解释为穷举。
青风藤的根、茎、叶具有抑菌抗炎作用,主要源于其包含的青藤碱所起的作用。但是目前对青风藤果实化学成分的研究较少,而对其果实抑菌活性研究仍处于空白阶段,导致每年有大量的青风藤果实被浪费。
发明人为提高青风藤果实的利用率,专注于对青风藤果实的研究,通过萃取等技术手段提取青风藤果实中的有效成分,并证实青风藤果实具有优异的抑菌活性。
基于此,第一方面,本申请实施例提出了一种青风藤果实萃取物的制备方法,包括以下步骤:
s100,提供新鲜的青风藤果实;
s200,将所述青风藤果实进行粉碎处理后,将其过滤并保留清液,得到青风藤果实粗提液;
s300,萃取所述青风藤果实粗提液,得到青风藤果实萃取物。
根据本申请实施例的制备方法,萃取得到的青风藤果实萃取物具有较优异的抑菌能力,尤其是对表皮葡萄球菌、痤疮丙酸杆菌和金黄色葡萄球菌具有优异的抑菌效果。
步骤s100中,青风藤的来源有两种,一种是防己科植物中的青风藤,另一种是陕西产防己科植物青风藤的变种毛青藤果实。青风藤果实形似蓝莓呈串状,浆汁丰富,果汁为紫红色。本申请实施例中所采用的青风藤可以是以上任意一种青风藤,也可以是两种青风藤的混合物。
步骤s200中,将青风藤果实进行预处理,为萃取步骤做准备。预处理过程包括:采集成熟新鲜的青风藤果实后,去除其果梗,将青风藤果实粉粹处理,然后过滤并保留清液。其中,过滤可采用常压过滤和/或减压过滤等。常压过滤更节省能源。减压过滤可提高过滤效率,并可避免有效活性成分被破坏。
步骤s300中,可采用有机溶剂对青风藤果实粗提液进行萃取。例如有机溶剂可选自乙酸乙酯和正丁醇中的至少一种。青风藤果实中的有效活性物质多为有机物质,采用有机溶剂进行萃取可提高有效活性物质的提取率。
在一些实施例中,有机溶剂可以为乙酸乙酯,乙酸乙酯对青风藤果实粗提液进行萃取。具体地,可采用乙酸乙酯逐级萃取3~5次青风藤果实粗提液,逐级萃取出青风藤果实粗提液中的不同有效活性物质,将逐级萃取后得到的萃取相溶液合并,合并后回收萃取相溶液中的乙酸乙酯。
作为对比示例,有机溶剂选用石油醚,采用石油醚脱色萃取层无色,未能萃取出活性物质。
在一些实施例中,回收萃取溶剂包括:
s310,将萃取后的青风藤果实粗提液减压旋干,以回收部分萃取溶剂,并得到青风藤果实萃取浓缩液。减压旋干过程将回收大部分萃取溶剂。
s320,将所述青风藤果实萃取浓缩液水浴加热,以回收剩余的萃取溶剂。
以有机溶剂为乙酸乙酯进行举例说明,于60℃左右,将乙酸乙酯萃取后的萃取相溶液于旋转蒸发仪内;例如在55℃~65℃之间的任一温度数值时,回收乙酸乙酯。此温度,既可以防止乙酸乙酯沸腾,又可以提高回收效率。其旋蒸时转速可以选取45~55r/min,配合旋蒸转速,相应地,选取旋蒸时间为18~22min。例如,于60℃旋蒸时,将转速调整为50r/min,在此转速下,旋蒸20min,即可回收乙酸乙酯。
在步骤s200之后,还可以包括步骤s400,浓缩处理所述青风藤果实粗提液。例如,于52℃~68℃下,将所述青风藤果实粗提液于45~65r/min下真空旋蒸1.8~2.2h。在52℃~68℃下,既不会温度过高破坏青风藤果实中的有效活性物质,又可提高旋蒸效率。在45~65r/min,既提高了成热速率,又可搅拌均匀;相应地,配合转速,将适应选择旋蒸时间。例如,于60℃旋蒸时,将转速调整为50r/min,在此转速下,旋蒸2h,即可回收青风藤果实中的大部分水分。
发明人通过对青风藤果实进行萃取,提取有效成分,可以增加青风藤果实的利用。本申请采用乙酸乙酯对青风藤果实的有效活性物质进行萃取,分析其活性成分的结构,发现有效活性物质主要包括:对羟基苯乙醇、2-羟基苯乙腈和5-氨基苯并咪唑酮。此三种物质协同作用,可以对表皮葡萄球菌、痤疮丙酸杆菌和金黄色葡萄球菌起到优异的抑菌效果。
第二方面,本申请实施例提出了一种青风藤果实萃取物,由本申请第一方面实施例的制备方法制备得到。青风藤果实萃取物对表皮葡萄球菌、痤疮丙酸杆菌和金黄色葡萄球菌起到优异的抑菌效果。
第三方面,本申请实施例提供了青风藤果实萃取物在治疗痤疮领域的应用。本申请实施例提供的青风藤果实萃取物可以是本申请第二方面实施例的青风藤果实萃取物。在将青风藤果实萃取物应用于治疗痤疮时,可以将其作为药物活性物质,需要时可加入药物可接受的载体或助剂,按照制剂学常规技术制成所需的制剂。制剂可以是内服或者外涂用。制剂中的药物活性物质,可以是0.1%~99.9%,其余作为药物可接受的载体或助剂。制剂可以是任何可药用的剂型,包括:颗粒剂、片剂、糖衣片剂,薄膜衣片剂、肠溶衣片剂、胶囊剂、口服液、滴丸剂、冲剂、丸剂、散剂、混悬剂和粉剂等。
本申请实施例的药物制剂,以单位剂量形式存在,所述单位剂量形式是指制剂的单位,如片剂的每片,颗粒剂每袋,胶囊的每粒胶囊等。
单位剂量形式的制剂中优选含1%左右至90%左右(例如20%-80%或30-60%)的活性成分。例如,胶囊、片剂或糖衣丸等单次给药的单位剂型可含有约1mg至约100g(例如10mg至80g、50mg至50g、1g-20g等)的活性成分。
为了制成合适的剂型,作为药物活性物质的青风藤果实萃取物可以任选地与适于给药的无机或有机、固体或液体可药用载体或助剂混合或结合。例如,适合的载体特别包括填充剂如糖(例如乳糖)、甘露醇或山梨醇、纤维素制品和/或磷酸钙(磷酸三钙或磷酸氢钙);粘合剂如淀粉糊、明胶、甲基纤维素和/或聚乙烯乙烯吡咯烷酮;崩解剂如淀粉、羧甲基淀粉、交联聚乙烯吡咯烷酮、琼脂或海藻酸或其盐(如海藻酸纳)。
以下通过具体实施例对本申请作进一步说明。
实施例
青风藤果实萃取物的制备
s101,采集新鲜成熟的青风藤果实4192.9g;
s201,压榨粉碎为浆料2000ml,将此浆料纱布过滤后抽滤,得到青风藤果实粗提液;
s401,取250ml青风藤果实粗提液,于60℃下,在旋转蒸发仪内以50r/min真空旋蒸2h,得到100ml青风藤果实浓缩液;
s301,取100ml乙酸乙酯萃取青风藤果实浓缩液,吸取上层淡黄色萃取层,逐级萃取3~5次,直至有机层无色透明,合并萃取相溶剂后,于60℃下,在旋转蒸发仪内减压旋干,回收大部分挥发出来的乙酸乙酯,并得到青风藤果实萃取浓缩液。
于60℃下,将青风藤果实萃取浓缩液水浴加热,回收乙酸乙酯,并得到青风藤果实萃取物。
青风藤果实萃取物的成分测定
检测样品:
取实施例的青风藤果实萃取物,采用超纯水作为溶剂,配置成200mg/ml青风藤果实萃取溶液。并配置100mg/ml、50mg/ml、25mg/ml、12.5mg/ml、6.25mg/ml、3.125mg/ml等浓度的青风藤果实萃取溶液,为后续试验做准备。
取1ml的200mg/ml青风藤果实萃取溶液,加2ml乙酸乙酯溶解。取两块硅胶层板,用铅笔在距离底部1cm的位置轻画出两条起始线,用毛细管蘸取少量溶液均匀的涂抹在线框内,点样两次。将点样好的硅胶层析板放入加有40ml乙酸乙酯的层析槽内,盖上盖子,静置30min,待物质分层。30min后乙酸乙酯均匀布满整个大板,用吹风机吹干,在紫外灯下显示出界限清晰的条带。将显色后的硅胶层板放置碘粉盒中,利用碘粉显示出紫外下未显色的部分,碘粉可挥发(不影响分离出来的物质)。将薄层层析板上碘液显色条带最宽的深紫色部分用刮勺刮下来,碾压成粉末,放进布氏漏斗里,用乙酸乙酯洗脱6遍,收集洗脱液,用旋转蒸发仪55℃,30r/min,回收乙酸乙酯,富集至少量溶液后,称量玻璃瓶,装于玻璃瓶中,继续旋蒸至乙酸乙酯溶液完全挥干,抽真空20min,称量重量,得到28mg青风藤果实萃取物分离纯化物质。
将青风藤果实萃取物分离纯化物质作为检测样品。
检测方法:
依据《中国药典》2020版四部通则0521和0431进行检测。气质联用仪:aglent8890+5977byf005;
气相参数:载气:氦气;进样量:1ul;进样口温度:250℃;分流比:10:1;流量:1ml/min。升温程序:45℃保持2min,以15℃/min升到250℃,保持5min。
色谱柱:色谱柱编号2b-gc/ms-11;色谱柱型号:hp-5ms30m×0.25mm×0.25μm;
质谱参数:ei模式,70ev;离子源温度:230℃;四级杆温度:150℃;溶剂延迟:1min;全扫描模式:33~500m/z;
检测结果:
1、图1是根据本申请实施例提供的青风藤果实萃取物碘分离物质的总离子流图,如图1所示,总离子流色谱图对含量较高,响应较好的化学成分的色谱峰面积较大。表1是积分峰列表。由图1和表1可以看出,共有四个相应峰,分离出四种物质,其中三个响应较好,保留时间分别为11.156min,11.58min和14.126min,其面积比分别为27.7%,62.05%和100%,保留时间为11.580min的物质响应最好,保留时间为14.126min的物质峰面积最大。
表1积分峰列表
2、图2是根据本申请实施例提供的保留时间11.156min的ei-ms质谱图,如图2所示,分子离子峰为138,最大丰度为107,结构稳定,为失去[-ch2oh]的产物;m/z77和m/z51可推测结构中含有苯环;含有m/z91的离子碎片,所以含有[ar-ch2ch2-],m/z121为m/z138失去[h2o]离子碎片;m/z91为m/z121失去[-ch2=oh](醇)离子碎片;因此化合物为对羟基苯乙醇,对羟基苯乙醇的结构式如下:
3、图3是根据本申请实施例提供的保留时间11.580min的ei-ms质谱图,如图3所示,分子离子峰为133;最大丰度为133,结构稳定;质谱图上出现苯环系列峰m/z51,m/z77,说明有苯环存在;m/z106为m/z133失去[cn]腈)离子碎片;m/z115为m/z133失去[h2o]离子碎片;m/z90为m/z115失去[cn]腈)离子碎片;因此化合物为2-羟基苯乙腈,2-羟基苯乙腈的结构式如下:
4、图4是根据本申请实施例提供的保留时间14.126min的ei-ms质谱图,如图4可知,分子离子峰为149;最大丰度为149,结构稳定;m/z66为m/z80失去[ch2]离子碎片;m/z51为m/z66失去[nh](氨基)离子碎片;m/z122为m/z149失去[co]离子碎片;m/z94为m/z122失去[n2]离子碎片;因此化合物为5-氨基苯并咪唑酮,5-氨基苯并咪唑酮的结构式如下:
5、对羟基苯乙醇、对2-羟基苯乙腈和5-氨基苯并咪唑酮同时做液相色谱分析。如表2所示,对羟基苯乙醇在gc-ms保留时间rt=11.156min,lc-ms保留时间rt=3.59min,所占面积比为27.7%;2-羟基苯乙腈在gc-ms保留时间rt=11.580min,lc-ms中的保留时间rt=4.509min,所占面积比为62.05%;5-氨基苯丙咪唑酮,gc-ms保留时间rt=14.126min,lc-ms中的保留时间rt=4.135min,所占面积比为100%。由此,也印证了本申请实施例的青风藤果实萃取物中包含此三种物质,此三种物质均为包含苯环的大分子物质,并具有一定的抑菌效果。
表2三种物质的离子峰表
青风藤果实萃取物的抑菌试验
1、病毒样本:
金黄色葡萄球菌湖南农业大学动物医学院动物分离纯化菌株;
表皮葡萄球菌(atcc12228)广东省微生物菌种保藏中心;
痤疮丙酸杆菌(atcc11827)广东省微生物菌种保藏中心。
2、培养基制备
分别配制硫乙醇酸盐培养基、厌氧培养基、lb培养基,将配制好的培养基置锥形瓶中密封,放入灭菌锅中于121℃下灭菌30min,待冷却后,置于4℃冰箱中保存备用。
3、菌悬液的制备
标准菌株活化后接种于液体培养基中进行增菌培养,金黄色葡萄球菌和表皮葡萄球菌置于50ml锥形瓶中,150r/min,37℃恒温摇床培养24h;痤疮丙酸杆菌置于50ml锥形瓶中,用厌氧袋封装,37℃下恒温静置培养48h。
4、抑菌圈的测定
(1)测定过程
将经过高温灭菌的各相应培养基倒入直径9cm的无菌培养皿中,使每个培养皿有20ml的培养基,冷却后备用。在培养基表面加入0.1ml相应的菌悬液,涂布均匀,用打孔器打出直径为8mm孔,拿镊子将孔中的琼脂取出。用移液枪移取100μl的青风藤果实萃取物至挖好的孔中,在平皿背面相应的孔后做好标记,勿使其外溢。
表皮葡萄球菌和金黄色葡萄球菌放置37℃恒温箱内培养24h,痤疮丙酸杆菌放置厌氧培养盒中,再放到37℃恒温箱内培养48h。最后用游标卡尺测量抑菌圈直径(精确到0.01mm),实验重复三次,取平均值,记录实验结果。
以孔为中心,分别将200mg/ml、100mg/ml、50mg/ml、25mg/ml、12.5mg/ml、6.25mg/ml和3.125mg/ml的青风藤果浆萃取物溶液向培养基扩散,抑制周边的菌落生长,形成不长菌的圆圈,抑菌圈越大,表明不同浓度的青风藤果实萃取物溶液的抑菌效果越好。标准为:直径>20mm为高敏、直径10-20mm为中敏、直径<10mm为耐药。
(2)结果分析
由表3可知,在200mg/ml时,表皮葡萄球菌对青风藤果实萃取物溶液最为敏感,其最大抑菌圈达到30.86(±0.59)mm,其次为痤疮丙酸杆菌,最大抑菌圈为30.16(±0.11)mm,金黄色葡萄球菌的抑菌圈为21.29(±0.88)mm,青风藤果实萃取物溶液对三种菌种的抑菌圈均达到高敏标准;随着青风藤果实萃取物溶液浓度的降低,抑菌圈逐渐减小。不同浓度青风藤果实萃取物溶液对表皮葡萄球菌均较敏感;低浓度青风藤果实萃取物溶液对金黄色葡萄球菌不敏感。高浓度的青风藤果实萃取物溶液对痤疮丙酸杆菌比较敏感,低浓度无明显反应。说明在一定浓度青风藤果实萃取物溶液的作用下,对痤疮主要菌种都有较明显的抑制作用。
表3不同浓度青风藤果实萃取物对痤疮致病菌的抑菌圈直径(n=3)
5、青风藤果实萃取物对三种致痘菌的最低抑菌浓度实验
(1)青风藤果实萃取物对表皮葡萄球菌和金黄色葡萄球菌的最低抑菌浓度实验
取15个1ml的无菌管,标记1-15号,分别取青风藤果实萃取物溶液浓度为200、100、90、80、70、60、50、45、40、35、30、25、12.5、6.25、3.125mg/ml的青风藤果实萃取物0.2ml于15个无菌管中,用菌落计数法调整菌浓度,并稀释细菌浓度约在1×107cfu/ml,在无菌管中再加入10μl1×107cfu/ml表皮葡萄球菌菌液、金黄色葡萄球菌菌液,混合均匀,取0.1ml混合液均匀涂布于lb培养基上,同时取一个无菌管加0.2ml无菌水和10μl相应菌液,做空白对照组。将lb培养基放置37℃恒温箱内培养24h。重复三组实验,数据一致则记录结果。观察结果,取无细菌生长的质量浓度为最小抑菌浓度。
(2)青风藤果实萃取物对痤疮丙酸菌的最低抑菌浓度实验
与(1)不同的是,在无菌管中再加入10μl1×107cfu/ml痤疮丙酸杆菌菌液。混合均匀,取0.1ml混合液均匀涂布于厌氧培养基上,同时取一个小瓶加0.2ml无菌水和10μl相应菌液,做空白对照组。将厌氧培养基放置厌氧培养盒中,再放入厌氧袋和指示剂,置于37℃恒温箱内培养48h。重复三组实验,数据一致则记录结果。观察结果,取无细菌生长的质量浓度为最小抑菌浓度。
(3)结果分析
由表4中数据可知,与空白组相比,加了青风藤果实萃取物溶液后,对于三种菌均体现了不同程度的抑制作用;在达到mic浓度后,随着青风藤果实萃取物溶液浓度的降低,菌量逐渐增多,展现出一个较明显的梯度变化。其中相对于金黄色葡萄球菌的mic为35mg/ml,表皮葡萄球菌和痤疮丙酸杆菌的mic均为25mg/ml,说明表皮葡萄球菌和痤疮丙酸杆菌对于青风藤果实萃取物较为敏感;金黄色葡萄球菌抗药性较强。
表4青风藤果实萃取物对三种致痘菌的最低杀菌浓度(mic)(n=3)
注:“-”表示无菌生长,“+”表示有少量菌生长,“++”表示有中等菌生长,“+++”表示有较多菌生长,“++++”表示不计其数
6、青风藤果实萃取物对三种致痘菌的时间动力学实验
(1)青风藤果实萃取物对表皮葡萄球菌的时间动力学实验
取4个2ml无菌管,编号为0、1、2、3号,0、1、2、3号无菌管中先加0.5mllb液体培养基,再加1ml浓度为1×107cfu/ml的表皮葡萄球菌菌悬液,再分别加入不同体积的100mg/ml的青风藤果实萃取物溶液,使其终浓度为1/4mic、1/2mic、mic,0号作为空白对照组只加0.5mllb液体培养基和菌,不加药,将无菌管放置37℃下恒温培养,分别在0,2,4,8,12h取0.1ml涂布于lb平板,将lb平板置于37℃下培养24h后观察菌落生长状态。
(2)青风藤果实萃取物对金黄色葡萄球菌的时间动力学实验
与(1)不同的是,表皮葡萄球菌替换为金黄色葡萄球菌。
(3)青风藤果实萃取物对痤疮丙酸杆菌的时间动力学实验
与(1)不同的是,表皮葡萄球菌替换为痤疮丙酸杆菌菌悬液,lb液体培养基替换为厌氧培养基。并将无菌管里加0.1ml的植物油用于液封以隔绝氧气,将无菌管放置37℃下恒温培养,分别在0、4、8、16、32、48h取0.1ml涂布于固体厌氧平板,将固体厌氧平板置于厌氧袋,再加入厌氧产气袋和指示剂,置于37℃恒温培养箱种培养48h后观察菌落生长状态。
(4)结果分析
图5是根据本申请实施例提供的青风藤果实萃取物对微生物的时间动力学曲线,其中,图5a是青风藤果实萃取物对表皮葡萄球菌的时间动力学曲线,图5b是青风藤果实萃取物对金黄色葡萄球菌的时间动力学曲线,图5c是青风藤果实萃取物对痤疮丙酸杆菌的时间动力学曲线。
由图5a可以看出,在mic浓度下和1/2mic浓度下,0h时,有少量菌生长,菌量在0-2h内出现骤降,在2h时,菌量降为零;在1/4mic浓度下,有较多菌落生长,但菌量在0-4h内出现骤降,在4h时培养基上只有个别菌落生长;在空白对照组中,因组分中含有培养基,表皮葡萄球菌呈现稳定增长的趋势。三种不同条件下的抑菌动力学曲线,可以明显看出,加了青风藤果实萃取物溶液后有效抑制了表皮葡萄球菌的生长,随着青风藤果实萃取物溶液浓度的降低,抑菌能力逐渐减弱;且青风藤果实萃取物溶液对于表皮葡萄球菌比较敏感,抑菌效果更加明显。
由图5b可以看出,在高浓度2mic浓度下,0-12h内培养基上均无菌落生长,说明2mic浓度可有效抑制金黄色葡萄球菌的生长;在mic下,0h时有少量菌落生长,随着时间的延长,在4h菌落全部死亡;在1/2mic下,0h时有较多菌生长,多于mic在0h时的菌量但小于空白组,随着时间的延长,菌量缓慢降低,在12h时菌落全部死完,菌量为零。空白组中,因组分中含有培养基,金黄色葡萄球菌呈现稳定增长的趋势。三种不同条件下的抑菌动力学曲线,可以明显看出,加了青风藤果实萃取物溶液后有效抑制了金黄色葡萄球菌的生长,随着青风藤果实萃取物溶液浓度的降低,抑菌能力逐渐减弱。
由图5c可以看出,在mic浓度下,0h时,有少量菌生长,菌量在0-2h内出现骤降,在2h时,菌量降为零;在1/2mic浓度下,0h时,有较多菌生长,菌量在0-4h内出现骤降,在4h时,菌量降为零;在1/4mic浓度下,0h时,有较多菌生长,随着时间的延长,菌量下降的速度由快到缓,在48h时仍有菌落生长,说明痤疮丙酸杆菌对于1/4mic浓度青风藤果实萃取物溶液不敏感,其抑菌效果较弱。空白组中,因组分中含有培养基,痤疮丙酸杆菌呈现稳定增长的趋势。三种不同条件下的抑菌动力学曲线,可以明显看出,加了青风藤果实萃取物溶液后有效抑制了痤疮丙酸杆菌的生长,随着青风藤果实萃取物溶液浓度的降低,抑菌能力逐渐减弱。
7、青风藤果实萃取物作用下三种致痘菌的生长曲线实验
(1)不同浓度的青风藤果实萃取物溶液作用下表皮葡萄球菌生长曲线实验
取五个50ml的灭菌过的锥形瓶,分别编号为0、1、2、3、4号,1、2、3、4号瓶加48mllb液体培养基,1ml1×107cfu/ml表皮葡萄球菌菌悬液,再分别加入1ml浓度为200、100、50、25mg/ml的青风藤果实萃取物溶液,使其青风藤果实萃取物溶液终浓度分别为4、2、1、0.5mg/ml,混合均匀后放入150rpm,37℃的恒温摇床中,在无菌环境中,取3ml于比色皿,以水调零,在600nm处测吸光度,0为空白对照组只加菌不加药,每隔2h测一次吸光值,连续测至12h,及次日24h。
(2)不同浓度的青风藤青风藤果实萃取物溶液作用下金黄色葡萄球菌生长曲线实验
与(1)不同的是,表皮葡萄球菌替换为金黄色葡萄球菌。
(3)不同浓度的青风藤青风藤果实萃取物溶液作用下痤疮丙酸杆菌生长曲线实验
与(1)不同的是,表皮葡萄球菌替换为痤疮丙酸杆菌,lb液体培养基替换为厌氧培养基。
(4)结果分析
图6是根据本申请实施例提供的青风藤果实萃取物作用下的微生物生长曲线图,图6a是不同浓度的青风藤果实萃取物作用下的表皮葡萄球菌生长曲线图,图6b是不同浓度的青风藤果实萃取物溶液作用下的金黄色葡萄球菌生长曲线图,图6c是不同浓度的青风藤果实萃取物溶液作用下的痤疮丙酸杆菌生长曲线图。
由图6a可知,当青风藤果实萃取物溶液浓度分别为4、2、1、0.5mg/ml,在12h对于表皮葡萄球菌的杀菌率分别为100%,99.31%,99.65%,89.15%。说明在4、2、1、0.5mg/ml青风藤果实萃取物溶液作用下,杀菌率普遍较高,表皮葡萄球菌对青风藤果实萃取物溶液较为敏感。在0-24h期间,当青风藤果实萃取物溶液添加量为4、2mg/ml时,表皮葡萄球菌几乎不增长,当青风藤果实萃取物溶液添加量为1、0.5mg/ml时,表皮葡萄球菌先增长较缓,12h后快速增长,两组间呈梯度关系。空白对照组中,表皮葡萄球菌的生长曲线呈s型,在4-12h时进入对数增长期。与表皮葡萄球菌正常生长相比,青风藤果实萃取物溶液作用下的表皮葡萄球菌的生长缓慢,说明青风藤果实萃取物对于表皮葡萄球菌有较好的抑菌作用。
由图6b可知,当青风藤果实萃取物溶液浓度为4、2、1、0.5mg/ml时,在12h对于金黄色葡萄球菌的杀菌率分别为99.63%,87.30%,15.64%,13.16%。说明在2、4mg/ml青风藤果实萃取物溶液作用下,杀菌率较高,4mg/ml浓度下,几乎无菌生长。在低浓度1、0.5mg/ml青风藤果实萃取物溶液作用下,杀菌率较低。当青风藤果实萃取物溶液浓度为4mg/ml时,生长曲线极为稳定,几乎不增长,说明4mg/ml青风藤果实萃取物溶液浓度杀菌率极强;当青风藤果实萃取物溶液浓度为2mg/ml时,在0-12h较为稳定,12h后增长速度急剧上升;当青风藤果实萃取物溶液浓度为1、0.5mg/ml时,生长曲线与空白组接近,在4-12h进入对数生长期,12h后仍有增长趋势。说明相对于表皮葡萄球菌,金黄色葡萄球菌的耐药性较强,低浓度青风藤果实萃取物溶液抑菌效果不明显。空白对照组中,金黄色葡萄球菌的生长曲线呈s型,与金黄色葡萄球菌正常生长相比,稍高浓度的青风藤果实萃取物溶液作用下的金黄色葡萄球菌的生长缓慢,抑制了金黄色葡萄球菌进入对数增长期,说明青风藤果实萃取物溶液对于表皮葡萄球菌有抑制作用。
由图6c可知,当青风藤果实萃取物溶液浓度为4、2、1、0.5mg/ml时,在48h对痤疮丙酸杆菌的杀菌率分别为93.82%,60.10%,55.84%,45.90%。当青风藤果实萃取物溶液浓度为4mg/ml时,生长曲线有波动,但整体较稳定,在48h时只有少量菌落增长;在青风藤果实萃取物溶液浓度为2、1、0.5mg/ml三组间,其生长曲线呈现梯度增长,在12-36h间出现缓慢增长,36-48h时趋于平稳,变化趋势与空白对照组大致相同。在空白对照组中,8-36h进入对数生长期,36h后进入迟缓期。与痤疮丙酸杆菌正常生长相比,青风藤果实萃取物溶液作用下的痤疮丙酸杆菌的生长更为缓慢,明显抑制了痤疮丙酸杆菌进入对数生长期,且在对数生长期的活性较低,说明青风藤果实萃取物溶液对于痤疮丙酸杆菌有较好的抑制作用。
综上,青风藤果实萃取物对表皮葡萄球菌、痤疮丙酸杆菌和金黄色葡萄球菌均具有抑菌性。随着青风藤果实萃取物溶液浓度的升高,抑菌能力逐渐增强。
以上所述,仅为本申请的具体实施方式,但本申请的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本申请揭露的技术范围内,可轻易想到各种等效的修改或替换,这些修改或替换都应涵盖在本申请的保护范围之内。因此,本申请的保护范围应以权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!