姜黄素二氟硼及其衍生物的用途的制作方法
本发明属于分析及医药领域,具体涉及姜黄素二氟硼及其衍生物的多种用途。
背景技术:
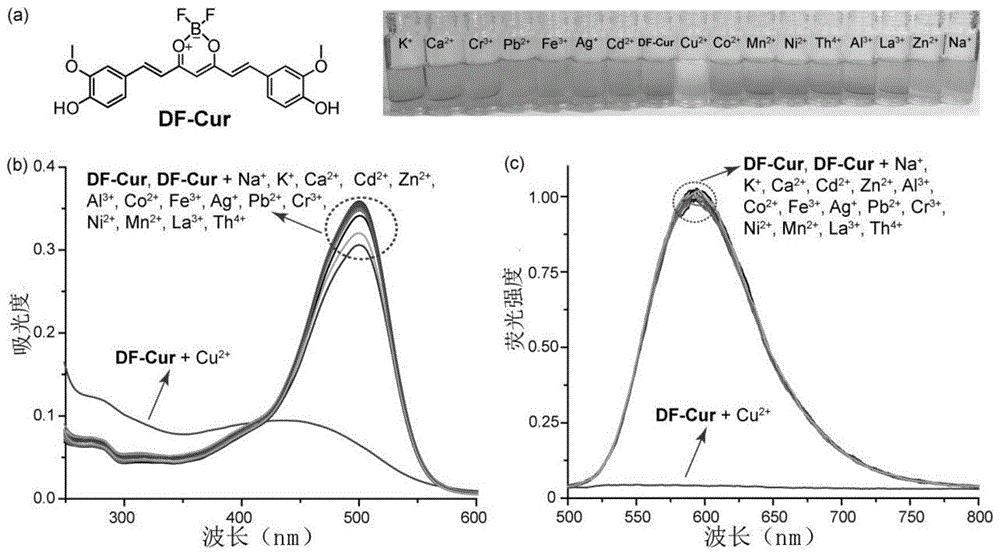
:铜对人体的作用体现在两个方面。在正常生理条件下,铜是多巴胺β-羟化酶,酪氨酸酶,赖氨酸氧化酶,细胞色素c氧化酶,超氧化物歧化酶和其他人类关键酶的辅因子,在维持营养和能量的正常代谢,促进组织生长和维持健康中起着重要作用。然而,铜是一种重金属元素,当铜过量存在时会造成严重危害,不仅会改变蛋白质的结构,而且还会交换铜或其他金属辅因子。金属蛋白会干扰细胞和组织的生物学功能,例如威尔逊氏病,是由肝脏中atp7b突变引起的铜代谢异常,导致铜无法排泄并积累在肝,血和脑等组织中,从而导致多器官损伤。同时,大脑中积累的铜可引起神经细胞损伤并引发焦虑,抑郁,人格分裂等精神问题,并通过诱导淀粉样蛋白沉淀而导致语言和认知障碍,肌张力障碍以及其他神经退行性疾病症状并干扰神经递质的代谢。最近的研究表明,cu2+的过度积累会导致多巴胺能和5-羟色胺神经递质代谢异常,这是pd和ad等神经退行性疾病的重要病理基础。因此,铜的过量积累对人体具有明显的毒性作用。另外,铜离子还对朊病毒具有激活等调控作用。除了人体代谢异常,环境污染是铜中毒的另一个重要原因。工业和农业活动的增加导致集中使用的建筑物、板材、带材和许多合金产品中存在的大量铜。在这些物质使用的过程中,大量废铜被排放到环境中,主要是水生生态系统。铜污染物被人类、鱼类、家禽、牲畜和野生动物从胃肠道、肺和皮肤吸收到系统循环中,最终导致铜积累和中毒,例如,人体吸收的cu2+将靶向肝和肾,从而引起肝毒性和肾衰竭。因此,铜检测剂在环境化学分析和肉类食品质量分析领域具有重要的应用价值;同时,由铜污染引起的中毒迫切需要更安全有效的铜解毒剂。技术实现要素:本发明基于姜黄素二氟硼及其衍生物对铜离子的选择性作用,提供了姜黄素二氟硼及其衍生物的多种用途。首先,本申请提供了姜黄素二氟硼及其衍生物在检测铜离子中的用途。实验证明,姜黄素二氟硼能够选择性识别铜离子,而对其他金属离子基本无反应;并且姜黄素二氟硼荧光强度随着cu2+浓度的增加,呈降低趋势;因此本发明中,姜黄素二氟硼能够用于定量和/或定性检测铜离子;并且利用姜黄素二氟硼,不仅能够检测常规溶液中铜离子,还能检测细胞中铜离子。进一步的,姜黄素二氟硼及其衍生物检测铜离子时,姜黄素二氟硼及其衍生物与铜离子的摩尔比为1:2~5。更进一步的,姜黄素二氟硼及其衍生物检测铜离子时,姜黄素二氟硼及其衍生物与铜离子的摩尔比为1:2。基于姜黄素二氟硼及其衍生物对铜离子的选择性识别,本发明还提供了姜黄素二氟硼及其衍生物在制备铜离子检测剂中的用途。本发明还提供了姜黄素二氟硼及其衍生物在制备铜解毒剂中的用途。本发明还提供了姜黄素二氟硼及其衍生物在制备用于铜离子中和的药剂和促铜离子排泄的药剂中的用途。本发明还提供了姜黄素二氟硼及其衍生物在制备治疗铜离子促进的相关疾病的药物中的用途。姜黄素二氟硼及其衍生物能够治疗因铜离子引起的各种相关疾病,上述用途中,所述相关疾病表现为铜离子在人体内过度蓄积或者异常促进体内关键酶的活性。具体的,上述用途中,所述相关疾病为铜稳态代谢障碍症、威尔逊病和大剂量铜摄入引起的中毒(包括铜中毒引起的肝肾损伤等);此外,姜黄素二氟硼及其衍生物对其他未探明的受到铜离子调节促进的疾病,同样能起到治疗作用。本发明还提供了姜黄素二氟硼及其衍生物在制备治疗神经退行性疾病的药物中的用途。进一步的,上述用途中,所述神经退行性疾病为帕金森氏病或阿尔茨海默病。本发明中,所述姜黄素二氟硼及其衍生物包括以下化合物:有益效果:本发明基于姜黄素二氟硼及其衍生物对铜离子的特异性作用,提供了姜黄素二氟硼及其衍生物的多种用途,包括铜离子检测、铜中毒解毒、铜离子相关疾病等;实验表明,姜黄素二氟硼及其衍生物对铜离子具有选择性识别,对与铜离子有关的相关疾病具有显著的治疗效果,特别是姜黄素二氟硼能使帕金森模型小鼠运动协调能力相比模型组有所恢复,并且能提高d-半乳糖致阿尔兹海默整模型小鼠的抗氧化能力,本发明为铜离子检测及铜离子相关疾病的治疗提供了一种新途径。附图说明图1为df-cur的结构式及其对铜离子选择性识别作用图,其中,a左侧为df-cur的化学结构式,a右侧为在含有df-cur(10μm)的ch3cn-h2o(95:5,v/v)溶液中加入5.0当量的各种金属离子后的视觉颜色变化图;b为加入5.0当量不同金属离子后,df-cur(10μm)的紫外-可见吸收光谱图,c为加入5.0当量不同金属离子后,df-cur(10μm)的荧光光谱图,λex=470nm。图2为不同浓度cu2+(0~5.0当量)的df-cur(10μm)ch3cn-h2o(95:5,v/v,λex=470nm)溶液的荧光滴定图,右上角为600nm处荧光强度与cu2+增加量的关系图。图3为mcf-7细胞中cu2+的共聚焦荧光图像,a为用df-cur(100nm)孵育30分钟的细胞荧光图像,b为用df-cur(100nm)孵育的细胞的明亮视野图像,c为用df-cur(100nm)孵育的细胞的显微图像合并,d为用df-cur(100nm)孵育30分钟后再用cu2+(100nm)孵育30分钟的细胞荧光图像,e为用df-cur(100nm)孵育30分钟后再用cu2+(100nm)孵育30分钟的细胞明亮视野图像,f为用df-cur(100nm)孵育30分钟后再用cu2+(100nm)孵育30分钟的细胞显微图像合并。图4为采用流式细胞仪对df-cur进行评价的结果图,其中,a为流式细胞仪检测mv4-11细胞的荧光信号,b为mv4-11细胞红色荧光信号的定量分析图,*表示p<0.05,与df-cur组比较有显著性差异。图5为活体斑马鱼体内cu2+的共焦荧光图像,其中,a~f为斑马鱼用df-cur(100nm)孵育30分钟的荧光图像,g~h为用df-cur(100nm)预孵育30分钟,然后用cu2+(100nm)孵育30分钟的斑马鱼的荧光图像,其中,a、d、g和j为荧光图像,b、e、h和k为亮场图像,c、f、i和l为合并图像。图6为给药期间血清(左)、尿液(中)和胆汁(右)中cu2+含量的变化图。图7为df-cur对铜毒性的体内解毒作用图,a为不同组小鼠的体重变化图,b为不同组肝、肾器官系数的变化图,c为肝肾组织病理学图。图8从左到右依次是造模后损伤1周后,各组动物依次在旋转杆上测试图。图9为模型建立及ad药效实验简明流程图。图10为空间探索实验结果图。具体实施方式以下通过实施例对本发明进行更详细的说明,本发明的保护范围并不局限于此,任何熟悉本领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或者替换,都应涵盖在本发明的保护范围之内。本发明具体实施方式部分使用的原料和仪器均可通过市场购买得到。试验例1、姜黄素衍生物的用途实验1、试剂信息所有化学药品均购自成都科龙化工有限公司(中国成都)。rpmi1640培养基购自hyclone(usa);胎牛血清(fbs)购自草原绿野生物工程材料有限公司(中国呼和浩特);青霉素和链霉素购自beyotime生物技术研究所(中国江苏);人白血病细胞株mv4-11、人乳腺癌细胞mcf-7、等均购于美国atcc公司。2、姜黄素二氟硼(df-cur)的合成df-cur是按照报道的文献程序制备的(yang等人,2019,7,2434-2441)。在氮气气氛下,向姜黄素(1.00g,2.71mmol)在无水二氯甲烷(100ml)中的溶液中添加三氟化硼二乙基(1.15g,8.13mmol)。然后将混合物在回流下搅拌2小时。加入水(100ml)以淬灭反应。有机层用h2o(2×100ml)洗涤两次,并用无水na2so4干燥。减压除去溶剂,得到粗产物。将获得的固体通过硅胶上的柱色谱进一步纯化,用石油醚/二氯甲烷(1:1,v/v)作为洗脱剂,得到呈红色粉末的df-cur(510mg,45%)。1hnmr(700mhz,dmso-d6)δ10.1(s,2h),7.92(d,j=15.5hz,2h),7.48(s,2h),7.35(d,j=8.2hz,2h),7.02(d,j=15.5hz,2h),6.88(d,j=8.2hz,2h),6.46(s,1h),3.86(s,6h)。13cnmr(100mhz,dmso-d6)δ.177.88;150.50;150.50;147.33;147.33;146.13;146.13;125.15;125.15;124.44;124.44;117.02;117.02;115.11;115.11;111.55;111.55;100.27;100.27;54.93;47.77。esi-ms(ch3oh):416.1266。3、光谱测定的一般程序所有储备液和工作溶液均在光谱级ch3cn-h2o(95:5,v/v)中制备。df-cur(10μm)的样品是在ch3cn-h2o(95:5,v/v)中新鲜制备的。根据以下实验记录荧光和uv-vis光谱:通过添加10μl不同的阳离子(3.0×10-2mol·l-1)溶液滴定3.0ml溶解在ch3cn-h2o(95:5,v/v)中的df-cur(10μm)溶液。在相同的培养基中进行检测(其中,图1中,各金属离子加入量为5eq,图2中铜离子加入量为0~5eq)。添加量限制为100μl,因此体积变化不明显。将测试溶液静置30分钟,其时间足以达到络合平衡,然后记录吸收光谱和发射光谱(见图1)。在分光荧光计中在470nm下以10nm发射狭缝宽度进行荧光激发。基于荧光滴定实验计算检测限。十次测量df-cur的荧光发射光谱,并达到空白测量的标准偏差。为了获得斜率,将荧光强度绘制为cu2+的浓度(见图2)。因此,df-cur的检出限可通过以下公式计算:检出限=3σ/k,其中σ是空白测量的标准偏差,k是荧光强度与cu2+之间的斜率。df-cur的结构如图1a左侧所示;由图1a右侧可知,仅添加5.0当量的df-cur从深黄色变为无色cu2+,可以通过肉眼轻松识别,其余金属离子均基本无变化,该结果表面该受体显示出对cu2+的选择性识别。df-cur识别金属离子(碱金属na+、k+和碱金属ca2+、主族金属al3+、过渡金属离子cu2+、cr3+、pb2+、fe3+、ag+、cd2+、co2+、mn2+、ni2+、zn2+和f嵌段金属离子la3+和th4+)在同一介质中通过光谱法进行了检查。df-cur表现出以500nm为中心的尖锐和强吸收带,如图1b所示。添加5.0当量的cu2+导致最大吸收显著减少和55nm蓝移(从500nm到445nm),同时吸收带从250nm到410nm略有增加。与此形成鲜明对比的是,在用其他金属离子处理后,没有观察到吸收光谱的明显变化,这意味着df-cur具有对cu2+的选择性识别。在相同条件下,游离df-cur在470nm激发时在600nm处显示出强荧光发射带,如图1c所示,几乎可以被cu2+完全淬灭(600nm处的淬灭效率:99%);另一方面,添加其他金属离子,df-cur发射强度的变化可忽略不计,进一步证实了df-cur对cu2+的选择性识别。df-cur识别cu2+的能力通过在相同介质中的光谱滴定来检测。df-cur在600nm处的最大荧光发射随着cu2+的持续添加而逐渐降低,达到拐点并且当添加2.0当量cu2+时发射开始达到平稳状态,如图2所示。这些结果表明形成了2:1(金属:配体)络合物和配位饱和。4、跟踪活细胞中cu2+和df-cur之间的动态相互作用。将mcf-7细胞(人乳腺癌细胞)接种在10毫米玻璃底培养皿中,并与df-cur(100nm)于37℃孵育30分钟。在5%co2培养箱中,将细胞用磷酸盐缓冲盐水(pbs)洗涤3次,然后分别与cu2+(100nm)孵育30分钟,再用pbs洗涤3次,并通过共聚焦荧光显微镜(olympusfv1200,日本)进行成像,实验结果见图3。如图3所示,mcf-7细胞与df-cur(100nm)孵育30分钟,然后使用激光扫描共聚焦荧光显微镜成像。结果显示直接用df-cur染色的细胞显示出强烈的细胞内红色荧光(图3a-c)。然而,再将有df-cur的细胞与cu2+进一步孵育30分钟后,在细胞内区域几乎没有观察到荧光(图3d-f)。结果表明df-cur能够检测活细胞中的cu2+。5、流式细胞仪分析mv4-11(人类骨髓单核细胞白血病)细胞以每孔2×105个细胞的形式接种在6孔板中。孵育24小时后,移出原始培养基,并用含有梯度浓度的cu2+(0.1μm、0.2μm、0.4μm)的新鲜培养基替换,并孵育30分钟。接下来,添加0.1nmdf-cur,再孵育30分钟。最后,立即通过流式细胞术分析了mv4-11细胞的荧光强度和数量,实验结果见图4。本次研究采用流式细胞仪对df-cur进行评价,实现血细胞中铜离子含量的定量分析。在用cu2+和探针df-cur处理mv4-11白血病细胞后,通过流式细胞术分析这些细胞的荧光强度和数量。由图4a和b可知,细胞的荧光强度随着cu2+浓度的增加呈剂量依赖性降低,表明df-cur可用于细胞中铜离子的快速和特异性定量分析。6、跟踪活斑马鱼中cu2+和df-cur之间的动态相互作用。斑马鱼在完全封闭的循环系统中饲养。斑马鱼屋中的明暗比为14h/10h,室内温度为26℃,水温为28℃,ph为7.2至7.5,电导率为500至550μs/cm,其各种3天大的斑马鱼在df-cur(100nm)中培养30分钟;水质指标符合要求。斑马鱼再用cu2+(100nm)处理30分钟。然后,将这些斑马鱼转移到新的共焦平板中,使用共聚焦荧光显微镜(日本olympusfv1200)进行成像,实验结果见图5。如图5所示,斑马鱼与df-cur(100nm)一起孵育,导致强烈的红色荧光(图5a-f)。随后,当载有df-cur的斑马鱼进一步用cu2+处理时,头部、胸部和尾部区域的荧光几乎完全淬灭,这与体外的基本发现一致。这些结果表明df-cur可适用于体内cu2+的荧光成像。7、血清、尿液和胆汁铜浓度的测定昆明小鼠随机分为两组(每组n=24只小鼠)。两组均接受i.p.以7.5mg·kg-1的剂量注射cu2+(溶于纯水)建立铜中毒模型。一组小鼠口服5%二甲基亚砜(dmso)、15%聚乙二醇(peg)和80%h2o溶剂,另一组口服60mg·kg-1df-cur溶解在相同溶剂中。每组3只小鼠在0、0.5、1、2、4、8、16和24小时收集胆汁、尿液和血清,并储存在-20℃以备后续分析。使用icp-ms(perkinelmernexion350x)测定血清,尿液和胆汁中铜的浓度。在消化池中准确称取0.20g血清样品,然后向消化池中加入5ml硝酸和2ml30%h2o2,并充分混合。在120℃下预消化30分钟后,将消解罐上的密封盖放入微波消解仪中开始消解。消化完成后,将液体倒入烧杯中,然后将其放在电热板上。将温度升高至140℃以除去酸。溶液冲至约0.5ml终止酸。冷却至室温后,转移到25ml容量瓶中,并用2%硝酸充分冲洗烧杯的内壁,将其合并到容量瓶中,加入内标元素ge(50ppb),最后稀释至25毫升。在离心管中准确称量尿液和胆汁样品,加入稀释剂(0.5%硝酸,0.05%tritonx-100、2%甲醇),内标元素ge(50ppb),充分混合,然后将尿液样品稀释至10ml,胆汁样品的体积设置为5ml。本实验采用内标法,以锗为内标元素,可以消除基质干扰和浓度相乘引起的干扰,使实验结果更加准确。铜的检测极限是连续注入空白溶液11次,然后将空白溶液标准偏差的3倍除以线性相关系数。在该方法的精密度实验中,选择连续6次进样的样品,并通过标准偏差与算术平均值的比值获得rsd(相对标准偏差)值。通过这种方法检测到的铜元素的rsd值在0.47%至1.99%之间。该方法的精度较高。这很好。表明该方法的准确性是通过将样品分为两部分来确定的,一部分与预处理相同,另一部分在此基础上添加20ppb标准铜元素,在相同条件下进行处理和测量。铜的标准回收率为91%~127%,表明该方法准确可靠。在该方法的稳定性测试中,分别在30分钟,60分钟和120分钟时选择一个样品,然后通过相同的方法进样并进行分析。rsd值在1.55%和2.88%之间,表明该方法具有良好的稳定性。实验结果见图6所示,cu2++df-cur处理小鼠血清铜含量在各时间点均显着低于cu2+组,cu2++df-cur处理的小鼠胆汁和尿液中铜含量在各时间点均显着高于cu2+组。因此,这些结果表明df-cur可以促进尿液和胆汁对铜离子的排泄。8、铜中毒小鼠模型的建立与治疗从成都中医药大学动物中心购买六周大的雌性km(昆明)小鼠,并在无菌环境中饲养,并随意喂养标准饮食。根据美国国家卫生研究院《实验动物的护理和使用指南》对动物进行护理。该方案已由成都中医药大学机构动物护理和使用委员会批准。适应一周后,将小鼠随机分为五组(每组n=6只小鼠):第一组:对照小鼠,连续30天接受腹腔注射纯水并口服含有5%二甲基亚砜(dmso)、15%聚乙二醇(peg)和80%h2o的溶剂。第二组:模型组小鼠,连续30天给小鼠腹腔内注射溶于纯水的cu2+(7.5mg·kg-1)并且口服含有5%二甲基亚砜(dmso)、15%聚乙二醇(peg)和80%h2o的溶剂。第三组-第五组:腹腔注射剂量为7.5mg·kg-1的cu2+,然后分别口服60mg·kg-1·d-1df-cur、30mg·kg-1·d-1df-cur、15mg·kg-1·d-1df-cur。每3天测量一次体重。每天两次连续30天每天一次给予df-cur治疗,以引起累积的铜毒性并评估df-cur的保护作用。在治疗期结束时,处死动物,并收集血液和组织样品用于下游分析。打开小鼠的腹腔,立即收集肝脏和肾脏,并在冷的生理盐水中洗涤,把收集的肝脏和肾脏进行he染色,观察df-cur是否会造成脏器病理损伤。(1)组织固定:取甲醛溶液10ml溶于90ml0.1mpbs中,把取好的裸鼠各脏器组织浸泡在10%缓冲甲醛溶液中固定24h。(2)组织脱水:将固定好的脏器组织用由低到高梯度浓度乙醇溶液进行组织脱水,75%乙醇→85%乙醇→95%乙醇→100%乙醇→100%乙醇浸泡各1h→浸入二甲苯中使组织透明,浸润2次,各40min→浸入65℃融化后的石蜡中,浸蜡3次,每次1h→取出组织做石蜡包埋。(3)组织切片:将包埋好的组织用leka石蜡切片机切片,切片厚度为3μm。(4)烘烤组织切片:将切好的石蜡切片放入65℃烤箱烘烤3h。(5)组织脱腊:将切好的石蜡切片浸泡在二甲苯里脱蜡2次,每次10min→再以由高到低梯度浓度乙醇脱腊,100%乙醇→100%乙醇→95%乙醇→80%乙醇→70%乙醇浸润各1min。(6)染色:将脱腊后的切片用自来水冲洗干净,放入苏木素染色液中染色10min,将苏木素染色液用自来水冲洗干净后,放入2%盐酸酒精溶液中浸润分色30s,自来水冲洗,返蓝15min。用1%伊红染色液染色2min,用自来水冲洗净伊红染色液。(7)切片脱水透明:将切片在由低到高梯度浓度乙醇中脱水,70%乙醇→80%乙醇→90%乙醇→100%乙醇→100%乙醇浸润各5min→于二甲苯中浸入透明,浸润两次,每次5min。(8)封片:将脱水透明后的切片于37℃干燥箱烘干,滴加中性树胶封片。从图7a可以看出,给药过程中各组小鼠体重的变化,df-cur在15、30和60mg·kg-1剂量下均能显著逆转cu2+所致的体重下降。从图7b可以看出df-cur能显著抑制cu2+诱导的肝、肾器官系数的增加。从图7c可以看出,cu2+处理可导致许多肝、肾细胞固缩、肌浆浓缩,肝细胞、肾上皮细胞浑浊肿胀、微泡病变,肝门、小叶、肾小球炎性细胞散在浸润,组织中巨噬细胞增多,肾腔为蛋白管型,少量红细胞型,肾间质大面积水肿,间质局灶性炎症,df-cur处理后的小鼠肾脏和肝脏均呈现更少量的肝、肾细胞固缩和炎性细胞分布,说明df-cur对cu2+造成的肝肾毒性具有一定的缓解作用。9、血清生化价值分析从上述步骤8中动物的眼眶窦收集血样,并在室温下孵育1小时以使其凝结。然后以8000r/min的速度离心5分钟收集血清,并保存在-20℃下。血清丙氨酸氨基转移酶(alt),天门冬氨酸氨基转移酶(ast),血尿素氮(bun),总胆红素(tbil),乳酸脱氢酶(ldh),低密度脂蛋白栗(ldl-c),直接胆红素(d-bil),葡萄糖(glu),肌酐(crea),甲状腺球蛋白(tg),钙(ca),磷(p),总胆固醇(cho1),钾(k),总蛋白(tp),白蛋白(alb),碱性磷酸酶(akp),肌酸激酶(ck)使用siemens-advia1800自动干化学分析仪进行测定,测定结果见表1。表1df-cur和cu2+对血清酶和生化成分的影响controlmodeldf-cur60mg/kgalt(u/l)37.42±4.72***84.91±29.64###44.69±12.45**#ast(u/l)106.3±12.5***269.94±10.42##121.13±28.63**#tp(g/l)59.54±3.66**47.99±6.54##58.93±4.91**alb(g/l)44.03±2.3**31.61±5.39##42.93±4.27**tbil(umol/ml)1.59±0.83***3.74±1.42###1.34±0.72***d-bil(umol/ml)0.21±0.12***0.70±0.13###0.21±0.08***akp(u/l)123.7±31.9***67.43±20.50###116.00±22.0***glu(mmol/ml)6.91±1.326.40±1.306.58±1.40bun(mmol/ml)7.94±0.78***16.46±6.74###7.85±1.14***crea(umol/ml)5.22±3.80***13.00±4.76###7.56±6.17**ck(u/l)989.3±133.5**221.04±69.04##400.0±112.1**#ldh(u/l)519.3±104.9**1524±295.57###643.6±201.6***#ldl-c(mmol/ml)0.26±0.11**0.55±0.17##0.31±0.17*k(mmol/ml)10.87±0.9911.67±2.2610.80±1.55*表示p<0.05,代表与模型组有显著差异。#表示p<0.05,代表与对照组的显著差异。**表示p<0.01,代表与模型组有明显显著差异。##表示p<0.01,代表与对照组的明显显著差异。***表示p<0.001,代表与模型组有极其明显显著差异。###表示p<0.01,代表与对照组的极其明显显著差异。通过生化分析检测每只小鼠的血清标记酶和生化成分。如表1所示,cu2+组血清丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、血尿素氮(bun)、肌酐(crea)含量显着高于对照组(p<0.05)。alt和ast通常分布在肝细胞的细胞质或线粒体中。当肝脏结构严重受损时,alt和ast被释放到循环系统中,导致血清中alt和ast活性升高。血清bun是人类蛋白质代谢的主要最终产物,并通过肾脏排泄。然而,当肾脏受损时,bun无法从体内排出并积聚在血液中通过生化分析检测每只小鼠的血清标记酶和生化成分。cu2+组血清丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、血尿素氮(bun)、肌酐(crea)含量显着高于对照组(p<0.05)。我们的研究结果表明,铜离子组肌酐含量显着升高,这可能是由于铜含量高导致肾脏排泄功能受损,以及蛋白质代谢物和其他物质代谢物在肾脏中的积累。df-cur处理显着降低(p<0.01)这些血清酶和生化成分的浓度。这些结果表明df-cur的干预和治疗减少了铜暴露引起的肝肾损伤。试验例2、帕金森氏病(pd)试验1.材料1.1实验动物雄性c57bl/6小鼠,10周龄,22~26g体重,由成都达硕实验动物有限公司提供。小鼠每笼5只,室温22~25℃,12小时昼夜节律,自由进食和饮水。1.2主要试剂mptp盐酸盐(帕金森氏病造模试剂)购自beyotime公司;二甲基亚砜(dmso)购自美国sigma-aldrich公司;盐酸苄丝肼、左旋多巴poly(ethyleneglycol)400购自美国sigma-aldrich公司;蛋白酶抑制剂购自美国sigma-aldrich公司;ripa裂解液(强)购自碧云天生物技术有限公司;高蛋白脱脂高钙奶粉购自杜尔伯特伊利乳业有限责任公司;化学发光底物购自abbkine公司;30%acr-bis(29:1)购自碧云天生物技术有限公司;双色预染蛋白marker购自上海雅酶生物科技有限公司,三羟甲基氨基甲烷(tris-base)、甘氨酸(glycine)购自gentihold公司;sds购自bioshar公司;小鼠抗β-actin购自北京中彬金桥生物技术有限公司;山羊抗小鼠lgg/辣根酶标记购自北京中彬金桥生物技术有限公司;山羊抗兔lgg/辣根酶标记购自北京中彬金桥生物技术有限公司;过硫酸铵(aps)购自美国sigma-aldrich公司。1.3仪器设备ja2003b电子天平,购自上海越平科学仪器有限公司;powerpacbasi通用型电泳仪,购自bio-rad公司;miniproteantetracell型转印槽,购自bio-rad公司;tdz5-w5型台式低速离心机,购自cence湘仪公司;hve-50型高压蒸汽灭菌锅,购自日本hirayama公司;f3ca69756型milli-q纯水仪,购自millipore公司;x30r型高速冷冻离心机,购自beckmancoulter公司;微量移液器,购自德国eppendorf公司;sk-r1808-e型摇床,购自scilogex公司;mdf-382e型超低温冰箱,购自日本sanyo公司;液氮罐,购自thermo公司;130358型超声波细胞粉碎机,购自宁波新芝生物科技有限公司;300037型制冰机,购自panasonic公司;hh-2型数显恒温水浴锅,购自国华电器有限公司;sb-50d型超声波清洗机,购自宁波新芝生物科技有限公司;微型离心机,购自德国eppendorf公司;离心管(批号430790,430828),购自corning公司;冻存管(批号375418),购自thermo公司;小鼠转棒疲劳测试仪,购自安徽正华生物科技有限公司,货号zh-300b。1.4有关溶液的配制(1)姜黄素二氟硼(df-cur)溶液配制:称取120mgdf-cur,用1mldmso溶解,配为浓度120mg/ml的母液备用,用时取75μl母液加600μlpeg,最后用生理盐水定容至1.5ml,配成60mg/kg剂量组;(2)mptp溶液配制:称取mptp15mg,加生理盐水5ml溶解,现配现用。2.方法2.1mptp造模采用mptp亚急性造模方法,给c57bl/6j小鼠每日固定时间(9:00am)腹腔注射(ip)mptp30mg/kg,每天一次,连续5天。2.2分组(1)对照组:腹腔注射生理盐水+灌胃(ig)生理盐水;(2)模型组:腹腔注射mptp30mg/kg+灌胃生理盐水;(3)df-cur高剂量组:腹腔注射mptp30mg/kg+灌胃df-cur60mg/kg;(4)美多巴组:腹腔注射mptp30mg/kg+灌胃美多巴50mg/kg。2.3给药方法在实验期间,df-cur处理组小鼠灌胃df-cur,美多巴组小鼠灌胃美多巴,每天一次,连续14天后进行神经行为学观察。2.4.神经行为学观察方法因神经行为学观察对实验动物的运动能力及观察者技能要求较高,故实验前应对小鼠进行筛选、训练,观察者熟悉方法后,进行正式实验,具体筛选条件和训练方法见以下介绍:一般情况观察包括体重、给药后数小时内的急性反应等,神经行为学指标观察时间点为造模前1天、造模结束后第1天、第3天、第5天、第7天、第14天,观察者在不知道分组的情况下对各指标进行客观评价与记录,结果见图8。2.4.1转棒实验自动旋转仪用于评价所描述的肌肉协调能力。它有一个旋转杆(直径75毫米),并且被划分成六个允许同时测试六只老鼠的间隔。当老鼠从转轴上掉下时仪器在0.1秒内自动记录时间。旋转杆转速设置为25r/min,截止时间为180s。在实验开始前所有组的动物都先在旋转杆上训练直到学会为止。然后损伤1周后,各组动物再次在旋转杆上测试(三次)。2.5统计学检验数据采用均数土标准差(x±sd)表示,应用spss16.0统计软件进行单因素方差分析(one-wayanova),两组间比较采用显著性检验,图8中,*表示p<0.05,代表与模型组有显著差异。3.实验结果3.1.df-cur对pd小鼠行为学的影响3.1.1转棒实验结果从图8可以看出,从左到右依次是造模后损伤1周后,各组动物依次在旋转杆上测试(平行三次实验)。与空白组相比,模型组肌肉协调能力明显下降,另外,df-cur60mg/kg剂量组以及美多巴组小鼠运动协调能力相比模型组均有恢复。试验例3、阿尔茨海默病(ad)试验材料与方法1.材料1.1实验动物雄性c57bl/6小鼠,10周龄,22~26g体重,由成都达硕实验动物有限公司提供。小鼠每笼5只,室温22~25℃,12小时昼夜节律,自由进食和饮水。1.2主要试剂表2主要试剂1.3仪器设备表3仪器设备2.方法2.1学习、记忆能力观察采用morris水迷宫实验。各组给药后先进行连续4d的morris水迷宫实验,每只小鼠每次训练120s,每天训练2次;在训练过程中,若小鼠入水后找到并爬到站台,则让小鼠在平台上停留30s;若入水后2min内小鼠未能找到或爬上站台,则将其引导至站台上并站立30s;平台停留后将小鼠取下休息,记录各组小鼠2min内初次到达平台的时间即潜伏期。实验第5天进行空间探索实验,去掉水中平台,记录小鼠2min内的潜伏期、穿越平台次数、目标象限停留时间。2.2ad药效实验和作用机制研究模型建立及药效实验:d-半乳糖致ad模型在老化型研究中最为常用,能表现出接近自然老化的生理特点与细胞学特性。实验简明流程见图9。实验分为空白组,m为d-半乳糖模型组,y为喜得镇阳性组(0.9mg/kg),60mg/kgdf-cur组,共4组60只。空白、模型两组灌胃给予相应体积的5/1000cmc-na水溶液,y、df-cur组灌胃给予相应体积的相应药物(溶于5/1000cmc-na水溶液),1天1次连续给药40天。给药1小时后,空白组于颈背部皮下注射相应体积的生理盐水,其余组别于颈背部皮下注射给予对应体积的d-半乳糖生理盐水溶液,给药剂量500mg/kg,给药体积为10ml/kg,1天1次。通过行为学实验分析化合物对d-半乳糖致ad小鼠学习记忆功能的影响:①水迷宫实验定向航行测试:于给药第31天开始,每天一次,持续5d。将小鼠面朝桶壁缓慢从平台所在象限相对象限放入,记录其从入水到找到平台的时间,为逃避潜伏期。如果小鼠1min中内未找到平台,须人为引导其至平台,停留5s~15s,逃避潜伏期记录为60s。如果小鼠1min中内找到平台,系统自动记录其逃避潜伏期。3.实验结果df-cur对d-半乳糖致ad模型小鼠学习记忆功能的影响3.1水迷宫实验在定向巡航实验中,由图10可知,与空白组相比,经过五天的训练,模型组的逃避潜伏期均较长且变化不明显,而空白组的逃避潜伏期呈缩短趋势,其中第5天(p<0.001)统计学差异明显,提示造模成功。与模型组相比,第1天、第2天、第3天逃避潜伏期均不具有统计学差异(p>0.05);第4天df-cur组逃避潜伏期(p<0.01)具有统计学差异;第5天df-cur组逃避潜伏期(p<0.01)具有统计学差异。因此,df-cur能改善d-半乳糖致ad模型的学习记忆功能。3.2分离海马和皮层后剩余脑组织的t-sod和mda测定根据sod、mda检测试剂盒说明书测定脑组织中sod、mda水平。由表4可知,与空白组相比,模型组sod活力较低,mda含量较高,具有统计学差异(p<0.01),提示造模成功。与模型组相比,df-cur组的sod的活力较高,具有统计学差异(p<0.01),mda的含量较低,具有统计学差异(p<0.05)。综合可知,df-cur能改善d-半乳糖致ad模型的抗氧化能力。表4t-sod和mda试剂盒实验结果组别数量(只)sod含量(u/mg)mda含量(nmol/ml)control8305.26±56.35**13.24±4.58**model8189.48±36.2622.59±7.59y8235.63±76.9618.91±5.13df-cur8324.25±26.47**14.09±1.96*通过对水迷宫实验的结果分析,df-cur能一定程度上改善d-半乳糖致ad模型的学习记忆能力。通过对分离海马和皮层后剩余脑组织的t-sod和mda试剂盒测定结果分析,提示df-cur能提高d-半乳糖致ad模型小鼠的抗氧化能力。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1