奥美卡替莫卡必尔片剂的制作方法
奥美卡替莫卡必尔片剂
1.发明背景
2.奥美卡替莫卡必尔(omecamtiv mecarbil)(om)是一种心肌肌球蛋白激活剂,其直接针对心肌细胞的收缩机制,旨在提高患有心血管病症(例如心力衰竭)的患者的心肌收缩效率。om目前处于3期临床试验阶段。为成年患者开发了一种尺寸为14.4mm x 8.4mm用于口服施用的om的调释(modified-release)(mr)片剂(参见国际专利申请公开wo2014/152236a1),以降低最大血浆浓度(c
max
)并安全地为患者提供有效量的om。然而,为了确保患者依从性,需要易于吞咽和施用并适用于某些患者群体,例如儿科患者(例如6-18岁)和吞咽困难的成年患者的om制剂。
技术实现要素:
3.本文提供了片剂制剂,其包含含有奥美卡替莫卡必尔、其药学上可接受的盐或其药学上可接受的盐的药学上可接受的水合物;填充剂;粘合剂;助流剂和润滑剂的片芯;以及在片芯上的薄膜包衣,该薄膜包衣包含调释聚合物和成孔剂。
4.本文还提供了制备所公开的片剂制剂和使用所公开的片剂制剂来治疗患有心血管疾病例如心力衰竭的患者的方法。
5.附图简要说明
6.图1显示了奥美卡替莫卡必尔二盐酸盐一水合物调释片剂在ph 6.8磷酸盐缓冲液中的溶出概况。
7.图2显示了奥美卡替莫卡必尔二盐酸盐一水合物1mg常释(immediate-release)微型片剂片芯的制造流程图。
8.图3显示了奥美卡替莫卡必尔颗粒的
19
f固态核磁共振(ssnmr)光谱的叠加。
9.图4显示了奥美卡替莫卡必尔常释微型片剂片芯的
19
f ssnmr光谱的叠加。
10.图5显示了奥美卡替莫卡必尔二盐酸盐一水合物1mg常释微型片剂片芯的调释包衣的制造流程图。
11.图6显示了包覆有70∶30 ca∶peg至10%包衣增重的奥美卡替莫卡必尔二盐酸盐一水合物1mg调释微型片剂(n=3)在ph 6.8缓冲液中的溶出概况。
12.图7显示了包覆有70∶30 ca∶peg至15%包衣增重的奥美卡替莫卡必尔二盐酸盐一水合物1mg调释微型片剂(n=3)在ph 6.8缓冲液中的溶出概况。
13.图8显示了包覆有70∶30 ca∶peg至20%包衣增重的奥美卡替莫卡必尔二盐酸盐一水合物1mg调释微型片剂(n=3)在ph 6.8缓冲液中的溶出概况。
14.图9显示了包覆有70∶30 ca∶peg或50∶50 ca∶peg至10%包衣增重的奥美卡替莫卡必尔二盐酸盐一水合物1mg调释微型片剂(n=3)在ph 6.8缓冲液中的溶出概况。
15.图10显示了奥美卡替莫卡必尔二盐酸盐一水合物1mg常释微型片剂片芯的调释包衣的制造流程图。
16.图11显示了不同批次之间奥美卡替莫卡必尔二盐酸盐一水合物1mg调释微型片剂(n=6)的溶出概况的比较(usp ii,50mm ph 6.8磷酸盐缓冲液,500ml,75rpm,37℃)。
17.图12显示了奥美卡替莫卡必尔二盐酸盐一水合物1mg调释微型片剂(n=6)在25℃/60%rh下储存一个月的溶出概况的比较(usp ii,50mm ph 6.8磷酸盐缓冲液,500ml,75rpm,37℃)。
18.图13显示了奥美卡替莫卡必尔二盐酸盐一水合物的晶型a的x射线粉末衍射图(xrpd)。
19.图14显示了奥美卡替莫卡必尔从公开的片剂制剂中的释放概况。
20.图15a显示了奥美卡替莫卡必尔微型片剂制剂(25x1mg)在168小时内的血浆浓度概况(算术平均值)(线性刻度)。
21.图15b显示了奥美卡替莫卡必尔微型片剂制剂(25x1mg)在168小时内的血浆浓度概况(算术平均值)(半对数刻度)。
22.图16a显示了奥美卡替莫卡必尔微型片剂制剂(25x1mg)在72小时内的血浆浓度概况(算术平均值)(线性刻度)。
23.图16b显示了奥美卡替莫卡必尔微型片剂制剂(25x1mg)在72小时内的血浆浓度概况(算术平均值)(半对数刻度)。
24.发明详述
25.在本文公开的制剂之前,研究了许多常规制剂以努力获得适用于儿科患者(例如,6-18岁或6-12岁)或吞咽困难的成年患者的奥美卡替莫卡必尔制剂。例如,评估了尺寸减小的片剂。然而,如图1所示,简单地将包含奥美卡替莫卡必尔二盐酸盐一水合物的调释(mr)片剂的物理尺寸和剂量减少一半会导致奥美卡替莫卡必尔的溶出速率显著的不希望的增加,这可能会导致不希望的更高c
max
。较高的c
max
可能导致不良事件增加。
26.用于儿科患者或吞咽困难的成人的片剂制剂应表现出有助于患者依从性(例如可吞咽性)的物理特性(例如形状和大小)并表现出合适的药代动力学性能(例如合适的c
max
和可重现的释放速率)。片剂的理想属性包括但不限于以下一种或多种:具有圆形和双凸形状的片芯;直径和高度小于3mm;约12.5mg重量;1-3mg奥美卡替莫卡必尔的剂量强度,其中从片芯释放与ph无关,且100%的奥美卡替莫卡必尔在60分钟内释放。mr包衣可以提供与ph值无关的释放速率,并且可以根据包衣的性质进行调节。
27.本文提供了包含片芯的片剂制剂,片芯上具有薄膜包衣,其中该薄膜包衣包含调释聚合物和成孔剂。该片芯包含奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物,并且未包衣的片芯提供了奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物的常释。片芯包括颗粒内和颗粒外组分。颗粒内组分包括以奥美卡替莫卡必尔、其药学上可接受的盐或其药学上可接受的盐的药学上可接受的水合物为活性成分、一种或多种填充剂和一种或多种粘合剂。颗粒外组分包括一种或多种助流剂和一种或多种润滑剂。可以使用本文所述的合适方法将颗粒内和颗粒外组分形成片芯。然后可以使用合适的方法用薄膜包衣对片芯进行包覆以提供所公开的片剂制剂。
28.所公开的片剂制剂的片芯包含奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物;填充剂;粘合剂;助流剂;和润滑剂。所公开的片剂制剂的片芯上的薄膜包衣包含调释聚合物(有时称为控释剂)和成孔剂。在一些实施方案中,对于本文公开的任何组分量,所述组分的规定量或重量百分比可以变化
±
5%。
29.在一些实施方案中,片剂制剂具有适合预期患者群体(例如儿科患者)的形式或尺寸。因此,该片剂制剂可具有5mm或更小,例如4.5mm或更小、4mm或更小、或3.5mm或更小的直径。可选择地或另外,该片剂制剂可具有0.5mm或更大,例如1mm或更大、1.5mm或更大、2mm或更大、2.5mm或更大、或3mm或更大的直径。因此,该片剂制剂可以具有由任何上述端点限定的直径。例如,该片剂制剂可以具有0.5-5mm、1-4.5mm、1.5-4mm、2-3.5mm或2.5-3mm的直径。
30.在一些实施方案中,该片剂制剂具有高达3mm(例如,0.5mm、1mm、1.5mm、2mm、2.5mm或3mm)的直径。
31.本文公开的制剂可提供奥美卡替莫卡必尔的理想释放概况。可以使用任何合适的方法确定制剂的释放或溶出概况。一种说明性方法是使用以下参数的美国药典(usp)ii方法:仪器为usp《711》仪器ii(paddle);容器尺寸/类型为1000ml透明玻璃,圆底;转速为75rpm;培养基体积为500ml;测试温度为37.0
±
0.5℃;溶出介质为磷酸盐缓冲液(ph 6.8);并且采样时间点为1、2、3、4、6、8、12、16和24小时。使用高效液相色谱法(hplc)使用以下条件分析测试溶液:泵为等度的;反相柱(例如x-bridge,150x3mm(id),c18,3.5μm粒径,可由waters购得);uv检测(235nm);进样量75μl;流速0.5ml/min;柱温30℃;自动进样器温度为环境温度;并且运行时间为6分钟。
32.在一些实施方案中,该片剂制剂在1小时内释放高达50%的奥美卡替莫卡必尔,例如,在1小时内释放高达45%、高达40%、高达35%、高达30%、高达25%、高达20%、高达15%,或高达10%的奥美卡替莫卡必尔。在一些实施方案中,该片剂制剂在1小时内释放5-10%的奥美卡替莫卡必尔,例如,在1小时内释放7%的奥美卡替莫卡必尔。在一些实施方案中,该片剂制剂在1小时内释放15-25%的奥美卡替莫卡必尔,例如,在1小时内释放20%的奥美卡替莫卡必尔。在一些实施方案中,该片剂制剂在1小时内释放35-45%的奥美卡替莫卡必尔,例如,在1小时内释放41%的奥美卡替莫卡必尔。
33.在一些实施方案中,该片剂制剂在2小时内释放高达70%的奥美卡替莫卡必尔,例如,在2小时内释放高达65%、高达60%、高达55%、高达50%、高达45%、高达40%、高达35%,或高达30%的奥美卡替莫卡必尔。在一些实施方案中,该片剂制剂在2小时内释放25-35%的奥美卡替莫卡必尔,例如,在2小时内释放28%的奥美卡替莫卡必尔。在一些实施方案中,该片剂制剂在2小时内释放35-45%的奥美卡替莫卡必尔,例如,在2小时内释放40%的奥美卡替莫卡必尔。在一些实施方案中,该片剂制剂在2小时内释放60-70%的奥美卡替莫卡必尔,例如,在2小时内释放66%的奥美卡替莫卡必尔。
34.在一些实施方案中,该片剂制剂在8小时内释放高达90%的奥美卡替莫卡必尔,例如,在8小时内释放高达85%、高达80%,或高达75%的奥美卡替莫卡必尔。在一些实施方案中,该片剂制剂在8小时内释放70-75%的奥美卡替莫卡必尔,例如,在8小时内释放72%的奥美卡替莫卡必尔。在一些实施方案中,该片剂制剂在8小时内释放75-80%的奥美卡替莫卡必尔,例如,在8小时内释放77%的奥美卡替莫卡必尔。在一些实施方案中,该片剂制剂在8小时内释放85-90%的奥美卡替莫卡必尔,例如,在8小时内释放87%的奥美卡替莫卡必尔。
35.在一些实施方案中,该片剂制剂在16小时内释放高达95%的奥美卡替莫卡必尔,例如,在16小时内释放高达90%、高达85%,或高达80%的奥美卡替莫卡必尔。在一些实施方案中,该片剂制剂在16小时内释放78-83%的奥美卡替莫卡必尔,例如,在16小时内释放
81%的奥美卡替莫卡必尔。在一些实施方案中,该片剂制剂在16小时内释放85-90%的奥美卡替莫卡必尔,例如,在16小时内释放86%的奥美卡替莫卡必尔。在一些实施方案中,该片剂制剂在16小时内释放90-95%的奥美卡替莫卡必尔,例如,在16小时内释放93%的奥美卡替莫卡必尔。
36.在一些实施方案中,该片剂制剂提供了在1小时内释放小于或等于50%的奥美卡替莫卡必尔;在2小时内释放60-70%的奥美卡替莫卡必尔;在8小时内释放85-90%的奥美卡替莫卡必尔;以及在16小时内释放大于或等于90%的奥美卡替莫卡必尔的奥美卡替莫卡必尔释放概况。
37.在一些实施方案中,该片剂制剂提供了在1小时内释放小于或等于25%的奥美卡替莫卡必尔;在2小时内释放35-45%的奥美卡替莫卡必尔;在8小时内释放75-80%的奥美卡替莫卡必尔;以及在16小时内释放大于或等于85%的奥美卡替莫卡必尔的奥美卡替莫卡必尔释放概况。
38.在一些实施方案中,该片剂制剂提供了在1小时内释放小于或等于10%的奥美卡替莫卡必尔;在2小时内释放25-35%的奥美卡替莫卡必尔;在8小时内释放70-75%的奥美卡替莫卡必尔;以及在16小时内释放大于或等于78%的奥美卡替莫卡必尔的奥美卡替莫卡必尔释放概况。
39.该片剂制剂在施用于患者后提供了合适的奥美卡替莫卡必尔的c
max
。在一些实施方案中,该片剂制剂在施用于患者后提供了100ng/ml或更大的奥美卡替莫卡必尔的c
max
,例如在施用于患者后提供了125ng/ml或更大、150ng/ml或更大、175ng/ml或更大、200ng/ml或更大、225ng/ml或更大、250ng/ml或更大、275ng/ml或更大、300ng/ml或更大、325ng/ml或更大、350ng/ml或更大、375ng/ml或更大、400ng/ml或更大、425ng/ml或更大、450ng/ml或更大、475ng/ml或更大、或者500ng/ml或更大的奥美卡替莫卡必尔的c
max
。可选择地或另外,该片剂制剂在施用于患者后提供了1000ng/ml或更小的奥美卡替莫卡必尔的c
max
,例如在施用于患者后提供了975ng/ml或更小、950ng/ml或更小、925ng/ml或更小、900ng/ml或更小、875ng/ml或更小、850ng/ml或更小、825ng/ml或更小、800ng/ml或更小、775ng/ml或更小、750ng/ml或更小、725ng/ml或更小、700ng/ml或更小、675ng/ml或更小、650ng/ml或更小、625ng/ml或更小、600ng/ml或更小、575ng/ml或更小、550ng/ml或更小、或者525ng/ml或更小的奥美卡替莫卡必尔的c
max
。
40.因此,该片剂制剂可以为患者提供由上述端点中的任何两个限定的奥美卡替莫卡必尔的c
max
。例如,该片剂制剂在施用于患者后可以提供100-1000ng/ml、125-975ng/ml、150-950ng/ml、175-925ng/ml、200-900ng/ml、225-875ng/ml、250-850ng/ml、275-825ng/ml、300-800ng/ml、325-775ng/ml、350-750ng/ml、375-725ng/ml、400-700ng/ml、425-675ng/ml、450-650ng/ml、475-625ng/ml、500-600ng/ml的奥美卡替莫卡必尔的c
max
,或者525-575ng/ml的奥美卡替莫卡必尔的c
max
。
41.在一些实施方案中,该片剂制剂在施用于患者后提供100-1000ng/ml或300-1000ng/ml的奥美卡替莫卡必尔的c
max
。
42.奥美卡替莫卡必尔
43.奥美卡替莫卡必尔(amg 423,ck-1827452)具有下列结构:
[0044][0045]
(参见,例如,国际专利申请公开wo2014/152236a1,第[0005]段)
[0046]
在所公开的制剂中使用的奥美卡替莫卡必尔可以作为奥美卡替莫卡必尔游离碱或药学上可接受的盐或其药学上可接受的盐的水合物存在。
[0047]“药学上可接受的盐”包括但不限于(1)酸加成盐,(a)与无机酸形成的盐,例如盐酸盐(即氢氯化物)、磷酸盐、二磷酸盐、氢溴酸盐、硫酸盐、亚磺酸盐、硝酸盐以及类似的盐;或(b)与有机酸形成的盐,例如苹果酸盐、马来酸盐、富马酸盐、酒石酸盐、琥珀酸盐、柠檬酸盐、乙酸盐、乳酸盐、甲磺酸盐、对甲苯磺酸盐、2-羟乙基磺酸盐、苯甲酸盐、水杨酸盐、硬脂酸盐和链烷酸盐,例如乙酸盐、hooc
‑‑
(ch2)n‑‑
cooh(其中n为0-4),以及类似的盐;和(2)当奥美卡替莫卡必尔的酸性质子被药学上可接受的阳离子(包括但不限于钠、钾、钙、铝、锂和铵)取代时形成的盐。本领域技术人员将认识到可用于制备无毒药学上可接受的加成盐的各种合成方法。
[0048]
在一些情况下,片剂制剂包含奥美卡替莫卡必尔。在一个实施方案中,该片剂制剂包含奥美卡替莫卡必尔二盐酸盐。在另一个实施方案中,该片剂制剂包含奥美卡替莫卡必尔二盐酸盐一水合物。在又一个实施方案中,该片剂制剂包含奥美卡替莫卡必尔二盐酸盐一水合物晶型a,如国际专利申请公开号wo2014/152270a1中所公开的。
[0049]
晶型a可以通过x射线粉末衍射(xrpd)图表征,如wo2014/152270a1中所述获得,使用cu kα辐射在6.6、14.9、20.1、21.4和26.8
±
0.2
°
2θ处具有峰。晶型a任选地可通过xrpd图进一步表征,使用cu kα辐射在8.4、24.2、26.0、33.3
±
0.2
°
2θ处具有另外的峰。晶型a任选地可甚至通过xrpd图进一步表征,使用cu kα辐射在6.2、9.7、13.2、14.3、15.4、16.3、16.9、18.9、19.5、20.7、21.8、22.8、23.6、25.1、27.3、27.7、28.4、29.4、30.2、31.2、31.5、31.9、33.9、34.5、34.9、36.1、36.8、37.7、38.5和39.7
±
0.2
°
2θ处具有另外的峰。在各种情况下,晶型a可通过xrpd图表征,使用cu kα辐射在6.2、6.6、8.4、9.7、13.2、14.3、14.9、15.4、16.3、16.9、18.9、19.5、20.1、20.7、21.4、21.8、22.8、23.6、24.3、25.1、26.0、26.8、27.3、27.7、28.4、29.4、30.2、31.2、31.5、31.9、33.3、33.9、34.5、34.9、36.1、36.8、37.7、38.5和39.7
±
0.2
°
2θ处具有峰。在一些实施方案中,晶型a可以通过基本上如图13所示的x射线粉末衍射图来表征,其中“基本上”是指所报告的峰可以变化
±
0.2
°
。在xrpd领域中众所周知,当光谱中的相对峰高依赖于多种因素,如样品制备以及仪器几何形状时,峰位置对于实验细节相对不敏感。
[0050]
在一些实施方案中,该片剂制剂包含奥美卡替莫卡必尔二盐酸盐晶型b。在一些实施方案中,该片剂制剂包含奥美卡替莫卡必尔二盐酸盐晶型c。奥美卡替莫卡必尔的晶型b和晶型c多晶型物是亚稳态的无水二盐酸盐形式,可以在不同的条件和温度下形成,如wo2014/152270a1中所述。
[0051]
如wo2014/152270a1中所述,晶型b可通过xrpd图表征,使用cu kα辐射在6.8、8.8、14.7、17.7和22.3
±
0.2
°
2θ处具有峰。晶型b任选地可通过xrpd图进一步表征,使用cu kα辐射在9.6、13.5、19.2、26.2
±
0.2
°
2θ处具有另外的峰。晶型b可通过xrpd图表征,使用cu kα
辐射在6.2、6.8、8.8、9.6、13.5、14.4、14.7、15.4、16.3、17.0、17.7、18.3、19.2、19.9、20.5、20.8、21.8、22.3、22.7、23.0、24.8、25.1、25.5、26.2、26.4、26.8、27.5、28.5、30.2、30.6、31.1、31.5、32.1、32.7、34.1、34.4、35.5、35.9、38.1、38.9
±
0.2
°
2θ处具有峰。在一些实施方案中,晶型b可以通过基本上如wo2014/152270a1中所述的xrpd图来表征,其中“基本上”是指所报告的峰可以变化
±
0.2
°
。
[0052]
如wo2014/152270a1中所述,晶型c可通过xrpd图表征,使用cu kα辐射在6.7、14.8、17.4、20.6和26.2
±
0.2
°
2θ处具有峰。晶型c任选地可通过xrpd图进一步表征,使用cu kα辐射在8.7、22.0、27.1和27.7
±
0.2
°
2θ处具有另外的峰。晶型c可通过xrpd图表征,使用cu kα辐射在6.2、6.7、8.7、9.6、13.5、14.5、14.8、15.4、16.4、17.1、17.4、18.4、19.3、19.5、19.9、20.6、20.8、21.8、22.0、22.5、22.8、24.3、24.7、25.1、25.6、26.2、26.5、27.1、27.3、27.7、28.5、30.0、30.5、31.0、31.5、32.2、32.8、34.1、35.2、36.0、36.9和38.8
±
0.2
°
2θ处具有峰。在一些实施方案中,晶型c可以通过基本上如wo2014/152270a1中所述的xrpd图来表征,其中“基本上”是指所报告的峰可以变化
±
0.2
°
。
[0053]
该片剂制剂含有任何合适量的奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物。如果片剂制剂包含太少的奥美卡替莫卡必尔,则会过度增加患者的药丸负担。相反,如果片剂制剂包含过多的奥美卡替莫卡必尔,则该片剂制剂可能表现出不希望的特性(例如,施用后患者的不良c
max
和/或无法以商业规模生产)。
[0054]
应当理解,本文关于奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物的量的描述是相对于活性成分的盐或水合物形式而言的。本文所述的奥美卡替莫卡必尔的量是指奥美卡替莫卡必尔游离碱的量(或等量)。例如,当片剂制剂显示具有1mg的奥美卡替莫卡必尔时,该片剂制剂包含1.22mg的奥美卡替莫卡必尔二盐酸盐一水合物(分子量(mw)为492.37g/mol),其提供1mg的奥美卡替莫卡必尔(mw为401.43g/mol)。
[0055]
在一些实施方案中,该片剂制剂包含奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物,其量为基于片剂制剂的总重量的0.1重量%或更多,例如0.5重量%或更多、1重量%或更多、2重量%或更多、3重量%或更多、4重量%或更多、5重量%或更多、6重量%或更多、7重量%或更多、8重量%或更多、9重量%或更多、10重量%或更多、11重量%或更多、12重量%或更多、13重量%或更多、14重量%或更多、15重量%或更多、16重量%或更多、17重量%或更多、18重量%或更多、19重量%或更多、20重量%或更多、21重量%或更多、22重量%或更多、23重量%或更多、24重量%或更多、25重量%或更多、26重量%或更多、27重量%或更多、28重量%或更多、29重量%或更多、30重量%或更多、31重量%或更多、32重量%或更多、33重量%或更多、34重量%或更多、35重量%或更多、36重量%或更多、37重量%或更多、38重量%或更多、39重量%或更多、或者40重量%或更多的奥美卡替莫卡必尔,无论以何种形式(例如,盐、盐水合物或游离碱)该奥美卡替莫卡必尔都存在于片剂制剂中。可选择地或另外,该片剂制剂包含奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物,其量为基于片剂制剂的总重量的80重量%或更少,例如,79重量%或更少、78重量%或更少、77重量%或更少、76重量%或更少、75重量%或更少、74重量%或更少、73重量%或更少、72重
量%或更少、71重量%或更少、70重量%或更少、69重量%或更少、68重量%或更少、67重量%或更少、66重量%或更少、65重量%或更少、64重量%或更少、63重量%或更少、62重量%或更少、61重量%或更少、60重量%或更少、59重量%或更少、58重量%或更少、57重量%或更少、56重量%或更少、55重量%或更少、54重量%或更少、53重量%或更少、52重量%或更少、51重量%或更少、50重量%或更少、49重量%或更少、48重量%或更少、47重量%或更少、46重量%或更少、45重量%或更少、44重量%或更少、43重量%或更少、42重量%或更少、或者41重量%或更少的奥美卡替莫卡必尔,无论以何种形式(例如,盐、盐水合物或游离碱)该奥美卡替莫卡必尔都存在于片剂制剂中。
[0056]
因此,该片剂制剂包含由上述端点中的任何两个限定的量的奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物。例如,该片剂制剂包含奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物,其量为基于片剂制剂的总重量的0.1至80重量%,例如0.5至79重量%、1至78重量%、2至77重量%、3至76重量%、4至75重量%、5至74重量%、6至73重量%、7至72重量%、8至71重量%、9至70重量%、10至69重量%、11至68重量%、12至67重量%、13至66重量%、14至65重量%、15至64重量%、16至63重量%、17至62重量%、18至61重量%、19至60重量%、20至59重量%、21至58重量%、22至57重量%、23至56重量%、24至55重量%、25至54重量%、26至53重量%、27至52重量%、28至51重量%、29至50重量%、30至49重量%、31至48重量%、32至47重量%、33至46重量%、34至45重量%、35至44重量%、36至43重量%、37至42重量%、38至41重量%、或者39至40重量%的奥美卡替莫卡必尔,无论以何种形式(例如,盐、盐水合物或游离碱)该奥美卡替莫卡必尔都存在于片剂制剂中。
[0057]
在一些实施方案中,该片剂制剂包含奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物,其量为基于片剂制剂的总重量的5至10重量%,例如,5.5重量%、6重量%、6.5重量%、7重量%、7.5重量%、8重量%、8.5重量%、9重量%或9.5重量%。
[0058]
在一些实施方案中,该片剂制剂的片芯包含奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物,其量为基于片芯的总重量的8重量%(作为奥美卡替莫卡必尔游离碱)。
[0059]
在一些实施方案中,该片剂制剂包含1-3mg的奥美卡替莫卡必尔(游离碱),其可作为奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物存在。在一些实施方案中,该片剂制剂包含1mg的奥美卡替莫卡必尔(游离碱),其可作为奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物存在。
[0060]
片剂片芯
[0061]
本文公开的片剂制剂包含包覆有薄膜包衣的片芯。该片芯含有奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物(如上所述)、填充剂、粘合剂、助流剂和润滑剂。
[0062]
如本文所述,本文公开的片剂制剂的特定组分的重量百分比是基于片剂制剂的总重量(即,整个片剂),除非另有说明。在某些情况下,基于部分片剂制剂(例如片芯或薄膜包衣)的总重量来讨论组分的量或浓度更为方便。
[0063]
该片剂制剂包含一种或多种填充剂。在一些情况下,该片剂制剂包含一种填充剂。在一些情况下,该片剂制剂包含多于一种填充剂(例如,两种、三种或四种填充剂)。该片剂制剂包含任何合适量的填充剂。如果片剂制剂包含太少的填充剂,则该片剂制剂可能表现出不希望的特性,例如,无法以商业规模生产。相反,如果片剂制剂包含过多的填充剂,则该片剂制剂可能表现出不希望的特性(例如,增加患者的药丸负担)。
[0064]
如本文所用,术语“填充剂”是指可以添加到药物制剂的组分中以增加要配制的(例如成片的)物质的散重的物质,从而达到所需的重量。填料包括但不限于淀粉、乳糖、纤维素衍生物、糖醇等。不同等级的淀粉包括但不限于玉米淀粉、马铃薯淀粉、大米淀粉、小麦淀粉、预胶化淀粉(可从signet chemical corporation以pcs pc10商购)和starch 1500、starch 1500lm等级(低水分等级)(购自colorcon)、全预胶化淀粉(可从essex grain products以national 78-1551商购)等。不同等级的乳糖包括但不限于乳糖一水合物、乳糖dt(直接成片)、无水乳糖、flowlac
tm
(可购自meggle products)、pharmatose
tm
(可购自dmv)等。可以使用的不同纤维素衍生物包括结晶纤维素,例如微晶纤维素和粉状纤维素。可以使用的不同糖醇包括甘露糖醇(例如pearlitol
tm sd 200)、山梨糖醇和木糖醇。
[0065]
在一些情况下,填充剂包括粒径为50μm且水分含量为3至5%的微晶纤维素(例如,avicel ph101),或粒径为100μm且水分含量为3至5%的微晶纤维素(例如,avicel ph102),或粒径为180μm且水分含量为2至5%的微晶纤维素(例如,avicel ph200)或乳糖一水合物,或结晶325目极细的乳糖一水合物(例如,unisweet l-313或pharmatose 110m)或结晶200目极细的乳糖一水合物(例如,unisweet l-312),或粒径为60-120μm的结晶和无定形乳糖一水合物的喷雾干燥的混合物(例如,fast flo 316),或其组合。
[0066]
该片剂制剂包含基于片剂制剂的总重量的20重量%或更多的填充剂,例如21重量%或更多、22重量%或更多、23重量%或更多、24重量%或更多、25重量%或更多、26重量%或更多、27重量%或更多、28重量%或更多、29重量%或更多、30重量%或更多、31重量%或更多、32重量%或更多、33重量%或更多、34重量%或更多、35重量%或更多、36重量%或更多、37重量%或更多、38重量%或更多、39重量%或更多、40重量%或更多、41重量%或更多、42重量%或更多、43重量%或更多、44重量%或更多、45重量%或更多、46重量%或更多、47重量%或更多、48重量%或更多、49重量%或更多、或50重量%或更多的填充剂,基于片剂制剂的总重量。可选择地或另外,该片剂制剂包含基于片剂制剂的总重量的90重量%或更少的填充剂,例如89重量%或更少、88重量%或更少、87重量%或更少、86重量%或更少、85重量%或更少、84重量%或更少、83重量%或更少、82重量%或更少、81重量%或更少、80重量%或更少、79重量%或更少、78重量%或更少、77重量%或更少、76重量%或更少、75重量%或更少、74重量%或更少、73重量%或更少、72重量%或更少、71重量%或更少、70重量%或更少、69重量%或更少、68重量%或更少、67重量%或更少、66重量%或更少、65重量%或更少、64重量%或更少、63重量%或更少、62重量%或更少、61重量%或更少、60重量%或更少、59重量%或更少、58重量%或更少、57重量%或更少、56重量%或更少、55重量%或更少、54重量%或更少、53重量%或更少、52重量%或更少、或51重量%或更少的填充剂,基于片剂制剂的总重量。
[0067]
因此,该片剂制剂包含由上述端点中的任何两个限定的量的填充剂。例如,该片剂制剂包含基于片剂制剂的总重量的20-90重量%的填充剂,例如,21-89重量%、22-88重
量%、23-87重量%、24-86重量%、25-85重量%、26-84重量%、27-83重量%、28-82重量%、29-81重量%、30-80重量%、31-79重量%、32-78重量%、33-77重量%、34-76重量%、35-75重量%、36-74重量%、37-73重量%、38-72重量%、39-71重量%、40-70重量%、41-69重量%、42-68重量%、43-67重量%、44-66重量%、45-65重量%、46-64重量%、47-63重量%、48-62重量%、49-61重量%、50-60重量%、51-59重量%、52-58重量%、53-57重量%、或54-56重量%的填充剂,基于片剂制剂的总重量。
[0068]
在一些实施方案中,该片剂制剂包含基于片剂制剂的总重量的60重量%至90重量%、77.9重量%、74.5%或65.9%的填充剂。在一些实施方案中,该片剂制剂的片芯包含基于片剂制剂的片芯的总重量的85.6重量%的填充剂。
[0069]
在一些实施方案中,填充剂包括微晶纤维素、乳糖一水合物或其组合。如本文所公开的片剂制剂中可以存在多于一种填充剂(例如,2、3、4或更多种填充剂)。例如,在一些实施方案中,填充剂包括微晶纤维素和乳糖一水合物。在其中包含多于一种填充剂的片剂制剂的实施方案中,应理解存在的填充剂的总量落入本文所述的量之内。
[0070]
在一些实施方案中,该片剂制剂包含基于片剂制剂的总重量的10-45重量%的微晶纤维素和10-45重量%的乳糖一水合物,例如,10-40重量%的微晶纤维素和10-40重量%的乳糖一水合物、30-40重量%的微晶纤维素和30-40重量%的乳糖一水合物、39重量%的微晶纤维素和39重量%的乳糖一水合物、38重量%的微晶纤维素和38重量%的乳糖一水合物、37重量%的微晶纤维素和37重量%的乳糖一水合物、36重量%的微晶纤维素和36重量%的乳糖一水合物、35重量%的微晶纤维素和35重量%的乳糖一水合物、34重量%的微晶纤维素和34重量%的乳糖一水合物、或33重量%的微晶纤维素和33重量%的乳糖一水合物、32重量%的微晶纤维素和32重量%的乳糖一水合物、或31重量%的微晶纤维素和31重量%的乳糖一水合物作为填充剂,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂的片芯包含42.8重量%的微晶纤维素和42.8重量%的乳糖一水合物,基于片剂制剂的片芯的总重量。
[0071]
在一些实施方案中,本文公开的片剂制剂包含粘合剂。在一些情况下,该片剂制剂包含一种粘合剂。在一些情况下,该片剂制剂包含多于一种粘合剂(例如,2、3或4种粘合剂)。片剂制剂包含任何合适量的粘合剂。如果片剂制剂包含太少的粘合剂,则该片剂制剂可能例如缺乏稳定性。相反,如果片剂制剂包含过多的粘合剂,则该片剂制剂可能表现出不希望的药代动力学特性(例如,缓慢释放速率)。
[0072]
如本文所用,术语“粘合剂”是指用于片剂制剂中以将活性药物成分和非活性成分一起保持在粘性颗粒中的物质。合适的粘合剂包括但不限于例如羧甲基纤维素钠usp、羟丙甲纤维素usp、羟乙基纤维素nf和羟丙基纤维素nf。此外,其他粘合剂包括聚维酮、聚乙烯吡咯烷酮、明胶nf、天然树胶(如阿拉伯胶、黄蓍胶、瓜尔胶和果胶)、淀粉糊、预胶化淀粉nf、蔗糖nf、玉米糖浆、聚乙二醇、和海藻酸钠、海藻酸钙铵、硅酸镁铝、聚乙二醇。在一个实施方案中,粘合剂包括羟丙基纤维素。
[0073]
在一些实施方案中,粘合剂包含具有300-600mpa-s(10%)的brookfield粘度的羟丙基纤维素(hpc)(例如klucel exf)。
[0074]
在各种实施方案中,该片剂制剂包含基于片剂制剂的总重量的0.5重量%或更多的粘合剂,例如,1重量%或更多、1.5重量%或更多、2重量%或更多、2.5重量%或更多、3重
量%或更多、3.5重量%或更多、4重量%或更多、4.5重量%或更多、5重量%或更多、5.5重量%或更多、6重量%或更多、6.5重量%或更多、7重量%或更多、或者7.5重量%或更多的粘合剂,基于片剂制剂的总重量。可选择地或另外,该片剂制剂包含15重量%或更少的粘合剂,例如,14.5重量%或更少、14重量%或更少、13.5重量%或更少、13重量%或更少、12.5重量%或更少、12重量%或更少、11.5重量%或更少、11重量%或更少、10.5重量%或更少、10重量%或更少、9.5重量%或更少、9重量%或更少、8.5重量%或更少、或者8重量%或更少的粘合剂,基于片剂制剂的总重量。
[0075]
因此,该片剂制剂包含由上述任何端点限定的量的粘合剂。例如,该片剂制剂包含0.5-15重量%的粘合剂,例如,1-14.5重量%、1.5-14重量%、2-13.5重量%、2.5-13重量%、3-12.5重量%、3.5-12重量%、4-11.5重量%、4.5-11重量%、5-10.5重量%、5.5-10重量%、6-9.5重量%、6.5-9重量%、7-8.5重量%、或者7.5-8重量%的粘合剂,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂包含1-8重量%的粘合剂,例如,2-5重量%、或2-4重量%的粘合剂。在一些实施方案中,该片剂制剂的片芯包含2-5重量%的粘合剂,基于片剂制剂的总重量。在任何上述实施方案中,该粘合剂可为hpc。
[0076]
在粘合剂例如包含hpc的实施方案中,该片剂制剂包含基于片剂制剂的总重量的1-8重量%的hpc,例如,基于片剂制剂的总重量的1-5重量%的hpc。在一些实施方案中,该片剂制剂的片芯包含基于片剂制剂的片芯的总重量的3重量%的hpc。在一些实施方案中,该片剂制剂包含基于片剂制剂的总重量的2.7重量%的hpc。在一些实施方案中,该片剂制剂包含基于片剂制剂的总重量的2.6重量%的hpc。在各种实施方案中,该片剂制剂包含基于片剂制剂的总重量的2.3重量%的hpc。在一些实施方案中,该片剂制剂的片芯包含基于片剂制剂的片芯的总重量的3重量%的hpc。
[0077]
在一些实施方案中,本文公开的片剂制剂包含助流剂。在一些情况下,该片剂制剂包含一种助流剂。在一些情况下,该片剂制剂包含多于一种助流剂(例如,2、3或4种助流剂)。助流剂是添加以改善组合物流动性的颗粒外组分。片剂制剂包含任何合适量的助流剂。如果组合物包含太少的助流剂,则片剂制剂会表现出较差的流动性并且在制造过程中难以加工。相反,如果组合物包含过多的助流剂,则片剂制剂可能表现出不期望的处理特性和/或不具有成本效益。
[0078]
如本文所用,术语“助流剂”是指添加到粉末制剂混合物中以提高其流动性的物质。合适的助流剂包括但不限于例如二氧化硅、胶体二氧化硅、无水胶体二氧化硅(例如aerosil 200)、三硅酸镁、粉状纤维素、淀粉、滑石及其组合。
[0079]
本文公开的片剂制剂包含基于片剂制剂的总重量的0.1重量%或更多的助流剂,例如,0.25重量%或更多、0.5重量%或更多、0.75重量%或更多、1重量%或更多、1.25重量%或更多、1.5重量%或更多、1.75重量%或更多、2重量%或更多、2.25重量%或更多、2.5重量%或更多、2.75重量%或更多、或者3重量%或更多的助流剂,基于片剂制剂的总重量。可选择地或另外,该片剂制剂包含5重量%或更少的助流剂,例如,4.75重量%或更少、4.5重量%或更少、4.25重量%或更少、4重量%或更少、3.75重量%或更少、3.5重量%或更少、或者3.25重量%或更少的助流剂,基于片剂制剂的总重量。
[0080]
因此,该片剂制剂包含由上述任何端点限定的量的助流剂。例如,该片剂制剂包含基于片剂制剂的总重量的0.1-5重量%的助流剂,例如,0.25-4.75重量%、0.5-4.5重量%、
0.75-4.25重量%、1-4重量%、1.25-3.75重量%、1.5-3.5重量%、1.75-3.25重量%、2-3重量%、或者2.25-2.75重量%的助流剂,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂包含0.1-5重量%的助流剂,例如,0.1-2重量%的助流剂或0.2-1重量%的助流剂,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂的片芯包含0.2-0.8重量%的助流剂,基于片剂制剂的总重量。在任何上述实施方案中,该助流剂可为胶体二氧化硅。
[0081]
在助流剂例如包含胶体二氧化硅的实施方案中,该片剂制剂包含0.5重量%的胶体二氧化硅,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂包含0.4重量%的胶体二氧化硅,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂的片芯包含0.5重量%的胶体二氧化硅,基于片剂制剂的片芯的总重量。
[0082]
在一些实施方案中,本文公开的片剂制剂包含润滑剂。在一些情况下,该片剂制剂包含一种润滑剂。在一些情况下,该片剂制剂包含一种以上的润滑剂(例如,两种、三种或四种润滑剂)。润滑剂是为改进组合物的处理而添加的颗粒外组分。该片剂制剂包含任何合适量的润滑剂。如果该组合物包含太少的润滑剂,则片剂制剂可能表现出较差的处理特性并且在制造过程中难以加工。相反,如果该组合物包含过多的润滑剂,则片剂制剂可能表现出不希望的性质和/或不具有成本效益。
[0083]
如本文所用,术语“润滑剂”是指可以添加到本发明片剂制剂的组分中以减少固体制剂对用于生产单位剂型的设备的粘附的物质。润滑剂包括硬脂酸、氢化植物油、氢化大豆油、和氢化大豆油&蓖麻蜡、硬脂醇、亮氨酸、硬脂酸镁、单硬脂酸甘油酯、硬脂酸、山嵛酸甘油酯、环氧乙烷聚合物、十二烷基硫酸钠、十二烷基硫酸镁、油酸钠、硬脂酰富马酸钠和dl-亮氨酸及其混合物。在一些情况下,该润滑剂包括硬脂酸镁。
[0084]
本文公开的片剂制剂包含基于片剂制剂的总重量的0.2重量%或更多的润滑剂,例如0.25重量%或更多、0.3重量%或更多、0.4重量%或更多、0.5重量%或更多、0.6重量%或更多、0.7重量%或更多、0.8重量%或更多、0.9重量%或更多、或者1重量%或更多的润滑剂,基于片剂制剂的总重量。可选择地或另外,该片剂制剂包含基于片剂制剂的总重量的2重量%或更少的润滑剂,例如1.9重量%或更少、1.8重量%或更少、1.7重量%或更少、1.6重量%或更少、1.5重量%或更少、1.4重量%或更少、1.3重量%或更少、1.2重量%或更少、或者1.1重量%或更少的润滑剂,基于片剂制剂的总重量。
[0085]
因此,本文公开的片剂制剂包含由上述任何端点限定的量的润滑剂。例如,该片剂制剂包含基于片剂制剂的总重量的0.2-2重量%的润滑剂,例如,0.25-1.9重量%、0.3-1.8重量%、0.4-1.7重量%、0.5-1.6重量%、0.6-1.5重量%、0.7-1.4重量%、0.8-1.3重量%、0.9-1.2重量%、或者1-1.1重量%的润滑剂,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂的片芯包含0.8-1.2重量%的润滑剂(例如,1重量%的润滑剂),基于片剂制剂的总重量。在任何上述实施方案中,该润滑剂可为硬脂酸镁。
[0086]
在一些实施方案中,其中该润滑剂例如包含硬脂酸镁,该片剂制剂包含0.25-3重量%的硬脂酸镁,基于片剂制剂的总重量。在各种实施方案中,其中该润滑剂包含硬脂酸镁,该片剂制剂包含0.5-3重量%的硬脂酸镁,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂包含1重量%的硬脂酸镁,基于片剂制剂的总重量。在各种实施方案中,该片剂制剂包含0.9重量%的硬脂酸镁,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂包含0.8重量%的硬脂酸镁,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂的片
芯包含1.0重量%的硬脂酸镁,基于片剂制剂的片芯的总重量。
[0087]
在各种实施方案中,本文公开的片剂制剂不含有或基本上不含ph调节剂。ph调节剂的实例包括马来酸、柠檬酸、苹果酸、富马酸、硫酸、酒石酸、乳酸、水杨酸、天冬氨酸、氨基水杨酸、丙二酸、谷氨酸或其组合。在一些情况下,ph调节剂是富马酸。
[0088]
申请人惊奇地发现含有富马酸的片芯在6.8缓冲液中没有表现出增强的奥美卡替莫卡必尔释放。不希望受任何特定理论的束缚,据信富马酸通过在中性ph 6.8环境下的常释微型片芯内提供低微环境ph而充当ph调节剂。微型片芯内的低ph值有助于溶解奥美卡替莫卡必尔,从而增强奥美卡替莫卡必尔在中性ph值6.8下的释放。然而,如本文图6-8中的数据所示,富马酸在6.8缓冲液中没有增强奥美卡替莫卡必尔的释放。不希望受任何特定理论的束缚,据信这种效应可能是由于富马酸在溶解开始时被缓冲离子中和,导致在ph 6.8缓冲液中的微型片剂内失去提供低ph值的能力。图6-8中的数据令人惊讶地表明,富马酸在中性ph下并没有增强奥美卡替莫卡必尔的释放,因此表明富马酸不是常释微型片剂制剂的必需组分。
[0089]
在一些实施方案中,该片剂制剂的片芯包含8-11重量%的奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物;83-86重量%的填充剂;2-5重量%的粘合剂;0.2-0.8重量%的助流剂;和0.8-1.2重量%的润滑剂,基于片芯的总重量。
[0090]
薄膜包衣
[0091]
本文公开的片剂制剂包含片芯上的薄膜包衣。该薄膜包衣包含调释聚合物(即控释剂)和成孔剂。在一些实施方案中,该薄膜包衣还包含增塑剂。在一些实施方案中,成孔剂也可用作增塑剂。
[0092]
如本文所用,术语“调释聚合物”(有时在本文中也称为“控释剂”)是指促进奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物以受控方式从片剂制剂中释放的物质。在一些情况下,该薄膜包衣包含一种调释聚合物。在一些情况下,该薄膜包衣包含多于一种调释聚合物(例如,两种、三种或四种调释聚合物)。调释聚合物可在水合时形成半透膜。调释聚合物的实例包括但不限于,乙酸纤维素(ca)、丙烯酸乙酯和甲基丙烯酸甲酯的共聚物(例如,丙烯酸乙酯-甲基丙烯酸甲酯-氯化甲基丙烯酸三甲胺基乙酯(trimethylammonioethyl methacrylate chloride)共聚物1∶2∶0.1(eudragit rs);和丙烯酸乙酯-甲基丙烯酸甲酯-氯化甲基丙烯酸三甲胺基乙酯共聚物1∶2∶0.2(eudragit rl)、乙基纤维素或聚乙酸乙烯酯、或其组合。
[0093]
在各种实施方案中,该薄膜包衣的调释聚合物包括乙基纤维素、丙烯酸乙酯-甲基丙烯酸甲酯共聚物、丙烯酸乙酯-甲基丙烯酸甲酯-氯化甲基丙烯酸三甲胺基乙酯共聚物、乙酸纤维素、聚乙酸乙烯酯、或其组合。在一些实施方案中,该调释聚合物包括乙酸纤维素。
[0094]
该片剂制剂包含任何合适量的调释聚合物。如果该片剂制剂包含太少的调释聚合物,则该片剂制剂可能表现出快速的奥美卡替莫卡必尔释放速率。相反,如果该片剂制剂包含过多的控释剂,则该片剂制剂可能表现出过慢的奥美卡替莫卡必尔的释放速率。
[0095]
在其中调释聚合物包含例如乙酸纤维素的实施方案中,该片剂制剂包含片剂制剂总重量的3重量%或更多的乙酸纤维素,例如,4重量%或更多、5重量%或更多、6重量%或更多、7重量%或更多、8重量%或更多、9重量%或更多、10重量%或更多、11重量%或更多、
或者12重量%或更多的乙酸纤维素,基于片剂制剂的总重量。可选择地或另外,该片剂制剂包含片剂制剂总重量的20重量%或更少的乙酸纤维素,例如,19重量%或更少、18重量%或更少、17重量%或更少、16重量%或更少、15重量%或更少、14重量%或更少、或者13重量%或更少的乙酸纤维素,基于片剂制剂的总重量。
[0096]
因此,该片剂制剂包含由上述端点限定的任何量的乙酸纤维素。例如,该片剂制剂包含片剂制剂总重量的3-20重量%的乙酸纤维素,例如,4-19重量%、5-18重量%、6-17重量%、7-16重量%、8-15重量%、9-14重量%、10-13重量%、或者11-12重量%的乙酸纤维素,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂包含5.4重量%的乙酸纤维素,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂包含7.8重量%的乙酸纤维素,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂包含13.8重量%的乙酸纤维素,基于片剂制剂的总重量。
[0097]
在一些实施方案中,该薄膜包衣包含基于薄膜包衣的总重量的40重量%或更多的调释聚合物,例如,41重量%或更多、42重量%或更多、43重量%或更多、44重量%或更多、45重量%或更多、46重量%或更多、47重量%或更多、48重量%或更多、49重量%或更多、50重量%或更多、51重量%或更多、52重量%或更多、53重量%或更多、54重量%或更多、55重量%或更多、56重量%或更多、57重量%或更多、58重量%或更多、59重量%或更多、60重量%或更多、61重量%或更多、62重量%或更多、63重量%或更多、64重量%或更多、或者65重量%或更多的调释聚合物,基于薄膜包衣的总重量。可选择地或另外,该薄膜包衣包含薄膜包衣的总重量的90重量%或更少的调释聚合物,例如,89重量%或更少、88重量%或更少、87重量%或更少、86重量%或更少、85重量%或更少、84重量%或更少、83重量%或更少、82重量%或更少、81重量%或更少、80重量%或更少、79重量%或更少、78重量%或更少、77重量%或更少、76重量%或更少、75重量%或更少、74重量%或更少、73重量%或更少、72重量%或更少、71重量%或更少、70重量%或更少、69重量%或更少、68重量%或更少、67重量%或更少、或者66重量%或更少的调释聚合物,基于薄膜包衣的总重量。
[0098]
因此,该薄膜包衣以由上述端点中的任何两个限定的量包含一定量的调释聚合物。例如,该薄膜包衣包含薄膜包衣总重量的40-90重量%的调释聚合物,基于薄膜包衣的总重量,例如,41-89重量%、42-88重量%、43-87重量%、44-86重量%、45-85重量%、46-84重量%、47-83重量%、48-82重量%、49-81重量%、50-80重量%、51-79重量%、52-78重量%、53-77重量%、54-76重量%、55-75重量%、56-74重量%、57-73重量%、58-72重量%、59-71重量%、60-70重量%、61-69重量%、62-68重量%、63-67重量%、或者64-66重量%的调释聚合物,基于薄膜包衣的总重量。
[0099]
在一些实施方案中,该薄膜包衣包含40-90重量%的调释聚合物、50-80重量%、60-70重量%、或者55-65重量%的调释聚合物,基于薄膜包衣的总重量。在一些实施方案中,该薄膜包衣包含60重量%的调释聚合物,基于薄膜包衣的总重量。
[0100]
如本文所用,术语“成孔剂”是指增加水不溶性膜的孔隙率并促进药物扩散的物质。在暴露于水或生物流体时,成孔剂溶解并在水不溶性薄膜屏障中形成药物释放通道。在一些情况下,该薄膜包衣包含一种成孔剂。在一些情况下,该薄膜包衣包含多于一种成孔剂(例如,两种、三种或四种成孔剂)。薄膜包衣的合适的成孔剂包括但不限于,羟丙基甲基纤维素、聚乙烯吡咯烷酮、山梨糖醇、柠檬酸三乙酯、聚乙二醇、或其组合。合适的成孔剂包括
但不限于,例如,聚乙二醇(例如,peg 3350)、山梨糖醇、羟丙甲纤维素(甲氧基含量为28-30%,羟丙基含量为7-12%,在20℃、2%的水中粘度为4-6cp)(例如,methocel e5)、羟丙甲纤维素(甲氧基含量为28-30%,羟丙基含量为7-12%,在20℃、2%的水中粘度为5-7cp)(例如,methocel e6)、或聚乙烯醇-聚乙二醇接枝共聚物(分子量为45kda,熔点为209℃,粘度为115mpa-s,20%溶液)(例如,kollicoat ir)、或其组合。
[0101]
在一些实施方案中,该成孔剂包括聚乙二醇(peg)。示例性的聚乙二醇为peg 3350(cas no.25322-68-3)(分子量(mw)为3350g/mol,熔点为56℃)。
[0102]
如本文所用,术语“增塑剂”是指降低可塑性或降低聚合物链之间的吸引力以使其更柔韧以防止聚合物膜形成裂纹或剥离的物质。在一些情况下,该薄膜包衣包含一种增塑剂。在一些情况下,该薄膜包衣包含多于一种增塑剂(例如,两种、三种或四种增塑剂)。合适的增塑剂包括但不限于,例如,聚乙二醇(例如,peg 3350)、邻苯二甲酸二乙酯、柠檬酸三乙酯、癸二酸二丁酯或三乙酸甘油酯、或其组合。在一些情况下,成孔剂还可以表现出增塑剂特性,并且组分可以既是成孔剂又是增塑剂。合适的增塑剂包括但不限于peg、邻苯二甲酸二乙酯、柠檬酸三乙酯、癸二酸二丁酯、三乙酸甘油酯、或其组合。在一些情况下,该增塑剂包括peg。
[0103]
在一些实施方案中,该成孔剂也是增塑剂。在一些情况下,成孔剂(其也是增塑剂)包括peg,例如,peg 3350。
[0104]
片剂制剂包含任何合适量的成孔剂。如果片剂制剂含有过少的成孔剂,则该片剂制剂可能表现出过慢的奥美卡替莫卡必尔释放速率。相反,如果片剂制剂含有过多的成孔剂,则该片剂制剂可能表现出过快的奥美卡替莫卡必尔释放速率。
[0105]
片剂制剂包含基于片剂制剂的总重量的2重量%或更多的成孔剂,例如,3重量%或更多、4重量%或更多、5重量%或更多、6重量%或更多、7重量%或更多、8重量%或更多、9重量%或更多、10重量%或更多、11重量%或更多、12重量%或更多、13重量%或更多、14重量%或更多、15重量%或更多、16重量%或更多、17重量%或更多、18重量%或更多、19重量%或更多、20重量%或更多、21重量%或更多、22重量%或更多、23重量%或更多、24重量%或更多、25重量%或更多、26重量%或更多、27重量%或更多、或者28重量%或更多的成孔剂,基于片剂制剂的总重量。可选择地或另外,该片剂制剂包含基于片剂制剂的总重量的50重量%或更少的成孔剂,例如,49重量%或更少、48重量%或更少、47重量%或更少、46重量%或更少、45重量%或更少、44重量%或更少、43重量%或更少、42重量%或更少、41重量%或更少、40重量%或更少、39重量%或更少、38重量%或更少、37重量%或更少、36重量%或更少、35重量%或更少、34重量%或更少、33重量%或更少、32重量%或更少、31重量%或更少、30重量%或更少、或者29重量%或更少的成孔剂,基于片剂制剂的总重量。
[0106]
因此,该片剂制剂包含由上述端点中的任何两个限定的量的成孔剂。例如,该薄膜包衣包含基于片剂制剂的总重量的2-50重量%的成孔剂,例如,3-49重量%、4-48重量%、5-47重量%、6-46重量%、7-45重量%、8-44重量%、9-43重量%、10-42重量%、11-41重量%、12-40重量%、13-39重量%、14-38重量%、15-37重量%、16-36重量%、17-35重量%、18-34重量%、19-33重量%、20-32重量%、21-31重量%、22-30重量%、23-29重量%、24-28重量%、或者25-27重量%的成孔剂,基于片剂制剂的总重量。在一些实施方案中,该薄膜包衣包含2-50重量%的成孔剂、或者20-40重量%的成孔剂,基于片剂制剂的总重量。
[0107]
在成孔剂包含例如peg的实施方案中,片剂制剂包含基于片剂制剂的总重量的2-15重量%的peg,例如,3、4、5、6、7、8、9、10、11、12、13或14重量%的peg,基于片剂制剂的总重量。在一些实施方案中,该片剂制剂包含基于片剂制剂的总重量的3.6重量%的peg。在各种实施方案中,该片剂制剂包含基于片剂制剂的总重量的5.2重量%的peg。在仍然不同的实施方案中,该片剂制剂包含基于片剂制剂的总重量的9.2重量%的peg。
[0108]
片剂制剂包含任何合适量的增塑剂。如果片剂制剂含有太少的增塑剂,则薄膜包衣可能会变脆并容易破裂。相反,如果片剂制剂含有过多的增塑剂,则薄膜包衣可能会表现出高水平的粘性和不太稳健的包衣工艺。
[0109]
片剂制剂包含基于片剂制剂的总重量的0.25重量%或更多的增塑剂,例如,0.3重量%或更多、0.4重量%或更多、0.5重量%或更多、0.6重量%或更多、0.7重量%或更多、0.8重量%或更多、0.9重量%或更多、1重量%或更多、1.1重量%或更多、1.2重量%或更多、1.3重量%或更多、1.4重量%或更多、1.5重量%或更多、1.6重量%或更多、1.7重量%或更多、1.8重量%或更多、1.9重量%或更多、2重量%或更多、2.1重量%或更多、2.2重量%或更多、2.3重量%或更多、2.4重量%或更多、或者2.5重量%或更多的增塑剂,基于片剂制剂的总重量。可选择地或另外,该片剂制剂包含基于片剂制剂的总重量的5重量%或更少,例如,4.9重量%或更少、4.8重量%或更少、4.7重量%或更少、4.6重量%或更少、4.5重量%或更少、4.4重量%或更少、4.3重量%或更少、4.2重量%或更少、4.1重量%或更少、4.0重量%或更少、3.9重量%或更少、3.8重量%或更少、3.7重量%或更少、3.6重量%或更少、3.5重量%或更少、3.4重量%或更少、3.3重量%或更少、3.2重量%或更少、3.1重量%或更少、3重量%或更少、2.9重量%或更少、2.8重量%或更少、2.7重量%或更少、或者2.6重量%或更少的增塑剂,基于片剂制剂的总重量。
[0110]
因此,该片剂制剂包含由上述端点中的任何两个限定的量的增塑剂。例如,该片剂制剂包含基于片剂制剂的总重量的0.25-5.0重量%的增塑剂,例如,0.3-4.9重量%、0.4-4.8重量%、0.5-4.7重量%、0.6-4.6重量%、0.7-4.5重量%、0.8-4.4重量%、0.9-4.3重量%、1.0-4.2重量%、1.1-4.1重量%、1.2-4.0重量%、1.3-3.9重量%、1.4-3.8重量%、1.5-3.7重量%、1.6-3.6重量%、1.7-3.5重量%、1.8-3.4重量%、1.9-3.2重量%、2.0-3.1重量%、2.1-3.0重量%、2.2-2.9重量%、2.3-2.8重量%、2.4-2.7重量%、或者2.5-2.6重量%的增塑剂,基于片剂制剂的总重量。
[0111]
在一些实施方案中,该片剂制剂包含0.25-5.0重量%的增塑剂,基于片剂制剂的总重量。
[0112]
薄膜包衣以及薄膜包衣的每个组分以提供奥美卡替莫卡必尔的理想释放概况的量存在。因此,可以调节薄膜包衣的量以及薄膜包衣的组成以调节奥美卡替莫卡必尔的释放。
[0113]
在一些实施方案中,该片剂制剂的薄膜包衣包含50-90重量%的调释聚合物和10-50重量%的成孔剂和增塑剂(当存在时),基于薄膜包衣的总重量,例如60重量%的调释聚合物和40重量%的成孔剂和增塑剂(当存在时),基于片剂制剂的总重量。在一些实施方案中,该薄膜包衣包含60重量%的调释聚合物和40重量%的成孔剂和增塑剂(当存在时),基于薄膜包衣的总重量。在一些实施方案中,该薄膜包衣占片剂制剂总重量的9重量%。在一些实施方案中,该薄膜包衣占片剂制剂总重量的13重量%。在一些实施方案中,该薄膜包衣
占片剂制剂总重量的23重量%。可以使用任何合适的包衣方法将包衣施加到片芯上。非限制性包衣方法包括例如锅包衣和流化床包衣方法。
[0114]
在一些情况下,使用包衣组合物施加包衣。该包衣组合物包含包衣溶剂、调释聚合物、成孔剂和增塑剂(当存在时)。可以使用任何合适的包衣溶剂来制备包衣组合物。合适的包衣溶剂包括但不限于水、丙酮和它们的任何组合。该包衣组合物可具有5-10重量%的固体和90-95重量%的溶剂。
[0115]
在一些实施方案中,该包衣溶剂包括丙酮和水(例如,以重量计9∶1)。
[0116]
片剂制剂
[0117]
在一些实施方案中,该片剂制剂包含5-40重量%的奥美卡替莫卡必尔二盐酸盐一水合物;10-45重量%的微晶纤维素;10-45重量%的乳糖一水合物;1-8重量%的羟丙基纤维素;0.1-2重量%的胶体二氧化硅;0.25-3重量%的硬脂酸镁;3-20重量%的乙酸纤维素;和2-15重量%的聚乙二醇,基于片剂制剂的总重量。
[0118]
在一些实施方案中,该片剂制剂包含5-10重量%的奥美卡替莫卡必尔二盐酸盐一水合物;30-45重量%的微晶纤维素;30-45重量%的乳糖一水合物;1-5重量%的羟丙基纤维素;0.1-2重量%的胶体二氧化硅;0.5-3重量%的硬脂酸镁;3-20重量%的乙酸纤维素;和2-15重量%的聚乙二醇,基于片剂制剂的总重量。
[0119]
在一些实施方案中,该片剂制剂包含9重量%的奥美卡替莫卡必尔二盐酸盐一水合物;38.9重量%的微晶纤维素;38.9重量%的乳糖一水合物;2.7重量%的羟丙基纤维素;0.5重量%的胶体二氧化硅;1重量%的硬脂酸镁;5.4重量%的乙酸纤维素;和3.6重量%的聚乙二醇,基于片剂制剂的总重量。
[0120]
在一些实施方案中,该片剂制剂包含8.5重量%的奥美卡替莫卡必尔二盐酸盐一水合物;37.3重量%的微晶纤维素;37.3重量%的乳糖一水合物;2.6重量%的羟丙基纤维素;0.4重量%的胶体二氧化硅;0.9重量%的硬脂酸镁;7.8重量%的乙酸纤维素;和5.2重量%的聚乙二醇,基于片剂制剂的总重量。
[0121]
在一些实施方案中,该片剂制剂包含7.5重量%的奥美卡替莫卡必尔二盐酸盐一水合物;33重量%的微晶纤维素;33重量%的乳糖一水合物;2.3重量%的羟丙基纤维素;0.4重量%的胶体二氧化硅;0.8重量%的硬脂酸镁;13.8重量%的乙酸纤维素;和9.2重量%的聚乙二醇,基于片剂制剂的总重量。
[0122]
在一些实施方案中,该片剂制剂的片芯包含9.8重量%的奥美卡替莫卡必尔二盐酸盐一水合物;42.8重量%的微晶纤维素;42.8重量%的乳糖一水合物;3重量%的羟丙基纤维素;0.5重量%的胶体二氧化硅;和1重量%的硬脂酸镁,基于片芯的总重量;并且该薄膜包衣导致片剂制剂的包衣增重10%,基于片芯总重量,并且其中该薄膜包衣包含60重量%的乙酸纤维素和40重量%的聚乙二醇,基于薄膜包衣的总重量。
[0123]
在一些实施方案中,该片剂制剂的片芯包含9.8重量%的奥美卡替莫卡必尔二盐酸盐一水合物;42.8重量%的微晶纤维素;42.8重量%的乳糖一水合物;3重量%的羟丙基纤维素;0.5重量%的胶体二氧化硅;和1重量%的硬脂酸镁,基于片芯的总重量;并且该薄膜包衣导致片剂制剂的包衣增重15%,基于片芯的总重量,并且其中该薄膜包衣包含60重量%的乙酸纤维素和40重量%的聚乙二醇,基于薄膜包衣的总重量。
[0124]
在一些实施方案中,该片剂制剂的片芯包含9.8重量%的奥美卡替莫卡必尔二盐
酸盐一水合物;42.8重量%的微晶纤维素;42.8重量%的乳糖一水合物;3重量%的羟丙基纤维素;0.5重量%的胶体二氧化硅;和1重量%的硬脂酸镁,基于片芯的总重量;并且该薄膜包衣导致片剂制剂的包衣增重30%,基于片芯的总重量,并且其中该薄膜包衣包含60重量%的乙酸纤维素和40重量%的聚乙二醇,基于薄膜包衣的总重量。
[0125]
在各种实施方案中,片剂制剂的奥美卡替莫卡必尔释放概况与ph值无关。
[0126]
制备片剂制剂的方法
[0127]
本文还提供了制备所公开的片剂制剂的方法。如本文所述,制备片剂片芯的方法包括制备包含一种或多种组分的颗粒,然后将该颗粒形成片剂片芯。可以使用任何合适的制粒方法。该方法包括干法制粒、湿法制粒或其组合。
[0128]
在一些实施方案中,用于制备片剂制剂的方法包括片芯成分的直接压制。
[0129]
在一些实施方案中,制备片剂制剂的方法包括将奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物、填充剂和粘合剂混合并粒化以形成颗粒状混合物;将该颗粒状混合物和粒化溶剂混合,并粒化以形成湿颗粒;干燥该湿颗粒以形成干燥颗粒;研磨该干燥颗粒以形成磨碎的颗粒;将该磨碎的颗粒、助流剂和润滑剂混合并压制该混合物以形成片芯;将该片芯与薄膜包衣预混合物混合以在片芯上提供薄膜包衣,并干燥包衣的片芯以形成片剂制剂,其中该薄膜包衣预混合物包含调释聚合物、增塑剂和薄膜包衣溶剂。
[0130]
在一些实施方案中,奥美卡替莫卡必尔、填充剂和粘合剂的混合使用高剪切制粒机进行。
[0131]
任何合适的粒化溶剂都可用于制备片剂制剂的方法。在各种情况下,该粒化溶剂是惰性的,并能够形成合适的颗粒状组分混合物。在一个实施方案中,该粒化溶剂包含水。
[0132]
在包括研磨干燥颗粒的方法的实施方案中,干燥颗粒的研磨可以使用冲击式研磨机进行。
[0133]
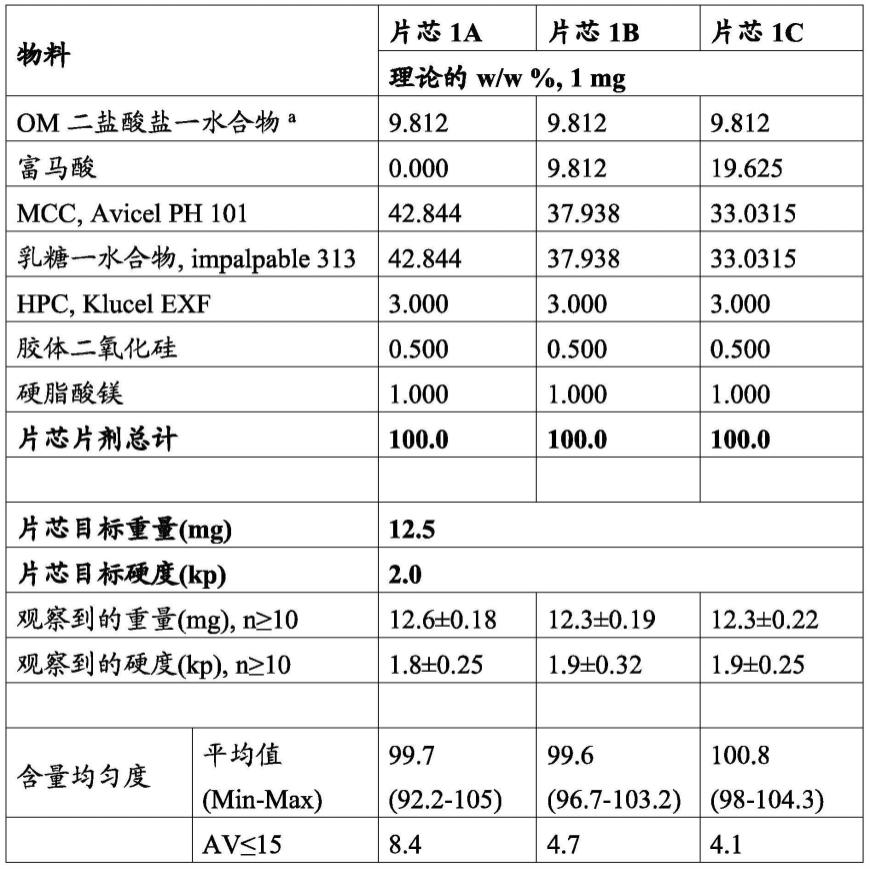
在该方法的一些实施方案中,将磨碎的颗粒、助流剂和润滑剂混合的步骤逐步进行,使得磨碎的颗粒和助流剂混合,然后将润滑剂与所得混合物混合。
[0134]
在一些实施方案中,该方法包括在流化床包衣机中混合片芯和薄膜包衣预混合物。
[0135]
在一些实施方案中,制备片剂的方法包括将奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物、填充剂和粘合剂混合并粒化以形成颗粒状混合物;将该颗粒状混合物研磨以形成磨碎的颗粒;将该磨碎的颗粒、助流剂和润滑剂混合并压制该混合物以形成片芯;将该片芯与薄膜包衣预混合物混合以在片芯上提供薄膜包衣,并干燥包衣的片芯以形成片剂制剂,其中该薄膜包衣预混合物包含调释聚合物、成孔剂和薄膜包衣溶剂。
[0136]
在一些实施方案中,制备片剂制剂的方法包括将奥美卡替莫卡必尔、或其盐或其盐的水合物、填充剂、粘合剂、助流剂和润滑剂混合并压制该混合物以形成片芯;将该片芯与薄膜包衣预混合物混合以在片芯上提供薄膜包衣,并干燥包衣的片芯以形成片剂制剂,其中该薄膜包衣预混合物包含调释聚合物、成孔剂和薄膜包衣溶剂。
[0137]
本文公开的片芯可以通过以下方法制备:直接压制片芯粉末混合物、湿法制粒或干法制粒该片芯粉末混合物,然后使用多头冲头(multi-tippunches)和模具将颗粒状混合
物旋转压制成片芯。
[0138]
使用方法
[0139]
本文还提供了使用所公开的片剂制剂治疗心血管病症例如心力衰竭(包括但不限于急性(或失代偿性)充血性心力衰竭、慢性充血性心力衰竭和射血分数降低的心力衰竭);或与收缩性心功能不全相关的心血管病症的方法。在某些实施方案中,所公开的片剂制剂可用于治疗射血分数降低的心力衰竭(hfref)。在某些实施方案中,所公开的片剂制剂可用于改善患有心血管病症的患者的心脏收缩性,或用于增加患有心血管病症例如hfref的患者的射血分数。
[0140]
在进一步的实施方案中,所公开的片剂制剂可用于(1)提高通过心肺运动测试(cpet)确定的运动能力,(2)提高通气效率,通过心肺运动测试(cpet)期间通气(ve)/二氧化碳输出(vco2)斜率的变化来衡量,或(3)改善患有心血管病症(例如慢性心力衰竭和射血分数降低的心力衰竭)患者的平均每日活动单位。
[0141]
所公开的方法包括以治疗有效量向有此需要的患者施用片剂制剂。在一些实施方案中,该患者为儿科患者。在一些实施方案中,该患者为吞咽困难的成年患者。
[0142]
在一些实施方案中,施用患者片剂制剂,其量为每天两次提供3-50mg奥美卡替莫卡必尔,基于奥美卡替莫卡必尔游离碱重量。在一些实施方案中,施用患者片剂制剂,其量为每天两次提供3-25mg奥美卡替莫卡必尔,基于奥美卡替莫卡必尔游离碱重量。
[0143]
该患者可以是儿科患者,例如6至12岁的儿童。在一些情况下,该患者为吞咽困难的成年人。
[0144]
实施方案
[0145]
1.片剂制剂,其包含:
[0146]
片芯,其包含:
[0147]
奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物;
[0148]
填充剂;
[0149]
粘合剂;
[0150]
助流剂;和
[0151]
润滑剂;和
[0152]
片芯上的薄膜包衣,该薄膜包衣包含:
[0153]
调释聚合物和成孔剂。
[0154]
2.实施方案1的片剂制剂,其中该奥美卡替莫卡必尔以奥美卡替莫卡必尔二盐酸盐一水合物存在。
[0155]
3.实施方案1或2的片剂制剂,其中该填充剂包括微晶纤维素、乳糖一水合物、或其组合。
[0156]
4.实施方案3的片剂制剂,其中该填充剂包括微晶纤维素和乳糖一水合物。
[0157]
5.实施方案1至4中任一项的片剂制剂,其中该粘合剂包括羟丙基纤维素。
[0158]
6.实施方案1至5中任一项的片剂制剂,其中该助流剂包括二氧化硅。
[0159]
7.实施方案1至6中任一项的片剂制剂,其中该润滑剂包括硬脂酸镁。
[0160]
8.实施方案1至7中任一项的片剂制剂,其中该片芯包含:
[0161]
8-11重量%的奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物;
[0162]
83-86重量%的填充剂;
[0163]
2-5重量%的粘合剂;
[0164]
0.2-0.8重量%的助流剂;和
[0165]
0.8-1.2重量%的润滑剂。
[0166]
9.实施方案1至8中任一项的片剂制剂,其中该薄膜包衣还包含增塑剂。
[0167]
10.实施方案1至9中任一项的片剂制剂,其中该成孔剂也是增塑剂。
[0168]
11.实施方案1至10中任一项的片剂制剂,其中该薄膜包衣中的调释聚合物包括乙基纤维素、丙烯酸乙酯-甲基丙烯酸甲酯共聚物、丙烯酸乙酯-甲基丙烯酸甲酯-氯化甲基丙烯酸三甲胺基乙酯共聚物、乙酸纤维素、聚乙酸乙烯酯、或其组合。
[0169]
12.实施方案11的片剂制剂,其中该调释聚合物包括乙酸纤维素。
[0170]
13.实施方案1至12中任一项的片剂制剂,其中该薄膜包衣的成孔剂包括羟丙甲纤维素、聚乙烯吡咯烷酮、山梨糖醇、柠檬酸三乙酯、聚乙二醇、或其组合。
[0171]
14.实施方案13的片剂制剂,其中该成孔剂包括聚乙二醇。
[0172]
15.实施方案14的片剂制剂,其中该聚乙二醇为聚乙二醇3350。
[0173]
16.实施方案9至15中任一项的片剂制剂,其中该增塑剂包括聚乙二醇、邻苯二甲酸二乙酯、柠檬酸三乙酯、癸二酸二丁酯、三乙酸甘油酯、或其组合。
[0174]
17.实施方案11至16中任一项的片剂制剂,其中该薄膜包衣包含:
[0175]
50-90重量%的调释聚合物;和
[0176]
10-50重量%的成孔剂和增塑剂(当存在时)。
[0177]
18.实施方案17的片剂制剂,其中该薄膜包衣包含60重量%的调释聚合物和40重量%的成孔剂和增塑剂(当存在时)。
[0178]
19.实施方案1至18中任一项的片剂制剂,其中该薄膜包衣占片剂制剂总重量的9重量%。
[0179]
20.实施方案1至18中任一项的片剂制剂,其中该薄膜包衣占片剂制剂总重量的13重量%。
[0180]
21.实施方案1至18中任一项的片剂制剂,其中该薄膜包衣占片剂制剂总重量的23重量%。
[0181]
22.实施方案1的片剂制剂,其包含:
[0182]
5-40重量%的奥美卡替莫卡必尔二盐酸盐一水合物;
[0183]
10-45重量%的微晶纤维素;
[0184]
10-45重量%的乳糖一水合物;
[0185]
1-8重量%的羟丙基纤维素;
[0186]
0.1-2重量%的胶体二氧化硅;
[0187]
0.25-3重量%的硬脂酸镁;
[0188]
3-20重量%的乙酸纤维素;和
[0189]
2-15重量%的聚乙二醇。
[0190]
23.实施方案22的片剂制剂,其包含:
[0191]
5-10重量%的奥美卡替莫卡必尔二盐酸盐一水合物;
[0192]
30-45重量%的微晶纤维素;
[0193]
30-45重量%的乳糖一水合物;
[0194]
1-5重量%的羟丙基纤维素;
[0195]
0.1-2重量%的胶体二氧化硅;
[0196]
0.5-3重量%的硬脂酸镁;
[0197]
3-20重量%的乙酸纤维素;和
[0198]
2-15重量%的聚乙二醇。
[0199]
24.实施方案23的片剂制剂,其包含:
[0200]
9重量%的奥美卡替莫卡必尔二盐酸盐一水合物;
[0201]
38.9重量%的微晶纤维素;
[0202]
38.9重量%的乳糖一水合物;
[0203]
2.7重量%的羟丙基纤维素;
[0204]
0.5重量%的胶体二氧化硅;
[0205]
1重量%的硬脂酸镁;
[0206]
5.4重量%的乙酸纤维素;和
[0207]
3.6重量%的聚乙二醇。
[0208]
25.实施方案23的片剂制剂,其包含:
[0209]
8.5重量%的奥美卡替莫卡必尔二盐酸盐一水合物;
[0210]
37.3重量%的微晶纤维素;
[0211]
37.3重量%的乳糖一水合物;
[0212]
2.6重量%的羟丙基纤维素;
[0213]
0.4重量%的胶体二氧化硅;
[0214]
0.9重量%的硬脂酸镁;
[0215]
7.8重量%的乙酸纤维素;和
[0216]
5.2重量%的聚乙二醇。
[0217]
26.实施方案23的片剂制剂,其包含:
[0218]
7.5重量%的奥美卡替莫卡必尔二盐酸盐一水合物;
[0219]
33重量%的微晶纤维素;
[0220]
33重量%的乳糖一水合物;
[0221]
2.3重量%的羟丙基纤维素;
[0222]
0.4重量%的胶体二氧化硅;
[0223]
0.8重量%的硬脂酸镁;
[0224]
13.8重量%的乙酸纤维素;和
[0225]
9.2重量%的聚乙二醇。
[0226]
27.实施方案1的片剂制剂,其中
[0227]
该片芯包含:
[0228]
9.8重量%的奥美卡替莫卡必尔二盐酸盐一水合物;
[0229]
42.8重量%的微晶纤维素;
[0230]
42.8重量%的乳糖一水合物;
[0231]
3重量%的羟丙基纤维素;
[0232]
0.5重量%的胶体二氧化硅;和
[0233]
1重量%的硬脂酸镁;并且其中
[0234]
该薄膜包衣导致片剂制剂的包衣增重10%,基于片芯总重量,并且其中该薄膜包衣包含60重量%的乙酸纤维素和40重量%的聚乙二醇,基于薄膜包衣的总重量。
[0235]
28.实施方案1的片剂制剂,其中
[0236]
该片芯包含:
[0237]
9.8重量%的奥美卡替莫卡必尔二盐酸盐一水合物;
[0238]
42.8重量%的微晶纤维素;
[0239]
42.8重量%的乳糖一水合物;
[0240]
3重量%的羟丙基纤维素;
[0241]
0.5重量%的胶体二氧化硅;和
[0242]
1重量%的硬脂酸镁;并且其中
[0243]
该薄膜包衣导致片剂制剂的包衣增重15%,基于片芯总重量,并且其中该薄膜包衣包含60重量%的乙酸纤维素和40重量%的聚乙二醇,基于薄膜包衣的总重量。
[0244]
29.实施方案1的片剂制剂,其中
[0245]
该片芯包含:
[0246]
9.8重量%的奥美卡替莫卡必尔二盐酸盐一水合物;
[0247]
42.8重量%的微晶纤维素;
[0248]
42.8重量%的乳糖一水合物;
[0249]
3重量%的羟丙基纤维素;
[0250]
0.5重量%的胶体二氧化硅;和
[0251]
1重量%的硬脂酸镁;并且其中
[0252]
该薄膜包衣导致片剂制剂的包衣增重30%,基于片芯总重量,并且其中该薄膜包衣包含60重量%的乙酸纤维素和40重量%的聚乙二醇,基于薄膜包衣的总重量。
[0253]
30.实施方案1至29中任一项的片剂制剂,其包含1-3mg的奥美卡替莫卡必尔。
[0254]
31.实施方案30的片剂制剂,其包含1mg的奥美卡替莫卡必尔。
[0255]
32.实施方案1至24、27、30和31中任一项的片剂制剂,其具有如下的奥美卡替莫卡必尔释放概况:
[0256]
在1小时内释放小于或等于50%的奥美卡替莫卡必尔;
[0257]
在2小时内释放60-70%的奥美卡替莫卡必尔;
[0258]
在8小时内释放85-90%的奥美卡替莫卡必尔;和
[0259]
在16小时内释放大于或等于90%的奥美卡替莫卡必尔。
[0260]
33.实施方案1至23、25、28、30和31中任一项的片剂制剂,其具有如下的奥美卡替莫卡必尔释放概况:
[0261]
在1小时内释放小于或等于25%的奥美卡替莫卡必尔;
[0262]
在2小时内释放35-45%的奥美卡替莫卡必尔;
[0263]
在8小时内释放75-80%的奥美卡替莫卡必尔;和
[0264]
在16小时内释放大于或等于85%的奥美卡替莫卡必尔。
[0265]
34.实施方案1至23、26和29至31中任一项的片剂制剂,其具有如下的奥美卡替莫卡必尔释放概况:
[0266]
在1小时内释放小于或等于10%的奥美卡替莫卡必尔;
[0267]
在2小时内释放25-35%的奥美卡替莫卡必尔;
[0268]
在8小时内释放70-75%的奥美卡替莫卡必尔;和
[0269]
在16小时内释放大于或等于78%的奥美卡替莫卡必尔。
[0270]
35.实施方案1-34中任一项的片剂制剂,其中在施用于患者后,该片剂制剂在患者中提供100-1000ng/ml的奥美卡替莫卡必尔的最大血浆浓度(cmax)。
[0271]
36.实施方案1至35中任一项的片剂制剂,其不包含(不含)ph调节剂。
[0272]
37.实施方案1至36中任一项的片剂制剂,其具有高达3mm的直径。
[0273]
38.治疗患有心力衰竭的患者的方法,其包括向该患者施用实施方案1至37中任一项的片剂制剂。
[0274]
39.实施方案38的方法,其中心力衰竭是急性的或慢性的。
[0275]
40.实施方案38的方法,其中心力衰竭是射血分数降低的心力衰竭(hfref)。
[0276]
41.实施方案38至40中任一项的方法,其中该患者是儿科患者。
[0277]
42.实施方案41的方法,其中向该儿科患者施用片剂制剂,其量为每天两次提供3-25mg的奥美卡替莫卡必尔。
[0278]
43.实施方案38至40中任一项的方法,其中该患者是吞咽困难的成年患者。
[0279]
44.实施方案43的方法,其中向该成年患者施用片剂制剂,其量为每天两次提供25mg或50mg的奥美卡替莫卡必尔。
[0280]
45.实施方案1至37中任一项的片剂制剂,其用于治疗心力衰竭。
[0281]
46.实施方案45的片剂制剂,其中心力衰竭是急性的或慢性的。
[0282]
47.实施方案45的片剂制剂,其中心力衰竭是射血分数降低的心力衰竭(hfref)。
[0283]
48.实施方案45至47中任一项的片剂制剂,其中该片剂制剂适合施用于儿科患者。
[0284]
49.实施方案48的片剂制剂,其中向该儿科患者施用片剂制剂,其量为每天两次提供3-25mg的奥美卡替莫卡必尔。
[0285]
50.实施方案45至47中任一项的片剂制剂,其中该片剂制剂适合施用于吞咽困难的成年患者。
[0286]
51.实施方案50的片剂制剂,其中向该成年患者施用片剂制剂,其量为每天两次提供25mg或50mg的奥美卡替莫卡必尔。
[0287]
52.实施方案1至37中任一项的片剂制剂在制备用于治疗心力衰竭的药物中的用途。
[0288]
53.实施方案52的用途,其中心力衰竭是急性的或慢性的。
[0289]
54.实施方案52的用途,其中心力衰竭是射血分数降低的心力衰竭(hfref)。
[0290]
55.实施方案52至54中任一项的用途,其中该片剂制剂适合施用于儿科患者。
[0291]
56.实施方案55的用途,其中向该儿科患者施用片剂制剂,其量为每天两次提供3-25mg的奥美卡替莫卡必尔。
[0292]
57.实施方案52至54中任一项的用途,其中该片剂制剂适合施用于吞咽困难的成
年患者。
[0293]
58.实施方案57的用途,其中向该成年患者施用片剂制剂,其量为每天两次提供25mg或50mg的奥美卡替莫卡必尔。
[0294]
59.制备实施方案1至37中任一项的片剂制剂的方法,其包括:
[0295]
将奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物、填充剂和粘合剂混合并粒化以形成颗粒状混合物;
[0296]
将该颗粒状混合物和粒化溶剂混合,并粒化以形成湿颗粒;
[0297]
干燥该湿颗粒以形成干燥颗粒;
[0298]
研磨该干燥颗粒以形成磨碎的颗粒;
[0299]
将该磨碎的颗粒、助流剂和润滑剂混合并压制该混合物以形成片芯;
[0300]
将该片芯与薄膜包衣预混合物混合以在片芯上提供薄膜包衣,和
[0301]
干燥包衣的片芯以形成片剂制剂,
[0302]
其中该薄膜包衣预混合物包含调释聚合物、增塑剂和薄膜包衣溶剂。
[0303]
60.实施方案59的方法,其中奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物、填充剂和粘合剂的混合使用高剪切制粒机进行。
[0304]
61.实施方案59或60的方法,其中该粒化溶剂包括水。
[0305]
62.实施方案59至61中任一项的方法,其中干燥颗粒的研磨使用冲击式研磨机进行。
[0306]
63.实施方案59至62中任一项的方法,其中逐步进行磨碎的颗粒、助流剂和润滑剂的混合,使得磨碎的颗粒和助流剂混合,然后将润滑剂与所得混合物混合。
[0307]
64.实施方案59至63中任一项的方法,其中该薄膜包衣溶剂包括丙酮、水或其混合物。
[0308]
65.实施方案64的方法,其中该薄膜包衣溶剂包括丙酮和水。
[0309]
66.实施方案65的方法,其中该薄膜包衣溶剂包括9∶1的丙酮∶水。
[0310]
67.实施方案59至66中任一项的方法,其中在流化床包衣机中进行片芯和薄膜包衣预混合物的混合。
[0311]
68.制备实施方案1至37中任一项的片剂制剂的方法,其包括
[0312]
将奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物、填充剂和粘合剂混合并粒化以形成颗粒状混合物;
[0313]
将该颗粒状混合物研磨以形成磨碎的颗粒;
[0314]
将该磨碎的颗粒、助流剂和润滑剂混合并压制该混合物以形成片芯;
[0315]
将该片芯与薄膜包衣预混合物混合以在片芯上提供薄膜包衣,和
[0316]
干燥包衣的片芯以形成片剂制剂,
[0317]
其中该薄膜包衣预混合物包含调释聚合物、增塑剂(当存在时)和薄膜包衣溶剂。
[0318]
69.制备实施方案1至37中任一项的片剂制剂的方法,其包括:
[0319]
将奥美卡替莫卡必尔、其药学上可接受的盐、或其药学上可接受的盐的药学上可接受的水合物、填充剂、粘合剂、助流剂和润滑剂混合并压制该混合物以形成片芯;
[0320]
将该片芯与薄膜包衣预混合物混合以在片芯上提供薄膜包衣,和
[0321]
干燥包衣的片芯以形成片剂制剂,
[0322]
其中该薄膜包衣预混合物包含调释聚合物、增塑剂(当存在时)和薄膜包衣溶剂。
实施例
[0323]
以下实施例进一步说明了公开的片剂制剂和方法,但当然不应解释为以任何方式限制其范围。
[0324]
实施例中使用了以下缩写:ir是指常释;om是指奥美卡替莫卡必尔;mcc是指微晶纤维素;hpc是指羟丙基纤维素;ca是指乙酸纤维素;peg是指聚乙二醇;ssnmr是指固态核磁共振;av是指接受值;pk是指药代动力学;glsm是指几何最小二乘均值;ci是指置信区间;和cv是指变异系数。
[0325]
图2描述了制造常释微型片剂片芯的示例性方法。该说明性方法包括以下步骤:1)在高剪切湿法制粒机中混合过筛的颗粒内组分;2)在递送纯净水的同时将颗粒内组分粒化;3)将湿物料烘干至预定的干燥失重值(lod);4)使用冲击式研磨机研磨干燥的颗粒;5)在滚筒搅拌机中将磨碎的颗粒与预筛分的胶体二氧化硅混合;6)将步骤5)的产物与预筛分的硬脂酸镁混合;和7)使用旋转压片机压制最终混合物,其中在整个压制过程中监测片剂外观、重量、厚度和硬度。
[0326]
图5和10描述了包衣常释微型片芯的示例性方法。该说明性方法包括以下步骤:1)在流化床包衣机中用mr包衣对微型片芯进行薄膜包衣;2)在流化床干燥器中干燥包衣的微型片剂;和3)通过筛子筛选干燥的微型片剂。示例性的包衣工艺以0.15kg规模(图5)或4kg规模(图10)进行。
[0327]
实施例1
[0328]
微型片剂片芯.该实施例展示了根据公开的片剂制剂的一个方面的含有奥美卡替莫卡必尔二盐酸盐一水合物的片芯。特别地,该实施例说明了不包含(不含)ph调节剂的微型片芯和包含ph调节剂的片芯。
[0329]
使用上面一般实施例部分中描述的方法制备了包含表1中列出的组分的三种片剂片芯(片芯1a-1c)。颗粒内组分由奥美卡替莫卡必尔二盐酸盐一水合物、微晶纤维素(mcc,avicel ph 101)和乳糖一水合物(impalpable 313)、羟丙基纤维素(hpc,klucel exf)和任选的富马酸组成(片芯1b和1c)。颗粒外组分由胶体二氧化硅和硬脂酸镁组成。
[0330]
使用不同量的富马酸作为ph调节剂制备微型片剂片芯。虽然片芯1a基本上不含富马酸,但片芯1b的富马酸与奥美卡替莫卡必尔的重量比为1∶1,并且片芯1c的富马酸与奥美卡替莫卡必尔的重量比为2∶1。
[0331]
表1.奥美卡替莫卡必尔二盐酸盐一水合物1mg ir微型片剂片芯
[0332][0333]a根据“理论游离碱当量”调整片剂制剂中的原料药:81.53%。
[0334]
对片芯1a-1c以及相应的颗粒进行分析表征。结果如图3和图4所示。
[0335]
图3和图4描绘了常释颗粒和常释微型片剂片芯的
19
f固态nmr(ssnmr)光谱。结果表明,奥美卡替莫卡必尔二盐酸盐一水合物在制造过程中是稳定的,并且在制造过程中物理形态没有变化。
[0336]
实施例2
[0337]
调释包衣.该实施例展示了根据公开的片剂制剂的一个方面的调释包衣。
[0338]
得自实施例1的片剂片芯(片芯1a-1c)用包含70∶30 ca∶peg的调释(mr)包衣进行包覆,以达到各种目标包衣增重(即10%、15%或20%增重)。将含有乙酸纤维素和聚乙二醇的mr包衣制备成5重量%的丙酮∶水(9∶1)溶液。使用流化床包衣机对片芯进行包覆。
[0339]
通过美国药典(usp)ii方法使用以下参数确定mr包衣的微型片剂的溶出概况:仪器为usp《711》仪器ii(paddle);容器尺寸/类型为1000ml透明玻璃,圆底;转速为75rpm;培养基体积为500ml;测试温度为37.0
±
0.5℃;溶出介质为磷酸盐缓冲液(ph 6.8);并且采样时间点为1、2、3、4、6、8、12、16和24小时。使用高效液相色谱法(hplc)使用以下条件分析测试溶液:泵为等梯度的;反相柱(例如x-bridge,150x3mm(id),c18,3.5μm粒径,可由waters
购得);uv检测(235nm);进样量75μl;流速0.5ml/min;柱温30℃;自动进样器温度为环境温度;并且运行时间为6分钟。
[0340]
结果如图6-8所示。
[0341]
图6显示了含有1mg奥美卡替莫卡必尔一水合物的常释微型片剂片芯(分别用70∶30 ca∶peg包覆至10%包衣增重)在ph 6.8缓冲液中的溶出概况。该溶出概况表明常释微型片剂片芯中的富马酸不会增强奥美卡替莫卡必尔在ph 6.8缓冲液中的释放。
[0342]
图7显示了含有1mg奥美卡替莫卡必尔一水合物的常释微型片剂片芯(分别用70∶30 ca∶peg包覆至15%包衣增重)在ph 6.8缓冲液中的溶出概况。该溶出概况表明微型片剂片芯中的富马酸不会增强奥美卡替莫卡必尔在ph 6.8缓冲液中的释放。
[0343]
图8显示了含有1mg奥美卡替莫卡必尔一水合物的常释微型片剂片芯(分别用70∶30 ca∶peg包覆至20%包衣增重)在ph 6.8缓冲液中的溶出概况。该溶出概况表明富马酸不会增强奥美卡替莫卡必尔在ph 6.8缓冲液中的释放。
[0344]
溶出度研究结果表明常释微型片剂片芯中不需要富马酸。
[0345]
实施例3
[0346]
调释包衣.该实施例展示了根据公开的片剂制剂的一个方面的调释包衣。
[0347]
将得自实施例1的片剂片芯1b用包含乙酸纤维素和peg的两种不同的mr包衣包覆至增重10%。该包衣组合物具有70∶30或50∶50的ca∶peg比率。使用实施例2中描述的方法测定mr包衣的微型片剂的溶出概况。溶出度研究的结果如图9所示。
[0348]
如图9所示,溶出概况显示与包含70∶30 ca∶peg的包衣相比,包含50∶50 ca∶peg的包衣增重10%并没有显著增加奥美卡替莫卡必尔释放。不希望受任何特定理论的束缚,相信在更高的包衣增重时不会观察到该结果。在相同和更高的包衣增重下,预计包含50∶50 ca∶peg包衣的奥美卡替莫卡必尔释放速度比包含70∶30 ca∶peg包衣的释放速度更快,因此,使用包含50∶50 ca∶peg的包衣,奥美卡替莫卡必尔释放速率对包衣增重的敏感性较低。包含50∶50 ca∶peg的包衣对包衣增重的敏感性较低,因此释放速率稳定。然而,使用50∶50 ca∶peg包衣需要更多的包衣增重才能实现较慢的释放速率。更多的包衣增重会导致较低的制造效率,因为更多的包衣增重将需要更长的包覆时间。
[0349]
为了平衡包衣工艺效率和释放速率稳定性以及参考图6-9中呈现的溶出概况,选择包含60∶40 ca∶peg的包衣以不同的包衣增重对奥美卡替莫卡必尔常释微型片剂进行包覆,以实现目标奥美卡替莫卡必尔释放概况。
[0350]
实施例4
[0351]
片剂制剂.该实施例展示了公开的片剂制剂的实施方案。
[0352]
表2和表3显示了包含常释微型片剂片芯和mr包衣的片剂制剂。根据图2所示的方法制备片剂片芯,并使用图10所示的方法对片芯进行包衣。
[0353]
表2.奥美卡替莫卡必尔常释微型片剂片芯
[0354][0355][0356]a根据“理论游离碱当量”调整片芯中的原料药:81.53%。
[0357]
表3.用于奥美卡替莫卡必尔ir微型片剂片芯的mr薄膜包衣组合物
[0358][0359]
注:丙酮和水以90∶10的重量比用作包衣溶剂。mr包衣预混合物含有5-10%的固体和90-95%的溶剂(按重量计)。
[0360]
实施例5
[0361]
体外释放速率.通过用mr包衣将常释微型片剂片芯包覆至三种不同的增重,开发了具有三种体外释放速率的片剂制剂。使用图2中描述的方法制备了两批(10kg和20kg)常释微型片剂片芯。如表4a和4b所示,使用图10中描述的方法将实施例4的常释微型片剂片芯用mr包衣进行包覆,以达到10%、15%或30%的目标增重,从而分别实现奥美卡替莫卡必尔的快速、中速和缓慢释放。表4a列出了相对于片芯重量的重量百分比。表4b列出了相对于片剂制剂的总重量的重量百分比。
[0362]
表4a.包含奥美卡替莫卡必尔的mr片剂制剂(相对于片芯的重量%)
[0363][0364][0365]a二盐酸盐一水合物盐和游离碱的分子量分别为492.37和401.43g/mol。使用的量可以通过原料药批次的分析来调整。
[0366]b在制造过程中蒸发。
[0367]
表4b.包含奥美卡替莫卡必尔的mr片剂制剂(相对于总片剂制剂的重量%)
[0368][0369][0370]
表5和表6显示了两个批次的常释微型片剂片芯和mr包衣的微型片剂的表征数据。数据显示,常释微型片剂片芯和mr包衣的微型片剂均符合目标片剂重量、片剂硬度、含量和均匀度值。图11显示了两个批次的三种释放速率(快速、中速和缓慢)的比较。这些结果表明两个批次的释放速率一致。
[0371]
表5.om二盐酸盐一水合物1mg ir微型片剂片芯
[0372][0373]
表6.om二盐酸盐一水合物1mg mr微型片剂的表征
[0374][0375][0376]
实施例6
[0377]
稳定性研究.将实施例5中制备的mr微型片剂包装在具有热感应密封和聚丙烯crc的45cc hdpe瓶(150个)中。长期监测药品稳定性(5℃)并加速(25℃/60%rh)24个月。表7和图12总结了长达1个月的稳定性结果。
[0378]
在以下条件下使用hplc进行杂质测定:反相柱(例如,x-bridge,150x3mm(id),c18,3.5μm粒径,可由waters购得);uv检测(235nm);进样量20μl;流速0.45ml/min;柱温30℃;自动进样器温度为环境温度;并且使用以下梯度条件,运行时间为26分钟:
[0379]
时间(min)流动相a(%)流动相b(%)09283.092815.5505018.5208020.5208020.692826.0928
[0380]
其中流动相a是0.2%氢氧化铵的水溶液(例如,2ml氢氧化铵并用纯化的过滤水
milli-q稀释至1000ml)。流动相b是0.2%氢氧化铵的乙腈溶液(例如,2ml氢氧化铵并用乙腈稀释至1000ml)。
[0381]
结果表明,在储存条件下1个月后外观、含量、含水量和溶出度无显著变化。
[0382]
[0383][0384]
实施例7
[0385]
体内研究.该研究的主要目的是评估在健康成人受试者中单次施用以下后om的药
代动力学(pk):25mg(1
×
25mg)调释(mr)片剂制剂,25mg(25
×
1mg)缓释微型片剂制剂,25mg(25
×
1mg)速释微型片剂制剂,6mg(6
×
1mg)缓释微型片剂制剂和6mg(6
×
1mg)速释微型片剂制剂。
[0386]
该研究的次要目的是评估单次6mg剂量(作为微型片剂施用)或25mg剂量(作为mr片剂或微型片剂施用)om施用于健康成人受试者的安全性和耐受性。
[0387]
该研究是一项1期、单中心、开放标签、随机、5-阶段、4-序列交叉研究,旨在调查所公开的片剂制剂和om的常规mr片剂制剂在健康男性和健康女性成年受试者中的药代动力学、安全性和耐受性。在第一次施用前21天内对受试者进行筛选以评估参加研究的资格。受试者在第1天进入临床研究单位,并在第1至第5阶段被限制在临床研究单位,直到研究结束时出院。在随机分为4个治疗序列中的1个后,受试者在每个治疗期的第1天接受5种治疗中的1种,所有受试者接受所有5种治疗。在预定时间点收集血液以表征om的血浆浓度。在整个研究过程中进行了安全性和耐受性监测。
[0388]
研究设计
[0389]
多达20名受试者(每个序列5名)参加了该研究。进入研究的所有20名受试者的数据都包括在pk和安全性分析中。根据纳入和排除标准选择健康的男性或女性受试者。将受试者分配到以下五个治疗组(a-e)之一:
[0390]
治疗组a:25mg(1
×
25mg)om mr片剂;
[0391]
治疗组b:25mg(25
×
1mg)om缓释微型片剂;
[0392]
治疗组c:25mg(25
×
1mg)om速释微型片剂;
[0393]
治疗组d:6mg(6
×
1mg)om缓释微型片剂;和
[0394]
治疗组e:6mg(6
×
1mg)om速释微型片剂。
[0395]
在用大约8盎司(240ml)的水隔夜禁食至少10小时后口服施用。受试者收到指示该片剂不得破碎或咀嚼,并且所有微型片剂的施用应在5分钟内完成。在每个治疗期的第1天施用单次口服剂量,两种治疗之间至少间隔7天。所有受试者接受5种治疗中的每一种的单剂量。
[0396]
药代动力学
[0397]
收集血样用于分析om的血浆浓度。由om的血浆浓度确定的pk参数如下:最大血浆浓度(c
max
),从零时间到最后可量化浓度时间(auc
last
)的血浆浓度-时间概况下面积(auc),auc从零到无穷大(auc
inf
),最大血浆浓度时间(t
max
),和表观末端消除半衰期(t
1/2
),由于从最后可测量浓度的时间外推到无穷大而得到的auc
inf
百分比(%auc
extrap
),消除速率常数(λz),消除相末端的相关系数(r2);确定λz时包含的数据点数(点数),指数拟合的开始和结束之间的差除以t
1/2
(λz跨度比),终相的下限(指数拟合的开始),终相的上限(指数拟合的结束)。
[0398]
安全性
[0399]
安全性分析包括在研究期间监测不良事件、临床实验室评估、12导联心电图(ecg)和生命体征。
[0400]
在本研究中,当以25mg(1
×
25mg)mr片剂制剂、25mg(25
×
1mg)缓释微型片剂制剂、25mg(25
×
1mg)速释微型片剂制剂、6mg(6
×
1mg)缓释微型片剂制剂和6mg(6
×
1mg)速释微型片剂制剂的形式施用于健康成人受试者时,单剂量的om是安全且耐受良好,当施用于健
康受试者时是安全且耐受性良好。所有不良事件的严重程度都很轻微,并在研究结束时得到解决。没有严重的不良事件,也没有因治疗引起的不良事件导致受试者过早退出研究。7名受试者报告了8种治疗中出现的不良事件,研究者认为这些不良事件与om相关,包括肌痛、头晕、肋软骨炎、肌肉抽搐和非心源性胸痛。在研究期间,在临床实验室评估、生命体征或12导联心电图中没有临床意义的发现。
[0401]
统计分析
[0402]
通过将测试治疗组与参考组的auc
last
、aucinf和c
max
进行比较,进行统计分析以研究不同om制剂对pk的生物利用度。治疗比较分别如下,两种情况均以治疗组a为参考:
[0403]
1.om,25
×
1mg口服缓释微型片剂(治疗组b)与om,1
×
25mg口服mr片剂(治疗组a)对比
[0404]
2.om,25
×
1mg口服速释微型片剂(治疗组c)与om,1
×
25mg口服mr片剂(治疗组a)对比。
[0405]
使用混合模型分析自然对数(ln)转换的pk参数。该模型包括作为固定效应的治疗和序列,以及作为随机效应嵌套在序列中的受试者。
[0406]
对于每个pk参数,分别计算每个治疗组的最小二乘均值(lsm)、测试和参考治疗组之间的lsm差异以及相应的90%置信区间(ci);然后将这些值进行回变换以给出几何lsm(glsm)、glsm的比率和相应的90%ci。
[0407]
此外,计算受试者内变异系数(cv)的汇总估计值(跨所有治疗组),并生成残差图以评估拟合模型的充分性。
[0408]
列出了所有安全数据。通过治疗、严重程度和与研究药物的关系总结了治疗中出现的不良事件。根据治疗、系统器官分类和监管活动医学词典的首选术语总结了治疗出现的不良事件的频率。没有计划进行推论统计分析。
[0409]
研究结果总结在表8和表9中。
[0410]
表8.om的血浆药代动力学参数估计总结(n=20)
[0411][0412]1n=17
[0413]
表9.om血浆药代动力学参数估计的统计分析1总结(n=20)
[0414][0415][0416]1模型:ln(参数)=治疗+序列+随机误差;该比例和ci是通过在自然对数(1n)尺度上取相应差异和ci的指数来获得的。
[0417]2cv是指“变异系数”[0418]
如表8和9所示,在施用25x1mg om缓释微型片剂后,与施用单片25mg om mr片剂相比,中位om t
max
出现得更早,尽管t
max
值的范围相似。两个治疗组之间的几何平均auc
last
和auc
inf
值相似,而与单片25mg om mr片剂相比,施用25
×
1mg om缓释微型片剂后c
max
更高。om的算术平均t
1/2
值在2个治疗组之间相似(表8和图15a-16b)。对于auc
last
、auc
inf
和c
max
,与单片25mg om mr片剂相比,25x1mg om缓释微型片剂的glsm比率(测试/参考组)分别为0.9980、0.9998和1.2858(表9)。
[0419]
施用25
×
1mg om速释微型片剂后,与施用单片25mg om mr片剂相比,中位om t
max
出现得更早。与施用单片25mg om mr片剂相比,施用25mg om速释微型片剂后的暴露量(基于几何平均auc和c
max
)更高。om的算术平均t
1/2
值在2个治疗组之间相似(表8和图15a-16b)。对于auc
last
、auc
inf
和c
max
,与单片25mg om mr片剂相比,25x 1mg om速释微型片剂的glsm比率(测试/参考组)分别为1.2560、1.2503和2.2136(表9)。
[0420]
如表8所示,在施用6x1mg om缓释微型片剂后,与施用6x1mg om速释微型片剂相比,中位om t
max
在2小时后出现。与6mg om缓释微型片剂剂量相全,施用6mg om速释微型片剂后的暴露量(基于几何平均auc和c
max
)更高。om的算术平均t
1/2
值在2个治疗组之间相似。
[0421]
如表8和9所示的数据表明,当om作为25
×
1mg om缓释微型片剂施用时,auc
last
、auc
inf
和c
max
分别是单片25mg om mr片剂的0.9980、0.9998和1.2858倍。而且,当om作为25
×
1mg om速释微型片剂施用时,auc
last
、auc
inf
和c
max
分别是单片25mg om mr片剂的1.2560、1.2503和2.2136倍。
[0422]
当以25mg(1
×
25mg)mr片剂制剂、25mg(25
×
1mg)缓释微型片剂制剂、25mg(25
×
1mg)速释微型片剂制剂、6mg(6
×
1mg)缓释微型片剂制剂和6mg(6
×
1mg)速释微型片剂制剂施用时,单次口服剂量om是安全的,并且健康成人受试者耐受性良好。
[0423]
所有治疗中出现的不良事件的严重程度都很轻微,并在研究结束时得到解决。没有导致研究中止的严重不良事件或治疗中出现的不良事件。
[0424]
本文引用的所有参考文献,包括出版物、专利申请和专利,均以相同的程度通过引用并入本文,就好像每篇参考文献单独且具体地表明以引用的方式并入,并在此全文阐述一样。
[0425]
在描述本发明的上下文中(尤其是在以下权利要求的上下文中)使用术语“一个”以及“该”和“至少一个”以及类似的指称应解释为涵盖单数和复数,除非本文另有说明或与上下文明显矛盾。除非本文另有说明或明确说明,否则使用术语“至少一个”后跟一个或多个项目的列表(例如,“a和b中的至少一个”)应解释为表示从所列项目中选择的一个项目(a或b)、或者所列项目中的两个或多个的任意组合(a和b)。除非另有说明,否则术语“含有”、“具有”、“包括”和“包含”将被解释为开放式术语(即,意思是“包括但不限于”)。除非在本文中另有说明,否则本文中数值范围的列举仅旨在用作单独引用落入该范围内的每个单独值的速记方法,并且每个单独的值被并入说明书中,就好像它在本文中单独列举一样。除非本文另有说明或与上下文明显矛盾,否则本文所述的所有方法都可以任何合适的顺序进行。除非另有声明,否则本文提供的任何和所有实施例或示例性语言(例如,“如”)的使用仅旨在更好地阐明本发明并且不对本发明的范围构成限制。说明书中的任何语言都不应被解释为表明任何未要求保护的元素对于本发明的实践是必不可少的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1