包含胎儿附属物来源组织细胞培养上清的脑神经损伤治疗剂
1.本发明涉及一种包含胎儿附属物来源组织细胞的培养上清的脑损伤治疗剂。
背景技术:
2.围产期的新生儿脑损伤是一种疾病,每1000名新生儿中就会有1~2人并发,这种疾病会导致此后的终身脑性瘫痪,不仅对本人,对抚养家庭也会造成沉重的负担。
3.导致脑性瘫痪的围产期脑损伤包括缺氧缺血性脑病、脑出血、脑室周围白质软化等,这些主要病症的炎症病症是细胞内ca升高、线粒体功能障碍引起的活性氧升高、巨噬细胞活性化及伴随其的高细胞因子血症。早产儿尤其容易并发脑出血,症状最重,生命预后差。
4.低温疗法被认为是一种有效的治疗方法,但据说在接受治疗的8~9名儿童中只有1名有效。并且,目前除了低温疗法外,没有确定的治疗方法。
5.到目前为止,已经推进了将自体骨髓来源的间充质干细胞直接给予脑性瘫痪患者的临床研究,并报道了其有效性(非专利文献1)。另外,虽然有给予脐带来源细胞的报道,但一部分运动机能并没有得到显著改善(非专利文献2)。并且,有报告称,通过向新生儿脑出血模型小鼠给予脐带血来源细胞,显著改善了运动机能障碍(专利文献1)。另外,也有报道称,将脐带和胎盘来源细胞移植到视神经损伤的小鼠模型中,可以促进视神经的再生长(专利文献2)。
6.现有技术文献
7.非专利文献
8.非专利文献1:cytotherapy 2013 dec;15(12):1549-62
9.非专利文献2:cytotherapy 2015 17(2):224-231
10.专利文献
11.专利文献1:国际公开第2017/204231号
12.专利文献2:日本专利特表2007-521793号公报。
技术实现要素:
13.发明要解决的技术问题
14.在由脑出血或缺血等引起的脑神经损伤中,不仅要治疗出血或缺血,还要促进由于该原因而受损的神经细胞等的保护或再生。为了此类神经细胞等的保护或再生,考虑给予脐带来源的细胞,但根据从脐带采集的方法、所得的细胞特性也不同,从而不清楚来自脐带的所有细胞或者所有供体是否都会有这种效果。另外,在脑神经损伤中,虽然设想通过腰椎穿刺进行蛛网膜下腔给药,但是这种给药方法具有高风险,因此提供一种给药途径更容易且有效的治疗剂成为问题。
15.解决技术问题的技术方案
16.发明人对上述技术问题进行了深入的研究,结果发现了胎儿附属物来源组织细胞
的培养上清,通过促进脑神经前体细胞的增殖生存,向脑损伤部位的归巢,脑神经前体细胞的分化成熟,可以再生脑神经、对脑神经损伤有一定的疗效,从而完成了本发明。
17.即,本发明涉及下述内容:
18.(1)一种脑神经损伤治疗剂,包含作为有效成分的胎儿附属物来源组织细胞的培养上清。
19.(2)根据(1)所述的脑神经损伤治疗剂,其中,胎儿附属物来源组织细胞是脐带细胞、胎盘细胞、卵膜细胞、绒毛膜细胞、羊膜细胞、或其组合。
20.(3)根据(1)或(2)所述的脑神经损伤治疗剂,其中,胎儿附属物来源组织细胞是华通氏胶来源间充质细胞、羊膜来源间充质细胞、绒毛膜来源间充质细胞、或其组合。
21.(4)根据(1)~(3)中任一项所述的脑神经损伤治疗剂,其中,培养上清中含有细胞因子和趋化因子。
22.(5)根据(1)~(4)中任一项所述的脑神经损伤治疗剂,其中,包含il-6、cxcl1、cxcl7、cxcl8和ccl2。
23.(6)根据(1)~(5)中任一项所述的脑神经损伤治疗剂,其中,培养上清是将胎儿附属物来源组织细胞培养1-3天得到的。
24.(7)根据(1)~(6)中任一项所述的脑神经损伤治疗剂,其中,培养开始时胎儿附属物来源组织细胞的密度为5
×
10
4-5
×
106个/ml。
25.(8)根据(1)~(7)中任一项所述的脑神经损伤治疗剂,其中,所述脑神经损伤是非遗传性疾病的脑神经损伤。
26.(9)根据(1)~(8)中任一项所述的脑神经损伤治疗剂,其中,脑神经疾病是运动障碍(左旋多巴诱导的异动症、慢性或迟发性运动障碍、或口面运动障碍)、下肢不宁综合征(药物诱发性或特发性)、药物诱发性肌张力障碍、舞蹈病(亨廷顿病、毒素诱发性舞蹈病、小舞蹈病(sydenham)、妊娠舞蹈病、威尔逊病、药物诱发性舞蹈病、或代谢性或内分泌性舞蹈病)、面部痉挛(运动性、语音性、单纯性、复杂性或图雷特综合征等)、肌张力障碍(急性、全身性、局灶性、节段性、性的、中间性、心因性或急性肌张力障碍反应等)、sodemytopic帕金森病、刻板运动障碍(自闭症、遗传性或儿童相关运动障碍等)、强迫性障碍、嗜睡症(猝倒等)、传染性海绵状脑病(克罗伊茨费尔特-雅各布病或库鲁病等)、痴呆症(阿尔茨海默病、路易体痴呆、血管性痴呆、匹克氏病或酒精性痴呆等)、神经棘红细胞增多症、发作或痉挛、手足徐动症(亨廷顿病、呼吸停止、新生儿黄疸或脑卒中相关等)、或儿童脑性瘫痪。
27.(10)一种(1)~(9)中任一项所述的脑神经损伤治疗剂的制备方法,包含(a)培养胎儿附属物来源组织细胞的工序,以及(b)回收所述胎儿附属物来源的组织细胞的培养上清的工序。
28.(11)一种药物组合物,包含(1)-(9)中任一项所述的脑神经损伤治疗剂。
29.(12)根据(11)所述的药物组合物,其为冻干制剂。
30.(13)一种脑神经再生促进剂,该促进剂包含作为有效成分的胎儿附属物来源组织细胞的培养上清。
31.(14)根据(13)所述的脑神经再生促进剂,其中,胎儿附属物来源组织细胞是脐带细胞、胎盘细胞、卵膜细胞、绒毛膜细胞、羊膜细胞、或其组合。
32.(15)根据(13)或(14)所述的脑神经再生促进剂,其中,胎儿附属物来源组织细胞
是华通氏胶来源间充质细胞、羊膜来源间充质细胞、绒毛膜来源间充质细胞、或其组合。
33.(16)根据(13)~(15)中任一项所述的脑神经再生促进剂,其中,脑神经再生促进剂为脑神经前体细胞生长生存促进剂、脑神经前体细胞归巢促进剂、脑神经前体细胞分化成熟促进剂、或其组合。
34.(17)根据(13)~(16)中任一项所述的脑神经再生促进剂,其中,培养上清中含有细胞因子和趋化因子。
35.(18)根据(13)~(17)中任一项所述的脑神经再生促进剂,其中,包含il-6、cxcl1、cxcl7、cxcl8和ccl2。
36.(19)根据(13)~(18)中任一项所述的脑神经再生促进剂,其中,培养上清将胎儿附属物来源组织细胞培养1-3天得到。
37.(20)根据(13)~(19)中任一项所述的脑神经再生促进剂,其中,培养开始时的分娩后来源组织的密度为5
×
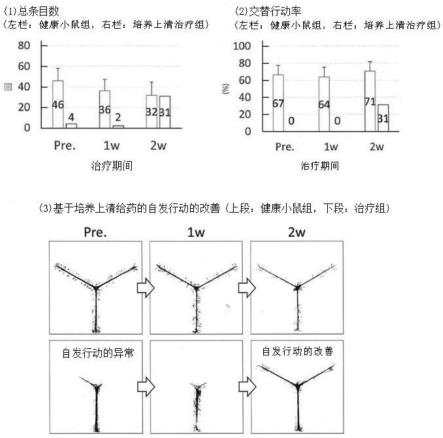
10
4-5
×
106个/ml。
38.(21)根据(13)~(20)中任一项所述的脑神经再生促进剂,其中,脑神经再是由非遗传性疾病的脑神经损伤引起。
39.(22)根据(13)~(21)中任一项所述的脑神经再生促进剂,其中,脑神经再生是由运动障碍(左旋多巴诱导的异动症、慢性或迟发性运动障碍、或口面运动障碍)、下肢不宁综合征(药物诱发性或特发性)、药物诱发性肌张力障碍、舞蹈病(亨廷顿病、毒素诱发性舞蹈病、小舞蹈病(sydenham)、妊娠舞蹈病、威尔逊病、药物诱发性舞蹈病、或代谢性或内分泌性舞蹈病)、面部痉挛(运动性、语音性、单纯性、复杂性或图雷特综合征等)、肌张力障碍(急性、全身性、局灶性、节段性、性的、中间性、心因性或急性肌张力障碍反应等)、sodemytopic帕金森病、刻板运动障碍(自闭症、遗传性或儿童相关运动障碍等)、强迫性障碍、嗜睡症(猝倒等)、传染性海绵状脑病(克罗伊茨费尔特-雅各布病或库鲁病等)、痴呆症(阿尔茨海默病、路易体痴呆、血管性痴呆、匹克氏病或酒精性痴呆等)、神经棘红细胞增多症、发作或痉挛、手足徐动症(亨廷顿病、呼吸停止、新生儿黄疸或脑卒中相关等)、或儿童脑性瘫痪引起。
40.(23)一种(13)~(22)中任一项所述的脑神经再生促进剂的制备方法,包含(a)培养胎儿附属物来源组织细胞的工序以及(b)回收所述胎儿附属物来源的组织细胞的培养上清的工序。
41.(24)一种药物组合物,其包含(13)~(22)中任一项所述的脑神经再生促进剂。
42.(25)根据(24)所述的药物组合物,其为冻干制剂。
43.发明效果
44.根据本发明,可以提供一种脑神经损伤的治疗剂,其包含胎儿附属物来源组织细胞的培养上清。该制剂通过混合多供体细胞培养上清来制备均质的脑神经损伤治疗剂,与含细胞的制剂相比,更易于制备、储存、给药。
45.附图的简单说明
46.图1为基于华通氏胶来源间充质细胞和神经前体细胞共培养的神经再生。(2)当共同培养时,(1)与单独培养相比,在培养的第3天和第7天神经前体细胞的生长或维持生存、迁移(游走)和分化成熟得到了增强。
47.图2为基于华通氏胶来源间充质细胞培养上清的神经再生(体外)。(2)当添加培养上清时,(1)与仅添加培养基相比,在培养的第3天和第7天神经前体细胞的维持生存、迁移
(游走)和分化成熟得到了增强。
48.图3为基于华通氏胶来源间充质细胞培养上清的治疗(1)。将培养上清施用于缺氧处理的小儿脑瘫小鼠模型(左栏),与仅给予培养基(右栏)相比,改善了y-maze试验中的(1)总条目数、(2)交替行为率。(3)y-maze试验中健康小鼠(上段)和通过培养上清的施用治疗的小鼠(下段)的自发行为的模式。
49.图4为基于华通氏胶来源间充质细胞培养上清的治疗(2)。治疗前(pre),缺氧处理的小儿脑瘫小鼠模型组(右栏)与健康组(左栏)相比,旋转杆试验中的运动功能下降。经过两周的治疗后(2w),以及之后两周的停药后(4w),将培养上清施用于缺氧处理的小儿脑瘫小鼠模型的治疗组(右栏)与对照组(中栏)相比,旋转杆试验的运动功能得到了显著的恢复(p《0.05,tukey检验),与健康组(左栏)等同。
具体实施方式
50.以下将根据具体的实施方式对本发明进行详细说明。但是,本发明并不限于以下的实施方式,在不脱离本发明精神的范围内,本发明可以任意的方式实施。
51.另外,本发明中引用的专利公报、专利申请公开公报、以及非专利文献等,出于所有目的,其整体通过引用并入本发明。
52.本发明中,适用于数值的“~”是指在规定的参考值以上、且在规定的参考值以下的范围内的数值范围。
53.1.胎儿附属物来源组织
54.在本发明中,“胎儿附属物来源组织”(也称为“分娩后来源组织”)是指分娩时被摘出的一组组织,包括脐带、卵膜(由羊膜、绒毛膜、脱落膜构成)、胎盘等。本发明的胎儿附属物来源组织,只要是从哺乳动物采取的胎儿附属物来源组织就不受特别的限制,例如灵长类哺乳动物的胎儿附属物来源组织。更优选人的胎儿附属物来源组织。
55.在本发明中,“脐带”是指连接胎儿和胎盘的白色管状组织,是不含胎盘的组织。作为脐带的实质部分的“华通氏胶”是指胚外中胚叶来源的结缔组织,通过覆盖两条脐动脉和脐静脉来保护脐带。本发明的脐带只要是从哺乳动物采取的脐带就不受特别的限制,例如为灵长类哺乳动物的脐带。更优选人的脐带。
56.在本发明中,“卵膜”是指包裹羊水的膜。卵膜不是一片膜,而是由子宫内膜变化的“蜕膜”、“绒毛膜”和“羊膜”三层组成。本发明的卵膜只要是从哺乳动物采取的卵膜就不受特别的限制,例如为灵长类哺乳动物的卵膜。更优选人的卵膜。另外,可以相互分离使用作为卵膜的内层的羊膜,中层的绒毛膜,作为外层的蜕膜,也可以将这些膜组织组合使用。
57.在本发明中,“胎盘”是指可从产后母体获得的胎盘组织。胎盘可以在分娩后容易摘出,但优选使用在脐带血库分离采取脐带血后,在知情的情况下获得的人类胎盘。更优选使用掌握了感染症等的检查结果等详细情况的上述胎盘。本发明的胎盘不限于来自哺乳类采取的胎盘,例如为灵长类哺乳动物的胎盘。更优选人的胎盘。
58.在本发明中,“胎儿附属物来源组织细胞”(也称为“分娩后来源组织细胞”)是指从胎儿附属物来源组织通过物理和/或酶处理获得的细胞,与特别分离的干细胞不同。胎儿附属物来源组织细胞与脐带血或源自胎儿附属物来源组织的各种干细胞不同,不需要多代传代培养或详细的细胞分化,因此容易制备。
59.2.胎儿附属物来源组织的回收以及处理
60.一般来说,在出生后其分娩后立即回收胎儿附属物来源组织。在优选实施方案中,胎儿附属物来源组织在知情的情况下从供体,或通过脐带血库回收。优选获得供体的感染等病史或检查结果并与胎儿附属物来源组织相关联。可使用此类病史来限制胎儿附属物来源组织或从中采取的胎儿附属物来源组织细胞的用途。
61.优选在回收胎儿附属物来源组织细胞之前,去除和/或洗涤脐带血和胎盘血等血液。在某些实施方案中,例如,回收在胎盘中的脐带血。对此可以实施已知的脐带血回收步骤。通常情况下,用针或插管在流动注射的情况下从胎盘采血(例如,参考anderson,美国专利5,372,581号;hessel等,美国专利第5,415,665号)。针或插管通常配置在脐静脉中,可轻轻按摩胎盘,便于脐带血从胎盘流出。优选胎盘在没有进一步操作的情况下通过流动注射出血,以使脐带血回收时的组织破坏最小。
62.哺乳动物的胎儿附属物来源的组织或其一部分可大致如上所述进行回收和制备,然后可以用本领域已知的任意方法处理,例如可以灌流、洗涤、切碎、破坏或粘附在培养容器上,例如可以细切后用一个或多个组织破坏酶消化,或粘附在培养容器而获得胎儿附属物来源的组织细胞。
63.在一实施方式中,通过对部分或全部器官的物理破坏,从哺乳动物胎儿附属物来源组回收细胞。例如,胎儿附属物来源组织,或其一部分可以进行例如,破碎、切断、细分、切丁、切丝、切碎、筛网等。通常情况下,胎儿附属物来源组织可以通过浸渍于例如,培养基、生理盐水等不损害细胞生存的溶液中进行破坏。然后可以培养组织,以获得粘附性胎儿附属物来源组织细胞群。
64.经物理破坏和/或酶的消化以及细胞回收之前,可以将胎儿附属物来源组织切割成单独的组织。例如,可以以获得羊膜、绒毛膜等卵膜、脐带、胎盘叶、或其任意组合的全部或一部分的方式进行切断。胎儿附属物来源组织细胞优选从羊膜、绒毛膜、脐带(如华通氏胶等)或其任意组合中获得。通常情况下,胎儿附属物来源组织细胞可以通过破坏胎儿附属物来源组织块来获得,胎儿附属物来源组织的小块例如,约为1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900或约1000立方毫米体积。例如,在如下条件下可以使用任意的物理破坏方法,即通过台盼蓝染色排除法测定,使所述胎儿附属物来源组织中的细胞的多个,更优选为大多数,以及更优选为至少60%、70%、80%、90%、95%、98%或99%处于生存状态。
65.在另一特别实施方式中,胎儿附属物来源组织细胞通过胎儿附属物来源组织的物理破坏进行回收,此时物理破坏可以并用酶消化,可以使用一个或多个组织消化酶进行消化。可用于消化胎儿附属物来源组织的酶有木瓜蛋白酶、脱氧核糖核酸酶、丝氨酸蛋白酶、胰蛋白酶、胰凝乳蛋白酶、胶原酶、分散酶或弹性蛋白酶等。丝氨酸蛋白酶在血清中可能受到α2-微球蛋白的抑制,而且血清中含有大量的底物蛋白,因此用于消化的培养基通常为无血清。一般来说,在酶消化过程中可以使用edta和/或dnase来提高细胞回收的效率。
66.组织消化酶可以作为任意组合使用。使用胰蛋白酶消化相关的典型浓度为0.05%-约2%的胰蛋白酶,例如,包含约0.05%的胰蛋白酶。蛋白酶可以组合使用,即在相同的消化反应中可以使用两种以上的蛋白酶,或同时使用来分离胎儿附属物来源的组织细胞。例如,在一个实施方式中,首先将胎盘或其一部分,例如在30分钟、1~约2mg/ml的条件
下用适量的胶原酶i进行消化,然后在37℃下例如在10分钟、约0.25%的浓度下使用胰蛋白酶进行消化。优选丝氨酸蛋白酶是在其他酶的使用后连续使用。
67.消化后,将消化物用例如,含有血清的培养基洗涤,洗涤后的细胞接种于培养容器。然后通过差异性粘附分离细胞,制备间质细胞。例如,可以制备脐带的华通氏胶来源间质细胞、卵膜的羊膜来源间质细胞、卵膜的绒毛膜来源间质细胞,和胎盘来源间质细胞。此外,这些间质细胞在制备培养上清之前,可以在含有血清的培养基中多次传代,优选10、9、8、7、6、5、4或3次以下的范围内传代。需要说明是,本发明中的胎儿附属物来源组织细胞不用特意包括分离干细胞的步骤,易于制备细胞。
68.3.培养上清的制备
69.胎儿附属物来源组织细胞的"培养"可以按照通常规方法,例如,以下方法实施。在培养容器中,根据需要含有钠、钾、钙、镁、磷、氯、氨基酸、维生素、激素、细胞因子、抗生素、脂肪酸、糖或根据目的含有其他化学成分或血清等生物成分的基本培养基中加入胎儿附属物来源组织细胞,在co2培养箱中,培养温度调整为30℃~40℃,优选调整为37℃,将二氧化碳气体浓度调整为0.03%~40%,优选调整为5%~10%,更优选5%,进行培养。氧浓度可以与大气层中的浓度相同,也可以是更低浓度(1~20%)。例如,氧浓度为1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%。培养期间为例如,短期的数小时水平至1天、1.5天、2天、3天、5天、7天。
70.关于培养基(也称为培养液),只要不抑制胎儿附属物来源组织细胞的增殖、维持和生存、蛋白质的分泌等,可以使用任意培养基。此外,作为基础培养基,除dulbecco改良eagle培养基(dmem)外,还可以使用iskov改良dulbecco培养基(imdm)、hamf12培养基(hamf12)、rpmi1640培养基等。另外,也可以并用两种以上的基础培养基。作为混合培养基的一个例子,可以列举等量混合了imdm和hamf12的培养基(例如,imdm/hamf12)。另外,作为可以添加到培养基中的成分,可例举血清(胎牛血清、人血清、马血清、绵羊血清等)、血清替代物(knockout血清替代物等)、各种条件培养基、牛血清白蛋白、人血清白蛋白、抗生素、各种维生素、深层海水和各种矿物质。
71.在本发明中,用于制备脑神经损伤治疗剂的胎儿附属物来源组织细胞的培养基优选不含血清的培养基。不含血清可以防止朊病毒等的感染风险,并防止混入牛血清白蛋白等异源蛋白质,从而提高脑神经损伤治疗剂的安全性。例如,通过在不含血清的培养基(无血清培养基)中培养胎儿附属物来源组织细胞,可以制备不含血清成分的培养上清。
72.本发明中,用于制备脑神经损伤治疗剂的培养基可以含有深层海水。“深层海水”一般是指超过200米深度的海水,据说它起源于格陵兰岛周围由于盐度差异引起的垂直下沉的、称为“羽流”的全球洋流,它在地球上循环了几个世纪,从未与大气接触过。由于该深层海水几乎不受阳光照射,并且处于低温高压的状态,因此细菌少,且富含无机营养盐(矿物质)等。通过含有深层海水,可以调整培养上清的分泌蛋白量,与不含深层海水的情况相比,可以制备活性更高的脑神经损伤治疗剂。培养基中所含深层海水的浓度(v/v),例如为1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、40%、50%、60%、70%或80%以上;以及90%、80%、70%、60%、50%、45%、40%、35%、30%、25%、20%、15%或10%以下;1~85%、5~85%、10%~85%、15%~85%、20%~85%、25%~85%、30%~85%、40%~85%、50%~85%、60%~85%、70%~85%、80%~85%、1~75%、5~
75%、10%~75%、15%~75%、20%~75%、25%~75%、30%~75%、40%~75%、50%~75%、60%~75%、70%~75%、1~45%、5~45%、10%~45%、15%~45%、20%~45%、25%~45%、30%~45%、40%~45%、1~10%或5~10%的范围;73%或81%。
73.获得胎儿附属物来源组织细胞的培养上清的培养时间,例如可以为5小时~7天、1天~6天、1天~5天、1天~4天、1天~3天或1天~2天,也可以为0.5天、1天、2天、3天、4天、5天、6天或7天。培养温度例如为36℃~38℃,例如为37℃,co2浓度为4~6%,例如为5%。另外,培养也可以通过非粘附条件下的三维培养进行,例如悬浮培养(例如分散培养、凝集悬浮培养等)。
74.作为用于获得胎儿附属物来源组织细胞的培养上清,培养开始时的胎儿附属物来源组织细胞的密度,例如可以为1
×
104~1
×
107个/ml、5
×
104~5
×
106个/ml、1
×
105~5
×
106个/ml、2
×
105~5
×
106个/ml、5
×
105~5
×
106个/ml或1
×
106~5
×
106个/ml,也可以为2
×
105个/ml、3
×
105个/ml、4
×
105个/ml、5
×
105个/ml、6
×
105个/ml、7
×
105个/ml、8
×
105个/ml、9
×
105个/ml、1
×
106个/ml、2
×
106个/ml、3
×
106个/ml、4
×
106个/ml、5
×
106个/ml、6
×
106个/ml、7
×
106个/ml、8
×
106个/ml、7
×
106个/ml、8
×
106个/ml、9
×
106个/ml或1
×
107个/ml。
75.培养结束后,通过分离去除细胞成分,即可获得胎儿附属物来源组织细胞的培养上清。本发明中,培养上清不仅是指从培养液中分离去除细胞成分而得到的上清本身,适当进行各种处理(例如离心处理、浓缩、溶剂置换、透析、冷冻、干燥、冷冻干燥、稀释、脱盐、保存等)的培养上清也包括在此范围内。培养上清的处理方法将在后面进行详细说明。本发明中,培养上清不含细胞成分。因此,本发明中的培养上清不含用于培养的胎儿附属物来源组织细胞,不是细胞医疗用组合物。
76.本发明中,胎儿附属物来源组织细胞在培养基中分泌细胞因子、趋化因子和生长因子。培养上清中的蛋白质可例举对脑神经再生重要的白细胞介素(il)-6,c-x-c基序趋化因子配体(c-x-c motif chemokine ligand,cxcl)1,cxcl7,cxcl8(也称为il-8)和c-c基序趋化因子配体(ccl)2(也称为mcp-1)。
77.本发明中,胎儿附属物来源组织细胞的培养上清可进一步包括以下一种或多种蛋白质:
78.tnf超家族成员14(也称为light),白细胞介素(il)-1a,il-1b,il-2,il-3,il-4,il-5,il-7,il-10,il-12p40/70,il-13,il-15,il-16,干扰素(ifn)-g,肿瘤坏死因子(tnf)-a,tnf-b等细胞因子;
79.c-x-c基序趋化因子配体(cxcl)1/2/3(也称为groa/b/g),cxcl6,cxcl9(也称为mig),cxcl10(也称为ip-10),cxcl12(也称为sdf-1),cxcl13,c-c motif chemokine ligand(ccl)1,ccl4,ccl5,ccl7,ccl8,ccl11,ccl13,ccl15,ccl17,ccl18,ccl20(也称为larc),ccl22,ccl23,ccl24,ccl26,c-x3-c motif chemokine ligand(cx3cl)1(也称为fkn)等趋化因子;
80.血管生成素,脑源性神经营养因子(bdnf),表皮细胞生长因子(egf),成纤维细胞生长因子(fgf)-4,fgf-6,fgf-7,fgf-9,fms样酪氨酸激酶3配体(flt-3l),胶质细胞源性神经营养因子(gdnf),粒细胞-巨噬细胞集落刺激因子(gm-csf),粒细胞集落刺激因子(g-csf),肝细胞生长因子(hgf),胰岛素样生长因子(igf)-1,胰岛素样生长因子结合蛋白
(igfbp)-2,igfbp-1,igfbp-4,igfbp-3,血小板衍生生长因子(pdgf)-bb,胎盘生长因子(plgf),转化生长因子(tgf)-b1,tgf-b2,tgf-b3,血小板生成素(tpo),干细胞因子(scf),巨噬细胞集落刺激因子(m-csf),神经营养因子(nt)-3,nt-4,血管内皮生长因子(vegf)-a等生长因子/相关因子;
81.瘦蛋白,白血病抑制因子(lif),巨噬细胞移动抑制因子(mif),骨桥蛋白(opn),骨保护素(opg),抑瘤素m(osm),金属蛋白酶组织抑制因子(timp)-1,timp-2等其他介质。
82.本发明中,可包含在胎儿附属物来源组织细胞的培养上清中的因子在以下方面对神经再生很重要。根据本发明的培养上清包含这些因子的一部分或全部,适合大脑或中枢神经系统的再生(boruczkowski等人,int.j.mol.sci.2019 20,2433;watson等人、neuroscience letters 2020 715,134533;wang等人、stem cell research&therapy 2017 8,26;baba等人、plos one 2019 14(9)e0221111;wang等人、acta medica okayama 2012 66(6)429等人):
83.a)神经前体细胞的增殖和存活:bdnf、ccl5、cxcl1、cxcl7、cxcl8、cx3cl1、egf、fgf-9、g-csf、igf-1、il-6、opn等
84.b)神经前体细胞的分化和成熟:bdnf、ccl11、cxcl1、cxcl7、cxcl9、cxcl12、cx3cl1、fgf-4、fgf-9、gdnf、gm-csf、il-1b、lif、opn、scf、tgf-b3等
85.c)神经前体细胞的迁移:ccl2、ccl11、ccl20、cxcl1、cxcl7、cxcl8、cxcl12、egf、igf-1等
86.d)神经营养:gdnf、ngf、nt-4/5等
87.e)星形胶质细胞的活性化等:bdnf、ifn-g、il-1a、il-1b等
88.f)小胶质细胞的活性化等:ccl17、cxcl10、leptin等
89.g)少突胶质细胞再生等:cxcl1、cxcl7、cxcl8、cxcl12、cx3cl1、egf、m-csf、nt-4、igfbp-4等
90.h)血管生成:血管生成素、ccl2、cxcl5、cxcl6、cxcl7、cxcl8、groa/b/c、hgf、igf-1、il-6、vegf、scf等。
91.i)抗炎症:ccl4、il-10、il-13、tgf-b2等
92.本发明中,作为胎儿附属物来源组织细胞的培养上清的细胞因子和趋化因子(以及生长因子等)的混合物,可作为胎儿附属物来源组织细胞培养上清的一部分,或者作为从胎儿附属物来源组织细胞培养上清分离的细胞因子和趋化因子(以及生长因子等)的混合物使用。在从胎儿附属物来源组织细胞培养上清中分离的细胞因子和趋化因子(及生长因子等)的混合物中,可以用一种或多种已知对应的基因重组等细胞因子和趋化因子(以及生长因子等)替换细胞因子和趋化因子(以及生长因子等)的一部分,或者也可以添加对应的基因重组等细胞因子和趋化因子(以及生长因子等)。
93.4.脑神经损伤治疗剂
94.根据本发明的脑神经损伤治疗剂含有胎儿附属物来源组织细胞的培养上清,从而产生针对脑神经损伤的神经组织再生的效果。这种程度的效果可以取代传统脐带血干细胞移植的部分或全部效果。另外,令人吃惊的是,本发明的脑神经损伤治疗剂通过促进脑室下带的神经前体细胞的增殖、向脑神经损伤部位的归巢、脑神经损伤部位的神经细胞的分化和成熟,对脑神经的神经组织起到普遍广泛的神经再生效果。因此,本发明的脑神经损伤治
疗剂不限于特定的脑神经损伤,对于广泛的脑神经损伤,可以作为脑神经再生促进剂用于治疗脑神经损伤、减轻症状等。由于本发明的脑神经损伤治疗剂用在脑神经损伤发病之前,因此即使该脑神经损伤处于患病未知阶段,通过给药至对象也可以有效抑制对象的脑神经损伤的恶化。因此,通过习惯性地使用本发明的脑神经损伤治疗剂,可以在发病前治疗多方面的脑神经损伤,预防、延缓或减轻发病。即,本发明中,“治疗”的范围不仅包括根治脑神经损伤引起的症状和异常的处理,还包括即使不能根治,却减轻症状和异常、或者与不进行处理的情况相比延缓症状和异常的处理,还包括预防、延缓或减轻发病的处理。
95.根据本发明的脑神经损伤治疗剂可以促进神经再生,从而应用于多种脑神经疾病。脑神经损伤例如是非遗传性疾病的脑神经损伤。根据本发明的脑神经损伤治疗剂包括但不限于运动障碍(左旋多巴诱导的异动症、慢性和迟发性运动障碍、以及口面运动障碍)、下肢不宁综合征(药物诱发性和特发性)、药物诱发性肌张力障碍、舞蹈病(亨廷顿病、毒素诱发性舞蹈病、小舞蹈病(sydenham)、妊娠舞蹈病、威尔逊病、药物诱发性舞蹈病、以及代谢性和内分泌性舞蹈病)、面部痉挛(运动性、语音性、单纯性、复杂性或图雷特综合征等)、肌张力障碍(急性、全身性、局灶性、节段性、性的、中间性、心因性和急性肌张力障碍反应等)、sodemytopic帕金森病、刻板运动障碍(自闭症、遗传性和儿童相关运动障碍等)、强迫性障碍、嗜睡症(猝倒等)、传染性海绵状脑病(克罗伊茨费尔特-雅各布病和库鲁病等)、痴呆症(阿尔茨海默病、路易体痴呆、血管性痴呆、匹克氏病和酒精性痴呆等)、神经棘红细胞增多症、发作或痉挛、手足徐动症(亨廷顿病、呼吸停止、新生儿黄疸和脑卒中相关等)、和儿童脑性瘫痪。
96.在某些实施方案中,根据本发明的脑神经损伤治疗剂治疗的脑损伤,例如儿童脑性瘫痪的体征或症状是运动功能障碍、语言或言语功能障碍、步态或移动功能障碍(例如行走速度的降低)、肌力功能性障碍、肌张力功能性障碍、反射异常、协调异常、痉挛、不自主运动、步态异常、平衡异常、肌肉减少、骨骼发育受损或肌肉发育受损。在一些实施方案中,根据本发明的脑神经损伤治疗剂治疗的脑损伤,例如儿童脑性瘫痪的体征或症状是手部力量障碍、灵活性障碍、步行速度障碍或步行障碍。在一些实施方案中,根据本发明的脑神经损伤治疗剂治疗的脑损伤,例如儿童脑性瘫痪的体征或症状可包括但不限于感觉运动障碍或感觉运动功能的损害,例如运动失调、全身控制能力障碍、协调或平衡障碍、身体感觉障碍、本体感觉障碍、耐力障碍、手部功能障碍、手部力量障碍、手部精细协调能力丧失或障碍、反射亢进、握力障碍、肌肉无力、肌张力障碍、运动范围障碍、痉挛、力量障碍/减弱、震颤、肢体功能障碍、上肢功能障碍、下肢功能障碍、下肢肌肉力量障碍、步态障碍(如行走速度降低)、站立能力障碍、语言障碍(如构音障碍)、下颌功能障碍、咀嚼功能障碍、以及颞下颌关节紊乱、灵活性障碍、反射、或本说明书中所述或本领域已知的任何其他感觉运动功能。
97.所述脑神经损伤治疗剂给药对象通常是,靶组织有损伤的人类患者,也可以假设适用于是人类以外的哺乳动物(包括宠物动物、家畜、实验动物。具体而言,例如为小鼠、大鼠、豚鼠、仓鼠、猴子、牛、猪、山羊、绵羊、狗、猫等)。
98.发生所述脑神经损伤的部位没有特别的限定。所述疾病发生的部位是全脑或部分脑,大脑具有前脑和脑干,前脑具有大脑和间脑,脑干具有中脑和菱脑。大脑具有嗅脑、扁桃体、纹状体、海马和新皮质等,间脑具有上丘脑、丘脑、下丘脑、丘脑腹、脑下垂体、松果体和第三脑室等。中脑具有中脑盖、大脑脚、视前区及中脑水管等,菱脑具有脑桥、小脑和延髓
等。发生上述脑神经损伤的部位可能是这些部位中的任意一个。
99.本发明中,使用脑神经损伤治疗剂的治疗方法,包括鼻内(鼻腔内)给药胎儿附属物来源组织细胞培养上清,以修复大脑的受损部分。根据本治疗方法,可以微创且有效地恢复因儿童脑性瘫痪等脑神经损伤而受损的区域。
100.5.制备方法
101.本发明还提供了,包括
102.(a)培养胎儿附属物来源组织细胞的工序,以及
103.(b)回收所述胎儿附属物来源组织细胞的培养上清的工序,
104.的脑神经损伤治疗剂的制备方法。该制造方法还可以包括对所述回收的培养上清,实施选自离心处理、浓缩、溶剂置换、透析、冷冻、干燥、冷冻干燥、稀释,以及脱盐的一种以上的处理步骤。通过包括上述步骤,脑神经损伤治疗剂的处理、保存、运输变得更加容易。另外,所述制备方法还可以包括向所述回收的培养上清中加入追加成分的步骤。通过加入上述追加成分,可以改变脑神经损伤治疗用组合物整体的物性,提高其特性。另外,所述制备方法还可以包括,摘出胎儿附属物来源组织的工序,以及从胎儿附属物来源组织制备胎儿附属物来源组织细胞的工序。关于各个步骤以及追加成分等,符合在根据本发明的脑神经损伤治疗剂的说明中记载的事项。包括对所述回收的培养上清实施选自离心处理、浓缩、溶剂置换、透析、冷冻、干燥、冷冻干燥、稀释、以及脱盐的一种以上的处理工序,和所述回收的培养上清中加入追加成分的工序这两个工序时,可以先实施任意步骤,在可能的情况下可以同时进行。
105.在上述过程(b)中,回收胎儿附属物来源组织细胞培养上清。例如,可以用滴管或移液管等吸引回收培养液。回收的培养上清原样或经过一种以上处理后,作为根据本发明的脑神经损伤治疗剂的有效成分使用。这里的处理包括,离心处理、浓缩、溶剂置换、透析、制剂化、冷冻、干燥、冷冻干燥、稀释、脱盐、保存(例如4℃、-80℃)。另外,胎儿附属物来源组织细胞的培养上清即使不进行复杂、高度的纯化也显示出了预期效果。因此,本发明中的脑神经损伤治疗剂可以通过简单的工序制备。不需要复杂的纯化工序也有利于避免纯化伴随的活性降低。
106.本发明中,胎儿附属物来源组织细胞培养上清可以来源于多个供体的胎儿附属物来源组织细胞。也就是说,可以混合来源于多个供体的胎儿附属物来源组织细胞进行培养,并回收培养上清,也可以混合来源于各个供体的胎儿附属物来源组织细胞的培养上清,进行一种以上处理(离心处理、浓缩、溶剂的置换、透析、制剂化、冷冻、干燥、冷冻干燥、稀释、脱盐、保存)之后,混合来源于各个供体的胎儿附属物来源组织细胞的培养上清。然而,本发明中的胎儿附属物来源组织细胞培养上清具有混入病毒等感染的风险,因此优选不混合来源于多个供体的胎儿附属物来源组织细胞进行培养。另外,来源于多个供体的胎儿附属物来源组织细胞的培养上清的优点在于它可以作为均质的脑神经损伤治疗剂生产。《胎儿附属物来源组织细胞培养上清的浓缩方法》
107.本发明中,用于治疗脑神经疾病的组合物可以制剂化。作为用于制剂化的胎儿附属物来源组织细胞培养上清的浓缩方法,可以应用通常用于培养上清的浓缩方法。作为浓缩方法的例子,例如可以列举以下两种方法。
108.1)离心柱浓缩法
109.使用amicon ultra centrifugal filter units-10k(millipore公司制造)浓缩培养上清。具体操作步骤如下。
110.(i)将培养上清(最多15ml)装入amicon ultra centrifugal filter units-10k中,以
×
4000g离心约60分钟,浓缩至200μl。
111.(ii)上述试管中放入与培养上清等量的无菌pbs,再次以
×
4000g离心约60分钟,用pbs替换基础液。
112.(iii)将得到的200μl溶液回收到一个微量试管中,获得浓缩胎儿附属物来源组织细胞培养上清。
113.(2)乙醇沉淀浓缩法
114.培养上清用乙醇沉淀法进行浓缩。具体操作步骤如下。
115.(i)在5ml的培养上清中加入45ml的100%乙醇,混合,在-20℃下放置60分钟。
116.(ii)4℃,以
×
15000g离心15分钟。
117.(iii)除去上清,加入10ml90%的乙醇并充分搅拌。
118.(iv)在4℃,以
×
15000g离心5分钟。
119.(v)去除上清,将得到的颗粒溶于500μl的无菌水,回收到一个微量试管中,作为浓缩胎儿附属物来源组织细胞培养上清。
120.《胎儿附属物来源组织细胞培养上清的冷冻干燥方法》
121.另外,本发明的脑神经损伤治疗剂中胎儿附属物来源组织细胞培养上清也可以是经冷冻干燥的。这提供了良好的储存稳定性。作为胎儿附属物来源组织细胞培养上清的冷冻干燥方法,可以适用通常用于冷冻干燥培养上清的方法。冷冻干燥方法的例子,可例举如下方法。冷冻干燥制造的培养上清液可以作为粉末制剂使用,或者用适当的溶剂如水重构后使用。
122.(i)将通过上述方法得到的胎儿附属物来源组织细胞培养上清或浓缩的胎儿附属物来源组织细胞培养上清在-80℃下冷冻2小时至半天。
123.(ii)冻结后,打开样品管的盖,放置于冷冻干燥机中。
124.(iii)冷冻干燥1-2天。
125.(iv)所得样品即为冷冻干燥的胎儿附属物来源组织细胞培养上清(可-80℃保存)。
126.6.药物组合物
127.根据适用对象的情况,在维持预期治疗效果的前提下,本发明的脑神经损伤治疗剂还可以含有其他附加成分作为药物组合物。附加可含的成分示例如下。
128.(i)生物可吸收材料。
129.作为有机生物吸收材料,可以使用透明质酸,胶原蛋白,纤维蛋白原(例如,bolheal(注册商标))等。
130.(ii)胶凝材料
131.凝胶化材料优选使用生物相容性高的材料,可以使用透明质酸,胶原蛋白或纤维蛋白胶等。可以选择使用各种透明质酸,胶原蛋白,但优选使用适合本发明的脑神经损伤治疗剂的适用目的(适用组织)的透明质酸和胶原蛋白。使用的胶原蛋白优选可溶性的(酸溶性胶原蛋白、碱溶性胶原蛋白、酶溶性胶原蛋白等)。
132.(iii)其他
133.还可以包含制剂上可接受的其他成分(例如载体、赋形剂、崩解剂、缓冲剂、乳化剂、助悬剂、镇痛剂、稳定剂、保存剂、防腐剂、生理盐水等)。赋形剂可以使用乳糖、淀粉、山梨醇、d-甘露醇、白糖等。崩解剂可以使用淀粉、羧甲基纤维素、碳酸钙等。缓冲剂可以使用磷酸盐、柠檬酸盐、乙酸盐等。乳化剂可以使用阿拉伯胶、海藻酸钠、黄蓍胶等。助悬剂可以使用单硬脂酸甘油酯、单硬脂酸铝、甲基纤维素、羧甲基纤维素、羟甲基纤维素、十二烷基硫酸钠等。镇痛剂可以使用苯甲醇、氯丁醇、山梨糖醇等。稳定剂可以使用丙二醇、抗坏血酸等。保存剂可以使用苯酚、苯扎氯铵、苯甲醇、氯丁醇、对羟基苯甲酸甲酯等。防腐剂可以使用苯扎氯铵、对羟基苯甲酸、氯丁醇等。也可以含有抗生素、ph调节剂、生长因子(例如表皮细胞生长因子(egf)、神经生长因子(ngf)、脑源性神经营养因子(bdnf))等。
134.本发明的药物组合物的最终形态没有特别限制。形态的例子有液体状(液状、凝胶状等)和固体状(包括粉末状、细粒、颗粒状等冻干制剂)。本发明中的药物组合物可以具有包含适合吸入的形态,例如,通过喷雾器或扩散器以雾状喷出的液体的形态。脑神经疾病相关部位是大脑,考虑到血脑屏障的存在,本发明的用于治疗脑神经损伤的组合物优选鼻腔给药,脑室内给药或髓腔内给药的形式。例如,鼻内给药可以以喷雾或粉末状的形式进行。与使用胎儿附属物来源组织细胞和胎儿附属物来源干细胞等的情况相比,胎儿附属物来源组织细胞的培养上清在前期准备和储存方面更具有优势,可以说特别适合于脑神经损伤的急性期和亚急性期的治疗。另外,胎儿附属物来源组织细胞的培养上清非常有用,因为它不含细胞成分,能够克服免疫排斥问题。
135.然而,在一些实施方案中,根据本发明的脑神经损伤治疗剂除了包括胎儿附属物来源组织细胞的培养上清之外,还可以含有胎儿附属物来源组织细胞、胎儿附属物来源干细胞、es细胞、ips细胞或间充质干细胞等、或者也可以与这些干细胞等组合使用。通过追加使用这样的干细胞等,某些情况下可以提高治疗效果。
136.本发明还提供了一种在脑神经损伤发病前抑制对象脑神经损伤发病的方法,包括向脑神经疾病发病之前的对象给予有效量的根据本发明的脑神经损伤治疗剂,以抑制所述脑神经损伤的发病。所述对象可以是人,或人以外哺乳动物(包括宠物、家畜、实验动物。具体而言,例如是小鼠、大鼠、豚鼠、仓鼠、猴子、牛、猪、山羊、绵羊、狗、猫等)。所述对象可以是被确定为具有脑神经损伤发病风险的对象。这种风险可以通过基因诊断,系谱分析等来确定。例如,有统计表明,特定基因中的特定等位基因或snp的存在与感染特定疾病的概率相关。
137.只要以能维持预期的治疗效果为前提,本发明的脑神经损伤治疗剂的给药剂量没有限制,例如,换算成未处理的培养上清的量,为0.1ml/kg/日~100ml/kg/日、1ml/kg/日~100ml/kg/日或5ml/kg/日~100ml/kg/日,换算成未处理的培养上清的蛋白质的量,为0.1mg/kg/日~1000mg/kg/日,另外,也可以为1mg/kg/日~100mg/kg/日。并且,给药方法没有特别限制。例如,所述脑神经损伤治疗剂的给药优选为非口服给药,非口服给药可以是全身性给药也可以是局部给药。只要以能维持预期的治疗效果为前提,所述脑神经损伤治疗剂的给药方法没有限制,可例举静脉给药、动脉给药、门静脉给药、皮内给药、皮下给药、肌肉内给药、腹腔内给药、经肺给药(经肺吸收)、脑室内给药、髓腔内和鼻腔给药等。其中,优选微创的鼻腔给药。此外,根据脑室内给药、髓腔内和鼻腔给药,在脑神经损伤的治疗中特
别有效,因为无需担心穿过血脑屏障的可能性。给药时间表,例如可以采用一天一次~几次、两天一次、或者三天一次等。在制定给药时间表时,可以考虑对象的性别、年龄、体重、病情等。
138.7.脑神经再生促进剂
139.本发明的胎儿附属物来源组织细胞培养上清是一种脑神经再生促进剂。“脑神经再生”可以指由于大脑中神经前体细胞的增加、分化和成熟而在神经修复或神经发育过程中发生的各种现象中的至少一种。因此,神经再生优选包括原有神经功能完全或部分恢复的现象。是否实现了有效的神经再生可以通过公知的方法来确认。例如,将具有神经损伤且给予神经再生促进剂的患病的人或家畜与具有神经损伤且未给予神经再生促进剂的患病的人或家畜进行比较,如果给予神经再生促进剂的患病的人或家畜的损伤神经功能的恢复程度较高,则可以判断已经实现了有效的神经再生。如下面的实施例所示,神经功能的恢复可以以对刺激的反应、运动功能、认知功能的恢复等为指标进行评价,运动功能的恢复,例如旋转杆实验(oh等人、exp.mol.med.2018 50(4),22;kossatz等人、front.pharmacol.2018 9,376)、y迷宫实验(miedel等人、j.vis.exp.2017(123);sarnyai等人、proc.natl.acad.sci.usa.2000 97(26),14731)、挂线试验(aartsma-rus等人、j.vis.exp.2014(85))等,可以用公知的方法检查。
140.神经再生发生于神经产生缺陷来源的细胞,可以发生于治疗对象部位本来就存在的细胞(内源性细胞),例如也可以发生于与神经再生促进剂一同移植的细胞(外源性细胞)。这些细胞可例举神经细胞、神经前体细胞、胚胎干细胞、诱导多能干细胞、间充质干细胞、血管内皮细胞、血管内皮前体细胞、造血干细胞等。
141.在本发明的胎儿附属物来源组织细胞培养上清是一种脑神经再生促进剂,可以是脑神经前体细胞增殖促进剂。“脑神经前体细胞增殖促进剂”是促进脑内神经前体细胞增殖的药剂。是否实现了有效的脑神经前体细胞增殖可以通过公知的方法来确认。例如,如下面的实施例所示,可以通过添加脑神经前体细胞分化和成熟促进剂,观察脑或脑源性神经前体细胞的增殖情况来进行评价。神经前体细胞可以是从活体采集的细胞,也可以是从ips等干细胞分化的细胞,也可以使用细胞系(例如a172、b65、c6、ks-1、n2a、pc12、sh-sy5y、skn-be2、t98g、u251、u87、yh-13)。
142.在本发明中,胎儿附属物来源组织细胞培养上清是一种脑神经再生促进剂,可以是脑神经前体细胞归巢促进剂。“脑神经前体细胞归巢促进剂”是促进神经前体细胞向脑损伤部位归巢的药剂。是否实现了有效的脑神经前体细胞归巢可以通过公知的方法来确认。例如,将具有神经损伤且给予脑神经前体细胞归巢促进剂的患病的人或家畜与具有神经损伤且未给予脑神经前体细胞归巢促进剂的患病的人或家畜进行比较,如果在给予脑神经前体细胞归巢促进剂的患病的人或家畜中,观察到脑神经前体细胞从海马的颗粒细胞下带、脑室下带向脑损伤部位的移动较多的情况下,则可以判断已经实现了有效的脑神经前体细胞归巢。另外,在并用神经前体细胞等细胞进行给药的情况下,根据所给予的细胞在脑损伤部位的聚集情况,也可以进行同样的判断。如下面的实施例所示,脑神经前体细胞的归巢可以使用脑神经前体细胞的标记物(例如dcx(双皮质素)、sox2(sry(性别决定区y)-box 2)、pax6(配对box 6))为指标进行评价。
143.在本发明中,胎儿附属物来源组织细胞培养上清是一种脑神经再生促进剂,可以
是脑神经前体细胞分化和成熟促进剂。“脑神经前体细胞分化和成熟促进剂”是一种促进脑内神经前体细胞轴突延伸、分化成熟为神经细胞的药剂。
144.是否实现了有效的脑神经前体细胞的分化和成熟,可以通过已知的方法进行确认。例如,如下述实施例所示,可以通过添加脑神经前体细胞分化成熟促进剂,观察脑或脑源性神经前体细胞的轴突延伸、或测定延伸的轴突长度来进行评价。神经前体细胞可以是从活体采集的细胞,也可以是从ips等干细胞分化的细胞,也可以使用细胞系(例如a172、b65、c6、ks-1、n2a、pc12、sh-sy5y、skn-be2、t98g、u251、u87、yh-13)。
145.在本发明中的脑神经再生促进剂包括细胞因子,趋化因子等。作为细胞因子,趋化因子等,可例举对脑神经再生重要的interleukin(il)-6,c-x-c motif chemokine ligand(cxcl)1,cxcl7,cxcl8(也称为il-8)和c-c motif chemokine ligand(ccl)2(也称为mcp-1)。
146.在本发明中,脑神经再生促进剂还可进一步含有以下一种或两种以上蛋白质:
147.tnf超家族成员14(也称为light),白细胞介素(il)-1a,il-1b,il-2,il-3,il-4,il-5,il-7,il-10,il-12p40/70,il-13,il-15,il-16,干扰素(ifn)-g,肿瘤坏死因子(tnf)-a,tnf-b等细胞因子;
148.c-x-c基序趋化因子配体(cxcl)1/2/3(也称为groa/b/g),cxcl6,cxcl9(也称为mig),cxcl10(也称为ip-10),cxcl12(也称为sdf-1),cxcl13,c-c motif chemokine ligand(ccl)1,ccl4,ccl5,ccl7,ccl8,ccl11,ccl13,ccl15,ccl17,ccl18,ccl20(也称为larc),ccl22,ccl23,ccl24,ccl26,c-x3-c基序趋化因子配体(cx3cl)1(也称为fkn)等趋化因子;
149.血管生成素,脑源性神经营养因子(bdnf),表皮细胞生长因子(egf),成纤维细胞生长因子(fgf)-4,fgf-6,fgf-7,fgf-9,fms样酪氨酸激酶3配体(flt-3l),胶质细胞源性神经营养因子(gdnf),粒细胞-巨噬细胞集落刺激因子(gm-csf),粒细胞集落刺激因子(g-csf),肝细胞生长因子(hgf),胰岛素样生长因子(igf)-1,胰岛素样生长因子结合蛋白(igfbp)-2,igfbp-1,igfbp-4,igfbp-3,血小板衍生生长因子(pdgf)-bb,胎盘生长因子(plgf),转化生长因子(tgf)-b1,tgf-b2,tgf-b3,血小板生成素(tpo),干细胞因子(scf),巨噬细胞集落刺激因子(m-csf),神经营养因子(nt)-3,nt-4,血管内皮生长因子(vegf)-a等生长因子/相关因子;
150.瘦蛋白,白血病抑制因子(lif),巨噬细胞移动抑制因子(mif),骨桥蛋白(opn),骨保护素(opg),抑瘤素m(osm),金属蛋白酶组织抑制因子(timp)-1,timp-2等其他介质。
151.本发明中,用于制备脑神经再生促进剂的培养基可以含有深层海水。“深层海水”一般是指超过200米深度的海水,据说它起源于格陵兰岛周围由于盐度差异引起的垂直下沉的、称为“羽流”的全球洋流,它在地球上循环了几个世纪,从未与大气接触过。由于该深层海水几乎不受阳光照射,并且处于低温高压的状态,因此细菌少,且富含无机营养盐(矿物质)等。通过含有深层海水,可以调整培养上清的分泌蛋白量,与不含深层海水的情况相比,可以制备活性更高的脑神经损伤治疗剂。培养基中所含的深层海水的浓度(v/v)例如为,1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、40%、50%、60%、70%或80%以上,以及90%、80%、70%、60%、50%、45%、40%、35%、30%、25%、20%、15%或10%以下,1~85%、5~85%、10%~85%、15%~85%、20%~85%、25%~
85%、30%~85%、40%~85%、50%~85%、60%~85%、70%~85%、80%~85%、1~75%、5~75%、10%~75%、15%~75%、20%~75%、25%~75%、30%~75%、40%~75%、50%~75%、60%~75%、70%~75%、1~45%、5~45%、10%~45%、15%~45%、20%~45%、25%~45%、30%~45%、40%~45%、1~10%或5~10%的范围内,73%或81%。
152.脑神经再生促进剂,即作为获得胎儿附属物来源组织细胞的培养上清的培养时间可以是,例如,5小时~7天、1天~6天、1天~5天、1天~4天、1天~3天或1天~2天、或0.5天、1天、2天、3天、4天、5天、6天或7天。培养温度例如为36℃~38℃,例如37℃,co2浓度为4~6%,例如5%。另外,培养例如可以通过在非粘附性条件下的三维培养,例如悬浮培养(例如分散培养、凝集悬浮培养等)来进行。
153.为了获得作为脑神经再生促进剂的胎儿附属物来源组织细胞的培养上清,培养开始时的胎儿附属物来源组织细胞的密度可以为,例如,1
×
10
4-1
×
107个/ml、5
×
10
4-5
×
106个/ml、1
×
10
5-5
×
106个/ml、2
×
10
5-5
×
106个/ml、5
×
10
5-5
×
106个/ml或1
×
10
6-5
×
106个/ml、2
×
105个/ml、3
×
105个/ml、4
×
105个/ml、5
×
105个/ml、6
×
105个/ml、7
×
105个/ml、8
×
105个/ml、9
×
105个/ml、1
×
106个/ml、2
×
106个/ml、3
×
106个/ml、4
×
106个/ml、5
×
106个/ml、6
×
106个/ml、7
×
106个/ml、8
×
106个/ml、7
×
106个/ml、8
×
106个/ml、9
×
106个/ml或1
×
107个/ml。
154.在本发明中,脑神经再生促进剂可以促进神经再生,从而应用于多种脑神经损伤。例如,脑神经损伤是非遗传性疾病的脑神经损伤。根据本发明的脑神经损伤治疗剂包括但不限于运动障碍(左旋多巴诱导的异动症、慢性和迟发性运动障碍、以及口面运动障碍)、下肢不宁综合征(药物诱发性和特发性)、药物诱发性肌张力障碍、舞蹈病(亨廷顿病、毒素诱发性舞蹈病、小舞蹈病(sydenham)、妊娠舞蹈病、威尔逊病、药物诱发性舞蹈病、以及代谢性和内分泌性舞蹈病)、面部痉挛(运动性、语音性、单纯性、复杂性或图雷特综合征等)、肌张力障碍(急性、全身性、局灶性、节段性、性的、中间性、心因性和急性肌张力障碍反应等)、sodemytopic帕金森病、刻板运动障碍(自闭症、遗传性和儿童相关运动障碍等)、强迫性障碍、嗜睡症(猝倒等)、传染性海绵状脑病(克罗伊茨费尔特-雅各布病和库鲁病等)、痴呆症(阿尔茨海默病、路易体痴呆、血管性痴呆、匹克氏病和酒精性痴呆等)、神经棘红细胞增多症、发作或痉挛、手足徐动症(亨廷顿病、呼吸停止、新生儿黄疸和脑卒中相关等)、和儿童脑性瘫痪。
155.在某些实施方案中,本发明中的脑神经再生促进剂治疗的脑部疾病,例如儿童脑性瘫痪的体征或症状是运动功能障碍、语言或言语功能障碍、步态或移动功能障碍(例如行走速度的降低)、肌力功能性障碍、肌张力功能性障碍、反射异常、协调异常、痉挛、不自主运动、步态异常、平衡异常、肌肉减少、骨骼发育受损或肌肉发育受损。在一些实施方案中,根据本发明的脑神经再生促进剂治疗的脑部疾病,例如儿童脑性瘫痪的体征或症状是手部力量障碍、灵活性障碍、步行速度障碍或步行障碍。在一些实施方案中,根据本发明的脑神经再生促进剂治疗的脑部疾病,例如儿童脑性瘫痪的体征或症状可包括但不限于感觉运动障碍或感觉运动功能的损害,例如运动失调、全身控制能力障碍、协调或平衡障碍、身体感觉障碍、本体感觉障碍、耐力障碍、手部功能障碍、手部力量障碍、手部精细协调能力丧失或障碍、反射亢进、握力障碍、肌肉无力、肌张力障碍、运动范围障碍、痉挛、力量障碍/减弱、震
颤、肢体功能障碍、上肢功能障碍、下肢功能障碍、下肢肌肉力量障碍、步态障碍(如行走速度降低)、站立能力障碍、语言障碍(如构音障碍)、下颌功能障碍、咀嚼功能障碍、以及颞下颌关节紊乱、灵活性障碍、反射、或本说明书中所述或本领域已知的任何其他感觉运动功能。
156.本发明还提供了,包括
157.(a)培养胎儿附属物来源组织细胞的工序,以及
158.(b)回收胎儿附属物来源组织细胞的培养上清的工序,
159.的脑神经再生促进剂的制备方法。该制造方法还可以包括对所述回收的培养上清实施选自离心处理、浓缩、溶剂置换、透析、冷冻、干燥、冷冻干燥、稀释,以及脱盐的一种以上处理的工序。通过包括这些工序,脑神经再生促进剂的处理,保存,运输变得容易。另外,所述制备方法还可以包括向所述回收的培养上清中加入追加成分的工序。通过加入上述追加成分,可以改变脑神经再生促进用组合物整体的物性,提高其特性。另外,所述制备方法还可以包括由胎儿附属物来源组织制备胎儿附属物来源组织细胞的工序。关于各个工序以及追加成分等,符合在根据本发明的脑神经损伤治疗剂的说明中记载的事项。包括对所述回收的培养上清实施选自离心处理、浓缩、溶剂置换、透析、冷冻、干燥、冷冻干燥、稀释,以及脱盐的一种以上处理的工序,和所述回收的培养上清中加入追加成分的工序这两个工序时,可以先实施任意工序,在可能的情况下同时进行。
160.根据所适用对象的状态、维持预期疗效作为条件,本发明中的脑神经再生促进剂可以额外包括其他成分作为药物组合物。可以额外包括的成分的例子如下所示。
161.(i)生物可吸收材料。
162.作为有机生物吸收材料,可以使用透明质酸,胶原蛋白,纤维蛋白原(例如,bolheal(注册商标))等。
163.(ii)胶凝材料
164.凝胶化材料优选使用生物相容性高的材料,可以使用透明质酸,胶原蛋白或纤维蛋白胶等。可以选择使用各种透明质酸,胶原蛋白,但优选使用适合本发明的脑神经损伤治疗剂的适用目的(适用组织)的透明质酸和胶原蛋白。使用的胶原蛋白优选可溶性的(酸溶性胶原蛋白、碱溶性胶原蛋白、酶溶性胶原蛋白等)。
165.(iii)其他
166.还可以包含制剂上可接受的其他成分(例如载体、赋形剂、崩解剂、缓冲剂、乳化剂、助悬剂、镇痛剂、稳定剂、保存剂、防腐剂、生理盐水等)。赋形剂可以使用乳糖、淀粉、山梨醇、d-甘露醇、白糖等。崩解剂可以使用淀粉、羧甲基纤维素、碳酸钙等。缓冲剂可以使用磷酸盐、柠檬酸盐、乙酸盐等。乳化剂可以使用阿拉伯胶、海藻酸钠、黄蓍胶等。助悬剂可以使用单硬脂酸甘油酯、单硬脂酸铝、甲基纤维素、羧甲基纤维素、羟甲基纤维素、十二烷基硫酸钠等。镇痛剂可以使用苯甲醇、氯丁醇、山梨糖醇等。稳定剂可以使用丙二醇、抗坏血酸等。保存剂可以使用苯酚、苯扎氯铵、苯甲醇、氯丁醇、对羟基苯甲酸甲酯等。防腐剂可以使用苯扎氯铵、对羟基苯甲酸、氯丁醇等。也可以含有抗生素、ph调节剂、生长因子(例如表皮细胞生长因子(egf)、神经生长因子(ngf)、脑源性神经营养因子(bdnf))等。
167.本发明的脑神经再生促进剂的药物组合物的最终形态没有特别限制。形态的例子有液体状(液状、凝胶状等)和固体状(包括粉末状、细粒、颗粒状等冻干制剂)。本发明中的
药物组合物可以具有包含适合吸入的形态,例如,通过喷雾器或扩散器以雾状喷出的液体的形态。脑神经损伤相关部位是大脑,考虑到血脑屏障的存在,本发明的用于治疗脑神经再生促进的组合物优选鼻腔给药,脑室内给药或髓腔内给药的形式。例如,鼻内给药可以以喷雾或粉末状的形式进行。与使用胎儿附属物来源组织细胞和胎儿附属物来源干细胞等的情况相比,胎儿附属物来源组织细胞的培养上清在前期准备和储存方面更具有优势,可以说特别适合于脑神经损伤的急性期和亚急性期的治疗。另外,胎儿附属物来源组织细胞的培养上清非常有用,因为它不含细胞成分,能够克服免疫排斥问题。
168.实施例
169.以下将基于实施例对本发明进行更详细的说明。但这些实例不以任何方式限制本发明。
170.实施例1:胎儿附属物来源组织细胞和培养上清的制备
171.1)华通氏胶来源间充质细胞的制备
172.由高知大学医院妇产科知情同意提供的人脐带,通过在70%的乙醇中浸泡几秒进行灭菌,然后用磷酸盐缓冲液(d-pbs)清洗去除粘附在周围的血液等。然后切开脐带,去除脐静脉和脐动脉,并将华通氏胶从脐带周围的膜分离出来。将华通氏胶切碎后,将2g的组织片排列在10cm塑料培养皿中。将细胞培养网cellamigo(注册商标)(椿本链条(tsubakimoto chain)公司制)放在组织片上,加入memα(包括10%fbs,100u/ml青霉素,100μg/ml链霉素),在37℃,5%co2下培养。将从组织片游离及生长的粘附细胞传代2~5次的细胞作为华通氏胶来源间充质细胞。
173.2)羊膜来源间充质细胞的制备
174.由高知大学医院妇产科知情同意提供的人卵膜,通过在70%的乙醇中浸泡几秒进行灭菌,并用手对卵膜进行剥离。回收从卵膜胎儿侧的第1层作为羊膜,通过苏木精—伊红染色法确认膜的结构。浸泡于[0.05%胰蛋白酶/0.2mm edta]溶液中,在37℃下反应1.5小时分散羊膜上皮组织。剩余羊膜结缔组织浸泡于[2.4mg/l胶原酶,0.01mg/ml脱氧核糖核酸酶]酶溶液中,在37℃下反应1.5小时分散羊膜结缔组织。将羊膜结缔组织分散液通过70μm细胞过滤器,对通过的液体离心并去除上清,d-pbs重悬两次去除酶溶液,得到的细胞加入memα(10%fbs,100u/ml青霉素,100μg/ml链霉素),在37℃,5%co2下培养。将增殖的细胞传代2~5次的细胞作为羊膜来源间充质细胞。
[0175]
3)绒毛膜来源间充质细胞的制备
[0176]
将所述人的卵膜用70%的乙醇浸泡几秒进行灭菌,并用手对卵膜进行剥离。回收卵膜胎儿侧的第2层作为绒毛膜结缔组织,通过苏木精—伊红染色法确认膜的结构。将绒毛膜结缔组织浸泡于[2.4mg/l胶原酶,0.01mg/ml脱氧核糖核酸酶]酶溶液中,在37℃下反应1.5小时分散绒毛结缔组织。将绒毛膜结缔组织分散液通过100μm细胞过滤器,对通过的液体离心并去除上清,d-pbs重悬两次。然后浸泡于[0.05%胰蛋白酶/0.2mmedta]溶液中,在37℃下反应5分钟后,加入memα(包括10%fbs,100u/ml青霉素,100μg/ml链霉素)停止反应。使胰蛋白酶分散液通过70μm细胞过滤器,对通过的液体离心并去除上清、d-pbs重悬两次去除酶溶液,得到的细胞加入memα(10%fbs,100u/ml青霉素,100μg/ml链霉素),在37℃,5%co2下培养。将增殖的细胞传代2~5次的细胞作为绒毛膜来源间充质细胞。
[0177]
4)胎儿附属物来源组织细胞的培养
[0178]
将人华通氏胶来源间充质细胞,人羊膜来源间充质细胞或人绒毛膜来源间充质细胞以2
×
105个/ml悬浮于dmem培养基或rpmi1640培养基中,无需加入或添加深层海水,在37℃,5%co2的条件下培养24小时。使用的深层海水是取自高知县室户近海的“天海之水1000”(赤穂化成公司制造)。使用nucleocounter nc-100(chemometec公司制造)测量细胞存活率,发现虽然存活率随着时间的推移而下降,但是添加和不添加深层海水之间没有区别。回收培养液,以300g离心10分钟来制备培养上清。
[0179]
实施例2:胎儿附属物来源组织细胞和神经前体细胞共培养的神经再生
[0180]
1)神经前体细胞的制备
[0181]
安乐死出生1周龄左右的nod/scid小鼠(日本查尔斯河公司:nod.cb17-prkdcscid/j)的幼鼠,采集脑组织。切取脑室下区周围组织,使用神经细胞用分散液(大日本住友制药公司制造)使其分散,得到的细胞置于加入了20ng/ml的表皮细胞生长因子(egf),10ng/ml成纤维细胞生长因子(fgf),2μl/ml肝磷酯(stemcell technologies公司制造)神经细胞生长培养基(stemcell technologies公司制造)中,在37℃,5%co2下培养,形成神经前体细胞聚集,用于下述测试。
[0182]
2)共培养
[0183]
将实施例1中制备的人华通氏胶来源间充质细胞和实施例2中制备的小鼠神经前体细胞分别悬浮于神经细胞基底完全培养基(stemcell technologies公司制造)中,使用μ-slide chemotaxis(易必迪公司制造),在37℃、5%co2的条件下,并在两个细胞互相不接触的条件下共培养。通过显微镜观察,评价了在培养第3天和第7天的神经前体细胞的生长和分化成熟。如图1所示,与华通氏胶来源间充质细胞共培养的神经前体细胞与单独培养的细胞相比,可以促进神经前体细胞的增殖或维持生存,观察到神经前体细胞的移动(迁移),确认到该细胞分化成熟为轴突延伸的神经元。
[0184]
以上结果表明,华通氏胶来源间充质细胞在制备状态(即,由于未分离干细胞等,因此是包含各种细胞的状态)下,分泌增强神经前体细胞的增殖,生存,移动(迁移),分化成熟的因子。
[0185]
实施例3:基于胎儿附属物来源组织培养上清的神经再生(体外)
[0186]
1)对神经前体细胞的效果
[0187]
实施例2中制备的神经前体细胞悬浮于神经细胞基底完全培养基(stemcell technologies公司制造)中,接种于μ-slide chemotaxis(易必迪公司制造)中,加入50%(v/v)的实施例1中得到的人华通氏胶来源间充质细胞的培养上清,在37℃,5%co2的条件下培养。作为对照,加入等量的制备华通氏胶来源间充质细胞培养上清时使用的培养基。通过显微镜观察,评价了在培养第3天和第7天的神经前体细胞的增殖和分化成熟。如图2所示,确认到与对照组相比,加入了华通氏胶来源间充质细胞的神经前体细胞在培养的第3天轴突延伸,在培养的第3天,第7天促进了细胞的增殖或维持生存,还观察到神经前体细胞的移动(迁移)。
[0188]
以上结果表明,华通氏胶来源间充质细胞在制备状态(即,由于未分离干细胞等,因此是包含各种细胞的状态)下,分泌增强神经前体细胞的增殖,生存,移动(迁移),分化成熟的因子,华通氏胶来源间充质细胞的培养上清促进神经再生。
[0189]
2)对神前体细胞的效果(2)。
[0190]
神经前体细胞,人类神经母细胞瘤株sh-sy5y(atcc,编号crl-2226),在dmem培养基中以2
×
l05细胞/ml的数量接种于96孔塑料板中,每孔100μl。加入100μl的实施例1中制备的各种培养上清,并在37℃、5%co2的条件下培养5天。作为对照,添加等量的制造各种培养上清时使用的培养基并进行培养。培养后用相差显微镜拍摄,使用分析软件imagej(nih)测量了神经突长度。
[0191]
对照组平均神经突的长度为29μm,而加入了人华通氏胶来源间充质细胞,人羊膜来源间充质细胞和人绒毛膜来源间充质细胞的培养上清时平均神经突的长度分别为62μm,43μm和41μm(n=3孔),胎儿附属物来源组织细胞培养上清促进神经前体细胞的轴突延伸,并促进神经分化。
[0192]
以上结果表明,胎儿附属物来源组织细胞在制备状态(即,由于未分离干细胞等,因此是包含各种细胞的状态)下,分泌增强神经前体细胞的生存维持和分化成熟的因子,胎儿附属物来源组织细胞的培养上清促进神经再生。
[0193]
3)培养上清液所含的因子
[0194]
通过抗体阵列(raybiotech公司制造,human cytokine array c5)研究了实施例1中制备的华通氏胶来源间充质细胞,羊膜来源间充质细胞,绒毛膜来源间充质细胞的培养上清中所含的因子(n=3)。如表1~3所示,培养上清中含有il-6等细胞因子、ccl2、cxcl1、cxcl5、cxcl7、cxcl8、groa/b/g等趋化因子、bdnf、egf等生长因子、骨桥蛋白(opn)等,这些因子被认为能促进神经再生。另外,用8、41、73、81%的浓度添加深层海水的培养基制备培养上清时,确认到这部分因子或所有因子的浓度增加。
[0195]
表1 华通氏胶来源间充质细胞的培养上清所含的因子
[0196]
[0197][0198]
表2 羊膜来源间充质细胞的培养上清所含的因子
[0199]
[0200][0201]
表3 绒毛膜来源间充质细胞的培养上清所含的因子
[0202]
[0203][0204]
实施例4:基于胎儿附属物来源组织细胞培养上清的神经再生(体内)
[0205]
1)小鼠缺氧再灌注处理儿童脑性瘫痪模型的构建
[0206]
采用icr小鼠(日本查士利华,crl:cd1),根据rice-vannucci等方法制备缺氧再灌注治疗儿童脑性瘫痪模型小鼠(wang等,j matern fetal neonatal med.2015;28(7):842-7)。用2%的异氟醚麻醉出生1周龄(7~9天)的小鼠(雌性和雄性),用脑动脉瘤夹(mizuho公司制造)对右颈动脉进行梗塞处理。个体在8%氧浓度下放置120分钟,然后取出脑动脉夹,并对血流进行再灌注。将脑损伤症状固定3周后的小鼠用于以下实验。
[0207]
2)基于华通氏胶来源间充质细胞培养上清的治疗(1)
[0208]
将实施例1中制备的10μl的华通氏胶来源间充质细胞培养上清,隔一天对缺氧处理的儿童脑性瘫痪模型小鼠进行鼻内给药,持续2周。使用治疗后的小鼠进行y-maze试验(小原医科产业公司制造,ym-3002),对于8分钟的自由行动,测定自发行动指标的总条目数、作为短期工作记忆指标的交替行动率(n=4)。如图3所示,治疗2周后,培养上清给药组
的自发性行动,短期工作记录得到了改善。
[0209]
3)基于华通氏胶来源间充质细胞培养上清的治疗(2)
[0210]
将实施例1中制备的10μl华通氏胶来源间充质细胞培养上清,隔一天鼻内给药于缺氧处理的儿童脑性瘫痪模型小鼠,持续2周。使用治疗后对小鼠进行转子杆试验(室町机械公制造,mk-610a),测量在300秒内加速至80rpm的旋转杆上落下的时间,结果培养上清给药组以治疗1周后为界线,显示出恢复趋势(治疗前、治疗1周和治疗2周后的步行时间分别为健康小鼠的67、34、50%(n=2))。
[0211]
然后,华通氏胶来源间充质细胞培养上清的治疗效果得到了长期的证实。将经过缺氧处理的儿童脑性瘫痪模型小鼠随机分为两组,对治疗组的小鼠每隔一天鼻内给药10μl的实施例1中制备的华通氏胶来源间充质细胞培养上清,持续两周(n=5)。使用治疗前后的小鼠进行旋转杆试验(室町机械公制造,mk-610a),测量在300秒内加速至40rpm的旋转杆上落下的时间。与对照组(非治疗组:n=2)相比,用华通氏胶来源间充质细胞培养上清治疗2周的组中观察到显示的恢复(2w:p《0.05,tukey检验),与健康小鼠(n=7)等同。此外,治疗效果在停药2周后(4w)仍然持续(图4)。
[0212]
综上所述,认识了胎儿附属物来源组织细胞在制备状态(即,由于未分离干细胞等,因此是包含各种细胞的状态)下,分泌增强神经前体细胞的增殖、生存、归巢、分化成熟的因子,胎儿附属物来源组织细胞的培养上清能够再生神经,用于治疗儿童脑性瘫痪等脑神经损伤。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1