脂质纳米颗粒
脂质纳米颗粒
发明领域
1.本发明涉及脂质纳米颗粒(lnp)领域;更具体地包含可电离的脂质、磷脂、甾醇、peg脂质和一种或多种核酸。本发明的lnp的特征在于包含小于约1摩尔%的c14-peg2000脂质;以及特定百分比的其他脂质。本发明提供了lnp用于核酸分子的免疫原性递送,特别是mrna的免疫原性递送的用途;从而使它们非常适合用于疫苗,诸如用于癌症或传染性疾病的治疗。最后,提供了用于制备这样的lnp的方法。
2.发明背景
3.生物活性物质的靶向递送领域的主要挑战之一通常是它们的不稳定性和低细胞穿透潜力。对于核酸分子,特别是(m)rna分子的递送,情况尤其如此。因此,适当的包装对于充分的保护和递送是至关重要的。因此,持续需要用于包装生物活性物质诸如核酸的方法和组合物。
4.在这方面,基于脂质的纳米颗粒组合物例如脂质复合物(lipoplex)和脂质体已经用作生物活性物质的包装载体,以允许运输到细胞和/或细胞内区室中。这些基于脂质的纳米颗粒组合物通常包含不同脂质的混合物,诸如阳离子脂质、可电离的脂质、磷脂、结构脂质(诸如甾醇或胆固醇)、peg(聚乙二醇)脂质、
…
(如reichmuth等人,2016中综述的)。
5.已经开发了由4种脂质(阳离子或可电离的脂质、磷脂、甾醇和聚乙二醇化脂质)的混合物组成的基于脂质的纳米颗粒,用于在全身施用后将sirna和mrna非免疫原性递送到肝脏。虽然许多这样的脂质组合物是本领域已知的,但是用于体内mrna递送的脂质组合物通常包含至少1.5mol水平的peg脂质,并且具有低的可电离的脂质:磷脂的比率,诸如约1:1至约5:1。
6.然而,我们现在已经出人意料地发现,使用低量(即小于约1摩尔%)的peg脂质产生高度适用于在全身注射lnp后免疫原性递送mrna的纳米颗粒。通过这样的低水平的peg脂质与相对高水平的可电离的脂质(即55
–
70摩尔%)和相对低水平的磷脂(即小于约10摩尔%)的组合,发现这些效果甚至因此比具有相对高比率的可电离的脂质:磷脂(即6:1
–
11:1)的lnp更显著。另外,本发明的一些实施方案的特征在于低百分比的甾醇(即小于约30摩尔%,诸如约25摩尔%)。
7.发明概述
8.在第一方面,本发明提供了脂质纳米颗粒(lnp),其包含:
[0009]-可电离的脂质;
[0010]-磷脂;
[0011]-甾醇;
[0012]-peg脂质;和
[0013]-一种或多种mrna分子;
[0014]
其特征在于
[0015]-所述peg脂质是c14-peg脂质;
[0016]-所述lnp包含小于约1摩尔%的所述peg脂质;
[0017]-所述可电离的脂质的摩尔百分比是约50
–
70摩尔%和在50
–
70摩尔%之间;和
[0018]-所述甾醇的摩尔百分比是约25摩尔%或25摩尔%以上。
[0019]
在另外的方面,本发明提供了脂质纳米颗粒(lnp),其包含:
[0020]-可电离的脂质;
[0021]-磷脂;
[0022]-甾醇;
[0023]-peg脂质;和
[0024]-一种或多种mrna分子;
[0025]
其特征在于
[0026]-所述peg脂质是c14-peg脂质;
[0027]-所述lnp包含小于约1摩尔%的所述peg脂质;
[0028]-所述可电离的脂质的摩尔百分比是约50
–
60摩尔%和在50
–
60摩尔%之间;和
[0029]-所述甾醇的摩尔百分比是约30摩尔%或30摩尔%以上。
[0030]
在本发明的另外的具体实施方案中,所述lnp包含约0.5摩尔%至约0.9摩尔%的所述peg脂质。
[0031]
在另一具体实施方案中,所述磷脂的摩尔百分比小于约10摩尔%;优选地约5摩尔%。
[0032]
在本发明的另外的实施方案中,可电离的脂质与磷脂的比率在5:1以上;优选为约6:1至11:1;最优选为约11:1。
[0033]
在本发明的又另外的实施方案中,所述可电离的脂质的摩尔百分比是约55
–
60摩尔%和在55
–
60摩尔%之间。
[0034]
在本发明的具体实施方案中,所述c14-peg脂质是二肉豆蔻酰基脂质,即具有2个c14脂肪酸尾部,诸如所述c14-peg2000脂质优选地选自包含以下的列表:1,2-二肉豆蔻酰基-rac-甘油-3-甲氧基聚乙二醇-2000(dmg-peg2000)或2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺二醇-2000(dmpe-peg2000)。
[0035]
在本发明的另一具体实施方案中,所述可电离的脂质选自包含以下的列表:
[0036]-1,1
‘‑
((2-(4-(2-((2-(双(2-羟基十二烷基)氨基)乙基)(2-羟基十二烷基)氨基)乙基)哌嗪-1-基)乙基)氮烷二基)双(十二烷-2-醇)(c12-200);
[0037]-4-二甲基氨基丁酸二亚油基甲酯(dlin-mc3-dma);或
[0038]-式(i)的化合物:
[0039][0040]
其中:
[0041]
rcoo选自包含以下的列表:肉豆蔻酰基、α-d-生育酚琥珀酰基、亚油酰基和油酰基;并且x选自包含以下的列表:
[0042][0043]
在优选的实施方案中,所述可电离的脂质是式(i)的脂质,其中rcoo是α-d-生育酚
琥珀酰基,并且x是
[0044]
在本发明的又另外的实施方案中,所述磷脂选自包含以下的列表:1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)及其混合物;特别地dope、dopc及其混合物。
[0045]
在本发明的又另外的实施方案中,所述甾醇选自包含以下的列表:胆固醇、麦角固醇、菜油甾醇、氧甾醇、樟芝甾醇(antrosterol)、链甾醇、尼卡甾醇(nicasterol)、谷甾醇和豆甾醇;优选胆固醇。
[0046]
在本发明的又另外的实施方案中,所述lnp包含约5
–
15摩尔%的所述磷脂。
[0047]
在本发明的具体实施方案中,所述lnp包含:
[0048]-约50
–
70摩尔%的所述可电离的脂质;
[0049]-约5
–
15摩尔%的所述磷脂;
[0050]-约0.5
–
0.9摩尔%的所述peg脂质;和
[0051]
余量为所述甾醇。
[0052]
在本发明的具体实施方案中,所述lnp包含:
[0053]-约50
–
60摩尔%的所述可电离的脂质;
[0054]-约5
–
15摩尔%的所述磷脂;
[0055]-约0.5
–
0.9摩尔%的所述peg脂质;和
[0056]
余量为所述甾醇。
[0057]
在本发明的非常具体的实施方案中,所述lnp包含:
[0058]-约50摩尔%的所述可电离的脂质;
[0059]-约10摩尔%的dope;
[0060]-约39.5摩尔%的胆固醇;和
[0061]-约0.5摩尔%的dmg-peg2000。
[0062]
在本发明的另一非常具体的实施方案中,所述lnp包含:
[0063]-约56.5摩尔%的所述可电离的脂质;
[0064]-约5摩尔%的dope;
[0065]-约38摩尔%的胆固醇;和
[0066]-约0.5摩尔%的dmg-peg2000。
[0067]
在本发明的另一非常具体的实施方案中,所述lnp包含:
[0068]-约65摩尔%的所述可电离的脂质;
[0069]-约9.5摩尔%的dope;
[0070]-约25摩尔%的胆固醇;和
[0071]-约0.5摩尔%的dmg-peg2000。
[0072]
在更具体的实施方案中,所述一种或多种mrna分子选自包含以下的列表:编码免疫调节多肽的mrna和/或编码抗原的mrna。所述编码免疫调节的mrna可以例如选自包含以下的列表:编码cd40l、cd70和catlr4的mrna分子。
[0073]
在又另外的方面,本发明提供了包含一种或多种如本文所定义的脂质纳米颗粒和
可接受的药用载体的药物组合物或疫苗。
[0074]
本发明还提供了如本文所定义的脂质纳米颗粒、药物组合物或疫苗,其用于人类或兽医学;特别是用于治疗癌症或传染性疾病。。
[0075]
附图简述
[0076]
现在具体参考附图,需强调的是,所示的细节仅作为示例,并且仅出于说明性地讨论本发明的不同实施方案的目的。它们是为了提供被认为是本发明的原理和构思方面的最有用和最容易的描述而呈现的。在这点上,不试图比对于本发明的基本理解所需必需的更详细地示出本发明的结构细节。结合附图的描述使得如何可以在实践中实施本发明的若干形式对于本领域技术人员是显而易见的。
[0077]
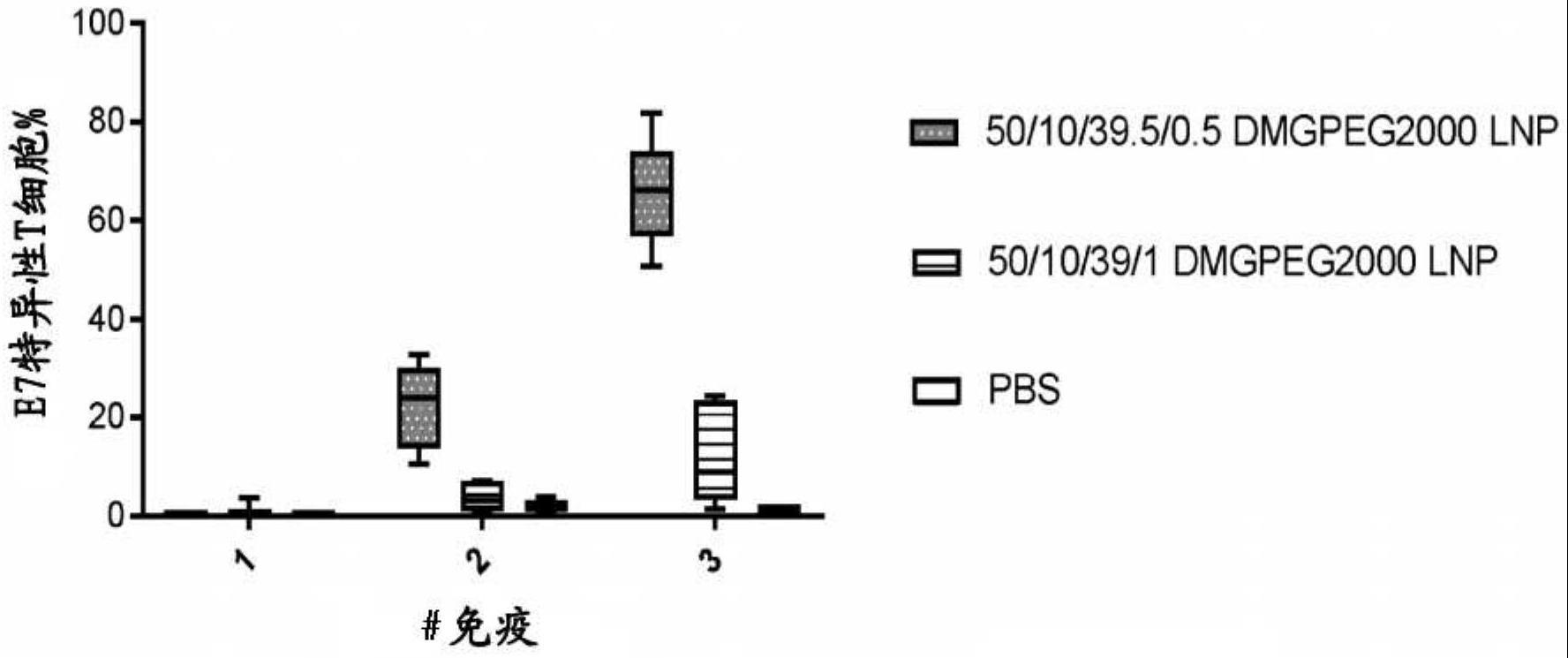
图1:显示了用由ss-ec/dope/胆固醇/dmg-peg2000以指定的摩尔比组成的e7 mrna lnp进行三次静脉内免疫的结果。
[0078]
图2:显示了用由ss-ec/dope/胆固醇/dmg-peg2000以指定的摩尔比组成的e7 mrna lnp进行三次静脉内免疫的结果。
[0079]
图3:显示了用包封在低百分比peg lnp(50/10/39.5/0.5可电离的脂质/dope/胆固醇/peg-脂质)中的10μg adpgk mrna或用50μgadpgk合成长肽(slp)四次静脉内施用的结果。
[0080]
图4:针对最大t细胞应答的doe驱动的lnp组合物的优化。a,在用doe文库的e7 mrna lnp免疫三次(每次间隔一周)之后,血液中的e7特异性t细胞。b.e7特异性cd8 t细胞应答作为doe文库的11种lnp的dmg-peg2000%的函数。c,显示了用预测的最佳lnp34和非最佳lnp35三次免疫(每次间隔一周)之后,血液中的e7特异性t细胞,平均值
±
sd。统计学通过单因素anova与sidak多重比较检验评估。***p《0.001
[0081]
图5:优化的mrna lnp疫苗诱导定性的t细胞应答和强的抗肿瘤功效。a,血液中e7特异性cd8
+
t细胞的动力学。b,血清中的ifn-y随重复免疫而增加。c.三次免疫之后由脾cd8+e7特异性t细胞产生ifn-γ和tnf-α。d,lnp34免疫小鼠中的平均tc-1肿瘤生长。e,lnp34免疫的小鼠的存活。f,用lnp34两次免疫之后的tc-1肿瘤浸润淋巴细胞(til)。g,til的e7特异性。a,b,f,g,显示了平均值
±
sd。c,显示了平均值
±
sem。d,统计学通过mantel-cox对数秩检验评估。f,g,统计学通过单因素anova与tukey多重比较检验评估,**p《0.01,***p《0.001,ns=不显著。
[0082]
图6:lnp被多种(先天)免疫细胞摄取并活化。a.在肾、肺、心脏、肝和脾中的荧光素酶活性,以总荧光素酶活性的百分比(%)计。b.通过注射lnp的小鼠相对于注射tbs缓冲液的小鼠的cy5 mfi的差异测量的多种细胞类型中lnp的摄取。c.在肾、肺、心脏、肝和脾中的荧光素酶活性,以总荧光素酶活性的百分比计。与非最佳lnp(lnp35)相比,最佳lnp34在脾中显示增加的荧光素酶活性。d.与非最佳lnp35相比,最佳lnp34的细胞摄取更高。e.观察到血清中ifn-a和ip-10细胞因子的瞬时增加(lnp施用后6小时与24小时相比)。f.cdc1和cdc2上的cd86表达被非最佳lnp35弱上调,而被最佳lnp34强上调。a-d显示平均值
±
sd。d,统计学通过单因素anova与sidak多重比较检验评估。**p《0.01,***p《0.001,ns=不显著。
[0083]
图7:c,在用交替的最佳(lnp59)和非最佳(lnp53)dmg-peg2000lnp两次免疫(每次间隔一周)之后,血液中的e7特异性t细胞,显示了平均值
±
sd。统计学通过单因素anova与sidak多重比较检验评估。***p《0.001。
[0084]
发明详述
[0085]
如本文以上已经详述的,本发明提供了包含c14-peg脂质(例如c14-peg2000脂质)的lnp,其以相对低的量(例如小于约1摩尔%)存在,为此,我们已经出人意料地发现这些高度适用于核酸、特别是mrna的免疫原性递送。
[0086]
在本发明的上下文中,“核酸分子的免疫原性递送”意指将核酸分子递送至细胞,由此与细胞接触,所述核酸分子在细胞内的内化和/或表达导致免疫应答的诱导。
[0087]
因此,在第一方面,本发明提供了脂质纳米颗粒(lnp),其包含:
[0088]-可电离的脂质;
[0089]-磷脂;
[0090]-甾醇;
[0091]-peg脂质;和
[0092]-一种或多种mrna分子;
[0093]
其特征在于
[0094]-所述peg脂质是c14-peg脂质;
[0095]-所述lnp包含小于约1摩尔%的所述peg脂质;
[0096]-所述可电离的脂质的摩尔百分比是约50
–
70摩尔%和在50
–
70摩尔%之间;和
[0097]-所述甾醇的摩尔百分比是约25摩尔%或25摩尔%以上。
[0098]
在另外的实施方案中,本发明提供了脂质纳米颗粒(lnp),其包含:
[0099]-可电离的脂质;
[0100]-磷脂;
[0101]-甾醇;
[0102]-peg脂质;和
[0103]-一种或多种核酸分子;特别是mrna分子;
[0104]
其特征在于
[0105]-所述peg脂质是c14-peg脂质;
[0106]-所述lnp包含小于约1摩尔%的所述peg脂质;
[0107]-所述可电离的脂质的摩尔百分比是约50
–
60摩尔%和在50
–
60摩尔%之间;和
[0108]-所述甾醇的摩尔百分比是约30摩尔%或30摩尔%以上。
[0109]
在本发明的另外的具体实施方案中,所述lnp包含约0.5摩尔%至约0.9摩尔%的所述peg脂质。
[0110]
脂质纳米颗粒(lnp)通常被认为是由不同脂质的组合组成的纳米级颗粒。虽然这样的lnp中可以包括许多不同类型的脂质,但是本发明的lnp通常由可电离的脂质、磷脂、甾醇和peg脂质的组合组成。
[0111]
如本文所使用的,术语“纳米颗粒”是指具有使颗粒适于特别是核酸的全身施用,特别是静脉内施用的直径的任何颗粒,通常具有小于1000纳米(nm),优选小于500nm,甚至更优选小于200nm,例如50至200nm;优选80至160nm的直径。
[0112]
在本发明的上下文中,术语“peg脂质”或供选择地“peg化脂质”意指用peg(聚乙二醇)基团修饰的任何合适的脂质。本发明的peg脂质的特征在于为c14-peg脂质。这些脂质含有限定脂质的分子量的聚乙二醇部分,以及包含14个c-原子的脂肪酸尾部。在具体实施方
案中,所述c14-peg2000脂质基于二肉豆蔻酰基,即具有2个c14尾部,诸如选自包含以下的列表:基于二肉豆蔻酰基的peg2000脂质,诸如dmg-peg2000脂质(1,2-二肉豆蔻酰基-rac-甘油-3-甲氧基聚乙二醇-2000)或2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺二醇-2000(dmpe-peg2000)。
[0113][0114][0115]
在本发明的上下文中,在化合物或脂质的上下文中,术语“可电离的”(或供选择地阳离子的)意指在所述化合物或脂质中存在任何不带电荷的基团,其能够通过产生离子(通常为h
+
离子)而解离并且因此自身变成带正电荷的。供选择地,所述化合物或脂质中的任何不带电荷的基团可以产生电子并且因此变成带负电荷的。
[0116]
在本发明的上下文中,可以合适地使用任何类型的可电离的脂质。具体地,合适的可电离的脂质是可电离的氨基脂质,其包含经由s-s键连接的2个相同或不同的尾部,所述尾部中的每一个包含诸如由以下表示的可电离的胺:
[0117][0118]
在具体实施方案中,所述可电离的脂质是式(i)的化合物:
[0119][0120]
其中:
[0121]
rcoo选自包含以下的列表:肉豆蔻酰基、α-d-生育酚琥珀酰基、亚油酰基和油酰基;且
[0122]
x选自包含以下的列表:
[0123][0124]
这样的可电离的脂质可以具体地由下式中的任一个表示:
[0125][0126][0127]
以上脂质中的后者表示如实施例部分中所使用的coatsome ss-ec。
[0128]
更具体地,所述可电离的脂质是式(i)的脂质,其中rcoo是α-d-生育酚琥珀酰基,并且x是
[0129][0130]
诸如由以下表示
[0131][0132]
其他合适的可电离的脂质可以选自1,1
‘‑
((2-(4-(2-((2-(双(2-羟基十二烷基)氨基)乙基)(2-羟基十二烷基)氨基)乙基)哌嗪-1-基)乙基)氮烷二基)双(十二烷-2-醇)(c12-200);以及4-二甲基氨基丁酸二亚油基甲酯(dlin-mc3-dma)。
[0133][0134]
因此,在具体实施方案中,本发明提供了脂质纳米颗粒,其包含:
[0135]-式(i)的化合物:
[0136][0137]
其中:
[0138]
rcoo选自包含以下的列表:肉豆蔻酰基、α-d-生育酚琥珀酰基、亚油酰基和油酰基;并且x选自包含以下的列表:
[0139][0140]-磷脂;
[0141]-甾醇;
[0142]-peg脂质;和
[0143]-一种或多种核酸分子;特别是mrna分子;
[0144]
其特征在于
[0145]-所述peg脂质是c14-peg脂质;
[0146]-所述lnp包含小于约1摩尔%的所述peg脂质;
[0147]-所述可电离的脂质的摩尔百分比是约50
–
70摩尔%和在50
–
70摩尔%之间;和
[0148]-所述甾醇的摩尔百分比是约25摩尔%或25摩尔%以上。
[0149]
因此,在具体实施方案中,本发明提供了脂质纳米颗粒,其包含:
[0150]-式(i)的化合物:
[0151][0152]
其中:
[0153]
rcoo选自包含以下的列表:肉豆蔻酰基、α-d-生育酚琥珀酰基、亚油酰基和油酰基;并且x选自包含以下的列表:
[0154][0155]-磷脂;
[0156]-甾醇;
[0157]-peg脂质;和
[0158]-一种或多种核酸分子;特别是mrna分子;
[0159]
其特征在于
[0160]-所述peg脂质是c14-peg脂质;
[0161]-所述lnp包含小于约1摩尔%的所述peg脂质;
[0162]-所述可电离的脂质的摩尔百分比是约50
–
60摩尔%和在50
–
60摩尔%之间;和
[0163]-所述甾醇的摩尔百分比是约30摩尔%或30摩尔%以上。
[0164]
在优选实施方案中,所述可电离的脂质是式(i)的脂质,其中rcoo是α-d-生育酚琥珀酰基,并且x是
[0165][0166]
在本发明的上下文中,术语“磷脂”意指由两个疏水性脂肪酸“尾部”和由磷酸酯基团组成的亲水性“头部”组成的脂质分子。该两种组分最通常由甘油分子连接在一起,因此,本发明的磷脂优选地是甘油-磷脂。此外,通常用简单的有机分子诸如胆碱(即产生磷酸胆碱)或乙醇胺(即产生磷酸乙醇胺)修饰磷酸基团。
[0167]
在本发明的上下文中,合适的磷脂可以选自包含以下的列表:1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)、1,2-二亚油酰基-sn-甘油-3-磷酸胆碱(dlpc)、1,2-二肉豆蔻酰基-sn-甘油-磷酸胆碱(dmpc)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)、1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(dppc)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)、1,2-二(十一烷酰基)-sn-甘油-磷酸胆碱(dupc)、1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸胆碱(popc)、1,2-二-o-十八碳烯基-sn-甘油-3-磷酸胆碱(18:0二醚pc)、1-油酰基-2-胆甾醇基半琥珀酰基-sn-甘油-3-磷酸胆碱(ochemspc)、1-十六烷基-sn-甘油-3-磷酸胆碱(c 16溶血pc)、1,2-二亚麻酰基-sn-甘油-3-磷酸胆碱、1,2-二花生四烯酰基-sn-甘油-3-磷酸胆碱、1,2-二(二十二碳己酰基)-sn-甘油-3-磷酸胆碱、1,2-二植烷酰基-sn-甘油-3-磷酸乙醇胺(me 16.0pe)、1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺、1,2-二亚油酰基-sn-甘油-3-磷酸乙醇胺、1,2-二亚麻酰基-sn-甘油-3-磷酸乙醇胺、1,2-二花生四烯酰基-sn-甘油-3-磷酸乙醇胺、1,2-二(二十二碳己酰基)-sn-甘油-3-磷酸乙醇胺、1,2-二油酰基-sn-甘油-3-磷酸-rac-(1-甘油)钠盐(dopg)、鞘磷脂、及其混合物。
[0168]
在本发明的具体实施方案中,当将磷脂选择为dspc时,可电离的脂质可以有利地是dlin-mc3-dma。
[0169]
在更具体的实施方案中,所述磷脂选自包含以下的列表:1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)、及其混合物;特别是dope、dopc及其混合物。
[0170]
因此,在具体实施方案中,本发明提供了脂质纳米颗粒,其包含:
[0171]-式(i)的可电离的脂质;
[0172][0173]
其中:
[0174]
rcoo选自包含以下的列表:肉豆蔻酰基、α-d-生育酚琥珀酰基、亚油酰基和油酰基;和
[0175]
x选自包含以下的列表:
[0176][0177]
特别是式(i)的脂质,其中rcoo是α-d-生育酚琥珀酰基,并且x是
[0178][0179]-选自dopc和dope、或其混合物的磷脂;
[0180]-甾醇;
[0181]-以小于约1摩尔%存在的c14-peg2000脂质;和
[0182]-一种或多种核酸分子;特别是mrna分子;
[0183]
其特征在于
[0184]-所述可电离的脂质的摩尔百分比是约50
–
70摩尔%和在50
–
70摩尔%之间;和
[0185]-所述甾醇的摩尔百分比是约25摩尔%或25摩尔%以上。
[0186]
因此,在具体实施方案中,本发明提供了脂质纳米颗粒,其包含:
[0187]-式(i)的可电离的脂质;
[0188][0189]
其中:
[0190]
rcoo选自包含以下的列表:肉豆蔻酰基、α-d-生育酚琥珀酰基、亚油酰基和油酰基;和
[0191]
x选自包含以下的列表:
[0192][0193]
特别是式(i)的脂质,其中rcoo是α-d-生育酚琥珀酰基,并且x是
[0194][0195]-选自dopc和dope、或其混合物的磷脂;
[0196]-甾醇;
[0197]-以小于约1摩尔%存在的c14-peg2000脂质;和
[0198]-一种或多种核酸分子;特别是mrna分子;
[0199]
其特征在于
[0200]-所述可电离的脂质的摩尔百分比是约50
–
60摩尔%和在50
–
60摩尔%之间;和
[0201]-所述甾醇的摩尔百分比是约30摩尔%或30摩尔%以上。
[0202]
在本发明的上下文中,术语“甾醇”(也称为类固醇)是甾体化合物的一个亚类,其天然存在于植物、动物和真菌中,或者可以由一些细菌产生。在本发明的上下文中,可以使用任何合适的甾醇,例如选自:胆固醇、麦角固醇、菜油甾醇、氧甾醇、樟芝甾醇、链甾醇、尼卡甾醇、谷甾醇和豆甾醇;优选胆固醇。
[0203]
因此,在具体实施方案中,本发明提供了脂质纳米颗粒,其包含:
[0204]-式(i)的可电离的脂质;
[0205][0206]
其中:
[0207]
rcoo选自包含以下的列表:肉豆蔻酰基、α-d-生育酚琥珀酰基、亚油酰基和油酰基;和
[0208]
x选自包含以下的列表:
[0209][0210]
特别是式(i)的脂质,其中rcoo是α-d-生育酚琥珀酰基,并且x是
[0211][0212]-选自dopc和dope、或其混合物的磷脂;
[0213]-胆固醇;
[0214]-以小于约1摩尔%存在的c14-peg2000脂质;和
[0215]-一种或多种核酸分子;特别是mrna分子
[0216]
其特征在于
[0217]-所述可电离的脂质的摩尔百分比是约50
–
70摩尔%和在50
–
70摩尔%之间;和
[0218]-所述甾醇的摩尔百分比是约25摩尔%或25摩尔%以上。
[0219]
因此,在具体实施方案中,本发明提供了脂质纳米颗粒,其包含:
[0220]-式(i)的可电离的脂质;
[0221][0222]
其中:
[0223]
rcoo选自包含以下的列表:肉豆蔻酰基、α-d-生育酚琥珀酰基、亚油酰基和油酰基;和
[0224]
x选自包含以下的列表:
[0225][0226]
特别是式(i)的脂质,其中rcoo是α-d-生育酚琥珀酰基,并且x是
[0227][0228]-选自dopc和dope、或其混合物的磷脂;
[0229]-胆固醇;
[0230]-以小于约1摩尔%存在的c14-peg2000脂质;和
[0231]-一种或多种核酸分子;特别是mrna分子
[0232]
其特征在于
[0233]-所述可电离的脂质的摩尔百分比是约50
–
60摩尔%和在50
–
60摩尔%之间;和
[0234]-所述甾醇的摩尔百分比是约30摩尔%或30摩尔%以上。
[0235]
在本发明的非常具体的实施方案中,所述脂质纳米颗粒包含:
[0236]-式(i)的可电离的脂质;
[0237][0238]
其中:
[0239]
rcoo选自包含以下的列表:肉豆蔻酰基、α-d-生育酚琥珀酰基、亚油酰基和油酰基;和
[0240]
x选自包含以下的列表:
[0241][0242]
特别是式(i)的脂质,其中rcoo是α-d-生育酚琥珀酰基,并且x是
[0243][0244]-选自dopc和dope、或其混合物的磷脂;
[0245]-胆固醇;
[0246]-以小于约1摩尔%存在的dmg-peg2000脂质;和
[0247]-一种或多种核酸分子;特别是mrna分子;
[0248]
其特征在于
[0249]-所述可电离的脂质的摩尔百分比是约50
–
70摩尔%和在50
–
70摩尔%之间;和
[0250]-所述甾醇的摩尔百分比是约25摩尔%或25摩尔%以上。
[0251]
在本发明的非常具体的实施方案中,所述脂质纳米颗粒包含:
[0252]-式(i)的可电离的脂质;
[0253][0254]
其中:
[0255]
rcoo选自包含以下的列表:肉豆蔻酰基、α-d-生育酚琥珀酰基、亚油酰基和油酰基;和
[0256]
x选自包含以下的列表:
[0257][0258]
特别是式(i)的脂质,其中rcoo是α-d-生育酚琥珀酰基,并且x是
[0259][0260]-选自dopc和dope、或其混合物的磷脂;
[0261]-胆固醇;
[0262]-以小于约1摩尔%存在的dmg-peg2000脂质;和
[0263]-一种或多种核酸分子;特别是mrna分子;
[0264]
其特征在于
[0265]-所述可电离的脂质的摩尔百分比是约50
–
60摩尔%和在50
–
60摩尔%之间;和
[0266]-所述甾醇的摩尔百分比是约30摩尔%或30摩尔%以上。
[0267]
此外,我们已经发现,通过使用低水平的peg脂质与相对高水平的可电离的脂质(即50
–
70摩尔%;诸如50-65摩尔%或55
–
60摩尔%)和相对低水平的磷脂(即小于约10摩尔%)的组合,本发明的lnp的免疫原性作用甚至可以相应地比具有相对高比率的可电离的脂质:磷脂(即5:1
–
10:1;供选择地约6:1至约11:1)的lnp进一步增加。因此,高水平的可电离的脂质可以是例如约50摩尔%、约51摩尔%、约52摩尔%、约53摩尔%、约54摩尔%、约55摩尔%、约56摩尔%、约57摩尔%、约58摩尔%、约59摩尔%、约60摩尔%、约61摩尔%、约62摩尔%、约63摩尔%、约64摩尔%、约65摩尔%;约66摩尔%、约67摩尔%、约68摩尔%、约69摩尔%;约70摩尔%。
[0268]
因此,在另一具体实施方案中,所述磷脂的摩尔百分比是约5
–
15摩尔%和在5
–
15摩尔%之间;特别地约5
–
10mol%和在5
–
10mol%之间;更特别地小于约10摩尔%;诸如约9摩尔%、约8摩尔%、约7摩尔%、约6摩尔%;约5摩尔%;优选地约5摩尔%的磷脂。
[0269]
在本发明的具体实施方案中,所述lnp包含约5:1或5:1以上;优选地约6:1或6:1以上;更优选地8:1以上,最优选地约10:1;供选择地在约6:1至11:1之间;最优选地约11:1,诸如约10.76:1的可电离的脂质与磷脂的比率。
[0270]
在本发明的又另外的实施方案中,所述可电离的脂质的摩尔百分比是约50
–
70摩尔%和在50
–
70摩尔%之间;诸如50
–
65摩尔%,特别地约55
–
60摩尔%和在55
–
60摩尔%之间。
[0271]
通常使用甾醇作为平衡脂质,并且在一些实施方案中总计约25摩尔%或25摩尔%以上,诸如约25摩尔%、约26摩尔%、约27摩尔%、约28摩尔%、约29摩尔%。供选择地,其总计约30摩尔%或30摩尔%以上;诸如约30摩尔%;约31摩尔%;约32摩尔%;约33摩尔%;约34摩尔%;约35摩尔%...。在具体实施方案中,胆固醇的量是约25摩尔%至29摩尔%和在25摩尔%至29摩尔%之间。因此,通常将甾醇的浓度与其他脂质的浓度进行权衡,以便补足至正好100%。因此,甾醇的量可以计算为100摩尔%减去磷脂的摩尔%减去peg脂质的摩尔%减去可电离的脂质的摩尔%。
[0272]
因此,在本发明的具体实施方案中,适用以下项中的一项或多项:
[0273]-所述lnp包含约50摩尔%至70摩尔%和在50摩尔%至70摩尔%之间的所述可电离的脂质;供选择地约50
–
65摩尔%和在50
–
65摩尔%之间;或50
–
60摩尔%;诸如约55
–
60摩尔%和在55
–
60摩尔%之间;
[0274]-所述lnp包含约5摩尔%至15摩尔%和在5摩尔%至15摩尔%之间的所述磷脂;优
选地小于约10摩尔%;最优选地约5摩尔%;
[0275]-所述lnp包含约0.5摩尔%至0.9摩尔%和在0.5摩尔%至0.9摩尔%之间的所述peg脂质;
[0276]
余量为所述甾醇。
[0277]
因此,在本发明的非常具体的实施方案中,所述lnp包含:
[0278]-约50
–
70摩尔%的式(i)的可电离的脂质;
[0279][0280]
其中:
[0281]
rcoo选自包含以下的列表:肉豆蔻酰基、α-d-生育酚琥珀酰基、亚油酰基和油酰基;和
[0282]
x选自包含以下的列表:
[0283][0284]
特别是式(i)的脂质,其中rcoo是α-d-生育酚琥珀酰基,并且x是
[0285][0286]-约5
–
15摩尔%的选自dopc和dope、或其混合物的磷脂;
[0287]-余量的胆固醇;
[0288]-约0.5
–
0.9摩尔%的dmg-peg2000脂质;和
[0289]-一种或多种核酸分子,特别是mrna分子。
[0290]
因此,在本发明的非常具体的实施方案中,所述lnp包含:
[0291]-约50
–
60摩尔%的式(i)的可电离的脂质;
[0292][0293]
其中:
[0294]
rcoo选自包含以下的列表:肉豆蔻酰基、α-d-生育酚琥珀酰基、亚油酰基和油酰基;和
[0295]
x选自包含以下的列表:
[0296][0297]
特别是式(i)的脂质,其中rcoo是α-d-生育酚琥珀酰基,并且x是
[0298][0299]-约5
–
15摩尔%的选自dopc和dope、或其混合物的磷脂;
[0300]-余量的胆固醇;
[0301]-约0.5
–
0.9摩尔%的dmg-peg2000脂质;和
[0302]-一种或多种核酸分子,特别是mrna分子。
[0303]
在本发明的上下文中使用摩尔%的情况下,其意指相对于空纳米颗粒的指定组分的摩尔%,即在没有核酸的情况下的指定组分的摩尔%。这意味着组分的摩尔%是相对于存在于所述lnp中的可电离的脂质、磷脂、甾醇和peg脂质的总量计算的。
[0304]
在本发明的具体实施方案中,所述lnp包含:
[0305]-约50
–
60摩尔%的所述可电离的脂质;
[0306]-约5
–
15摩尔%的所述磷脂;
[0307]-约0.5
–
0.9摩尔%的所述dmg-peg2000脂质;和
[0308]
余量为所述甾醇。
[0309]
在本发明的非常具体的实施方案中,所述lnp包含:
[0310]-约56.5摩尔%的所述可电离的脂质;
[0311]-约5.25摩尔%的dope;
[0312]-约37.75摩尔%的胆固醇;和
[0313]-约0.5摩尔%的dmg-peg2000。
[0314]
在本发明的另一非常具体的实施方案中,所述lnp包含:
[0315]-约50摩尔%的所述可电离的脂质;
[0316]-约10摩尔%的dope;
[0317]-约39.5摩尔%的胆固醇;和
[0318]-约0.5摩尔%的dmg-peg2000。
[0319]
在本发明的另一非常具体的实施方案中,所述lnp包含:
[0320]-约50摩尔%的所述可电离的脂质;
[0321]-约11摩尔%的dope;
[0322]-约38.5摩尔%的胆固醇;和
[0323]-约0.5摩尔%的dmg-peg2000。
[0324]
在本发明的又另一非常具体的实施方案中,所述lnp包含:
[0325]-约50摩尔%的所述可电离的脂质;
[0326]-约7.76摩尔%的dope;
[0327]-约41.66摩尔%的胆固醇;和
[0328]-约0.58摩尔%的dmg-peg2000。
[0329]
在本发明的另一非常具体的实施方案中,所述lnp包含:
[0330]-约65摩尔%的所述可电离的脂质;
[0331]-约9.5摩尔%的dope;
[0332]-约25摩尔%的胆固醇;和
[0333]-约0.5摩尔%的dmg-peg2000。
[0334]
因此,在本发明的非常具体的实施方案中,所述lnp包含:
[0335]-约50摩尔%的式(i)的可电离的脂质;
[0336][0337]
其中:
[0338]
rcoo是α-d-生育酚琥珀酰基,并且x是
[0339][0340]-约10摩尔%的选自dopc和dope、或其混合物的磷脂;
[0341]-约39.5摩尔%的胆固醇;
[0342]-约0.5摩尔%的dmg-peg2000脂质;和
[0343]-一种或多种核酸分子,特别是mrna分子。
[0344]
在本发明的另一非常具体的实施方案中,所述lnp包含:
[0345]-约56.5摩尔%的式(i)的可电离的脂质;
[0346][0347]
其中:
[0348]
rcoo是α-d-生育酚琥珀酰基,并且x是
[0349][0350]-约5.25摩尔%的选自dopc和dope、或其混合物的磷脂;
[0351]-约37.75摩尔%的胆固醇;
[0352]-约0.5摩尔%的dmg-peg2000脂质;和
[0353]-一种或多种核酸分子,特别是mrna分子。
[0354]
在本发明的另一非常具体的实施方案中,所述lnp包含:
[0355]-约65摩尔%的式(i)的可电离的脂质;
[0356][0357]
其中:
[0358]
rcoo是α-d-生育酚琥珀酰基,并且x是
[0359][0360]-约9.5摩尔%的选自dopc和dope、或其混合物的磷脂;
[0361]-约25摩尔%的胆固醇;
[0362]-约0.5摩尔%的dmg-peg2000脂质;和
[0363]-一种或多种核酸分子,特别是mrna分子。
[0364]
在本发明的另一非常具体的实施方案中,所述lnp包含:
[0365]-约50摩尔%的式(i)的可电离的脂质;
[0366][0367]
其中:
[0368]
rcoo是α-d-生育酚琥珀酰基,并且x是
[0369][0370]-约11摩尔%的选自dopc和dope、或其混合物的磷脂;
[0371]-约38.5摩尔%的胆固醇;
[0372]-约0.5摩尔%的dmg-peg2000脂质;和
[0373]-一种或多种核酸分子,特别是mrna分子。
[0374]
在本发明的另一非常具体的实施方案中,所述lnp包含:
[0375]-约50摩尔%的式(i)的可电离的脂质;
[0376][0377]
其中:
[0378]
rcoo是α-d-生育酚琥珀酰基,并且x是
[0379][0380]-约7.76摩尔%的选自dopc和dope、或其混合物的磷脂;
[0381]-约41.66摩尔%的胆固醇;
[0382]-约0.58摩尔%的dmg-peg2000脂质;和
[0383]-一种或多种核酸分子,特别是mrna分子。
[0384]
在本发明的上下文中的其他特别适合的lnp的组成在表1中表示。
[0385]
表1:合适的lnp的组成
[0386]
[0387]
[0388][0389]
其他特别合适的lnp的特征在于以下的可电离的脂质/磷脂/甾醇/c14-peg2000脂质比率:
[0390]-50/10/39.5/0.5
[0391]-56.5/5/38/0.5
[0392]-50/11/38.5/0.5
[0393]-50/7.76/41.66/0.58
[0394]-65/9.5/25/0.5
[0395]
本发明人已经发现本发明的lnp特别适用于核酸的免疫原性递送。因此,本发明提供了包含一种或多种核酸分子的lnp,所述核酸分子例如dna或rna,更具体地是mrna。
[0396]
所述lnp中核酸的量通常由摩尔比,即阳离子脂质(可电离的脂质)与rna磷酸酯的比率表示。在本发明的上下文中,lnp的摩尔比是约4:1至16:1和在4:1至16:1之间。
[0397]
供选择地,所述lnp中核酸的量可以由n/p比率,即可电离的脂质中的氮原子与核酸中的磷酸酯基团的比率表示。在本发明的上下文中,lnp的n/p比率是约4:1至16:1和在4:1至16:1之间。
[0398]
在本发明的上下文中,“核酸”是脱氧核糖核酸(dna)或优选为核糖核酸(rna),更优选为mrna。根据本发明,核酸包括基因组dna、cdna、mrna、重组产生的和化学合成的分子。根据本发明的核酸可以是单链或双链且线性或共价封闭以形成环的分子形式。核酸可以用于例如以rna的形式引入(即转染)细胞,该rna可以通过从dna模板体外转录来制备。此外,可以在应用之前通过稳定序列、加帽和/或聚腺苷酸化来修饰rna。
[0399]
在本发明的上下文中,术语“rna”涉及包含核糖核苷酸残基并且优选完全或基本上由核糖核苷酸残基组成的分子。“核糖核苷酸”涉及在β-d-呋喃核糖基的2'位具有羟基的核苷酸。该术语包括双链rna,单链rna,分离的rna,例如部分纯化的rna、基本上纯的rna,合
成的rna,重组产生的rna,以及修饰的rna,其与天然存在的rna的区别在于一个或多个核苷酸的添加、缺失、置换和/或改变。这样的改变可包括将非核苷酸物质添加到例如rna的末端或内部,例如rna的一个或多个核苷酸处。rna分子中的核苷酸还可包含非标准核苷酸,例如非天然存在的核苷酸或化学合成的核苷酸或脱氧核苷酸。这些改变的rna可以称为类似物。核酸可以包含在载体中。如本文所用,术语“载体”包括技术人员已知的任何载体,包括质粒载体,粘粒载体,噬菌体载体例如λ噬菌体,病毒载体例如腺病毒或杆状病毒载体,或人工染色体载体例如细菌人工染色体(bac),酵母人工染色体,或天然存在的rna的类似物。
[0400]
根据本发明,术语“rna”包括并且优选地涉及“mrna”,其意指“信使rna”并且涉及可以使用dna作为模板产生并且编码肽或蛋白质的“转录物”。mrna通常包含5'非翻译区(5'-utr)、蛋白质或肽编码区和3'非翻译区(3'-utr)。mrna在细胞中和体外具有有限的半衰期。优选地,使用dna模板通过体外转录产生mrna。在本发明的一个实施方案中,通过体外转录或化学合成获得rna。体外转录方法是技术人员已知的。例如,有多种可商购获得的体外转录试剂盒。
[0401]
在本发明的具体实施方案中,所述mrna分子是编码免疫调节蛋白的mrna分子。
[0402]
在本发明的上下文中,术语“编码免疫调节蛋白的mrna分子”是指编码改变抗原呈递细胞(更特别地树突状细胞)的功能性的蛋白的mrna分子。这样的分子可以选自包含以下的列表:cd40l、cd70、catlr4、il-12p70、l-选择蛋白、ccr7、和/或4-1bbl、icosl、ox40l、il-21;更特别地cd40l、cd70和catlr4中的一种或多种。本发明的方法中所使用的免疫刺激因子的优选组合是cd40l和catlr4(即“dimix”)。在另一优选实施方案中,使用cd40l、cd70和catlr4免疫刺激分子的组合,其在本文中也称为“trimix”。
[0403]
在另一具体实施方案中,所述mrna分子是编码抗原和/或疾病特异性蛋白的mrna分子。
[0404]
根据本发明,术语“抗原”包括任何分子,优选地肽或蛋白质,其包含将引发免疫应答和/或免疫应答所针对的至少一个表位;因此,术语抗原也包括来自抗原的最小表位。如本文所定义的“最小表位”意指能够引发免疫应答的最小结构。优选地,在本发明的上下文中,抗原是任选地在加工后诱导免疫应答的分子,该免疫应答优选地对抗原或表达该抗原的细胞是特异性的。特别地,“抗原”涉及任选地在加工后由mhc分子呈递并且与t淋巴细胞(t细胞)特异性反应的分子。
[0405]
在一个具体的实施方案中,抗原是靶标特异性抗原,其可以是肿瘤抗原,或细菌、病毒或真菌抗原。所述靶标特异性抗原可源自以下任一种:从(一种或多种)靶细胞分离的总mrna,一种或多种特异性靶mrna分子,(一种或多种)靶细胞的蛋白裂解物,来自(一种或多种)靶细胞的特异性蛋白,或合成的靶标特异性肽或蛋白质以及编码靶标特异性抗原或其衍生肽的合成的mrna或dna。
[0406]
为了避免任何误解,本发明的lnp可以包含单个mrna分子,或者它们可以包含多个mrna分子,诸如一种或多种编码免疫调节蛋白的mrna分子和/或一种或多种编码抗原特异性蛋白和/或疾病特异性蛋白的mrna分子的组合。
[0407]
在非常具体的实施方案中,所述编码免疫调节分子的mrna分子可以与一种或多种编码抗原特异性蛋白和/或疾病特异性蛋白的mrna分子组合。例如,本发明的lnp可以包含编码免疫刺激分子cd40l、cd70和/或catlr4的mrna分子(诸如dimix或trimix);与一种或多
种编码抗原特异性蛋白和/或疾病特异性蛋白的mrna分子组合。因此,在非常具体的实施方案中,本发明的lnp包含编码cd40l、cd70和/或catlr4的mrna分子;与一种或多种编码抗原特异性蛋白和/或疾病特异性蛋白的mrna分子组合。
[0408]
在另外的方面,本发明提供了包含一种或多种如本文所定义的lnp的药物组合物。这样的药物组合物特别适合作为疫苗。因此,本发明还提供了包含一种或多种根据本发明的lnp的疫苗。
[0409]
在本发明的上下文中,如本文所使用的术语“疫苗”意指旨在提供针对疾病的适应性免疫(抗体和/或t细胞应答)的任何制剂。为此,如本文所意指的疫苗含有至少一种编码引发适应性免疫应答的抗原的mrna分子。该抗原可以以微生物的减弱或杀死形式、蛋白质或肽、或者编码核酸的抗原的形式存在。在本发明的上下文中,抗原意指被宿主的免疫系统识别为外源的蛋白质或肽,从而刺激针对其的抗体的产生,目的是对抗这样的抗原。疫苗可以是预防性的(例如:预防或改善未来被任何天然或“野生”病原体感染的影响)、或治疗性的(例如,积极治疗或减轻正在发生的疾病的症状)。疫苗的施用被称为疫苗接种。
[0410]
本发明的疫苗可用于诱导免疫应答,特别是针对疾病相关抗原或表达疾病相关抗原的细胞的免疫应答,例如针对癌症的免疫应答。因此,疫苗可以用于预防性和/或治疗性治疗涉及疾病相关抗原或表达疾病相关抗原的细胞的疾病,例如癌症。优选地,所述免疫应答是t细胞应答。在一个实施方案中,疾病相关抗原是肿瘤抗原。由本文所述的纳米颗粒中包含的rna编码的抗原优选为疾病相关抗原或引发针对疾病相关抗原或表达疾病相关抗原的细胞的免疫应答。
[0411]
本发明的lnp和疫苗特别地意图用于静脉内施用,即将液体物质直接输注到静脉中。静脉内途径是在整个体内(即全身性)递送液体和药物的最快方法。因此,本发明提供了静脉内疫苗,以及所公开的疫苗和lnp用于静脉内施用的用途。因此,本发明的疫苗和lnp可以静脉内施用。本发明还提供了根据本发明的疫苗和lnp的用途;其中疫苗是静脉内施用的。
[0412]
特别地发现,本发明的lnp的免疫原性在多次免疫后增加。因此,在具体实施方案中,如本文所定义的lnp用于在疫苗接种目的中的用途,其中将lnp在特定间隔内施用至少两次、优选地至少3次。
[0413]
本发明还提供了用于人类或兽医学的根据本发明的lnp、药物组合物和疫苗。还考虑根据本发明的lnp、药物组合物和疫苗用于人类或兽医学的用途。最后,本发明提供了一种用于通过向有需要的受试者施用根据本发明的lnp、药物组合物和疫苗来预防和治疗人类和兽类疾病的方法。
[0414]
本发明进一步提供了根据本发明的lnp、药物组合物或疫苗用于所述一种或多种核酸分子的免疫原性递送的用途。因此,本发明的lnp、药物组合物和疫苗在治疗若干人类和兽类疾病中非常有用。因此,本发明提供了用于治疗癌症或传染性疾病的本发明的lnp、药物组合物和疫苗。
[0415]
本发明的脂质纳米颗粒可以根据如实施例部分中所指定的方案制备。更一般地,lnp可以使用包括以下的方法制备:
[0416]-制备包含所述可离子化脂质、所述磷脂、所述甾醇、所述peg脂质、以及合适的醇溶剂的第一醇组合物;
[0417]-制备包含所述一种或多种核酸和水性溶剂的第二水性组合物;
[0418]-在微流体混合装置中将所述第一和第二组合物混合。
[0419]
更详细地,将脂质组分以合适的浓度在醇媒介物诸如乙醇中组合。向其中添加包含核酸的水性组合物,并且随后将其装载在微流体混合装置中。
[0420]
微流体混合的目的是在微型装置中实现多种样品(即脂质相和核酸相)的彻底和快速混合。通常通过增强不同物质流之间的扩散作用来实现这种样品混合。另外,可以使用几种微流体混合装置,例如在lee等人,2011中综述的。根据本发明的特别合适的微流体混合装置是来自precision nanosystems的nanoassemblr。
[0421]
适用于制备本发明的lnp的其他技术包括将组分分散在合适的分散介质例如水性溶剂和醇溶剂中,并应用以下方法中的一种或多种:乙醇稀释法、简单水合法、超声处理、加热、涡旋、乙醚注入法、弗氏压碎器法(french press method)、胆酸法、ca
2+
融合法、冻融法、反相蒸发法、t型结混合、微流体水力聚焦、交错人字形混合等。
实施例
[0422]
用于实施例1
–
3的材料和方法
[0423]
小鼠
[0424]
雌性c57bl/6小鼠购自charles river laboratories(法国)并且圈养在具有标准垫底材料和密集型笼(cage enrichment)的单独通风笼中。根据机构(布鲁塞尔自由大学(vrije universiteit brussel))和欧盟动物实验指南维持和处理动物。小鼠随意获取食物和水。当小鼠为6至10周龄时开始实验。小鼠经由尾静脉接受在lnp中的10μg mrna(以200μl的体积)的静脉内注射。以相同的时间间隔用200μl的tbs(tris缓冲盐水)注射对照小鼠。每2天监测小鼠的体重。
[0425]
在用adpgk合成长肽(slp)接种的情况下,以相同的时间间隔向小鼠腹膜内注射在200μl的pbs中的50μg adpgk slp(gipvhlelasmtnmelmssivhqqvfpt,(seq id no:3)genscript)、50μg抗-cd40 mab(clone fjk45,bioxcell)和100μg pic hmw(invivogen)的组合。
[0426]
mrna合成和纯化
[0427]
根据wo2015071295所述的方案,通过etherna通过体外转录(ivt)由etherna质粒petherna制备加帽的、非核苷修饰的e7和adpgk mrna。编码hpv16-e7或adpgk蛋白的序列在信号序列和人dc-lamp的跨膜和胞质区之间被框内克隆。将该嵌合基因克隆到petherna质粒中,该质粒在5'端富含翻译增强子,在3'端富含rna稳定序列。ivt后,通过纤维素纯化除去dsrna。纤维素粉末购自sigma,并且在具有16%乙醇的1xste(氯化钠-tris-edta)缓冲液中洗涤。将ivt mrna(在具有16%乙醇的1xste缓冲液中)添加至经洗涤的纤维素沉淀物中,并且在室温下摇动20分钟。然后将该溶液置于真空过滤器(corning)上。洗脱液含有ssrna级分并且用于所有实验。通过毛细管凝胶电泳(agilent,belgium)监测mrna质量。
[0428]
基于mrna脂质的纳米颗粒的产生
[0429]
使用nanoassemblr benchtop(precision nanosystems),通过以9ml/min的速度以2:1体积比微流体混合乙酸钠缓冲液中的mrna溶液(100mm,ph 4)和脂质溶液来产生基于脂质的纳米颗粒。脂质溶液含有coatsomess-ec(nof corporation)、dope(avanti)、胆固醇
(sigma)和dmg-peg2000(c14脂质)(sunbright gm-020,nof corporation)的混合物。将4种脂质以不同的摩尔比混合。使用slide-a-lyzer透析盒(20kmwco,3ml,thermofisher)用tbs透析lnp(tbs体积是lnp体积的10000倍)。
[0430]
流式细胞术
[0431]
在免疫后约6天从处理的小鼠和对照小鼠中收集血液。根据生产商的说明书(mbl international)裂解红细胞,并用apc标记的e7
(rahynivtf)-四聚体(seq id no:1)或adpgk(asmtnmelm)-四聚体(seq id no:2)对剩余的白细胞染色。洗去过量的四聚体。此后,将表面分子的抗体混合物(列于表2)加入到细胞中,并在4℃下孵育30分钟,在lsr fortessa或attune细胞仪上获得数据,并用flow jo软件分析。
[0432]
结果
[0433]
实施例1.小鼠接受由ss-ec/dope/胆固醇/dmg-peg2000以指定的摩尔比组成的e7 mrna lnp的三次静脉内免疫。在每次免疫之后,通过流式细胞术评估血液中由相应mrna lnp组合物引发的e7特异性cd8 t细胞的百分比。如从图1明显看出的,与以1摩尔%dmg-peg2000配制的mrna lnp相比,以0.5摩尔%dmg-peg2000配制的mrna lnp引发高得多的e7特异性cd8 t细胞应答。
[0434]
实施例2.小鼠接受由ss-ec/dope/胆固醇/dmg-peg2000以指定的摩尔比组成的e7 mrna lnp的三次静脉内免疫。在每次免疫之后,通过流式细胞术评估血液中由相应mrna lnp组合物引发的e7特异性cd8 t细胞的百分比。如从图2明显看出的,与以2摩尔%dmg-peg2000配制的mrna lnp相比,以0.5摩尔%dmg-peg2000配制的mrna lnp引起高得多的e7特异性cd8 t细胞应答,在3次免疫之后效果甚至更显著。
[0435]
实施例3.小鼠接受用包封在低百分比peg lnp(50/10/39.5/0.5可电离的脂质/dope/胆固醇/peg-脂质)中的10μg adpgk mrna或用50μgadpgk合成长肽(slp)的四次静脉内施用。在第四次免疫之后6天确定血液中adpgk特异性cd8
+
t细胞的百分比。与slp相比,以0,5摩尔%dmg-peg2000配制的mrna lnp在引发抗原特异性免疫应答方面更优异(图3)。
[0436]
用于实施例4-8的材料和方法
[0437]
动物
[0438]
在由umc utrecht的utrecht动物福利机构(utrecht animal welfare body)或由根特大学的动物伦理委员会批准下进行所有小鼠实验。根据已建立的指导原则进行动物管理。所有小鼠不受限制地获得水和标准实验室动物食物。雌性c57bl/6j小鼠获得自charles river laboratories,inc.(德国/法国)。
[0439]
mrna合成和纯化
[0440]
密码子优化的e7、trimix和荧光素酶mrna通过etherna通过体外转录(ivt)由etherna质粒制备。未使用核苷酸修饰。doe中所使用的e7 mrna是arca加帽的。所有后面的实验都使用cleancapped mrna进行。ivt之后,通过纤维素纯化去除dsrna。通过毛细管凝胶电泳(agilent,belgium)监测mrna质量。cy5-标记的fluc mrna(5-甲氧基尿苷修饰的和二氧化硅纯化的)购自trilink biotechnologies。
[0441]
lnp制备和表征
[0442]
对于生物分布和细胞摄取研究,用编码萤火虫荧光素酶(fluc)的mrna(etherna免
疫疗法nv)和cy5-标记的fluc mrna(trilink biotechnologies)以1:1的比率的混合物装载lnp。为了doe免疫原性研究,用e7 mrna装载lnp。所有其他研究用以3:1:1:1比率的e7、小鼠cd40l、小鼠cd70和组成型活性tlr4 mrna的混合物进行。将mrna在100mm乙酸钠缓冲液(ph 4)中稀释,并且将脂质溶解并且在乙醇中稀释。使用nanoassemblr benchtop微流体混合系统(precision nanosystems)混合mrna和脂质溶液,随后用tris-缓冲盐水(tbs,20mm tris,0.9% nacl,ph 7.4)透析过夜。使用amicon超离心过滤器(10kd)浓缩lnp。用zetasizer nano(malvern)测量尺寸、多分散指数和ζ电势。经由ribogreen测定(thermofisher)确定mrna包封效率。所有lnp的组成总结于表2中。
[0443]
t细胞应答
[0444]
以每周的间隔经尾静脉用在所选择的lnp中的10μg的mrna静脉内免疫小鼠。免疫之后5至7天收集血液用于流式细胞术染色。红细胞裂解之后,将细胞与fcr阻断和活性染料一起温育。在温育和洗涤之后,添加apc标记的e7
(rahynivtf)-四聚体,并且在室温下温育30分钟。洗去过量的四聚体,并且将表面分子cd3和cd8的抗体混合物添加至细胞中,并且在4℃下温育30分钟。在3-激光器atunenxt流式细胞仪或4-激光器bd lsrfortessa流式细胞仪上采集样品。
[0445]
在第三次免疫之后7天确定脾中细胞内细胞因子的产生。通过压碎脾,裂解红细胞并且经40μm细胞过滤器过滤样品来制备脾细胞的单细胞悬浮液。将200.000个细胞/孔/样品一式两份铺在96孔板中。添加4ug的e7肽(genscript)用于刺激,然后将细胞在37℃下温育。在肽刺激1小时之后,添加golgiplug(bd cytofix/cytoperm试剂盒(bd biosciences))。将细胞再温育4小时。此后,将细胞与fcr阻断和活性染料一起温育。在温育和洗涤之后,添加apc标记的e7
(rahynivtf)-四聚体,并且在室温下温育30分钟。洗去过量的右旋糖酐(dextramer),并且将表面分子cd3和cd8的抗体混合物添加至细胞中,并且在4℃下温育30分钟。另外的步骤根据bd cytofix/cytoperm试剂盒(bd biosciences)的制造商说明书。透化之后,对细胞进行ifn-γ和tnf-α染色。在4-激光器bd lsrfortessa流式细胞仪上采集样品。使用flowjo软件进行分析。
[0446]
炎症细胞因子
[0447]
在每次免疫(第0、7、14和50天)之后6小时,将血液样品收集在具有凝胶凝血因子(sarstedt)的管中。将凝结的血液样品以10.000g离心5min以获得血清。将血清样品储存在-80℃下直至分析。使用procartaplex多重测定(thermofisher)确定ifn-α、ifn-γ、ip-10的浓度。将血清样品在测定缓冲液中稀释3倍,并且与荧光标记的珠温育120分钟。根据方案进行另外的步骤。在magpix仪器(luminex)上采集样品。使用procartaplex analyst软件分析数据。
[0448]
tc-1肿瘤实验
[0449]
tc-1细胞获得自莱顿大学医学中心(leiden university medical center)。将50μl pbs中的500000个tc-1细胞皮下注射到小鼠的右胁腹上。使用卡尺进行肿瘤测量。肿瘤体积计算为(最小直径2
×
最大直径)/2。将抗pd-1和同种型对照抗体在pbs中新鲜稀释至200μg/200μl/小鼠的浓度并腹膜内注射。小鼠接受抗pd-1抗体(单一疗法或与mrna lnp免疫组合)或同种型对照(与lnp免疫组合)。从第一次mrna lnp免疫之后3天开始并且到最后一次lnp注射之后2周结束,每3至4天注射一次抗体。为了分析肿瘤浸润淋巴细胞,在第二次
mrna lnp免疫之后3天分离肿瘤,并且置于填充有macs组织储存缓冲液(miltenyi biotec)的24孔板中。将肿瘤切碎并且在消化缓冲液中温育1小时,同时定期摇动。此后,使红细胞裂解并且将所有样品经70μm细胞过滤器过滤。通过ficoll-paque密度梯度纯化来富集淋巴细胞,然后进行染色。首先,将细胞与fcr阻断和活性染料一起温育。在温育和洗涤之后,添加apc标记的e7
(rahynivtf)-四聚体,并且在室温下温育30分钟。洗去过量的四聚体,并且将表面分子cd45和cd8的抗体混合物添加至细胞中,并且在4℃下温育30分钟。在3-激光器atunenxt流式细胞仪或4-激光器bd lsrfortessa流式细胞仪上采集样品。使用flowjo软件进行分析。
[0450]
生物分布和细胞摄取
[0451]
经由尾静脉向小鼠静脉内注射10μg在所选择的lnp制剂中的mrna。4小时之后,用250μl的戊巴比妥(6mg/ml)麻醉小鼠。将血液样品收集在具有凝胶凝血因子(sarstedt)的管中。随后,打开胸腔,切开门静脉,并且通过右心室用7ml的pbs灌注小鼠。取出器官并且在液氮中快速冷冻。对于肝和脾组织,将一部分器官保持在冰冷的pbs中用于流式细胞术分析。
[0452]
细胞摄取
[0453]
将肝和脾组织置于具有rpmi 1640培养基的陪替氏培养皿中,这些培养皿分别含有1mg/ml胶原酶a(roche)或20μg/ml释放酶tm(roche)和10μg/ml dna酶i,ii级(roche)。使用手术刀片切碎组织并且在37℃下温育30min。随后,使组织悬浮液通过100μm尼龙细胞过滤器。将肝悬浮液在70
×
g下离心3min以去除实质细胞。将上清液和脾悬液以500
×
g离心7min以沉淀细胞。将红细胞在ack缓冲液(gibco)中裂解5min,用pbs灭活,并且随后通过100μm细胞过滤器。用含有1%胎牛血清(fbs)的rpmi 1640洗涤细胞,与台盼蓝混合并且用luna-ii自动细胞计数器(logos biosystems)计数。将3
×
105个(肝)或6
×
105个(脾)活细胞接种在96孔板中,以500
×
g沉淀5min并且重新悬浮于含有50% brilliant染色缓冲液(bd biosciences)和2μg/ml trustain fcx(biolegend)的在pbs中的2% bsa(2% pbsa)中。将细胞在冰上温育10min,并且以1:1与含有适用抗体混合物(总共三种)的2% pbsa一式两份地混合。将细胞在室温下在振荡器上温育15min,用2% pbsa洗涤两次并且重新悬浮于含有0.25μg/ml 7-aad活性染料(biolegend)的2% pbsa中。在4-激光器bd lsrfortessa流式细胞仪上采集样品。使用flowjo软件进行分析。
[0454]
全身分布
[0455]
将大约50-100mg的每种组织解剖,称重并且置于具有1.4mm陶瓷珠(qiagen)的大约5mm的层的2ml微管中。对于每mg的组织,添加3μl的冷细胞培养物裂解试剂(promega),并且使用mini-beadbeater-8(biospec)在4℃下以全速匀化组织60s。将匀浆储存在-80℃下,解冻,在4℃下以10.000
×
g离心10min以去除珠和碎片,并且将上清液再次储存在-80℃下。在白色96孔板中一式两份等分十微升的每种裂解物。使用配备注射器的spectramax id3读板仪,在混合的同时将50μl的荧光素酶测定试剂(promega)分配在每个孔中,随后延迟2秒并且记录荧光素酶发射持续10s。针对从注射tbs的小鼠的器官裂解物获得的背景信号将荧光素酶活性归一化。
[0456]
免疫细胞活化
[0457]
经由尾静脉向小鼠静脉内注射5μg的在所选择的lnp中的mrna。4小时后收获脾用
于流式细胞术染色。制备脾细胞的单细胞悬浮,并且用消化缓冲液(具有dna酶-1和胶原酶-iii的dmem)温育20分钟,同时定期摇动。此后,将样品与fc阻断和活性染料一起温育。温育和洗涤之后,用细胞谱系标志物和活化标志物将细胞染色。在3-激光器atunenxt流式细胞仪上采集样品。使用flowjo软件进行分析。
[0458]
实施例4
–
为获得最大t细胞应答的lnp组合物的doe驱动优化
[0459]
通过将可商购的可电离的脂质coatsome ss-ec与胆固醇、dope和peg化脂质组合来产生lnp库。dope已经是几种被批准的脂质体产品和研究中的mrna疫苗的一部分。对于本实验,研究了包含dmg-peg2000的不同lnp组合物。
[0460]
第一lnp库被设计用于阐明脂质摩尔比是否影响由静脉内mrna-lnp-接种引发的t-细胞应答,并且因此表示可以优化以改进疫苗效力的变量。ss-ec、dope和peg-脂质的摩尔百分比被认为是独立变量,而胆固醇被认为是填充剂脂质以将摩尔百分比平衡至100%。通过使用doe-方法学,产生了涉及11个lnp的实验设计(参见表3中的组成)。
[0461][0462]
表2:doe实验中dmg-peg2000 lnp的组成
[0463]
11种脂质比率在实验范围内均匀分布(数据未显示)。对于免疫原性筛选,认为三次静脉内免疫之后血液中e7特异性cd8 t细胞的百分比是待最大化的应答变量。为此,所有lnp包封编码人乳头瘤病毒16(hpv16)癌蛋白e7的mrna作为抗原。结果证实了我们的假设,即cd8t细胞应答的强度强烈依赖于lnp组成。若干种mrna-lnp-疫苗引起超过50%的e7特异性cd8 t细胞应答,而其他mrna-lnp-疫苗几乎不诱导任何应答(图4a)。dmg-peg2000的摩尔%被确定为与e7特异性cd8 t细胞应答的强度相关的关键参数。需要低摩尔百分比的peg-脂质以获得最大的t细胞应答(图4c)。
[0464]
将贝叶斯回归模型应用于数据以产生可以预测特定lnp组合物的免疫原性的响应面模型(数据未显示)。为了验证模型的预测值,评估了2种新的lnp组合物(表3)。
[0465][0466]
表3:doe实验中dmg-peg2000 lnp的组成
[0467]
用lnp34(dmg-peg2000)免疫的小鼠引发>30%的e7特异性cd8t细胞的可能性超过90%(最佳lnp),而lnp35(dmg-peg2000)被预测产生差的t细胞应答(非最佳lnp)。实验数据在很大程度上与预测匹配,并且因此成功地验证了模型。用预测的最佳lnp免疫的所有小鼠确实表现出超过30%的e7特异性cd8 t细胞应答,而用lnp35免疫的小鼠均未引发在该阈值以上的t细胞应答(图4b)。
[0468]
实施例5
–
mrna疫苗诱导定性的t细胞应答
[0469]
癌症免疫疗法的成功受多种因素影响,包括t细胞表型、功能性和肿瘤浸润。我们首先评估了lnp34诱发的t细胞应答的品质和增强能力(boostability)。为此目的,小鼠在第0、7和14天接受三次初次免疫,随后在第50天接受最终免疫。用trimix,即3种免疫刺激mrna的混合物(bonehill等人,2008)补充e7 mrna,其增加t细胞应答的强度。
[0470]
用e7-trimix免疫3次后,超过70%的e7特异性t细胞存在于血液中(图5a)。在第三次免疫之后五周,e7特异性cd8 t细胞的百分比保持高度升高。在施用最终的加强免疫时,观察到e7特异性效应t细胞的快速扩增,因此证明疫苗是可加强的(图5a)。每次免疫都测量血清中更高浓度的ifn-y(图5b),反映了e7特异性t细胞数目的增加。
[0471]
为了评估t细胞功能性,我们在三次免疫之后进行细胞内细胞因子染色。同时产生多于一种细胞因子的多功能cd8 t细胞与更好地控制传染性疾病和肿瘤相关,并且占最佳lnp的cd8 e7特异性t细胞的大约28%(图5c)。
[0472]
实施例6
–
mrna疫苗诱导肿瘤消退
[0473]
在用hpv16 e6/e7抗原逆转录病毒转导产生的同基因小鼠肿瘤模型tc-1中评价治疗性抗肿瘤功效。当肿瘤达到55mm3的平均直径时,开始用lnp34递送的5μg e7-trimix治疗。另外,用抗pd-1(或同种型对照抗体)治疗小鼠。pd-1在活化的t细胞上表达,并且在与pd-l1相互作用时抑制t细胞功能并诱导耐受性。pd-1检查点阻断维持t细胞反应性,并且被批准用于患有转移性或不可切除的复发性hnscc的患者的一线治疗。lnp34疫苗接种导致tc-1肿瘤的明显消退(图5d)和显著延长的存活时间(图5e),然而肿瘤在治疗停止之后复发。抗pd1单一疗法对携带tc-1的小鼠不提供任何治疗性益处。
[0474]
最后,我们评估了疫苗引发t细胞到达肿瘤床的能力。用相应的mrna-lnp-疫苗进行两次疫苗接种导致cd8
+
肿瘤浸润性t细胞强烈浸润到肿瘤中(图5f),超过70%对e7具有特异性(图5g)。向疫苗处理中添加抗pd-1不显著改变进入肿瘤的e7特异性cd8 t细胞的百分比。
[0475]
实施例7
–
最佳lnp增加脾中的摄取并且活化免疫细胞
[0476]
为了阐明诱发的t细胞应答的强度与mrna摄取和表达在器官和细胞类型水平上的
生物分布之间是否存在相关性,我们将cy5标记的萤火虫荧光素酶mrna包封在先前针对免疫原性进行了筛选的dmg-peg2000lnp中。在lnp注射之后四小时,在分离的肝、脾、肺、心脏和肾中测量荧光素酶活性。如所预期的,lnp组合物对mrna-表达的强度和器官特异性具有强烈的影响。肝是主要的靶器官,接着是脾,但是肝与脾的比率在lnp之间差别很大(图6a)。在第三次免疫之后e7特异性cd8 t细胞应答的强度与脾表达正相关。通过总表达与t细胞应答之间不存在相关性,进一步强调了递送至脾的重要性(数据未显示)。还确认了lnp尺寸之间的显著相关性(与脂质组成强烈缠结)。
[0477]
我们接下来评估免疫原性是否与脾中特异性免疫细胞类型的早期mrna摄取和活化有关。lnp主要在巨噬细胞和单核细胞中累积(图6b)。在t细胞应答与由脾巨噬细胞、单核细胞、浆细胞样dc(pdc)和b细胞的lnp摄取之间存在强烈的总体相关性(数据未显示)。
[0478]
为了进一步证实脾中mrna摄取和表达的重要性,我们比较了最佳的、高免疫原性的lnp34与非最佳的、差免疫原性的lnp35的生物分布和细胞摄取特性。相对于lnp35,lnp34显著增加脾中的相对mrna-表达(图6c)和脾中由巨噬细胞、b细胞和dc的摄取(图6d)。
[0479]
与它们的次优对应物相比,最佳mrna lnp组合物lnp34触发血液中更高水平的炎症细胞因子,指示先天活化增加(图6e)。
[0480]
实施例8
–
本发明的另外的dmg-peg2000 lnp
[0481]
在本实施例中,测试了另外的感兴趣的lnp(参见表4)。对小鼠进行2次静脉内免疫,彼此间隔1周。在第二次免疫之后5天分析血液中的e7特异性t细胞。图7中所显示的数据证明,lnp59比lnp53表现显著更好;并且因此也高度适合于本发明的上下文中。lnp59的特征还在于具有低百分比的peg脂质,即0.5摩尔%,但也具有显著更低的胆固醇水平,即小于30摩尔%;特别地约25摩尔%。
[0482][0483]
表4:另外的dmg-peg2000 lnp的组成
[0484]
结论
[0485]
通过调节脂质比率可以调节lnp组合物的强免疫原性。最佳的lnp组合物显示在脾中增加的表达,其中多个apc群体的摄取增强。最佳的lnp诱导高水平的i型ifn,其在t细胞应答诱导中被发现是关键的。出人意料地,大多数注射的mrna剂量与b细胞有关。b细胞显示活化的表型,并且对于抗原特异性cd8 t细胞的诱导是至关重要的,表明b细胞先前未被证明的作用。
[0486]
doe方法成功地预测lnp-组合物是高或差免疫原性的。最佳的lnp组合物促进a)脾apc(主要是b细胞)的mrna摄取和表达,b)先天活化,这通过炎症细胞因子的释放增加和apc上活化标志物的表达来证明,c)高量级和定性的t细胞应答,其能够使确立的tc-1肿瘤消退。发现i型干扰素的诱导对于静脉内施用的mrna疫苗的功效至关重要。b细胞对于诱导t细胞应答也是至关重要的,这可能部分地归因于抗peg抗体的产生。重要地,抗lnp的抗体的存在不干扰t细胞应答的引发。考虑到许多人在用peg化的lnp疫苗接种之后将获得peg-抗体,
这是高度相关的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1