一种福多司坦片的制备方法与流程
1.本发明涉及医药技术领域,尤其是涉及一种福多司坦片的制备方法。
背景技术:
2.福多司坦是由日本三菱和ss制药株式会社研制的一类具有祛痰和黏痰溶解作用的半胱氨酸衍生物,2001年12月在日本首发上市,主要用于支气管哮喘、慢性喘息性支气管炎、支气管扩张、肺结核、尘肺、肺气肿等多痰久咳性疾病的治疗,主要剂型有片和口服液。
3.2017年7月21日,国家食品药品监督管理总局在《仿制药参比制剂目录(第八批)》(2017年第116号)通告中公示了福多司坦片参比制剂(序号8-63),规格为0.2g,持证商为田边三菱制药株式会社。通过查询if文件,获悉原研片芯的处方组成为福多司坦、玉米淀粉、滑石粉、硬脂酸镁,包衣层的处方组成为羟丙甲纤维素、二氧化钛、聚乙二醇6000。根据原研片芯处方组成、各辅料功能及实际片重(约0.225g)测算,原料药占比约90%,填充剂玉米淀粉占比小于10%,由此推断原料药的粉体学性质和处理方式对制剂工艺的可行性具有重要影响。
4.实践过程发现,由于原料药占比高,总混物料的流动性和可压性难以保证,生产过程中经常出现下料不顺畅或裂片问题,严重影响生产效率;大幅提升辅料用量和片重虽有助于缓解上述问题,但势必会增加生产成本。同时,大量原料药在制粒过程中如受到高剪切或强力挤压的影响,易产生难以破碎的硬颗粒,进而引起片剂含量均匀性或溶出rsd偏大等质量问题。
5.专利cn1155373c采用玉米淀粉或土豆淀粉为填充剂,专利cn1463698a中用羧甲基淀粉钠为填充剂,均为解决福多司坦制剂在长期储存后的变色问题,所涉及片剂实施例的工艺均为混粉直压,没有改变原料药本身的粉体学属性,不可避免会出现混粉流动性和可压性差等生产难题;专利cn102908328a采用常规湿法制粒方式制备福多司坦片,除95%乙醇作为粘合剂存在巨大的安全风险外,所涉及实施例均大幅增加了辅料用量,相比原研制剂整体增重16.4%~79.6%,大幅增加了生产成本,不能满足质优价廉的群众用药需求。
6.专利检索发现,目前尚无针对福多司坦片实际生产过程存在的问题进行工艺技术创新或优化的报道,授权专利中仅有cn101152172b和cn100404026c两篇用于解决福多司坦片长期储存后变色的报道,因此开发一种能够解决物料流动性、可压性、片剂含量均匀性和溶出rsd,同时要求生产成本较低、物料损耗较小、适合工业化生产的福多司坦片制备方法尤为必要。
技术实现要素:
7.本发明的技术方案是:一种福多司坦片剂组合物,其特征是单位剂量的片含有福多司坦200mg,羧甲基淀粉钠16mg,硬脂酸镁2mg,薄膜包衣预混剂(胃溶型)7mg。
8.本发明所述组合物的制备方法,包括以下步骤:第一步 筛分原料药:将粉碎后的福多司坦原料药过筛,将筛上筛下两部分的原料
药分别收集,备用;第二步 配制黏合剂:将第一步筛上部分的大粒度原料药加乙醇水溶液溶解,备用;第三步 流化床制粒:将第一步筛下部分的小粒度原料药投至流化床中,用第二步配置的黏合剂进行制粒,干燥;第四步 混合压片:将第三步所得颗粒进行整粒后与处方量的羧甲基淀粉钠、硬脂酸镁混合均匀,用φ8mm浅凹冲模压片;第五步 薄膜包衣:采用薄膜包衣预混剂(胃溶型)10%水溶液包衣,包衣增重1%-3%,得福多司坦片。
9.优选的,制备方法第一步中筛分原料药的筛网孔径为40-60目。
10.优选的,制备方法第二步中配制黏合剂所用的乙醇水溶液浓度为50%以下。
11.本发明的有益效果(1)结合福多司坦原料药固有的理化和粉体学属性以及在制剂中占比高的特点,本发明创造性提出了筛分后大粒度原料药用于配制黏合剂、小粒度原料药参与流化床制粒的实施方案,无需对常规原料药粒度进行精准控制,有效提升了生产效率,获得了批内均一性优于原研制剂的优质药品。
12.(2)本发明所述的福多司坦片制备过程极大改善了原料药遇水遇湿发黏、流动性和可压性差的特点,所得总混物料的流动性和可压性优良,所得片剂硬度和脆碎度优良,有效规避了裂片、粘冲等压片难题,适合工业化生产高速压片。
具体实施方式
13.实施例1处方:福多司坦200g,羧甲基淀粉钠16g,硬脂酸镁2g,薄膜包衣预混剂(胃溶型)7g。
14.制备方法:按下述制备方法制备1000片,具体步骤如下:第一步 筛分原料药:将粉碎后的福多司坦原料药过60目筛,将筛上筛下两部分的原料药分别收集,备用;第二步 配制黏合剂:将第一步筛上部分的大粒度原料药加50%乙醇水溶液溶解,备用;第三步 流化床制粒:将第一步筛下部分的小粒度原料药投至流化床中,用第二步配制的黏合剂进行制粒,干燥;第四步 混合压片:将第三步所得颗粒进行整粒后与处方量的羧甲基淀粉钠、硬脂酸镁混合均匀,用φ8mm浅凹冲模压片;第五步 薄膜包衣:采用薄膜包衣预混剂(胃溶型)10%水溶液包衣,包衣增重1%-3%,得福多司坦片。
15.实施例2处方:福多司坦200g,羧甲基淀粉钠16g,硬脂酸镁2g,薄膜包衣预混剂(胃溶型)7g。
16.制备方法:按下述制备方法制备1000片,具体步骤如下:
第一步 筛分原料药:将粉碎后的福多司坦原料药过40目筛,将筛上筛下两部分的原料药分别收集,备用;第二步 配制黏合剂:将第一步筛上部分的大粒度原料药加纯化水溶解,备用;第三步 流化床制粒:将第一步筛下部分的小粒度原料药投至流化床中,用第二步配制的黏合剂进行制粒,干燥;第四步 混合压片:将第三步所得颗粒进行整粒后与处方量的羧甲基淀粉钠、硬脂酸镁混合均匀,用φ8mm浅凹冲模压片;第五步 薄膜包衣:采用薄膜包衣预混剂(胃溶型)10%水溶液包衣,包衣增重1%-3%,得福多司坦片。
17.对照例1处方:福多司坦200g,羧甲基淀粉钠16g,硬脂酸镁2g,薄膜包衣预混剂(胃溶型)7g。
18.制备方法:按下述制备方法制备1000片,区别于实施例1的是粉碎后的原料药未经过筛分处理,具体如下:第一步 配制润湿剂:配制与实施例1等量的50%乙醇水溶液,备用;第二步 流化床制粒:将未筛分的福多司坦原料药投至流化床中,用第一步配制的润湿剂进行制粒,干燥;第三步 混合压片:将第二步所得颗粒进行整粒后与处方量的羧甲基淀粉钠、硬脂酸镁混合均匀,用φ8mm浅凹冲模压片;第四步 薄膜包衣:采用薄膜包衣预混剂(胃溶型)10%水溶液包衣,包衣增重1%-3%,得福多司坦片。
19.对照例2处方:福多司坦200g,羧甲基淀粉钠16g,硬脂酸镁2g,薄膜包衣预混剂(胃溶型)7g。
20.制备方法:按下述制备方法制备1000片,区别于实施例1的是配制黏合剂所用的乙醇水溶液浓度较高,具体步骤如下:第一步 筛分原料药:将粉碎后的福多司坦原料药过60目筛,将筛上筛下两部分的原料药分别收集,备用;第二步 配制黏合剂:将第一步筛上部分的大粒度原料药加75%乙醇水溶液溶解,备用;第三步 流化床制粒:将第一步筛下部分的小粒度原料药投至流化床中,用第二步配制的黏合剂进行制粒,干燥;第四步 混合压片:将第三步所得颗粒进行整粒后与处方量的羧甲基淀粉钠、硬脂酸镁混合均匀,用φ8mm浅凹冲模压片;第五步 薄膜包衣:采用薄膜包衣预混剂(胃溶型)10%水溶液包衣,包衣增重1%-3%,得福多司坦片。
21.对照例3处方:福多司坦200g,羧甲基淀粉钠16g,硬脂酸镁2g,薄膜包衣预混剂(胃溶型)7g。
22.制备方法:按下述制备方法制备1000片,区别于实施例1和2的是采用湿法制粒,具体如下:第一步 筛分原料药:将粉碎后的福多司坦原料药过60目筛,将筛上筛下两部分的原料药分别收集,备用;第二步 配制黏合剂:将第一步筛上部分的大粒度原料药加适量50%乙醇水溶液溶解,备用;第三步 湿法制粒:将第一步筛下部分的小粒度原料药投至湿法制粒机中,用第二步配制的黏合剂进行湿法制粒,干燥;第四步 混合压片:将第三步所得颗粒进行整粒后与处方量的羧甲基淀粉钠、硬脂酸镁混合均匀,用φ8mm浅凹冲模压片;第五步 薄膜包衣:采用薄膜包衣预混剂(胃溶型)10%水溶液包衣,包衣增重1%-3%,得福多司坦片。
23.对照例4处方:福多司坦200g,羧甲基淀粉钠16g,硬脂酸镁2g,薄膜包衣预混剂(胃溶型)7g。
24.制备方法:按下述制备方法制备1000片,区别于实施例1和2的是采用干法制粒,具体如下:第一步 干法制粒:将福多司坦原料药加至干法制粒机中,调整进料速度、压轮转速、压力和整粒转速等参数,进行制粒;第二步 混合压片:将第一步所得颗粒与处方量的羧甲基淀粉钠、硬脂酸镁混合均匀,用φ8mm浅凹冲模压片。
25.第三步 薄膜包衣:采用薄膜包衣预混剂(胃溶型)10%水溶液包衣,包衣增重1%-3%,得福多司坦片。
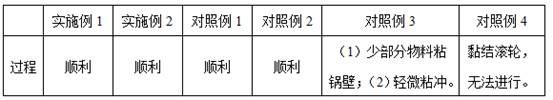
26.试验例1 生产过程可行性考察观察和记录实施例1-2、对照例1-4各工序的实际制备过程,评估生产可行性,具体结果见表1。
27.表1 实际制备过程现象记录从上表可以看出,实施1-2和对照例1-2均采用流化床制粒的方式,制备过程顺利;对照例3采用湿法制粒的方式,在制粒过程中存在少部分物料粘锅壁,在压片过程中存在轻微粘冲,整体工艺基本可行,但对生产效率有一定不利影响;对照例4采用干法制粒的方式,在第一步制粒时就存在严重的黏结滚轮现象,致使后续工序无法正常进行,因此后续试验不再进行对照例4的考察。
28.试验例2 混合物料流动性考察休止角是反映物料流动性的重要指标。将实施例1-2和对照例1-2压片前的混合物
料通过漏斗分别垂直注入到直径为5cm的圆盘中心,直到粉体堆积层斜边的物料沿圆盘边缘自动流出为止,停止注入,测定休止角,数据记录于表2。
29.表2 休止角测量记录从上表可以看出,实施1-2和对照例1混合物料的休止角均小于40
°
,能够满足生产高速压片机对物料流动性的要求;对照例2和对照例3混合物料的休止角均大于40
°
,证明物料的流动性欠佳,其中对照例2与高浓度乙醇水溶液制得的颗粒较松散有一定关系,对照例3与湿法制粒时部分粘锅壁物料参与制粒程度不充分、不均匀有一定关系。
30.试验例3 最大平均硬度考察最大平均硬度是反映物料可压性的重要指标。将实施例1-2及对照例1-3混合物料分别加入北京国药龙立科技有限公司生产的zp-10a旋转式压片机的料斗中,调节压片机速至1万片/小时,以物料和设备所能承受的最大压力(压片机会有轻微异响,注意不要损坏压片机)进行试机考察,待装量差异等相关指标确认合格后,收集药片并记录最大平均硬度,数据记录于表3。
31.表3 片芯最大平均硬度记录(n=10)取市售福多司坦原研制剂10片,用小刀小心刮去包衣层,测得其片芯平均硬度约为40n;考虑到生产过程对压片机的保护,实际制片压力要小于最大制片压力,因此推测原研制剂片芯的最大平均硬度高于40n。实施例1-2片芯的最大平均硬度在60n左右,能够满足生产高速压片机对物料可压性的要求;对照例1片芯的最大平均硬度低于原研制剂和实施例1-2,其原因在于未经筛分处理的部分原料药“硬块”影响了物料的可压性;对照例2片芯的最大平均硬度介于实施例1-2和对照例1之间,其原因与高浓度乙醇制得的颗粒较松散有关;对照例3片芯的最大平均硬度低于40n,这与原料药本身黏性较大、在湿法制粒过程中部分物料粘锅、制粒不充分不均匀有关。
32.试验例4 溶出度考察参照《中国药典》2020年版四部0931溶出度与释放度测定法第二法(桨法),选用ph1.2盐酸介质900ml,转速50rpm/min,分别测定原研制剂、实施例1-2和对照例1-3在5min、10min和15min的溶出量并计算rsd(n=12),数据记录于表4。
33.从上表可以看出,实施例1-2在各时间点的溶出量均接近于原研制剂,且溶出rsd明显优于原研制剂,证明批内均一性良好;对照例1在各时间点的溶出量明显低于原研制剂,其中15min溶出量低于85%,且各时间点溶出rsd偏大,证明批内均一性差;对照例2在各时间点的溶出量略快于原研制剂,这与高浓度乙醇制得的颗粒较松散、原料药易溶出有关;对照例3在各时间点的溶出量低于原研制剂,且溶出rsd差于原研制剂,这与湿法制粒过程中部分物料粘锅,制粒不充分以及干燥后存在一些难以破碎的硬颗粒有关。
34.综上,实施1-2的制备过程顺利,所得混合物料的流动性、可压性优良,适合工业化生产高速压片,同时产品溶出优良、rsd明显优于原研制剂,显示出了更好的批内均一性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1