S-亚硝基化谷胱甘肽还原酶抑制剂在改善肺纤维化血管新生中的应用的制作方法
s-亚硝基化谷胱甘肽还原酶抑制剂在改善肺纤维化血管新生中的应用
技术领域
1.本技术涉及肺纤维化技术领域,尤其是涉及s-亚硝基化谷胱甘肽还原酶抑制剂在改善肺纤维化血管新生中的应用。
背景技术:
2.特发性肺纤维化(idiopathic pulmonary fibrosis,ipf)是一种慢性致死性疾病,其特征是进行性的成纤维细胞增殖、肺组织中广泛沉积的细胞外基质(extracelluar matrix,ecm)、肺泡结构破坏以及肺功能持续下降,最终导致呼吸衰竭和死亡。ipf的发病机制是多方面的,包括炎症反应、血管新生与重塑、氧化应激、纤维蛋白溶解障碍、基质金属蛋白酶等,目前尚不完全清楚。
3.其中,血管新生是指新的微血管网络的形成,在人体内主要通过血管生成来实现,实际上是沿着血管排列的血管内皮细胞增殖,从现有血管系统中生长出新的毛细血管的过程,也是生长、组织损伤、修复和愈合过程中的重要生理过程。血管新生在癌症、糖尿病视网膜病变、类风湿性关节炎和动脉粥样硬化等疾病的发病机制中都具有重要作用。而随着对肺纤维化研究的不断深入,血管新生与重塑在肺纤维化发生中的作用也日益得到重视,被认为是其中的一个关键环节。为了了解血管完整性和修复的过程,有必要确定ipf中与血管生成相关的因素。
4.正常生理条件下的肺中,血管生成和血管抑制因子通过两者的平衡调节血管内稳态。尽管早期的研究表明ipf与血管生成增加有关,但最近研究显示ipf成纤维细胞灶中血管新生减少(renzoni ea,et al.,am j respir crit care med.2003;167(3):438-43.;cosgrove gp,et al.,am j respir crit care med.2004;170(3):242-51.),同时血管生成抑制因子(血管内皮素)的表达水平上调(sumi m,et al.,j clin lab anal.2005;19(4):146-9.);另外,在对ltbp4的研究中发现,其可能通过减少血管生成导致肺泡间隔缺损,从而影响肺纤维化(bultmann-mellin i,et al.,am j physiol lung cell mol physiol.2017;313,l687-l698.);而vegf还可以通过保护内皮细胞、促进血管生成等途径,修复肺组织的损伤和减少肺纤维化的形成(derseh,et al.,sci rep.2009;9(1):19893);以上证据支持肺纤维化血管新生过少的观点。所以,血管新生可能是肺纤维化的重要靶点,有必要开发能够改善血管新生的产品,以探讨肺纤维化的治疗策略。
5.s-亚硝基化谷胱甘肽还原酶(s-nitrosoglutathione reductase,gsnor)是细胞内s-亚硝基化谷胱甘肽(gsno)的还原酶,是最主要的去s-亚硝基化酶。蛋白质s-亚硝基化,即一氧化氮(no)对半胱氨酸的氧化修饰,形成蛋白质s-亚硝基硫醇(sno),介导no对细胞功能的调控。gsnor在调节平滑肌松弛、免疫功能、炎症、神经元发育以及癌症发生中都起到重要的作用,但并无gsnor与肺纤维化的血管新生关系的报导。
技术实现要素:
6.本技术旨在至少解决现有技术中存在的技术问题之一。为此,本技术提出一种s-亚硝基化谷胱甘肽还原酶抑制剂在改善肺纤维化血管新生中的应用,利用gsnor抑制剂可以有效改善肺纤维化的血管新生。
7.本技术的第一方面,提供以下a1~a3中至少一种物质在制备改善肺纤维化的血管新生的产品中的应用:
8.a1.s-亚硝基化谷胱甘肽;
9.a2.s-亚硝基化谷胱甘肽还原酶的抑制剂;
10.a3.a1~a2中任一种在药学上可接受的盐。
11.根据本技术实施例的应用,至少具有如下有益效果:
12.实验过程中发现,抑制去s-亚硝基化可作为改善特发性肺纤维化的血管新生的靶点,通过提供gsnor抑制剂和/或外源性的gsno可以有效增加肺纤维化小鼠模型的肺组织中的血管密度,促进血管新生;同时在体外对于细胞也表现出良好的成血管能力。
13.其中,s-亚硝基化谷胱甘肽还原酶的抑制剂是指能够抑制s-亚硝基化谷胱甘肽还原酶的表达和/或降低s-亚硝基化谷胱甘肽还原酶的酶活的物质。
14.在本技术的一些实施方式中,抑制剂选自以下b1~b5中任一种:
15.b1.特异性编辑s-亚硝基化谷胱甘肽还原酶基因的物质;
16.b2.特异性抑制s-亚硝基化谷胱甘肽还原酶的mrna水平的物质;
17.b3.特异性抑制s-亚硝基化谷胱甘肽还原酶的表达水平的物质;
18.b4.特异性抑制s-亚硝基化谷胱甘肽还原酶活性的物质;
19.b5.包含b1~b4中任一种的载体。
20.特异性编辑s-亚硝基化谷胱甘肽还原酶基因的物质可以通过对基因的敲除、置换、同源重组等方式实现编辑,从而控制s-亚硝基化谷胱甘肽还原酶的表达。在本技术的一些实施方式中,特异性编辑s-亚硝基化谷胱甘肽还原酶基因的物质为crispr/cas、锌指核糖核酸酶zfn、转录激活因子样效应物核酸酶talen、cre-loxp重组酶中的至少一种。
21.以crispr/cas为例,该系统通常包含crispr序列和crispr相关核酸酶,其中crispr序列一般包括间隔序列和重复序列,而crispr相关核酸酶选自cas(如cas1、cas2、cas3、cas4、cas5、cas6、cas7、cas8、cas9、cas10、cas12a~i、cas13a~d、cas14a~c)、csa(csa1~5)、csb(csb1~3)、csc(csc1~2)、cse(cse1~2)、csf(csf1~4)、csm(csm1~6)、csn、csx(csx1~20)、csy(csy1~3)、cmr(cmr1~6)中的至少一种。
22.特异性抑制s-亚硝基化谷胱甘肽还原酶的mrna水平的物质可以通过控制s-亚硝基化谷胱甘肽还原酶的基因的沉默,从而抑制s-亚硝基化谷胱甘肽还原酶的表达。在本技术的一些实施方式中,特异性抑制s-亚硝基化谷胱甘肽还原酶的mrna水平的物质选自反义核酸序列、sirna、shrna、dsrna、mirna中的至少一种。上述物质的获取可以在知晓s-亚硝基化谷胱甘肽还原酶基因序列后,通过现有的软件自行设计或交由相关公司进行设计。
23.在本技术的一些实施方式中,特异性抑制s-亚硝基化谷胱甘肽还原酶的mrna水平的物质为sirna,sirna选自sirna gsnor1、sirna gsnor2、sirna gsnor3中的至少一种;
24.其中,sirna gsnor1的正义链包含如seq id no.1所示的核苷酸序列:
25.aauucagucaugaaccuguuuuctg(后2nt tg为dna)(seq id no.1);或
26.sirna gsnor1的反义链包含如seq id no.2所示的核苷酸序列:
27.cagaaaacagguucaugacugaauuau(seq id no.2);或
28.sirna gsnor2的正义链包含如seq id no.3所示的核苷酸序列:
29.gugucugaauauauguccaaaaaga(后2nt ga为dna)(seq id no.3);或
30.sirna gsnor2的反义链包含如seq id no.4所示的核苷酸序列:
31.ucuuuuuggacauauauucagacacca(seq id no.4);或
32.sirna gsnor3的正义链包含如seq id no.5所示的核苷酸序列:
33.uccuuugaauguauugguaauguga (后2nt ga为dna)(seq id no.5);或
34.sirna gsnor3的反义链包含如seq id no.6所示的核苷酸序列:
35.ucacauuaccaauacauucaaaggaau(seq id no.6)。
36.在本技术的一些实施方式中,sirna gsnor1的正义链如seq id no.1所示;或
37.sirna gsnor1的反义链如seq id no.2所示;或
38.sirna gsnor2的正义链如seq id no.3所示;或
39.sirna gsnor2的反义链如seq id no.4所示;或
40.sirna gsnor3的正义链如seq id no.5所示;或
41.sirna gsnor3的反义链如seq id no.6所示。
42.在本技术的一些实施方式中,特异性抑制s-亚硝基化谷胱甘肽还原酶的活性的物质可以是任选的小分子化合物抑制剂,例如n30公司(n30 pharmaceuticals)开发的gsnor小分子抑制剂,如n6系列、n7系列、n9系列中的任一种;saje公司(saje pharma)开发的gsnor小分子抑制剂,如spl-334、spl-850等其中的任一种。
43.在本技术的一些实施方式中,特异性抑制s-亚硝基化谷胱甘肽还原酶的活性的物质为n6022(n30 pharmaceuticals)、n6547(n30 pharmaceuticals)、n6338(n30 pharmaceuticals)、n91115(n30 pharmaceuticals)、n91138(n30 pharmaceuticals)、spl-334(saje pharma)中的至少一种。
44.其中,部分小分子抑制剂的结构式举例说明如下:
45.n6022的结构式为:
[0046][0047]
n91115的结构式为:
[0048][0049]
spl-334的结构式为:
[0050][0051]
在本技术的一些实施方式中,特异性抑制s-亚硝基化谷胱甘肽还原酶活性的物质的给药量为0.05~10mg/kg。例如可以是0.05mg/kg、0.1mg/kg、0.2mg/kg、0.5mg/kg、1mg/kg、1.5mg/kg、2mg/kg、2.5mg/kg、3mg/kg、3.5mg/kg、4mg/kg、4.5mg/kg、5mg/kg、5.5mg/kg、6mg/kg、6.5mg/kg、7mg/kg、7.5mg/kg、8mg/kg、8.5mg/kg、9mg/kg、9.5mg/kg、10mg/kg。
[0052]
在其中一些具体的实施方式中,特异性抑制s-亚硝基化谷胱甘肽还原酶活性的物质的给药量为0.08~10mg/kg、0.1~10mg/kg、0.2~10mg/kg、0.5~10mg/kg、1~10mg/kg、2~10mg/kg、5~10mg/kg、0.1~8mg/kg、0.1~5mg/kg、1~8mg/kg、1~5mg/kg、1~3mg/kg。
[0053]
在其中一些具体的实施方式中,特异性抑制s-亚硝基化谷胱甘肽还原酶活性的物质在改善肺纤维化的血管新生产品中的含量为1~1000mg。例如可以是1mg、2mg、2.5mg、5mg、10mg、20mg、25mg、30mg、40mg、50mg、60mg、70mg、80mg、90mg、100mg、150mg、200mg、300mg、400mg、500mg、600mg、700mg、800mg、900mg、1000mg。
[0054]
在其中一些具体的实施方式中,特异性抑制s-亚硝基化谷胱甘肽还原酶活性的物质在改善肺纤维化的血管新生产品中的含量为2~1000mg、2.5~1000mg、5~1000mg、10~1000mg、20~1000mg、50~1000mg、100~1000mg、200~1000mg、500~1000mg、1~800mg、1~500mg、1~200mg、1~100mg、20~500mg。
[0055]
在本技术的一些实施方式中,载体为无机载体、有机载体、无机-有机复合载体中的任一种。其中,无机载体包括但不限于碳纳米管、碳点、石墨烯、纳米二氧化硅或其它无机纳米载体等其中至少一种;有机载体包括但不限于胆固醇、脂质体、腺病毒载体、腺相关病毒载体、慢病毒载体、逆转录病毒载体等其中至少一种;有机-无机复合载体包括但不限于金属有机框架mofs(如zif、uio、pcn、mil)、共价有机框架cofs(如py-azine、tppa-1、tpb-dmtp、tpome-pa1、dhatph、lzu1)等其中至少一种。此外,载体进一步也可以是或还包括胶体分散系统、其它大分子复合物、纳米胶囊、微球、珠子、水包油乳剂、胶束、混合胶束、溶剂、分散剂等其中至少一种。
[0056]
在本技术的一些实施方式中,肺纤维化为特发性肺纤维化。
[0057]
在本技术的一些实施方式中,肺纤维化为博莱霉素诱导的肺纤维化。
[0058]
在本技术的一些实施方式中,产品为药物,药物选自片剂、胶囊剂、丸剂、栓剂、气雾剂、口服液体制剂、颗粒剂、散剂、注射剂、露剂、酊剂、膜剂中的至少一种。
[0059]
在本技术的一些实施方式中,还提供a1~a3中至少一种物质在制备治疗肺纤维化的产品中的应用。上述物质可以改善肺纤维化的血管新生。
[0060]
在本技术的一些实施方式中,还提供a1~a3中至少一种物质在制备促进血管新生的产品中的应用。
[0061]
本技术的第二方面,还提供一种组合物,该组合物包括第一物质和第二物质,其中第一物质选自s-亚硝基化谷胱甘肽或s-亚硝基化谷胱甘肽还原酶的抑制剂中的至少一种;
第二物质选自治疗肺纤维化的其它药品、改善肺纤维化的血管新生的其他药品中的至少一种。
[0062]
在本技术的一些实施方式中,治疗肺纤维化的其它药品选自吡非尼酮、尼达尼布、甲强龙、强的松、甲氨蝶呤、环磷酰胺、波生坦、马西替坦、西地那非、n-乙酰半胱氨酸、质子泵抑制剂、组胺2受体拮抗剂,其它也可能包括抗结缔组织生长因子(ctgf)抗体、溶血磷脂酸(lpa)抑制剂、正五聚蛋白(穿透素)-2、jak-stat信号通路抑制剂、磷酸二酯酶4(pde4)抑制剂、tas-115(多种细胞因子受体tki)、伊非尼酮、整合素(integrin avb6)拮抗剂、组蛋白去乙酰化酶抑制剂等。
[0063]
综合以上,本技术提供了一种去s-亚硝基化的作用靶点,通过gsnor小分子抑制剂、外源性gsno和gsnor小干扰rna(sirna gsnor)等,可改善肺纤维化尤其是促进特发性肺纤维化中的血管新生。
[0064]
本技术的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本技术的实践了解到。
附图说明
[0065]
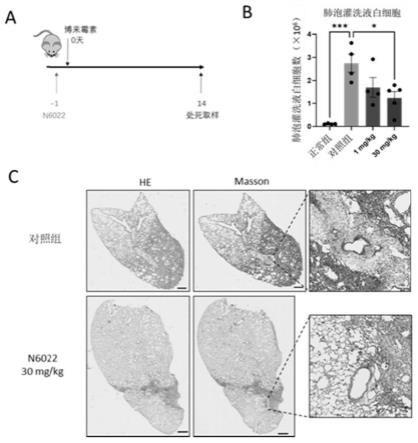
图1是本技术的实施例1中gsnor抑制剂n6022对特发性肺纤维化的功效研究的实验流程和实验结果。其中,a为建模过程中给药的示意图;b为不同组别的肺泡灌洗液中白细胞计数结果,*:p《0.05;***:p《0.001;c为对照组和30mg/kg组小鼠肺组织he染色和masson染色结果,第一列和第二列的he染色和masson染色的标尺为500μm,第三列masson染色放大图的标尺为50μm。
[0066]
图2是本技术的实施例2中gsnor抑制剂n6022对改善特发性肺纤维化血管新生的功效研究的实验结果。其中,a为模型小鼠在第0天和第21天的肺组织切片he染色结果,标尺为50μm;b为模型小鼠在第0天和第21天的内皮细胞特异性染色结果,标尺为100μm;c为对照组模型小鼠和30mg/kg组的小鼠在第14天的肺组织切片的内皮细胞特异性染色结果,标尺为100μm。
[0067]
图3是本技术的实施例3中gsnor小干扰rna(sirna gsnor)对体外血管生成的功效研究结果。其中,a为通过rt-pcr检测到的对照组和实验组的gsnor mrna的相对表达量,****:p《0.0001;b为通过western blot(wb)检测到的对照组和实验组的gsnor蛋白与内参β-actin的水平;c为血管形成实验中对照组和实验组在基质胶培养条件下成管能力的照片,标尺为200μm。
[0068]
图4是本技术的实施例4中gsnor抑制剂及外源性gsno对体内血管生成的功效研究结果。其中,从左到右分别是matrigel的空白对照、添加6mm gsno、添加0.4mm spl-334的基质胶栓切片的he染色结果照片,标尺为100μm。
具体实施方式
[0069]
以下将结合实施例对本技术的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本技术的目的、特征和效果。显然,所描述的实施例只是本技术的一部分实施例,而不是全部实施例,基于本技术的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本技术保护的范围。
[0070]
下面详细描述本技术的实施例,描述的实施例是示例性的,仅用于解释本技术,而不能理解为对本技术的限制。
[0071]
在本技术的描述中,若干的含义是一个以上,多个的含义是两个以上,大于、小于、超过等理解为不包括本数,以上、以下、以内等理解为包括本数。如果有描述到第一、第二只是用于区分技术特征为目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量或者隐含指明所指示的技术特征的先后关系。
[0072]
除非另有定义,本技术中所使用的所有的技术和科学术语与属于本技术的技术领域的技术人员通常理解的含义相同。本文中所使用的术语只是为了描述本技术实施例的目的,不是旨在限制本技术。
[0073]
本技术的描述中,参考术语“一个实施例”、“一些实施例”、“示意性实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本技术的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
[0074]
下面结合具体实例进行说明。
[0075]
实施例1:gsnor抑制剂n6022对特发性肺纤维化的功效研究
[0076]
1.动物模型的建立
[0077]
将spf级10周龄雄性c57bl/6j小鼠随机分为4组:正常组;对照组(特发性肺纤维化模型+pbs);1mg/kg组(特发性肺纤维化模型+1mg/kg n6022);30mg/kg组(特发性肺纤维化模型+30mg/kg n6022)。参考图1的a,特发性肺纤维化模型的建模方式如下:将小鼠麻醉,钝性分离暴露出气管,一次性气管注射博来霉素(5u/kg),自然苏醒后归笼。n6022在博来霉素刺激前24小时腹腔给药一次。博来霉素刺激后第14~21天已经出现显著的肺部纤维化特征。
[0078]
2.收集肺泡灌洗液和细胞计数
[0079]
博来霉素给药后第14天处死,气管插管灌注适量pbs缓冲液制得肺泡灌洗液(bal)。4℃,1000g离心5min后,细胞球(沉渣)洗涤两次并重悬于50μl pbs缓冲液中,血细胞计数器对其中的白细胞计数。
[0080]
3.肺组织形态学观察
[0081]
将各组小鼠左肺组织在10%体积分数的中性甲醛中固定24h,常规石蜡包埋、切片(厚度约5μm),分别进行he染色(苏木精染色2~5min,伊红染色1min)和masson染色(masson复合染色液染色5min),显微镜下观察小鼠组织的病理变化。
[0082]
4.实验结果
[0083]
肺泡灌洗液白细胞计数结果如图1的b所示,对照组模型小鼠的bal中白细胞数量与正常组小鼠的bal中白细胞数量的差异具有统计学意义,表明对照组建模成功。同时30mg/kg组小鼠的bal中白细胞数量与对照组的白细胞数量的差异同样存在统计学意义,表明30mg/kg的gsnor抑制剂n6022在14天显著减低了bal中白细胞的数量,而1mg/kg的gsnor抑制剂n6022在第14天已呈现出降低bal中白细胞数量的趋势。上述结果证明gsnor的抑制剂能够有效抑制纤维化肺组织中炎症细胞的数量。
[0084]
he和masson染色结果如图1的c所示,第14天时,对照组模型小鼠的肺组织出现大
量的炎性细胞浸润和胶原纤维沉积,而相较于对照组,30mg/kg组预先经过n6022处理后,肺组织病变样区域显著减小,胶原纤维的分布降低,纤维化区域显著减少。上述结果表明抑制gsnor可以抑制肺纤维化的发展进程。
[0085]
实施例2:gsnor抑制剂n6022对改善特发性肺纤维化血管新生的功效研究
[0086]
参考实施例1中的步骤,采用相同的方法利用博来霉素建立肺纤维化小鼠模型,分别在第0天和第21天对小鼠的肺组织切片进行he染色和内皮细胞特异性染色(cd31)。
[0087]
结果如图2的a和b所示,从图中可以看出,相比于第0天,第21天小鼠肺组织中血管密度显著下降。
[0088]
此外,对实施例1中对照组和30mg/kg组的小鼠在第14天进行内皮细胞特异性染色(cd31),结果如图2的c所示,从图中可以看出,预先使用30mg/kg的gsnor抑制剂n6022的药物处理后到建模的第14天显著增加了博来霉素诱导的肺纤维化小鼠肺组织中的血管密度。
[0089]
实施例3:gsnor小干扰rna(sirna gsnor)对体外血管生成的功效研究
[0090]
使用lipofectamine rnaimax reagent转染试剂按照其说明书的转染方案将sirna gsnor mix(sirna gsnor1、sirna gsnor2、sirna gsnor3)转染到人脐静脉内皮细胞(huvec)中,敲低gsnor(adh5)表达。
[0091]
sirna gsnor1、sirna gsnor2、sirna gsnor3的序列如下:
[0092]
其中,正义链25碱基,前23nt是rna,后2nt是dna悬垂,反义链27碱基为全链rna。
[0093]
sirna gsnor1:
[0094]
正义链序列(5'-3'):aauucagucaugaaccuguuuuctg(seq id no.1);
[0095]
反义链序列(5'-3'):cagaaaacagguucaugacugaauuau(seq id no.2);
[0096]
sirna gsnor2:
[0097]
正义链序列(5'-3'):gugucugaauauauguccaaaaaga(seq id no.3);
[0098]
反义链序列(5'-3'):ucuuuuuggacauauauucagacacca(seq id no.4);
[0099]
sirna gsnor3:
[0100]
正义链序列(5'-3'):uccuuugaauguauugguaauguga(seq id no.5);
[0101]
反义链序列(5'-3'):ucacauuaccaauacauucaaaggaau(seq id no.6)。
[0102]
通过rt-pcr和wb分别检测其中gsnor mrna含量以及gsnor的蛋白含量,结果如图3的a和b所示,从图中可以看出,上述三个sirna gsnor成功敲低了huvec细胞中gsnor mrna和蛋白质水平,表明其通过这三个sirna实现了gsnor的下调。
[0103]
取转染sirna gsnor mix的huvec和未转染的huvec分别作为实验组和对照组进行血管形成实验,步骤如下:
[0104]
实验前一天将matrigel置于冰盒中4℃冰箱过夜,使其过夜缓慢融化。待matrigel冻融后,在冰上用预冷枪头将matrigel分装到96孔板中,并置入培养箱中静置30~60min待其凝固。
[0105]
将上述实验组和对照组的huvec消化、重悬,制成密度为2
×
105个/ml的细胞悬液,96孔板中每孔加入50μl,随后在细胞培养箱中常规培养14h镜下观察拍照。
[0106]
结果如图3的c所示,从图中可以看出,实验组中gsnor下调表达后,huvec细胞在基质胶培养14小时的成管能力显著要高于对照组,表明这些gsnor sirna具有良好的促血管生成效果。
[0107]
实施例4:gsnor抑制剂及外源性gsno对体内血管生成的功效研究
[0108]
将300μl matrigel和pbs配成体积400ml(vegf 200ng/ml;heparin 60u/ml)混合液皮下注射于nod-scid小鼠腹部,5天后处死小鼠,取出已经凝聚的基质胶栓,固定、包埋、切片,he染色。其中,matrigel根据其组成是否还添加有其它成分从而分为三组:对照组(空白对照)、gsno组(加入gsno 6mm)、spl-334组(加入gsnor小分子抑制剂spl-3340.4mm)。结果如图4所示,gsnor抑制剂spl-334或外源性gsno能有效增强nod-scid小鼠体内基质胶栓血管形成能力,因而抑制蛋白去s-亚硝基化(抑制gsnor以及gsno外源性供给)能够显著促进血管再生。
[0109]
上面结合实施例对本技术作了详细说明,但是本技术不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本技术宗旨的前提下作出各种变化。此外,在不冲突的情况下,本技术的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1