一种用于心梗治疗的程序性释药核壳结构复合凝胶及其制备方法
本发明涉及一种用于心梗治疗的程序性释药核壳结构复合凝胶及其制备方法,属于医用材料领域。
背景技术:
1、心肌梗死是一种常见的急性危重症,在临床上引起广泛关注。心肌梗死后会经历五个阶段:早期进行性细胞外基质变性、心肌坏死细胞增多、炎症细胞浸润、纤维化瘢痕形成,最终导致左心室扩张和心力衰竭致死。炎症是人体对组织损伤或致病性感染信号的自然和基本反应。心肌梗死引起的心肌细胞凋亡能够迅速激活先天免疫通路,引发强烈但短暂的炎症反应。适度的炎症反应有助于清除死亡细胞和细胞外基质碎片,并可被随后的修复过程所调控。然而,过度和失控的炎症反应会增加心力衰竭的风险。另有研究表明,在心肌梗死的不同阶段将表达不同的生物因子。比如,剑桥大学李璇团队研究发现心梗后第三天,一种名为微管蛋白亲和力调节激酶4(mark4)的蛋白开始过表达,严重影响心肌收缩力,进而损害心脏功能。再如,另有研究发现,心梗后第三天(即增殖期),结缔组织生长因子(ctgf)开始过度表达,成纤维细胞向肌成纤维细胞分化,严重影响心肌收缩力,进而损害心脏功能。因此,根据心梗不同阶段的特点来制定相应的治疗策略将使得治疗更加高效。本研究制备了一种ros响应型双载药核壳结构微凝胶,经微创注射于心梗部位,以实现对心梗不同阶段的精准治疗。
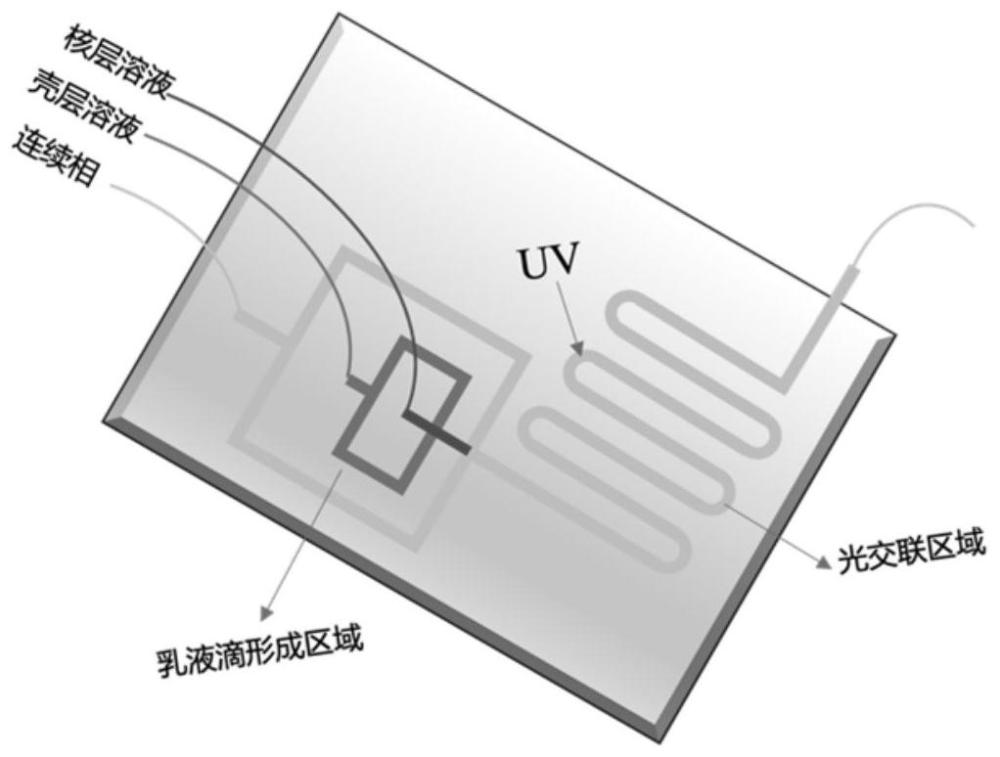
2、目前常用的微凝胶制备方法有间歇乳液法、机械破碎法、光刻法、膜乳化法、微流控法等。微流控法是利用微流控芯片或毛细管等装置,通过流动的水油两相之间的剪切力和疏水作用形成液滴,随后固化形成微凝胶,该方法可以得到近似单分散的微凝胶。与分布均匀的微凝胶相比,核壳结构微凝胶具有更大的内部空间,对物质的负载以及封装具有很高的效率。在药物的缓慢控释,物质的封装和保护等方面具有很大的应用前景。
3、目前的研究中,为实现不同药物的程序性释放,主要通过将药物负载于不同的载体中实现。例如,chu等人通过微流控技术制备了一种能够程序释放药物的核壳结构微凝胶。首先采用乳化溶剂挥发法制备负载姜黄素的plga纳米粒(cur-plga-nps),然后采用毛细管微流控技术,以油包水包油(o/w/o)型乳液为模板,制备了同时含有游离药物分子和载药plga纳米粒的核壳结构微凝胶,体外实验表明改微凝胶很好地实现了药物的程序性释放。然而,在微流控过程中,plga纳米粒子的存在会使得核壳结构微凝胶的制备过程变得不稳定,毛细管通道也容易被其堵住。
技术实现思路
1、鉴于此,本发明针对现有技术的不足,通过利用有机凝胶能够在体温下原位成胶的特性,提供一种用于心梗治疗的程序性释药核壳结构复合凝胶及其制备方法,以实现对不同阶段的精准治疗。将微凝胶经微创注射引入动物心脏梗死区域,通过壳层ros响应特性和所负载的亲水性抗炎药物,抑制心梗中第一阶段过表达的炎症反应。随着壳层的降解,核内负载的疏水性药物释放出来,特异性作用于心梗第二阶段中过度表达的生物因子,以此实现对两个阶段的精准干预,改善心脏功能并达到更有效的治疗效果。
2、为实现上述目的,本发明通过微流控芯片法制备了一种用于心梗治疗的程序性释药核壳结构复合凝胶,包括能够响应心梗微环境中过度表达的ros的壳层水凝胶,以及负载治疗心梗药物的核层有机凝胶。采用的技术方案如下:
3、s1、合成双键化的壳层基体材料:将甲基丙烯酸酐与聚合物材料加入n,n-甲基甲酰胺与水的混合液进行反应,对聚合物材料进行双键接枝;
4、s2、制备具有ros响应性质的壳层预聚液:以水为溶剂,将s1得到的双键化后的聚合物材料、ros响应材料hbpak、光引发剂及表面活性剂f127混合制备成壳层预聚液;
5、s3、制备负载疏水性药物的核层有机溶胶:将胶凝剂添加于有机溶媒中,混合体系置于胶凝剂熔点以上形成有机溶胶,加入抗凝剂、表面活性剂及疏水性心梗治疗药物,得到负载疏水性药物的核层有机溶胶;
6、s4、制备连续相:连续相由石蜡油和表面活性剂组成;s3及s4中的表面活性剂为司班80或聚甘油蓖麻醇酸酯;
7、s5、使用微流控技术并进行光引发交联制备核壳结构复合凝胶;
8、s6、之后浸泡在亲水性抗炎药物溶液中,室温下孵育后,离心收集,得到用于心梗治疗的程序性释药核壳结构复合凝胶。
9、进一步地,s1中所述的聚合物材料可以为透明质酸、明胶、胶原、硫酸软骨素、纤维蛋白、肝素、琼脂糖、海藻酸钠等中的一种。
10、进一步地,s1中n,n-甲基甲酰胺与水的体积比为1:2,甲基丙烯酸酐浓度为0.5-1.5mmol/ml,聚合物材料浓度为0.01-0.2mmol/ml,反应条件为冰浴或加热,反应ph为8-9,反应时间为12-24h。
11、进一步地,s2中壳层预聚液的各部分质量浓度为:双键化后的聚合物材料、ros响应材料hbpak、光引发剂以及表面活性剂f127分别为1-10%、5-15%、0.5-1%以及0.5-3%。
12、进一步地,s3中有机溶媒为植物食用油,例如玉米油、大豆油、橄榄油等;胶凝剂为长链脂肪酸,例如软脂酸、硬脂酸、花生酸等;其中抗凝剂为n-甲基吡咯烷酮(nmp)。所述疏水性心梗治疗药物为坎地沙坦、mark4抑制剂、尼可地尔、中、依普利酮的一种。s3中有机溶媒中胶凝剂的质量浓度为5-10%,抗凝剂的体积浓度为5-10%,表面活性剂的体积浓度为1%-5%。
13、进一步地,s4中使用液体石蜡以及表面活性剂(司班80或聚甘油蓖麻醇酸酯)作为连续相,其中表面活性剂体积浓度为5-15%。
14、进一步地,s5中微流控壳相控制流速为50-300μl/h,核相控制流速为20-150μl/h,连续相控制流速为300-1000μl/h。
15、进一步地,s5中所述的光引发功率为20w,引发时间为5-30min。
16、进一步地,s5中制备得到的核壳结构微凝胶粒径为100-200μm。
17、进一步地,s6中所述的亲水性抗炎药物为低塞米松碳酸钠、丹酚酸b、双氯芬酸等。
18、本发明与现有技术相比较有如下有益效果:
19、1)通过微流控方式能够将水凝胶和有机凝胶简单高效地结合在一起,并实现一体化制备水凝胶/有机凝胶复合凝胶系统;
20、2)可根据需要灵活选择/合成壳层或核层材料,赋予凝胶系统特定的功能,比如实现近红外、磁、超声等响应释药;
21、3)疏水药物溶解于有机溶媒中,通过微流控包裹于水凝胶内,可以实现高负载率;
22、4)在同一微凝胶中实现了亲水药物和疏水药物的同时负载,且可通过壳层厚度、ros响应能力强弱有效控制亲疏水药物的释放时间,实现程序性释药。
技术特征:
1.一种用于心梗治疗的程序性释药核壳结构复合凝胶的制备方法,其特征在于,包括如下:
2.根据权利要求1所述的用于心梗治疗的程序性释药核壳结构复合凝胶的制备方法,其特征在于,所述n,n-甲基甲酰胺与水的体积比为1:2,甲基丙烯酸酐浓度为0.5-1.5mmol/ml,聚合物材料浓度为0.01-0.2mmol/ml,反应条件为冰浴或加热,反应ph为8-9,反应时间为12-24h。
3.根据权利要求1所述的用于心梗治疗的程序性释药核壳结构复合凝胶的制备方法,其特征在于,所述聚合物材料为透明质酸钠、明胶、胶原、硫酸软骨素、纤维蛋白、肝素、琼脂糖、海藻酸钠中的一种或多种。
4.根据权利要求1所述的用于心梗治疗的程序性释药核壳结构复合凝胶的制备方法,其特征在于,壳层预聚液中双键化后的聚合物材料、ros响应材料hbpak、光引发剂及表面活性剂f127的质量浓度分别为1-10%、5-15%、0.5-1%以及0.5-3%。
5.根据权利要求1所述的用于心梗治疗的程序性释药核壳结构复合凝胶的制备方法,其特征在于,所述有机溶媒为植物食用油,所述胶凝剂为长链脂肪酸;所述抗凝剂为n-甲基吡咯烷酮;所述疏水性心梗治疗药物为坎地沙坦、mark4抑制剂、尼可地尔、依普利酮中的一种。
6.根据权利要求1所述的用于心梗治疗的程序性释药核壳结构复合凝胶的制备方法,其特征在于,s3中有机溶媒中胶凝剂的质量浓度为5-10%,抗凝剂的体积浓度为5-10%,表面活性剂的体积浓度为1%-5%;s4中表面活性剂的体积浓度为5-15%。
7.根据权利要求1所述的用于心梗治疗的程序性释药核壳结构复合凝胶的制备方法,其特征在于,s5中微流控壳相控制流速为50-300μl/h,核相控制流速为20-150μl/h,连续相控制流速为300-1000μl/h。
8.根据权利要求1所述的用于心梗治疗的程序性释药核壳结构复合凝胶的制备方法,其特征在于,s6中称取每100-500mg核壳结构复合凝胶浸泡在含有10-100μm亲水性抗炎药物的pbs溶液中,在室温、100rpm的摇床中孵育12h,通过离心空柱管收集装载亲水药物的核壳结构微凝胶。
9.根据权利要求1所述的用于心梗治疗的程序性释药核壳结构复合凝胶的制备方法,其特征在于,所述的亲水性抗炎药物为低塞米松碳酸钠、丹酚酸b、双氯芬酸中的一种。
10.一种用于心梗治疗的程序性释药核壳结构复合凝胶,其特征在于,采用如权利要求1-9任一项所述的方法制得,所述复合凝胶为粒径100-200μm的微凝胶。
技术总结
本发明公开了一种用于心梗治疗的程序性释药核壳结构复合凝胶及其制备方法,其制备方法包括如下:S1、合成双键化的壳层基体材料,S2、制备具有ROS响应性质的壳层预聚液;S3、制备含有疏水药物的核层有机溶胶;S4、制备连续相;S5、使用微流控技术并进行光引发交联制备核壳结构复合凝胶;S6、之后浸泡在亲水性抗炎药物溶液中,室温下孵育后,离心收集,得到用于心梗治疗的程序性释药核壳结构复合凝胶。该凝胶经微创注射引入动物心肌梗死区域,可以通过壳层材料及其负载的亲水性抗炎药物抑制心梗中第一阶段过表达的炎症反应;随着壳层的降解,核内负载的疏水性药物释放出来,作用于心梗中第二阶段特异性表达的生物因子,实现对两个阶段的精准干预,改善心脏功能并达到更有效的治疗效果。
技术研发人员:高长有,宋亮
受保护的技术使用者:浙江大学
技术研发日:
技术公布日:2024/2/29
- 还没有人留言评论。精彩留言会获得点赞!