用于回收金的工艺的制作方法
发明领域
本发明涉及回收金的工艺,并且更特别地涉及从含金矿石和精矿回收金。示例性和非限制性的实施方案总体上涉及回收金,并且更特别地涉及用于在浸出过程中从含金材料回收金的方法。
发明背景
可使用氰化物浸出或盐酸浸出来湿法冶金地制备金。金矿石、精矿、氧化残余物和煅烧物几乎是仅仅经受采用碳浸法、碳浆法的氰化物浸出,或氰化物浸出随后使用锌置换金(merrill-crowe工艺)。采用高酸性和高氧化还原电势的盐酸浸出主要应用于二次原材料(包括高浓度铂族金属(pgm),例如阳极泥)。目前,存在可忽略的量的用于金矿石、精矿、氧化残余物、煅烧物或低级二次原材料的工业级无氰化物金工艺。
早在19世纪,通过使用氯气来浸出金。通过使用氯气,可提高浸出溶液的氧化还原电势并且使金从原材料溶解为金氯化物络合物。在那时的主要问题之一为金沉淀在制备设备材料上,例如在转动的木桶上。有时在浸出装置/设备寿命的终点时,燃烧桶来回收金。尝试了例如通过木质表面上的焦油阻止该现象。当发展氯化物工艺时,金氯化物络合物沉淀/还原回原材料或存在于该工艺中的其他材料的这种倾向(还称作劫金(preg-robbing)、再吸收、溶液耗尽)引起问题。
发展阶段金氯化物浸出工艺整体上使用高浓度的氯化物,典型地存在溴化物添加和氧化剂(例如cu2+)。这是为了溶解金并且在溶液中保持金稳定。通常认可降低的氯化物浓度对金浸出动力学具有消极影响。然而,高氯化物和溴化物浓度可引起高的操作成本例如提高量的洗涤用水或化学品至排出物和/或浸出残余物的提高的损失以及在工艺中越来越复杂的化学组成。
例如au2008202814公开了用于使用卤化物溶液回收金和其他贵金属的方法。
au201320205公开了洗提金和银的方法,其包括通过加热使用包括氯离子和/或溴离子作为阴离子以及铜和铁作为阳离子的酸性浸出溶液从含金和银的硫化矿将金和银浸出至该酸性浸出溶液;在活性炭上吸收该酸性浸出溶液中的至少金和银并且洗提活性炭上的金和银,通过使用维持在小于ph7下的硫代硫酸盐水溶液在活性炭上至少吸附金和银。au201320205的连续方法似乎不允许从劫金原材料回收金。
与在au2008202814和au201320205中公开的方法相关的问题之一是需要高卤化物(例如氯化物或溴化物)浓度从而导致在可将从工艺排出的所有工艺水排放到环境之前需要清洁所有工艺水并且提高工艺化学成本、工业用水和任选的蒸发成本。
发明简要描述
目的因此是提供一种方法从而减轻上面的缺点。通过以在独立权利要求中陈述的为特征的方法来实现该目的。在从属权利要求中公开了优选实施方案。
本发明基于出乎预料的实现:当以特别的方式调节工艺参数时,可在温和的条件下在含金原材料的浸出中利用具有低氯化物浓度的浸出溶液并具有高的金回收率。除了可能的中和,在排放到环境之前从该工艺排出的工艺水仅需要较少的净化。
因此本文提供用于从含金原材料回收金的工艺。该方法包括使该含金材料与含有氯离子的浸出溶液接触以用于将金从该含金材料浸出至浸出溶液中,并且其中使该含金的浸出溶液与再吸收材料接触以用于从该浸出溶液回收金。
该方法的优点是获得更环境友好的用于浸出金的方法,因为可在较温和的工艺条件(以较低浓度的氯离子、铜离子和/或铁离子)进行浸出并且可避免使用例如溴化物和氰化物的物质。本发明的方法的进一步优点是在浸出设施的地点可天然得到的含氯化物的水溶液(例如海水)可直接用于或仅使用较少的化学添加(例如氯化钠/氯化钙)而用于金回收中,因此节省操作成本并简化总体工艺。
附图简要描述
下面将通过参考附图的优选实施方案来更详细地描述本发明,其中
图1显示金回收工艺的流程图,其说明了本发明的第一实例;
图2说明了用于特定矿石的在铁或铜浸出环境中获得的金提取率;
图3说明了在有和没有再吸收材料的情况下获得的金提取率;
图4显示沉淀在溴化丁基橡胶上的金的显微视图;
图5说明了在低氯化物环境中获得的金提取率;
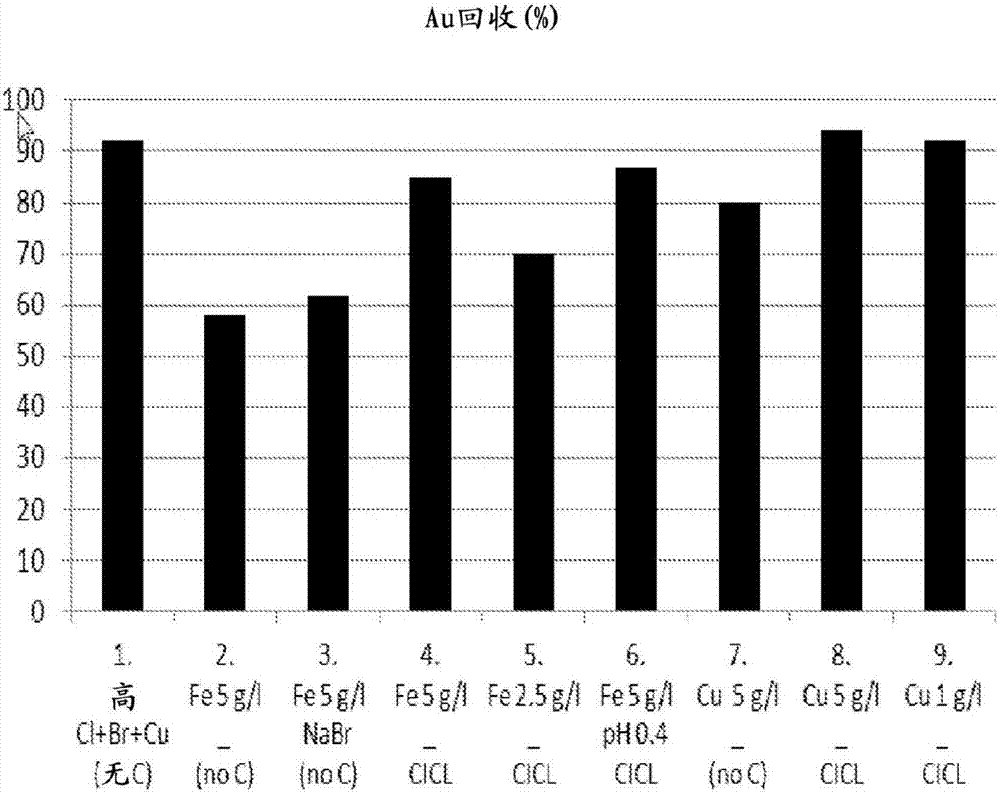
图6说明了在不同的金氯化物工艺中金的回收(%);和
图7说明了在本发明的方法的替代性实例过程中的氧化还原电势。
发明详细描述
本发明提供用于从含金原材料回收金的工艺。该工艺包括(a)在含氯化物的浸出溶液中浸出所述含金原材料以溶解金并获得在溶液中包含金的浸出溶液,该含氯化物的浸出溶液包含小于120g/l的总浓度的卤离子,其中氯离子的总浓度小于120g/l;并且同时使在溶液中包含金的浸出溶液与再吸收材料接触以获得包含含金再吸收材料的浸出溶液;以及(b)从所述含金再吸收材料回收金和任选的银。
特别地,本发明提供用于从含金原材料回收金的工艺。该工艺包括(a)在含氯化物的浸出溶液中浸出所述含金原材料以溶解金并获得在溶液中包含金的浸出溶液,该含氯化物的浸出溶液包含小于50g/l的总浓度的卤离子和至少0.26g/l的总浓度的铜离子和/或铁离子,其中氯离子的总浓度小于50g/l,溴离子总浓度小于10g/l;并且同时使在溶液中包含金的浸出溶液与再吸收材料接触以获得包含含金再吸收材料的浸出溶液;以及(b)从所述含金再吸收材料回收金和任选的银。
以下实施方案是示例性的。虽然说明书可在许多地方提及“一个(an)”、“一种(one)”或“一些”实施方案,但是这不必然意味着每个这样的提及物是相同的一个或多个实施方案,或者特征仅适用于单一实施方案。还可组合不同实施方案的单一特征以提供其他的实施方案。此外,词语“包含”和“包括”应理解为不将所描述的实施方案限制于仅由已经提到的那些特征组成并且这样的实施方案还可含有没有特别提到的特征/结构。应宽泛地解释所有词语和表述并且它们意在说明而非限制实施方案。
金氯化物络合物没有例如金溴化物络合物或金氰化物络合物那么稳定。通常,低的氧化还原电势、不存在溴化物和浸出溶液中的低氯化物浓度导致较慢的金溶解和/或导致原材料/设备表面上的金还原/沉淀,等等。尽管如此,本发明提供一种方法,在该方法中通过使用温和的氯化物浸出环境,甚至在不存在溴化物的情况下通过提供有竞争力的还原/吸附/吸收物质,可以在金在溶液中较不稳定的环境下回收金(见以下实施例1和5)。
在本工艺中不需要在浸出溶液中金氯化物络合物的稳定性,但是当暴露至浸出溶液时立即在再吸收物质上捕获金。这允许使用较低的氯化物浓度、较低的氧化剂浓度(即较低的铁和/或铜和/或其他氧化剂浓度)、和较低的氧化还原电势,以及使用劫金原材料(见以下实施例4)。在示例性实施方案中,可浸出和回收具有在溶液中使金沉淀的倾向的材料(称作劫金材料)中的金。在示例性实施方案中,可实现较低的化学品消耗和较低的资本支出(capex)和运营支出(opex)。在示例性实施方案中,该工艺完全不含氰化物。这些特征使该工艺更环境友好并且更可适用于许多原材料。
本发明的工艺因此适合于易选的和/或预氧化的非易选的含金原材料。所述原材料可为劫金的但是不需要为劫金的。如本文及以后使用的术语“劫金”意指从主体材料溶解的金的再沉积、还原和/或吸附至劫金物质表面(例如材料的非晶碳表面)上并且因此意指其自溶液和与矸石和/或浸出残余物一起留下的损失。术语“劫金原材料”还意指在所述原材料中存在劫金材料例如碳质非晶、石墨碳、其他的碳质物质、黏土或其他吸附/还原组分、或其任何混合物。所述原材料典型地包含该原材料总重量的至少0.01%w/w,特别地至少0.5%w/w,优选至少1%w/w的降低金回收率的劫金物质。
根据本发明,当含金原材料不是易选的时,优选在浸出步骤(a)之前通过以下任一项来预氧化该含金原材料:焙烧、压力氧化和生物氧化(例如细菌氧化)或其任何组合。如果需要,还可在浸出步骤(a)之前预氧化易选的含金原材料。所述原材料例如可为矿石、精矿、尾矿、焙烧炉煅烧物、氧化残余物、浸出残余物、浸出中间物、二次原材料、废弃材料、重选精矿、硫化精矿、电子电气设备废弃物(weee)废料或其他易选的材料,或其任何组合。
图1显示金回收工艺的工艺流程图的实例。将含金原材料(1)供给至金浸出步骤(20),其中在大气或轻微加压的条件下在存在再吸收材料(2)的情况下浸出原材料(1),该再吸收材料能够捕获(例如吸收、还原和/或沉淀)来自浸出溶液的溶解的金。如果处理包含非易选物质的原材料,则首先使所述原材料(1’)经受上面讨论的预氧化步骤(10)例如压力氧化(pox)以获得易选的含金原材料(1)。
可在由流体静压和大气压组成的总压下进行浸出(20)。任选地可使用小的过压。典型地在反应器顶部该过压小于0.5巴。特别地可利用流体静压来提高溶解动力学。优选在大气条件下进行浸出步骤(a)。浸出步骤(a)的温度处于或低于浸出溶液的沸点,有利地从70至105℃,优选从90至100℃。由流体静压所致,浸出步骤(a)的温度可局部升高大于浸出溶液的沸点。
在包含氯离子的浸出溶液(2)中进行浸出。
浸出溶液的总卤化物浓度小于120g/l,例如从50至100g/l,或者小于50g/l,特别地小于40g/l,优选从1至35g/l,更优选从2至30,甚至更优选从10至20g/l。浸出溶液的总氯化物浓度小于120g/l,例如从50至100g/l,或者小于50g/l,特别地小于40g/l,优选从1至35g/l,更优选从2至30,甚至更优选从10至20g/l。
在本发明的一个实例中,作为盐溶液(例如nacl或cacl2)提供或从一些其他氯化物源接收用于金络合的氯化物。根据本发明的优选实例,浸出溶液包含在浸出设施的地点可得到的含氯化物的水溶液。因此,取决于含氯化物的水溶液的属性,浸出溶液的总氯化物浓度可变化。在浸出设施的地点可得到的所述含氯化物的水溶液可为例如源自于氯化物化学品、海水、在该浸出设施内产生的含氯化物的含水排出物、或其任何混合物的氯化物溶液。例如,取决于地理位置,海水的氯化物含量变化。如所述的,典型地在浸出溶液中自生地含有所述氯离子,然而可替代地或另外地例如以氯化物盐或含盐溶液的形式(例如氯化钠(nacl)、氯化钙(cacl2)、氯化铜(cucl2)、氯化铁(fecl3)或其任何混合物)将所述氯离子提供至浸出溶液。在本发明的特别实例中,浸出溶液是海水或源于海水。在替代性的实例中浸出溶液为合成的氯化物水溶液。
在一些现有技术的金浸出工艺中,将溴离子添加至溶液以作为金溴化物络合物使金保持更稳定。采用本发明的方法,不必要将溴离子添加至浸出溶液。然而,容许在浸出步骤中溴离子的存在。在本发明的优选实例中,在不存在添加的溴离子的情况下进行浸出步骤(a)10。典型地在含氯化物的浸出溶液中溴离子的浓度小于10g/l,更优选从0至5g/l,最优选0g/l。
优选保持浸出步骤(a)中的ph小于对于铜和/或铁而言的沉淀极限。典型地ph小于4.0,优选小于2.7,更优选等于或小于1。在本工艺的一个实例中,ph为从1至4,优选从1至1.5以便进一步保持铜和铁或铜可溶解。可使用至多4.0的ph,因为随着氯化物浓度降低,氯铜矿/铜沉淀ph提高。hcl浓度可小于40g/l,优选小于12g/l,更优选小于10g/l。ph没有显著地影响金溶解动力学。然而,在存在杂质的情况下高ph是有利的,因为在较高的ph下,溶液中的杂质水平较小,与杂质络合物结合的氯化物的量较小并且因此排出物可较少。本工艺还能够在高酸性(hcl~10g/l)下操作,然而在现有技术工艺中在高酸性下用于金溶解的铁离子活性降低。
在高酸性(hcl~10g/l)下,可使用铁离子和/或铜离子作为氧化剂。在较高ph(>1.5)下铁沉淀,并且可使用低的铜浓度作为氧化剂。示例性实施方案主要适合于游离金浸出例如易选矿石、焙烧炉煅烧物、氧化残余物、浸出残余物、二次原材料、重选精矿和/或硫化精矿。
调节浸出步骤(a)中浸出溶液的氧化还原电势至金将溶解的水平。典型地通过氧化剂(典型地铜离子和/或铁离子)(3)的存在来实现氧化条件。典型地以铜盐(例如cuso4和/或cucl2)的形式将所述铜离子提供至浸出溶液中,或者所述铜离子源自于原材料。在浸出设施的地点可得到的含氯化物的水溶液的自生氯化物浓度极低并且必须将氯离子的量调节至较高浓度的情况下,cucl2可为有利的。优选地,以对应的硫酸盐(即cuso4和/或feso4)的形式提供所述铜离子和/或铁离子。另外提供含氧气体(5)的进料(例如氧气、空气或富氧空气)以典型地使铜和/或铁被氧化。
含氯化物的浸出溶液中的溶解的铜离子和/或铁离子的总浓度为至少0.26g/l,优选至少1g/l,更优选至少3g/l,甚至更优选从5至45g/l,最优选从9至20g/l。在本发明的浸出步骤中不需要强氧化试剂例如过氧化氢、硝酸或氯气。在本发明的一方面不必要地需要铜离子的存在,甚至在原材料中不必要地需要铜离子的存在。这是由随着氯离子浓度降低铁/亚铁的氧化还原电势提高的事实所致。优选地,在含氯化物的浸出溶液中铁离子的总浓度为0g/l至10g/l,更优选0.26g/l至5g/l。另外优选地,在含氯化物的浸出溶液中铜离子的总浓度小于20g/l,更优选小于5g/l,甚至更优选小于1g/l,最优选0g/l。在示例性实施方案中,在不存在铁的情况下进行浸出。在示例性实施方案中,在不存在铜的情况下进行浸出。
在示例性实施方案中,在氯化铁溶液中浸出金,其中通过铁(iii)铁fe3+进行主要的金氧化。初始浸出溶液组成包含小浓度的fe3+,适中的cl浓度,没有br并且没有cu2+,即金在溶液中为相对不稳定的环境。通过在活性炭或其他再吸收材料上浸出的过程中即刻回收金使得能够浸出金(见以下实施例1)。
将氯化物浸出步骤(a)中的浸出溶液的氧化还原电势调节至金溶解的水平,典型地调节至相对于ag/agcl至少400mv,优选相对于ag/agcl大于450mv,特别地相对于ag/agcl大于500mv。采用本工艺典型地保持氧化还原电势相对于ag/agcl小于600mv,优选相对于ag/agcl甚至小于530mv。特别地,该氧化还原电势为相对于ag/agcl从450至530mv。
根据本发明在存在再吸收材料(4)的情况下进行浸出步骤(a),该再吸收材料能够捕获(例如吸收、吸附、还原和/或沉淀)来自浸出溶液的溶解的金。由于金氯化物络合物可能在浸出条件下具有非常低的稳定性并且需要在再吸收材料上尽可能快地被回收的事实,需要存在再吸收材料。否则金将沉淀回到原材料、构造材料或其它表面上,甚至在所述原材料中不存在劫金材料的情况下。
浸出过程中,可设置再吸收材料位于例如浸出反应器的壁上,或该再吸收材料(4)在浸出溶液中可为例如颗粒、离子交换树脂和/或无规则填充物的形式。
典型地再吸收材料(4)选自包含碳的化学品和材料,优选选自由活性炭、树脂、有机溶剂、有机物质(例如木材、煤和纤维)、无机碳、橡胶、塑料、生物聚合物及其任何组合组成的组。例如再吸收材料包含以下一种或多种:活性炭、浸出物中的树脂、浸出物中的溶剂、有机物质、无机碳、橡胶、塑料、离子交换树脂和聚合树脂。
在示例性实施方案中,金在氯化物浸出物中的碳(即cicl)上被还原。在以下实施例1中显示从较不稳定的溶液(即其中金氯化物络合物是不稳定的溶液)可即刻进行回收,其中可使用cicl或氯化物浸出物中的树脂(ricl)或对应的方法作为金回收方法。由于cicl允许较低的试剂浓度、较低的氧化还原电势的使用以及劫金进料材料和氯化物浸出中的工艺设备的使用的事实,使用cicl是有利的(见以下实施例4)。
在本发明的典型实例中再吸收材料(4)为活性炭。活性炭的优点为与许多其他吸收剂相比用于吸附/还原/沉淀的高面积,对于氯化物介质中金的高亲和性,优良的可得性和低的价格。活性炭(活性炭黑、活性木炭、活化煤)是被加工的碳的一种形式使得小体积的孔提高可用于吸附或化学反应的表面面积。活性炭具有高程度的微孔,其提供所需活化水平。除活性炭之外,在示例性实施方案中待使用的合适的再吸收材料包括例如浸出物中的树脂、浸出物中的溶剂、有机物质(例如木材)、无机碳、橡胶、塑料、离子交换树脂和/或聚合树脂。图4显示沉淀在溴化丁基橡胶上的金的显微视图。
在本发明的另一个实例中再吸收材料(4)为塑料例如聚合物树脂。适合于回收金的聚合物树脂的实例为金选择性树脂例如聚苯乙烯树脂。在这样的聚苯乙烯树脂中金被吸附至实心球形聚苯乙烯树脂球上而不是活性炭晶粒上。合适的离子交换树脂的另一实例包括包含哌嗪官能团的树脂。
添加至浸出溶液(2)的再吸收材料(4)的量取决于待回收的金的量和/或含金原材料中劫金材料的浓度和/或金溶解率。优选在浸出溶液中再吸收材料(4)的浓度为至少5g/l,优选至少10g/l,更优选20至80g/l。
参考图1,含金再吸收材料(7)经受金回收步骤(b)(30)用于从所述再吸收材料回收金。可通过已知的方法从含金再吸收材料(7)回收金。例如可火法冶金地通过洗提、通过反萃取或通过从火法冶金接收的灰浸出金来从再吸收材料(7)回收金。
优选地火法冶金地从含金再吸收材料(7)回收金。典型地通过燃烧含金再吸收材料实现火法冶金地从含金再吸收材料回收金以获得富含金(和任选的银)的含金块(dore)(8)。可任选地浸出或洗提(40)所得的燃烧的再吸收材料(31)以确保完全回收金(42)和银(43)。可将通过任选的浸出或洗提步骤(40)回收的铜(41)再循环至氯化物浸出步骤(a)(20)用于提供在所述浸出步骤(a)(20)中需要的铜离子(4)。
可使从金浸出步骤(a)(20)所得的耗尽金的浸出溶液(21)经受固-液分离(50)以从溶液分离浸出残余物(52)并且获得浸出流出物(51)。可直接将该浸出流出物(51)再循环回到浸出步骤(a)(20)或首先将其处理以通过例如沉淀来从所述浸出流出物(51)回收铜离子和/或铁离子来源。然后可将耗尽铜的浸出流出物排放至环境例如返回大海并且可将沉淀的铜和/或铁溶解并再循环至浸出步骤(a)(20)。
同时可部分或完全回收银(见以下实施例2)。或者或除此之外,可通过沉淀(例如通过硫化)、还原、置换(例如通过铜)、溶剂提取、离子交换或一些其他合适的方法来从再吸收材料(和/或从浸出溶液)回收银。
还可在再吸收材料上还原/吸附/吸收/沉淀杂质。可火法冶金地进行从碳回收金。获得au-ag含金块。杂质可最终成为au-ag含金块,可从碳洗提或从烧过的碳(即灰)洗提杂质。取代碳或者除了碳之外,在浸出物中可使用一些替代性的再吸收材料例如浸出物中的树脂、浸出物中的溶剂、有机物质(例如木材)、无机碳(例如黏土)、橡胶、塑料、离子交换树脂和/或聚合树脂。
在示例性工艺中,可在适度的氯化物溶液中浸出金。可使用铁离子作为主要氧化剂。在示例性工艺中不需要br并且不需要cu2+或需要较少cu2+用于金氧化或稳定化。示例性工艺可包括约0-10g/l,优选约0.26-5g/l的fe3+;小于120g/l,优选约50-100g/l的cl-;小于20g/l,优选小于5g/l,更优选小于1g/l的铜(cu2+);75℃至浸出溶液的沸点的温度,优选90℃;小于铁和/或铜的沉淀极限的ph,但是hcl浓度甚至高达10g/l。
在这些条件下,认为金氯化物络合物在浸出溶液中较不稳定。出于此原因,习惯上在较高的氧化还原电势(具有在溶液中较高的铜、氯化物和溴化物浓度)处进行金氯化物浸出。在示例性实施方案中,同时存在再吸收材料例如活性炭使浸出溶液的金回收成为可能(见以下实施例1)。
在示例性实施方案中,与现有的金氯化物浸出工艺相比,可在更低的氯化物浓度下浸出金。低氯化物浓度提高ph极限,大于该极限发生cu2+/氯铜矿沉淀。出于此原因,cu2+为含水形式并且还能够在较高ph下氧化金。甚至当ph=4时仍可采用低氯化物浓度施加示例性工艺。
在示例性工艺中,在单一阶段(任选采用低浓度的三价铁(iii)和含氧气体(例如空气/氧气/富氧空气))浸出在原材料(还称作含金原材料)中存在的金。任选可使用低浓度的二价铜(ii)。氧化-还原电势(氧化还原电势)相对于ag/agcl参比电极可为400mv至750mv,优选500mv至620mv,更优选500mv至550mv。ph小于铜和/或铁的沉淀极限,并且可使用[hcl]=10g/l或甚至更高数量级的hcl浓度。例如,该浸出溶液可具有5g/l至40g/l,优选10g/l至12g/l,更优选10g/l的hcl浓度。不需要其他强氧化试剂例如过氧化氢或硝酸。在浸出阶段中在活性炭或其他用于金的合适再吸收材料上同时还原/吸附/吸收/沉淀在浸出过程中溶液中获得的金。可在存在过量氯化物的情况下浸出并且通过碳同时回收银(如果存在)。或者或除此之外,可通过其他方式(例如通过sx)随后沉淀或提取银。
示例性工艺装置可包括a)浸出和金回收单元,b)活性炭燃烧单元和/或任选的洗提单元(或沉淀剂/还原剂/吸附剂/吸收剂处理单元),c)固液分离单元,d)循环单元,e)蒸发单元(例如可通过蒸发的方式使工艺溶液平衡以从浸出溶液去除过量的水)和d)杂质处理单元。
示例性实施方案包括闭合的化学循环,其中通过蒸发和/或通过反渗透(ro)和/或一些其他的水去除技术处理水平衡,使得不存在排出物或仅存在最少的排出物至环境。
在示例性实施方案中,将金(和银)从浸出溶液分离之后,存在固/液分离阶段。在该工艺中使溶液循环并且可通过蒸发和/或一些其他合适的水去除技术去除过量的水。可使杂质(如果累积)经受适当的废水处理以使环境影响最小化。
因为不需要铜和溴化物的存在,所以不需要设置用于铜或溴化物的回收。然而,在示例性实施方案中浸出溶液可含有铜(添加或来自原材料),其中可设置适当的铜回收和/或循环。
实施例
实施例1:金浸出条件下的au提取。采用易选矿测试用于金的氯化物浸出条件。以下表1(测试参数)和图1(金提取)显示基于在表1中列出的试验(铁或铜浸出条件)过程中的固体分析可在溶液中没有溴化物的较不稳定的溶液中实现高数量级(>90%)的金回收。
测试1:测试1为在溶液中使金保持稳定的常规氧化浸出环境中进行的“参比测试”(高[cl]、[br]和[cu],与intec或一些其他发展阶段氯化物浸出工艺相似)。金回收率为91%。
测试2、测试3和测试7:在溶液中使用低浓度的铁离子或铜离子(不存在碳和溴化物),金提取率降低并且在58-80%之间变化(测试2和测试7,表1和图2)。这是由在较低氧化还原电势处金氯化物络合物不稳定性所致。向铁浸出物添加nabr(不存在碳,测试3,表1,图2)轻微地改进金回收从58%至62%。
测试4:在不存在溴化物和铜的情况下具有[fe3+]=5g/l的金cicl铁浸出物给出有希望的~85%的au提取(图1,见测试4)。这显示通过使用还原性物质(即活性炭),可浸出金并且还在较不氧化性环境中回收金。
测试5:与测试4相比,cicl中更低的铁浓度(测试5中2.5g/l的[fe3+],表1,图2)显示更低的金回收(~70%),但是与没有cicl的测试2和测试3相比显示更高的回收。
测试6:较低的酸性(测试6,表1,图2)给出与较高酸性(测试4,表1,图2)相同水平的金回收(~87%),显示酸性没有降低铁离子活性,而是在高酸性和较低酸性下浸出都是有效的。
测试7-9:显示具有[cu2+]=5g/l或[cu2+]=1g/l(测试8和9,表1,图2)的cicl铜浸出物给出非常好的>90%的金回收。
另外,可建议采用碳的逆流模式可最有可能地提高金回收至较高的水平。
表1用于易选的金精矿的初始浸出测试参数
实施例2:碳上的au和ag回收。实施例2显示可在碳上回收金。在示例性浸出工艺中可至少部分地回收银;然而,银的回收不是非常高。基于在实施例1中所示的相同试验参数(表1),在浸出物中具有碳的氯化铁浸出中(测试4(fe5g/l,cicl)金回收为85%(基于固体分析)和89%(基于碳分析)。这比没有碳的“强”氯化物浸出中的(92%)低一点。采用cicl的氯化铁浸出物中的银提取为53%(基于残余物分析)和29%(基于碳分析)。这与在没有碳的“强”氯化物浸出(测试1(高cl+br+cu),表1,图1)(56%)中的具有相同数量级。
表2测试中碳上的au和ag回收
实施例3:在示例性浸出工艺中,铁离子是强氧化剂。随着cl浓度升高,fe2+/fe3+的氧化还原电势降低,使cu2+为溶液中主要的和最强的氧化剂,这是在现有技术的金浸出工艺中铜是存在的主要氧化剂的原因。在示例性浸出工艺中铜的存在不是必要的(然而,应注意在真实情况下经常存在一些例如由使用的原材料所致的铜)。
实施例4:对于与表1中所示的那些相同的浸出介质中的劫金氧化残余物原材料进行金浸出测试。图5说明了在有和没有再吸收材料的情况下获得的金提取率。图3显示在浸出物中没有再吸收物质的情况下(即当没有使用氯化物浸出物中的碳(cicl)时)金回收仅为0.5%。通过施加cicl方法,金回收提高直至81%。
实施例5:在金浸出条件下的au提取。采用易选矿测试用于金的氯化物浸出条件。以下表3(测试参数)和图5(金提取)显示可在溶液中没有溴化物并且仅有较小量的铜离子的较不稳定的溶液中以低的氯化物浓度实现与氰化物浸出相当的金回收。
表3用于易选的金精矿的初始浸出测试参数
实施例6:与采用高氯化物浓度的现有技术浸出(测试1和2)相比,采用有低氯化物浓度的溶液(具有[cu2+]=35g/l,[cl-]=40g/l,ph=2.6,t=98℃,t=40h,氧进料的测试3)和海水类型溶液(具有[cu2+]=17.5g/l,[cl-]=20g/l,ph<3,t=98℃,t=40h,氧进料的测试4)和甚至更温和的溶液(具有[cu2+]=9g/l,[cl-]=10g/l,ph<3,t=98℃,t=40h,氧进料的测试5)进行在温和环境下的标示性浸出测试。在试验过程中氧化还原为相对于ag/agcl<600mv并且甚至<500(图3)即具有不认为金在溶液中稳定的数量级。出乎预料地观察到采用所有测试的温和溶液(测试3至测试5)金回收为>90%。
图6显示可在采用高卤化物浓度的现有技术工艺(测试1)中浸出92%的金。不存在碳。采用碳浸法(测试2),[cu]=1g/l,[cl-]=100g/l)测试导致大约94%的回收。通过施加本发明的方法,测试3([cl]=40g/l与35g/l的cu2+)和测试4([cl]=20g/l与17.5g/l的cu2+)和测试5([cl]=10g/l与9g/l的cu2+),可分别浸出99%、97%和90%的金。
图7显示在浸出实验过程中的氧化还原电势。特别地在测试4中氧化还原电势非常低,相对于ag/agcl小于520mv。在这样的低电势下,不存在已经报道金氯化物浸出成功的氯化物工艺/实验室研究。出乎预料地,观察到在这样的低电势下在存在再吸收剂的情况下金可溶解。如本发明的方法展示的,可使用海水或相似类型的含氯化物的合成水溶液在低redox下使金溶解。
实施例7:金浸出条件下的au提取。采用低氯化物浓度测试用于金的氯化物浸出条件。在表4中提供测试参数。不存在添加的溴化物。所有测试中的驻留时间为20h并且浸出温度为98℃。表4还显示可在低氯化物浓度下实现合理的金回收。
表4用于易选的金精矿的初始浸出测试参数
对本领域技术人员将显而易见的是,随着技术进步可以以各种方式实施本发明构思。本发明及其实施方案不限于以上所述的实施例,而是可在权利要求的范围内变化。
- 还没有人留言评论。精彩留言会获得点赞!