一种纳米金的绿色可控合成方法及其一步肽功能化方法与流程
本发明属于纳米材料技术领域。更具体地,涉及一种纳米金的绿色可控合成方法及其一步肽功能化方法。
背景技术:
近年来,贵金属纳米材料得到了快速的发展。其中纳米金在光学传感、电化学传感、生物分析、化学分析、自组装和纳米器件等方面有着广泛的应用。在各别研究领域中,对纳米金的粒径有了特别的需求。因此,找到一种粒径可控的纳米金制备方法对促进纳米金的应用有重要意义。
目前制备金颗粒所用的方法有物理法和化学法。物理法主要是通过各种分散技术将金直接转变为纳米粒子,主要包括真空沉积法、激光消融法等方法。化学法是以金的化合物为原料,利用还原反应生成金纳米粒子,通过控制反应条件,制备所需尺寸的颗粒,主要包括:水相氧化还原法、晶种法、微乳法和模板法等。目前纳米金的合成制备已进入相对成熟的阶段,虽然个别方法能通过改变反应中物料的比例,在一定程度上实现纳米金粒径的变化,但是这些方法难以达到对纳米金粒径的预测和精确控制,由此阻碍了进一步的实验研究。此外,现有的合成方法大多需要高温反应,而少数几个室温制备方法中则需要用到盐酸羟胺(nh2oh·hcl)、硼氢化钠(nabh4)等危险试剂,对人体和环境存在巨大伤害。
因此,开发操作简便、环境友好、粒径可控的纳米金制备方法,对纳米金的研究发展与应用具有重要意义。
技术实现要素:
本发明要解决的技术问题是克服现有技术的缺陷和不足,提供一种操作简单、设备少、制备成本低的纳米金绿色可控合成方法。所述纳米金合成方法进行了原料和过程的优化,可得到不同粒径的纳米金,并能一步实现纳米金的肽功能化。
本发明的第一个目的是提供一种纳米金的绿色可控合成方法。
本发明的第二个目的是提供使用上述绿色可控合成方法制备得到的纳米金颗粒。
本发明的第三个目的是提供一种一步合成功能化纳米金的方法。
本发明的第四个目的是提供使用上述方法制备得到的功能化纳米金。
本发明的第五个目的是提供所述纳米金颗粒和所述功能化纳米金在蛋白酶定量分析中的应用。
本发明上述目的通过以下技术方案实现:
具体的,一种纳米金的绿色可控合成方法,包括以下步骤:
s1.用ph值为8.0~12.7的碱性缓冲溶液配置浓度为0.15~0.5mg/ml的酪氨酸溶液;
s2.将酪氨酸溶液和氯金酸溶液混匀,在25~41℃条件下反应0.5~14h,即可得到所述纳米金。
优选地,步骤s1中所述碱性缓冲溶液为br缓冲溶液或naoh溶液,所述br缓冲溶液的ph值为8.0~12.0。
优选地,步骤s1中,所述酪氨酸的浓度为0.5mg/ml。
优选地,步骤s2中,所述氯金酸的浓度为1~5mmol/l。
更优选地,步骤s2中,所述氯金酸的浓度为2.94mmol/l。
优选地,步骤s2中,所述酪氨酸溶液和氯金酸溶液的体积比为0.6~3:1。
更优选地,步骤s2中,所述酪氨酸溶液和氯金酸溶液的体积比为2:1。
优选地,步骤s2中,所述反应的温度为37~41℃。
更优选地,步骤s2中,所述反应的温度为37℃。
优选地,步骤s2中,所述反应的时间为60~150min。
更优选地,步骤s2中,所述反应的时间为90~120min。
最优选地,步骤s2中,所述反应的时间为120min。
优选地,所述纳米金的粒径为15~35nm。
具体的,一种一步合成功能化纳米金的方法,包括如下步骤:
s11.用ph值为8.0~12.7的碱性缓冲溶液配置浓度为0.15~0.5mg/ml的酪氨酸溶液;
s12.将五肽calnn溶液和氯金酸溶液混合,得到氯金酸-肽溶液;
s13.将步骤s11的酪氨酸溶液和步骤s12的氯金酸-肽溶液混合,在25~41℃条件下反应0.5~14h,离心,洗涤,即可得到肽功能化纳米金。
或者采用包括以下步骤的方法制备功能化纳米金:
s21.将制备的纳米金颗粒与五肽calnn溶液混合,得到混合溶液;
s22.将步骤s21的混合溶液在4~25℃条件下反应2~14h,离心,洗涤,即可得到肽功能化纳米金。
优选地,步骤s11中所述碱性缓冲溶液为br缓冲溶液或naoh溶液,所述br缓冲溶液的ph值为8.0~12.0。
优选地,步骤s11中,所述酪氨酸的浓度为0.5mg/ml。
优选地,步骤s12中,所述氯金酸的浓度为1~5mmol/l。
更优选地,步骤s12中,所述氯金酸的浓度为2.94mmol/l。
优选地,步骤s12和步骤s21中,所述五肽calnn溶液的浓度为0.2~2mmol/l。
更优选的,步骤s12和步骤s21中,所述五肽calnn溶液的浓度为1mmol/l。
优选地,步骤s12中,所述五肽calnn溶液和氯金酸溶液混合的体积比为8~10:1。
优选地,步骤s12中,所述五肽calnn溶液和氯金酸溶液混合的体积比为9:1。
优选地,步骤s13中,所述酪氨酸溶液和氯金酸-肽溶液的体积比0.6~3:1。
更优选地,步骤s13中,所述酪氨酸溶液和氯金酸-肽溶液的体积比2:1。
优选地,步骤s13和步骤s22中,所述反应的温度为37~41℃。
更优选地,步骤s13和步骤s22中,所述反应的温度为37℃。
优选地,步骤s13中,所述反应的时间为60~150min。
更进一步优选地,步骤s13中,所述反应的时间为90~120min。
最优选地,步骤s13中,所述反应的时间为120min。
因此,本发明制备得到的纳米金颗粒和功能化纳米金均在本发明保护范围之内。
另外,所述的纳米金颗粒或所述的功能化纳米金在蛋白酶定量分析中的应用也在本发明保护范围之内。
本发明具有以下有益效果:
该合成步骤简单易行,所需设备、试剂容易获得,能耗低,对环境友好,符合可持续发展的理念;便于将纳米金的制备过程与生物功能化过程偶合,实现纳米金在生命分析中的应用;且纳米金的粒径与ph值呈现良好的线性关系,粒径可以精确控制,实际应用中可以根据具体需求,计算纳米金的粒径对应所需的ph值,通过调节反应溶液的ph值,获得精确粒径的纳米金,纳米金粒径的连续可调和精确控制,为纳米金在自组装、生命分析、纳米器件等研究领域中粒径的影响研究提供了基础,利于推动研究的发展和成果的产业化。
本发明功能化纳米金的制备方法可以在合成纳米金的基础上一步功能化,节约时间;且本发明制备的功能化纳米金肽包覆较好,与文献报道的分步制备产品的一致,具有很好的离子强度稳定性和ph稳定性,可以应用在生命体系中的蛋白分析等方面。
附图说明
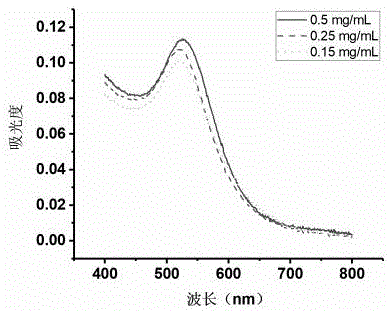
图1为不同酪氨酸浓度条件下合成纳米金的紫外-可见吸收光谱比较。
图2为不同温度条件下合成纳米金的紫外-可见吸收光谱比较。
图3为纳米金的spr吸收强度随反应时间的变化曲线。
图4为不同ph条件下合成的纳米金溶液的照片。
图5为ph10.0~12.0以及0.05mol/lnaoh条件下合成的纳米金的透射电子显微镜表征。
图6为ph10.0~12.0以及0.05mol/lnaoh条件下合成的纳米金的粒径与ph值关系曲线。
图7为一步肽功能化纳米金的bca方法表征结果。
图8中a)为肽-纳米金在不同盐浓度下的紫外-可见吸收光谱图,b)为对应的600nm处吸光度a600与520nm处吸光度a520比值对盐浓度的变化曲线。
图9中a)为肽-纳米金在不同ph条件下的紫外-可见吸收光谱图,b)为对应的600nm处吸光度a600与520nm处吸光度a520比值对ph值的变化曲线。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
以下实施例中,高分辨透射电镜采用的仪器是feitecnaig2f30,测试条件:加速电压300kv;
bca方法是指蛋白检测方法,检测步骤为:bca试剂盒(生工生物工程(上海)股份有限公司),选取酶标板上3个孔,各孔分别加入20μl一定浓度的纳米钯、肽对照样品和缓冲液空白,再加入200μlbca工作液,迅速混匀。在37℃水浴中保温30min,冷却至室温后,在酶标仪上测各孔的吸收光谱;
紫外-可见吸收光谱的测试方法:在酶标仪(tecaninfinitem200pro)上使用透明96孔板,波长扫描范围400~700nm。
实施例1纳米金合成
纳米金合成,其步骤如下:
(1)用浓度为0.05mol/l的氢氧化钠溶液(ph值为12.7)配置酪氨酸浓度为0.5mg/ml,用超纯水稀释氯金酸为2.94mmol/l;
(2)取1ml酪氨酸和0.5ml的氯金酸混匀(酪氨酸与氯金酸的体积比为2:1),37℃下反应120min,即可得到纳米金。
该合成步骤简单易行,所需设备、试剂容易获得,能耗低,对环境友好,符合可持续发展的理念。
实施例2纳米金合成
纳米金合成,其步骤如下:
(1)用浓度为0.05mol/l的氢氧化钠溶液(ph值为12.7)配置酪氨酸浓度为0.5mg/ml,用超纯水稀释氯金酸为2.94mmol/l;
(2)取0.6ml酪氨酸和1ml的氯金酸混匀(酪氨酸与氯金酸的体积比为0.6:1),37℃下反应120min,即可得到纳米金。
实施例3纳米金合成
纳米金合成,其步骤如下:
(1)用浓度为0.05mol/l的氢氧化钠溶液(ph值为12.7)配置酪氨酸浓度为0.5mg/ml,用超纯水稀释氯金酸为2.94mmol/l;
(2)取1.5ml酪氨酸和0.5ml的氯金酸混匀(酪氨酸与氯金酸的体积比为3:1),37℃下反应120min,即可得到纳米金。
实验发现,当酪氨酸与氯金酸的体积比为0.6~3:1时,在实验条件下均能制备出纳米金,效果较好;其中,当酪氨酸与氯金酸的体积比为2:1时,纳米金的合成重现性好,产率较高;而如果酪氨酸与氯金酸的体积比偏低时,则会造成实验效果重现性差,主要表现为产品纳米金的颜色存在明显批间差异;如果酪氨酸与氯金酸的体积比过高时,对纳米金的合成没有带来显著的影响,不会使纳米金的产率上升,也不会使产品纳米金的颜色出现变化,但相对过量的酪氨酸会造成资源浪费。
实施例4反应物浓度优化
1、实验步骤
纳米金合成,对反应物浓度优化,其步骤如下:
(1)用浓度为0.05mol/l的氢氧化钠溶液分别配置酪氨酸浓度为0.15、0.25、0.5mg/ml;
(2)用超纯水稀释氯金酸为2.94mmol/l;
(3)取1ml各浓度的酪氨酸和0.5ml的氯金酸混匀,37℃下反应2h。
2、实验结果
对产品进行紫外吸收强度测试,结果如图1所示。结果发现,随着酪氨酸浓度的增加,紫外-可见吸收光谱中520nm处spr吸收峰得到增强,表明随着酪氨酸浓度的增加,制备所得纳米金产率更高,同时质量更好。
结果表明,酪氨酸浓度在0.15~0.5mg/ml范围时,氯金酸浓度在2.94mmol/l皆可合成目标纳米金。但是,考虑到酪氨酸在水中的溶解度为0.45mg/ml,即使继续增加酪氨酸的浓度,制备所得的纳米金产率有限,而酪氨酸在碱性溶液中溶解度稍大,所以酪氨酸浓度为0.5mg/ml时为最优,在保证酪氨酸的溶解性,同时获得较好的纳米金。
实施例5反应温度优化
1、实验步骤
纳米金合成,对反应温度优化,其步骤如下:
(1)用浓度为0.05m的氢氧化钠溶液配置酪氨酸浓度为0.5mg/ml;
(2)用超纯水稀释氯金酸的浓度为2.94mmol/l;
(3)取1ml的酪氨酸和0.5ml的氯金酸,分别置于温度为25℃、30℃、37℃、41℃的条件下反应2h。
2、实验结果
测定生成的纳米金的紫外-可见吸收光谱如图2所示。结果表明,在温度25~41℃范围内可以生成较稳定的纳米金,且随着温度提高,纳米金的spr吸收峰越强。当温度达到37℃时,继续升高温度对纳米金的合成已没有显著影响。因此,37℃是反应的较优选择。
实施例6反应时间优化
1、实验步骤
纳米金合成,对反应时间优化,其步骤如下:
(1)用浓度为0.05m的氢氧化钠溶液配置酪氨酸浓度为0.5mg/ml;
(2)用超纯水稀释氯金酸的浓度为2.94mmol/l;
(3)取1ml的酪氨酸和0.5ml的氯金酸摇匀后在37℃反应;
(4)在反应过程中分别于30、60、90、120、150和180min时间点采集产物进行紫外-可见吸收光谱的测定。
2、实验结果
结果如图3所示。结果发现在反应30min时已开始生成纳米金,在30~120min内纳米金的spr吸收峰随时间逐渐增强。在120~180min紫外-可见吸收强度已经没有明显的变化,表明酪氨酸已经反应完全,因此,120min反应时间为较优时间。
实施例7纳米金粒径的控制
1、实验步骤
纳米金合成,通过ph值调控纳米金的粒径,其步骤如下:
(1)用ph为8.0~12.0的br缓冲溶液和0.05mol/lnaoh溶液(对应ph为12.7)配置酪氨酸浓度为0.5mg/ml;
(2)用超纯水稀释氯金酸的浓度为2.94mmol/l;
(3)取1ml用br缓冲溶液配置酪氨酸和0.5ml的氯金酸混合,于37℃反应120min,取1ml用0.05mol/lnaoh溶液配置酪氨酸和0.5ml的氯金酸混合,在4℃条件下反应10~14小时;
(5)将反应物后的混合溶液,离心纯化,并进行透射电子显微镜分析。
2、实验结果
结果如图4~图6所示,发现在不同ph条件下获得的纳米金粒径不同。如图6所示,随着溶液ph值的增加,粒径逐渐变小,而在ph10.0~12.7的范围内,纳米金的粒径与ph值呈现良好的线性关系,线性方程为y=111-7.58x,线性相关系数r2达0.996。据此,实际应用中可以根据具体需求,计算纳米金的粒径对应所需的ph值,通过调节反应溶液的ph值,获得15nm~35nm范围内精确粒径的纳米金,可实现纳米金粒径的调控。纳米金粒径的连续可调和精确控制,为纳米金在自组装、生命分析、纳米器件等研究领域中粒径的影响研究提供了基础,利于推动研究的发展和成果的产业化。
实施例8功能化纳米金的一步法合成
功能化纳米金的一步法合成,其步骤如下:
(1)用浓度为0.05mol/l的氢氧化钠溶液配置酪氨酸浓度为0.5mg/ml;
(2)用超纯水配制浓度为0.2mmol/l的五肽calnn和浓度为29.4mmol/l的氯金酸,将五肽calnn与氯金酸以9:1的比例混合成氯金酸-肽溶液;
(3)取1ml的酪氨酸和0.5ml的氯金酸-肽溶液混合,于37℃反应120min;
(4)将反应完全的溶液离心,随后用蒸馏水重复离心洗涤4次。所得到的肽功能化纳米金密封置于冰箱4℃保存。
实施例9功能化纳米金的一步法合成
功能化纳米金的一步法合成,其步骤如下:
(1)用浓度为0.05mol/l的氢氧化钠溶液配置酪氨酸浓度为0.5mg/ml;
(2)用超纯水配制浓度为2mmol/l的五肽calnn和浓度为29.4mmol/l的氯金酸,将五肽calnn与氯金酸以9:1的比例混合成氯金酸-肽溶液;
(3)取1ml的酪氨酸和0.5ml的氯金酸-肽溶液混合,于37℃反应120min。
(4)将反应完全的溶液离心,随后用蒸馏水重复离心洗涤4次;所得到的肽功能化纳米金密封置于冰箱4℃保存。
实施例10功能化纳米金的一步法合成
功能化纳米金的一步法合成,其步骤如下:
(1)用浓度为0.05mol/l的氢氧化钠溶液配置酪氨酸浓度为0.5mg/ml;
(2)用超纯水配制浓度为1mmol/l的五肽calnn和浓度为29.4mmol/l的氯金酸,将五肽calnn与氯金酸以8:1的比例混合成氯金酸-肽溶液;
(3)取1ml的酪氨酸和0.5ml的氯金酸-肽溶液混合,于37℃反应120min;
(4)将反应完全的溶液离心,随后用蒸馏水重复离心洗涤4次。所得到的肽功能化纳米金密封置于冰箱4℃保存。
实施例11功能化纳米金的一步法合成
功能化纳米金的一步法合成,其步骤如下:
(1)用浓度为0.05mol/l的氢氧化钠溶液配置酪氨酸浓度为0.5mg/ml;
(2)用超纯水配制浓度为1mmol/l的五肽calnn和浓度为29.4mmol/l的氯金酸,将五肽calnn与氯金酸以10:1的比例混合成氯金酸-肽溶液;
(3)取1ml的酪氨酸和0.5ml的氯金酸-肽溶液混合,于37℃反应120min;
(4)将反应完全的溶液离心,随后用蒸馏水重复离心洗涤4次。所得到的肽功能化纳米金密封置于冰箱4℃保存。
实施例12功能化纳米金的一步法合成
1、实验步骤
功能化纳米金的一步法合成,其步骤如下:
(1)用浓度为0.05mol/l的氢氧化钠溶液配置酪氨酸浓度为0.5mg/ml;
(2)用超纯水配制浓度为1mmol/l的五肽calnn和浓度为29.4mmol/l的氯金酸,将五肽calnn与氯金酸以9:1的比例混合成氯金酸-肽溶液;
(3)取1ml的酪氨酸和0.5ml的氯金酸-肽溶液混合,于37℃反应120min;
(4)将反应完全的溶液离心,随后用蒸馏水重复离心洗涤4次。所得到的肽功能化纳米金密封置于冰箱4℃保存。
2、实验结果
结果参见附图7~9。此步骤一步实现了纳米金的功能化。对合成产物进行表征,结果表明纳米金确被肽包覆,却其稳定性与文献报道的分步制备产品的一致。
(1)利用bca方法分析肽功能化纳米金的肽配体,结果如图7所示,从图7中可看出,以五肽calnn为阳性对照,利用bca方法可使溶液的紫外-可见吸收光谱发生变化,在564nm处出现最大吸收;对应地,本实施例所制备的纳米材料亦在564nm处出现与阳性对照一样的最大吸收峰,表明纳米材料表面确是包覆了配体calnn。
(2)进一步对本实施例制备的肽功能化纳米金进行测试,结果如图8、图9所示。从图8中a)图可见,肽-纳米金的紫外-可见吸收光谱在nacl浓度100~300mm的范围内没有发生变化,表明肽-纳米金保持良好的分散状态,具有很好的离子强度稳定性。当nacl浓度达到400mm,肽-纳米金的紫外-可见吸收光谱在600~700nm波长范围内吸光度增加,表明纳米金开始发生团聚。纳米金的稳定性可以a600/a520的变化较直观反映,结果如图8中b)图所示。
(3)同理,从图9可见,肽-纳米金具有良好的ph稳定性,在ph>5.0的条件下保持良好的分散性,直到ph=4.0时,开始出现轻微的团聚现象。由此,充分证明本发明方法可实现纳米金的一步肽功能化。
实施例13功能化纳米金的合成
1、功能化纳米金的合成,其步骤如下:
(1)将实施例1的纳米金颗粒与1mmol/l的五肽calnn溶液混合,得到混合溶液;
(2)将步骤(1)的混合溶液在4~25℃条件下反应2~14h,离心,洗涤,即可得到肽功能化纳米金。
肽功能化纳米金具有较高的稳定性和生物相容性,为肿瘤光热治疗等研究提供了理想的生物材料。此外,纳米金的肽功能化过程可通过添加一定比例的特殊功能化肽,简单地引入特殊功能化分子,丰富纳米金的功能性,拓展其应用,如:利用纳米金的超强猝灭能力,肽功能化过程中引入荧光基团和特殊酶的底物,可实现酶的体内和体外荧光测定;引入特殊的自组装分子,同时利用纳米金精确可调的粒径,为基于纳米金的纳米器件研究提供基础。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!