掺杂的镍酸盐材料的制作方法
本发明涉及新的掺杂的镍酸盐材料,涉及用于制备这样的掺杂的镍酸盐材料的方法,涉及包含这样的材料的电极,涉及这样的材料例如在储能装置中的用途。此外,本发明涉及使用包括这样的掺杂的镍酸盐材料的装置储存电荷的方法,和涉及包括这样的材料的可充电电池组。
发明背景
钠离子电池组在许多方面与现今通常使用的锂离子电池组是类似的;它们均为可重复使用的包括阳极(负极)、阴极(正极)和电解质材料的二次电池组,均能够储能,并且它们均通过类似的反应机制充电和放电。当钠离子(或锂离子)电池组充电时,Na+(或Li+)离子从阴极脱嵌(deintercalate)并嵌入阳极中。同时,电荷平衡电子从阴极穿过包括充电器的外电路并进入电池组的阳极。在放电过程中发生相同的过程,但是以相反的方向发生。
锂离子电池组技术在近年来得到许多关注,并为现今使用的大多数电子设备提供了优选的便携式电池组;然而,锂就来源而言不是廉价的金属,并且被认为对于大规模应用中的使用而言太昂贵。相比之下,钠离子电池组技术仍然处在其相对初期,但被视为有利的;钠比锂充足得多,并且一些研究者预测这将给未来提供更廉价和更持久的储能方式,特别是对于大规模应用如在电网上储能。然而,在钠离子电池组成为商业上的现实之前,还需要做很多工作。
已知具有通式AxMO2的金属氧化物(其中A表示一种或多种碱金属离子且M表示一种或多种金属离子,其中至少一种具有几种氧化态,例如过渡金属)以许多不同的层状结构结晶。这由C.Delmas等人在“层状氧化物的结构分类和性质(Structural Classification and Properties of the Layered Oxides)”,Physica 99B(1980)81-85中详细描述。总之,这些结构均由形成(MO2)n片的MO6边缘共享八面体构成。这些片以一个在另一个之上的方式堆叠并且被碱金属原子隔开,并且碱金属的精确位置将决定金属氧化物的整体结构被描述为八面体(O)、四面体(T)或棱柱形(P)。在由六边形片(hexagonal sheet)构成的晶格中,氧原子有三种可能的位置,通常称为A、B和C。正是其中这些片堆积在一起的顺序导致O、T和P环境。数字2或3还用于描述在垂直于分层的重复单元中的碱金属层的数量。例如,当层以顺序ABCABC堆积时,获得O3结构。这转化为在重复单元中的3个碱金属层,并且每种碱金属都在八面体环境中。这样的材料的特征在于碱金属离子为八面体取向,并且该结构的典型化合物为AxMO2(x≤1)。碱金属离子呈四面体取向的顺序ABAB将产生以A2MO2化合物为代表的T1结构。以ABBA顺序堆积片得到P2结构,其中一半的棱柱与MO6八面体共享边缘,而另一半共享面,典型的化合物为A≈0.7MO2。最后,以ABBCCA顺序堆积得到P3结构类型,其中所有棱柱与一个MO6八面体共享一个面,并且与下一个片的三个MO6八面体共享三条边缘。发现A≈0.5MO2化合物采用P3结构。将注意到存在于AxMO2材料中的碱金属的量对金属氧化物的整体结构有直接影响。
在过去十年中,许多工作者已经研究了具有P2结构的单相金属氧化物的电化学性质。例如,C.Delmas等人报导了P2-NaxCoO2的相转变和电化学行为,参见例如,J.Solid State Chem.,2004,177,2790-2802和Inorg.Chem.,2009,48,9671-9683。另外,Lu和Dahn,J.Electrochem.Soc.,2001,148,A710-715证实了在钠半电池中的P2-层状氧化物Na2/3[Ni1/3Mn2/3]O2可以可逆地交换Na粒子,然而,预期这些氧化物化合物(oxide compound)尤其是在C/100下在2.3–4.5V显示差的循环能力。
最近,Kim等人在Adv.Energy Mater.,2011,1,333-336中报导了在单相P2锂取代的化合物如Na1.0Li0.2Ni0.25Mn0.75O2中的锂的存在为循环期间的结构稳定性提供了一些改进,但这些化合物的可逆容量由于有限量(25%)的氧化还原活性二价Ni而仍然太低。最近在Y.Shirley Meng和D.H.Lee的另一篇论文Phys.Chem.Chem.Phys.,2013,15,3304中,报导了P2-Na2/3[Ni1/3Mn2/3]O2显示优异的循环和高速率能力,然而这些结果仅当材料在4.22V以下充电时才能实现;在4.22V以上,在循环期间由于从P2到O2的相转变而不能保持充电容量。
总之,以上讨论的金属氧化物特别是在宽范围内的充电电压下受到不良的循环稳定性的阻碍。因此,这些化合物在Na离子电池中的商业应用受到限制。
目前工作人员已经开发了新的化合物,其是能够提供特定容量性能而在循环时具有很少衰减或没有衰减的含掺杂的镍酸盐的材料(以下称为目标活性材料)。此外,理想地,已发现本发明的含掺杂的镍酸盐的材料在通常导致从P2到O2的相转变的电压条件下实现这些优异的结果;这是优于现有技术中描述的化合物的显著改进。因此,本发明的目标活性材料可以用于提供能够多次再充电而没有显著的充电容量损失的电极,优选地正电极。特别地,本发明的目标活性材料将提供用于钠离子电池或钠金属电池中的储能装置,例如电池组。
因此,本发明提供了含掺杂的镍酸盐的材料(目标活性材料),其具有以下通式:
Aa M1v M2w M3x M4y M5z O2-δ
其中
A包括一种或多种选自钠、锂和钾的碱金属;
M1为2+氧化态的镍,
M2包括一种或多种4+氧化态的金属,
M3包括一种或多种2+氧化态的金属,
M4包括一种或多种4+氧化态的金属,和
M5包括一种或多种3+氧化态的金属,
其中
0.4≤a<0.9,优选地0.5≤a<0.85,进一步优选地0.6≤a≤0.75,
0<v<0.5,优选地0<v≤0.45,和理想地0<v≤0.333,
w和y中至少一个>0,
x>0,
z≥0,
0≤δ≤0.1,
并且其中选择a、v、w、x、y和z以保持电中性。
优选地δ=0。
优选的含掺杂的镍酸盐的材料(目标活性材料)具有以下通式:
Aa M1v M2w M3x M4y M5z O2-δ
其中
A包括一种或多种选自钠、锂和钾的碱金属;
M1为2+氧化态的镍,
M2包括一种或多种4+氧化态的金属,
M3包括一种或多种2+氧化态的金属,
M4包括一种或多种4+氧化态的金属,和
M5包括一种或多种3+氧化态的金属,
其中
0.55<a<0.85,
0.25<v≤0.333,
w和y中至少一个>0,
x>0,
z≥0,
0≤δ≤0.1,
并且其中选择a、v、w、x、y和z以保持电中性。
优选地,碱金属A选自钠或其中钠为主要成分的混合碱金属。
在特别优选的目标活性材料中,v+w+x+y+z=1。
优选的目标活性材料包括:
Na0.67Ni0.3Mn0.6Mg0.033Ti0.067O2,
Na0.67Ni0.267Mn0.533Mg0.067Ti0.133O2,
Na0.67Ni0.283Mn0.567Mg0.05Ti0.1O2,
Na0.67Ni0.25Mn0.667Mg0.083O2,
Na0.7Ni0.240Mn0.533Mg0.110Ti0.117O2,
Na0.6Ni0.240Mn0.533Mg0.060Ti0.167O2,
Na0.67Ni0.240Mn0.533Mg0.093Ti0.133O2,
Na0.55Ni0.240Mn0.533Mg0.035Ti0.192O2,
Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Fe0.100O2和
Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Al0.100O2。
金属M2和M4可以是相同或不同的4+氧化态的金属。此外,M2和M4可以彼此互换。当M2=M4时,则该结构可以书写为:
Aa M1V M2W M3X M4Y M5Z O2-δ,
或
Aa M1V M2W+Y M3X M5Z O2-δ,
或
Aa M1V M3X M4Y+W M5Z O2-δ,
并且等式的所有这些形式被视为等价的。
优选地,本发明的含掺杂的镍酸盐的材料(目标活性材料)仅包含钠作为选择的碱金属。
此外,在进一步优选的含掺杂的镍酸盐的目标活性材料中,M2包括一种或多种选自锰、钛和锆的4+氧化态的金属;M3包括一种或多种选自镁、钙、铜、锌和钴的2+氧化态的金属;M4包括一种或多种选自锰、钛和锆的4+氧化态的金属;和M5包括一种或多种选自铝、铁、钴、钼、铬、钒、钪和钇的3+氧化态的金属。
包括层状P2-型结构的目标活性材料是特别有利的。
目标活性材料可以通过任何已知的和/或便利的方法制备。例如,可以(例如,在炉中)加热一种或多种用于目标活性材料的前体材料以促进固态反应过程。这样的方法可以在空气的存在下便利地进行,但也可以在惰性气氛下进行。理想地,一种或多种用于目标活性材料的前体材料包含一种或多种选自如上所定义的A、M1、M2、M3、M4和M5的金属。特别优选地,这些一种或多种金属以对应于目标活性材料中存在的相应的一种或多种金属的量的化学计量比存在于前体材料中。
本发明的含掺杂的镍酸盐的材料(目标活性材料)适用于许多不同的应用,包括钠离子和/或锂离子和/或钾离子电池,其可以广泛用于例如储能装置中,如电池组、可充电电池组、电化学装置和电致变色器件中。
有利地,一种或多种目标活性材料可以用于电极,优选地正电极(阴极),并且进一步优选地与对电极和一种或多种电解质材料联合使用。电解质材料可以是任何常规或已知的材料,并且可包括(多种)水性电解质或(多种)非水性电解质。
也可以使用离子交换方法将钠离子衍生物转化为混合的锂离子/钠离子材料。
实现Na到Li离子交换的典型方式包括:
1.将钠离子材料与含锂材料例如LiNO3混合,加热至LiNO3的熔点(264℃)以上,冷却然后洗涤以除去过量的LiNO3和副反应产物。
2.使用锂盐的水溶液,例如1M LiCl的水溶液处理Na离子材料;和
3.使用锂盐的非水性溶液,例如LiBr的一种或多种脂肪族醇如己醇、丙醇等的溶液处理Na离子材料。
附图简述
现在将参照以下附图描述本发明,其中:
图1(A)是实施例1(比较例)中使用的已知化合物P2-Na0.67Ni0.33Mn0.67O2的XRD图;
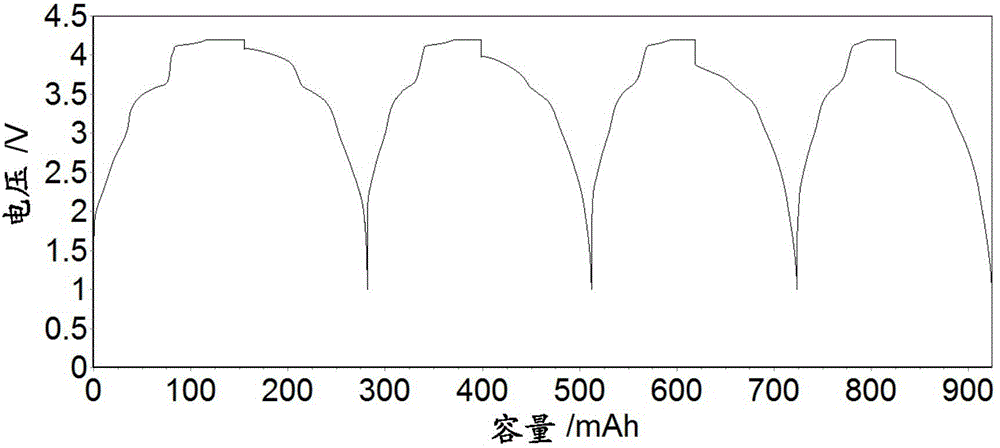
图1(B)显示硬碳//Na0.67Ni0.33Mn0.67O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g]);
图1(C)显示在0.5M NaClO4中在30℃下在1.0-4.2V的电压范围内,包含硬碳(Carbotron P(J)Kureha)和P2-Na0.67Ni0.33Mn0.67O2的全Na离子电池的恒定电流循环(CC/CV),其中碳酸丙烯酯(PC)和玻璃纤维滤纸(Whatman Grade GF/A)用作隔膜(separator);
图2(A)是实施例2中制备的具有式P2-Na0.67Ni0.3Mn0.6Mg0.033Ti0.067O2的本发明的P2-目标活性材料的XRD图;
图2(B)显示了硬碳//P2-Na0.67Ni0.30Mn0.60Mg0.033Ti0.067O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g]);
图2(C)显示在0.5M NaClO4、碳酸丙烯酯(PC)和GF/A中在30℃下在1.0-4.2V的电压范围内,包含硬碳(Carbotron P(J)Kureha)和P2-Na0.67Ni0.3Mn0.6Mg0.033Ti0.067O2的全Na离子电池的恒定电流循环(CC/CV);
图3(A)是实施例3中制备的具有式P2-Na0.67Ni0.267Mn0.533Mg0.067Ti0.133O2的本发明的P2-目标活性材料的XRD图;
图3(B)显示硬碳//P2-Na0.67Ni0.267Mn0.533Mg0.067Ti0.133O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g]);
图3(C)显示在0.5M NaClO4、碳酸丙烯酯(PC)和GF/A中在30℃下在1.0-4.2V的电压范围内,包含硬碳(Carbotron P(J)Kureha)和P2-Na0.67Ni0.267Mn0.533Mg0.067Ti0.133O2的全Na离子电池的恒定电流循环(CC/CV);
图4(A)是实施例4中制备的具有式P2-Na0.67Ni0.25Mn0.667Mg0.083O2的本发明的P2-目标活性材料的XRD图;
图4(B)显示硬碳//P2-Na0.67Ni0.25Mn0.667Mg0.083O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g]);
图4(C)显示在0.5M NaClO4、碳酸丙烯酯(PC)和GF/A中在30℃下在1.0-4.2V的电压范围内,包含硬碳(Carbotron P(J)Kureha)和P2-Na0.67Ni0.25Mn0.667Mg0.083O2的全Na离子电池的恒定电流循环(CC/CV);
图5(A)是实施例5中制备的具有式P2-Na0.67Ni0.283Mn0.567Mg0.05Ti0.10O2的本发明的P2-目标活性材料的XRD图;
图5(B)显示硬碳//P2-Na0.67Ni0.283Mn0.567Mg0.05Ti0.10O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g]);
图5(C)显示在0.5M NaClO4、碳酸丙烯酯(PC)和GF/A中在30℃下在1.0-4.2V的电压范围内,包含硬碳(Carbotron P(J)Kureha)和P2-Na0.67Ni0.283Mn0.567Mg0.05Ti0.1O2的全Na离子电池的恒定电流循环(CC/CV);
图6(A)是实施例6中制备的具有式P2-Na0.70Ni0.240Mn0.533Mg0.110Ti0.117O2的本发明的P2-目标活性材料的XRD图;
图6(B)显示硬碳//P2-Na0.70Ni0.240Mn0.533Mg0.110Ti0.117O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g]);
图6(C)显示在0.5M NaPF6的碳酸亚乙酯/碳酸二乙酯/碳酸丙烯酯溶液中在30℃下在1.0-4.3V的电压范围内,包含硬碳(Carbotron P(J)Kureha)和P2-Na0.70Ni0.240Mn0.533Mg0.110Ti0.117O2的全Na离子电池的恒定电流循环寿命曲线(放电阴极比容量对循环数);
图7(A)是实施例7中制备的具有式P2-Na0.60Ni0.240Mn0.533Mg0.060Ti0.167O2的本发明的P2-目标活性材料的XRD图;
图7(B)显示硬碳//P2-Na0.60Ni0.240Mn0.533Mg0.060Ti0.167O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g]);
图7(C)显示在0.5M NaPF6的碳酸亚乙酯/碳酸二乙酯/碳酸丙烯酯溶液中在30℃下在1.0-4.3V的电压范围内,包含硬碳(Carbotron P(J)Kureha)和P2-Na0.60Ni0.240Mn0.533Mg0.060Ti0.167O2的全Na离子电池的恒定电流循环寿命曲线(放电阴极比容量对循环数);
图8(A)是实施例8中制备的具有式P2-Na0.67Ni0.240Mn0.533Mg0.093Ti0.133O2的本发明的P2-目标活性材料的XRD图;
图8(B)显示硬碳//P2-Na0.67Ni0.240Mn0.533Mg0.093Ti0.133O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g]);
图8(C)显示在0.5M NaPF6的碳酸亚乙酯/碳酸二乙酯/碳酸丙烯酯溶液中在30℃下在1.0-4.3V的电压范围内,包含硬碳(Carbotron P(J)Kureha)和P2-Na0.67Ni0.24Mn0.533Mg0.093Ti0.133O2的全Na离子电池的恒定电流循环寿命曲线(放电阴极比容量对循环数);
图9(A)是实施例9中制备的具有式P2-Na0.55Ni0.240Mn0.533Mg0.035Ti0.192O2的本发明的P2-目标活性材料的XRD图;
图9(B)显示硬碳//P2-Na0.55Ni0.240Mn0.533Mg0.035Ti0.192O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g]);
图9(C)显示在0.5M NaPF6的碳酸亚乙酯/碳酸二乙酯/碳酸丙烯酯溶液中在30℃下在1.0-4.3V的电压范围内,包含硬碳(Carbotron P(J)Kureha)和P2-Na0.55Ni0.240Mn0.533Mg0.035Ti0.192O2的全Na离子电池的恒定电流循环寿命曲线(放电阴极比容量对循环数);
图10(A)是实施例10中制备的具有式P2-Na0.67Ni0.240Mn-0.533Mg0.043Ti0.083Fe0.100O2的本发明的P2-目标活性材料的XRD图;
图10(B)显示硬碳//P2-Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Fe0.100O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g]);
图10(C)显示在0.5M NaPF6的碳酸亚乙酯/碳酸二乙酯/碳酸丙烯酯溶液中在30℃下在1.0-4.3V的电压范围内,包含硬碳(Carbotron P(J)Kureha)和式P2-Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Fe0.100O2的目标活性组合物的全Na离子电池的恒定电流循环寿命曲线(放电阴极比容量对循环数);
图11(A)是实施例11中制备的具有式P2-Na0.67Ni0.240Mn-0.533Mg0.043Ti0.083Al0.100O2的本发明的P2-目标活性材料的XRD图;
图11(B)显示硬碳//P2-Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Al0.100O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g]);
图11(C)显示在0.5M NaPF6的碳酸亚乙酯/碳酸二乙酯/碳酸丙烯酯溶液中在30℃下在1.0-4.3V的电压范围内,包含硬碳(Carbotron P(J)Kureha)和具有式P2-Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Al0.100O2的本发明的P2-目标活性组合物的全Na离子电池的恒定电流循环寿命曲线(放电阴极比容量对循环数)。
详述
任意便利的方法可以用于制备本发明的目标活性材料,并且便利的化学反应可以使用以下通用方法:
通用方法:
1)将起始材料(即,目标活性材料的前体)以针对具体目标活性材料的正确的化学计量比密切混合在一起,并压成颗粒(pellet);
2)在包含例如环境空气或惰性气氛(例如,氩气、氮气)(如果需要,气体可以是流动的)的适合的气氛下,在单一温度下或在400℃至1500℃的温度范围内在炉中加热所得到的混合物,直到形成反应产物;和任选地
3)使产物冷却,然后将其研磨成粉末。
下表1列出了用于制备已知的(对比)组合物(实施例1)和本发明的目标活性材料(实施例2至11)的起始材料和加热条件。
表1
使用XRD的产物分析
使用Siemens D5000粉末衍射仪进行通过X射线衍射技术的分析,以证实希望的目标材料已被制备,确立产物材料的相纯度,并且确定存在的杂质类型。能够由该信息确定晶胞的晶格参数。
用于分析材料的通用XRD操作条件如下:
狭缝尺寸:1mm,1mm,0.1mm
范围:2θ=5°-60°
速度:1.0秒/步
增量:0.025°
电化学结果
使用具有硬碳阳极的Na离子测试电池测试目标材料。电池可以使用以下过程制备:
包含活性材料的Na离子电化学测试电池如下构建:
制备硬碳Na离子电池的通用过程
通过溶剂浇铸活性材料、导电碳、粘合剂和溶剂的浆液来制备正极。使用的导电碳是Super P(Timcal)。PVdF用作粘合剂,并且N-甲基-2-吡咯烷酮(NMP)用作溶剂。然后将浆液浇铸在铝箔上并加热,直到大多数溶剂蒸发并形成电极膜。然后在约120℃下在动态真空下干燥电极。电极膜含有以下组分,以重量百分比表示:88%的活性材料、6%的Super P碳和6%的PVdF粘合剂。
通过溶剂浇铸硬碳活性材料(Carbotron P/J,由Kureha供应)、导电碳、粘合剂和溶剂的浆液来制备负极。使用的导电碳是Super P(Timcal)。PVdF用作粘合剂,并且N-甲基-2-吡咯烷酮(NMP)用作溶剂。然后将浆液浇铸在铝箔上并加热,直到大多数溶剂蒸发并形成电极膜。然后在约120℃下在动态真空下进一步干燥电极。电极膜含有以下组分,以重量百分比表示:89%的活性材料、2%的Super P碳和9%的PVdF粘合剂。
电池测试
使用恒定电流循环技术,如下测试电池。
在预设的电压限度之间、在给定的电流密度下循环电池。使用来自Maccor Inc.(Tulsa,OK,USA)的市售的电池组循环器(cycler)。充电时,从阴极活性材料提取碱离子。在放电过程中,碱离子重新嵌入到阴极活性材料中。
结果讨论
实施例1:P2-Na0.67Ni0.33Mn0.67O2
图1(A)显示已知材料Na0.67Ni0.33Mn0.67O2(样品编号X1657)的X射线衍射图。该图显示该材料符合层状P2-型结构。
参照图1(B)–(C):
图1(B)至1(C)中显示的数据来自Na离子电池(电池号311044)中的P2-Na0.67Ni0.33Mn0.67O2阴极活性材料的恒定电流循环数据,其中该阴极材料与硬碳(Carbotron P(J))阳极材料偶联。使用的电解质为0.5M NaClO4的碳酸丙烯酯(PC)溶液。在1.00至4.20V的电压限度之间、在0.2mA/cm2的近似电流密度下收集恒定电流数据。为了确保Na离子电池完全充电,在恒定电流充电过程结束时,将电池恒电势地保持在4.2V下,直到电流密度降至恒定电流值的10%。测试在30℃下进行。
在电池充电过程期间,从阴极活性材料提取钠离子,并嵌入硬碳阳极中。在随后的放电过程期间,从硬碳提取钠离子并重新嵌入阴极活性材料中。
图1(B)显示硬碳//Na0.67Ni0.33Mn0.67O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g])。这些数据显示电压滞后的水平(即在充电和放电过程之间的电压差)较大,表明在该阴极材料中的Na离子提取-嵌入反应中的相对较差的动力学可逆性。
图1(C)显示硬碳//P2-Na0.67Ni0.33Mn0.67O2电池的恒定电流循环寿命曲线,即放电阴极比容量[mAh/g]和循环数之间的关系。对于循环1,阴极的放电比容量为约127mAh/g。对于循环20,阴极的放电比容量为约61mAh/g。这表示在20个循环中的容量衰减为约52%,或每个循环平均2.6%。测试中的阴极材料明显显示相对差的容量保持行为。
实施例2:P2-Na0.67Ni0.3Mn0.6Mg0.033Ti0.067O2
图2(A)显示Na0.67Ni0.3Mn0.6Mg0.033Ti0.067O2(样品编号X1659)的X射线衍射图。该图显示该样品符合层状P2-型结构。
参照图2(B)–(C):
图2(B)至(C)中显示的数据来自Na离子电池(电池号311051)中的P2-Na0.67Ni0.30Mn0.60Mg0.033Ti0.067O2阴极活性材料的恒定电流循环数据,其中该阴极材料与硬碳(Carbotron P(J))阳极材料偶联。使用的电解质为0.5M NaClO4的碳酸丙烯酯(PC)溶液。在1.00至4.20V的电压限度之间、在0.2mA/cm2的近似电流密度下收集恒定电流数据。为了确保Na离子电池完全充电,在恒定电流充电过程结束时,将电池恒电势地保持在4.2V下,直到电流密度降至恒定电流值的10%。测试在30℃下进行。
在电池充电过程期间,从阴极活性材料提取钠离子,并嵌入硬碳阳极中。在随后的放电过程期间,从硬碳提取钠离子并重新嵌入阴极活性材料中。
图2(B)显示硬碳//P2-Na0.67Ni0.30Mn0.60Mg0.033Ti0.067O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g])。这些数据显示电压滞后的水平(即在充电和放电过程之间的电压差)较小,表明Na离子提取-嵌入反应的优异的动力学可逆性。此外,充电/放电电压曲线的一般对称性质证实了提取-嵌入反应的优异的可逆性。
图2(C)显示硬碳//P2-Na0.67Ni0.30Mn0.60Mg0.033Ti0.067O2电池的恒定电流循环寿命曲线,即放电阴极比容量[mAh/g]和循环数之间的关系。对于循环1,阴极的放电比容量为约117mAh/g。对于循环30,阴极的放电比容量为约106mAh/g。这表示在30个循环中的容量衰减为约9.4%,或每个循环平均0.3%。测试中的阴极材料明显显示优异的容量保持行为。
实施例3:P2-Na0.67Ni0.267Mn0.533Mg0.067Ti0.133O2
图3(A)显示Na0.67Ni0.267Mn0.533Mg0.067Ti0.133O2(样品编号X1663)的X射线衍射图。该图显示该样品符合层状P2-型结构。
参照图3(B)–(C):
图3(B)至(C)中显示的数据来自Na离子电池(电池号311058)中的P2-Na0.67Ni0.267Mn0.533Mg0.067Ti0.133O2阴极活性材料的恒定电流循环数据,其中该阴极材料与硬碳(Carbotron P(J))阳极材料偶联。使用的电解质为0.5M NaClO4的碳酸丙烯酯(PC)溶液。在1.00至4.20V的电压限度之间、在0.2mA/cm2的近似电流密度下收集恒定电流数据。为了确保Na离子电池完全充电,在恒定电流充电过程结束时,将电池恒电势地保持在4.2V下,直到电流密度降至恒定电流值的10%。测试在30℃下进行。
在电池充电过程期间,从阴极活性材料提取钠离子,并嵌入硬碳阳极中。在随后的放电过程期间,从硬碳提取钠离子并重新嵌入阴极活性材料中。
图3(B)显示硬碳//P2-Na0.67Ni0.267Mn0.533Mg0.067Ti0.133O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g])。这些数据显示电压滞后的水平(即在充电和放电过程之间的电压差)较小,表明Na离子提取-嵌入反应的优异的动力学可逆性。此外,充电/放电电压曲线的一般对称性质证实了提取-嵌入反应的优异的可逆性。
图3(C)显示硬碳//P2-Na0.67Ni0.267Mn0.533Mg0.067Ti0.133O2电池的恒定电流循环寿命曲线,即放电阴极比容量[mAh/g]和循环数之间的关系。对于循环1,阴极的放电比容量为约105mAh/g。对于循环30,阴极的放电比容量为约101mAh/g。这表示在30个循环中的容量衰减为约3.8%,或每个循环平均0.13%。测试中的阴极材料明显显示优异的容量保持行为。
实施例4:P2-Na0.67Ni0.25Mn0.667Mg0.083O2
图4(A)显示Na0.67Ni0.25Mn0.667Mg0.083O2(样品编号X1684)的X射线衍射图。该图显示该样品符合层状P2-型结构。
参照图4(B)–(C):
图4(B)至(C)中显示的数据来自Na离子电池(电池号312020)中的P2-Na0.67Ni0.25Mn0.667Mg0.083O2阴极活性材料的恒定电流循环数据,其中该阴极材料与硬碳(Carbotron P(J))阳极材料偶联。使用的电解质为0.5M NaClO4的碳酸丙烯酯(PC)溶液。在1.00至4.20V的电压限度之间、在0.2mA/cm2的近似电流密度下收集恒定电流数据。为了确保Na离子电池完全充电,在恒定电流充电过程结束时,将电池恒电势地保持在4.2V下,直到电流密度降至恒定电流值的10%。测试在30℃下进行。
在电池充电过程期间,从阴极活性材料提取钠离子,并嵌入硬碳阳极中。在随后的放电过程期间,从硬碳提取钠离子并重新嵌入阴极活性材料中。
图4(B)显示硬碳//P2-Na0.67Ni0.25Mn0.667Mg0.083O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g])。这些数据显示电压滞后的水平(即在充电和放电过程之间的电压差)较小,表明Na离子提取-嵌入反应的优异的动力学可逆性。此外,充电/放电电压曲线的一般对称性质证实了提取-嵌入反应的优异的可逆性。
图4(C)显示硬碳//P2-Na0.67Ni0.25Mn0.667Mg0.083O2电池的恒定电流循环寿命曲线,即放电阴极比容量[mAh/g]和循环数之间的关系。对于循环1,阴极的放电比容量为约96mAh/g。对于循环30,阴极的放电比容量为约95mAh/g。这表示在30个循环中的容量衰减为约1.0%,或每个循环平均0.03%。测试中的阴极材料明显显示优异的容量保持行为。
实施例5:P2-Na0.67Ni0.283Mn0.567Mg0.05Ti0.1O2
图5(A)显示Na0.67Ni0.283Mn0.567Mg0.05Ti0.1O2(样品编号X1713)的X射线衍射图。该图显示该样品符合层状P2-型结构。
参照图5(B)–(C):
图5(B)至(C)中显示的数据来自Na离子电池(电池号401018)中的P2-Na0.67Ni0.283Mn0.567Mg0.05Ti0.10O2阴极活性材料的恒定电流循环数据,其中该阴极材料与硬碳(Carbotron P(J))阳极材料偶联。使用的电解质为0.5M NaClO4的碳酸丙烯酯(PC)溶液。在1.00至4.20V的电压限度之间、在0.2mA/cm2的近似电流密度下收集恒定电流数据。为了确保Na离子电池完全充电,在恒定电流充电过程结束时,将电池恒电势地保持在4.2V下,直到电流密度降至恒定电流值的10%。测试在30℃下进行。
在电池充电过程期间,从阴极活性材料提取钠离子,并嵌入硬碳阳极中。在随后的放电过程期间,从硬碳提取钠离子并重新嵌入阴极活性材料中。
图5(B)显示硬碳//P2-Na0.67Ni0.283Mn0.567Mg0.05Ti0.10O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g])。这些数据显示电压滞后的水平(即在充电和放电过程之间的电压差)较小,表明Na离子提取-嵌入反应的优异的动力学可逆性。此外,充电/放电电压曲线的一般对称性质证实了提取-嵌入反应的优异的可逆性。
图5(C)显示硬碳//P2-Na0.67Ni0.283Mn0.567Mg0.05Ti0.10O2电池的恒定电流循环寿命曲线,即放电阴极比容量[mAh/g]和循环数之间的关系。对于循环1,阴极的放电比容量为约97mAh/g。对于循环30,阴极的放电比容量为约92mAh/g。这表示在30个循环中的容量衰减为约5.2%,或每个循环平均0.17%。测试中的阴极材料明显显示优异的容量保持行为。
实施例6:P2-Na0.7Ni0.240Mn0.533Mg0.110Ti0.117O2
图6(A)显示Na0.7Ni0.24Mn0.533Mg0.110Ti0.117O2(样品编号X1919)的X射线衍射图。该图显示该样品符合层状P2-型结构。
参照图6(B)–(C):
图6(B)至(C)中显示的数据来自Na离子电池(电池号410001)中的P2-Na0.70Ni0.240Mn0.533Mg0.110Ti0.117O2阴极活性材料的恒定电流循环数据,其中该阴极材料与硬碳(Carbotron P(J))阳极材料偶联。使用的电解质为0.5M NaPF6的碳酸亚乙酯/碳酸二乙酯/碳酸丙烯酯溶液。在1.00至4.30V的电压限度之间、在0.2mA/cm2的近似电流密度下收集恒定电流数据。为了确保Na离子电池完全充电,在恒定电流充电过程结束时,将电池恒电势地保持在4.3V下,直到电流密度降至恒定电流值的10%。测试在30℃下进行。
在电池充电过程期间,从阴极活性材料提取钠离子,并嵌入硬碳阳极中。在随后的放电过程期间,从硬碳提取钠离子并重新嵌入阴极活性材料中。
图6(B)显示硬碳//P2-Na0.70Ni0.240Mn0.533Mg0.110Ti0.117O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g])。这些数据显示电压滞后的水平(即在充电和放电过程之间的电压差)较小,表明在该阴极材料中的Na离子提取-嵌入反应的优异的动力学可逆性。
图6(C)显示硬碳//P2-Na0.70Ni0.240Mn0.533Mg0.110Ti0.117O2电池的恒定电流循环寿命曲线,即放电阴极比容量[mAh/g]和循环数之间的关系。对于循环1,阴极的放电比容量为约108mAh/g。对于循环6,阴极的放电比容量为约108mAh/g。这表示在4个循环中的容量衰减为约0%。测试中的阴极材料明显显示优异的容量保持行为。
实施例7:P2-Na0.60Ni0.240Mn0.533Mg0.060Ti0.167O2
图7(A)显示Na0.6Ni0.24Mn0.533Mg0.060Ti0.167O2(样品编号X1921)的X射线衍射图。该图显示该样品符合层状P2-型结构。
参照图7(B)–(C):
图7(B)至(C)中显示的数据来自Na离子电池(电池号410003)中的P2-Na0.60Ni0.240Mn0.533Mg0.060Ti0.167O2阴极活性材料的恒定电流循环数据,其中该阴极材料与硬碳(Carbotron P(J))阳极材料偶联。使用的电解质为0.5M NaPF6的碳酸亚乙酯/碳酸二乙酯/碳酸丙烯酯溶液。在1.00至4.30V的电压限度之间、在0.2mA/cm2的近似电流密度下收集恒定电流数据。为了确保Na离子电池完全充电,在恒定电流充电过程结束时,将电池恒电势地保持在4.3V下,直到电流密度降至恒定电流值的10%。测试在30℃下进行。
在电池充电过程期间,从阴极活性材料提取钠离子,并嵌入硬碳阳极中。在随后的放电过程期间,从硬碳提取钠离子并重新嵌入阴极活性材料中。
图7(B)显示硬碳//P2-Na0.60Ni0.240Mn0.533Mg0.060Ti0.167O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g])。这些数据显示电压滞后的水平(即在充电和放电过程之间的电压差)较小,表明在该阴极材料中的Na离子提取-嵌入反应的优异的动力学可逆性。
图7(C)显示硬碳//P2-Na0.60Ni0.240Mn0.533Mg0.060Ti0.167O2电池的恒定电流循环寿命曲线,即放电阴极比容量[mAh/g]和循环数之间的关系。对于循环1,阴极的放电比容量为约94mAh/g。对于循环7,阴极的放电比容量为约91mAh/g。这表示在7个循环中的容量衰减为约3%。测试中的阴极材料明显显示良好的容量保持行为。
实施例8:P2-Na0.67Ni0.240Mn0.533Mg0.093Ti0.133O2
图8(A)显示Na0.67Ni0.240Mn0.533Mg0.093Ti0.133O2(样品编号X1922)的X射线衍射图。该图显示该样品符合层状P2-型结构。
参照图8(B)–(C):
图8(B)至(C)中显示的数据来自Na离子电池(电池号410004)中的P2-Na0.67Ni0.240Mn0.533Mg0.093Ti0.133O2阴极活性材料的恒定电流循环数据,其中该阴极材料与硬碳(Carbotron P(J))阳极材料偶联。使用的电解质为0.5M NaPF6的碳酸亚乙酯/碳酸二乙酯/碳酸丙烯酯溶液。在1.00至4.30V的电压限度之间、在0.2mA/cm2的近似电流密度下收集恒定电流数据。为了确保Na离子电池完全充电,在恒定电流充电过程结束时,将电池恒电势地保持在4.3V下,直到电流密度降至恒定电流值的10%。测试在30℃下进行。
在电池充电过程期间,从阴极活性材料提取钠离子,并嵌入硬碳阳极中。在随后的放电过程期间,从硬碳提取钠离子并重新嵌入阴极活性材料中。
图8(B)显示硬碳//P2-Na0.67Ni0.240Mn0.533Mg0.093Ti0.133O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g])。这些数据显示电压滞后的水平(即在充电和放电过程之间的电压差)较小,证实了在该阴极材料中的Na离子提取-嵌入反应的优异的动力学可逆性。
图8(C)显示硬碳//P2-Na0.67Ni0.240Mn0.533Mg0.093Ti0.133O2电池的恒定电流循环寿命曲线,即放电阴极比容量[mAh/g]和循环数之间的关系。对于循环1,阴极的放电比容量为约100mAh/g。对于循环5,阴极的放电比容量为约99mAh/g。这表示在5个循环中的容量衰减为约1%。测试中的阴极材料明显显示优异的容量保持行为。
实施例9:P2-Na0.55Ni0.240Mn0.533Mg0.035Ti0.192O2
图9(A)显示Na0.55Ni0.240Mn0.533Mg0.035Ti0.192O2(样品编号X1923)的X射线衍射图。该图显示该样品符合层状P2-型结构。
参照图9(B)–(C):
图9(B)至(C)中显示的数据来自Na离子电池(电池号410005)中的P2-Na0.55Ni0.240Mn0.533Mg0.035Ti0.192O2阴极活性材料的恒定电流循环数据,其中该阴极材料与硬碳(Carbotron P(J))阳极材料偶联。使用的电解质为0.5M NaPF6的碳酸亚乙酯/碳酸二乙酯/碳酸丙烯酯溶液。在1.00至4.30V的电压限度之间、在0.2mA/cm2的近似电流密度下收集恒定电流数据。为了确保Na离子电池完全充电,在恒定电流充电过程结束时,将电池恒电势地保持在4.3V下,直到电流密度降至恒定电流值的10%。测试在30℃下进行。
在电池充电过程期间,从阴极活性材料提取钠离子,并嵌入硬碳阳极中。在随后的放电过程期间,从硬碳提取钠离子并重新嵌入阴极活性材料中。
图9(B)显示硬碳//P2-Na0.55Ni0.240Mn0.533Mg0.035Ti0.192O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g])。这些数据显示电压滞后的水平(即在充电和放电过程之间的电压差)较小,表明在该阴极材料中的Na离子提取-嵌入反应的优异的动力学可逆性。
图9(C)显示硬碳//P2-Na0.55Ni0.240Mn0.533Mg0.035Ti0.192O2电池的恒定电流循环寿命曲线,即放电阴极比容量[mAh/g]和循环数之间的关系。对于循环1,阴极的放电比容量为约93mAh/g。对于循环4,阴极的放电比容量为约89mAh/g。这表示在4个循环中的容量衰减为约4%。测试中的阴极材料显示合理的容量保持行为。
实施例10:P2-Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Fe0.1O2
图10(A)显示Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Fe0.1O2(样品编号X1926)的X射线衍射图。该图显示该样品符合层状P2-型结构。
参照图10(B)–(C):
图10(B)至(C)中显示的数据来自Na离子电池(电池号410006)中的P2-Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Fe0.1O2阴极活性材料的恒定电流循环数据,其中该阴极材料与硬碳(Carbotron P(J))阳极材料偶联。使用的电解质为0.5M NaPF6的碳酸亚乙酯/碳酸二乙酯/碳酸丙烯酯溶液。在1.00至4.30V的电压限度之间、在0.2mA/cm2的近似电流密度下收集恒定电流数据。为了确保Na离子电池完全充电,在恒定电流充电过程结束时,将电池恒电势地保持在4.3V下,直到电流密度降至恒定电流值的10%。测试在30℃下进行。
在电池充电过程期间,从阴极活性材料提取钠离子,并嵌入硬碳阳极中。在随后的放电过程期间,从硬碳提取钠离子并重新嵌入阴极活性材料中。
图10(B)显示硬碳//P2-Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Fe0.1O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g])。这些数据显示电压滞后的水平(即在充电和放电过程之间的电压差)较小,表明在该阴极材料中的Na离子提取-嵌入反应的优异的动力学可逆性。
图10(C)显示硬碳//P2-Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Fe0.1O2电池的恒定电流循环寿命曲线,即放电阴极比容量[mAh/g]和循环数之间的关系。对于循环1,阴极的放电比容量为约101mAh/g。对于循环3,阴极的放电比容量为约97mAh/g。这表示在3个循环中的容量衰减为约4%。测试中的阴极材料显示合理的容量保持行为。
实施例11:P2-Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Al0.1O2
图11(A)显示Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Al0.1O2(样品编号X1927)的X射线衍射图。该图显示该样品符合层状P2-型结构。
参照图11(B)–(C):
图11(B)至(C)中显示的数据来自Na离子电池(电池号410007)中的P2-Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Al0.1O2阴极活性材料的恒定电流循环数据,其中该阴极材料与硬碳(Carbotron P(J))阳极材料偶联。使用的电解质为0.5M NaPF6的碳酸亚乙酯/碳酸二乙酯/碳酸丙烯酯溶液。在1.00至4.30V的电压限度之间、在0.2mA/cm2的近似电流密度下收集恒定电流数据。为了确保Na离子电池完全充电,在恒定电流充电过程结束时,将电池恒电势地保持在4.3V下,直到电流密度降至恒定电流值的10%。测试在30℃下进行。
在电池充电过程期间,从阴极活性材料提取钠离子,并嵌入硬碳阳极中。在随后的放电过程期间,从硬碳提取钠离子并重新嵌入阴极活性材料中。
图11(B)显示硬碳//P2-Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Al0.1O2电池的前四个充电/放电循环的电池电压曲线(即Na离子电池电压[V]对累积阴极比容量[mAh/g])。这些数据显示电压滞后的水平(即在充电和放电过程之间的电压差)较小,表明在该阴极材料中的Na离子提取-嵌入反应的优异的动力学可逆性。
图11(C)显示硬碳//P2-Na0.67Ni0.240Mn0.533Mg0.043Ti0.083Al0.1O2电池的恒定电流循环寿命曲线,即放电阴极比容量[mAh/g]和循环数之间的关系。对于循环1,阴极的放电比容量为约101mAh/g。对于循环3,阴极的放电比容量为约97mAh/g。这表示在3个循环中的容量衰减为约4%。测试中的阴极材料显示合理的容量保持行为。
- 还没有人留言评论。精彩留言会获得点赞!