以非氟非铁离子液体作为共萃剂提取锂离子的方法与流程
本发明属于化工分离技术领域,涉及一种以非氟非铁离子液体作为共萃剂提取锂离子的方法,具体涉及一种以非氟非铁离子液体作为共萃剂从含锂水溶液中提取锂离子的方法。
背景技术:
锂及其化合物是国民经济和国防建设中具有重要意义的战略物资,也是与人们生活息息相关的新型绿色能源材料,广泛用于制造工业、新能源、合金及医药等多个领域,被誉为“工业味精”、“明天的宇航合金”、“21世纪清洁能源金属”及“推动世界前进的重要元素”。近年来,随着锂电池技术的快速发展和锂同位素在核聚变领域中的广泛应用,锂的需求量逐年增加。据估算,预计到2025年,全球年均锂消费量将超过50万吨碳酸锂当量,是目前20万吨/年消费量的两倍多。随着固体锂矿的逐渐枯竭,从水溶液中提取锂逐渐成为了获取锂资源的主要途径,如盐湖、卤水、废旧锂电池浸出液等,其中盐湖卤水中蕴含着丰富的液体锂资源,所以从盐湖卤水中提取锂资源有着十分重要的意义。
溶剂萃取法具有选择性高、可连续自动化操作、易于工业放大等特点,故成为当前提取锂离子技术的研究热点。现有的用于高选择性提取锂离子的溶剂萃取工艺通常采用共萃取的方法,这种方法通过在萃取过程中引入另一种试剂作为共萃取剂来提高锂离子的提取效率。现有的提取锂离子的共萃取剂中以三氯化铁最为常用,且共萃取效果较好。然而,虽然采用三氯化铁作为共萃取剂的工艺已被不断地优化和改进,但目前仍存在一些问题,例如,三氯化铁要发挥共萃剂作用,需先与氯离子生成四氯化铁络阴离子,即FeCl3+Cl-=FeCl4-,才能与Li+电荷平衡,为使有机相循环使用,要求整个工艺流程三氯化铁均以FeCl4-络阴离子的形式存在于有机相中,由于FeCl3生成FeCl4-的反应为可逆反应,这就要求所有与有机相接触的水溶液,包括含锂水溶液、洗涤剂、反萃剂和有机相再生剂,均需含有一定浓度的氯离子,需消耗大量含氯化合物,只能应用于氯化型含锂水溶液,且大大限制了洗涤剂、反萃剂和有机相再生剂的选择范围;有机相洗酸再生时需使用碱溶液中和HFeCl4中的氢离子,而铁离子遇碱很容易形成多种形式的沉淀,导致共萃剂损失较大,大大增加生产成本。而采用六氟磷酸盐和/或氟硼酸盐替代三氯化铁作为共萃取剂用于提取锂离子虽然从一定程度上解决了三氯化铁作为共萃剂引起的一些问题,但是含氟化合物,遇水或水蒸气易水解生成氟化氢,对设备腐蚀严重,对操作工人的身体健康也造成极大的威胁。
因此,目前亟需研究开发一种萃取效率和选择性高,萃取过程中试剂对设备腐蚀小,对人体危害少,且成本较低的锂离子提取技术。
技术实现要素:
本发明所要解决的技术问题是针对上述现有技术的不足,提供从含锂水溶液中提取锂离子的方法。该方法以含对称立体结构络阴离子的非氟非铁离子液体作为共萃剂用于萃取提取含锂水溶液中锂离子,经过萃取、洗涤和反萃等步骤,得到组成为LiCl+NaCl的反萃液,然后加入沉淀剂制备Li2CO3产品。该方法工艺简单,可采用常规萃取分离设备,面向含锂水溶液范围广,易于放大,适用于工业化生产。
为此,本发明提供了一种从含锂水溶液中提取锂离子的方法,其包括
步骤B,将共萃剂和有机相溶液加入到含锂水溶液中,进行萃取,获得萃余液和萃取液;
步骤C,用洗涤剂洗涤萃取液,获得净化萃取液和洗涤废液;
步骤D,将反萃剂加入到净化萃取液中,进行反萃取,获得反萃液和反萃余液;
步骤F,向反萃液中加入沉淀剂,制得Li2CO3产品;
其中,所述共萃剂为非氟非铁离子液体。
在本发明的一些优选的实施例中,所述共萃剂为含对称立体结构络阴离子的非氟非铁离子液体。
在本发明的一些具体优选的实施例中,所述共萃剂包括1-丁基-3-甲基咪唑磷钨钼酸盐([Bmim]3PW6Mo6O40)、N-甲基咪唑磷钼酸盐([Mim]3PMo12O40)、N-甲基咪唑硅钨酸盐([Mim]4SiW12O40)、1-丁基-3-甲基咪唑磷钨酸盐([Bmim]3PW12O40)、1-己基-3-甲基咪唑磷钨酸盐([Hmim]3PW12O40)、1-辛基-3-甲基咪唑磷钨酸盐([Omim]3PW12O40)、1-丁基-3-甲基咪唑四苯基硼酸盐(BmimBPh4)、1-己基-3-甲基咪唑四苯基硼酸盐(HmimBPh4)、1-辛基-3-甲基咪唑四苯基硼酸盐(OmimBPh4)和1-丁基-3-甲基咪唑高氯酸盐(BmimClO4)中的一种或几种。
根据本发明方法,所述共萃剂与含锂水溶液中锂离子的摩尔比为1:5~5:1。
本发明中,所述洗涤剂为NaCl与LiCl混合溶液。
在本发明的一些实施例中,在所述洗涤剂中,NaCl和LiCl的浓度均为0.01~6mol/L。
在本发明的一些实施例中,所述萃取液与洗涤剂的体积比为1:30~30:1。
本发明中,有机相溶液为萃取剂和稀释剂的混合溶液。
在本发明的一些实施例中,在所述有机相溶液中,萃取剂和稀释剂的体积比为4:1~1:4。
在本发明的一些实施例中,在步骤B中,所述有机相溶液与含锂水溶液的体积比为1:10~10:1。
本发明中,所述反萃剂为盐酸溶液。
在本发明的一些实施例中,所述盐酸溶液的浓度为0.01~3mol/L。
在本发明的一些实施例中,在步骤D中,净化的萃取液与反萃剂的体积比为1:30~30:1。
本发明中,所述萃取剂为中性有机磷类萃取剂。
在本发明的一些具体实施例中,所述中性有机磷类萃取剂为磷酸三丁酯、磷酸三异丁酯、磷酸三辛酯、磷酸三甲酚酯和2-乙基己基二苯基磷酸酯中的一种或几种。
根据本发明,所述稀释剂包括酮、酯和卤代烷烃中的一种或几种。
在本发明的一些实施例中,所述酮包括甲基异丁基甲酮和/或乙酰丙酮。
在本发明的一些实施例中,所述酯包括邻苯二甲酸二甲酯。
在本发明的一些实施例中,所述卤代烷烃包括环氧氯丙烷、溴氯甲烷和二氯甲烷中的一种或几种。
根据本发明方法,所述方法还包括在步骤D之后的步骤E,将有机相再生剂与反萃余液混合后,分离,获得再生有机相溶液返回步骤B。
本发明中,所述有机相再生剂为NaOH溶液。
在本发明的一些实施例中,所述NaOH的浓度为0.01~3mol/L。
在本发明的一些实施例中,所述反萃余液与有机相再生剂的体积比1:30~30:1。
本发明的有益效果是:(1)使用非氟非铁类具有立体对称结构络阴离子的离子液体取代FeCl4-存在于循环有机相中用于液液萃取法提取含锂水溶液中锂离子,解决了三氯化铁作为共萃剂带来的潜在问题;(2)采用合成离子液体的方式使非氟非铁类具有立体对称结构络阴离子的共萃剂更好地溶解到有机相或水相中,其中此类共萃剂均采用不含氟的离子液体,避免因氟水解生成氟化氢对设备及人体带来极大伤害;(3)使用极性酮、酯或卤代烷烃做稀释剂,可有效提高非氟非铁离子液体的溶解性能,萃取过程中分相速度快,实验浓度范围内均无第三相出现,且锂离子分配系数、锂镁及锂钾分离因子显著大于煤油为稀释剂的体系,稀释剂在含盐溶液的整个循环过程中损失较少;(4)洗涤剂组成为NaCl和LiCl,洗涤剂不含酸碱,可有效降低对设备的腐蚀;(5)反萃剂采用低浓度盐酸,可得到LiCl和NaCl混合溶液,可采用加入沉淀剂(例如Na2CO3)的方法制备Li2CO3产品。
附图说明
为使本发明容易理解,下面将结合附图来详细说明本发明。
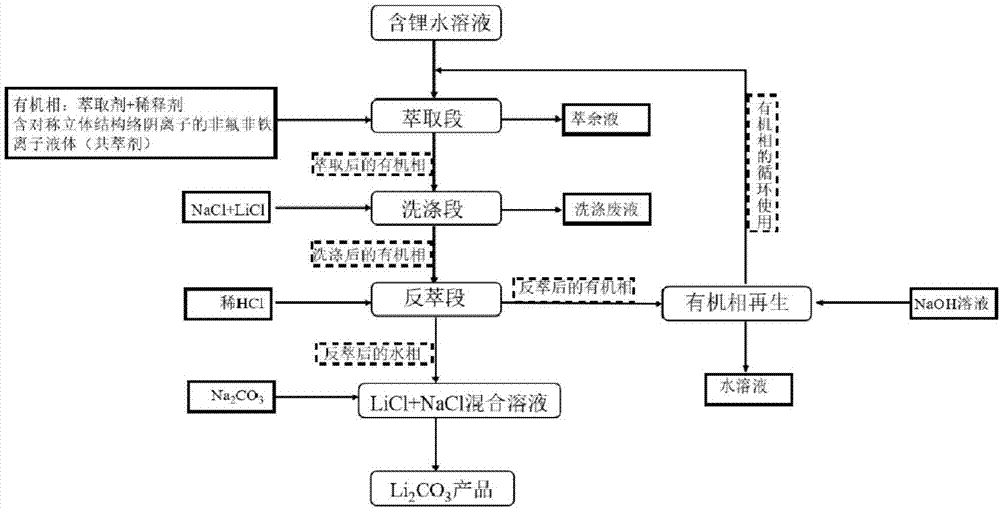
图1为本发明采用非氟非铁离子液体作为共萃剂从含锂水溶液中提取锂离子的工艺流程图。
具体实施方式
为使本发明更加容易理解,下面将结合本发明的具体实施方案参照附图详细说明如下,但仅作为说明而不是限制本发明。
如前所述,现有的提取锂离子的共萃取剂中以三氯化铁最为常用,且共萃取效果较好。然而,虽然采用三氯化铁作为共萃取剂的工艺已被不断地优化和改进,但目前仍存在一些问题,例如,三氯化铁要发挥共萃剂作用,需先与氯离子生成四氯化铁络阴离子,即FeCl3+Cl-=FeCl4-,才能与Li+电荷平衡,为使有机相循环使用,要求整个工艺流程三氯化铁均以FeCl4-络阴离子的形式存在于有机相中,由于FeCl3生成FeCl4-的反应为可逆反应,这就要求所有与有机相接触的水溶液,包括含锂水溶液、洗涤剂、反萃剂和有机相再生剂,均需含有一定浓度的氯离子,需消耗大量含氯化合物,只能应用于氯化型含锂水溶液,且大大限制了洗涤剂、反萃剂和有机相再生剂的选择范围;有机相洗酸再生时需使用碱溶液中和HFeCl4中的氢离子,而铁离子遇碱很容易形成多种形式的沉淀,导致共萃剂损失较大,大大增加生产成本。而采用六氟磷酸盐和/或氟硼酸盐替代三氯化铁作为共萃取剂用于提取锂离子虽然从一定程度上解决了三氯化铁作为共萃剂引起的一些问题,但是含氟化合物,遇水或水蒸气易水解生成氟化氢,对设备腐蚀严重,对操作工人的身体健康也造成极大的威胁。因此,如何在提高萃取效率和选择性的同时,避免设备腐蚀和工艺操作对人员身体的伤害,并能有效解决三氯化铁作为共萃剂带来的一系列问题成为锂离子萃取提取领域中一直以来人们想要解决而又难以解决的难题。为此,本发明人对锂离子提取工艺进行了大量调研。
本发明人通过对现有萃取法提取锂离子的技术进行研究发现,中国专利CN87103431A将以体积比为50%-70%TBP为萃取剂,体积比为30%-50%200#溶剂煤油为稀释剂,三氯化铁为共萃剂的萃取提锂工艺应用于总氯离子浓度大于6mol/L的高镁低锂溶液中萃取锂,分别采用稀盐酸和6-9mol/L盐酸进行洗涤和反萃,共萃剂三氯化铁以HFeCl4形式存在于有机相连续循环使用。该工艺于1990年进行了中试,并未成功,主要原因之一是采用的稀释剂200#溶剂煤油对萃取后生成的极性有机络合物溶解能力较差,当有机络合物浓度超过一定值后便会析出自成一相,导致在萃取过程中易形成第三相,造成萃取过程无法连续有效进行,降低萃取效率;二是采用高浓盐酸作为反萃剂,易引起酸雾,对设备腐蚀严重,流程操作亦存在很大风险,无法实现连续循环操作。中国专利CN102275956A采用极性溶剂醇或酮来取代200#溶剂煤油解决了萃取过程中易出现第三相的问题,并通过优化洗涤和反萃工艺,采用HCl+LiCl为洗涤剂,HCl+NaCl或HCl+NH4Cl为反萃剂,通过调控相比有效降低了盐酸浓度。但是该工艺仍然采用三氯化铁为共萃剂,为使有机相循环使用,要求整个工艺流程三氯化铁均以FeCl4-络阴离子的形式存在于有机相中,由于FeCl3生成FeCl4-的反应为可逆反应,即FeCl3+Cl-=FeCl4-,这就要求所有与有机相接触的水溶液,包括原溶液、洗涤剂、反萃剂和有机相再生剂,均需含有一定浓度的氯离子,同时有机相洗酸再生时需使用碱溶液中和HFeCl4中的氢离子,而铁离子遇碱很容易形成多种形式的沉淀,导致共萃剂损失。中国专利CN104404268A采用含有与FeCl4-结构类似的具有对称立体结构的络阴离子的盐来取代三氯化铁作为共萃剂,即六氟磷酸钾、六氟磷酸钠、六氟磷酸镁、六氟磷酸钙、氟硼酸钾,氟硼酸钠、氟硼酸镁、氟硼酸钙中的一种或两种以上的混合物,取得了较好的提锂效果。但所用的这八种共萃剂均为含氟化合物,遇水或水蒸气易水解生成氟化氢,对设备腐蚀严重,对操作工人的身体健康也造成极大的威胁。
鉴于此,本发明人考虑采用不含氟不含铁的具有立体对称结构络阴离子的离子液体作为共萃取剂来解决上述技术难题,含对称立体结构络阴离子的非氟非铁离子液体作为共萃剂可以在水相或有机相中具有较好的溶解性能,由此在提高萃取效率和选择性的同时,又可以解决三氯化铁作为共萃剂带来的潜在问题,还能够避免含氟共萃剂对设备及人体带来极大伤害,本发明正是基于上述发现作出的。
图1为本发明采用非氟非铁离子液体作为共萃剂从含锂水溶液中提取锂离子的工艺流程图,从图1可以看出,本发明所涉及的从含锂水溶液中提取锂离子的方法包括:
步骤B(萃取段),将共萃剂和有机相溶液加入到含锂水溶液中,进行萃取,获得萃余液和萃取液(萃取后的有机相);
步骤C(洗涤段),用洗涤剂洗涤萃取液,获得净化萃取液(洗涤后的有机相)和洗涤废液;
步骤D(反萃段),将反萃剂加入到净化萃取液中,进行反萃取,获得反萃液(反萃后的水相)和反萃余液(反萃后的有机相);
步骤F(沉淀分离段),向反萃液(LiCl+NaCl)中加入沉淀剂,制得Li2CO3产品;
其中,所述共萃剂为非氟非铁离子液体。
在本发明的一些优选的实施例中,所述共萃剂为含对称立体结构络阴离子的非氟非铁离子液体。
在本发明的一些具体优选的实施例中,所述共萃剂包括1-丁基-3-甲基咪唑磷钨钼酸盐([Bmim]3PW6Mo6O40)、N-甲基咪唑磷钼酸盐([Mim]3PMo12O40)、N-甲基咪唑硅钨酸盐([Mim]4SiW12O40)、1-丁基-3-甲基咪唑磷钨酸盐([Bmim]3PW12O40)、1-己基-3-甲基咪唑磷钨酸盐([Hmim]3PW12O40)、1-辛基-3-甲基咪唑磷钨酸盐([Omim]3PW12O40)、1-丁基-3-甲基咪唑四苯基硼酸盐(BmimBPh4)、1-己基-3-甲基咪唑四苯基硼酸盐(HmimBPh4)、1-辛基-3-甲基咪唑四苯基硼酸盐(OmimBPh4)和1-丁基-3-甲基咪唑高氯酸盐(BmimClO4)中的一种或几种;优选为1-丁基-3-甲基咪唑磷钨钼酸盐([Bmim]3PW6Mo6O40)、N-甲基咪唑磷钼酸盐([Mim]3PMo12O40)、N-甲基咪唑硅钨酸盐([Mim]4SiW12O40)、1-丁基-3-甲基咪唑磷钨酸盐([Bmim]3PW12O40)、1-丁基-3-甲基咪唑四苯基硼酸盐(BmimBPh4)、1-己基-3-甲基咪唑四苯基硼酸盐(HmimBPh4)或1-丁基-3-甲基咪唑高氯酸盐(BmimClO4)。
根据本发明方法,所述共萃剂与含锂水溶液中锂离子的摩尔比为1:5~5:1,优选为(1.2~3):1。
本发明中,所述洗涤剂为NaCl与LiCl混合溶液。
在本发明的一些实施例中,例如,在所述洗涤剂中,NaCl的浓度为0.01~6mol/L,优选为0.12~1.2mol/L,LiCl的浓度为0.01~6mol/L,优选为0.23~0.3mol/L。
在一些具体优选的例子中,在所述洗涤剂中,例如,可以配制浓度为1.2mol/L NaCl+0.3mol/L LiCl,或者浓度为0.12mol/L NaCl+0.23mol/L LiCl,或者浓度为0.17mol/L NaCl+0.24mol/L LiCl,或者浓度为0.93mol/L NaCl+0.25mol/L LiCl的混合溶液作为洗涤剂。
在本发明的一些实施例中,所述萃取液与洗涤剂的体积比为1:30~30:1,优选为(2~8):1。
本发明中,有机相溶液为萃取剂和稀释剂的混合溶液。在本发明的一些实施例中,在所述有机相溶液中,萃取剂和稀释剂的体积比为4:1~1:4,优选为(1~1.5):1。
基于上述不难理解,本发明所涉及的从含锂水溶液中提取锂离子的方法还可以包括步骤A,将萃取剂和稀释剂混合后制成有机溶液的步骤。
本领域技术人员应该了解的是,上述步骤A和步骤B既可以分步操作也可以合并操作。例如,可以先将萃取剂和稀释剂混合后制成有机溶液(步骤A),然后再将共萃剂和有机相溶液加入到含锂水溶液中,进行萃取,获得萃余液和萃取液(步骤B);还可以将萃取剂、稀释剂及共萃剂与含锂水溶液混合,进行萃取,获得萃余液和萃取液(步骤A+B)。
在本发明的一些实施例中,在步骤B中,所述有机相溶液与含锂水溶液的体积比为1:10~10:1,优选为(0.5~2):1,进一步优选为1:1。
本发明中,所述反萃剂为盐酸溶液。在本发明的一些实施例中,例如,所述盐酸溶液的浓度为0.01~3mol/L,优选为0.17~0.34mol/L。
在本发明的一些实施例中,在步骤D中,净化的萃取液与反萃剂的体积比为1:30~30:1,优选为(3~8):1。
本发明中,所述萃取剂为中性有机磷类萃取剂。
在本发明的一些具体实施例中,所述中性有机磷类萃取剂为磷酸三丁酯、磷酸三异丁酯、磷酸三辛酯、磷酸三甲酚酯和2-乙基己基二苯基磷酸酯中的一种或几种,优选为磷酸三丁酯、磷酸三辛酯或2-乙基己基二苯基磷酸酯。
根据本发明,所述稀释剂包括酮、酯和卤代烷烃中的一种或几种。
在本发明的一些实施例中,所述酮包括甲基异丁基甲酮和/或乙酰丙酮。
在本发明的一些实施例中,所述酯包括邻苯二甲酸二甲酯。
在本发明的一些实施例中,所述卤代烷烃包括环氧氯丙烷、溴氯甲烷和二氯甲烷中的一种或几种。
根据本发明方法,所述方法还包括在步骤D之后的步骤E,将有机相再生剂与反萃余液混合后,分离,获得再生有机相溶液循环返回步骤B,同时产生作为废液排出的水溶液。
本发明中,所述有机相再生剂为NaOH溶液。
在本发明的一些实施例中,所述NaOH的浓度为0.01~3mol/L,优选为0.17~0.34mol/L。
在本发明的一些实施例中,所述反萃余液与有机相再生剂的体积比1:30~30:1,优选为(3~8):1。
本发明中,所述反萃液组成为NaCl+LiCl,加入沉淀剂,例如,Na2CO3可制备Li2CO3。
本发明中对于沉淀剂没有特别的限制,可以选用本领域常规沉淀剂,例如,所述沉淀剂包括Na2CO3和/或CO2,优选为Na2CO3。沉淀剂的用量以能够将反萃液中的Li离子完全沉淀为准。
本发明中含锂水溶液中金属离子,包括锂离子、镁离子、钾离子和钠离子的浓度可以采用原子吸收光谱法测量。该原子吸收光谱法采用AA-6880原子吸收分光光度计(日本岛津公司)进行测量,采用乙炔+空气火焰燃烧,火焰燃烧头高度可自动调节,四种金属离子检测上限均为2ppm,配备光学/电子双光束,测定波长范围为185-900nm,配有象差校正型切尼尔-特纳装置,可实现0.1、0.2、0.4、0.7、1.0、2.0nm的6段自动切换,可实现快速自吸收法和2频率同时测光方式,具有8个灯位,可同时点灯2个(1个预热),7和8号位还可驱动高性能空心阴极灯。
本发明中所述用语“mim”或称“Mim”是指甲基咪唑;相应地,所述用语“Hmin”是指己基-…-甲基咪唑;相应地,所述用语“Bmin”是指丁基-…-甲基咪唑;相应地,所述用语“Omin”是指辛基-…-甲基咪唑。
本发明所用术语“萃取剂”是指与被萃取物形成溶于有机相的萃合物的化学试剂。在湿法冶金中,萃取剂的作用是与被萃取的金属通过配合化学反应生成萃合物萃入到有机相,又能通过某种化学反应使被萃取的金属从有机相反萃取到水相,由此而达到金属提纯与富集的目的。
本发明中所用术语“共萃取”是指某一元素(通常为微量元素,即待萃取元素)单独存在时不被萃取或萃取率很低,但有另一元素(通常为常量元素)存在时,难萃元素的萃取率大增,这一现象称之为共萃取。相应地,含有另一元素(通常为常量元素),且也能够与萃取剂形成溶于有机相的萃合物的化学试剂即为共萃取剂。
本发明中所用术语“络阴离子”是指在由金属或有机阳离子和含氧或非氧酸根结合而成的盐的结构中呈独立的阴离子团存在的含氧或非氧酸根。例如,本发明的共萃剂,1-丁基-3-甲基咪唑磷钨钼酸盐([Bmim]3PW6Mo6O40)、N-甲基咪唑磷钼酸盐([Mim]3PMo12O40)、N-甲基咪唑硅钨酸盐([Mim]4SiW12O40)、1-丁基-3-甲基咪唑磷钨酸盐([Bmim]3PW12O40)、1-己基-3-甲基咪唑磷钨酸盐([Hmim]3PW12O40)、1-辛基-3-甲基咪唑磷钨酸盐([Omim]3PW12O40)、1-丁基-3-甲基咪唑四苯基硼酸盐(BmimBPh4)、1-己基-3-甲基咪唑四苯基硼酸盐(HmimBPh4)、1-辛基-3-甲基咪唑四苯基硼酸盐(OmimBPh4)和1-丁基-3-甲基咪唑高氯酸盐(BmimClO4),均具有由金属或有机阳离子和含氧或非氧酸根结合而成的盐的结构,其中的呈独立的阴离子团存在的含氧或非氧酸根,例如,磷钨钼酸根、磷钼酸根、硅钨酸根、磷钨酸根、四苯基硼酸根和高氯酸根,即为“络阴离子”。本发明中上述磷钨钼酸根、磷钼酸根、硅钨酸根、磷钨酸根、四苯基硼酸根和高氯酸根络阴离子具有立体对称结构。
本发明中所用术语“离子液体”一般是指在室温或接近室温(<100℃)下呈液态的完全由阴阳离子由库仑力结合所形成的盐。
本发明中所述“含锂水溶液”一词是指溶有锂离子的由水作溶剂的溶液,例如各种盐湖卤水等。
本发明中所用术语“反萃取”是指使被萃取物从负载有机相(本发明中亦称为萃取相或萃取液)返回水相的过程。为萃取的逆过程。
相应地,本发明中所用术语“反萃剂”是指与被萃取物形成萃合物从而使被萃取物从负载有机相(本发明中亦称为萃取相或萃取液)返回水相的试剂。
本发明中所述用语“萃取有机相”、“有机相”和“有机相溶液”可以互换使用。
本发明中所述用语“负载有机相”、“萃取后的有机相”、“萃取液”和“萃取相”可以互换使用。
本发明中所述用语“净化萃取液”与“洗涤后的有机相”可以互换使用。
本发明中所述用语“反萃余液”与“反萃后的有机相”可以互换使用。
本发明中所述用语“反萃液”与“反萃后的负载水相”和“反萃后的水相”可以互换使用。
本发明中所述用语“摩尔浓度”和“浓度”可以互换使用。
本发明中所述“水”一词,在没有特别说明或限定的条件下,是指去离子水,蒸馏水或超纯水。
实施例
为使本发明更加容易理解,下面将结合实施例来进一步详细说明本发明,这些实施例仅起说明性作用,并不局限于本发明的应用范围。本发明中所使用的原料或组分若无特殊说明均可以通过商业途径买到或常规方法制得。
实施例1:
配制模拟盐湖卤水(含锂水溶液),组成为Li+(0.05mol/L)、Na+(0.08mol/L)、K+(0.02mol/L)、Mg2+(4.00mol/L)、Cl-(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和溴氯甲烷(稀释剂)混合,制成萃取有机相(有机相溶液),磷酸三丁酯、溴氯甲烷分别占萃取有机相总体积的50%和50%;
(2)将1-丁基-3-甲基咪唑四苯基硼酸盐(共萃剂)溶解到上述萃取有机相中,1-丁基-3-甲基咪唑四苯基硼酸盐(共萃剂)与锂离子的摩尔比为2.6:1,然后将模拟卤水与萃取有机相充分混合,萃取有机相与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.17mol/L NaCl+0.24mol/L LiCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为2:1,洗涤萃取后的有机相;
(4)配制浓度为0.17mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,洗涤后的有机相和反萃剂的体积比为4:1,反萃后得到反萃液(LiCl和NaCl混合溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.17mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃后的有机相与再生剂的体积比为4:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为64%,单级锂钠、锂钾及锂镁分离因子分别是58,1762和2754。经过三级萃取,一级洗涤,两级反萃后锂总回收率达92%以上。
实施例2:
配制模拟盐湖卤水(含锂水溶液),组成为Li+(0.05mol/L)、Na+(0.08mol/L)、K+(0.02mol/L)、Mg2+(4.00mol/L)、Cl-(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和二氯甲烷(稀释剂)混合,制成萃取有机相(有机相溶液),磷酸三丁酯、二氯甲烷分别占萃取有机相总体积的50%和50%;
(2)将1-丁基-3-甲基咪唑四苯基硼酸盐(共萃剂)溶解到上述萃取有机相中,1-丁基-3-甲基咪唑四苯基硼酸盐(共萃剂)与锂离子的摩尔比为3:1,然后将模拟卤水与萃取有机相充分混合,萃取有机相与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.17mol/L NaCl+0.24mol/L LiCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为2:1,洗涤萃取后的有机相;
(4)配制浓度为0.34mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,洗涤后的有机相和反萃剂的体积比为8:1,反萃后得到反萃液(LiCl和NaCl混合溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.34mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃后的有机相与再生剂的体积比为8:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为62%,单级锂钠、锂钾及锂镁分离因子分别是44,891和2509。经过三级萃取,一级洗涤,两级反萃后锂总回收率达90%以上。
实施例3:
配制模拟盐湖卤水(含锂水溶液),组成为Li+(0.05mol/L)、Na+(0.08mol/L)、K+(0.02mol/L)、Mg2+(4.00mol/L)、Cl-(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三辛酯(萃取剂)和二氯甲烷(稀释剂)混合,制成萃取有机相(有机相溶液),磷酸三辛酯、二氯甲烷分别占萃取有机相总体积的50%和50%;
(2)将1-丁基-3-甲基咪唑四苯基硼酸盐(共萃剂)溶解到上述萃取有机相中,1-丁基-3-甲基咪唑四苯基硼酸盐(共萃剂)与锂离子的摩尔比为3:1,然后将模拟卤水与萃取有机相充分混合,萃取有机相与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.17mol/L NaCl+0.24mol/L LiCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为2:1,洗涤萃取后的有机相;
(4)配制浓度为0.17mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,洗涤后的有机相和反萃剂的体积比为4:1,反萃后得到反萃液(LiCl+NaCl混合溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.17mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃后的有机相与再生剂的体积比为4:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为14%。经过十一级萃取,一级洗涤,两级反萃后锂总回收率达80%以上。
实施例4:
配制模拟盐湖卤水(含锂水溶液),组成为Li+(0.05mol/L)、Na+(0.08mol/L)、K+(0.02mol/L)、Mg2+(4.00mol/L)、Cl-(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和二氯甲烷(稀释剂)混合,制成萃取有机相(有机相溶液),磷酸三丁酯、二氯甲烷分别占萃取有机相总体积的50%和50%;
(2)将1-己基-3-甲基咪唑四苯基硼酸盐(共萃剂)溶解到上述萃取有机相中,1-己基-3-甲基咪唑四苯基硼酸盐(共萃剂)与锂离子的摩尔比为2.7:1,然后将模拟卤水与萃取有机相充分混合,萃取有机相与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.17mol/L NaCl+0.24mol/L LiCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为2:1,洗涤有机相;
(4)配制浓度为0.34mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,洗涤后的有机相和反萃剂的体积比为8:1,反萃后得到反萃液(LiCl+NaCl溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.34mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃后的有机相与再生剂的体积比为8:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为15%。经过十级萃取,一级洗涤,两级反萃后锂总回收率达80%以上。
实施例5:
配制模拟盐湖卤水(含锂水溶液),组成为Li+(0.05mol/L)、Na+(0.08mol/L)、K+(0.02mol/L)、Mg2+(4.00mol/L)、Cl-(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和甲基异丁基甲酮(稀释剂)混合,制成萃取有机相(有机相溶液),磷酸三丁酯、甲基异丁基甲酮分别占萃取有机相总体积的60%和40%;
(2)将1-丁基-3-甲基咪唑高氯酸盐(共萃剂)溶解到上述萃取有机相中,1-丁基-3-甲基咪唑高氯酸盐(共萃剂)与锂离子的摩尔比为3:1,然后将模拟卤水与萃取有机相充分混合,萃取有机相与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.12mol/L NaCl+0.23mol/L LiCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为4:1,洗涤有机相;
(4)配制浓度为0.3mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,洗涤后的有机相和反萃剂的体积比为6:1,反萃后得到反萃液(LiCl+NaCl溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.3mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃后的有机相与再生剂的体积比为6:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为57%。经过三级萃取,一级洗涤,两级反萃后锂总回收率达90%以上。
实施例6:
配制模拟盐湖卤水(含锂水溶液),组成为Li+(0.05mol/L)、Na+(0.08mol/L)、K+(0.02mol/L)、Mg2+(4.00mol/L)、Cl-(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将2-乙基己基二苯基磷酸酯(萃取剂)和乙酰丙酮(稀释剂)混合,制成萃取有机相(有机相溶液),2-乙基己基二苯基磷酸酯、乙酰丙酮分别占萃取有机相总体积的50%和50%;
(2)将N-甲基咪唑磷钼酸盐(共萃剂)溶解到上述萃取有机相中,N-甲基咪唑磷钼酸盐(共萃剂)与锂离子的摩尔比为1.2:1,然后将模拟卤水与萃取有机相充分混合,萃取有机相与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为1.2mol/LNaCl+0.3mol/L LiCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为5:1,洗涤有机相;
(4)配制浓度为0.25mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,洗涤后的有机相和反萃剂的体积比为3:1,反萃后得到反萃液(LiCl+NaCl溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.25mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃后的有机相与再生剂的体积比为3:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为62%。经过三级萃取,一级洗涤,两级反萃后锂总回收率达92%以上。
实施例7:
配制模拟盐湖卤水(含锂水溶液),组成为Li+(0.05mol/L)、Na+(0.08mol/L)、K+(0.02mol/L)、Mg2+(4.00mol/L)、Cl-(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和乙酰丙酮(稀释剂)混合,制成萃取有机相(有机相溶液),磷酸三丁酯、乙酰丙酮分别占萃取有机相总体积的60%和40%;
(2)将1-丁基-3-甲基咪唑磷钨钼酸盐(共萃剂)溶解到上述萃取有机相中,1-丁基-3-甲基咪唑磷钨钼酸盐(共萃剂)与锂离子的摩尔比为1.3:1,然后将模拟卤水与萃取有机相充分混合,萃取有机相与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为1.2mol/L NaCl+0.3mol/L LiCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为6:1,洗涤有机相;
(4)配制浓度为0.3mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,洗涤后的有机相和反萃剂的体积比为4:1,反萃后得到反萃液(LiCl+NaCl溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.3mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃后的有机相与再生剂的体积比为4:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为76%。经过两级萃取,一级洗涤,两级反萃后锂总回收率达92%以上。
实施例8:
配制模拟盐湖卤水(含锂水溶液),组成为Li+(0.05mol/L)、Na+(0.08mol/L)、K+(0.02mol/L)、Mg2+(4.00mol/L)、Cl-(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和环氧氯丙烷(稀释剂)混合,制成萃取有机相(有机相溶液),磷酸三丁酯、环氧氯丙烷分别占萃取有机相总体积的60%和40%;
(2)将N-甲基咪唑硅钨酸盐(共萃剂)溶解到上述萃取有机相中,N-甲基咪唑硅钨酸盐(共萃剂)与锂离子的摩尔比为1.2:1,然后将模拟卤水与萃取有机相充分混合,萃取有机相与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为1.2mol/L NaCl+0.3mol/L LiCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为5:1,洗涤有机相;
(4)配制浓度为0.3mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,洗涤后的有机相和反萃剂的体积比为3:1,反萃后得到反萃液(LiCl+NaCl溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.3mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃后的有机相与再生剂的体积比为3:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为65%,单级锂钠、锂钾及锂镁分离因子分别是25,232和123。经过三级萃取,一级洗涤,两级反萃后锂总回收率达93%以上。
实施例9:
配制模拟盐湖卤水(含锂水溶液),组成为Li+(0.05mol/L)、Na+(0.08mol/L)、K+(0.02mol/L)、Mg2+(4.00mol/L)、Cl-(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和邻苯二甲酸二甲酯(稀释剂)混合,制成萃取有机相(有机相溶液),磷酸三丁酯、邻苯二甲酸二甲酯分别占萃取有机相总体积的50%和50%;
(2)将1-丁基-3-甲基咪唑磷钨酸盐(共萃剂)溶解到上述萃取有机相中,1-丁基-3-甲基咪唑磷钨酸盐(共萃剂)与锂离子的摩尔比为1.2:1,然后将模拟卤水与萃取有机相充分混合,萃取有机相与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.93mol/L NaCl+0.25mol/L LiCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为8:1,洗涤有机相;
(4)配制浓度为0.31mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,洗涤后的有机相和反萃剂的体积比为6:1,反萃后得到反萃液(LiCl+NaCl溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.31mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃后的有机相与再生剂的体积比为6:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为55%,单级锂钠、锂钾及锂镁分离因子分别是39,244和153。经过四级萃取,一级洗涤,两级反萃后锂总回收率达93%以上。
应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。
- 还没有人留言评论。精彩留言会获得点赞!