纳米碳的电子传递作用的制作方法
公开一种涉及纳米碳与其他物质的电子传递的技术。
背景技术:
纳米碳由于电导率高,因此作为进行与其他物质的电子传递的导电材料的应用正在推进之中。例如提出过如下的方案,即,将纳米碳混合到包含碳和树脂及有机溶剂的墨液中并印刷于基板上,作为生物传感器用的电极使用(专利文献1)。另外,作为纳米碳的一种的碳纳米管可以用于测定过氧化物的传感器中(专利文献2)、或与酶一起成形为膜状并作为传感器、燃料电池的电极使用(专利文献3)。此外还报告过通过使用单层碳纳米管而直接以电子移动进行从酶向电极的电子传递(非专利文献1)。这使得将以往需要介质(mediator)的、以黄素腺嘌呤二核苷酸作为辅酶的葡糖脱氢酶(fadgdh)无介质地用于葡萄糖传感器成为可能。
现有技术文献
专利文献
专利文献1:wo2005088288
专利文献2:wo2011007582
专利文献3:wo2012002290
非专利文献
非专利文献1:acscatal.2017,7,725_734
技术实现要素:
发明所要解决的问题
一个目的在于,提供促进纳米碳与其他物质的电子传递作用的方式。
用于解决问题的方法
为了解决该问题等反复进行了深入研究,结果发现,具有芳香环骨架的化合物具有促进纳米碳的电子传递功能的作用。对该见解反复进行进一步的研究和改良,提出了以下述内容为代表的发明。
事项1.
一种纳米碳的电子传递作用促进剂,其包含具有芳香环骨架的化合物。
事项2.
一种纳米碳,其中,具有芳香环骨架的化合物借助分子间相互作用附着或靠近地存在。
事项3.
根据事项2中记载的纳米碳,其中,具有芳香环骨架的化合物是单独情况下不具有作为介质的功能的化合物。
事项4.
根据事项2或3中记载的纳米碳,其中,具有芳香环骨架的化合物选自百里酚、苯酚、双(4-羟基苯基)砜、酪氨酸二钠水合物、水杨酸钠、甲苯、5-羟基吲哚、苯胺、醌茜隐色体、香芹酚、1,5-萘二酚、4-异丙基-3-甲基苯酚、2-异丙基苯酚、4-异丙基苯酚、1-萘酚、2-叔丁基-5-甲基苯酚、2,4,6-三甲基苯酚、2,6-二异丙基苯酚、2-叔丁基-4-乙基苯酚、6-叔丁基-2,4-二甲苯酚、2-叔丁基-4-甲基苯酚、2-叔丁基-6-甲基苯酚、2,4-二叔丁基苯酚、2,4-二叔丁基-5-甲基苯酚、双(对羟基苯基)甲烷、3-叔丁基苯酚、2-异丙基-5-甲基茴香醚、邻甲酚、间甲酚、以及对甲酚中。
事项5.
一种电极,其在基板上装载有纳米碳、具有芳香环骨架的化合物、以及酶。
事项6.
根据事项5中记载的电极,其中,纳米碳为碳纳米管。
事项7.
根据事项5或6中记载的电极,其中,碳纳米管为单层碳纳米管。
事项8.
根据事项5~7中任一项记载的电极,其中,酶为黄素结合型葡糖脱氢酶。
事项9.
根据事项5~8中任一项记载的电极,其中,在基板上还装载有分散剂。
事项10.
根据事项5~9中任一项记载的电极,其中,基板为形成有碳或金属的薄膜的基板。
事项11.
一种传感器,其包含事项5~10中任一项记载的电极。
事项12.
一种具有芳香环骨架的化合物的用途,其用于促进或提高纳米碳的电子传递。
事项13.
根据事项12中记载的用途,其中,纳米碳的电子传递为电极与酶之间的电子传递。
事项14.
根据事项13中记载的用途,其中,酶为黄素结合型葡糖脱氢酶。
事项15.
根据事项12~14中任一项记载的用途,其中,具有芳香环骨架的化合物选自百里酚、苯酚、双(4-羟基苯基)砜、酪氨酸二钠水合物、水杨酸钠、甲苯、5-羟基吲哚、苯胺、醌茜隐色体、香芹酚、1,5-萘二酚、4-异丙基-3-甲基苯酚、2-异丙基苯酚、4-异丙基苯酚、1-萘酚、2-叔丁基-5-甲基苯酚、2,4,6-三甲基苯酚、2,6-二异丙基苯酚、2-叔丁基-4-乙基苯酚、6-叔丁基-2,4-二甲苯酚、2-叔丁基-4-甲基苯酚、2-叔丁基-6-甲基苯酚、2,4-二叔丁基苯酚、2,4-二叔丁基-5-甲基苯酚、双(对羟基苯基)甲烷、3-叔丁基苯酚、2-异丙基-5-甲基茴香醚、邻甲酚、间甲酚、以及对甲酚。
事项16.
根据事项12~15中任一项记载的用途,其中,纳米碳为碳纳米管。
事项17.
一种方法,是促进或提高纳米碳的电子传递的方法,所述方法包括使具有芳香环骨架的化合物向纳米碳附着或靠近。
事项18.
根据事项17中记载的方法,其中,纳米碳的电子传递为酶与电极之间的电子传递。
事项19.
根据事项18中记载的方法,其中,酶为黄素结合型葡糖脱氢酶。
事项20.
根据事项17~19中任一项记载的方法,其中,向纳米碳附着或靠近是在电极的基板上装载纳米碳、具有芳香环骨架的化合物、以及酶。
事项21.
根据事项17~19中任一项记载的方法,其中,向纳米碳附着或靠近是将在基板上装载有纳米碳及酶的电极浸渍于包含具有芳香环骨架的化合物的溶剂中。
事项22.
根据事项21中记载的方法,其中,溶剂中的具有芳香环骨架的化合物的浓度为0.000001~2%(w/v)。
事项23.
根据事项17~22中任一项记载的方法,其中,具有芳香环骨架的化合物选自百里酚、苯酚、双(4-羟基苯基)砜、酪氨酸二钠水合物、水杨酸钠、甲苯、5-羟基吲哚、苯胺、醌茜隐色体、香芹酚、1,5-萘二酚、4-异丙基-3-甲基苯酚、2-异丙基苯酚、4-异丙基苯酚、1-萘酚、2-叔丁基-5-甲基苯酚、2,4,6-三甲基苯酚、2,6-二异丙基苯酚、2-叔丁基-4-乙基苯酚、6-叔丁基-2,4-二甲苯酚、2-叔丁基-4-甲基苯酚、2-叔丁基-6-甲基苯酚、2,4-二叔丁基苯酚、2,4-二叔丁基-5-甲基苯酚、双(对羟基苯基)甲烷、3-叔丁基苯酚、2-异丙基-5-甲基茴香醚、邻甲酚、间甲酚、以及对甲酚。
事项24.
根据事项17~23中任一项记载的方法,其中,纳米碳为碳纳米管。
事项25.
一种传感器,是包含浸渍于溶剂中的电极的传感器,所述电极在基板上装载有纳米碳及酶,所述溶剂包含具有芳香环骨架的化合物。
事项26.
根据事项25中记载的传感器,其中,溶剂中的具有芳香环骨架的化合物的浓度为0.000001~2%(w/v)。
发明效果
纳米碳的电子传递作用得到促进。由此,纳米碳的电子传递作用的利用领域得到扩大。在一个实施方式中,能够将纳米碳作为酶与电极的授受电子的媒介物质稳定和/或更加有效地利用。
附图说明
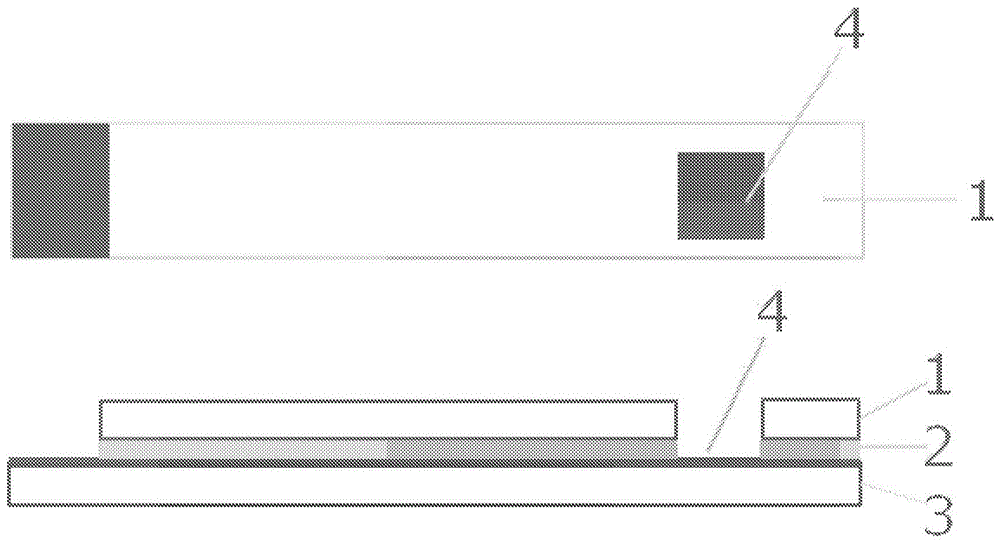
图1表示实施例1中制作的电极的结构。“1”为pet膜,“2”为粘合片,“3”为蒸镀有金的pet膜,“4”为作用电极部位。
图2表示在实施例1中在作用电极部位载置百里酚而测定出的循环伏安图。
图3表示在实施例1中在作用电极部位载置苯酚而测定出的循环伏安图。
图4表示在比较例1中在作用电极部位载置薄荷醇而测定出的循环伏安图。
图5表示在比较例1中在作用电极部位载置环己醇而测定出的循环伏安图。
图6表示在比较例1中未在作用电极部位载置化合物地测定出的循环伏安图。
图7表示实施例3中制作出的电极的结构。“5”为pet膜,“6”为粘合片,“7”为印刷有碳糊的pet膜,“8”为作用电极部位。
图8表示在实施例3中向缓冲液中添加百里酚而测定出的循环伏安图。
图9表示在比较例3中未向缓冲液中添加百里酚地测定出的循环伏安图。
图10表示在实施例4中未向缓冲液中添加百里酚地测定出的循环伏安图。
图11表示在实施例4中以达到0.00001%(w/v)的方式向缓冲液中添加百里酚而测定出的循环伏安图。
图12表示在实施例4中以达到0.0001%(w/v)的方式向缓冲液中添加百里酚而测定出的循环伏安图。
图13表示在实施例4中以达到0.001%(w/v)的方式向缓冲液中添加百里酚而测定出的循环伏安图。
图14表示在实施例4中以达到0.01%(w/v)的方式向缓冲液中添加百里酚而测定出的循环伏安图。
图15表示在实施例7中向缓冲液中添加百里酚而测定出的循环伏安图。
图16表示在比较例5中未向缓冲液中添加百里酚地测定出的循环伏安图。
图17表示在实施例8中在作用电极部位载置单层碳纳米管而测定出的循环伏安图。
图18表示在实施例8中在作用电极部位载置多层碳纳米管而测定出的循环伏安图。
图19表示在比较例6中在作用电极部位载置单层碳纳米管而测定出的循环伏安图。
图20表示在比较例6中在作用电极部位载置多层碳纳米管而测定出的循环伏安图。
图21表示在实施例9中在作用电极部位载置单层碳纳米管而测定出的循环伏安图。
图22表示在实施例9中在作用电极部位载置多层碳纳米管而测定出的循环伏安图。
图23表示在比较例7中在作用电极部位载置单层碳纳米管而测定出的循环伏安图。
图24表示在比较例7中在作用电极部位载置多层碳纳米管而测定出的循环伏安图。
具体实施方式
1.纳米碳的电子传递作用促进剂
纳米碳只要是具有电子传递功能的、被认为是纳米碳的物质,就没有特别限制。作为此种物质,例如是指包括碳纳米管、碳纳米角、碳纳米弯线(carbonnanotwist)、茧(cocoon)、碳纳米螺旋(carbonnanocoil)、石墨烯、富勒烯等的、主要由碳形成的碳材料。碳纳米管可以是单层碳纳米管,也可以是双层碳纳米管、多层碳纳米管。在一个实施方式中纳米碳优选为碳纳米管,更优选为单层碳纳米管。
纳米碳的电子传递作用促进剂优先包含具有芳香环骨架的化合物。芳香环骨架的成环原子的个数例如为5~18,优选为5~16,更优选为5~14。在芳香环骨架中,包括具有包含1个苯环的骨架、包含2个以上(例如2~4)的苯环的骨架(萘骨架、蒽骨架等)、包含苯环与其他芳香环(含氮芳香环、含氧芳香环、含硫芳香环等)的稠合环的骨架(菲咯啉骨架、苯并呋喃骨架、苯并咪唑骨架、咔唑骨架等)、包含由碳与其他元素(氮、氧、硫等)形成的芳香环的骨架(三嗪骨架、三唑骨架、吡啶骨架等)的芳香环骨架。具有芳香环骨架的化合物优选为单独情况下不具有作为介质的功能的化合物。所谓单独情况下不具有作为介质的功能,是指不具有像苯醌、1-甲氧基吩嗪硫酸甲酯那样在电极与酶之间或者电极与基质之间单独地进行电子传递的功能。
在一个实施方式中,具有芳香环骨架的化合物优选具有给电子性的取代基。所谓给电子性的取代基,是指羟基、氨基、以及甲基等。优选的给电子性的取代基为羟基。作为具有给电子性的取代基及芳香环骨架的化合物,可以举出具有取代有羟基的苯环的化合物(例如百里酚、苯酚、双(4-羟基苯基)砜、酪氨酸二钠水合物、水杨酸钠、5-羟基吲哚、醌茜隐色体、香芹酚、1,5-萘二酚、4-异丙基-3-甲基苯酚、2-异丙基苯酚、4-异丙基苯酚、1-萘酚、2-叔丁基-5-甲基苯酚、2,4,6-三甲基苯酚、2,6-二异丙基苯酚、2-叔丁基-4-乙基苯酚、6-叔丁基-2,4-二甲苯酚、2-叔丁基-4-甲基苯酚、2-叔丁基-6-甲基苯酚、2,4-二叔丁基苯酚、及2,4-二叔丁基-5-甲基苯酚、双(对羟基苯基)甲烷、3-叔丁基苯酚、邻甲酚、间甲酚、对甲酚)、具有取代有氨基的苯环的化合物(例如苯胺)、具有取代有甲基的苯环的化合物(例如甲苯、2-异丙基-5-甲基茴香醚)。
上述化合物中,优选百里酚、苯酚及香芹酚。
通过使纳米碳的电子传递作用促进剂向纳米碳靠近或附着,可以促进纳米碳与其他物质间的电子传递作用。电子传递作用促进剂与纳米碳优选借助分子间相互作用发生附着或靠近。为了促进纳米碳的电子传递作用而靠近或附着地配置的电子传递作用促进剂的量没有特别限制。
2.电子传递作用促进剂发生靠近或附着的纳米碳
通过使上述的电子传递作用促进剂向纳米碳靠近或附着,可以获得促进了电子传递作用的纳米碳。使电子传递作用促进剂向纳米碳靠近或附着的方式没有特别限制。例如可以通过将纳米碳与电子传递作用促进剂混合(包括溶液中的混合)、或在纳米碳上配置电子传递作用促进剂来实施。向纳米碳靠近或附着地配置的电子传递作用促进剂可以被固定,也可以不被固定。固定只要不妨碍纳米碳及电子传递作用促进剂的功能就没有限制,可以从公知的方式中适当地选择使用。
在电子传递作用促进剂发生靠近或附着的纳米碳中,能够使用的纳米碳及电子传递促进剂如关于上述1.的记载所示。
3.电极
电极优选具有基板、且在该基板上装载有纳米碳、具有芳香环骨架的化合物、以及酶。纳米碳及具有芳香环骨架的化合物如上述1中记载所示。
具有芳香环骨架的化合物的装载量没有特别限制。具有芳香环骨架的化合物的装载量相对于纳米碳的装载量100质量份例如为0.001质量份以上,优选为0.01质量份以上,更优选为0.1质量份以上。另外,具有芳香环骨架的化合物的装载量相对于纳米碳的装载量100质量份例如为100000质量份以下,优选为10000质量份以下,更优选为1000质量份以下。所述下限及上限可以任意组合。另外,具有芳香环骨架的化合物的装载量相对于酶的装载量100质量份例如为0.001质量份以上,优选为0.01质量份以上,更优选为0.1质量份以上。另外,具有芳香环骨架的化合物的装载量相对于酶的装载量100质量份例如为1000000质量份以下,优选为100000质量份以下,更优选为10000质量份以下。所述下限及上限可以任意组合。
基板只要适合于生物传感器中利用的固定有酶的电极,就没有特别限制。例如,基板可以使用在绝缘性基板上形成有金属膜(例如金属薄膜)的基板。绝缘性基板例如可以使用玻璃基板或塑料基板(例如pet基板)。形成金属膜的金属的种类只要是电极中使用的金属,就没有特别限制。例如可以举出金、铂、以及钛等。另外,基板也可以不是形成有金属膜的基板,而是形成有碳膜(例如碳糊的薄膜)的基板。
酶优选伴随着催化反应游离出电子的酶。作为此种酶,例如可以举出氧化还原酶。作为氧化还原酶,例如可以举出葡糖脱氢酶、葡萄糖氧化酶、乳酸氧化酶、胆固醇氧化酶、醇氧化酶、肌氨酸氧化酶、果糖胺氧化酶(fructosylamineoxidase)、丙酮酸氧化酶、乳酸脱氢酶、醇脱氢酶、甘油氧化酶、甘油-3-磷酸氧化酶、尿酸酶、胆碱氧化酶、黄嘌呤氧化酶、以及羟基丁酸脱氢酶等。
在一个实施方式中,酶优选为葡糖脱氢酶,更优选为黄素结合型葡糖脱氢酶,进一步优选为以黄素腺嘌呤二核苷酸(fad)作为辅酶的葡糖脱氢酶(也称作“fadgdh”)。fadgdh在由多肽形成的三维结构的凹陷中保持fad,因此为了将其中生成的电子向电极传递,以往需要称作介质的物质。与之不同,通过使用纳米碳(优选为碳纳米管,更优选为单层碳纳米管),即使不利用介质,也能够将电子向电极传递。另外,通过利用上述的电子传递促进剂,能够格外有效地(或强力地)进行经由纳米碳的电子传递。
fadgdh的种类没有限制,可以使用任意的fadgdh。作为fadgdh的具体例,可以举出来自于下面的生物的任意一个的fadgdh:土曲霉(aspergillusterreus)、米曲霉(aspergillusoryzae)、黑曲霉(aspergillusniger)、臭曲霉(aspergillusfoetidus)、金黄曲霉(aspergillusaureus)、杂色曲霉(aspergillusversicolor)、白曲霉(aspergilluskawachii)、泡盛曲霉(aspergillusawamori)、根癌农杆菌(agrobacteriumtumefaciens)、海黄噬纤维菌(cytophagamarinoflava)、双孢蘑菇(agaricusbisporus)、粗鳞大环柄菇(macrolepiotarhacodes)、伯克霍尔德菌(burkholderiacepacia)、细孢毛霉(mucorsubtilissimus)、季也蒙毛霉(mucorguilliermondii)、普雷恩毛霉(mucorprainii)、爪哇毛霉(mucorjavanicus)、卷枝毛霉(mucorcircinelloides)、卷枝毛霉卷枝变型(mucorcircinelioidesf.cirinelloides)、冻土毛霉(mucorhiemalis)、冻土毛霉林生变型(mucorhiemalisf.silvaticus)、两型孢毛霉(mucordimorphosporus)、柱孢犁头霉(absidiacylindrospora)、透孢犁头霉(absidiahyalospora)、雅致放射毛霉(actinomucorelegans)、单卷霉(circinellasimplex)、安地卷霉(circinellaangarensis)、中华卷霉(circinellachinensis)、泪孢卷霉(circinellalacrymispora)、小卷霉(circinellaminor)、毛霉状卷霉(circinellamucoroides)、硬卷霉(circinellarigida)、伞形卷霉(circinellaumbellata)、蝇卷霉(circinellamuscae)、绿僵菌属(metarhiziumsp.)及菜豆炭疽菌属(colletotricumsp.)。
一个实施方式中优选的fadgdh为来自于米曲霉的fadgdh、来自于冻土毛霉的fadgdh、来自于细孢毛霉的fadgdh、来自于单卷霉的fadgdh、来自于绿僵菌属的fadgdh或来自于菜豆炭疽菌属的fadgdh,可以举出优选与序列号1~6的氨基酸序列具有80%以上的同源性、更优选与序列号1~6的氨基酸序列具有90%以上的同源性、进一步优选与序列号1~6的氨基酸序列具有95%以上的同源性、并且具有葡萄糖脱氢活性的fadgdh。氨基酸序列的同源性可以使用市售的或通过电通信线路(互联网)能够利用的分析工具算出,例如可以使用美国国家生物技术信息中心(ncbi)的相同性算法blast(basiclocalalignmentsearchtool)http://www.ncbi.nlm.nih.gov/blast/中默认(初始设定)的参数算出。需要说明的是,序列号1的氨基酸序列为来自于米曲霉的fadgdh的氨基酸序列,序列号2的氨基酸序列为来自于冻土毛霉的fadgdh的氨基酸序列,序列号3的氨基酸序列为来自于细孢毛霉的fadgdh的氨基酸序列,序列号4的氨基酸序列为来自于单卷霉的fadgdh的氨基酸序列,序列号5的氨基酸序列为来自于绿僵菌属的fadgdh的氨基酸序列,序列号6的氨基酸序列为来自于菜豆炭疽菌属的fadgdh的氨基酸序列。
可以在基板上还装载有分散剂。分散剂只要是能够抑制基板上的纳米碳的凝聚、使之分散的物质,就没有特别限制。作为分散剂,例如可以举出胆酸钠、脱氧胆酸钠、十二烷基硫酸钠、十二烷基苯磺酸钠、十六烷基三甲基溴化铵、辛基苯酚乙氧基化物等。在一个实施方式中,优选的分散剂为胆酸钠、脱氧胆酸钠。
纳米碳、具有芳香环骨架的化合物、以及酶可以利用任意的方式装载于基板。例如,制备分别分散或溶解有这些物质的溶液,将它们依次向基板上的给定部位(在基板为在绝缘性基板上形成有金属薄膜的基板的情况下,是形成有金属薄膜的场所)滴下,使之干燥,通过反复进行该操作,能够进行装载。作为分散介质或溶剂,没有特别限制,可以举出水、醇系溶剂(例如乙醇)、酮系溶剂(例如丙酮)、它们的组合。
装载的顺序是任意的,然而在一个实施方式中,优选依照纳米碳→酶→具有芳香环骨架的化合物、或纳米碳→具有芳香环骨架的化合物→酶的顺序进行装载。
纳米碳、具有芳香环骨架的化合物、酶的使用量没有特别限制。
在一个实施方式中,纳米碳、具有芳香环骨架的化合物、以及酶可以固定化于基板。固定化可以适当地选择公知的方法实施。例如,将溶解有四氟乙烯/全氟[2-(氟磺酰基乙氧基)聚乙烯基醚]共聚物(例:nafion(商标))及羧甲基纤维素等适于固定化的物质的液体向基板上的装载有上述各物质的部位滴下、并使之干燥,由此可以进行固定化。在一个实施方式中,优选在将纳米碳、具有芳香环骨架的化合物、以及酶装载于基板后,以将这些物质覆盖的方式利用羧甲基纤维素等聚合物物质进行处理。
在一个实施方式中,优选将分散剂配合于分散有纳米碳的分散液中。分散剂的配合比例是任意的,然而例如优选配合0.2~2%(w/v)。需要说明的是,纳米碳的配合比例也是任意的,然而例如优选配合0.05~0.5%(w/v)。
4.传感器
传感器优选包含上述3的电极。在一个实施方式中,传感器优选包含上述3的电极作为作用电极。传感器优选在作用电极以外还具有对电极(反电极,counterelectrode)。传感器可以还具备恒电位仪及电流检测电路等生物传感器通常具备的构成。对于反电极、恒电位仪、以及电流检测电路等的具体构成而言,只要能够实现传感器的目标测定,即为任意的构成,可以从该技术领域中公知的方式中适当地选择设计。
在一个实施方式中传感器所包含的作用电极可以是从上述3的电极中去除具有芳香环骨架的化合物的电极。在使用此种作用电极的情况下,浸渍各电极的溶剂(包含测定对象物质或基质的溶剂)优选包含具有芳香环骨架的化合物。作为溶剂,在典型的情况下,可以举出缓冲液,作为其例子,可以举出乙酸盐缓冲液、柠檬酸盐缓冲液、磷酸盐缓冲液、硼酸盐缓冲液等。
溶剂中的测定对象物质或基质的浓度没有特别限定,可以设定为测定中所必需的任意的浓度。
溶剂中的具有芳香环骨架的化合物的浓度没有特别限定。所述浓度的下限例如为0.000001%(w/v),优选为0.000005%(w/v),更优选为0.00001%(w/v),更优选为0.00005%(w/v),更优选为0.0001%(w/v),更优选为0.0005%(w/v),更优选为0.001%(w/v),更优选为0.005%(w/v),更优选为0.01%(w/v)。所述浓度的上限例如为2%(w/v),优选为1.5%(w/v),更优选为1%(w/v)。所述浓度的下限及上限可以任意地组合。
使用这些传感器能够进行目的物的检测、测定。
[实施例]
以下,利用实施例对本发明进一步详细说明,然而本发明不受它们限制。
实施例1
使用在pet基板蒸镀有金的片,制作出具有9mm2的作用电极部位的电极头(图1)。图1中,“1”为pet膜,“2”为粘合片,“3”为蒸镀有金的pet膜,“4”表示作用电极部位。向该作用电极部位滴下包含2%(w/v)的胆酸钠及0.15%(w/v)的单层碳纳米管(superpuretubes、nanointegris公司、外径1.1~1.7nm)的水分散液5μl并使之干燥。在碳纳米管分散液的干燥后,向作用电极部位滴下溶解于超纯水中的fadgdh(具有序列号2的氨基酸序列;20u/μl)5μl并使之干燥。在fadgdh液的干燥后,向作用电极部位滴下下述的(1)或(2)的化合物(各1%(w/v)溶液)5μl并使之干燥。
(1)百里酚(溶解于50%(v/v)乙醇中)
(2)苯酚(溶解于40mm磷酸钠缓冲液中)
在化合物液的干燥后,向作用电极部位滴下3%(w/v)nafion液5μl,使之干燥,将碳纳米管及fad-gdh固定化于作用电极。在电化学分析仪(als/chi660b、abs(株)公司制)的作用极安放上文中制作出的电极头,在参照电极安放银/氯化银电极,在对电极安放铂线。将该3个电极浸渍于40mm磷酸钠缓冲液(ph7.4)中。在未向该缓冲液中添加葡萄糖(0mm)、或以达到10mm或48mm的方式添加葡萄糖的情况下,实施利用循环伏安法的测定。
将在葡萄糖浓度0mm、10mm、48mm条件下分别测定出的循环伏安图表示于图2及图3中。图2是使用了百里酚的情况,图3是使用了苯酚的情况。
在该循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表1所示。
[表1]
比较例1
除了将实施例1的化合物(1)变更为下述的化合物(3)或(4)以外,与实施例1同样地测定出循环伏安图。
(3)薄荷醇(溶解于50%(v/v)乙醇中)
(4)环己醇(溶解于40mm磷酸钠缓冲液中)
将结果表示于图4(薄荷醇)、图5(环己醇)、以及图6(未添加化合物)中。图4~6所示的循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表2所示。
[表2]
根据实施例1与比较例1的结果判明,即使在仅将酶和碳纳米管固定化于作用电极部位时无法测定电流的条件下,也可以通过添加百里酚或苯酚来测定电流。另一方面判明,在取代百里酚及苯酚而使用薄荷醇、环己醇的情况下,无法测定电流。
实施例2
与实施例1同样地使用在pet基板蒸镀有金的片,制作出具有9mm2的作用电极部位的电极头。向该作用电极部位滴下包含2%(w/v)的胆酸钠及0.15%(w/v)的单层碳纳米管(外径1.1~1.7nm)的水分散液5μl并使之干燥。在碳纳米管分散液的干燥后,向作用电极部位滴下溶解于超纯水中的fadgdh(具有序列号2的氨基酸序列;20u/μl)5μl并使之干燥。在fadgdh液的干燥后,向作用电极部位滴下3%(w/v)nafion液5μl,并使之干燥,将碳纳米管、fadgdh固定化于作用电极。
然后,向40mm磷酸钠缓冲液(ph7.4)中添加溶解0.1%(w/v)的以下的(5)~(10)的任意种化合物。
(5)苯酚
(6)双(4-羟基苯基)砜
(7)酪氨酸二钠水合物
(8)水杨酸钠
(9)甲苯
(10)5-羟基吲哚
在电化学分析仪(als/chi660b)的作用极安放上文中制作出的电极,在参照电极安放银/氯化银电极,在对电极安放铂线,浸渍于溶解有上述(5)~(10)的任意种化合物的磷酸钠缓冲液中。在未向该缓冲液中添加葡萄糖(0mm)、或以达到10mm或48mm的方式添加葡萄糖的情况下,实施了利用循环伏安法的测定。在所得的循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表3所示。
[表3]
如上所述,确认即使将百里酚或苯酚变更为上述(5)~(10)的化合物,也可以观测到实施例1中测定的电流。
比较例2
除了将上述(5)~(10)的任意种化合物替换为上述(3)或(4)的化合物以外,与实施例2同样地得到循环伏安图。在所得的循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表4所示。
[表4]
如上所述,确认在实施例2的构成中,若不添加化合物(5)~(10)或将它们置换为薄荷醇或环己醇,则实质上无法测定出电流。
化合物(1)、(2)、(5)~(10)均具有芳香环骨架,然而化合物(3)及(4)不具有芳香环骨架。由此可以认为,化合物(1)、(2)、(5)~(10)因具有芳香环骨架,而成为作为辅酶的fad与碳纳米管之间的授受电子的媒介,并促进电子的授受。
实施例3
使用在pet基板印刷有碳糊的片,制作出具有9mm2的作用电极部位的电极头(图7)。图7中,“5”为pet膜,“6”为粘合片,“7”为印刷有碳糊的pet膜,“8”表示作用电极部位。向该作用电极部位滴下包含2%(w/v)的胆酸钠的0.15%(w/v)的单层碳纳米管(外径1.1~1.7nm)的水分散液5μl并使之干燥。在碳纳米管分散液的干燥后,向作用电极部位滴下溶解于超纯水中的fadgdh(具有序列号2中记载的氨基酸序列;20u/μl)5μl并使之干燥。在fadgdh液的干燥后,向作用电极部位滴下1%(w/v)羧甲基纤维素液5μl并使之干燥,将碳纳米管、fad-gdh固定化于作用电极。将溶解于50%(v/v)乙醇中的5%(w/v)百里酚溶液以使百里酚达到0.1%(w/v)的方式向40mm磷酸钠缓冲液(ph7.4)中添加混合。
在电化学分析仪(als/chi660b)的作用极安放上文中制作出的电极,在参照电极安放银/氯化银电极,在对电极安放铂线,浸渍于包含0.01%(w/v)百里酚的磷酸钠缓冲液中。在未向该缓冲液中添加葡萄糖(0mm)、或以达到10mm或48mm的方式添加葡萄糖的情况下,实施了利用循环伏安法的测定。将所得的循环伏安图表示于图8中。在该循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表5所示。
[表5]
比较例3
除了未向40mm磷酸钠缓冲液(ph7.4)中添加百里酚以外,与实施例3同样地实施了利用循环伏安法的测定。将所得的循环伏安图表示于图9中。在该循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表6所示。
[表6]
如实施例3及比较例3所示,确认通过不将百里酚固定化于电极,而是使缓冲液中含有百里酚,也能够进行电流的测定。该结果证实,具有芳香环骨架的化合物成为作为辅酶的fad与碳纳米管之间的授受电子的媒介,并促进电子的授受。
实施例4
与实施例1同样地使用在pet基板蒸镀有金的片,制作出具有9mm2的作用电极部位的电极头。向该作用电极部位滴下包含2%(w/v)的胆酸钠及0.15%(w/v)的单层碳纳米管(外径1.1~1.7nm)的水分散液5μl并使之干燥。在碳纳米管分散液的干燥后,向作用电极部位滴下溶解于超纯水中的fadgdh(具有序列号2的氨基酸序列;20u/μl)5μl并使之干燥。
在fadgdh液的干燥后,向作用电极部位滴下3%(w/v)nafion液5μl并使之干燥,将碳纳米管及fadgdh固定化于作用电极。
然后,将溶解于100%乙醇中的10%(w/v)百里酚溶液添加到40mm磷酸钠缓冲液(ph7.4)中,制备出4种浓度(0.00001、0.0001、0.001、0.01(w/v))的含有百里酚的缓冲液。
在电化学分析仪(als/chi660b)的作用极安放上文中制作出的电极头,在参照电极安放银/氯化银电极,在对电极安放铂线,浸渍于上述任意种浓度的含有百里酚的缓冲液、或40mm磷酸钠缓冲液(ph7.4)中,实施了利用循环伏安法的测定。将在葡萄糖浓度0mm、10mm、48mm条件下分别测定的循环伏安图表示于图10~图14中。对于百里酚浓度(w/v)而言,图10为0%的情况,图11为0.00001%的情况,图12为0.0001%的情况,图13为0.001%的情况,图14为0.01%的情况。
在该循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表7所示。
[表7]
如上所述,判明即使在仅将酶和碳纳米管固定化于作用电极部位时无法测定电流的条件下,也可以通过向缓冲液中添加极少量(0.00001%(w/v))的百里酚来测定电流。另外判明,通过向缓冲液中以达到0.001%(w/v)的方式添加百里酚,可以测定因添加百里酚而得到的最大电流值的6成以上的电流值。
实施例5
向40mm磷酸钠缓冲液(ph7.4)中以达到0.1%(w/v)的方式添加溶解以下的(11)~(14)的任意种化合物。
(11)苯胺
(12)邻甲酚
(13)间甲酚
(14)对甲酚
将与实施例1同样地制作出的电极头安放于电化学分析仪(als/chi660b)的作用极,在参照电极安放银/氯化银电极,在对电极安放铂线,浸渍于上述溶解有苯胺的磷酸钠缓冲液、或40mm磷酸钠缓冲液(ph7.4)中。在未向该缓冲液中添加葡萄糖(0mm)、或以达到48mm的方式添加葡萄糖的情况下,实施了利用循环伏安法的测定。在所得的循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表8所示。
[表8]
如上所述,判明即使在仅将酶和碳纳米管固定化于作用电极部位时无法测定电流的条件下,也可以通过添加(11)~(14)的化合物来测定电流。
实施例6
与实施例1同样地使用在pet基板蒸镀有金的片,制作出具有9mm2的作用电极部位的电极头。向该作用电极部位滴下包含2%(w/v)的胆酸钠及0.15%(w/v)的单层碳纳米管(外径1.1~1.7nm)的水分散液5μl并使之干燥。在碳纳米管分散液的干燥后,向作用电极部位滴下溶解于超纯水中的fadgdh(具有序列号2的氨基酸序列;20u/μl)5μl并使之干燥。在fadgdh液的干燥后,向作用电极部位滴下下述(15)~(33)的化合物(各1%(w/v)液)5μl并使之干燥。
(15)醌茜隐色体(溶解于80%(v/v)丙酮中)
(16)香芹酚(溶解于50%(v/v)乙醇中)
(17)1,5-萘二酚(溶解于50%(v/v)乙醇中)
(18)4-异丙基-3-甲基苯酚(溶解于50%(v/v)乙醇中)
(19)2-异丙基苯酚(溶解于50%(v/v)乙醇中)
(20)4-异丙基苯酚(溶解于50%(v/v)乙醇中)
(21)1-萘酚(溶解于50%(v/v)乙醇中)
(22)2-叔丁基-5-甲基苯酚(溶解于50%(v/v)乙醇中)
(23)2,4,6-三甲基苯酚(溶解于50%(v/v)乙醇中)
(24)2,6-二异丙基苯酚(溶解于50%(v/v)乙醇中)
(25)2-叔丁基-4-乙基苯酚(溶解于50%(v/v)乙醇中)
(26)6-叔丁基-2,4-二甲苯酚(溶解于50%(v/v)乙醇中)
(27)2-叔丁基-4-甲基苯酚(溶解于50%(v/v)乙醇中)
(28)2-叔丁基-6-甲基苯酚(溶解于50%(v/v)乙醇中)
(29)2,4-二叔丁基苯酚(溶解于50%(v/v)乙醇中)
(30)2,4-二叔丁基-5-甲基苯酚(溶解于50%(v/v)乙醇中)
(31)双(对羟基苯基)甲烷(溶解于50%(v/v)乙醇中)
(32)3-叔丁基苯酚(溶解于50%(v/v)乙醇中)
(33)2-异丙基-5-甲基茴香醚(溶解于80%(v/v)乙醇中)
在(15)~(33)的化合物液的干燥后,向作用电极部位滴下3%(w/v)nafion液5μl,并使之干燥,将碳纳米管、fadgdh固定化于作用电极。
在电化学分析仪(als/chi660b)的作用极安放上文中制作出的电极头,在参照电极安放银/氯化银电极,在对电极安放铂线。将该3个电极浸渍于40mm磷酸钠缓冲液(ph7.4)中。在向该缓冲液中不添加葡萄糖(0mm)、或以达到48mm的方式添加葡萄糖的情况下,实施了利用循环伏安法的测定。在所得的循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表9所示。
[表9]
比较例4
除了将上述(15)~(33)的化合物替换为下述(34)的化合物以外,与实施例3同样地测定出循环伏安图。
(34)戊间二烯(piperylene)(溶解于100%丙酮中)
在所得的循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表10所示。
[表10]
根据实施例6与比较例4的结果判明,即使在仅将酶和碳纳米管固定化于作用电极部位时无法测定电流的条件下,也可以通过添加(15)~(33)的化合物来测定电流。另一方面判明,在添加了化合物(34)的情况下无法测定电流。
化合物(15)~(33)均具有芳香环骨架,而化合物(34)虽然具有π电子,但不具有芳香环骨架。由此可以认为,化合物(15)~(33)因具有芳香环骨架,而成为作为辅酶的fad与碳纳米管之间的授受电子的媒介,并促进电子的授受。
实施例7
与实施例1同样地使用在pet基板蒸镀有金的片,制作出具有9mm2的作用电极部位的电极头。向该作用电极部位滴下包含2%(w/v)的胆酸钠及0.092%(w/v)的多层碳纳米管(nc7000、nanocyl公司、外径5~15nm)的水分散液8.2μl并使之干燥。在碳纳米管分散液的干燥后,向作用电极部位滴下溶解于超纯水中的fadgdh(具有序列号2中记载的氨基酸序列;20u/μl)5μl并使之干燥。在fadgdh液的干燥后,向作用电极部位滴下3%(w/v)nafion液5μl并使之干燥,将碳纳米管、fad-gdh固定化于作用电极。将溶解于100%乙醇中的10%(w/v)百里酚溶液以达到0.01%(w/v)的方式添加混合到40mm磷酸钠缓冲液(ph7.4)中。
在电化学分析仪(als/chi660b)的作用极安放上文中制作出的电极头,在参照电极安放银/氯化银电极,在对电极安放铂线,浸渍于包含0.01%(w/v)百里酚的磷酸钠缓冲液中,实施了利用循环伏安法的测定。将在葡萄糖浓度0mm、10mm、48mm条件下分别测定出的循环伏安图表示于图15中。在该循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表11所示。
[表11]
比较例5
除了未向40mm磷酸钠缓冲液(ph7.4)中添加百里酚以外,与实施例4同样地实施了利用循环伏安法的测定。将所得的循环伏安图表示于图16中。在该循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表12所示。
[表12]
如实施例7及比较例5所示,确认在使用了多层碳纳米管的情况下,通过使缓冲液中含有百里酚,也能够进行电流的测定。
实施例8
与实施例1同样地使用在pet基板蒸镀有金的片,制作出具有9mm2的作用电极部位的电极头。向该作用电极部位滴下包含2%(w/v)的胆酸钠及0.15%(w/v)的单层碳纳米管(外径1.1~1.7nm)的水分散液5μl、或包含2%(w/v)的胆酸钠及0.092%(w/v)的多层碳纳米管(外径5~15nm)的水分散液8.2μl并使之干燥。在碳纳米管分散液的干燥后,向作用电极部位滴下溶解于超纯水中的葡萄糖氧化酶(20u/μl)5μl并使之干燥。在葡萄糖氧化酶液的干燥后,向作用电极部位滴下3%(w/v)nafion液5μl并使之干燥,将碳纳米管、葡萄糖氧化酶固定化于作用电极。将溶解于100%乙醇中的10%(w/v)百里酚溶液以达到0.01%(w/v)的方式添加混合到40mm磷酸钠缓冲液(ph7.4)中。
在电化学分析仪(als/chi660b)的作用极安放上文中制作出的电极头,在参照电极安放银/氯化银电极,在对电极安放铂线,浸渍于包含0.01%(w/v)百里酚的磷酸钠缓冲液中,实施了利用循环伏安法的测定。将在葡萄糖浓度0mm、10mm、48mm条件下分别测定出的循环伏安图表示于图17(单层碳纳米管)、图18(多层碳纳米管)中。在该循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表13所示。
[表13]
比较例6
除了未向40mm磷酸钠缓冲液(ph7.4)中添加百里酚以外,与实施例8同样地实施了利用循环伏安法的测定。将所得的循环伏安图表示于图19(单层碳纳米管)、图20(多层碳纳米管)中。在该循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表14所示。
[表14]
如实施例8及比较例6所示,确认在使用了单层碳纳米管及多层碳纳米管的任意种的情况下,通过使缓冲液中含有百里酚,电流值也会增大。
实施例9
与实施例1同样地使用在pet基板蒸镀有金的片,制作出具有9mm2的作用电极部位的电极头。向该作用电极部位滴下包含2%(w/v)的胆酸钠及0.15%(w/v)的单层碳纳米管(外径1.1~1.7nm)的水分散液5μl、或包含2%(w/v)的胆酸钠及0.092%(w/v)的多层碳纳米管(外径5~15nm)的水分散液8.2μl并使之干燥。在碳纳米管分散液的干燥后,向作用电极部位滴下溶解于超纯水中的乳酸氧化酶(具有序列号7的氨基酸序列;20u/μl)5μl并使之干燥。在乳酸氧化酶液的干燥后,向作用电极部位滴下3%(w/v)nafion液5μl并使之干燥,将碳纳米管、乳酸氧化酶固定化于作用电极。将溶解于100%乙醇中的10%(w/v)百里酚溶液以达到0.01%(w/v)的方式添加混合到40mm磷酸钠缓冲液(ph7.4)中。
在电化学分析仪(als/chi660b)的作用极安放上文中制作出的电极头,在参照电极安放银/氯化银电极,在对电极安放铂线,浸渍于包含0.01%(w/v)百里酚的磷酸钠缓冲液中,实施了利用循环伏安法的测定。将在乳酸浓度0mm、5mm、12mm条件下分别测定出的循环伏安图表示于图21(单层碳纳米管)、图22(多层碳纳米管)中。在该循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表15所示。
[表15]
比较例7
除了未向40mm磷酸钠缓冲液(ph7.4)中添加百里酚以外,与实施例8同样地实施了利用循环伏安法的测定。将所得的循环伏安图表示于图23(单层碳纳米管)、图24(多层碳纳米管)中。在该循环伏安图中从-0.8v向+0.8v扫描时的+0.6v的电流值如下述表16所示。
[表16]
如实施例9及比较例7所示,确认在使用了单层碳纳米管及多层碳纳米管的任意种的情况下,通过使缓冲液中含有百里酚,电流值也会增大。
- 还没有人留言评论。精彩留言会获得点赞!