离子导体
离子导体
1.本发明涉及用于电化学装置(例如燃料电池和电解槽)中的新的固体离子传导材料、制造这种材料的方法以及使用这种材料层的电化学装置。特别地,本发明涉及使用具有合适的结构和反应性的各种陶瓷氧化物的羟基氧化物和/或水合氧化物作为固体离子传导材料,其因此可以被描述为陶瓷离子传导材料。在一些实施方式中,材料可以是纯的或主要是离子导体,并且可以用作电解质,该材料可以被描述为电解质材料。在其他实施方式中,材料可以提供混合的离子传导和电子传导,并且可以适合作为电极材料。
2.离子传导材料被用作电化学装置(例如燃料电池、电解槽、蓄电池、液流电池、电化学合成池、气体分离池和传感器)中的离子传导材料,例如电解质。电化学装置的挑战通常包括较差的耐久性和高成本;两个挑战都与所用材料有关。稳固且低成本的固体离子传导材料的开发将使耐久性得到改善并且成本得到降低,使得大规模应用在经济上是可行的。电解质是研究的具体焦点,但是应当理解,作为电解质的用途仅是离子传导材料在电化学装置中的广泛用途的一个实例。
3.例如,在用于电动车辆的燃料电池领域中,广泛使用质子交换膜燃料电池(pemfc)(例如,由toyota mirai和hyundai ix35开发的)。然而,由于在阴极侧产生的h2o2的氧化和pt电极扩散到聚合物膜中引起短路,因此通常被认为是现有可用的最佳膜的膜电解质是不稳定的。使用膜的氢燃料电池的寿命一般小于2000小时,这对于具有大约10年的典型寿命的车辆来说是不理想的。的成本也非常高(通常在800美元/平方米左右)。因此,期望的是找到较低成本的膜。此外,因为是聚合物膜,它不是非常致密的。因此,在氢燃料电池的阳极处的h2可以扩散穿过膜到达阴极。这将导致阴极处的氢损失。由于氢是易燃的,这可能导致潜在的安全问题以及降低效率。因此,期望开发更致密的膜来替换聚合物膜,理想的是同时保持膜的柔性。类似地,在液流电池中,跨膜的钒离子的交叉扩散可能导致自放电,因此降低效率。
4.对于不同的燃料电池类型,已经研究了基于传导oh-离子的聚合物电解质的碱性膜作为碱性膜燃料电池(amfc)的电解质。所报道的碱性膜的低稳定性限制了amfc的应用。因此,期望发现稳固的oh-离子传导膜以用作新碱性燃料电池的电解质。用固体电解质替换常规碱性燃料电池中的液体koh溶液电解质还可促进使用空气(不去除co2)作为阴极处的氧化剂,从而降低运行成本。这同样适用于一些金属-空气电池,例如,目前使用koh溶液作为电解质的zn-空气电池。
5.技术人员将理解,也可以列出电化学合成、废水处理、气体分离等领域中的许多其他实例,从而强调对于改善的h
+
和oh-离子传导材料的期望。因此,对于用作电解质的新的离子传导材料存在期望。
6.根据本发明的第一方面,提供了一种用于电化学装置的固体电解质,所述电解质包含源自具有钙钛矿或钙铁石结构的氧化物的羟基氧化物。该羟基氧化物具有以下通式:
7.(a
1-x
a’x
)
1-ab1-yby
(o
3-z-dcz
)(oh)m·
nh2o;其中:
8.a和a’选自ca、sr、ba、ln、y、na、k、rb、cs、pb和bi;
9.b和b’选自co、fe、mn、in、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、
mo、w和ta,并且包括ti、v、cr、mn、fe、co、ni和cu中的至少一种;
10.c选自n、cl、f、br、s和se;
11.0≤x≤1;0≤y≤1;a≤0.15;z≤0.2;d≤2;m≥0.01;并且n≥0.
12.b和b’可选自co、fe、mn、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w和ta。特别地,铟可以被排除,因为与其他组成相比,铟的性质可能不符合相对较高的成本。b和b’两者可选自以下元素:sc、ti、v、cr、mn、fe、co、ni、cu和zn。b和b”可以包括mn、fe、co、ni和cu中的至少一种,并且可选地,b和b’中的至少一种是钴(co)或铁(fe)。
13.可选地,a和a’中的至少一个可以是锶(sr)。
14.示例性材料包括sr2fe2o5和srco
0.5
ti
0.5o3-δ
。
15.当n=0时,羟基氧化物可被描述为无水的。当n》0时,羟基氧化物可被描述为水合的。
16.制备电解质材料的具有钙钛矿或钙铁石结构的氧化物可称为起始材料。可选地,起始材料可具有钙铁石结构,并且可以是sr2co2o5,更精确地为sr2co2o5±
δ
,或sr2fe2o5,更精确地为sr2fe2o5±
δ
。因此,电解质可包含分别源自钙铁石结构的sr2co2o5±
δ
或sr2fe2o5±
δ
的羟基氧化物。可以选择缺氧的钙铁石结构的氧化物(即o
5-δ
)。可选地,起始材料可以具有钙钛矿结构,并且可以是srcoo3,更精确地为srcoo
3-δ
,或srfeo3,更精确地为srfeo
3-δ
。因此,电解质可包含分别源自钙钛矿结构的srcoo
3-δ
或srfeo
3-δ
的羟基氧化物。当使用钙钛矿结构的氧化物时,可以选择缺氧的钙钛矿结构的氧化物(即,δ》0,o
3-δ
,与在各个实施方式中接受的
±
δ的钙铁石结构的氧化物不同)。
17.m的值可以为0.01至2,可选地为0.2至1.5,进一步可选地为0.5至1。n的值可以为0至12,可选地为0.1至2,进一步可选地为0.2至1.5。
18.具有钙钛矿或钙铁石结构的氧化物可以是以下中的一种或多种:
19.(i)sr2co2o5±
δ
;(ii)sr2co2o
5-xnx
;(iii)ca2co2o5±
δ
;(iv)srcoo
3-δ
;(v)cacoo
3-δ
;(vi)srcafecoo5±
δ
;(vii)srcaco2o5±
δ
;或(viii)srco
0.5
ti
0.5o3-δ
;(ix)sr2fe2o5±
δ
;(x)sr2fe2o
5-xnx
;(xi)ca2fe2o5±
δ
;或(xii)srcafe2o5±
δ
。
20.因此,a位点和/或b位点可以被混合元素占据,并且氧化物可以是纯氧化物(没有氧之外的其他c位点元素)或掺杂氧化物(例如,如上面的实例(ii)列出的氧氮化物)。
21.起始材料可包含单一氧化物组成(不算杂质),或根据以上标准选择的多种不同氧化物。
22.羟基氧化物(它是无水的或水合的)形成电解质的主要成分,并且可选地可形成电解质的唯一离子传导材料。在一些情况下,电解质可由羟基氧化物材料组成(不算任何杂质或其余粘合剂材料)。
23.根据第二方面,提供了一种用于电化学装置的固体电解质,所述电解质包含源自具有钙铁石结构的氧化物的水合氧化物。所述水合氧化物具有以下通式:
24.(a
2-x
a’x
)
1-ab2-yby
(o
1-zcz
)5±
δ
·
n’h2o,其中:
25.a和a’选自ca、sr、ba、ln、y、na、k、rb、cs、pb和bi;
26.b和b’选自co、fe、mn、ni、cu、zn、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w和ta;
27.c选自n、cl、f、br、s和se;
28.a≤0.15;0≤x≤1;0≤y≤1;z≤0.04;并且n’≥0.01。
29.a的值可以小于或等于0.10。如针对第一方面所列出的,可以进行组成的更窄选择。
30.具有钙铁石结构的氧化物可以是以下中的一种或多种:
31.(i)sr2fe2o5;(ii)sr2co2o5;或(iii)sr2co2o
5-xnx
;(iv)sr2fecoo5;或(v)sr2fe2o
5-xnx
。
32.起始材料可包含单一氧化物组成(不算杂质),或根据以上标准选择的多种不同氧化物。水合氧化物形成电解质的主要成分,并且可选地形成电解质的唯一离子传导材料。在一些情况下,电解质可由水合氧化物材料组成(不算任何杂质)。
33.根据第三方面,提供了一种用于电化学装置的固体电解质,所述电解质包含源自具有钙钛矿结构的氧化物的水合氧化物,所述水合氧化物具有以下通式:
34.(a
1-x
a’x
)
1-ab1-y
b’yo3-z-d’cz·
n”h2o,其中:
35.a和a’选自ca、sr、ba、ln、y、na、k、rb、cs、pb和bi;
36.b和b’选自co、fe、mn、in、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w和ta,并且包括ti、v、cr、mn、fe、co、ni和cu中的至少一种;
37.c选自n、cl、f、br、s和se;0≤x≤1;0≤y≤1;a≤0.15;z≤0.2;d≤2;并且n”≥0.01。
38.a的值可以小于或等于0.1。如针对第一方面所列出的,可以进行组成的较窄选择。例如,具有钙钛矿结构的氧化物可以是以下中的一种或多种:srcoo
3-δ
;或srco
0.5
ti
0.5o3-δ
。可以选择缺氧的钙钛矿结构的氧化物。
39.起始材料可包含单一氧化物组成(不算杂质),或根据以上标准选择的多种不同氧化物。水合氧化物形成电解质的主要成分,并且可选地形成电解质的唯一离子传导材料。在一些情况下,电解质可由水合氧化物材料组成(不算任何杂质)。
40.根据第四方面,提供了一种用于电化学装置的固体电解质,所述电解质包含源自具有k4cdcl6结构的氧化物的水合氧化物,或水合或非水合羟基氧化物。具有k4cdcl6结构的氧化物具有以下通式:
41.(a
1-x
a’x
)3b
2-y
b’yo6-zcz
,其中:
42.a和a’选自ca、sr、ba、na、k、rb、cs、ln、y、pb和bi;
43.b和b’选自co、fe、mn、ni、cu、ti、v、cr、碱土金属、镧系元素、y、zn、cd、na、b、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、ta、pt、ir和ru,并且包括元素ti、v、cr、mn、fe、co、ni和cu中的至少一种;
44.c选自n、cl、f、br、s和se;
45.y为0至2;z为0至0.5;并且x为0至1。
46.b和b’可选自co、fe、mn、ni、cu、ti、v、cr、碱土金属、镧系元素、y、zn、cd、na、b、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w和ta。特别地,可以排除pt、ir和ru,因为它们的成本可能太高。b和b’中的至少一个可选自co、fe、mn、ni和cu。
47.氧化物可以是ca3co2o6。固体电解质可包含具有以下通式的水合氧化物:(a
1-x
a’x
)3b
2-y
b’yo6-zcz
·
nh2o,其中n大于或等于0.01,x为0至1,y为0至2,并且z为0至0.5。
48.固体电解质可包含具有以下通式的羟基氧化物:
49.(a
1-x
a’x
)3b
2-y
b’yo6-zcz
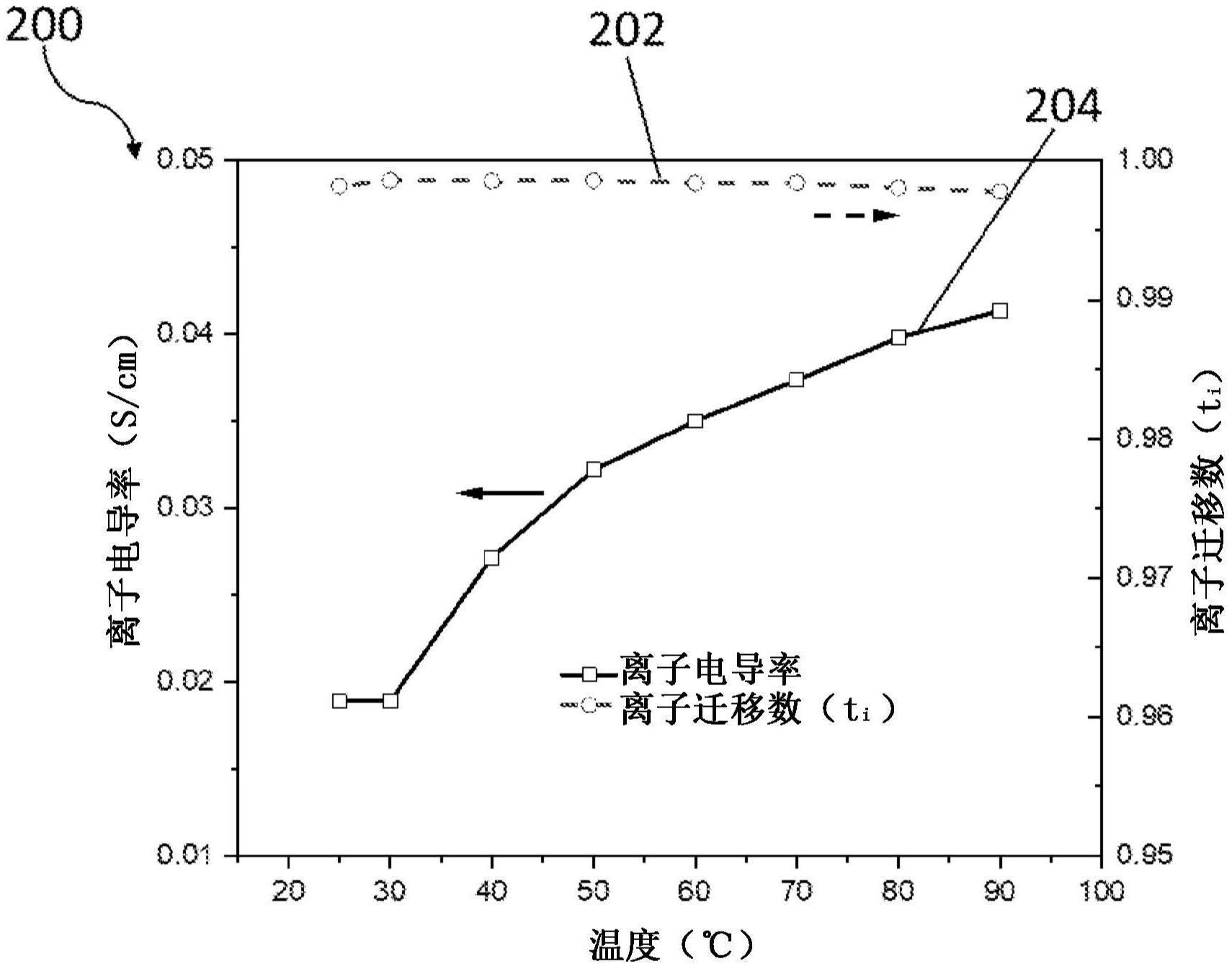
(oh)m·
nh2o,其中x为0至1,y为0至2,z为0至0.5,并且m为0.01至6。对于水合羟基氧化物,n的值可以大于或等于0.01。
50.起始材料可包含单一氧化物组成(不算杂质),或根据以上标准选择的多种不同氧化物。羟基氧化物或水合氧化物通常形成电解质的主要成分,并且可选地形成电解质的唯一离子传导材料。在一些情况下,电解质可由羟基氧化物或水合氧化物材料组成(不算任何杂质)。
51.如前述方面中的任一项所述的固体电解质可以是纯陶瓷电解质。
52.如前述方面中的任一项所述的固体电解质可以作为替代是复合电解质,其包含与一种或多种聚合物混合的如上所述的至少一种水合氧化物或水合或非水合(无水)羟基氧化物。复合电解质可以包含多种不同的聚合物。复合电解质可以是柔性膜的形式。复合电解质可包含1体积%至99体积%的至少一种水合氧化物或水合或非水合羟基氧化物,可选地10体积%至80体积%,进一步可选地30体积%至50体积%。陶瓷的体积%可以至少是30-33%。陶瓷的体积%可以至多为85%。复合材料的密度可以显著高于其聚合物成分的密度。聚合物可以是或包括亲水性聚合物。聚合物的主要组成可以是亲水性的(例如,超过50体积%,并且可选地超过70体积%或90体积%)。可以包含少量的疏水性聚合物,例如ptfe。可以选择聚合物,使得陶瓷-聚合物复合材料总体上是亲水性的,以促进水扩散到复合材料中以润湿陶瓷成分。
53.根据第五方面,提供了一种制造用于电化学装置的固体电解质的方法,所述方法包括:
54.获取陶瓷氧化物材料,其中,所述陶瓷氧化物材料是具有钙钛矿、钙铁石或k4cdcl6结构的氧化物,并且包括选自ca、sr、ba、ln、y、na、k、rb、cs、pb和bi的一种或多种元素的a位点离子和选自co、fe、mn、in、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、ta、pt、ir和ru的一种或多种元素的b位点离子;
55.通过以下步骤将另外的氧空位引入所获取的陶瓷氧化物材料中:
56.(i)在具有比空气更低的氧气分压的气氛中煅烧陶瓷氧化物材料;
57.(iii)将陶瓷氧化物材料浸泡在还原性液体中;或者
58.(iv)电化学还原经煅烧的陶瓷氧化物材料;以及
59.用水处理所述陶瓷氧化物材料,所述处理包括将经煅烧的陶瓷氧化物材料浸泡在水中,或将其暴露于具有至少1体积%的水的气氛中,以形成水合氧化物或水合或非水合羟基氧化物。
60.所形成的电解质可如关于前述方面中的任一项所述,因此可使用上文所描述的标准相应地选择所获取的陶瓷氧化物材料的a位点离子和b位点离子。
61.具有比空气更低的氧气分压的气氛可具有小于或等于0.01atm的氧气分压(po2)。
62.在一些实施方式中,具有比空气更低的氧气分压的气氛可基本上不含氧气。具有比空气更低的氧气分压的气氛可以是:(i)惰性气氛(例如氮气或氩气);或(ii)还原性气氛(例如氢气,或惰性气体和还原性气体的混合物,例如5体积%h2/ar)。另选地,气氛可包括惰性气体与氧气或空气的混合物。应当理解,用于市售ar或n2的典型po2是非零的,并且通常是约0.00001atm(10-5
atm)。因此,“惰性”气氛可包括痕量氧气。还原性气氛中的任何痕量氧气可能在煅烧期间燃烧掉。在具有比空气更低的氧气分压的气氛中煅烧陶瓷氧化物材料的
实施方式中,可以选择200℃至1200℃的煅烧温度,可选地为300℃至1000℃,进一步可选地为400℃至800℃。
63.所获取的陶瓷氧化物材料可以是以下中的至少一种:
64.(i)具有钙钛矿结构的氧化物,其可选地可以如关于第一和/或第三方面所述,例如srcoo
3-δ
或srco
0.5
ti
0.5o3-δ
;
65.(ii)具有钙铁石结构的氧化物,其可选地可以如关于第一和/或第二方面所述,例如sr2co2o5±
δ
,或sr2fe2o5±
δ
;或
66.(iii)具有k4cdcl6结构的氧化物,其可选地可以如关于第四方面所述,例如ca3co2o6。
67.用水进行的处理可以进行至少2小时的时间,可选地至少48小时,进一步可选地至少96小时。
68.所获取的陶瓷氧化物材料可以是具有钙钛矿、钙铁石或k4cdcl6结构的氧化物,并且可以包括选自ca、sr、ba、ln、y、na、k、rb、cs、pb和bi的一种或多种元素的a位点离子以及选自co、fe、mn、in、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w和ta的一种或多种元素的b位点离子。
69.由该方法产生的固体电解质可以是纯陶瓷电解质。在这种实施方式中,可将单个煅烧步骤设置成烧结陶瓷材料并引入另外的氧空位,从而形成经烧结的材料,该经烧结的材料设置成保持电解质的期望形状。另选地,可以在第一煅烧步骤中将所述材料在空气中烧结,然后在具有比空气更低的氧气分压的气氛中煅烧经烧结的材料,以引入另外的氧空位。另选地,所述材料可以在空气中烧结,然后进行处理以引入氧空位而无需进一步煅烧(例如,用还原性液体处理)。
70.特别地,在单个步骤煅烧程序烧结材料以及引入另外的氧空位的实施方式中,选择用于煅烧的温度可以为300℃或500℃至1700℃,可选地为500℃至1500℃或700℃至1400℃,进一步可选地为800℃或900℃至1200℃。
71.所述方法可包括在低于所述陶瓷氧化物材料的熔点的50℃至700℃、可选地在低于所述熔点的50℃至300℃的温度下煅烧所述陶瓷氧化物材料,从而形成经煅烧的陶瓷氧化物材料。煅烧可以烧结陶瓷氧化物材料。选择用于煅烧的温度可以为低于陶瓷氧化物材料的熔点的50℃至200℃。
72.因此,固体电解质可以是纯陶瓷电解质,并且煅烧步骤可以设置成烧结陶瓷材料,从而形成设置成保持电解质的期望形状的经烧结材料。当存在时,煅烧可以是单步过程或多步过程(例如,使用两个以上不同的煅烧温度和/或两种以上不同的煅烧气氛)。可以选择煅烧过程的停留时间,以便使经烧结的陶瓷材料具有足够的机械强度以在煅烧之后保持期望的形状。
73.在一些实施方式中,可以获得经烧结的氧化物材料(例如,以一种或多种丸粒或膜的形式),然后可以进行(第二)煅烧步骤以便生成氧空位。例如,经烧结的氧化物可在还原性气氛(例如纯h2)中煅烧。该步骤的煅烧温度可以低于烧结步骤的煅烧温度。该步骤的煅烧温度可以是200℃至1000℃或1200℃,可选地为300℃至700℃或1000℃,进一步可选地为400℃至500℃或700℃。在其他实施方式中,可以使用稀释的h2气氛,例如在ar或n2中的5体积%的h2,与在纯h2中相比,通过减少氧化物的分解来潜在地提供对煅烧条件的更好控制。
另选地,该方法可包括将陶瓷材料与一种或多种聚合物混合以形成复合陶瓷-聚合物电解质。
74.通过该方法生产的固体电解质可以另外是陶瓷-聚合物复合电解质。该方法可进一步包括:在用水处理之前,将陶瓷材料与一种或多种聚合物混合以形成复合陶瓷-聚合物电解质。在大多数实施方式中,在引入另外的氧空位的步骤之后进行将陶瓷材料与一种或多种聚合物的混合,应当理解,在与聚合物混合之后使用煅烧通常会受到聚合物的熔化或分解温度的限制。类似地,一些还原性液体或还原处理可能损坏聚合物膜,然而,例如,在陶瓷与聚合物混合之后,使用还原性液体的一些处理可能适合于应用。
75.对于本文所述的实施方式,作为纯陶瓷电解质使用,通常期望烧结材料。然而,通常不期望将陶瓷烧结到完全致密,以便留下空间以适应体积膨胀并允许水扩散通过所形成的丸粒或膜等。因此可选择烧结温度显著低于氧化物材料的熔点。
76.对于本文所述的实施方式,作为复合聚合物-陶瓷电解质使用,通常不期望烧结材料,因为更细的粉末可优选用于引入聚合物复合材料中,特别是在要制备薄膜时。如果陶瓷材料要用于形成这样的复合电解质,则可以选择煅烧条件以避免烧结,例如使用较低的煅烧温度(例如,低于陶瓷氧化物材料的熔点的超过300℃,或者低于所述熔点的甚至超过700℃)和/或较短的煅烧时间,或者铺展待煅烧的粉末,使得颗粒被分开并且不会在加热时结合。对于用于制备陶瓷-聚合物复合电解质的氧化物粉末,煅烧温度通常应该足够高以产生更多的氧空位,同时避免氧化物粉末的分解和/或烧结。在一些实施方式中,代替避免烧结,可以将烧结材料研磨成用于复合电解质中的粉末。
77.总的来说,当烧结纯陶瓷电解质(例如以一个或多个丸粒或膜的形式)时,用于烧结的煅烧温度通常被选择为足够高以赋予形成的陶瓷电解质足够的机械强度,该温度通常也足够高以引入氧空位,条件是选择合适的气氛。当制备用于陶瓷-聚合物复合电解质中的氧化物时,通常将煅烧温度选择为足够高以将氧空位添加到钙铁石、钙钛矿或k4cdcl6结构中,同时避免这些粉末的烧结。
78.在处理以引入更多的氧空位后,可将所述陶瓷氧化物材料浸泡在水中,或暴露于具有至少1体积%的水的气氛中。用水的这种处理可以进行至少2小时的时间,可选地至少48小时,进一步可选地至少96小时。技术人员将理解,可基于氧化物结构及组成及/或电解质大小、孔隙度及曲折度以及其他特征来选择时长。水可以作为液态水、水蒸气(例如,使用加湿的气流)和/或蒸汽提供。
79.在一些实施方式中,即使在具有低氧气分压的气氛中煅烧之后,氧化物材料仍可能具有不足的氧空位。在此情况下,该方法可进一步包括将经煅烧的陶瓷氧化物材料浸泡在还原性液体中,或电化学还原经煅烧的陶瓷氧化物材料。该处理可在将材料浸泡在水中或将其暴露于具有至少1体积%的水的气氛之前进行,或与其同时进行。在其他实施方式中,通过还原性液体和/或电化学还原进行处理,代替在具有低氧气分压的气氛中煅烧。
80.该方法可用于制备如任意前述方面所述的固体电解质。
81.该方法可以包括将陶瓷材料与一种或多种聚合物混合以形成复合电解质。
82.根据第六方面,提供了一种用于电化学装置的固体电解质,该电解质通过第五方面的方法制备。电解质可以是陶瓷电解质或包含陶瓷成分的复合电解质。
83.根据第七方面,提供了一种电化学装置,其包含在第一方面至第四方面或第六方
面中的任一个中描述的和/或通过第五方面的方法制造的固体电解质。电化学装置可设置成保持电解质在使用中水合,特别是在使用水合氧化物或水合羟基氧化物的情况下。
84.电化学装置可以是燃料电池、电解槽或蓄电池。例如,电化学装置可以是氧化还原液流电池、水性电池或zn-空气电池。电化学装置可以是电化学合成池或气体分离池。
85.起始材料氧化物可以不是纯净的/单一相。由于找到的材料(例如sr2fe2o5)在与水反应之后的电导率相对较高,所以即使具有多达30体积%的绝缘陶瓷杂质(例如al2o3或tio2)的污染仍然可以提供具有高到足以用作电化学装置的电解质的离子电导率的最终材料。类似地,可以在制备氧化物材料时制备第二相,例如,可以随期望的srco
0.5
ti
0.5o3-δ
形成较少量的sr3ti2o7。然而,较少量(例如,至多30体积%)的sr3ti2o7可能不会阻止该材料用作电解质。
86.设想的是,在现有电解质膜被如本文所述的电解质替换时,氢燃料电池的寿命可从2000小时延长至20000小时。电解质成本也可以降低,因为纯陶瓷电解质或复合膜包括相对便宜的无机材料。因此,氢或液体燃料进料、燃料电池可以在各种领域(例如电动车辆)中与电池技术更有竞争力。特别地,如本文所述的电解质可以提供改善的稳定性、降低的成本以及相当或更高的离子电导率中的一种或多种(测试已经证明了与膜相当的电导率,如下面更详细描述的)。
87.如本文所公开的电解质和电化学装置可具有许多和不同的应用。固态电解质可用于解决现有电化学装置(例如燃料电池(例如,pemfc、碱性燃料电池、碱性膜燃料电池)、电解槽、超级电容器、蓄电池(例如,液流电池、金属-空气电池和水性电池)、气体分离/净化、气体传感器、电化学合成等)的问题。在一般的基于聚合物电解质膜燃料电池(pemf)的氢燃料电池中,其一般具有作为电解质的膜,需要对阳极处的h2和阴极处的空气/o2两者都进行加湿,以便保持nafion膜水合,从而保持电解质膜的高质子传导。本文所述的一些材料(在前述和下述的方面)是混合的h
+
/oh-离子导体。当它们用作氢燃料电池的电解质时,质子在阳极处产生而移动到阴极,从而进一步与o2反应并在阴极处形成h2o,这可使电解质水合,而在阴极处形成的h2o可与o2(例如来自空气的o2)原位反应,以形成oh-离子,从而进一步传输至阳极以与h2反应以再次形成h2o,其可使电解质水合。由于在阳极和阴极处都产生水,这可减少对阳极处的h2和阴极处的o2/空气加湿的要求。因此,各种实施方式可提供优于使用h
+
或oh-离子导体作为电解质的常规pemfc的优点。
88.当陶瓷离子传导材料(作为离子传导材料的纯陶瓷层,或与另一种陶瓷材料或诸如聚合物等其他材料组合以形成复合致密膜)用作电化学装置(例如燃料电池、电解槽或氧化还原液流电池)的电解质时,可有效地避免化学物质、离子和气体的交叉扩散,应当理解,当使用传统的基于聚合物的膜作为电解质时,对于常规燃料电池、电解槽和氧化还原液流电池(例如钒氧化还原液流电池)而言,交叉是一个大问题。含有聚合物(例如hdpe)与导电氧化物材料(例如srzr
0.8y0.2o3-δ
)组合的聚合物-陶瓷复合物可具有优异的机械强度,并且也足够致密以减少化学物质和气体的交叉扩散。由这种材料制成的膜可以比更致密。
89.如本文所讨论的电解质可设置成进行水的电解以产生h2和o2,或进行氨或尿素水溶液的电解以产生h2和n2。在氯碱工业中,离子交换膜(例如)用作nacl水溶液电解的电解质,以便生产naoh、h2和cl2。然而,离子交换膜的长期稳定性是一个问题。以纯净形式
或与另一种陶瓷或聚合物混合以形成具有改善的机械强度的复合材料的如本文所述的由离子导体制成的膜展现出足够的离子电导率,从而成为用于氯碱工业的nacl或kcl水溶液电解的理想电解质。这些膜也可通过电解或电渗析用于其他工业化学生产过程,只要该过程涉及h
+
或/和oh-离子的传输即可。
90.低温电解槽通常具有碱性电解质,通常使用koh水溶液作为电解质,同时必须除去来自水的co2。本文所述的材料可替换koh水溶液并降低对co2去除的要求。与基于koh水溶液电解质的常规碱性电解槽相比,开发基于聚合物膜的电解槽是期望的,以便具有快速启动并缩短响应时间。由于风力、太阳能和其他可再生能源的间歇性质,短响应时间对于可再生电力用于水的电解以供储存可再生能量是非常重要的。基于酸性膜(例如)的电解质需要在电极中使用贵金属催化剂(例如pt、ir),因此对于大规模应用来说成本太高。当酸性膜被碱性膜替换时,可以使用更便宜的电极,但是现有碱性膜的耐久性不够好。因此,需要开发能够传导h
+
和/或oh-的稳固膜作为电解质用于电解槽。本文描述的材料提供了实现这些新技术的解决方案。对于碱性电解槽或碱性膜电解槽,便宜的非贵金属催化剂可用作基于本文所述的离子传导电解质的电解槽中的电极,因此可显著降低电解槽的成本,从而将其推向大规模应用。对于其他电化学过程,例如n2或co2的电化学还原以产生氨或烃、脱盐、废水处理,只要该过程涉及h
+
或/和oh-离子的传输,则这些离子导体再次具有用作电解质的潜力。
91.在化学工业中,存在许多需要将h2与混合物分离或将较不纯的h2纯化为高纯h2的方法。本文所述的具有h
+
/oh-离子传导的离子导体可用于分离或纯化h2。当在电化学装置的正极侧处供应湿h2或含有h2的混合物时,在施加dc电压之后,可将正极处的h2离子化为h
+
离子,并且接着将其传输至电解质的另一侧,即负极,在此其获得电子而再次形成纯h2。在负极侧产生的h2将是非常纯的,因为所有其他气体/化学物质被具有h
+
传导的致密纯陶瓷或复合物(例如陶瓷-陶瓷或陶瓷-聚合物复合物)电解质阻挡。由于存在电极和通过导线施加的dc电压,该方法可以称为“有线”法。
92.当这些氧化物中的一些被水合时,它们是混合的h
+
/电子导体。在此情况下,当它们作为致密隔膜用于气体分离时,对其施加dc电压将由于致密隔膜中的电子传导而引起短路。然而,如果一侧暴露于含有h2(纯净的或其他)的混合物,并且另一侧暴露于较低压力的纯蒸汽或湿h2,则来自混合物的h2将扩散到较低压力下的另一侧(可通过真空泵实现),因此通过混合的h
+
/e’传导致密膜(也可使用混合的h
+
/oh-/e’导体)也实现h2分离/纯化。再次,在低压侧产生的h2可以是非常纯的,因为所有其他气体/化学物质被具有h
+
传导的致密纯陶瓷、聚合物-陶瓷复合或陶瓷-陶瓷复合层阻挡。由于没有施加的dc电势,因此没有电线,该方法可以被称为“无线”法。
93.类似于h2分离/纯化的“有线”和“无线”法,在o
2-离子代替h
+
离子在具有足够的机械强度的致密陶瓷或陶瓷-陶瓷或陶瓷-聚合物复合膜中传输的情况下,本文所述的具有o
2-离子传导的离子导体也可用于从含有o2的混合物(例如湿空气)分离o2,或者使用类似的机制将低品级o2至非常纯的o2。类似地,当使用混合的oh-/e’导体(可选地为混合的o
2-/h
+
/e’导体)时,当在致密的陶瓷或复合膜的不同侧之间存在o2分压差异时,可以通过“无线”过程实现o2分离/纯化。例如,如果使用混合的o
2-/e’(或o
2-/h
+
/e’)导体将湿空气暴露于电化学分离器的一侧,并且另一侧暴露于低压蒸汽或湿o2,则o2将从湿空气扩散到另一侧,而在低
压侧产生高纯湿o2,由此实现从空气分离o2。o2发生器广泛用于医院中以治疗患有呼吸困难的患者,例如患有covid-19的患者。
94.在燃气/燃煤电站中,为了捕获所产生的co2,研究人员提出使用纯o2代替空气来燃烧煤/天然气,以便在没有来自空气的n2/惰性气体的情况下产生相对较纯的co2,从而简化/绕过分离过程。该方法称为氧燃料燃烧方法。主要挑战是缺乏有效地从空气分离o2的技术。类似于h2分离/纯化法,所述的o
2-离子导体(可选地为混合的o
2-/h
+
导体)和混合的o
2-/e’离子导体(可选地为混合的o
2-/h
+
/e’导体)可分别用于通过“有线”和“无线”法的o2分离或纯化。这种材料还可以从湿空气分离o2,以用于燃煤/燃气电站的氧燃料燃烧过程或其他类似过程。
95.具有离子(h
+
/oh-)或混合离子/e’(h
+
/oh-/e’)传导的氧化物-聚合物复合材料也可用于如上所述的h2/o2分离/纯化方法,尽管由于气体/化学物质可能交叉扩散通过复合材料的聚合物部分,获得的h2/o2的纯度水平可能较低。然而,如果对气体纯度的要求不是非常高,例如用于氧燃料燃烧的o2,或者如果使用足够致密的聚合物,则这可能不是问题。
96.一些氧化物(例如sr2co2o5)在空气中煅烧后在水中处理或在ar中进一步煅烧较短的时间时,形成混合的离子/e’导体。这些材料可以通过所述的“无线”法用于h2或o2分离/纯化。对于纯离子导体,其可以与例如金属(钢、钛等)或非金属(碳、石墨烯等)等电子导体或电子传导聚合物(聚吡咯(ppy)、聚苯胺(pan)等)混合形成用于h2/o2分离的混合离子/电子复合材料。纯净相(例如sr2co2o5)的或与其他材料混合形成复合材料的混合h
+
/oh-/e’导体也可用作电化学装置(例如燃料电池、电解槽、蓄电池或超级电容器)中的电极。例如,当srzr
0.8y0.2o3-δ
用作燃料电池、电解质、蓄电池或超级电容器的电极时,可将srzr
0.8y0.2o3-δ
添加到这些装置的负极和正极中,以便改善电极的离子传导,促进h
+
/oh-离子在电极中的传输,降低两个电极上的过电位,并且使电化学装置更有效地工作。当然,其他h
+
/oh-导体(例如srce
0.8y0.2o3-δ
)或混合的h
+
/oh-/e’导体(例如在空气中煅烧时的sr2co2o5)也可以添加到电极中,起到与srzr
0.8y0.2o3-δ
相同的作用。因此,混合的h
+
/oh-/e’导体也可以用作各种电化学装置中的电极中的成分。
97.减少电化学装置中阳极室和阴极室之间的化学物质或气体的交叉扩散是现有电化学装置中的一大挑战。例如,在所有钒氧化还原液流电池中,当使用例如等聚合物膜作为电解质时,两个室之间的不同钒离子的交叉扩散会导致自放电。这对于所有钒氧化还原液流电池的大规模应用来说都是一大挑战。对于直接式甲醇燃料电池,甲醇从阳极到阴极的交叉扩散也是大问题。对于使用聚合物电解质的常规氢燃料电池,可能出现相同的问题——在燃料电池中氢气从阳极到阴极的交叉扩散。当纯致密陶瓷膜或陶瓷-陶瓷复合材料(没有或仅具有小比例的聚合物)或陶瓷-聚合物复合材料(如果仔细选择聚合物,例如各种塑料)用作电解质时,可解决这种交叉扩散。本文所述的陶瓷、陶瓷-陶瓷复合材料或陶瓷-聚合物复合电解质可提供减少或消除交叉扩散的优点。在一些具体应用(例如“无线”气体分离)中,致密陶瓷-金属复合膜可用于避免化学物质或气体的交叉扩散。
98.根据另一方面,提供了一种电化学装置,其包含固体离子传导层,所述离子传导层包含源自具有钙钛矿或钙铁石结构的氧化物的羟基氧化物,所述羟基氧化物具有以下通式:
99.(a
1-x
a’x
)
1-ab1-yby
(o
3-z-dcz
)(oh)m·
nh2o;其中:
100.a和a’选自ca、sr、ba、ln、y、na、k、rb、cs、pb和bi;
101.b和b’选自ln、y、sc、mg、ca、sr、li、na、co、fe、mn、in、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、as、sb、zr、hf、nb、mo、w、cd和ta;
102.c选自n、cl、f、br、s、te和se;
103.0≤x≤1;a≤0.15;z≤0.2;y≤1;d≤2;m≥0.01;n≥0,
104.并且其中,电化学装置设置成在使用中,离子传导层暴露于液态水或具有至少5体积%的水的气体。
105.水可以作为液态水、作为加湿气体中的水或以蒸汽的形式提供。水可以在高于室温下提供,例如在80℃以上或90℃以上的温度下提供。
106.如本文和科学文献中的其他地方所使用的,ln是镧系元素的非正式化学符号;具有57至71的原子数的15种金属化学元素(从镧到镥)。其中,已经发现铈(ce)在一些实施方式中具有特别合适的性质。因此,在一些实施方式中,b或b’可以是ce。在b位点可用的镧系元素材料中,ce和y可以是特别有意义的。b位点处的其他重要镧系元素包括yb、sm和gd。
107.在各种实施方式中,m为0.01至2,可选地为0.2至1.5,进一步可选地为0.5至1。在各种实施方式中,n为0至12,可选地为0.1至2,进一步可选地为0.2至1.5。
108.固体离子传导层可以是以下中的一种或多种:(i)纯离子导体,并且可选地可以是电解质;(ii)oh-和/或h+离子的导体;和(iii)主要是oh-离子导体。
109.具有钙钛矿或钙铁石结构的氧化物可以是以下中的一种或多种:(i)sr2co2o5±
δ
;(ii)sr2co2o
5-xnx
;(iii)ca2co2o5±
δ
;(iv)srcoo
3-δ
;(v)cacoo
3-δ
;(vi)srcafecoo5±
δ
;(vii)srcaco2o5±
δ
;或(viii)srco
0.5
ti
0.5o3-δ
(在水中混合的离子/电子导体)或srti
0.7
co
0.3o3-δ
(在水中的离子导体);(ix)sr2fe2o5±
δ
;(x)sr2fe2o
5-xnx
;(xi)ca2fe2o5±
δ
;(xii)srzr
0.8y0.2o3-δ
;(xiii)srce
0.8y0.2o3-δ
或srce
0.85y0.15o3-δ
;(xiv)srceo
3-δ
;或(xv)srcafe2o5±
δ
。δ的值可以大于或等于零。可选地,0≤δ≤1。根据另一个方面,提供了一种用于电化学装置的固体离子传导层,所述固体离子传导层包含源自具有钙铁石结构的氧化物的水合氧化物,所述水合氧化物具有以下通式:
110.(a
2-x
a’x
)
1-ab2-yby
(o
1-zcz
)5±
δ
·
n’h2o,其中:
111.a和a’选自ca、sr、ba、ln、y、na、k、rb、cs、pb和bi;
112.b和b’选自ln、co、fe、mn、ni、cu、zn、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、as、y、in、sc、sr、ca、mg、li、na、cd和ta;
113.c选自n、cl、f、br、s、te和se;
114.a≤0.15;0≤x≤1;0≤y≤1;z≤0.04;并且n’≥0.01。
115.具有钙铁石结构的氧化物是以下中的一种或多种:(i)sr2fe2o5;(ii)sr2fecoo5;(iii)sr2fe2o
5-xnx
;和(iv)ba2ince
0.5
la
0.5
o5。固体离子传导层可以是以下中的一种或多种:(i)纯离子导体,并且其中可选地,固体离子传导层是电解质;(ii)oh-和/或h
+
离子的导体;和(iii)主要是oh-离子导体。
116.根据另一方面,提供了一种用于电化学装置的固体离子传导层,所述固体离子传导层包含源自具有钙钛矿结构的氧化物的水合氧化物,所述水合氧化物具有以下通式:
117.(a
1-x
a’x
)
1-ab1-y
b’yo3-z-d’cz·
n”h2o,其中:
118.a和a’选自ca、sr、ba、ln、y、na、k、rb、cs、pb和bi;
119.b和b’选自ln、y、in、sc、sr、ca、mg、li、na、co、fe、mn、ni、cu、zn、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、cd、as和ta;
120.c选自n、cl、f、br、s、te和se;
121.0≤x≤1;a≤0.15;z≤0.2;d≤2;n”≥0.01。
122.具有钙钛矿结构的氧化物可以是以下中的一种或多种:(i)srcoo
3-δ
;或(ii)srco
0.5
ti
0.5o3-δ
;(iii)srzr
0.8y0.2o3-δ
;(iv)srce
0.8y0.2o3-δ
;(v)srti
0.7
co
0.3o3-δ
;或(vi)srceo
3-δ
。
123.固体离子传导层可以是以下中的一种或多种:(i)纯离子导体,并且其中可选地,固体离子传导层是电解质;(ii)oh-和/或h
+
离子的导体;和(iii)主要是oh-离子导体。
124.根据另一个方面,提供了一种用于电化学装置的固体离子传导层,所述固体离子传导层包含源自具有k4cdcl6结构的氧化物的水合氧化物或水合或非水合羟基氧化物,所述具有k4cdcl6结构的氧化物具有以下通式:
125.(a
1-x
a’x
)3b
2-y
b’yo6-zcz
,其中:
126.a和a’选自ca、sr、ba、na、k、rb、cs、ln、y、pb、in、tl和bi;
127.b和b’选自co、fe、mn、ni、cu、ti、v、cr、碱土金属、mg、ca、sr、b、镧系元素(ln)、y、zn、cd、li、sc、na、b、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、ta、pt、rh、ir和ru(可选地,b和b’可包括元素ti、v、cr、mn、fe、co、ni、ce、zr、y、sc和cu中的至少一种);
128.c选自n、cl、f、br、i、s、te和se;
129.y为0至2;z为0至0.5;并且x为0至1。
130.b和b’中的至少一种可选自ti、ce、zr、y、sc、co、fe、mn、ni和cu。可选地,氧化物可以是ca3co2o6。在b位点可用的镧系元素材料中,ce和y可以是特别有意义的。b位点处的其他重要镧系元素包括yb、sm和gd。
131.固体离子传导层可包含(i)具有通式(a
1-x
a’x
)3b
2-y
b’yo6-zcz
·
nh2o的水合氧化物,其中n大于或等于0.01,x为0至1,y为0至2,并且z为0至0.5;或(ii)具有通式(a
1-x
a’x
)3b
2-y
b’yo6-zcz
(oh)m·
nh2o的羟基氧化物,其中x为0至1,y为0至2,z为0至0.5,并且m为0.01至6。
132.前述方面中任一项的固体离子传导层可以是包含与聚合物混合的如针对此方面描述的至少一种水合氧化物或水合或非水合羟基氧化物的复合固体离子传导层。固体离子传导层可包含1体积%至99体积%的至少一种水合氧化物或水合或非水合羟基氧化物,可选地为10体积%至80体积%,可选地为30体积%至50体积%。聚合物可以是或包括亲水性聚合物或疏水性聚合物。在各种实施方式中,陶瓷-聚合物复合材料中使用的塑料可以是诸如hdpe、peek或ptfe等聚合物,其是疏水性的。这种复合膜可以具有优异的机械强度,同时还允许该复合材料的陶瓷成分保持水合以保持其高离子电导率。使用诸如pva或paa等亲水性聚合物可以以机械强度为代价来增加水吸收。当使用疏水性聚合物时,可能需要确保陶瓷为主要成分,从而为离子传导材料的水合提供足够的水吸收。
133.另选地或另外地,除了聚合物之外或代替聚合物,可将金属或非金属材料与如针对各个方面中的任一个所述的至少一种水合氧化物或水合或非水合羟基氧化物混合。非金属材料可以分类为陶瓷、聚合物、玻璃、纯(非金属)元素、盐等,因此覆盖大范围的材料。陶瓷-石墨复合材料是一种这样的具有非金属材料的的复合材料的实例。固体离子传导层可以是柔性膜,例如在混合材料是聚合物或石墨时。盐(例如caco3、baso4)也是可用于这种复
合材料中的非金属材料。当与陶瓷离子导体混合以形成复合材料时,添加的材料可以改善机械强度。与上面列出的那些类似的体积比可以应用于由陶瓷导电材料和与其混合的金属或非金属材料形成的复合材料。离子传导材料是纯离子导体还是混合离子/电子导体取决于化学组成和预处理历史。复合材料的性质还将取决于与初始离子传导材料混合的材料的量和性质。
134.与未混合的离子传导材料相比,由混合物形成的复合材料可以具有提高的机械强度。通常,可使用与离子传导材料化学相容的聚合物、氧化物或陶瓷粘合剂或玻璃来形成复合物。复合材料可以形成具有优异机械强度的致密离子导体。例如,这种致密离子传导材料可有利地避免在使用中化学物质在电化学装置的阴极室与阳极室之间的交叉扩散。这在氧化还原液流电池/蓄电池、电解质和燃料电池中特别有用。
135.固体离子传导层可以是以下中的一种或多种:(i)纯离子导体,并且其中可选地,固体离子传导层是电解质;(ii)oh-和/或h
+
离子的导体;(iii)主要是oh-离子导体;和(iv)混合的h
+
/oh-/e’导体,并且其中可选地,固体离子传导层用作用于“无线”气体分离的膜或用作电化学装置的电极。
136.根据另一方面,提供了一种制造用于电化学装置的固体离子传导层的方法,所述方法包括:
137.获取陶瓷氧化物材料,其中,所述陶瓷氧化物材料是具有钙钛矿、钙铁石或k4cdcl6结构的氧化物,并且包括选自ca、sr、ba、ln、y、na、k、rb、cs、pb和bi的一种或多种元素的a位点离子和选自ln、y、sc、mg、ca、sr、ba、li、na、cd、co、fe、mn、in、ni、cu、zn、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、ta、pt、rh、ir和ru的一种或多种元素的b位点离子;
138.通过以下步骤将另外的氧空位引入所获取的陶瓷氧化物材料中:
139.(i)在空气中煅烧陶瓷氧化物材料;
140.(ii)在具有比空气更低的氧气分压的气氛中煅烧所述陶瓷氧化物材料;
141.(iii)将所述陶瓷氧化物材料浸泡在还原性液体中;或者
142.(iv)电化学还原经煅烧的陶瓷氧化物材料;以及
143.用水处理所述陶瓷氧化物材料,所述处理包括将所述经煅烧的陶瓷氧化物材料浸泡在水中,或将其暴露于具有至少5体积%的水的气氛中,以形成水合氧化物或水合或非水合羟基氧化物。
144.尽管预期方法选项(ii)至(iv)在未润湿材料中产生更多的氧空位,但对于本文所述的大量氧化物,发现即使在材料已在空气中煅烧(选项(i))后,仍发现用水进行处理产生了足够高的离子传导水平。特别地,发现诸如srzr
0.8y0.2
o3、srce
0.8y0.2
o3、srceo3、srti
0.7
fe
0.3
o3等材料(其各自在空气中煅烧而没有在还原性气氛中的任何进一步处理)在水处理之后表现为离子导体。实际上,本文所述的大多数材料可在空气中煅烧,然后简单地在水中处理以实现高离子电导率或混合的离子/电子电导率。对于一些材料,特别是那些在化学组成中具有多价元素的材料,发现了在还原性气氛(比空气更低的氧气分压)或还原性液体中处理或施加电化学还原过程(以增加阴离子空位(通常为氧空位)的浓度)是有益的,从而在暴露于液态水或加湿气氛时实现高离子迁移数。水可以作为液态水、作为加湿气体中的水或以蒸汽的形式提供。水可以在高于室温下提供,例如在80℃以上或90℃以上的温度下提供。
145.具有比空气更低的氧气分压的气氛可以是(i)惰性气氛(例如ar);或(ii)还原性气氛(例如5% h2/95% ar)。
146.所获取的陶瓷氧化物材料可如先前方面中所述,和/或可为以下中的至少一种:(i)具有钙钛矿结构的氧化物,例如srce
0.8y0.2o3-δ
、srzr
0.8y0.2o3-δ
或srco
0.5
ti
0.5o3-δ
;(ii)具有钙铁石结构的氧化物,例如sr2fe2o5±
δ
;或(iii)具有k4cdcl6结构的氧化物,例如ca3co2o6。
147.在使用固体离子传导层之前,可以用水处理至少1小时或2小时,可选地至少48小时,进一步可选地至少96小时。用水处理的时间可取决于材料的组成和厚度以及温度。通常,在室温下,在使用固体离子导电层之前,可以对厚度约2mm的丸粒进行至少1小时的时间。在固体离子传导层是薄膜或膜的形式的实施方式中,时间可以减少。实际上,对于足够薄和/或多孔的样品,仅几分钟的处理时间就足够了。不管水处理是否在原位进行,固体离子传导层在水处理和使用之间保持水合。理想地,水处理可以在装置开机之前立即原位进行。
148.固体离子传导层可以是纯陶瓷固体离子传导层。可将单个煅烧步骤设置成烧结陶瓷材料并引入另外的氧空位,以便形成经烧结的材料,该经烧结的材料设置成保持固体离子传导层的期望形状。另选地,可以在第一煅烧步骤中将材料在空气中烧结,然后在具有比空气更低的氧气分压的气氛中煅烧经烧结的材料,从而引入另外的氧空位。
149.该方法可以进一步包括,在用水处理之前,将陶瓷材料与一种或多种聚合物混合以形成复合陶瓷-聚合物固体离子传导层。在另选或另外的实施方式中,陶瓷材料可与另一种材料混合以形成复合陶瓷-聚合物或陶瓷-陶瓷固体离子传导层,例如用作电解质。在其他实施方式中,可形成非陶瓷-聚合物、陶瓷-碳(例如石墨)、陶瓷-陶瓷或甚至陶瓷-金属复合物用作混合离子/电子传导层(例如用作用于“无线”气体分离(通常为h2和o2)的电极或分离膜)。复合材料的形成可增加机械强度,增加用于特定应用的离子/电子混合传导(例如,通过提供一些/更多电子传导),例如用于电化学装置的电极或作为如上文所描述的用于“无线”气体分离的分离膜。
150.根据另一方面,提供了一种用于电化学装置的固体离子传导层,所述固体离子传导层通过前述方面的方法制备。如果这些材料是纯离子导体,则它们可以适合用作电解质,或者如果纯材料或在与金属或非金属材料(例如,聚合物、陶瓷、如碳等纯单质)混合之后形成的复合材料是混合的离子/电子导体,则这些材料也可以用作电极或用于气体分离膜。
151.根据另一方面,提供了一种电化学装置,其包含如任意前述方面所述的固体离子传导层,其中,在使用中,固体离子传导层暴露于液态水或具有至少5体积%的水的气体。如上所述,如本文所用,“水”是指h2o,无论其作为液态水、水蒸气还是蒸汽存在。
152.任意前述方面的电化学装置可设置成在小于或等于250℃、可选地小于235℃、进一步可选地小于或等于120℃的工作温度下工作。可选地,当工作温度高于100℃时,可提供加压蒸汽或加压水以保持暴露于液态水或具有至少5体积%的水的气体。任意前述方面的电化学装置被设置为在存在液态水或周围气体中至少5体积%的蒸汽或水蒸气的情况下工作。因此可以相应地选择温度和压力。在高压下,工作温度可以远高于100℃(在环境压力下的液态水的沸点),同时仍然保持液态水。
153.电化学装置可以是燃料电池、电解槽或蓄电池。固体离子传导层可以是电解质。电化学装置可被设置为保持固体离子传导层(其可为纯离子导体或混合的离子/电子导体)在
使用中水合。固体离子传导层可以是混合的h+/oh-/e’导体;这种材料可以用作用于“无线”气体分离的膜或用作电化学装置的电极。
154.任意前述方面的固体离子传导层可由陶瓷氧化物材料组成,或包含陶瓷氧化物材料。在一些实施方式中,上述氧化物材料可以掺杂有少量的一种或多种其他阴离子,通常为n、cl、f、br、s、te和se。
155.根据另一方面,提供了一种运行任意前述方面中所述的电化学装置的方法,所述方法包括在所述电化学装置、更具体地所述离子传导层处于使用中的同时,将所述离子传导层连续暴露于液态水或具有至少5体积%的水(作为水蒸气或蒸汽)的气体。
156.技术人员将理解,关于本发明的一个方面描述的特征可以加以必要的变更而应用于本发明的任何其他方面。现在仅通过示例的方式参照附图对本发明的实施方式进行详细描述,在附图中:
157.图1是电化学装置的示意图;
158.图2是在室温下在水中浸泡6天后的sr2fe2o5(钙铁石结构)样品的电导率和离子迁移数随温度变化的图;
159.图3是钙铁石结构的图示;
160.图4是钙钛矿结构的图示;
161.图5是k4cdcl6结构的图示;
162.图6是在室温下在水中浸泡3天后的srco
0.5
ti
0.5o3-δ
(钙钛矿结构)样品的电导率和离子迁移数随温度变化的图;
163.图7是在室温下在水中浸泡3天后的ca3co2o6(k4cdcl6结构)样品的电导率和离子迁移数随温度变化的图;
164.图8a和8b提供了使用三种不同燃料的sr2fe2o5类电解质材料的燃料电池性能的图;
165.图9示出了一个实施方式的方法;
166.图10提供了在1200℃的ar中煅烧的sr2fe2o5样品的x射线衍射(xrd)数据;
167.图11提供了在水中进行处理和电导率测量之后的图10的样品的xrd数据;
168.图12提供了在1100℃的ar中煅烧的srco
0.5
ti
0.5o3-δ
样品的xrd数据;
169.图13提供了在空气中于1000℃煅烧的ca3co2o
6-δ
样品的xrd数据。
170.图14示出了制备原样的srzr
0.8y0.2o3-δ
丸粒、在h2o中在高达90℃的温度下进行了电导率测量之后以及在d2o中进行了电导率测量之后的丸粒的xrd图谱;
171.图15示出了在冷却时测量的srzro3、srzr
0.9y0.1o3-δ
和srzr
0.8y0.2o3-δ
在水中的电导率(填充符号)和离子迁移数(空心符号);
172.图16示出了mzr
0.8y0.2o3-δ
的电导率(填充符号)和离子迁移数(空心符号),其中m=ca,sr,ba;
173.图17示出了在90℃的水中处理(包括在测量之前将水更换三次)后srzr
0.8y0.2o3-δ
在90℃的水中的电导率的稳定性;
174.图18示出了在不同温度下的湿空气中srzr
0.8y0.2o3-δ
的离子电导率,包括高于100℃的电导率作为插图(空气通过100℃水);
175.图19示出了在20℃至100℃的湿空气(空气通过100℃沸水以将其加湿)中的
srzr
0.8y0.2o3-δ
的离子电导率和离子迁移数;
176.图20示出了在70℃的湿空气(空气通过100℃沸水以将其加湿)中的srzr
0.8y0.2o3-δ
样品的电导率稳定性图;
177.图21示出了在冷却时测量的在h2o和d2o中的srzr
0.8y0.2o3-δ
丸粒的电导率和离子迁移数;
178.图22示出了在室温下测量的水合(实线)和氘代srzr
0.8y0.2o3-δ
(虚线)的1h-魔角旋转(mas)固态nmr;
179.图23示出了在空气中煅烧的并且在高达90℃的温度下在水中进行电导率测量之后的sr2co2o5的xrd图谱;所述样品是在空气中煅烧之后的单相,并且该相在电导率测量之后保持,这意味着它是稳定的(不能排除sr2co2o5与h2o反应形成羟基氧化物,因为这不能通过xrd检测,这是由于其对元素氢不灵敏);
180.图24示出了对于在没有任何进一步处理(例如,没有通过在不同气氛中煅烧或用还原性液体处理来进行还原处理)的情况下在空气中煅烧的样品,sr2co2o5在水中的电导率(在冷却时测量)和离子迁移数;
181.图25示出了在空气中煅烧、然后在ar中煅烧并且在高达90℃的温度下在水中进行电导率测量之后的sr2co2o5的xrd图谱,显示出在空气中煅烧之后形成了单相,并且其在ar中煅烧之后保持(尽管更差地结晶);在水中的电导率测量之后,尽管出现了co(oh)2的一些峰,但该相依然保持;
182.图26示出了在冷却时测量的sr2co2o5在水中的电导率和迁移数;所述样品在空气中煅烧,然后在ar中煅烧,并且用水洗涤两次,之后进行电导率测量;
183.图27示出了纯co(oh)2丸粒在水中的电导率和离子迁移数,显示出在相同条件下,其电导率比在ar中煅烧的sr2co2o5丸粒的电导率低两个数量级;
184.图28示出了对于在电导率测量前在空气中烧结、然后用还原剂(1m naoh+7m nabh4)处理8小时的样品,在冷却时测量的sr2co2o5在水中的电导率和迁移数;
185.图29示出了在-1.14v vs ag/agcl下电化学还原10小时然后在水中进行电导率测量前后的纯sr2co2o5的xrd图谱,显示出主要相保持,但不好地结晶;
186.图30示出了在加热过程中sr2co2o5丸粒在水中的电导率数据,所述丸粒被电化学还原10小时,并浸入90℃的水中3天,之后进行电导率测量;
187.图31示出了在冷却时测量的sr2co2o5样品在水中的电导率和迁移数,所述样品在空气中烧结,然后用还原剂(1m naoh+7m nabh4)处理8小时。
188.在附图中,相同或相应的附图标记用于相同或相应的部件。
189.图1示出了简化的电化学装置100。电化学装置100(例如燃料电池)通常包括两个电极102、106(阳极和阴极)和将阳极与阴极隔开的电解质104。电解质104被选择为离子导体以允许电极102、106之间的离子传输,但是为电子绝缘体,以避免或最大程度减少短路/电流泄漏。可通过本文所述的电解质104提供稳定的离子电导率。在另选实施方式中,电化学装置100可包括不充当电解质的固体离子传导层。技术人员将理解,电解质104是固体离子传导层104的示例,但是本文描述的材料和工艺对于不是电解质的固体离子传导层也可以是有用的。虽然为了便于阅读,以下描述通常涉及电解质104,但是应当理解,本发明不限于电解质104,实际上,在一些情况下,离子传导层可以是混合的离子和电子导体,因此不适
合用作例如蓄电池或燃料电池100的电解质。在此描述的离子导体(纯的或混合的离子/电子传导)可以被添加到电化学装置的电极中,或者用作在“有线”或“无线”气体分离装置中用于气体分离/纯化(通常为h2和o2)的分离膜。
190.虽然可以参照燃料电池100来描述本文所述的实施方式,但是技术人员将理解,所描述的电解质104(或实际上的其他离子传导层)可以同样地应用于其他电化学装置100以及许多不同类型的燃料电池100。作为非限制性实例,可以使用如本文所述的电解质(或其他离子传导层)104的合适的电化学装置100包括:
191.·
电解槽,例如,用于分解水以生成“绿色”h2或在氨/尿素电解槽中用于将氨/尿素分成氢气和氮气,或在氯碱工业中用于电解nacl/kcl水溶液的电解质以产生naoh/koh、h2和cl2;
192.·
使用气体或液体燃料的燃料电池;一般的燃料是氢气、甲醇、乙醇、氨、肼、尿素和甲烷。这样的燃料电池可以用于发电的唯一目的,或者可以具有双重目的。例如,使用如本文所述的电解质104的氨/尿素燃料电池可以用于从含有氨/尿素的废水中去除氨,并且发电可以是有益的副产物而不是主要目的;
193.·
氧化还原液流电池或其他液流电池;
194.·
蓄电池,例如金属-空气电池(例如,zn-空气电池或其他金属-空气电池,使用oh-或混合的h
+
/oh-离子导体作为电解质)和水性可再充电电池,以及基于h
+
或/和oh-离子传导电解质的任何水性电池;
195.·
用于化学合成化学物质(例如氨和烃)的电化学装置;
196.·
超级电容器;
197.·
电渗析装置,例如用于废水处理或脱盐以从海水中生产淡水;
198.·
气体分离器(特别是h2和o2)、气体净化器或其他分离单元;以及
199.·
传感器。
200.通常,本文所述的材料可用于任何合适的电化学装置100,其需要离子传导层是电解质(例如oh-或混合的h
+
/oh-传导)所需的纯离子传导或优选用于电极或气体分离膜(例如混合的oh-/e’或混合的h
+
/oh-/e’导体)的混合离子电子传导。在用作气体分离的膜时,所选择的材料可以是混合的h
+
/oh-/e’导体。对于氢气分离,可以仅使用h
+
/e’传导特性,或者对于o2分离,可以仅使用oh-/e’传导特性。
201.本文描述和要求保护的所有材料都是离子导体,其中一些材料另外是电子导体(即,是混合的离子/电子导体)。特别地,材料通常是混合的h
+
/oh-离子导体,并且混合的离子电子导体(miec)是混合的h
+
/oh-/e’导体。通常,离子传导主要是oh-传导,尽管在一些情况下,h
+
传导可能超过oh-传导。
202.与这些钙钛矿氧化物仅在高温(>500℃)下作为o
2-或h
+
或混合的o
2-/h
+
导体工作的在先预期相反,发现本文中制备和描述的并在水中工作的诸如srzr
0.8y0.2o3-δ
、srce
0.8y02o3-δ
和srce
0.85y0.15o3-δ
等材料即使在相对较低的温度(例如120℃以下)下也作为混合的h
+
/oh-离子导体起作用。因此,即使使用具有类似化学组成的钙钛矿氧化物,由于环境的差异(例如,材料与液态水接触或暴露于具有至少5体积%蒸汽的气体)和/或预处理,传导机制也是非常不同的(不同的电荷载体)。发现使用与液态水接触或暴露于具有至少5体积%的水的气体的这种氧化物导致高oh-离子传导或混合的h
+
/oh-离子传导(通常在100
℃以下的温度下,但是如果装置100被加压,则温度可以更高)。
203.以下指南可用于选择可能在水或蒸汽中或在水合状态下具有高离子电导率的陶瓷材料。
204.a.所述材料富含阴离子空位,通常为氧空位;
205.b.当材料暴露于水或蒸汽时,合适的材料可与水或蒸汽反应以形成羟基氧化物或水合氧化物,或以其他方式将oh-离子引入材料中;
206.c.所述材料可经选择具有带连续路径的结构,其促进h
+
/oh-离子在晶格中的迁移,从而提供高h
+
/oh-离子电导率。具有所需路径的一般晶体结构是钙钛矿和钙钛矿相关结构,其含有原始的abo3钙钛矿块、钙铁石和k4cdcl6结构。
207.在一些情况下,仅满足三个标准中的两个的材料表现出合适的行为,例如,发现未掺杂的srceo3在与液态水接触或暴露于具有至少5体积%的蒸汽的气态气氛时表现出高离子电导率,尽管没有被分类为富含氧空位。该原始钙钛矿结构化材料满足上面列出的第二和第三指南,但不满足第一指南。
208.如本文所述的电解质104包括陶瓷成分,电解质104可以是纯陶瓷电解质,或例如陶瓷-聚合物复合或陶瓷-陶瓷复合电解质。电解质104的结构和性质被选择和控制以提供用于电化学装置100中的合适的电导率和其他参数。
209.已找到在适当制备时表现出高离子电导率的氧化物材料的家族(例如,对于经处理的sr2fe2o5,室温下电导率为1.9
×
10-2
s/cm,在水中测量电导率以确保测试水合材料)。不同于在使用氧化物材料本身作为电解质材料的相关氧化物材料上的在先工作,本发明人认识到,当使用所得的水合氧化物或羟基氧化物材料来形成电解质104时,形成特别选择的氧化物的水合氧化物或水合或非水合羟基氧化物提供了改善的性质。用于形成电解质104的氧化物材料可特别制备以促进水合氧化物或水合或非水合羟基氧化物的形成(例如,通过引入氧空位和/或选择与水具有合适反应性的组成)。
210.作为实例,在图2中的图表200中示出了在25℃至90℃下的srfeo
2.5
(oh)m·
nh2o材料的离子电导率和离子迁移数。离子迁移数202为约0.998,表明所述材料为适合用作电化学装置100的电解质104的纯离子导体。离子电导率204在90℃下为0.041s/cm,其与市售膜(在96℃下为0.04s/cm)相同。为了形成数据如图2所示的srfeo
2.5
(oh)m·
nh2o材料,通过标准固态反应方法制备sr2fe2o5。特别地,使用球磨机(ortoalresa oabm 255)以300rpm将14.91g srco3和8.03g fe2o3(分析级)混合12小时,然后在1100℃的空气中焙烧55小时,加热/冷却速率为5℃/min。将粉末研磨并造粒,然后在1200℃的氩气中下煅烧8小时。在图10中提供了在氩气中煅烧后的丸粒的xrd数据,确认了期望的钙铁石结构。除非另有说明,否则具有13mm直径和2.2mm厚度的盘形丸粒被认为是本文所述的测试的默认值,技术人员将理解,在其他实施方式中可以使用任何合适的尺寸和形状的丸粒。
211.为了测试水中sr2fe2o5丸粒的离子电导率,用银导电油墨(fisher scientific)涂覆丸粒的两个平坦侧面以形成ag电极。将具有ag油墨涂层的丸粒在130℃下干燥150分钟。然后将具有在两层银网之间的丸粒的夹层结构单元固定在夹具中,其中该单元浸没在液态水中。然后使用具有10mv振幅和100000-0.01hz频率范围的solartron1470/1455来进行电化学阻抗谱(eis)。记录在丸粒上的dc电压和通过其的电流,从而得出对于电子传导的电阻。电导率结果示于图2中。发现其在水中于90℃获得的最高离子电导率为0.041s/cm,离子
迁移数(ti)为99.8%。随着温度降低,电导率降低。图11提供了浸入水中后的电解质104的xrd数据,显示出该结构受到水合的影响(与图10相比)。
212.技术人员将理解,结构和组成以各种复杂的方式相互作用,以提供初始氧化物和所产生的羟基氧化物或水合氧化物的反应性和导电性,因此进行广泛的研究和实验以找到合适的一组陶瓷氧化物起始材料。此外,与水的反应产生羟基氧化物或水合氧化物可改变材料的结构,使得电解质材料可具有与起始材料氧化物不同的结构。收集数据以证明使用这些材料作为燃料电池中的电解质。
213.图8a示出了使用由sr2fe2o5制备的电解质的燃料电池的电流-电压(iv)曲线,比较在相同条件(60℃的工作温度,使用1摩尔(1m)溶液液体燃料)下使用甲醇和乙醇作为燃料。图8b示出了在不同温度下使用1m氨溶液作为燃料的相同燃料电池的iv曲线。对于这些燃料电池测试,使用先前在1200℃的氩中加热过的具有15mm直径和0.8mm厚度的盘形sr2fe2o
55
丸粒作为电解质。阳极和阴极由20重量%的pt/c形成,添加pap-bp-100离聚物并且使用碳布作为基材(papr-bp-100是指具有n-甲基-4-哌啶酮、2,2,2-三氟苯乙酮和联苯的聚(芳基哌啶鎓)聚合物,n-甲基-4-哌啶酮和芳基单体的摩尔比为1:1)。为了制备pt/c电极,将68mg的市售pt/c(20重量%的pt)在超声处理浴(fisherbrand fb15051)中于125μl去离子水、125mg异丙醇和385μl的5重量%的pap-bp-100离聚物溶液的混合物中超声分散1小时。用5重量%的hcl和异丙醇预处理碳布以除去杂质和污染物。超声处理之后,将油墨刷在干净的碳布上,将电极置于80℃的干燥烘箱中并干燥8小时。电极的pt负载量为0.77mg/cm2。燃料电池100组装在燃料电池夹具中。sr2fe2o5电解质104夹在阴极和阳极之间。燃料电池的有效面积是1
×
1cm2。在测试中使用甲醇、乙醇和氨各自的1摩尔水溶液作为燃料。将燃料溶液缓慢地泵送到阳极室中,并且将加湿的压缩空气(使用鼓泡装置获得)从相反方向引入到阴极室中。通过以10rpm旋转的泵控制燃料溶液的流速,产生约0.5ml/min的溶液流速。控制空气流速为20ml/min。在所描述的实施方式中,电解质在插入到燃料电池中之前不用水处理,作为替代,在燃料电池测试之前,将电解质在具有燃料和加湿空气的燃料电池中原位放置过夜,从而与水反应,因此在使用之前原位进行水处理。在使用气体燃料代替水性燃料的实施方式中,燃料电池100可以在使用之前浸泡在水中,和/或电解质104可以在插入到燃料电池100中之前浸泡在水中,以允许足够的时间来使电解质104与水反应,并获得足够的离子电导率。
214.使用由电化学软件corr-ware/corrview控制的solartron 1287a电化学界面测试燃料电池100的性能。燃料电池性能数据在图8a和8b中示出。总的来说,发现增加温度和氨浓度提高了燃料电池的开路电压(ocv)。因此,sr2fe2o5型电解质104显示为用于直接甲醇、乙醇和氨燃料电池的有前景的电解质材料,并且特别是对于氨燃料电池应用具有良好的适合性,因为发现当使用浓氨作为燃料时燃料电池具有0.44v的ocv。由于该燃料电池的电解质104是固体的、相对致密的、烧结的丸粒,并具有相对较低的孔隙率和高曲折度,因此避免了燃料交叉。
215.找到的sr2fe2o5作为一部分的氧化物家族具有通式a2b2o5±
δ
和钙铁石结构。该家族包括混合的钙铁石氧化物,其中a位点和/或b位点包含元素的混合物而不是单种元素(即,在所述通式中,a可以用a和a’替换,和/或b用b和b’替换,从而得到a
2-x
a’xb2-yby
o5±
δ
)。下文中可以使用简化式a2b2o5±
δ
等,但是技术人员将理解,这并不旨在排除具有混合a位点和/或
b位点元素的氧化物。类似地,更一般化的化学式不旨在排除具有一种a位点和/或b位点元素的氧化物。在此,a、a’用于a位点元素,b、b’用于b位点元素。然而,技术人员将理解,可以仅存在一种a位点元素或b位点元素,或者可以存在多于两种a位点元素或b位点元素(例如,每个位点三、四或五种不同元素)。所使用的通式被选择为强调a和b位点两者都可以被混合元素占据,而不是将所描述的实施方式限制为在每个位点仅具有一种或两种元素。
216.在描述的钙铁石氧化物中,a和a’(当存在时)选自ca、sr、ba、ln(即,任何镧系元素)、y、na、k、rb、cs、pb和bi。更具体地,a和/或a’可以是ca、sr或ba。
217.在描述的钙铁石氧化物中,b和b’(当存在时)选自ln、y、sc、mg、ca、sr、li、na、co、fe、mn、in、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、cd、te和ta。在一些这样的实施方式中,b和b’(当存在时)可选自zr、ce、in、y、la、te、co、fe、mn、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、as和ta(铟可以可选地也包括在该列表中),并且包括zr、ce、y、ti、v、cr、mn、fe、co、ni、te和cu中的至少一种。更具体地,b和/或b’可以是zr、ce(镧系元素,ln)、y、ti、mn、fe或co。
218.此外,一些氧可以用n、cl、f、br、s和/或se替换,从而提供掺杂的氧化物(例如,如果n替换一些氧,则提供氮氧化物)。例如,氮氧化物(例如sr2fe2o
5-x
ny或srfeo
2.5-x
ny(oh)m·
nh2o)可用作电解质材料。因此,上述通式中的o5±
δ
可以用o
5-z
±
δcz
替换,其中c表示掺杂元素。因此,本文使用的术语“氧化物”旨在包括掺杂氧化物,例如氮氧化物。明确示出可选掺杂的钙铁石氧化物的通式可以写为:(a
2-x
a’x
)
1-ab2-yby
(o
1-zcz
)5±
δ
。替换一些氧的掺杂剂元素c通常选自n、cl、f、br、s和se。
219.a的值通常小于或等于0.3,可选地≤0.2,进一步可选地≤0.1(对于a位点缺乏的钙铁石氧化物,这可能是特别有可能的)。在各种实施方式中,对于阴离子掺杂的钙铁石氧化物,a的值小于或等于0.15,可选地≤0.10,进一步可选地≤0.05。z的值通常小于或等于0.04,并且可选地≤0.02。在各种实施方式中,z的值小于或等于0.02,并且可选地≤0.01。
220.在与水反应之后,可形成羟基氧化物和/或水合氧化物。水合钙铁石氧化物的通式为(a
2-x
a’x
)
1-ab2-yby
(o
1-zcz
)5±
δ
·
n’h2o,其中n’≥0.01。下面更详细地讨论羟基氧化物。
221.图3示出了一般的钙铁石结构,更具体地示出了sr2co2o5的结构。a位点离子(在此情况下为锶)由暗灰色球体表示。b位点离子(在此情况下为钴)由多面体表示。氧离子(在此情况下不与另一c位点离子混合)由亮灰色球体表示。这些类型的氧化物(或掺杂氧化物,例如氮氧化物)富含氧空位,其可吸附水形成a2b2o5(oh)m(非水合羟基氧化物)或a2b2o5(oh)m·
nh2o(水合羟基氧化物)。oh-和/或h
+
离子在a2b2o5(oh)m·
nh2o晶格中是可移动的,导致高离子传导(非水合羟基氧化物具有n=0)。如上所述,该通式可以概括为a
2-x
a’xb2-y
b’yo5-zcz
(oh)m·
nh2o。所选家族的氧化物可具有相对较高密度的氧或阴离子空位。在这些氧化物在适当的条件下用水处理后,即使在相对较低的温度(低于100-200℃,可选地为大约25℃)下,这些空位的先前位置处或附近的晶格水或oh-也可用于传导h
+
和/或oh-离子。
222.通常,离子电导率的最小要求是1.0
×
10-2
s/cm,以便使用这些材料作为电化学装置100(例如燃料电池、电解槽和气体分离器/净化器)的电解质104(或其他离子传导层)。对于蓄电池,要求通常略低。在较高温度下,离子电导率通常增加,但甚至在室温左右的温度(20-25℃)下,电导率显示为高于此极限。因此,这些材料可以用于电解质104以在大约室温下以及在更高的温度下工作。因此,室温燃料电池和电解槽100可以使用这些陶瓷电解质材
料。有利地,材料可以在低于500℃、可选地低于100℃或60℃的温度下使用。例如,如本文所述的电解质104可具有0至600℃、可选地为0至400℃、进一步可选地为0至200℃的工作温度。在一些实施方式中可以应用例如10℃、15℃或20℃的工作温度的下限。因此,在相对较低的温度和室温下,电化学装置100可使用如本文所述的电解质104(或其他离子传导层)。
223.由这些材料制成的纯陶瓷电解质104是固态的,并且可以使用标准制造技术制得致密且稳固,从而解决与目前使用的聚合物膜电解质或koh型碱性电解质有关的交叉问题。
224.上面提到了高密度的氧或阴离子空位,其有助于提供高离子电导率和高离子迁移数,然而,发现这不是唯一的因素。特别地,在本文中考虑下面的相互关联的因素。
225.(1)起始材料结构:高离子电导率与起始氧化物的结构有关。例如,具有萤石结构的掺杂ceo2具有相对较高密度的氧空位,但按照下文所述的制备方法对ce
0.5
la
0.5o2-δ
进行实验,得到的材料电导率太低,而且也是离子/电子混合传导而不是纯离子传导。因此,高浓度的氧空位不能确保高离子电导率。
226.(2)起始材料氧空位位置:发现形成连续通道的有序氧空位(例如用于钙铁石氧化物)或至少局部有序(如在钙钛矿中)提供了改善的离子电导率。
227.(3)起始材料组成:实验表明期望起始氧化物与水的相对较高反应性;特别是具有形成(可选地水合的)羟基氧化物和水合氧化物的趋势。发现与水的反应性(其与起始氧化物的结构和组成相关)是形成具有高离子电导率的纯离子导体的重要性质。发现能够形成羟基氧化物的起始材料在一些实施方式中是特别有益的。
228.(4)水合过程:发现形成水合氧化物或羟基氧化物在形成具有足够高的离子迁移数的离子传导材料方面具有强烈的影响。在一些氧化物(例如srzr
0.8y0.2o3-δ
和srce
0.8y0.2o3-δ
)中,由于在b位点处掺杂有低价元素,因此存在外来氧空位。在一些情况下,当在a位点掺杂低价元素以产生a位点缺乏的氧化物时,也可引入氧或阴离子空位。对于大多数材料,例如srzr
0.8y0.2o3-δ
、srce
0.8y0.2o3-δ
、srti
0.7
fe
0.3o3-δ
和srti
0.7
co
0.3o3-δ
,其在空气中煅烧之后获得钙钛矿相(可以包含少量的次要相),然后在水中处理,它们显示出具有高离子迁移数的高离子电导率。离子传导与化学组成高度相关。通常,当与液态水接触时,由固定价态元素组成的氧化物可能是良好的纯离子导体,而当与液态水接触时,由多价元素组成的氧化物可能是电子或混合的离子/电子导体。该材料的精确化学组成也非常重要。例如,当仅在空气中煅烧时,srti
0.5
fe
0.5o3-δ
在水中是混合离子/电子导体,而srti
0.7
fe
0.3o3-δ
在水中主要是离子导体。增加srti
1-x
fe
xo3-δ
系列中的ti含量可以将材料从电子改变为混合的离子/电子导体,然后主要是离子导体。选择为起始材料的家族的未经处理的氧化物(通常具有钙钛矿或钙铁石结构)通常是电子导体、半导体或离子和电子绝缘体,在如本文所述制备和处理时,仅获得它们的离子传导特性。离子电导率通常不足以用作电解质104。在用水水合时,陶瓷材料的结构受到影响。发现用具有所列出的结构的材料开始提供用于在水合材料中扩散离子(例如oh-或h
+
离子)的足够路径。在存在oh-离子或新的o-h键的情况下,促进oh-和/或h
+
离子的连续扩散,从而提高离子电导率。特别地,氧化物和水之间的反应形成新的(水合的或无水的)羟基氧化物,导致形成新的键,并且还破坏在起始材料中可用的电子的路径(因此减少或消除电子电导率)。对于具有较低浓度的氧空位的样品,电子的通道可能不完全被阻挡,导致电子导体或混合的电子/离子导体,因此特别是当离子传导层用作电解质(期望最小的电子传导或不需要电子传导)时,较高浓度的氧空位是有利的。当在
不同条件下(例如,在不同气氛(可选的还原性气氛)的不同温度下)煅烧氧化物时,可调整材料组成和/或氧空位的数量。在使经煅烧的氧化物材料与水反应之后,已显示由具有合理高浓度的氧空位的各种陶瓷获得几乎纯离子导电材料。这些材料适合用作电化学装置100的电解质104。当氧空位浓度不够高时,在与水反应之后,可以形成混合的离子/电子导体,在这种情况下,电子传导可能太高而不能用作电解质。然而,这些混合的离子/电子导体可应用为用于一些电化学装置的电极材料或用于气体分离膜。
229.(5)离子尺寸:发现离子电导率与a位点处的阳离子尺寸相关,特别是对于钙钛矿或钙铁石结构氧化物。a位点具有(相对较小的)sr阳离子的氧化物倾向于表现出更高的离子电导率。a位点处具有(较大的)ba阳离子的氧化物倾向于表现出较低的离子电导率。通常,a位点处的大ba
2+
离子将导致大晶格参数,因此在由该起始氧化物形成的羟基氧化物中的相邻oh-离子之间的间隙更大。oh-离子或h
+
离子经由oh-离子或晶格h2o的跳跃或扩散随着较大间隔变得更加困难,导致较低的离子传导。然而,当a位点离子太小,例如在一些结构中具有ca
2+
离子时,则通常发现所形成的羟基氧化物对于用作电化学装置100中的电解质104而言具有太高的电子传导。因此,a位点离子的大小被选择为足够大以破坏电子的路径,但足够小以允许离子“跳跃”以用于离子传导。特别地,认为a位离子尺寸影响电解质材料中的oh键分离。发现由ba2fe2o5±
δ
形成的羟基氧化物的离子电导率低于由sr2fe2o5±
δ
形成的羟基氧化物的离子电导率。这被认为可能是由于a位点存在大阳离子使得由ba2fe2o5±
δ
形成的羟基氧化物中的相邻oh键之间的距离/间距较长,使得oh-/h
+
离子的跳跃更困难。具有如本文中所详述的组成的氧化物可形成具有用于离子的适当尺寸的扩散通道的羟基氧化物。如果通道太窄(当使用较小的a位点阳离子时),则离子(oh-和/或h
+
离子)的迁移可能受到限制。当通道太大(例如,具有较大a位点阳离子,例如ba
2+
)时,离子从一个位点跳跃到下一可用位点可能变得困难,导致较低的离子电导率。在各种实验中,显示在a位点处具有sr
2+
离子的样品表现出最高的离子电导率。然而,为离子提供途径的通道的尺寸也与b位点离子的尺寸和晶体结构有关。因此,可以通过在a和/或b位点用阳离子掺杂来调整通道尺寸。阳离子尺寸的影响在不同的晶体结构之间也可能变化。
230.技术人员将理解,因此需要仔细调整起始氧化物的组成和结构以产生具有适合于电解质104的性质的材料。特别地,可能期望使具有合理高数量密度的氧空位的材料具有层状结构,或者由此形成的(水合的或无水的)羟基氧化物(在用水处理之后)具有用于oh-/h
+
离子的扩散的通道或路径。特别地,具有有序氧空位(例如钙铁石结构)的起始材料氧化物、或富含氧空位且氧空位局部有序的起始材料氧化物(例如各种钙钛矿氧化物)、或具有氧空位的层状氧化物(例如各种k4cdcl6结构氧化物)可以是有利的。
231.如下文更详细地描述,可调整电解质材料的制备方法以提供所需性质。例如,对于具有钙钛矿或钙铁石结构的氧化物,通常,起始材料在具有低氧气分压的气氛(如纯n2、ar或混合n2/ar)中煅烧。可以将还原性气体(通常为h2)和可选的另一种还原性气体(如co)加入到气氛中。在具有低氧气分压和可选的还原性气氛的气氛中煅烧可有助于提高所得经煅烧材料中的氧空位浓度。氧空位的数量增加可促进在水合步骤中形成的羟基氧化物中形成更多的oh-离子,并且还促进将更多的h2o集成到晶格中,从而导致更高的离子电导率。
232.因此,本文所述的固态h
+
和/或oh-离子传导材料可用作电解质104以替换例如现有技术的膜或碱性膜或koh溶液。所描述的陶瓷氧化物起始材料在空气中通常是稳定
的,与co2相容,并且可以是致密的,从而避免燃料交叉。电解质成本也可以较低,因为相对便宜的氧化物材料用于形成电解质104。
233.上述的钙铁石结构材料是提供合适特性的一族材料的实例。迄今为止,在结构方面,找到的满足这些标准并在水合时提供电解质材料的起始材料家族是:
234.a.具有钙铁石结构的氧化物,如图3所示;
235.b.具有钙钛矿结构的氧化物,如图4所示;和
236.c.具有k4cdcl6结构的氧化物,例如ca3co2o6,如图5所示。
237.技术人员将理解,术语“k4cdcl6结构”广泛用于指已知结构的k4cdcl6,无论材料的元素组成如何。k4cdcl6本身不包括在“具有k4cdcl6结构的氧化物”的集合中,因为它不是氧化物。k4cdcl6结构是如图5所示的1d层状结构。该结构包括1d通道,其提供用于扩散离子(例如oh-或h
+
离子)的潜在路径。
238.如上所述,起始材料的元素组成也影响性质,并非所有具有上面列出的结构的氧化物形成所找到的家族的一部分。本文其他地方提供了对各家族的进一步限制,此处为便于参考而提供了各家族的结构定义的列表。此外,随后的水合改变了起始材料的结构和组成以形成电解质材料。通常,选择具有有序氧空位(例如钙铁石结构)或具有高浓度的局部有序的氧空位(例如富含氧空位的钙钛矿氧化物)的起始材料陶瓷氧化物,或者具有氧空位的层状氧化物。在大多数情况下,在与水反应之后,水分子和/或oh-阴离子被引入到b位点四面体的位置处或附近,形成用作离子(例如oh-和h
+
离子)的路径的连续通道。
239.例如,对于家族a的起始材料,即钙铁石结构氧化物,对于仅包含三种元素的简单的未掺杂的钙铁石陶瓷,通式为:a
2-a
b2o5±
δ
。a选自ca、sr、ba、ln(即,任何镧系元素)、y、na、k、rb、cs、pb和bi。b可选自ce、zr、in、y、ti、v、cr、mn、fe、co、ni、cu,并且更通常选自ln、y、sc、mg、ca、sr、li、na、co、fe、mn、in、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、cd、as和ta。对于a位点缺乏的钙铁石氧化物,上述通式中a的值通常小于或等于0.3,通常小于或等于0.2,并且仍进一步可选地小于或等于0.1。
240.在掺杂的钙铁石中,a、b和o中的一个或多个可以被一种或多种其他元素部分地替换,所述一种或多种其他元素再次选自列表以提供期望的性质。掺杂的氧化物的通式可呈现为(a
2-x
a’x
)
1-ab2-yby
(o
1-zcz
)5±
δ
。a和a’是选自上面针对未掺杂氧化物中的a提供的列表的一种或多种元素:ca、sr、ba、ln、y、na、k、rb、cs、pb、bi。b和b’是选自ln、y、sc、mg、ca、sr、li、na、co、fe、mn、in、ni、cu、zn、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、cd、as和ta的一种或多种元素。可选地,b和b’是选自ce、zr、y、co、fe、mn、in、ni、cu、zn、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、ta的一种或多种元素,并且b和b’中的至少一个可选自针对未掺杂氧化物中的b提供的列表:ce、zr、y、ti、v、cr、mn、fe、co、ni、cu。a的值通常如针对未掺杂氧化物所描述。对于阴离子掺杂的钙铁石氧化物,z的值通常小于或等于0.04,并且可选地小于或等于0.02。替换未掺杂氧化物的一些氧的c是选自n、cl、f、br、s、te和se的一种或多种元素。
241.作为该家族的一个实例,sr2fe2o5±
δ
在与水反应形成羟基氧化物之后的离子电导率在90℃下为0.041s/cm,其与市售膜(在96℃下为0.04s/cm)相同,离子迁移数为0.998,因此提供强电解质性能。
242.钙铁石结构属于被配制为a
nbno3n-1
的化合物家族,其中n大于或等于2。该结构包括
(n-1)个共角bo6八面体的交替的钙钛矿型层和一层的bo4四面体行。在钙铁石(a2b
205
,即n=2的特定情况)的结构中,氧空位沿着(010)平面有序,在四面体层中形成用于氧离子迁移的一维(1d)扩散路径。
243.转到家族b的起始材料,即钙钛矿结构氧化物,图4示出了钙钛矿结构,并且更具体地为srcoo
2.64
的结构。该结构是原始钙钛矿的典型。a位点离子(在此情况下为锶)由暗灰色球体表示。b位点离子(在此情况下为钴)由多面体(在这种情况下coo6八面体,其中一些氧位点未被占据)表示。氧离子(在其他实施方式中,氧可与另一c位点离子混合)由亮灰色球体表示。在许多实施方式中,b家族的缺氧钙钛矿结构氧化物材料与水反应形成用作电解质材料的羟基氧化物。
244.应当注意,钙钛矿的最简化的通式是abo3,srcoo
2.64
中的氧的化学计量仅仅是2.64,而不是3,这表示缺氧。通式可重写为abo
3-δ
,δ的值显示缺氧的水平。在一些实施方式中,δ的值可以是零,但是在各种实施方式中可以被选择为大于或等于0.1、0.2、0.3、0.4或0.5。更具体地,“原始”钙钛矿氧化物具有通式abo
3-δ
。如与钙铁石氧化物一样,a、b和o都可以被一种或多种其他元素部分地替换,术语“双钙钛矿氧化物”或“三钙钛矿氧化物”分别用于具有例如两种或三种不同a位点和b位点元素的钙钛矿。这产生更复杂的通式:
245.·
双钙钛矿氧化物:(a
2-x
a’x
)ab
2-y
b’yo6-δ
246.·
三钙钛矿氧化物:(a
3-x-x’a’x
a”x’)ab
3-y-y’b’y
b”y’o
9-δ
247.·
掺杂的双钙钛矿氧化物:(a
1-x-x’a’x
a”x’)
2-ab2-y-y’b’y
b”y’(o
1-zcz
)
6-δ
248.在该起始材料家族中,一种或多种a位点元素选自ca、sr、ba、ln、y、na、k、rb、cs、pb、bi。所述一个或多个b位点元素选自ln、y、sc、mg、ca、sr、li、na、co、fe、mn、in、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、cd和ta。可选地,所述一种或多种b位点元素选自zr、ce、y、co、fe、mn、in、ni、cu、zn、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、ta;并且可以包括zr、ce、y、ti、mn、fe、co、ni、cu中的至少一种。当存在时,c选自n、cl、f、br、s、se。对于a位点缺乏的钙钛矿氧化物,上述通式中a的值通常小于或等于0.15,通常小于或等于0.1,并且仍然进一步可选地小于或等于0.05。对于阴离子掺杂钙钛矿氧化物,z的值通常小于或等于0.2,并且可选地小于或等于0.1。对于未掺杂的氧化物,z的值为零。在使用简化式abo
3-δ
的情况下,应当理解,这通常用于表示掺杂的钙钛矿,其具有任意适当数量的a位点元素和b位点元素,并且可选地部分置换氧。
249.对于具有钙钛矿结构的氧化物,当氧空位浓度增加到某一水平时,氧空位可能不是完全有序的,如通常对于钙铁石结构氧化物的情况那样。然而,部分的局部有序被认为存在,在与水反应之后提供一些用于离子迁移的通道。如果其他因素未改变,则较高浓度的氧空位通常增加离子电导率。作为实例,在图6的图表200中示出了在25℃至90℃下的水合srco
0.5
ti
0.5o3-δ
钙钛矿材料的离子电导率和离子迁移数。图6示出了在室温下将材料浸泡在水中3天之后srco
0.5
ti
0.5o3-δ
的电导率和离子迁移数。离子电导率在室温下为0.016s/cm,离子迁移数为0.997。当温度升至90℃时,离子电导率增加至0.05s/cm,离子迁移数为0.988。该离子电导率高于的离子电导率(在96℃下为0.04s/cm)。用于测试样品的srco
0.5
ti
0.5o3-δ
由标准pechini方法合成。将21.60g sr(no)、14.90g co(no3)2·
6h2o和14.93g钛异丙醇(ti(c3h7o)4)溶解在去离子水中以制备混合溶液。然后将46.58g柠檬酸(c6h8o7)加入到混合溶液中,提供的柠檬酸与金属离子的总摩尔浓度的摩尔比为1.2:1。将
10.03g乙二醇(c2h6o2)(与柠檬酸的摩尔比为2:3)加入到混合溶液中,并在热板上在150℃磁力搅拌6小时以形成凝胶。将凝胶在450℃的恒温下干燥1小时以烧掉有机成分。除去有机成分后,将粉末研磨并在空气中于600℃下焙烧5小时,加热/冷却速率为5℃/min。然后,将粉末再研磨并在空气中于900℃下焙烧9小时以形成srco
0.5
ti
0.5o3-δ
相。然后将制备的粉末造粒并在氩气中在1100℃下煅烧12小时,加热/冷却速率为2℃/min。图12提供了在氩气中煅烧之后丸粒的xrd数据,证实了预期的钙钛矿结构。为了测试水中srco
0.5
ti
0.5o3-δ
丸粒的离子电导率,用银导电油墨(fisher scientific)涂覆丸粒的两个侧面以形成ag电极。将涂覆有ag油墨的丸粒在130℃下干燥150分钟。然后将具有两个银网格层之间的丸粒的夹层结构单元固定在夹具中。然后使用具有10mv的振幅和100000-0.01hz的频率范围的solartron 1470/1455来进行电化学阻抗谱(eis)。通过在丸粒上施加1v的恒定dc电压同时记录样品的电流,利用伪四端子法测量丸粒的dc电导率。电导率和离子迁移数在图6中示出。在水中于90℃获得的srco
0.5
ti
0.5o3-δ
的最高离子电导率为0.050s/cm,离子传导迁移数(ti)为98.8%。在冷却过程中测量电导率。
250.对于具有通式(a
1-x
a’x
)
1-ab1-y
b’yo3-z-dcz
的钙钛矿氧化物,在与水反应之后,可形成具有以下通式的水合钙钛矿氧化物:
251.(a
1-x
a’x
)
1-ab1-y
b’yo3-z-d’cz·
n”h2o。
252.n”为非零,并且通常为n”≥0.01。a、a’、b、b’和c如先前所定义。在其他参数中:0≤x≤1;0≤y≤1;a≤0.15;z≤0.2;并且d≤2。
253.可以将a和b家族的起始钙铁石或钙钛矿结构的氧化物(掺杂的或以其他方式)选择为在b位点含有具有多价的元素,从而容纳氧空位,因为发现这些与经处理的材料的电解质性能相关。然而,也可以使用单价元素。例如,在一些实施方式中,srzr
0.8y0.2
o3可以提供比sr2co2o5更好的性能。例如,在氨燃料电池或氨电解槽中,如果预处理的sr2co2o5用作电解质104,则钴可与氨反应以形成水溶性络合化合物,导致sr2co2o5在工作期间缓慢损失。如srzr
0.8y0.2
o3等材料可避免该问题,因此提供改善的稳定性。
254.a和b家族的所有氧化物可通过煅烧由粉末制备。在引入h2、ch4或co的情况下,可以在空气、n2、ar、he或可选地在还原性气氛中进行煅烧。当制备n掺杂氧化物时,样品可以在nh3中煅烧以引入一些氮。可选地,可以使用与空气相比具有相对较低的氧气分压的气氛,例如与惰性气体(例如氩气)混合的空气。在与水反应之前,这些掺杂或未掺杂的具有钙铁石或钙钛矿结构的氧化物通常是电子导体、半导体或绝缘体。这些氧化物与水反应形成所需的电解质材料。氧化物可通过将它们浸泡在液态水中或通过将其放置在包括至少1体积%的水(作为蒸汽和/或水蒸气)的气氛中而与水反应。氧化物可与h2o反应以形成水合或非水合羟基氧化物,或可形成水合氧化物。
255.由钙钛矿或钙铁石起始材料形成的水合或非水合羟基氧化物的通式可提供为:
256.(a
1-x
a’x
)
1-ab1-yby
(o
3-z-dcz
)(oh)m·
nh2o;其中:
257.a和a’选自ca、sr、ba、ln、y、na、k、rb、cs、pb和bi;b和b’选自ln、y、sc、mg、ca、sr、li、na、co、fe、mn、in、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、cd和ta,并且可选地还有as。可选地,b和b’选自ce、zr、y、in、co、fe、mn、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w和ta,并且可以包括ce、zr、y、ti、v、cr、mn、fe、co、ni和cu中的至少一种。c选自n、cl、f、br、s和se,并且可选地还选自te;0≤x≤1;a≤0.15;z≤0.2;0
≤y≤1;d≤2;m≥0.01;并且n≥0。
258.可选地,对于a位点缺乏的钙钛矿或钙铁石氧化物,a可以小于或等于0.1或0.05。可选地,对于阴离子掺杂钙钛矿或钙铁石氧化物,z可以小于或等于0.1。m的值通常取决于b位离子的价态和氧空位浓度而变化。技术人员将理解,z和d的值通常随着m的值变化。阴离子空位的浓度至少部分取决于(z+d)的值;z+d值越高,阴离子空位(通常为氧空位)越多,并且相应地m的值越高。n的值通常取决于材料的化学组成和周围的蒸汽/水蒸气浓度或液态水的存在而变化。对于掺杂或未掺杂的非水合(无水)羟基氧化物,n=0。水合羟基氧化物的n的值取决于材料的结构和组成,并且可以在实施方式之间广泛地变化,从近零变化到相对较高的值。在各种实施方式中,n的值可以小于或等于15或12,并且可选地小于或等于6。在各种实施方式中,n的值可以为0.1至4,并且可选地为1至2。对于更多孔/不太致密的氧化物材料,和/或通过用水处理更长的时间,可以获得更高的n值。
259.在这些情况下,用作电解质(或其他离子传导层)的离子传导材料是或者包括水合或非水合的掺杂或未掺杂的羟基氧化物形式的材料。在另外或另选的实施方式中,所形成的离子传导材料可以是或者包括由原始起始材料形成的水合氧化物(掺杂或未掺杂的)。
260.对于具有钙铁石结构的陶瓷氧化物起始材料,水合氧化物可具有以下通式:
261.(a
2-x
a’x
)
1-ab2-yby
(o
1-zcz
)5±
δ
·
n’h2o,其中:
262.a和a’选自ca、sr、ba、ln、y、na、k、rb、cs、pb和bi。b和b’选自ln、y、sc、mg、ca、sr、li、na、co、fe、mn、in、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、cd和ta。可选地,b和b’选自ce、zr、y、in、co、fe、mn、ni、cu、zn、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、as和ta。c选自n、cl、f、br、s、te和se。a≤0.15;0≤x≤1;0≤y≤1;z≤0.04;并且n’≥0.01。在一些实施方式中,a≤0.10且z≤0.02。在各种实施方式中,对于a位点缺乏的钙铁石氧化物,a≤0.2,且通常≤0.1。可选地,a≤0.15。在各种实施方式中,对于阴离子掺杂的钙铁石氧化物,z≤0.02,并且可选地z≤0.01。
263.对于具有钙钛矿结构的陶瓷氧化物起始材料,水合氧化物可具有以下通式:
264.(a
1-x
a’x
)
1-ab1-y
b’yo3-z-d’cz·
n”h2o,其中:
265.a和a’选自ca、sr、ba、ln、y、na、k、rb、cs、pb和bi。b和b’选自ln、y、sc、mg、ca、sr、li、na、co、fe、mn、in、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、cd、as和ta。可选地,b和b’选自ce、zr、y、co、fe、mn、in、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w和ta,并且可以包括ce、zr、y、ti、v、cr、mn、fe、co、ni和cu中的至少一种。c选自n、cl、f、br、s、te和se。0≤x≤1;0≤y≤1;a≤0.15;z≤0.2;d≤2;并且n”≥0.01。
266.在一些情况下,羟基氧化物和水合氧化物的混合物可由家族a和/或b起始材料形成。
267.家族c起始材料包括具有k4cdcl6结构的氧化物,如图5所示。家族c氧化物材料(例如ca3co2o6和sr3co2o6)可以在水中反应(例如,通过浸泡在液态水中,或用水蒸气和/或蒸汽进行处理)产生用作电解质材料的羟基氧化物和/或水合氧化物。更具体地,图5示出了一般的k4cdcl6结构,并且更具体地示出了sr3co2o6的结构。a位点离子(在此情况下为锶)由暗灰色球体表示。b位点离子(在此情况下为钴)由多面体表示。氧离子(在其他实施方式中可与一个或多个其他c位点离子混合)由亮灰色球体表示。所述结构具有沿着c轴的co-o链的独特的一维特征,其中co原子形成共享三角棱柱和八面体的配位多面体的交替面。穿过该结
构的1d通道由邻接的多面体提供。
268.作为该家族的实例,发现a位点缺乏的ca3co2o6氧化物材料在浸泡在水中时在90℃下具有0.053s/cm的离子电导率。该电导率高于的电导率,尽管离子迁移数是约0.91,并且可以看到比电解质104所需的电子传导更多的电子传导(这没有由钙钛矿或钙铁石结构起始材料获得的性能强,但在一些应用中仍然是可接受的)。通过调整化学组成,可以进一步提高离子迁移数。
269.具有k4cdcl6结构的氧化物具有下面所示的通式,注意之前关于a和b位点元素的掺杂和数量的评述也适用于该家族:
270.(a
1-x
a’x
)3b
2-y
b’yo6-zcz
271.a和a’选自ca、sr、ba、na、k、rb、cs、ln、y、pb、in、tl和bi。b和b’选自co、fe、mn、ni、cu、ti、v、cr、碱土金属、mg、ca、sr、ba、镧系元素、ln(例如,ce)、zr、sc、y、zn、cd、na、b、ga、ge、al、si、sn、sb、zr、hf、nb、mo、w、ta、pt、ir、ru、li、rh,并且可以可选地包含元素ce、zr、y、sc、ti、v、cr、mn、fe、co、ni和cu中的至少一种。c选自n、cl、f、br、s、i、te和se。y为0至2;z为0至0.5;并且x为0至1。
272.应当理解,对于先前讨论的结构,氧的量可以不正好等于从理想化学计量预期的量。例如,对于未掺杂的氧化物,氧的化学计量值可以比6高或低delta(δ)量——ca3co2o6±
δ
。在所描述的实施方式中,通常优选ca3co2o
6-δ
以提供氧空位。因此,上述通式可以更通常写成(a
1-x
a’x
)3b
2-y
b’yo6-z-δcz
。上面的简化通式并不旨在排除δ的非零值,为清楚起见,简单地没有示出δ。
273.作为家族c的实例,在图7的图表中示出了在25℃至90℃的温度下浸泡在水中三天的ca3co2o6材料的离子电导率和离子迁移数。图7示出了在室温下浸泡3天后的ca3co2o6样品的离子电导率和离子迁移数。离子电导率在室温下为0.021s/cm,离子迁移数为0.881。当温度升至90℃时,离子电导率增加至0.053s/cm,离子迁移数为0.91。离子电导率高于的离子电导率(在96℃下为0.04s/cm)。
274.通过以下方法制备用于测试的a位点缺乏的ca3co2o6:通过溶胶-凝胶工艺合成ca3co2o6。将19.50g ca(no3)2·
4h2o、20.36g co(ch3coo)2·
4h2o和37.25g柠檬酸(c6h8o7)以1:1:2.4的摩尔比溶解在去离子水中以形成混合溶液。将混合溶液在热板上在125℃下磁力搅拌12小时以形成凝胶。将凝胶在450℃的恒温下干燥1小时,以使得混合物中的有机成分被烧掉。将所得粉末研磨并在空气中于600℃下煅烧8小时。然后,将粉末再研磨并造粒,然后在空气中于800℃煅烧10小时以形成ca2co2o5相。此后,将丸粒在空气中于1000℃加热10小时,加热/冷却速率为5℃/min,以形成ca3co2o6相。x射线衍射(xrd)分析表明形成ca3co2o6相,结构为k4cdcl6(图13中所示的数据)。这些xrd数据证实所得的丸粒是单一ca3co2o6相。
275.当起始材料不包括足够的ca而形成ca3co2o6时,据信形成了ca缺乏的ca3co2o6相。在用水处理(在室温下浸泡在液态水中三天)之后,发现该材料在水中在90℃下表现出0.053s/cm的相对较高的离子电导率,离子迁移数为约0.91。虽然不如对于sr2co2o5类氧化物获得的值一样高,但在此水平左右的电导率对于电解质材料仍然可行。此外,存在具有k4cdcl6结构的大量氧化物,并且根据本文描述的原理调整a位点和b位点组成可能进一步改善离子电导率和离子迁移数。为了测试水中ca3co2o6丸粒的电导率,用银导电油墨(fisher scientific)涂覆丸粒的两个侧面以形成ag电极。将涂覆的丸粒在130℃下干燥150分钟。然
后将具有两个银网格层之间的丸粒的夹层结构单元固定在夹具中。然后使用具有10mv振幅和100000hz-0.01hz的频率范围的solartron 1470/1455来进行电化学阻抗谱(eis)。通过在丸粒上施加1v的恒定dc电压同时记录样品的电流以算出电阻,利用伪四端子法测量丸粒的dc电导率。电导率结果示于图7中。在水中于90℃获得ca3co2o6的最高离子电导率为0.053s/cm,离子迁移数(ti)为0.91。在样品冷却过程中测量电导率。
276.应当理解,化学计量比ca3co2o6通常具有低浓度的氧空位。然而,由于本文所述的制备方法,所制备的氧化物表现出ca3co2o6结构,但ca缺乏,因此具有增加的氧空位浓度。相对于空气,在800℃下在ar或n2中煅烧前体可以进一步增加氧空位浓度。由于ca缺乏引入了氧空位,所以空气中的煅烧可以产生具有足够的离子电导率的材料,即使没有随后的步骤(例如使用还原性液体处理或在不同的气氛中煅烧)也是如此。
277.通过用水进行处理来形成从如上所述的源自具有k4cdcl6结构的氧化物(掺杂或以其他方式)的水合氧化物或水合或非水合羟基氧化物,以用作电解质材料。特别地,可以形成以下中的一种或多种:(i)具有通式(a
1-x
a’x
)3b
2-y
b’yo6-zcz
·
nh2o的水合氧化物,其中n大于或等于0.01;或(ii)具有通式(a
1-x
a’x
)3b
2-y
b’yo6-zcz
(oh)m·
nh2o的羟基氧化物,其中m为0.01至6。对于无水羟基氧化物,n等于零。水合羟基氧化物的n的值通常取决于材料的结构和组成,并且可以在实施方式之间广泛地变化,从近零变化到相对较高的值。对于水合羟基氧化物,n通常大于或等于0.01。
278.在各种实施方式中,n的值可以小于或等于15或12,并且可选地小于或等于6。在各种实施方式中,n的值可以为0.1至4,并且可选地为1至2。
279.钙钛矿氧化物——srzr
0.8y0.2o3-δ
和相关材料的实施例
280.1.srzr
0.8y0.2o3-δ-1300air——实验过程:
281.通过溶胶-凝胶工艺合成srzr
0.8y0.2o3-δ
。将10.80g的sr(no3)2、3.83g的y(no3)3·
6h2o、13.15g的zrocl2·
8h2o、5ml硝酸(70%)和38.81g柠檬酸以1:0.2:0.8:1.6:4的摩尔比溶解在去离子水中以制备混合溶液。然后将混合溶液在热板上在90℃下磁力搅拌12h以形成凝胶。将凝胶在400℃的恒温下干燥1h,然后点燃以进行燃烧。在混合物中的有机成分烧掉后,将粉末研磨并在空气中于400℃下煅烧3小时,然后在1000℃下煅烧2小时,以形成srzr
0.8y0.2o3-δ
相。xrd图谱表明了形成了单一相。
282.为了测试srzr
0.8y0.2o3-δ
丸粒在水中的电导率,使用银导电油墨(fisher scientific)涂覆丸粒的两个侧面以形成ag电极。将ag糊剂在130℃下干燥150分钟。涂覆有ag的丸粒在电导率测试之前在90℃的淡水中处理两次,以确保材料被水合。将所得的夹层结构单元组装上在两层银网之间的丸粒,并固定在夹具中。然后使用具有10mv振幅和1mhz-0.01hz频率范围的solartron 1470/1455进行电化学阻抗谱(eis)。通过在丸粒上施加1v的恒定dc电压同时记录电流以得出对于电子传导的电阻,利用伪四端子法测量丸粒的dc电导率。由于对一系列的丸粒使用相同的制备方法和电导率测试的性能,因此下文为了便于提及,该方法被称为“方法1”。
283.2.mzr
0.8y0.2o3-δ
(m=ca,sr,ba)丸粒——实验过程:
284.通过溶胶-凝胶工艺合成mzr
0.8y0.2o3-δ
(m=ca,sr,ba)。将m(no3)2(m=ca,sr,ba)、y(no3)3·
6h2o、zrocl2·
8h2o、硝酸和柠檬酸以1:0.2:0.8:1.6:4的摩尔比溶于去离子水中以制备混合溶液。然后将混合溶液在热板上在90℃下磁力搅拌过夜以形成凝胶。然后将凝胶
在400℃的恒温下干燥1h,并点燃以进行燃烧。在混合物中的有机成分烧掉后,将粉末研磨并在空气中于400℃下煅烧3小时,然后在1000℃下煅烧2小时。之后,将粉末再研磨并造粒,然后在空气中煅烧。通过在1300℃下处理24小时形成srzr
0.8y0.2o3-δ
相,通过在1300℃下处理4小时形成cazr
0.8y0.2o3-δ
相,通过在1500℃下处理4小时形成bazr
0.8y0.2o3-δ
相。
285.为了测试mzr
0.8y0.2o3-δ
(m=ba,ca,sr)丸粒在水中的的电导率,再次进行如上所述的方法1。
286.3.srzr
1-xyxo3-δ-1300air(x=0至0.2)丸粒——实验过程:
287.通过溶胶-凝胶工艺合成srzr
1-xyxo3-δ-1300air(x=0至0.2)。在x=0.2、0.1和0时,将sr(no3)2、y(no3)3·
6h2o、zrocl2·
8h2o、硝酸和柠檬酸以1:0.2:0.8:1.6:4的摩尔比溶于去离子水中以制备混合溶液。然后将混合溶液在热板上在90℃下磁力搅拌过夜以形成凝胶。然后将凝胶在400℃的恒温下干燥1h,并点燃以进行燃烧。在混合物中的有机成分烧掉后,将粉末研磨并在空气中于400℃下煅烧3小时,然后在1000℃下煅烧2小时。之后,将粉末再研磨并造粒,然后在1300℃的空气中焙烧24小时,加热/冷却速率为5℃/min,以形成srzr
0.8y0.2o3-δ
相。xrd图谱表明获得了单一相。
288.为了测试srzr
1-xyxo3-delta-1300air(x=0至0.2)丸粒在水中的电导率,再次进行方法1。
289.结果:
290.制备的srzr
0.8y0.2o3-δ
的主要相是具有srzro3结构的固溶体(pdf卡编号31-1365),并且还包含微量的sry2o4(pdf卡号32-1272)。图14中所示的srzr
0.8y0.2o3-δ
的xrd图谱示出了所形成的是几乎纯的固溶体相。
291.将各种样品各自在水中在90℃下加热一天,然后冷却至室温。然后换水,再加热至90℃,然后再次冷却至室温,重复该过程三次。该过程避免了可能在sro与h2o反应时形成的任何未反应的杂质,例如sro或sr(oh)2。然后在初始处理之后,在随后的冷却过程中获得图15中所示的电导率数据。通常,在srzr
1-xyxo3-δ
系列中,随着x的值增加,更多的氧空位被引入到晶格中。在水中处理之后,srzr
0.8y0.2o3-δ
样品表现出最高的离子电导率,因为其在b位点具有最高的掺杂水平。然而,这不是唯一的因素。例如,在srce
1-xyxo3-δ
系列中,在90℃的热水中处理之后,未掺杂的srceo
3-δ
的离子电导率高于srce
0.9y0.1o3-δ
的离子电导率。因此,一些具有很少氧或阴离子空位的未掺杂材料在水中(特别是热水)处理之后也可表现出较高的离子电导率。然而,当在水中测量时,srceo
3-δ
的离子电导率仍然低于重度掺杂的样品srce
0.8y0.2o3-δ
的离子电导率。这表明引入另外的氧空位仍然是获得具有高离子电导率的材料的极好策略。
292.这些实验(其结果在图15中示出)表明在srzr
1-xyxo3-δ
固溶体中,在更高的y掺杂下,样品具有更多的氧空位,导致更高的离子电导率。离子电导率与氧空位相关。此外,如图16所示,在相同的掺杂水平,可以看出离子电导率与钙钛矿氧化物中a位点的阳离子尺寸有关。srzr
0.8y0.2o3-δ
样品表现出测试组的最高离子电导率。
293.对于在mzr
0.8y0.2o3-δ
(m=ca,sr,ba)系列中的常规质子导体,预期样品bazr
0.8y0.2o3-δ
在高于500℃的温度下表现出最高的h
+
或混合的h
+
/o
2-电导率,因为其具有最大的晶胞体积,因此具有更多的“自由体积(晶格中未被离子占据的空间)”以允许传输h
+
/o
2-离子。然而,在本文报道的研究中,使用水处理,发现样品srzr
0.8y0.2o3-δ
在mzr
0.8y0.2o3-δ
(m
=ca,sr,ba)系列中表现出最高的离子电导率,远高于cazr
0.8y0.2o3-δ
和bazr
0.8y0.2o3-δ
的离子电导率,表明迁移离子的类型(h
+
/oh-离子,不是h
+
/o
2-离子)可能不同,所述材料提供不同的传输机制。发现srzr
0.8y0.2o3-δ
在液态水中是混合的h
+
/oh-离子导体,其在高温下与质子传导特性非常不同。
294.因此推断出,当晶格参数太大时,相邻空位位点之间的距离太长,因此离子难以跳跃或扩散。当晶格参数太小时,自由体积(未占用空间)太小,这也使得离子的跳跃/扩散变得困难。无论是bazr
0.8y0.2o3-δ
中过大的“自由体积”还是cazr
0.8y0.2o3-δ
中过小的“自由体积”都不会导致水中的高离子电导率,相反,这两者之间存在优化的晶格尺寸或“自由体积”。特别地,srzr
0.8y0.2o3-δ
的样品表现出测试样品的最高离子电导率。对于h
+
/oh-的跳跃/迁移,两个可用相邻位点之间的距离不能太长,从而形成用于传输h
+
/oh-离子的连续路径。这可能是bazr
0.8y0.2o3-δ
样品具有更大的“自由体积”并且在暴露于水时表现出比srzr
0.8y0.2o3-δ
样品更低的离子电导率的原因。cazr
0.8y0.2o3-δ
的离子电导率低于srzr
0.8y0.2o3-δ
的离子电导率,这是因为其具有更小的“自由体积”。因此,在a位点处存在优化的离子尺寸,在“自由体积”和h
+
/oh-离子的跳跃/迁移距离之间平衡,以实现最高的离子电导率。
295.如图17所示,在90℃下,观察到srzr
0.8y0.2o3-δ
在水中的电导率略微降低,然后在75小时之后稳定,表明优异的稳定性。
296.图18示出了在不同温度下srzr
0.8y0.2o3-δ
在湿空气中的离子电导率。在低于100℃的温度下,可以看出电导率随着温度升高而增加。然而,当温度高于100℃时,电导率显著下降,为10-6-10-5
s/cm。该实验表明srzr
0.8y0.2
o3的高离子电导率在低温(通常低于100℃)下与水或蒸汽相关。这与所报道的用作固体氧化物燃料电池和固体氧化物电解池的电解质的钙钛矿氧化物在高温(通常高于500℃)下的质子传导或混合的h
+
/o
2-离子传导非常不同。图19更详细地示出了低于100℃的温度下的电导率和离子迁移数的变化。离子迁移数超过99.6%,表明所述材料是适合用作各种电化学装置的电解质的良好的离子导体。
297.图20提供了随时间的电导率数据。该实验表明,当水可以作为蒸汽或加湿的气态气氛而不是作为液体供应时,srzr
0.8y0.2o3-δ
的电导率在湿空气中是稳定的,因此表明所述材料适合用作燃料电池或其他电化学装置的电解质(因为当在加湿的气氛中暴露时保持高离子电导率)。当用作在阳极处供应加湿氢气并且在阴极处供应加湿空气或o2的直接氢燃料电池的电解质膜(可选地作为增强柔性和机械强度的复合物的一部分)时,这是特别有用的。这样的电极膜可以用聚合物交换膜电解质替换用于氢燃料电池的现有技术的膜电解质,从而降低成本。与酸性nafion膜不同,本文所述材料的酸性弱得多,并且一些甚至可以是碱性的。因此,所述材料也可以用作碱性膜燃料电池的电解质膜。由于这些氧化物中的大多数与空气中的co2化学相容,因此常规碱性膜由于空气中的co2中毒(其导致oh-离子电导率降低)对于这些电解质材料将不会是问题。因此,所公开的材料可克服常规碱性膜燃料电池和电解槽的最大挑战(避免co2中毒)。
298.在d2o中测试srzr
0.8y0.2o3-δ-1300air丸粒——实验过程:
299.为了测试h2o和d2o中srzr
0.8y0.2o3-δ
丸粒的电导率,再次进行如上所述的方法1。电导率测试的结果示于图21中。
300.发现srzr
0.8y0.2o3-δ
在d2o中的电导率远低于在h2o中的电导率,表明离子传导与如h
+
和/或oh-离子等含氢物种的迁移相关。根据下面描述的浓差电池测量,材料表明为混合的h
+
/oh-离子导体,但主要是oh-离子导体。材料是否主要是h
+
或oh-导体可取决于结构、化学组成、温度和水合水平中的一个或多个。
301.图22示出了在室温下测量的水合(实线)和氘代(虚线)srzr
0.8y0.2o3-δ
的1h-mas固态nmr数据。在3.52ppm和0.71ppm的化学位移处的两个峰分别对应于zr-oh-zr和zr-oh-y。已经证实,h
+
或oh-离子形式的0.71ppm的化学位移处的氢是可移动的。当样品脱水时,0.71ppm处的峰变得非常弱,表明其与物理和/或化学吸附的水相关。这表明,加湿环境对于保持材料水合是非常重要的,以保持高离子电导率,这可以通过与液态水的直接接触或在具有至少5体积%的水(例如,作为蒸汽)的气氛中暴露来实现。当相同的材料被置于不同的环境中时,它们可以表现出非常不同的传导特性。
302.为了测定材料是h
+
或oh-离子导体还是混合的h
+
/oh-离子导体,按照j.am.chem.soc.2013,135,1112-11130中描述的方法,使用浓差电池。对于在室温下浸入水中的陶瓷氧化物电解质srzr
0.8y0.2o3-δ
,发现在h池中30分钟之后的oh-的迁移数为0.80。
303.通过该测量,在水中,srzr
0.8y0.2o3-δ
显示为混合的h
+
/oh-离子导体,但主要是oh-离子导体。这非常不同于类似氧化物(例如掺杂的bazro3和baceo3),后者在高于500℃的温度下称为h+离子或混合的h
+
/o
2-离子导体,并且在那些条件下用作燃料电池或电解池的电解质。相比之下,为本文所述的离子传导层选择的工作温度通常被选择为低得多,通常在100℃以下,并且提供水或加湿的气氛。在低于100℃的加湿环境中,传导物种为h
+
/oh-离子,而相同材料可在高于500℃的温度下充当o
2-/h
+
离子导体。如图18所示,在高于200℃的温度下,srzr
0.8y0.2o3-δ
在湿空气中的电导率为约10-6
s cm-1
,其通常太低而不能用作电化学装置的电解质。然而,当与液态水接触或暴露于加湿空气(图16-20)时,其离子电导率在低于100℃的温度下为10-3
~10-2
s cm-1
,同时还表现出良好的稳定性。由于10-3
~10-2
s cm-1
的离子电导率高到足以用作电化学装置中的电解质,因为该氧化物被显示为实际上有用的材料。
304.sr2co2o5305.在空气中煅烧的sr2co2o5丸粒——实验过程:
306.sr2co2o5通过标准固态技术制备。将21.59g sr(no3)2和29.79g co(no3)2·
6h2o研磨形成混合物,然后在空气中于600℃以1℃/min的冷却速率焙烧8小时。然后,将粉末研磨并在空气中于1100℃下以1℃/min的冷却速率焙烧3小时,以形成srcoo
2.5
相。此后,将制备原样的粉末造粒并在空气中于1100℃下以1℃/min的冷却速率烧结3小时。在图23中示出的xrd图谱表明形成了单一相。为了测试水中sr2co2o5丸粒的电导率,再次使用如上所述的方法1。在图24中示出的电导率数据表明在空气中煅烧的纯sr2co2o5在水中主要是电子导体。xrd显示在电导率测试之后保持单一相,表明所述相是稳定的。然而,xrd不能排除sr2co2o5与h2o反应形成羟基氧化物的可能性,因为这不能通过xrd检测,这是由于其对元素氢不灵敏。
307.在空气中煅烧然后用氩处理的sr2co2o5丸粒——实验过程:
308.sr2co2o5通过标准固态技术制备。将21.59g sr(no3)2和29.79g co(no3)2·
6h2o研磨形成混合物,然后在空气中于600℃以1℃/min的冷却速率焙烧8小时。然后,将粉末研磨并在空气中于1100℃下以1℃/min的冷却速率焙烧3小时,以形成sr2co2o5相。此后,将制备原样的粉末造粒并在1100℃下于氩气中加热8小时以增加固体结构的氧空位。为了测试sr2co2o
5-1100ar丸粒在水中的电导率,再次进行方法1。如图25所示,在电导率测试之后,在
样品的xrd图谱中观察到co(oh)2的一些峰。
309.通过从cocl2和naoh的共沉淀制备一些co(oh)2粉末,然后将其直接压制成丸粒以测试其在水中的电导率。图25中所示的xrd数据证实合成的co(oh)2是单一相。图26示出了在冷却时测量的sr2co2o5在水中的电导率数据,并且图27示出了纯co(oh)2样品在水中的电导率数据,显示出在相同条件下电导率比在ar中煅烧的sr2co2o5丸粒的电导率低两个数量级。该实验表明在ar中煅烧之后的sr2co2o5的高离子电导率并非由于任何形成的co(oh)2所致。
310.在空气中煅烧然后在还原性液体中处理的sr2co2o5丸粒——实验过程:
311.再次通过标准固态技术制备sr2co2o5。将21.59g sr(no3)2和29.79g co(no3)2·
6h2o研磨形成混合物,然后在空气中于600℃以1℃/min的冷却速率焙烧8小时。然后,将粉末研磨并在空气中于1100℃下以1℃/min的冷却速率焙烧3小时,以形成sr2co2o5相。此后,将制备原样的粉末造粒并在空气中于1100℃下以1℃/min的冷却速率烧结3小时。xrd图谱表明形成了单一相。
312.为了增加固体结构的氧空位,在室温下将sr2co2o
5-1100air丸粒浸入由2m naoh和14m nabh4组成的还原剂中5天。然后将丸粒用去离子水冲洗数次,并将其浸入去离子水中12小时,以洗掉丸粒上的残留还原剂。
313.为了测试水中sr2co2o
5-nabh4丸粒的电导率,再次进行方法1。图28中所示的经处理的丸粒的电导率数据证实,当材料暴露于液态水或加湿条件时,在还原性液体中处理氧化物可将诸如sr2co2o5等正常电子导体转化为离子导体。该方法可应用于其他材料,特别是在组成中具有多价元素的那些。
314.在空气中煅烧然后电化学还原(er)的sr2co2o5丸粒——实验过程:
315.再次通过标准固态技术制备sr2co2o5。将21.59g sr(no3)2和29.79g co(no3)2·
6h2o研磨形成混合物,然后在空气中于600℃以1℃/min的冷却速率焙烧8小时。然后,将粉末研磨并在空气中于1100℃下以1℃/min的冷却速率焙烧3小时,以形成sr2co2o5相。此后,将制备原样的粉末造粒并在空气中于1100℃下以1℃/min的冷却速率烧结3小时。xrd图谱表明形成了单一相。
316.将电化学还原工艺应用于sr2co2o5丸粒,以增加固体结构的氧空位。用银导电油墨(fisher scientific)涂覆丸粒的两个侧面以形成ag电极。将ag糊剂在130℃下干燥150分钟。将由8g sr(oh)2·
8h2o和30ml去离子水组成的过饱和sr(oh)2溶液用作电解质。涂覆有ag糊剂的sr2co2o
5-1100air丸粒、pt网和ag/agcl分别用作工作电极、对电极和参比电极。通过电化学界面(solartron 1287a)将电化学还原电压控制在-1.14v vs.ag/agcl持续10小时。然后将丸粒用去离子水冲洗数次,并将其浸入去离子水中2小时,以洗掉丸粒上的残余sr(oh)2。此后,将丸粒在室温下干燥并通过银导电油墨(rs成分)再涂覆,以用于进一步的电导率测试。为了测试水中sr2co2o
5-er丸粒的电导率,进行方法1,但不包括添加银油墨层,而是使用已经添加的银油墨。图29示出了在水中的电导率测试之后的电化学还原的sr2co2o5丸粒的xrd图谱。主要相保持但其不良地结晶。图30示出了浸入水中的丸粒的获得的电导率数据。在电化学还原之后,水中sr2co2o5的离子迁移数超过0.9,表明该材料主要是离子导体。该实验表明,当暴露于水时,电化学还原过程还可以将电子导体转化为主要的离子导体。同样,该方法可应用于其他材料,特别是在组成中具有多价元素的那些。
317.在一些实施方式中,对于所描述的任何家族和材料,形成纯陶瓷电解质104。该电解质104可至少基本上由如上所述的一种或多种水合氧化物和/或水合或非水合羟基氧化物组成。这些材料可通过在选定气氛中和在选定温度下烧结所制备的粉末而形成,从而形成具有所需性质的固体陶瓷电解质104。在另选实施方式中,形成复合陶瓷-聚合物电解质104。
318.固体离子传导层104可以是包含与一种或多种聚合物材料混合形成复合材料的如本文所述的至少一种水合氧化物或水合或非水合羟基氧化物的复合固体离子传导层。另选地或另外地,氧化物或羟基氧化物可以与结晶或非结晶的一种或多种金属或陶瓷材料混合形成具有良好机械强度的复合材料,同时保持足够的离子电导率。当离子导体以合适的体积比与聚合物材料、陶瓷材料或非金属材料(例如碳/石墨)混合时,如果聚合物或非金属材料本身不是电子导体,则新的复合材料将是适合用作电化学装置的电解质的纯离子导体。当离子导体与导电聚合物(例如聚吡咯(ppy)或聚苯胺(pan))、金属或电子导电非金属材料(例如碳、石墨烯、石墨和/或一种或多种电子导电氧化物/氮化物/碳化物)混合时,新形成的复合物将是混合的离子/电子导体。在适当的体积比下,当如srti
0.5
fe
0.5o3-δ
等混合的离子/电子导体与任何其他电子导体或绝缘体混合时,新形成的复合材料可能将是混合导体。
319.复合陶瓷-聚合物电解质104可包含与一种或多种聚合物混合的如上所述的一种或多种水合氧化物和/或水合或非水合羟基氧化物。在一些实施方式中,如上所述的一种或多种水合氧化物和/或水合或非水合羟基氧化物是陶瓷-聚合物电解质104的唯一离子导体;在其他实施方式中,所选择的聚合物可提供一些离子电导率。聚合物成分可为陶瓷提供柔性支持基质。陶瓷可作为粉末提供而与聚合物组合。当制备陶瓷-聚合物复合电解质104时,通常不需要或实际上希望烧结陶瓷粉末。然而,在一些实施方式中,发现在相对较高的温度下(通常在还原性气氛或具有低氧气分压的气氛中)煅烧粉末有利于在氧化物粉末中形成所需的氧空位。
320.用于制备陶瓷-聚合物复合电解质的典型方法可以如下。获取合适的陶瓷氧化物起始材料。如果该材料具有不足的氧空位浓度,则所述材料可以在具有低氧气分压的气氛中或可选地在还原性气氛中煅烧,以引入更多的氧空位。例如,材料可在5体积%的h2/ar或5体积%的h2/n2中煅烧。该步骤的煅烧温度可以为200℃至1200℃,并且可选地为200℃至700℃,其中基于材料的组成和结构来选择温度。对于该煅烧步骤,另选地或另外地,可以用还原性液体处理所述材料,或将所述材料电化学还原,以引入更多的氧空位。如果材料是烧结的而不是粉末,则可以将材料研磨成粉末,以制造聚合物-陶瓷复合物。将所选择的一种或多种聚合物溶解在合适的溶剂中,或者制备聚合物悬浮液。然后以选定的比例将氧化物粉末与含聚合物的液体混合。然后例如通过成型或印刷形成所需形状、尺寸和厚度的陶瓷-聚合物膜、丸粒或其他制品。然后将复合制品干燥,例如在室温或稍暖的温度下干燥,以除去溶剂。然后在水中处理所制备的陶瓷-聚合物制品,使陶瓷成分反应并获得所需的离子传导性质,从而形成复合离子导体,例如电解质。
321.在一些实施方式中,用于形成氧化物-聚合物复合电解质材料的一种或多种聚合物选自下面的列表,但是技术人员将理解,可以使用其他合适的聚合物代替列出的那些聚合物,或者还可以使用其他合适的聚合物:离聚物,高密度聚乙烯(hdpe),低密度聚乙烯(ldpe),聚醚醚酮(peek);聚苯并咪唑(pbi);聚乙烯醇(pva);聚(丙
烯酸)(paa);聚(芳基哌啶鎓)(pap);聚(环氧乙烷)(peo);聚环氧丙烷(ppo);聚(乙二醇)(peg);聚砜(ps);聚(亚芳基醚砜)(pesf);聚(甲基丙烯酸甲酯)(pmma);聚(偏二氟乙烯)(pvdf);聚(丙烯腈)(pan);聚氨酯(pu);聚乙烯吡咯烷酮(pvp);聚丙烯酰胺(paam);聚(二烯丙基二甲基铵)(pdadma);聚(偏二氟乙烯-共-六氟丙烯)(pvdf-hfp);聚四氟乙烯(ptfe);聚苯并咪唑(pbi);聚氯乙烯(pvc);壳聚糖和碱性离聚物。技术人员将理解,先前针对质子交换膜燃料电池(pemf)或碱性膜燃料电池(amfc)研究的所有聚合物材料可适用于形成如本文所述的氧化物-聚合物复合材料。在许多实施方式中,聚合物被选择为不溶于水,因为其可以与使用中的水接触。然而,当用作电池的电解质时,例如,其处于密封环境中,也可以使用例如聚(乙烯醇)(pva)或聚(丙烯酸)(paa)等水溶性聚合物,因为不存在溶解聚合物的流动水。
322.因此,如本文所述的经洗涤处理的氧化物粉末(例如sr2fe2o5±
δ
)可与一种或多种聚合物混合,例如形成聚合物/羟基氧化物复合电解质。由于主要的传导依赖于导电性(水合的或无水的)羟基氧化物,因此这些复合膜的稳定性可以非常好。因此,膜可以制得很薄,例如具有约25μm至100μm的厚度,从而促进材料的润湿。可以在复合物中使用单一聚合物或混合聚合物。在一些实施方式中,选择pva和/或peo。为了降低复合膜的成本,例如pva、peg、ps等低成本聚合物可以是特别有意义的。
323.在大多数实施方式中,聚合物成分被选择为亲水性的。然而,相对少量的疏水性聚合物可与另一种聚合物一起使用,例如使用少量ptfe(其通常是疏水性的)以改善复合物的机械强度。在制备-陶瓷氧化物电解质104(例如以膜的形式)的实施方式中,由和陶瓷材料提供离子电导率。因此,总离子电导率可以高于相同体积%的非导电聚合物的总离子电导率。在膜中存在陶瓷氧化物可降低的氧化水平(例如,通过在燃料电池阴极产生的h2o2),因为氧化物可提供所需的离子传导,因此潜在地减少燃料电池劣化。如果陶瓷相主要是oh-离子导体,则由其制成的陶瓷-膜通常是混合的h
+
/oh-导体。当用作氢燃料电池的电解质104时,可在阳极和阴极处都产生水/蒸汽,因此润湿陶瓷-聚合物复合膜,并减少润湿阳极侧的h2或润湿阴极侧的空气/o2的任何要求。
324.在各种实施方式中,氧化物粉末可与聚合物碱性离聚物混合以制备碱性聚合物-陶瓷氧化物复合膜。由于陶瓷氧化物-聚合物复合材料中的碱性聚合物也传导oh-离子,类似于-陶瓷氧化物膜,总离子电导率可因此高于相同体积%的非传导性聚合物的总离子电导率。如果陶瓷氧化物主要是质子导体,则碱性聚合物-陶瓷氧化物膜将是混合的h
+
/oh-导体。当用作氢燃料电池100的电解质104时,再次在阳极侧和阴极侧都产生水/蒸汽以润湿陶瓷-聚合物复合膜,从而减少润湿阳极侧的h2或润湿阴极侧的空气/o2的任何要求。
325.在各种实施方式中,可使用大范围的体积百分比的陶瓷。例如,仅具有1体积%陶瓷的复合电解质104可以工作,特别是在聚合物是离子导体(例如,质子或碱性聚合物)的情况下,但在性能方面可能不提供特定益处,并且可能具有低效率。当陶瓷的体积%超过大约33体积%时,陶瓷丸粒开始形成连续路径,从而提高电导率。如果使用例如pmma等强聚合物,则陶瓷的体积可以是80%以上,以使离子电导率最大化。对于其他聚合物,为了结构完整性可能需要更多的聚合物基质材料。在各种实施方式中,陶瓷(羟基氧化物或水合氧化物)是主要传导相。在各种实施方式中,陶瓷(羟基氧化物或水合氧化物)包含至少30体积%的电解质。复合物中使用的聚合物可以是绝缘体或离子导体,但是在离子传导材料用作电
解质104时应当是电绝缘的。
326.技术人员已知的制造技术可用于使用这些陶瓷材料来产生陶瓷-聚合物复合材料。例如,膜包含ceo2(通常小于20重量%),以保护其免受燃料电池阴极产生的h2o2的氧化/损坏,因此可靠的复合聚合物-陶瓷电解质膜制造技术是已知的。已知用于成型的一般塑料可用于形成提供非常低的交叉扩散的陶瓷-聚合物复合材料(在此提供这种聚合物的实例:https://www.plastikcity.co.uk/useful-stuff/material-melt-mould-temperatures)。这在一些实施方式中可能是非常重要的,例如用作电解质或气体分离膜——用于避免化学物质或气体交叉。本文所述的离子和混合离子/电子导体可与诸如高密度聚乙烯(hdpe)、低密度聚乙烯(ldpe)、聚酰胺(尼龙)、聚氯乙烯(pvc)、聚(氧基-1,4-亚苯基氧基-1,4-亚苯基羰基-1,4-亚苯基)(peek)、聚偏氟乙烯或聚偏二氟乙烯(pvdf)、聚四氟乙烯(ptfe)等聚合物混合形成薄膜(例如,使用热压机形成),或者通过模型浇注等以不同的形状制造而用于不同的具体应用。如本文所述的方法不限于热压、模型浇注或任何特定的成形技术,可将用于制造陶瓷-聚合物复合材料的任何适当技术应用于本文所述的材料。
327.由一些聚合物(例如hdpe)制成的陶瓷-聚合物复合膜可以有效地使电化学装置(例如氧化还原液流电池/电池、燃料电池、电解槽、气体分离/纯化等)中的负极和正极处化学物质和气体在两个室之间的交叉扩散最小化。可通过使用不同的聚合物和/或其他材料形成复合物来调整材料性质。如本文所述的氧化物/羟基氧化物-聚合物复合电解质可提供以下益处中的一个或多个:。
328.·
与纯陶瓷电解质相比,更好的机械强度和形状的柔性;
329.·
制造简单(例如,用于连续生产膜/薄膜);
330.·
由于使用薄膜而减少了电解质的电阻,并且燃料电池粉末密度更高;
331.·
更好地润湿氧化物/羟基氧化物以保持高离子电导率(例如,在燃料电池中),如果包含水的液体燃料用作阳极,但阴极暴露于干空气或湿空气,则在致密的纯陶瓷电解质的阴极侧上润湿陶瓷材料可能不足以实现高离子电导率,特别是如果离子电导率依赖于水合氧化物。然而,如果纯陶瓷膜被氧化物/羟基氧化物-聚合物复合膜替换,则聚合物可以使阳极处的水更容易地扩散到膜中以润湿陶瓷材料,从而保持较高的离子电导率。
332.尽管具有较低的柔性,但是纯陶瓷电解质或陶瓷-陶瓷复合电解质具有其自身的优点,例如避免化学物质或气体在电化学装置的两侧之间的交叉扩散,并且在各种应用中可以是优选的,例如许多电解槽和液流电池,以及在两侧上具有液体燃料的燃料电池。现在参照图9描述形成上面列举的实施方式的固体电解质104的方法900。总的来说,方法900包括:
333.·
获取902陶瓷氧化物材料。陶瓷氧化物材料是用于形成固体电解质104的起始材料,并且可以如上所述。
334.·
在所述陶瓷氧化物材料中形成另外的904氧空位。这可以通过煅烧来完成,并且可以根据需要选择用于煅烧的气氛以将氧空位引入到材料中。另选地或另外地,其可以通过用还原性液体处理904或通过电化学还原904来完成。
335.·
用水处理906陶瓷氧化物材料以形成水合氧化物、水合羟基氧化物和/或无水羟基氧化物。
336.获取步骤902可以包括获取902上述三个家族之一的陶瓷氧化物材料。技术人员将
理解,对于本文所述的一些材料(例如ca3co2o6),即使在不进行步骤904的情况下,例如,如果材料是通过包括在空气中煅烧的标准技术产生的,则材料也可具有足够的氧空位而在用水处理之后提供良好的离子电导率。因此,该步骤904不被认为是形成如本文所述的所有电解质104所必需的,但是可以进一步改善性能,即使在没有有意添加另外的氧空位的情况下获得可行的电解质特性时也是如此。在一些实施方式中,陶瓷-陶瓷复合材料可以是合乎期望的。为了制备陶瓷-陶瓷复合物,用于制备上述三个家族之一的陶瓷材料的前体可以与一种或多种其他陶瓷材料混合,所述其他材料被选择为不与前体或产生的陶瓷离子导体反应。另选地,可以首先制成上述三个家族之一的陶瓷离子导体(例如通过在空气中煅烧),然后与另一种陶瓷材料(或可选地多种其他陶瓷材料)混合形成混合物,然后可以将该混合物再次成形并在空气中煅烧(或在如n2、ar或5%的h2/ar等受控气氛中煅烧)以形成陶瓷-陶瓷复合材料。
337.在使用前用水处理材料的步骤906可包括相对长期的水处理,例如1-2小时至2周,这取决于材料、温度和水暴露的类型(例如蒸汽或液态水)。在第一处理906之后,优选地将离子传导材料保持在加湿环境中,直到使用以及在使用期间。为了在材料干燥/保持在非加湿环境中的情况下恢复离子电导率,可进行第二处理,此第二处理可仅花费几分钟,尤其是在相对较高温度(例如,90℃)下进行时。同样,合适的处理时间可取决于材料结构和组成。
338.特别地,所述陶瓷氧化物材料是具有钙钛矿、钙铁石或k4cdcl6结构的氧化物,并且包括选自ca、sr、ba、ln、y、na、k、rb、cs、pb和bi、in、tl中的一种或多种元素的a位点离子,以及选自ln(例如,ce、la)、y、sc、mg、ca、sr、li、na、co、fe、mn、in、ni、cu、zn、sc、ti、v、cr、ga、ge、al、si、sn、as、sb、zr、hf、nb、mo、w、cd、rh、mg、ba和ta以及可选的pt、ir和ru的一种或多种元素的b位点离子。陶瓷氧化物材料可以是单一相(不算任何杂质),或者可以包括多个不同的相。所述陶瓷氧化物材料可为粉末形式,可选地为细粉末。陶瓷氧化物材料可以通过本领域已知的任何合适的技术制备,例如固态反应、溶胶-凝胶工艺、共沉淀法、pvd(物理气相沉积)、cvd(化学气相沉积)、雾化喷雾热解(nsp)、燃烧合成、溶剂热合成、微波合成或脉冲激光沉积(pld)。通常,可以使用诸如氧化物、碳酸盐和/或硝酸盐等前体通过固态反应来制备氧化物材料。然而,可使用已知适合的任何其他方法,例如上文所列出的那些方法。当制备cl、br、s或se掺杂的氧化物时,可通过添加cl、br、s或se前体而使用溶剂热合成。
339.然后处理904所获取的陶瓷氧化物材料,以在步骤904中引入另外的氧空位。当通过煅烧进行处理904时,煅烧气氛可以是空气,或者可以是n2、ar、h2、混合的h2/n2、混合的h2/ar、nh3、ch4或其他惰性或还原性气氛。可基于氧化物材料的化学组成和/或结构来选择气氛。在各种实施方式中,原则是使氧空位浓度最大化,同时避免破坏晶体结构或以其他方式分解氧化物。
340.在期望纯陶瓷电解质104的各种实施方式中,烧结陶瓷氧化物材料。烧结可与煅烧904同时发生以引入氧空位,或可预先进行。烧结过程包括将粉末适当地成形(例如形成丸粒或流延),并在选定的温度下对其进行煅烧,以使烧结材料具有足够的机械强度以保持其形状(例如丸粒或膜)。煅烧温度可以是在低于陶瓷氧化物材料的熔点的50℃至300℃的温度下,可选地在低于熔点的50℃至200℃的温度下。在一些实施方式中,对于某些材料,烧结可在进一步低于熔点的更低的温度下实现,例如低于熔点的50℃至700℃的温度。使用烧结助剂(例如h3bo3)对于较低的相对温度烧结是有益的,这样的烧结助剂可以降低烧结所需的
最小温度。
341.对于测试的各种氧化物,发现最佳煅烧温度为800℃至1200℃。在各种实施方式中,更通常,煅烧温度可以为300℃至1700℃或500℃至1700℃,可选地为500℃至1500℃或700℃至1400℃,进一步可选地为800℃至1200℃。
342.在通过pvd、cvd或形成结构化固体的其他方法组装电解质104的实施方式中,可以直接形成氧化物材料膜或丸粒,并且可以不需要烧结。如果所形成的材料不具有足够高的氧空位浓度,则可在还原性气氛、惰性气氛或具有低氧气分压的其他气氛中进行随后的煅烧步骤,以便引入更多的氧空位。另外地或另选地,可以用还原性液体处理904所形成的材料,或将其电化学还原904。在所形成的氧化物材料含有足够的氧空位的实施方式中,可能不需要煅烧步骤或其他处理步骤904。应当理解,对于通过物理气相沉积(pvd)和脉冲激光沉积(pld)制成的氧化物材料,制备通常在真空下或在惰性气体气氛中进行,这类材料在没有进一步处理的情况下可以具有足够浓度的氧空位。
343.在需要纯陶瓷电解质104的实施方式中,烧结材料可以是陶瓷膜、膜、丸粒或块的形式,可选地根据目标电化学装置100的需要成形和设定尺寸。陶瓷膜或膜可通过本领域已知的任何合适的方法制造,例如压制成丸粒、丝网印刷、流延、凝胶浇注、滑动涂覆、浸涂、旋涂、溶胶-凝胶工艺、pvd或cvd。所获取的氧化物材料可以在烧结之前成形,使得其在煅烧/烧结后保持所需的形状。
344.在需要复合聚合物-陶瓷电解质104的实施方式中,通常不进行烧结。为了便于将陶瓷氧化物材料与一种或多种聚合物混合908形成均一膜(例如,具有约100μm的厚度),提供陶瓷氧化物材料作为粉末。粉末粒径可被选择为足够细以容易地形成所需厚度的膜,并且足够粗糙以提供氧化物相的良好接触(将理解,具有更多晶界可降低离子电导率,因为通过晶界的离子转移通常比通过体相材料的转移更困难)。因此,粉末的粒径可被选择为适合于材料和期望的电解质形状。复合电解质104的陶瓷和聚合物成分的混合908可以在用水处理906之前或之后以及在将氧空位添加904到陶瓷材料中之前或之后进行。图9中所示的顺序可以是各种实施方式的代表,但不旨在是限制性的。对于纯陶瓷电解质104,步骤908通常根本不进行。
345.在各种实施方式中,松散粉末(即,粉末未被压制或以其他方式成形,如可以对纯陶瓷电解质进行的)在选定温度下和选定气氛中煅烧904以引入氧空位。温度和气氛选择可以如上所述,尽管在一些实施方式中可优选较低的温度(和/或较短的煅烧时间)以避免烧结。使用较低的煅烧温度也可降低能量成本。在一些实施方式中,在较低温度下在空气或氩气或氮气中煅烧氧化物材料可导致经煅烧材料的氧空位浓度没有高到足以形成良好的离子导体。然而,在还原性气氛(例如纯h2)中煅烧样品可以促进在低得多的温度(例如低于熔融温度400-500℃或更多)下形成具有足够的氧空位浓度的单相氧化物。
346.为了使成本最小化,用于制备氧化物材料的最简单的方法通常是在空气中制备和煅烧它们,而不是在惰性或还原性气氛中。然而,已发现通过在空气中煅烧而产生的氧化物通常缺乏足够高的氧空位浓度(尽管在一些情况下,浓度可能是足够的,例如上文所描述的ca缺乏的ca3co2o6的实例)。实际上,具有钙铁石结构的许多氧化物不能通过在空气中煅烧而形成,但是可以通过在高温下在ar或n2中煅烧而形成。因此,在一些实施方式中,氧化物材料在空气中煅烧。应当理解,在空气中的煅烧通常比在其他环境中煅烧更便宜,并且具有
更低的设备要求。当氧化物材料在空气中煅烧时,氧空位浓度通常相对较低。可以用还原剂(例如还原性液体)处理904经煅烧的氧化物材料(例如以氧化物丸粒或粉末的形式),以增加氧空位的浓度。可以小心地控制还原性液体的浓度和温度,以使氧化物中的一些晶格氧被去除,从而形成另外的氧空位。即使不在空气中进行煅烧904时,如果期望进一步增加氧空位浓度,也可以使用还原性液体处理904。
347.还原性液体可以是水溶液,在此情况下,用还原性液体处理904也可以满足用水处理906的作用。在这种实施方式中,形成的富含氧空位的氧化物可同时与还原性液体中的h2o反应,以形成水合氧化物或水合或无水羟基氧化物。在另外的或另选的实施方式中,可以在用还原性液体处理之后用水处理906材料。还原性液体的使用可用于将电子导体转化为离子导体。例如,硼氢化钠或硼氢化钾可以用作还原剂。
348.nabh4/naoh的混合物可以用作还原性液体,或kbh4/koh等。使用naoh(或koh)可避免nabh4(或kbh4,如果适用)的水解。例如,在空气中煅烧的sr2co2o5在水中是电子导体。在ar中煅烧后,其在水中是离子导体,但是在ar中的高温煅烧是费钱的,因此可以优选使用还原剂。sr2co2o
55
材料可以放置在混合的nabh4/naoh水溶液浴中,并且在室温下处理或加热(例如,45℃或90℃),以便将材料转化为离子导体,从而避免更费钱的高温。下面描述在空气中于1100℃下煅烧(“sr2co2o
5-1100air丸粒”)然后进行这种还原处理的sr2co2o5的制备。sr2co2o5通过标准固态技术制备。将21.59g sr(no3)2和29.79g co(no3)2·
6h2o研磨形成混合物,然后在600℃的空气中以1℃/min的冷却速率焙烧8小时。然后,将粉末研磨并在空气中于1100℃下以1℃/min的冷却速率焙烧3小时,以形成srcoo
2.5
相。此后,将制备原样的粉末造粒并在空气中于1100℃下以1℃/min的冷却速率烧结3小时。xrd数据表明形成了单一相。然后将sr2co2o
5-1100air丸粒在室温(rt)下浸入1m naoh+7m nabh4还原剂中2小时,然后在室温下浸入去离子水中过夜。然后,将丸粒在室温下浸入相同的还原剂中3小时,并在水中在90℃下加热过夜。重复该过程两次,使得施加在丸粒上的总化学还原时间(在还原剂中的总时间)为8小时(在室温下)。然后用去离子水漂洗丸粒以洗掉剩余的还原剂,在室温下干燥,并用银导电油墨(rs成分)涂覆以利于电导率测试。为了在上述处理过程之后测试水中sr2co2o5丸粒的电导率,通过银导电油墨(rs成分)涂覆丸粒的两个侧面以形成ag电极。将ag糊剂在室温下干燥40分钟。然后将所得夹层结构单元(具有在两层银网之间的丸粒层)固定在夹具中。在电导率测试之前,在90
°
的淡水中处理ag涂覆的丸粒,使得丸粒吸收水。然后使用具有10mv振幅和1mhz-0.01hz频率范围的solartron 1470/1455进行电化学阻抗谱(eis)。通过在丸粒上施加10mv的恒定dc电压同时记录电流以确定电子电阻,利用伪四端子法测量丸粒的dc电导率。图31示出了如上所述制备的样品的电导率数据,显示出在高于60℃的温度下的高电导率。
349.可用于在环境温度下在氧化物中产生氧空位代替使用还原性液体的处理以及使用还原性液体的处理)的另一工艺904是电化学还原904。众所周知,石墨烯氧化物可以通过电化学还原过程还原为石墨烯。可以应用相同的工艺904以在电化学池中部分地还原在空气中制备的氧化物,以形成富含氧空位的氧化物(去除晶格氧)。然后可使部分还原的氧化物与水同时反应或随后与水反应906,以形成羟基氧化物和/或水合氧化物。由于可以在工作台上/不使用受控气氛以及在环境温度和压力下进行处理904,因此可以保持低成本。
350.在其他实施方式中,氧化物材料在与空气相比具有降低的氧气分压的气氛中煅烧
904,例如在氮气、氩气或其他惰性气体或空气和惰性气体的混合物中。在各种情况下,特别是当期望烧结时,当在具有较低氧气分压的气氛中煅烧时,对于相同材料可能需要较高的煅烧温度。在本文中,术语“低氧气分压”用于指小于空气(其中约21%是氧气,提供约0.21个大气压的分压,其为约21kpa)的氧气分压。在一些实施方式中,优选约0.01个大气压(约1kpa)的氧气分压。在一些实施方式中,氧化物材料在还原性气氛中煅烧(例如含有h2或co等还原剂)。例如,可以使用在空气中具有5体积%h2、纯h2或在ar或n2中的不同浓度的h2的气氛。通常,对于给定的氧化物材料,h2的浓度越高,则煅烧温度越低。高温本身可以被视为还原剂,因此,对于相同的材料,在较高温度下煅烧将导致氧空位浓度较高,因此在与水反应之后通常具有较高的离子电导率。如果煅烧温度太高,则氧化物可能过度还原,并且晶格可能塌缩并进一步分解为在还原条件下更稳定的其他混合氧化物或金属和氧化物。
351.如上所述,如果在空气(例如)中煅烧的氧化物具有不够高浓度的氧空位,则可以在用水处理906之前将经煅烧的材料置于液体还原环境中,或者可以用还原性水溶液处理906经煅烧的材料,从而同时提供还原和水处理。例如,肼(n2h4)或nabh4/kbh4的混合物和碱性溶液(例如naoh(aq)或koh(aq))可以用于部分地去除晶格氧原子,以产生富含氧空位的氧化物。还原性液体可部分还原氧化物中的b位点处的任何多价元素(例如mn、fe、co、ni、cu)以产生氧空位。这可比在5% h2/ar或5% h2/n2中烧结更简单且更具成本效益。选择用于在还原环境中浸泡的时间长度通常取决于氧化物的化学组成、液体还原剂的浓度、反应性和温度。可以为给定的陶瓷材料选择合适的参数,以便在不破坏结构的情况下产生更多的氧空位。
352.在各种实施方式中,如上所述,通过固态反应方法制备氧化物。例如,为了制备sr2fe2o5,将srco3和fe2o3通过球磨以300rpm混合12小时,然后在空气中于1100℃下焙烧55小时,加热/冷却速率为5℃/min。将粉末研磨并造粒,然后在氩气中在1200℃下煅烧904持续8小时。
353.当通过流延制备陶瓷膜时,例如,可首先在空气中制备所获取的氧化物材料,然后将其与一种或多种粘合剂混合以通过流延来制备薄膜。然后可以在高达700℃的温度下在空气中煅烧薄膜,以烧掉流延膜中的有机粘合剂。然后可以可选地在较高温度下在具有低氧气分压的气氛(例如n2或ar(惰性气体))中进行进一步的煅烧步骤。一些烧结可在第一煅烧步骤中发生。第二煅烧步骤可用于确保材料烧结到期望的水平,并引入氧空位。
354.因此,可以在一个或两个步骤中实现煅烧。对于单步骤,当通过固态反应方法制备氧化物材料时,可以预煅烧氧化物/碳酸盐前体以分解碳酸盐前体,然后可以将经预煅烧的粉末压制成丸粒。然后可以直接在空气或n2或ar(例如)中煅烧丸粒。取决于材料的熔点,用于煅烧丸粒的温度通常为700℃至1300℃。在一些实施方式中,这种煅烧904烧结材料并同时引入所需的另外的氧空位,或随后可使用非煅烧步骤(例如电化学还原)来引入另外的氧空位。对于两步煅烧过程,丸粒可以首先在空气中煅烧以获得足够的机械强度,通常相对密度≥70%。然后,这些丸粒可以在还原性气氛(例如,5% h2/ar或5% h2/n2)中在相对较低的温度(例如,50℃至600℃)下煅烧904,以除去一些晶格氧,以便产生更多的氧空位。
355.对于单步煅烧过程904,停留时间通常从数小时到至多48小时之间变化,并且通常是约4至10小时。对于本文所述的许多氧化物材料,如果温度相当接近材料的熔点,则4小时足以获得具有良好机械强度的丸粒。对于两步煅烧过程,还原性气氛中的煅烧904通常进行
至多48或72小时。通常在该气氛中通过同步热分析(sta)确定煅烧温度,即选择陶瓷材料开始损失氧/重量的温度。应当注意,如果煅烧温度太高或如果煅烧持续时间太长,则氧化物可能分解。
356.然后用水对经煅烧的材料进行处理906,从而由氧化物起始材料形成水合氧化物和/或羟基氧化物(其可以是水合的或无水的)。用水处理906也可以以各种方式进行。例如,富含氧空位的氧化物(例如,在ar或n2中煅烧,或在空气中煅烧,然后可选地还原)的丸粒可以在室温下浸泡在(液体)水中4天。另选地,氧化物材料可以用含有至少1体积%的水、可选的至少3-4体积%的水(例如,作为加湿气体流中的水蒸气,或作为蒸汽)、进一步可选的至少5体积%的水的气氛进行处理,以形成所需的水合或未水合的金属羟基氧化物和/或水合氧化物。在氧化物材料已在空气中煅烧过并且在煅烧之后未进行任何还原处理的实施方式中,可能需要用液态水或含有至少5体积%的水的气氛进行处理。例如,空气或其他载气可以在25℃下通过水(例如,使用气体鼓泡器)。所得气流可具有约3体积%的水含量。另选地或另外地,可使用蒸汽。
357.选择用于处理906的时间取决于材料的孔隙率/相对密度和曲折度、材料的尺寸和形状(例如,丸粒或薄膜)以及氧化物的性质/组成。提高水的温度可以促进富含氧空位的氧化物和水之间的反应以形成水合的或未水合的金属羟基氧化物和/或水合氧化物,因此可以减少用于较高温度水处理906的时间。过高的温度(例如,高温蒸汽)可能导致材料的劣化。对于更薄和/或更多孔的材料,以及对于与水更有反应性的材料,也可以减少该时间。例如,可以选择小于1小时或等于或大约2小时、8小时、10小时、24小时、48小时或72小时的时间。在相同的温度下,在湿气氛中选择的暴露时间可能比液态水中的暴露时间长,但是气氛的升高温度和/或在加湿的气流中使用蒸汽代替水蒸气可能改变该平衡。如果使用蒸汽来产生离子导电(可选地水合)的羟基氧化物或水合氧化物,则将暴露温度限制为低于所需(可选地水合)的羟基氧化物或水合氧化物的分解温度。增加水的体积%也可能减少该时间。
358.在用含有至少1体积%的水(可选地至少5体积%的水)的气氛处理材料的实施方式中,可根据材料选择蒸汽(在标准压力下高于100℃的温度)或水蒸气(例如,在环境压力和温度下的加湿空气流)。例如,在srfeo
2.5-x
(oh)
2x
·
nh2o的情况下,材料在低于100℃的温度下的液态水中或在这样的温度(例如80℃)下的水蒸气饱和的气氛中是稳定的,因此形成水合羟基氧化物srfeo
2.5-x
(oh)
2x
·
nh2o并保持稳定。当温度升高到100℃以上时,该相可能开始从晶格中损失水合水。因为认为电荷载体包括晶格中的水合水和由此形成的oh-离子,所以h2o的损失意味着电荷载体的损失。对于h
+
和/或oh-离子电荷载体,传导路径可以依赖于晶格h2o,因此晶格中水合的h2o的损失限制了h
+
和/或oh-离子的迁移率。在两种情况下,晶格水的损失可以导致降低的离子电导率,因此是不希望的,因此可以使用液态水或水蒸气替换蒸汽。如果h
+
和/或oh-离子的转移对于晶格h2o的依赖没有那么大,则h2o的损失将不会影响电导率,因此可以保持无水相srfeo
2.5-x
(oh)
2x
(n=0)的离子传导。srfeo
2.5-x
(oh)
2x
·
nh2o和srfeo
2.5-x
(oh)
2x
稳定的温度范围取决于h2o的分压(ph2o)。ph2o越高,材料分解的温度越高。在无水srfeo
2.5-x
(oh)
2x
损失另外的水以形成sr2fe2o5的点处,材料由离子导体改变为电子导体或半导体,不再可用作电解质材料。
359.对于本文所述的大多数材料,在标准压力(1个大气压)下至少1-3体积%(可选地
至少5体积%)的水的气氛足以用于反应,并且不需要加压。所选择的温度可以是室温,或者可以是电化学装置100的工作温度。可以使用给定温度下的饱和气流。这些条件可以相对容易地在装置100内(例如,在pemfc中)原位获得,因此当选择的温度高于室温时,例如通过与装置100的热交换,使正确的相得以原位产生并保持。例如,如果氢燃料电池的工作温度是80℃,则提供给阴极的空气或o2可以在80℃下提供并且在该温度下饱和。这些条件已经在基于电解质的市售氢燃料电池中提供。其他电化学装置100(例如使用纯陶瓷膜104或陶瓷-聚合物复合膜104的燃料电池)的工作温度可超过100℃,并且可选地高达200℃。可以在环境压力下将200℃的蒸汽饱和的空气提供给阴极,可以存在蒸汽和水蒸气的组合。不需要高压。如果进一步升高温度,则加压可能是期望的。如上所述,当使用混合h
+
/oh-膜作为氢燃料电池的电解质时,对于电解质的蓄意/另外的润湿的任何要求可能较低,因为在阳极侧和阴极侧都产生水/蒸汽,并且可提供足够的润湿。
360.在各种实施方式中,工作温度可小于或等于120℃;在高于100℃的温度下,可对电化学装置100加压,或可供应加压蒸汽,以在适用的情况下维持离子传导层的水合。大多数电化学装置在接近环境压力的压力下工作。然而,在一些电化学装置(例如水电解槽)中,出口h2和o2压力可以高达30巴(3000kpa)或甚至50巴(5000kpa)。在120℃下,如果压力为2巴(200kpa),则水仍处于液态并且可用于使氧化物离子导体水合。当在水电解槽中使用时,如果出口气体的压力为5000kpa,则即使在大约250℃的温度下,水仍处于液态。只要这种电解槽的工作温度不超过250℃,例如为230℃或250℃,便可以使用液态水来提供离子传导层的平稳工作。在265℃下的水的平衡压力为大约5000kpa。如果来自电解槽的出口h2和o2的出口压力为5000kpa,则水电解槽的工作温度可以更高,例如265℃。因此,通过相应地调节压力,可以在升高的温度(高于100℃)下提供具有液态水的工作环境。另选地,可在升高的温度下提供包含至少5体积%的蒸汽的气态环境,以用于需要该水合的离子传导材料,以便获得足够强的离子传导性能。
361.对于所找到的三个家族的各种氧化物,发现浸泡在水中至少48小时的处理时间实现了最高的离子电导率。然而,可以在较短的时间范围内获得可接受的电导率。例如,发现浸泡在水中约2小时的ca3co2o6具有0.001s/cm的离子电导率,尽管在室温下在水中浸泡三天之后,其在90℃下增加到0.053s/cm。对于与水更具反应性或不同形状(例如,较薄的膜或用于复合电解质中的丸粒)的其他氧化物,浸泡在水中的更短的时间可提供可接受的电导率。已经发现,对于许多氧化物,在浸泡在水中的同时,测试的陶瓷丸粒的电导率上升,然后达到平台期。对于具有较高相对密度(与理论密度相比,即低孔隙率)的样品,水缓慢扩散到丸粒的中心,因此需要更长的时间。对于测试的大多数丸粒(具有大约12-13mm的直径和大约2mm的厚度),在室温下4天足以达到平台期。升高温度可以促进(水合的或无水的)羟基氧化物的形成,从而减少时长。应当理解,更短的时间可以满足更小/更薄的丸粒。氧化物材料的组成和反应性也影响达到平台期所花费的时间。对于一些相对具反应性的材料,例如ca6co2o6,与水的反应仅花费数分钟就将半导体转化为离子导体,但是可能需要更多的时间来实现用于电化学装置的足够高的离子电导率,在室温下,这可能需要在水中浸泡48小时。
362.当形成纯陶瓷电解质时,烧结的陶瓷氧化物可具有60-99%的相对密度(即,该结构的理论密度的60-99%的密度),并且可选地为70-85%。在与水反应之后,相对密度可以增加到70-99%,并且可选地增加到85-99%。在与水反应906之后,所形成的(水合的或无水
的)羟基氧化物或水合氧化物的孔隙率可以为1%至30%,可选地为1%至15%,进一步可选地为1%至5%。较低的孔隙率(因此较高的密度)通常有利于最小化或避免例如氢或其他燃料/反应物的交叉,并使可用的离子传导路径最大化。如果离子电导率足够高,则较厚的膜/层可以用作电解质,并且较低的相对密度可以是可接受的(即,可以足以最小化或避免例如氢或其他燃料/反应物的交叉)。闭孔倾向于降低电导率,但通常不影响电解质104的密封。对于开孔,它们使电导率降低,并且还影响电解质104的密封(可能允许有害的交叉)。因此,对所需孔隙率的限制关乎到电解质104的厚度和孔的性质(例如,曲折度)。电解质104的厚度的上限可以基于离子电导率。
363.还发现,陶瓷材料的机械强度可以通过改变组成来调整。例如,发现由srcoo
3-δ
和水之间的反应得到的羟基氧化物的机械强度相对较低,但是作为替代用ti掺杂b位点形成srco
0.5
ti
0.5o3-δ
则提高了机械强度。机械强度对于致密的陶瓷膜或膜可能比聚合物-复合电解质更重要。
364.在所描述的实施方式中,经烧结的陶瓷材料在所有暴露表面上均匀地进行处理906,并且时间允许水在整个结构中扩散。
365.因此,具有氧空位的陶瓷氧化物材料通常通过将陶瓷氧化物浸泡在水中数天(通常2到4天)来与水反应,以形成水合氧化物和/或(可选地水合的)羟基氧化物,以便实现更高的离子电导率。
366.由于在许多实施方式中使用的相对较高温度的煅烧过程904,在新制备的氧化物中通常不存在水合水。当用水处理906这些氧化物时,本文所述的电解质材料存在四种主要可能性:。
367.·
氧化物吸附水形成水合的氧化物,水分子被整合到晶格中。
368.例如,钙铁石结构的sr2fe2o5可反应形成sr2fe2o5·
nh2o;
369.·
氧化物与水反应形成无水羟基氧化物。
370.例如,钙钛矿结构的sr2fe2o5±
δ
或具有相对较高浓度的氧空位的类似组成的钙钛矿结构(例如具有较大δ值的srfeo
3-δ
)可反应形成无水羟基氧化物,例如srfeo
x
(oh)y。
371.·
氧化物反应形成水合羟基氧化物。
372.·
氧化物反应形成金属氢氧化物和一种或多种上述物质的混合物(特别是在化学上较不稳定的氧化物的情况下)。
373.对于给定的氧化物材料,温度、处理906的水浓度和处理持续时间均可影响所得产物。在一些实施方式中,可以形成混合相产物,例如包含水合的和无水的羟基氧化物,以及可选的一种或多种与所需的羟基氧化物和/或水合的氧化物混合的金属氧化物或氢氧化物。如果没有形成合适的水合氧化物或羟基氧化物,或者这样的组合物仅以不合适的少量形成,则可以调节煅烧904或水处理906的条件,和/或可以进行用于引入氧空位的其他步骤904,例如用还原性液体处理。
374.对于许多测试的氧化物材料,在约25℃用水处理产生水合羟基氧化物。当样品被加热时,水合水缓慢损失而形成无水羟基氧化物。进一步加热导致进一步的水损失,从而使材料返回到最初生产的缺氧的氧化物,因此该过程显示为可逆的。在极少的情况下,发现用水处理906经烧结的陶瓷材料直接形成无水羟基氧化物。当在加湿空气而不是环境空气中进行加热时,由于ph2o较高,通常在稍微较高的温度下发生h2o的损失。
375.当温度超过100℃时,对于许多测试的材料,大部分水合羟基氧化物变成无水的,即n=0。尽管水损失,但发现测试的无水羟基氧化物保持了良好的离子传导特性;这被认为至少部分是由于离子的迁移率在较高温度下增加,因此补偿了损失的水途径。在低温至中等温度(例如,10℃至200-300℃)下,本文所述材料的水合羟基氧化物和/或无水羟基氧化物可以是良好的离子导体。在羟基氧化物相分解成缺氧的氧化物后,材料从离子导体转化为电子导体或半导体,如对于在b位点处具有第一行过渡元素的大多数氧化物所观察到的。
376.电化学装置100可被设置为在相对较低的温度下工作,例如在200℃以下,可选地在100℃以下,进一步可选地在90℃或60℃以下。
377.电化学装置100可设置成保持电解质104被加湿。例如,蒸汽可以供应到燃料电池的阳极侧和阴极侧,或者气态燃料(例如,h2或nh3,或实际上是co或ch4)和氧化剂(空气或o2或h2o2)可以在它们接近电解质104时通过室温水,以提供水蒸气。对于低于100℃的工作温度,在该温度下在饱和蒸气压附近提供水通常足以将电解质104维持在所需的相中。对于高于100℃的温度,在100℃下饱和的蒸气压通常足以将电解质104维持在所需的相中。如果主要是oh-离子导体的羟基氧化物电解质用作氢燃料电池100中的电解质104,则将在阳极处产生水并且将在该侧上润湿电解质膜。如果电解质是质子导体,则将在阴极处产生水。如果电解质是混合h
+
/oh-导体,则可在氢燃料电池的阳极和阴极处都产生水/蒸汽,因此自动润湿电解质。通过调整组成,用水处理的具有钙铁石、钙钛矿或k4cdcl6结构的氧化物可表现出混合h
+
/oh-传导,这对于氢燃料电池的电解质104可能是特别有益的。
378.对于水性电池、电解池、氧化还原液流电池等,电解质104通常保持在液态水内,因此在使用中可能不需要加湿。在使用液体燃料(例如甲醇、乙醇、氨溶液、尿素溶液、肼或硼氢化物水溶液)的燃料电池100中,水通常存在于燃料溶液中,并且可以足以保持整个电解质被加湿,例如在陶瓷膜足够薄时润湿陶瓷膜,或扩散到陶瓷-聚合物复合膜的亲水性聚合物中。在这样的实施方式中,润湿阴极室中的气体可能是不必要的,或者最小要求(例如,使空气/o2通过室温水)可能就是足够的,而不需要任何引入的蒸汽。使用废热或单独的加热器来将水加热到更接近或等于电池工作温度的温度,并且使气体通过该加热的水可以改善性能。
379.在一些燃料电池中,将过氧化氢(h2o2)水溶液用作阴极处的氧化剂。这在基于如本文所述的水合氧化物电解质的燃料电池中可能是特别有用的,因为h2o2水溶液中的水可以保持电解质的高离子电导率。这种电化学装置在细分应用中可能具有特别的实用性,例如在潜水艇或航天飞机(其中空气/o2可能不容易获得)中,因为这种类型的燃料电池可以在没有o2或空气的情况下发电。例如,可以在阳极处提供氨、尿素、肼、甲醇或乙醇水溶液,并且可以在阴极处提供h2o2水溶液。当使用燃料和氧化剂时,其可以被替换,从而对电池再充电提供更快的替代方案。潜在地,氨/h2o2、尿素/h2o2、n2h4/h2o2、甲醇/h2o2或乙醇/h2o2燃料电池可用于便携式应用或为电动车辆供电。阳极处的水溶液燃料不限于氨、尿素、肼、甲醇和/或乙醇,类似地,水溶液氧化剂不限于h2o2水溶液,这些仅作为示例列出。
380.对于一些电化学装置100,例如水电解槽、水性电池和一些液流电池,电解质104在使用中暴露于阳极侧和阴极侧上的液态水。在一些实施方式中,液态水可以作为液体混合物或溶液(例如还包含醇、氨、尿素、肼或硼氢化物)的一部分提供。这种暴露于液态水在发展和维持本文所述材料的离子传导性质方面可以是有益的。本文提供的各种材料的在水中
的测量电导率可以最准确地反映该工作环境中的电导率,因为电导率可能在干燥工作条件下略微降低(同时仍然足以用于电解质)。
381.在各种实施方式中,固体氧化物离子传导层104暴露于阳极处的液态水(例如在通常用作电解槽中的电解质的情况下)或含有液态水的燃料(例如氨、尿素、肼、硼氢化物、甲醇和/或乙醇的水溶液),或阴极处的含有液态水的氧化剂(例如h2o2水溶液),水含量可能不一定高达5%。例如,使用98体积%的乙醇/2体积%的h2o的混合物的直接乙醇燃料电池可具有如本文所述的固体氧化物离子传导层作为电解质,并且2体积%的液态水甚至对于在气流中需要至少5体积%的水来确保良好离子导电率的离子传导材料来说也是足够的。只要氧化物与含有液态水的介质接触,水的体积%可以低于针对包含蒸汽的气流所选择的水量(优选最少5体积%以保持高离子电导率)。当工作温度高于100℃时,如果意图维持暴露于液相水,则电化学装置可被加压,高于环境压力。当使用加湿的气流/气氛替换蒸汽与气流/气氛的混合物时,也可以选择最少5体积%的h2o。
382.当本文所述的固体氧化物离子导电层在具有气体的环境中使用时,例如用作氢燃料电池中的电解质时,在阳极处的氢气(或其他燃料)和在阴极处的o2/空气(或其他氧化剂)都可被加湿,从而在阳极处的h2/h2o混合物中和在阴极处的空气/h2o混合物中包含至少5体积%的h2o,以便提供高离子电导率以供电化学装置平稳工作。
383.当在诸如蓄电池或超级电容器等密封环境中使用如本文所述的固体氧化物离子传导层时,可能不需要与水或加湿气体的流或供应接触以实现期望的水合水平。液态水或蒸汽(取决于温度和压力)被密封在密封的蓄电池/超级电容器内部,因此在不需要更换的情况下提供水合。例如,预处理的srzr0·8y
0.2o3-δ
薄陶瓷膜或srzr
0.8y0.2o3-δ
聚合物复合材料或srzr
0.8y0.2o3-δ
陶瓷复合材料可用作使用oh-和/或h
+
作为电荷载体的蓄电池或超级电容器中的电解质。当本文所述的各种材料用于诸如蓄电池或超级电容器等密封电化学装置时,需要保持材料水合以保持高离子电导率(如果材料用作电极或电极的一部分,则可选地为高度的混合的离子/电子传导)。电解质和/或电极被设置成与液态水或密封环境接触,在使用中密封电化学装置内部的平衡气体中具有至少5体积%的蒸汽。并非所有蓄电池都是密封系统。例如,在诸如zn-空气和mg-空气电池等金属-空气电池中,阴极暴露于空气。多孔膜可用于使来自周围空气的o2到达zn-空气电池的阴极。该膜可以防止水分从zn-空气电池中损失,从而保持zn-空气电池的离子传导层被水合以保持高离子电导率。
384.在废水处理的特殊情况下,如果在阳极处提供还原性废水并且在燃料电池的阴极处提供氧化性废水,则在处理废水的同时可以有利地产生电力作为副产物。
385.如果如本文所述的陶瓷或陶瓷-聚合物膜用作设置成从含氨废水中去除氨的燃料电池100中的电解质104,则膜104可比更耐受废水中的杂质,因此可展现出比基于或碱性膜电解质的现有燃料电池更好的耐久性。
386.所描述的实施方式的电化学装置100被设置为最大工作温度低于水合氧化物或水合羟基氧化物将开始损失晶格水或者无水羟基氧化物将开始损失水而形成原始起始氧化物(如果适用)的温度。该温度取决于化学组成、水合氧化物或水合或无水羟基氧化物的结构以及电化学装置内的水的分压(ph2o)。ph2o越高,离子导体的最大工作温度越高,同时仍保持足够的离子电导率。
387.如本文所述的,已经找到了三个家族的氧化物可用于形成具有适合用作电化学装
置100中的电解质104的合适性质的羟基氧化物和/或水合氧化物。还描述了制造这些材料的各种方法900。应当理解,本文提及的特定组成是所找到的氧化物类别的示例,不应被视为限制本公开的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1