用于核酸扩增的方法、组合物、系统、仪器和试剂盒与流程
背景技术:
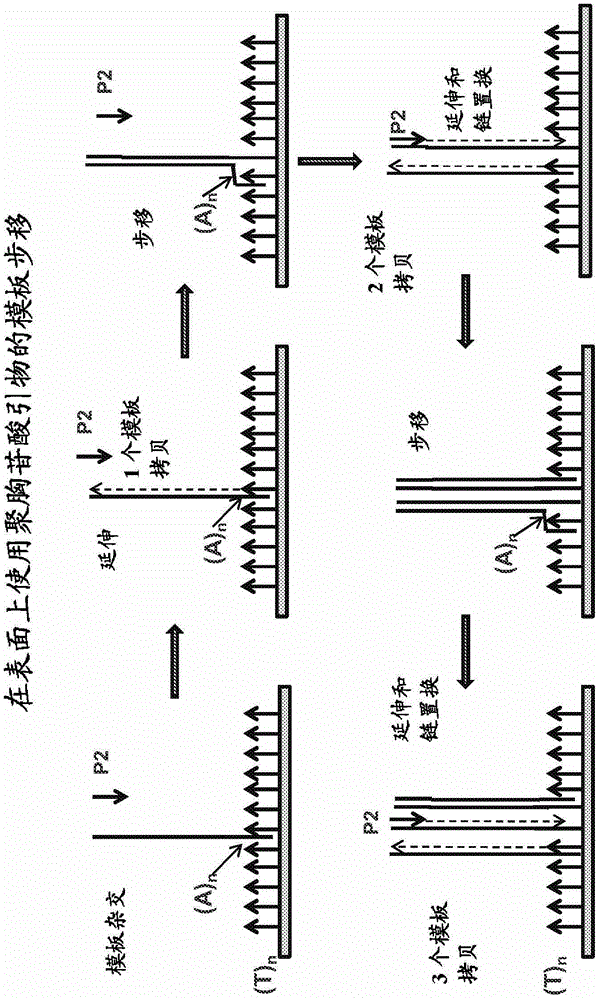
:核酸扩增在分子生物学中是非常有用的,且在生物学、治疗、诊断、法医学和研究的几乎每个方面中具有广泛的适用性。通常,使用一种或多种引物从起始模板制备多个扩增子,其中所述扩增子与用于制备它们的模板是同源的或互补的。多路扩增还可以使过程流线化,并减少开销。可以将单组引物与不同的模板相混合,或者可以使单一模板与多种不同的引物接触,或者可以使多种不同的模板与多种不同的引物接触。本申请涉及用于核酸扩增和/或分析的方法和试剂。技术实现要素:本文提供了核酸扩增和/或分析的方法、试剂和产品。扩增可以使用固定化的和/或可溶性的引物。从本文提供的方法制备的扩增子是适合用于其它分析(例如,序列测定)的底物。附图说明图1:显示模板步移(templatewalking)的一个实施方案的示意图。在一个替代实施方案中,固定化的引物包含被命名为(A)n的富含腺苷的序列,例如,(A)30,且固定化的引物在模板上的引物结合位点包含互补的富含T的序列,例如,(T)30。图2:通过模板步移在珠子上进行扩增、以及在平面阵列上沉积珠子进行测序的概述。图3:使用基于半导体的合成测序检测的替代实施方案。可以使用模板步移在珠子上或在反应室的基底或底部上制备克隆扩增子群体。在一个替代实施方案中,固定化的引物包含被命名为(A)n的富含腺苷的序列,例如,(A)30,且固定化的引物在模板上的引物结合位点包含互补的富含T的序列,例如,(T)30。图4:在平面衬底上的引物坪(primerlawn)形式的固定化位点的替代实施方案。可以使用分离的固定化位点的阵列,或者可以将引物的单个连续坪(lawn)视作固定化位点的随机阵列。任选地,在引物的连续坪中的一个或多个固定化位点的位置可以是尚未确定的,其中所述位置在初始模板步移之前在连接时确定,或者通过扩增簇占据的空间来确定。在一个替代实施方案中,固定化的引物包含被命名为(A)n的富含腺苷的序列,例如,(A)30,且固定化的引物在模板上的引物结合位点包含互补的富含T的序列,例如,(T)30。图5:温度对模板步移反应的影响。计算在模板步移扩增之前和之后的δCt,并相对于反应温度绘制其图形。图6:96双链体TaqManqPCR反应的Ct值的表。图7:通过模板步移在珠子上的100,000倍扩增。计算在模板步移反应之前和之后的δCt、以及在模板步移反应之前和之后的扩增倍数,并相对于反应时间绘图。图8:一个示例性的链倒转(strand-flipping)和步移策略的示意描绘。(A)模板步移,(B)链倒转以产生倒转链,(C)新引物结合序列Pg'在最终的倒转链上的添加。定义任何主动动词(或它的动名词)意图指示,对应的动作以特定的、显著的或实质的水平(例如,超过随机的、或超过适当的对照)发生。例如,“杂交”的动作指示,发生显著或实质水平的特异性杂交。例如,在扩增过程中引物与模板杂交的情况下,杂交任选地足以从单个模板实现期望的扩增倍数–例如,至少103或104或105或106个扩增子。在另一个实施例中,特异性杂交超过不具有显著量的序列同源性的2个核酸之间发生的杂交。在另一个实施例中,特异性杂交包括:在确定的严谨性条件下,在不发生与杂交混合物中存在的其它核苷酸序列的实质结合下,核酸与靶核苷酸序列的结合。任选地,所述样品源自为了诊断或法医学目的取自活的或死的生物体(例如,人类)的组织或流体。任选地,所述样品包含基因组文库或外显子组文库。在下述情况下,可以认为2个序列是互补的:在选择的条件下,一个序列与另一个序列实质性地且特异性地杂交。在下述情况下,可以认为2个序列是同源的:在选择的条件下,一个序列的反向互补物可以与另一个序列实质性地且特异性地杂交。实质性杂交是例如这样的情况:所述核酸之一中的超过5%(任选地10%、30%、50%或80%)与另一个核酸杂交。2个单链核酸之间的杂交经常、但不一定涉及在选择的条件下稳定的双链结构的形成。选择的条件是例如这样的条件:在该条件下预期会杂交,例如,在扩增循环的退火步骤中。在下述情况下,2个单链多核苷酸被任选地视作杂交:它们通过2个或更多个顺序地邻近的碱基配对而彼此键合。任选地,在双链结构的一条链中的大部分核苷酸与在另一条链上的核苷发生Watson-Crick碱基配对。杂交也包括核苷类似物(诸如脱氧肌苷)、核苷与2-氨基嘌呤碱基等的配对,其可以用于减少探针的简并性,不论这样的配对是否涉及氢键的形成。在下述情况下,可以认为核酸被固定化:至少在选择的条件下(例如,在扩增反应过程中),其以基本上稳定的方式与载体连接。所述连接可以是通过任何机理,包括、但不限于非共价键合、离子相互作用、共价键。如果第一核酸与固定化在载体上的第二核酸杂交,那么所述第一核酸也可以视作在扩增过程中被固定化在载体上,只要扩增条件使得大量第一核酸和第二核酸在扩增过程中的任意时间或所有时间彼此结合或连接。例如,第一核酸和第二核酸可以通过包含Watson-Crick碱基配对或氢键合的杂交结合到一起。在一个实施例中,选择的扩增条件允许至少50%、80%、90%、95%或99%的第一核酸保持与第二核酸杂交,或反之亦然。如果核酸未与载体直接地或间接地连接或结合,可以认为核酸是未固定化的或非固定化的。在下述情况下,可以认为介质在选择的条件下是可流动的:所述介质在这些条件下至少暂时地是流体介质,所述流体介质不会实质上或完全地限制或阻碍未固定化的分子的转移或运动。所述未固定化的分子本身没有固定化至固体载体或表面上或与其它固定化的分子结合。在一个实施方案中,所述未固定化的分子是在可流动的介质中的溶质(例如,核酸)。在介质中的示例性的转移或运动可以是借助于液体内的扩散、对流、湍流、搅拌、布朗运动、平流、电流(currentflows)或其它分子运动,从连续相中的任意第一点至处于流体连通的或在同一连续相中的任意其它点。例如,在可流动的介质中,大量未固定化的核酸从一个固定化位点转移至另一个固定化位点,所述另一个固定化位点在可流动的介质的同一连续相内,或者与所述第一固定化位点流体连通。任选地,核酸在介质中的转移或运动的速率与核酸在水中的转移或运动的速率相当。在某些情况下,选择的条件是在扩增过程中介质所处的条件。选择的条件可以允许或不允许可流动的介质保持基本上静止。所述条件可以使得或不使得可流动的介质发生有效混合、搅拌或摇动。所述介质在扩增过程中任选地是至少暂时可流动的。例如,所述介质在至少一种选择的预扩增和/或扩增条件下是可流动的。任选地,可流动的介质不会实质上阻止不同的未固定化的核酸的混合或未固定化的核酸在可流动的介质的连续相的不同地带之间的转移。例如,核酸的运动或转移可以借助于扩散或对流造成。如果未固定化的核酸在扩增后不能在不同的固定化位点之间或在整个连续相上扩散或移动,则任选地认为介质是不可流动的。通常,可流动的介质不会在扩增的时段内将未固定化的核酸(例如,模板或扩增子)实质上限制在反应体积的有限地带内或在固定位置处。任选地,通过用不同的方式(meansor)改变可流动的介质的条件可以使其是不可流动的。任选地,如果介质是液体或不是半固体,那么介质是可流动的。如果介质的流动性与纯水相当,那么可以认为介质是可流动的。在其它实施方案中,如果介质是基本上不含聚合物的流体,或者如果它的粘度系数与纯水的粘度系数类似,可以认为介质是可流动的。在一个实施方案中,载体包含一个或多个固定化位点。核酸(例如,模板或扩增子)任选地在它的相应固定化位点处与载体结合。固定化位点任选地构成载体的特定部分或区域、或载体上的位置或部位。固定化位点可以具有、或者任选地可以缺少在载体上的任何特定的或预定的部位、位置、尺寸、大小、区域或结构,或任意其它区别性的参数或特征。任选地,在模板与载体结合时,和/或在扩增过程中或结束时,为固定化位点确定一种或多种这样的参数。在一个实施方案中,一个部分或模板结合部分(例如,扩增引物)与载体连接,所述部分任选地以或不以预定的或确定的位置或角度或至确定点的中心的距离排列在载体上。任选地,模板分子在载体上的一个或多个固定化位点处的排列,是或不是通过各个连接部分的故意设计或布置来实现。连接部分(例如,引物)的这种“随机分布的”或“随机的”阵列可以如下实现:将包含核酸分子集合的溶液、乳剂、气溶胶、蒸汽或干燥制品点滴、喷洒、铺板或涂布在载体上,并允许核酸分子沉积在载体上,用或不用任何措施将它们引向所述载体上的特定的或预定的固定化位点。载体或固定化位点任选地包含一个或多个与载体连接的寡核苷酸(例如,扩增引物)。优选地,但不一定,在后续扩增或其它测定过程中,寡核苷酸与载体或固定化位点的连接是稳定的(例如,在处于选择的扩增条件以后,超过10%、30%、50%、70%或90%的寡核苷酸保持结合)。任选地,在本文所述的任何方法中,在至少一个载体或固定化位点上的所有引物包含相同的序列。所述载体或固定化位点可以任选地包含其它核酸,所述其它核酸不与目标模板的一条链或它的互补物杂交。所述载体或固定化位点任选地不包含与目标模板的一条链或它的互补物杂交的任意其它核酸(即,所述固定化位点任选地缺少任意其它引物)。任选地,载体或固定化位点包含多个引物,所述引物具有至少2种不同的序列。任选地,所述载体或固定化位点包含与单链模板的第一部分互补的固定化的引物物质,且不包含与模板的第二不重叠部分同源的固定化的引物(或可以与模板互补物杂交)。在下述情况下,所述2个部分是不重叠的:它们不含有会彼此杂交的或会与其它部分的互补物杂交的任何子部分。2种或更多种不同类型的引物(例如,序列不同)可以以彼此基本上相同的浓度存在,或者可替换地,以不同的浓度存在。任选地,引物基本上均匀地分布在载体或固定化位点上。任选地,在本文所述的任何方法中,2个不同的固定化位点是单一载体的在空间分开的子组分(例如,部分或区域),和/或是在不同的(例如,结构上不连续的)载体上。任选地,在本文所述的任何方法中,至少一个固定化位点包括载体的整个表面或载体的整个体积。固定化的引物任选地均匀地分布在一种或多种载体或固定化位点上。任选地,在本文所述的任何方法中,2个不同的固定化位点以预定的排列位于共享的载体内部或表面(例如以网格图形)。在其它实施方案中,在将模板固定化至载体上之前,未知或未确定一个或多个固定化位点的量、边界或位置。在一个实施例中,所述载体包含多个固定化的引物,且起始模板与其杂交(例如,在发生任何扩增之前)的引物可以视作被包含在该模板的固定化位点内(例如,中心点)。在这样的一个实施方案中,在引物与模板杂交的过程中或之后,确定固定化位点的位置。还可以在延伸和/或扩增过程中或之后,确定固定化位点的量和边界。在下述情况下,认为核酸群体是克隆的:它的成员的大部分具有基本上相同的(或基本上互补的)序列。应该理解,群体的成员不需要是100%同一的或互补的,例如,在合成过程中可能发生特定数目的“误差”。在一个实施方案中,群体的至少50%的成员彼此之间或与参照核酸分子(即,用作序列对比基础的、具有确定序列的分子)是基本上相同的(或互补的)。更优选地,群体的至少60%、至少70%、至少80%、至少90%、至少95%、至少99%、或更多的成员与参照核酸分子是基本上相同的(或互补的)。在下述情况下,可以认为2个分子是基本上相同的:当最佳地比对时,2个分子之间的同一性百分比是至少75%、80%、85%、90%、95%、98%、99%、99.9%或更大。在下述情况下,可以认为2个分子是基本上互补的:当最佳地比对时,2个分子之间的互补性百分比是至少75%、80%、85%、90%、95%、98%、99%、99.9%或更大。另外,在本文所述的方法中,可能发生不同源核酸的低水平或非实质水平的混合,因而克隆群体可能含有小量不同的核酸(例如,小于30%,例如,小于10%)。本领域普通技术人员会理解,对模板、初始化寡核苷酸、延伸探针、引物等的提及可以是指,在相关部分内基本上相同的的核酸分子的群体或集合,而不是单个分子。例如,“模板”可以是指多个基本上相同的模板分子;“探针”可以是指多个基本上相同的探针分子等。就在一个或多个位置处发生简并的探针而言,应当理解,构成特定探针的探针分子的序列将在简并位置处存在差异,即,构成特定探针的探针分子的序列可以仅仅在非简并位置处是基本上相同的。在本申请内的这些术语意图提供群体或分子的载体。在意图表示单个核酸分子(即,一个分子)的情况下,术语“模板分子”、“探针分子”、“引物分子”等可以替代性地使用。在某些情况下,会明确地指出基本上相同的核酸分子的群体的复数性质。“模板”、“寡核苷酸”、“探针”、“引物”、“模板”、“核酸”等意图是在本文中可互换的术语。这些术语表示多核苷酸,不一定限于任何长度或功能。同一核酸可以取决于上下文而视作“模板”、“探针”或“引物”,且可以随着时间在这些角色之间转换。“多核苷酸”也称为“核酸”,是通过共价的核苷间键连接的2个或更多个核苷酸的线性聚合物或其变体或功能片段。在它们的天然存在的例子中,核苷间键通常是磷酸二酯键。但是,其它例子任选地包含其它核苷间键,诸如硫代磷酸酯键,且可以包含或不包含磷酸酯基团。多核苷酸包括双链和单链DNA、以及双链和单链RNA、DNA:RNA杂合体、肽-核酸(PNA)、以及在PNA和DNA或RNA之间的杂合体,且也包括已知类型的修饰。多核苷酸可以任选地例如通过5'或3'末端与下述物质连接:一个或多个非核苷酸部分诸如标记和其它小分子,大分子诸如蛋白、脂质、糖和固体或半固体载体。标记包括使用选择的检测方法可检测的任意部分,并因而使得连接的核苷酸或多核苷酸类似地可用选择的检测方法检测出。任选地,所述标记会发射光学地可检测的或可见的电磁辐射。在某些情况下,核苷酸或多核苷酸未与标记连接,并且直接检测核苷酸或多核苷酸的存在。“核苷酸”表示核苷酸、核苷或其类似物。任选地,核苷酸是嘌呤或嘧啶碱基的N-或C-糖苷(例如,含有2-脱氧-D-核糖的脱氧核糖核苷,或含有D-核糖的核糖核苷)。其它类似物的例子包括、但不限于,硫代磷酸酯、氨基磷酸酯、甲基膦酸酯、手性-甲基膦酸酯、2-O-甲基核糖核苷酸。通过这些术语中的任一个对核酸的提及,应当视作暗示,所述核酸具有任何特殊的活性、功能或性质。例如,词语“模板”不指示,所述“模板”被聚合酶拷贝,或者所述模板不能充当“引物”或“探针”。应当理解,在某些情况下,在扩增中涉及的核酸试剂(诸如模板、探针、引物等)可以是更大核酸分子的一部分,所述更大核酸分子还含有不起相同功能的另一部分。任选地,该其它部分不起任何模板、探针或引物功能。在某些情况下,与任选地固定化的引物(例如,在固定化位点上)实质上杂交的核酸被视作“模板”。在模板步移中涉及的任意一种或多种核酸试剂(模板、固定化的链、固定化的或未固定化的引物等)可以在扩增之前或在扩增过程中从其它核酸产生。所述核酸试剂任选地如下从输入核酸产生(且不需要与其相同):对最初引入模板步移介质中的核酸做出一个或多个修饰。例如,可以对输入核酸进行限制酶切消化、连接、一个或多个扩增循环、变性、突变等,以产生在扩增或进一步扩增过程中充当模板、引物等的核酸。例如,可以使双链的输入核酸变性,以产生第一单链核酸,其任选地用于产生第二互补链。如果希望如此的话,所述第一单链核酸可以视作用于我们在本文中的目的的“模板”。可替换地,从所述第一单链核酸产生的第二互补链可以视作用于我们在本文中的目的的“模板”。在另一个实施例中,模板源自输入核酸,且不一定与输入核酸相同。例如,模板可以包含在输入核酸中不存在的额外序列。在一个实施方案中,模板可以是使用一种或多种引物从输入核酸产生的扩增子,所述引物具有与输入核酸不互补的5'突出端。术语“扩增”是指产生核酸分子的拷贝,例如经由引发的酶促合成的重复循环。任选地,这样的扩增用固定化的模板核酸分子和/或固定化的一种或多种引物进行。扩增子是例如通过从起始模板核酸的扩增操作产生的单链或双链核酸。扩增子包含这样的核酸链:其至少一部分与起始模板的至少一部分基本上相同的或基本上互补。在起始模板是双链的情况下,扩增子包含这样的核酸链:其与一条链的至少一部分基本上相同,且与任一条链的至少一部分基本上互补。扩增子可以是单链的或双链的,不论初始模板是单链的还是双链的。术语“载体”包括,在其上面可以固定化试剂(诸如核酸)的任何固体或半固体物品。核酸可以通过任意方法固定化在固体载体上,所述方法包括、但不限于物理吸附、离子键或共价键形成或它们的组合。固体载体可以包括高分子材料、玻璃材料或金属材料。固体载体的例子包括膜、平面表面、微孔滴定板、珠子、滤器、试验条、载玻片、盖玻片和试管,是指在其上面合成、附着、连接或以其它方式固定化寡聚体的任何固相材料。载体可以任选地包括“树脂”、“相”、“表面”和“支持物”。载体可以由下述材料组成:有机聚合物诸如聚苯乙烯、聚乙烯、聚丙烯、聚氟乙烯、聚氧乙烯和聚丙烯酰胺,以及它们的共聚物和接枝聚合物。载体也可以是无机物,诸如玻璃、二氧化硅、可控孔度玻璃(CPG)或反相二氧化硅。载体的构型可以是珠子、球、微粒、颗粒、凝胶或表面的形式。表面可以是平面的、基本上平面的或非平面的。载体可以是多孔的或无孔的,且可以具有膨胀或不膨胀特征。可以使载体成形以包含一个或多个孔、凹陷或其它容器、管(vessel)、部件或位置。多个载体可以在不同的位置处构造成阵列。载体任选地是可访问的(例如,用于试剂的机器人递送),或者可被检测装置访问,包括通过激光照射扫描和共焦光聚集或偏移光聚集。扩增载体(例如,珠子)可以放置在其它载体内部或表面上(例如,在第二载体的孔内)。在一个实施方案中,固体载体是具有下述最小横截面长度(例如,直径)的“微粒”、“珠子”、“微米珠”等(任选地但不一定是球形):50微米或更小,优选10微米或更小,3微米或更小,大约1微米或更小,大约0.5微米或更小,例如,大约0.1、0.2、0.3或0.4微米或更小(例如,低于1纳米、约1-10纳米、约10-100纳米、或约100-500纳米)。微粒(例如,得自挪威奥斯陆Dynal的Dynabeads)可以由多种无机或有机材料制成,所述材料包括、但不限于:玻璃(例如,可控孔度玻璃)、二氧化硅、氧化锆、交联的聚苯乙烯、聚丙烯酸酯,聚甲基丙烯酸甲酯、二氧化钛、胶乳、聚苯乙烯等。磁化可以促进微粒连接的试剂(例如,多核苷酸或连接酶)在扩增后的收集和浓缩,且也可以促进其它步骤(例如,洗涤、试剂除去等)。在本发明的某些实施方案中,可以使用具有不同形状、大小和/或颜色的微粒群体。微粒可以任选地用例如量子点编码,使得每个微粒可以被单独地或独特地鉴别出。具体实施方式在某些实施方案中,本公开内容一般地涉及用于克隆扩增一个或多个核酸模板以形成克隆扩增的核酸模板的群体的方法、组合物、系统、仪器和试剂盒。本文所述的任意扩增方法任选地包括重复的核酸扩增循环。一个扩增循环任选地包括:(a)使引物与模板链杂交,(b)引物延伸,以形成第一延伸链,(c)使延伸链从模板链部分或不完全变性。与模板链杂交的引物(为了方便,命名为“正向”引物)任选地被固定化在载体表面上或固定化至载体。所述载体是例如固体或半固体。任选地,从步骤(c)得到的模板链的变性部分在下一个扩增循环中自由地与不同的正向引物杂交。在一个实施方案中,在后续扩增循环中的引物延伸包括第一延伸链从模板链的置换。例如可以包括第二种“反向”引物,其与第一延伸链的3'末端杂交。所述反向引物任选地未被固定化。在一个实施方案中,使用固定化在/至一种或多种固体或半固体载体上的引物,扩增模板。任选地,所述载体包含固定化的引物,所述引物与模板链的第一部分互补。任选地,所述载体不显著地包含固定化的引物,所述引物与相同模板链的第二不重叠部分同源。在下述情况下,2个部分是不重叠的:它们不含有彼此杂交的或与其互补物杂交的任何子部分。在另一个实施例中,所述载体任选地不显著地包含固定化的引物,所述引物可与模板链的互补物杂交。任选地,在有一种或多种载体存在下,在单个连续液相中同时地扩增多个核酸模板,其中每种载体包含一个或多个固定化位点。在一个实施方案中,扩增每个模板,以产生扩增子的克隆群体,其中各个克隆群体被固定化在与其它扩增群体不同的载体或固定化位点内部或表面上。任选地,所述扩增群体在扩增后保持基本上同源(clonal)。例如扩增模板以产生克隆群体,所述克隆群体包括模板同源链(在本文中被称作“模板链”或“反向链”)和/或模板互补链(在本文中被称作“引物链”或“正向链”)。在一个实施方案中,如下在得到的扩增的核酸群体中维持克隆形成能力:维持模板链和它的引物链之间的结合,由此将有关的克隆后代有效地结合或“连接”在一起,并减小不同的克隆群体之间的交叉污染的可能性。任选地,将克隆群体中的一个或多个扩增的核酸与载体连接。基本上相同的核酸的克隆群体可以任选地具有在空间上局部化的或离散的宏观外观。在一个实施方案中,克隆群体可以类似于单独的斑点或集落(例如,当分布在载体中时,任选地在所述载体的外表面上)。在某些实施方案中,本公开内容一般地涉及新颖的制备克隆扩增子的局部化克隆群体的方法,所述克隆扩增子任选地固定化在一种或多种载体中或表面上。所述载体可以是例如固体或半固体(诸如凝胶或水凝胶)。所述扩增的克隆群体任选地连接至所述载体的外表面,或者也可以在载体的内表面内(例如,在所述载体具有多孔结构或基体结构的情况下)。在某些实施方案中,通过沿着目标模板链(也称为“反向”链)的引物延伸的多个循环,实现扩增。为了方便,与目标模板链杂交的引物被称作“正向”引物,且其任选地以模板依赖性的方式延伸,以形成与目标模板链互补的“正向”链。在某些方法中,所述正向链本身被称作“反向”引物的第二引物杂交,所述第二引物延伸以形成新的模板链(也称为反向链)。任选地,新模板链的至少一部分与原始的目标模板(“反向”)链同源。如提及的,可以将一种或多种引物固定化在一种或多种载体中或表面上。任选地,一种引物通过与载体的连接而固定化。第二引物可以存在,且任选地没有固定化或与载体连接。例如,可以在单个连续液相中在不同的载体或固定化位点上同时扩增不同的模板,以形成克隆核酸群体。在下述情况下,可以认为液相是连续的:所述液相的任意部分与液体主体的任意其它部分发生流体接触或连通。在另一个实施例中,在下述情况下,可以认为液相是连续的:没有部分被完全细分或隔离、或以其它方式与液体主体的剩余部分完全物理上分离。任选地,液相是可流动的。任选地,连续液相不是在凝胶或基体内。在其它实施方案中,连续液相是在凝胶或基体内。例如,连续液相占据固体或半固体载体的孔、空间或其它间隙。在液相是在凝胶或基体内的情况下,将一种或多种引物任选地固定化在载体上。任选地,所述载体是凝胶或基体本身。可替换地,所述载体不是凝胶或基体本身。在一个实施例中,一种引物被固定化在被包含在凝胶内的固体载体上,且没有固定化至凝胶分子。所述载体是例如平面表面或一个或多个微粒的形式。任选地所述平面表面或多个微粒包含具有基本上相同的序列的正向引物。在一个实施方案中,所述载体不含有显著量的第二种不同的引物。任选地,第二种未固定化的引物是在凝胶内的溶液中。所述第二种未固定化的引物例如与模板链(即,反向链)结合,而所述固定化的引物与正向链结合。为了方便,核酸模板链的被引物杂交的部分称作“引物结合序列”或PBS。因而,正向引物与反向链上的正向引物结合序列(“正向PBS”)结合,而反向引物与正向链上的反向PBS结合。一个实施方案包括引物延伸的方法,所述方法包括:(a)引物-杂交步骤,(b)延伸步骤,和(c)步移步骤。任选地,所述引物-杂交步骤包括:使第一引物分子(“第一正向引物”)与在核酸链(“反向链”)上的互补的正向-引物结合序列(“正向PBS”)杂交。任选地,所述延伸步骤包括:制备延伸的第一正向链,其是反向链的全长互补物且与反向链杂交。所述延伸的第一正向链例如如下制备:使用反向链作为模板,以模板依赖性的方式延伸第一正向引物分子。任选地,所述步移步骤包括:使第二引物(“第二正向引物”)与正向PBS杂交,其中所述反向链也与第一正向链杂交。例如,所述步移步骤包括:使正向PBS的至少一部分(“游离部分”)从正向链变性,其中反向链的另一部分保持与正向链杂交。在一个实施方案中,所述引物延伸方法是扩增方法,其中将引物-杂交、延伸和/或步移中的任意一个或多个步骤重复至少1次。例如,所述方法可以包括:通过一个或多个扩增循环,扩增正向链。扩增循环任选地包括延伸和步移。一个示例性的扩增循环包括延伸和随后的步移,或者基本上由延伸和随后的步移组成。任选地,第一个扩增循环的第二正向引物充当后续扩增循环的第一正向引物。例如,在第一个扩增循环中的步移步骤的第二正向引物充当后续扩增循环的延伸步骤的第一正向引物。任选地,引物延伸或扩增方法另外包括,如下延伸或扩增反向链:(a)使第一反向引物分子与延伸的正向链上的互补的反向-引物结合序列(“反向PBS”)杂交;(b)使用正向链作为模板,以模板依赖性的方式延伸第一反向引物分子,从而制备延伸的第一反向链,其是正向链的全长互补物且与正向链杂交;和(c)使第二引物(“第二反向引物”)与反向PBS杂交,其中正向链也与第一反向链杂交。任选地进行步骤(b)至(c)的一次或多次重复,其中步骤(c)的第二反向引物是重复的步骤(b)的第一反向引物;且其中在所述一次或多次重复过程中或重复之间的所有时间时,正向链的大部分与反向链杂交。在实施方案中,所述大部分任选地是至少30%、40%、50%、60%、65%、70%、75%、80%、85%、90%、95%或99%。任选地,在扩增过程中,反向链和/或正向链没有暴露于完全变性条件,所述完全变性条件会导致大多数链的大部分(例如,超过10%、20%、30%、40%或50%)从它们的延伸互补物和/或全长互补物完全分离。在一个实施方案中,在一个或多个扩增循环(例如,1个、5个、10个、20个扩增循环、或进行的所有扩增循环)过程中或扩增循环之间的所有时间时,正向链和/或反向链的大部分任选地与延伸互补物和/或全长互补物杂交。在实施方案中,链的大部分任选地是链的至少60%、65%、70%、75%、80%、85%、90%、95%或99%。在一个实施方案中,这如下实现:使扩增反应维持在这样的温度,所述温度高于未延伸的引物的Tm,但是低于引物-互补链的Tm。例如,保持扩增条件在高于未延伸的正向引物的Tm、但是低于延伸的反向链或全长反向链的Tm的温度内。还例如,保持扩增条件在高于未延伸的反向引物的Tm、但是低于延伸的正向链或全长正向链的Tm的温度内。任选地,一种或多种正向引物和/或一种或多种反向引物是可呼吸的(breathable),例如,具有低Tm。在一个实施例中,可呼吸的引物的至少60%、65%、70%、75%、80%、85%、90%、95%或99%的核苷酸碱基是腺嘌呤、胸腺嘧啶或尿嘧啶,或者与腺嘌呤、胸腺嘧啶或尿嘧啶互补。核酸链(例如,引物或模板链)的Tm是例如这样的温度:在该温度时,在选择的试剂条件下,双链体的克隆群体的至少期望的比例变成完全单链的,其中单个双链体包含与它的全长互补物杂交的目标核酸链。在默认时,期望的比例是50%。在实施方案中,期望的比例任选地是至少10%、20%、30%、40%、50%、60%、65%、70%、75%、80%、85%、90%、95%或99%。在一个实施方案中,使用已知方法(例如,如本文所讨论的)在理论上预测Tm(N)。在另一个实施方案中,通过已知方法经验地测量所述Tm(例如,Spink,MethodsCellBiol.2008;84:115-41;Meunier-Prest等人,NucleicAcidsRes.2003年12月1日;31(23):e150;Brewood等人,NucleicAcidsRes.2008年9月;36(15):e98.)。期望的比例的Tm可以描述为Tm(N),其中N表示百分比方式的期望的比例。在一个实施方案中,正向引物和/或反向引物的Tm(50)(在该温度,所有引物分子中的50%与它们的互补PBS完全离解)是不超过50℃、55℃、60℃、65℃、70℃、75℃或80℃。任选地,延伸的或全长的正向链和/或反向链的Tm(50)(在该温度,所有链分子中的50%与它们的互补序列完全离解)不小于80℃、75℃、70℃、65℃、60℃或55℃。在另一个实施方案中,正向引物和/或反向引物的Tm(80)是不超过50℃、55℃、60℃、65℃、70℃、75℃或80℃。任选地,延伸的或全长的正向链和/或反向链的Tm(80)是不小于80℃、75℃、70℃、65℃、60℃或55℃。在另一个实施方案中,正向引物和/或反向引物的Tm(90)是不超过50℃、55℃、60℃、65℃、70℃、75℃或80℃。任选地,延伸的或全长的正向链和/或反向链的Tm(90)是不小于80℃、75℃、70℃、65℃、60℃或55℃。在另一个实施方案中,正向引物和/或反向引物的Tm(95)是不超过50℃、55℃、60℃、65℃、70℃、75℃或80℃。任选地,延伸的或全长的正向链和/或反向链的Tm(95)是不小于80℃、75℃、70℃、65℃、60℃或55℃。任选地,延伸的或全长的正向链和/或反向链的Tm(99)是不小于80℃、75℃、70℃、65℃、60℃或55℃。在另一个实施方案中,正向引物和/或反向引物的Tm(95)是不超过50℃、55℃、60℃、65℃、70℃、75℃或80℃。任选地,延伸的或全长的正向链和/或反向链的Tm(99)是不小于80℃、75℃、70℃、65℃、60℃或55℃。任选地,在高于未延伸的引物的Tm(70)且低于互补全长链的Tm(20)的温度,进行一个或多个扩增循环(例如,1个、5个、10个、20个扩增循环或基本上所有的扩增循环)。例如,所述温度是高于未延伸的引物的Tm(80)且低于互补全长链的Tm(20)或Tm(15)或Tm(10)或Tm(5)或Tm(1)。还例如,所述温度是高于未延伸的引物的Tm(90)且低于互补全长链的Tm(20)或Tm(15)或Tm(10)或Tm(5)或Tm(1)。还例如,所述温度是高于未延伸的引物的Tm(95)且低于互补全长链的Tm(20)或Tm(15)或Tm(10)或Tm(5)或Tm(1)。还例如,所述温度是高于未延伸的引物的Tm(98)且低于互补全长链的Tm(20)或Tm(15)或Tm(10)或Tm(5)或Tm(1)。还例如,所述温度是高于未延伸的引物的Tm(99)且低于互补全长链的Tm(20)或Tm(15)或Tm(10)或Tm(5)或Tm(1)。任选地,在比未延伸的引物的Tm(50)高至少5、10、15、20、25、30、35或45℃的温度,进行一个或多个扩增循环。任选地,所述温度比全长引物-互补链的Tm(50)低至少5、10、15、20、25、30、35或45℃。在一个实施方案中,未延伸的引物是正向引物,互补全长链是反向链,或反之亦然。任选地,在延伸步骤中使用反向链作为模板对正向引物的模板依赖性延伸会导致已经与反向链杂交的另一个正向链的置换。任选地,在延伸步骤中使用正向链作为模板对反向引物的模板依赖性延伸会导致已经与正向链杂交的另一个反向链的置换。在一个实施方案中,所述方法另外包括:在进行引物延伸或所需数目的扩增循环以后,使延伸的正向链与反向链分离,和任选地从存在的分离的固定化的反向链中除去分离的正向链,或反之亦然。任选地,在任意一个或多个步骤过程中,一种或多种核酸试剂未与重组酶和/或逆转录酶和/或解螺旋酶和/或切口酶和/或不是聚合酶的任意其它酶接触。例如,引物和/或模板在任何时间未与一种或多种这类酶接触。任选地非酶促地实现变性,例如,通过升高温度。在一个实施方案中,如本文所述,在基本上等温的条件下进行扩增。任选地,任意一种或多种核酸(例如,引物)与载体连接(例如,共价连接)。在一个实施方案中,第一正向引物和/或第二正向引物固定化至单一(同一)载体。在一个实施方案中,第一正向引物和第二正向引物靠近地固定化至同一载体,由此扩增产生延伸的正向链的固定化的克隆群体。任选地,第一正向引物和第二正向引物之间的距离是不超过引物或PBS的长度的2倍。任选地,使多个模板核酸单独地与在空间上隔开的固定化位点杂交,由此扩增产生与各个模板核酸相对应的在空间上隔开的克隆群体。在一个实施方案中,使第一正向引物与在“反向”模板链上的正向PBS杂交。任选地,将第一正向引物固定化在载体上。第一正向引物可以沿着反向链延伸,以形成(延伸的)第一正向链。所述延伸任选地是模板依赖性的,使用反向链作为模板。在延伸后,第一正向链和反向链任选地在双链体中彼此杂交。任选地,第一反向链的PBS的至少一部分和第一正向链的正向-引物部分彼此分离(例如,经由变性或解链),但是第一反向链和第一正向链保持在另一部分上彼此结合(例如,杂交)。然后可以使反向链的分离的部分(包括正向-PBS的至少一部分)与不同的第二正向引物对合(例如,通过杂交)。任选地,所述第二正向引物固定化在载体上。所述第二正向引物可以例如固定化在与第一正向引物相同的载体上,且任选地位于与第一引物充分靠近处,使得反向链的一部分可以与第一正向链杂交,而反向链的另一部分同时与第二正向引物杂交。然后又可以延伸所述第二正向引物,以形成延伸的第二正向链。任选地,以模板依赖性的方式沿着反向链延伸所述第二正向引物。所述第二正向引物的延伸任选地使所述第一正向链从反向链置换。如前所述,反向链的引物结合序列可以与第二正向链的引物部分分离,其中反向链的另一部分保持与第二正向链结合(例如,通过杂交)。可以用其它正向引物重复这些步骤,以形成其它延伸的正向链(例如,延伸的第三、第四、第五、第六、第七、第八、第九、第十或更高阶的延伸链)。可以任选地重复所述方法所需数目的扩增循环,以提供扩增的固定化的核酸分子的群体。所述群体在性质上可以是基本上同源的。例如,扩增的克隆群体的扩增的核酸分子可以包括多个彼此基本上相同的和/或基本上互补的核酸。任选地,延伸的正向链包含反向引物可与其杂交的反向-引物结合序列(“反向PBS”)。在所述正向链上的反向PBS任选地包含所述正向链的3'末端或在所述3'末端附近。在某些实施方案中,扩增包括:使反向PBS的至少部分从任何杂交的或结合的序列(诸如在反向链上的序列)离解。在所述正向链上的反向PBS任选地与反向引物(其可与所述反向PBS杂交)接触。然后使用正向链作为模板来延伸反向引物,以形成延伸的反向链。任选地,新产生的反向链充当正向引物延伸的模板。所述反向链还可以作为模板、引物或探针参与另一个反应,包括本文所述的任何方法。扩增的核酸群体可以用于许多不同的目的,包括测序、筛选、诊断、原位核酸合成、监测基因表达、核酸指纹法等。任选地,本文中的任意一种或多种引物延伸和/或扩增方法会产生一种或多种固定化的核酸延伸产物。在一种变体中,固体载体包含全部相同的或基本上相同的引物。固体载体可以包含其它核酸。任选地,这些其它核酸不与目标模板链或它的互补物杂交。固体载体任选地不包含与目标模板链或它的互补物杂交的任意其它核酸。在某些实施方案中,本公开内容一般地涉及在扩增反应溶液中在载体上克隆扩增核酸模板的方法、组合物、系统、仪器和试剂盒。任选地,在包含连续液相的溶液中,使核酸模板与载体接触。所述载体可以包括引物群体,所述引物至少包括第一引物和第二引物。所述引物群体可以固定化在所述载体上,例如通过与所述载体的共价连接。在某些实施方案中,所述核酸模板包括邻近靶序列的引物结合序列。所述引物结合序列可以与所述第一引物的序列互补,并任选地与所述第二引物的序列互补。所述靶序列可以不与所述群体中的引物互补。在某些实施方案中,所述核酸模板的引物结合序列与所述第一引物杂交。使用聚合酶可以使所述第一引物沿着模板延伸,由此形成延伸的第一引物。所述模板的引物结合序列的至少一部分可以与延伸的第一引物分离(例如,变性或解链)。任选地在维持模板的一部分和延伸的第一引物之间的杂交的同时,进行所述分离。随后可以使引物结合序列的分离的部分与所述第二引物杂交。任选地,在维持模板的其它部分和延伸的第一引物之间的杂交的同时,进行这样的杂交。使用聚合酶可以使所述第二引物沿着模板延伸,由此形成包括延伸的第一引物和延伸的第二引物的载体。延伸的第一引物和/或延伸的第二引物的延伸部分可以包括与靶序列互补的序列。在某些实施方案中,本公开内容一般地涉及在扩增反应溶液中在载体上克隆扩增核酸模板的方法,所述方法包括:使核酸模板与载体在液体溶液中接触,其中所述载体包括固定化的引物的群体,所述引物至少包括第一引物和第二引物,且其中所述核酸模板包括邻近靶序列的引物结合序列,其中所述引物结合序列与所述第一引物的序列和所述第二引物的序列互补,且所述靶序列不与所述群体中的引物互补;使所述核酸模板的引物结合序列与所述第一引物杂交;使用聚合酶使所述第一引物沿着模板延伸,由此形成延伸的第一引物;在维持模板的另一部分和延伸的第一引物之间的杂交的同时,使模板的引物结合序列的至少一部分从延伸的第一引物变性;在维持模板的其它部分和延伸的第一引物之间的杂交的同时,使引物结合序列的变性部分与所述第二引物杂交;和使用聚合酶使所述第二引物沿着模板延伸,由此形成包括延伸的第一引物和延伸的第二引物的载体,其中所述延伸的第一引物和所述延伸的第二引物各自包括与靶序列互补的序列。所述引物群体可以由基本上相同的引物组成,所述引物的序列相差不超过1、2、3、4或5个核苷酸。在某些实施方案中,所述引物群体由不同的引物组成,所述引物中的至少一些包括与模板的引物结合序列互补的序列。在某些实施方案中,群体的引物不与模板的5’末端部分的序列互补。在某些实施方案中,群体的引物不与载体的任意延伸引物的3’末端部分的序列互补。在某些实施方案中,群体的引物不与模板的除了引物结合序列以外的任何序列互补。在某些实施方案中,本公开内容一般地涉及在扩增反应溶液中在载体群体上克隆扩增核酸模板群体的方法,所述方法包括:根据本文公开的任一种方法,在第一载体上的第一核酸模板上克隆扩增第一模板,和根据相同的方法,在第二载体上克隆扩增第二核酸模板,其中两种载体在扩增过程中都被包括在单个连续液相内。本领域普通技术人员会理解,对模板、初始化寡核苷酸、延伸探针、引物等的提及在某些实施方案中可以表示在相关区域内基本上相同的核酸分子群体或集合,而不是单个分子。因而,例如,“模板”在某些实施方案中可以表示多个基本上相同的模板;“探针”在某些实施方案中可以表示多个基本上相同的探针分子,等。就在一个或多个位置发生简并的探针而言,应当理解,构成特定探针的探针分子的序列将在简并位置处存在差异,即,构成特定探针的探针分子的序列可以仅仅在非简并位置处是基本上相同的。为了描述目的,单数形式不仅可以用于表示单个分子,而且可以用于表示基本上相同的分子的群体。在某些情况下,将明确地指示核酸分子的单数性质或基本上相同的核酸分子的群体的复数性质。应该理解,群体的成员不需要具有100%同一性。例如,克隆扩增的核酸序列群体的所有成员不需要是相同的,因为在合成过程中可能发生特定数目的“误差”;类似地,引物群体内的所有引物不需要彼此相同。在某些实施方案中,群体的至少50%的成员与参照核酸分子(即,用作序列对比基础的、具有确定序列的分子)是相同的。在某些实施方案中,群体的至少50%的成员与参照核酸分子具有至少70%、75%、85%、90%或更优选至少95%同一性。更优选地,群体的至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或更多的成员与参照核酸分子具有至少85%、90%、或更优选至少95%同一性、或更优选至少99%同一性。优选地,群体的至少95%或更优选至少99%的成员与参照核酸分子的同一性百分比是至少98%、99%、99.9%或更大。可以如下计算同一性百分比:对比2个最佳比对的序列,确定2个序列中存在相同核酸碱基(例如,A、T、C、G、U或I)的位置的数目,得到匹配位置的数目,将所述匹配位置的数目除以位置总数,并将结果乘以100,得到序列同一性百分比。应当理解,在某些情况下,核酸分子(诸如模板、探针、引物等)可以是更大核酸分子的一部分,所述更大核酸分子还含有不起模板、探针或引物功能的部分。在该情况下,群体的各个成员不需要就该部分而言是基本上相同的。核酸任选地包含一个或多个核苷酸。在一个实施方案中,核苷酸包含核苷碱基(含氮碱基)、5碳糖(核糖或2'-脱氧核糖)和磷酸酯基团中的任意一种或多种。任选地,核苷酸包含所有3种组分或其衍生物。任选地,核苷碱基是嘌呤或嘧啶碱基。示例性的嘌呤碱基包括腺嘌呤和鸟嘌呤,而示例性的嘧啶是胸腺嘧啶、尿嘧啶和胞嘧啶。当与单个核苷酸结合使用时,本文中使用的术语“互补”和它的变体包括,在生理条件下在DNA复制过程中被DNA聚合酶彼此相对地有效掺入的核苷酸。在一个典型实施方案中,互补的核苷酸可以彼此形成碱基对,诸如通过彼此反向平行的核苷酸和/或多核苷酸位置的核苷碱基之间的特异性的Watson-Crick型氢键合形成的A-T/U和G-C碱基对;还可以存在其它类型的碱基配对。例如,其它人工碱基对的互补性可以是基于其它类型的氢键合和/或碱基的疏水性和/或碱基之间的形状互补性。当与核酸序列结合使用时,本文中使用的术语“互补”和它的变体是指,在处于反向平行取向的2个或更多个单独对应位置处可以彼此发生累积碱基配对的核酸序列,如在杂交的双链体中。任选地,在第一核酸序列和第二核酸序列之间可以存在“完全的”或“总的”互补性,其中在第一核酸分子或序列中的每个核苷酸可以与第二核酸序列上的对应反向平行位置处的核苷酸发生稳定性的碱基配对相互作用;可替换地,在下述情况下,2个核酸序列可以是互补的:一个核酸序列的至少50%的核苷酸残基与其它核酸序列中的核苷酸残基互补。在特定互补核酸序列内的互补残基不需要总是彼此邻近,且可以被互补核酸序列内的一个或多个不互补的残基中断。在某些实施方案中,2个互补核酸序列之一的至少50%、但是小于100%的残基与其它核酸序列中的残基互补。在某些实施方案中,一个核酸序列的至少70%、80%、90%、95%或99%的残基与其它核酸序列中的残基互补。在下述情况下,称作序列是“基本上互补的”:一个核酸序列的至少85%的残基与其它核酸序列中的残基互补。当与2个或更多个核酸分子结合使用时,本文中使用的“互补”可以包括这样的任意核酸分子:其中每个分子包含与其它核酸分子中的序列互补的序列。互补的核酸分子不需要在它们的整个长度是互补的,并且每个分子可以包括一个或多个不与其它分子互补的区域。例如,模板和引物分子可以被称作“互补的”,即使在它们具有不同的长度时;在某些实施方案中,模板可以比引物更长,且包括不与引物的任何序列互补的序列,或反之亦然。本文中与2个核酸分子或序列结合使用的术语“非互补”和它的变体通常是指这样的核酸分子或序列:其中一个核酸分子或序列的小于50%的残基与其它核酸分子或序列中的残基互补。“错配”存在于核酸分子或序列中的任意位置处,在该处,2个相对的核苷酸是不互补的。类似地,在下述情况下,认为2个核苷酸序列或其部分彼此匹配:所述序列或部分彼此相同或互补。本文中使用的术语“杂交”是指,任意2个核酸分子(包括互补的核苷酸)之间在一个或多个位置处的碱基配对过程。通常,这样的碱基配对可以根据确定的范例发生,所述范例例如Watson-Crick范例,其中通过在彼此反向平行的核苷酸和/或多核苷酸位置的核苷碱基之间的特异性的Watson-Crick型氢键合形成A-T/U和G-C碱基对。在某些实施方案中,杂交同样可以根据非-WatsonCrick范例发生;例如,通过其它类型的氢键合和/或碱基的疏水性和/或碱基之间的形状互补性,可以形成人工碱基对。杂交的核酸分子不需要在它们的整个长度是杂交的,并且每个分子可以包括一个或多个不与其它分子杂交的区域。例如,即使在模板、引物或二者的大部分区域保持彼此不杂交时,模板和引物分子也可以被描述为彼此杂交。此外,杂交区域可以包括一个或多个没有彼此碱基配对的连续核苷酸。以此方式彼此碱基配对的核酸分子(或在核酸分子内的序列)被称作“杂交的”。在某些实施方案中,单个核酸分子可能发生与其自身的自杂交(例如,发夹形成)。通常,使核酸分子杂交(例如,使引物与模板杂交)包括:在特定条件下,使核酸分子彼此接触,其中每个核酸分子的一个或多个核苷酸残基与另一个核酸分子的一个或多个核苷酸碱基配对。所述接触可以使用任意合适的条件来实现,取决于期望的用途。在一个示例性的测定中,在包含盐和/或去污剂(例如,SDS)的缓冲溶液中使2个核酸分子接触所需的时间长度和所需的时段。例如,可以使用低严谨性、中等严谨性或高严谨性杂交条件实现杂交。通过改变不同的杂交参数,可以调节杂交的严谨性,所述杂交参数包括例如温度、盐浓度、SDS浓度等。杂交方法和控制杂交的严谨性的方法是本领域众所周知的。除了别的以外,提供了制备单链模板序列的固定化克隆扩增子的局部化克隆群体的方法,所述方法包括:(a)使单链模板序列(“模板1”)与固定化位点(“IS1”)连接,其中IS1包含可与模板1实质上杂交的固定化的引物(“IS1引物”)的多个拷贝,且模板1通过与IS1引物的杂交而与IS1连接,和(b)使用IS1引物和未固定化的引物(“SP1引物”)在溶液中扩增模板1,其中与单链模板1互补的扩增链在单链时不可与IS1上的引物实质上杂交,其中扩增在模板1与IS1的初始杂交点周围产生固定化克隆扩增子的局部化克隆群体。还提供了制备第一模板序列(“模板1”)和第二模板序列(“模板2”)的分离的和固定化的克隆群体的方法,所述方法包括:扩增所述第一模板序列和第二模板序列,以产生模板1的克隆扩增子群体或模板2的克隆扩增子群体,所述模板1的克隆扩增子群体基本上连接至第一固定化位点(“IS1”)且未连接至第二固定化位点(“IS2”),所述模板2的克隆扩增子群体基本上连接至IS2且未连接至IS1,其中:(a)两个模板和所有扩增子被包含在同一连续液相内,其中所述连续液相与第一固定化位点和第二固定化位点(分别是“IS1”和“IS2”)接触,且其中IS1和IS2在空间上分离,(b)模板1当处于单链形式时包含在一个末端处的第一子序列(“T1-FOR”)和在它的相对末端处的第二子序列(“T1-REV”),(c)模板2当处于单链形式时包含在一个末端处的第一子序列(“T2-FOR”)和在它的相对末端处的第二子序列(“T2-REV”),(d)IS1包含固定化的核酸引物(“IS1引物”)的多个拷贝,当T1和T2是单链时,所述IS1引物可以与T1-FOR和T2-FOR实质上杂交,(e)IS2包含固定化的引物(“IS2引物”)的多个拷贝,当T1和T2是单链时,所述IS2引物可以与T1-FOR和T2-FOR实质上杂交,(f)T1-REV的反向互补物在单链时不可与IS1上的引物实质上杂交,但是可以与连续液相中的未固定化的引物(“SP1”)实质上杂交;和(g)T2-REV的反向互补物在单链时不可与IS2上的引物实质上杂交,但是可以与连续液相中的未固定化的引物(“SP2”)实质上杂交。另外,提供了制备第一模板序列(“模板1”)和第二模板序列(“模板2”)的分离的和固定化的克隆群体的方法,所述方法包括:扩增所述第一模板序列和第二模板序列,其中:(a)两个模板都处于单链形式,且都被包含在同一连续液相中,其中第一固定化位点和第二固定化位点(分别是”IS1”和“IS2”)与所述连续液相接触,且其中IS1和IS2在空间上分离,(b)模板1包含在它的3'末端处的第一子序列(“T1-FOR”)和在它的5'末端处且与T1-FOR不重叠的第二子序列(“T1-REV”),(c)模板2包含在它的3'末端处的第一子序列(“T2-FOR”)和在它的5'末端处且与T2-FOR不重叠的第二子序列(“T2-REV”),(d)IS1包含可与T1-FOR和T2-FOR二者杂交的固定化的引物(“IS1引物”),(e)IS2包含可与T1-FOR和T2-FOR二者杂交的固定化的引物(“IS2引物”),和(f)T1-REV的反向互补物不可与IS1上的引物实质上杂交,和/或T2-REV的反向互补物不可与IS2上的引物实质上杂交,但是各自可以与连续液相中的未固定化的引物实质上杂交;由此扩增产生模板1的基本上连接至IS1且未连接至IS2的克隆扩增子群体和/或模板2的基本上连接至IS2且未连接至IS1的克隆扩增子群体。任选地,在本文所述的任何方法中,所述连续介质是可流动的。任选地,在扩增过程的至少一部分中,例如,在本文所述的任意一个或多个步骤或循环过程中,未固定化的核酸分子在连续液相中的混合基本上未受到延迟。任选地,在本文所述的任何方法中,在扩增过程中,混合在一段时间内基本上未受到延迟。例如,在整个扩增持续时间中,混合基本上未受到延迟。任选地,在本文所述的任何方法中,已经从一个固定化位点离解的任意核酸能够与两个固定化位点实质上杂交,且所述离解的核酸在连续液相中向另一个固定化位点的任何运动(例如,通过扩散、对流的运动)基本上未受到延迟。任选地,在本文所述的任何方法中,所述连续液相与IS1和IS2同时接触。任选地,在本文所述的任何方法中,模板的被固定化的引物结合的第一部分不与模板的第二部分重叠,所述第二部分的互补物被未固定化的引物结合。任选地,在本文所述的任何方法中,在输入核酸与至少一个固定化位点接触以后,从该核酸产生至少一个要扩增的模板。任选地,在本文所述的任何方法中,所述方法包括下述步骤:(a)使包含固定化的引物的载体与单链核酸模板接触,其中:使第一固定化的引物与在模板上的引物结合序列(PBS)杂交;(b)以模板依赖性延伸延伸杂交的第一引物,以形成与模板互补的且至少部分地与模板杂交的延伸链;(c)使所述模板从延伸的互补链部分地变性,使得PBS的至少一部分处于单链形式(“游离部分”);(d)使游离部分与未延伸的固定化的第二引物杂交;(e)以模板依赖性延伸延伸所述第二引物,以形成与模板互补的延伸链;(f)任选地,使退火的延伸的固定化的核酸链彼此分离。任选地,在本文所述的任何方法中,(a)在扩增过程中,形成包含起始模板和/或扩增链的核酸双链体;所述双链体在扩增过程中未遭受会使大量双链体完全变性的条件。任选地,在本文所述的任何方法中,如下产生单链模板:获取要扩增的多个输入双链或单链核酸序列(所述序列可以是已知的或未知的),和将第一通用接头序列和第二通用接头序列拼接或建立在至少一个输入核酸的末端上;其中所述第一通用接头序列与IS1引物和/或IS2引物杂交,且所述第二通用接头序列的反向互补物与至少一种未固定化的引物杂交。所述接头可以是双链的或单链的。任选地,在本文所述的任何方法中,将第一核酸接头序列和第二核酸接头序列提供在所述单链模板序列的第一末端和第二末端处。任选地,在本文所述的任何方法中,还将标签添加至一种或多种核酸序列(例如,模板或引物或扩增子)上,所述标签使得含有该标签的核酸能够被鉴别。任选地,在本文所述的任何方法中,在至少一个固定化位点或载体上的引物具有相同的序列。任选地,固定化位点或载体包含多个具有至少2种不同序列的引物。任选地,2种或更多种不同类型的引物(例如,序列不同)以彼此基本上相同的浓度存在,或者可替换地,以不同的浓度存在。任选地,至少一个固定化位点或载体的引物基本上均匀地分散在固定化位点或载体上。任选地,在本文所述的任何方法中,2个不同的固定化位点是单一载体的在空间上分开的子组分和/或是在不同的未连接的载体上。任选地,在本文所述的任何方法中,所述载体形成三维基体,且所述2个不同的固定化位点是所述载体的没有完全重叠的2个不同三维部分。任选地,在本文所述的任何方法中,所述2个不同的固定化位点是载体表面上的没有完全重叠的2个不同区域。任选地,在本文所述的任何方法中,所述2个不同的固定化位点是在不同的载体上。至少一种载体可以是珠子,例如,微米珠或纳米珠。在一个实施方案中,所述珠子是在美国公开申请号2010-0304982(其通过引用并入)中描述的“支架化的核酸聚合物颗粒”或SNAPP。任选地,在本文所述的任何方法中,至少一个固定化位点包括所述载体的整个表面或所述载体的整个体积。任选地,在本文所述的任何方法中,所述2个不同的固定化位点以预定的排列(例如以网格图形)定位。在其它实施方案中,一个或多个固定化位点是未预定的(例如,所述载体包含在未预定的位置处的固定化的引物),且起始模板与其杂交的引物(例如,在发生任何扩增之前)可以视作该模板的固定化位点。任选地,在本文所述的任何方法中,使用加热来部分地分离退火的核酸链。任选地,如下实现引物延伸:使引物与模板杂交,并与聚合酶和核苷酸接触。所述接触和杂交可以同时地或顺序地实现。任选地,一个或多个核苷酸被可检测地标记。任选地,在本文所述的任何方法中,所述方法另外包括下述步骤:处理一个或多个延伸的固定化的核酸链,从而释放核酸分子或其部分。所述处理例如可以任选地由核酸切割组成,例如,用限制性内切核酸酶或用核酶进行核酸切割。例如,所述引物中的一个或多个具有限制性内切核酸酶识别位点或核酶识别位点,或者具有这样的位点的部分,该部分在发生引物延伸时变成完整的。任选地,在本文所述的任何方法中,使用所述方法来扩增多个不同的核酸序列,例如,顺序地或同时地。所述多个是例如超过103、105、107、109、1011、1014或1020个靶核酸。可以使用本文中的任意方法提供用于诊断或用于筛选或用于基因分型的扩增的核酸分子,或提供要用作其它组分的载体的扩增的核酸分子,或制备处于游离(例如,未固定化的,而不是固定化的)形式的其它核酸分子。例如,可以使用任意方法来监测基因表达,或鉴别含有罕见地表达的基因产物的核酸分子,鉴别杂合的个体、核酸指纹法。任选地,在本文所述的任何方法中,给所述不同的核酸序列各自提供如本文任意地方描述的第一和第二核酸“接头”序列,就所述不同核酸序列中的每一个而言,所述第一和第二“接头”序列是相同的。任选地,在本文所述的任何方法中,给所述不同的核酸序列各自提供不同的标签,使得所述不同的序列可以彼此区分开。在一个实施方案中,使用RPA,即,重组酶-聚合酶扩增(参见,例如,WO2003072805,通过引用并入本文),实现扩增。任选地在没有温度或试剂条件的实质性变化下进行RPA。在本文中的一个实施方案中,使用重组酶和/或单链结合蛋白,可以实现部分变性和/或扩增,包括本文所述的任意一个或多个步骤或方法。适合的重组酶包括RecA和它的原核或真核同系物、或其功能片段或变体,任选地与单链结合蛋白(SSB)相组合。在一个实施方案中,所述重组酶试剂任选地包被单链DNA(ssDNA)诸如扩增引物,以形成核蛋白丝链,该链侵入模板上的具有同源性的双链区域。这会任选地建立短的杂合体和置换的链泡(被称作D-环)。在一个实施方案中,通过DNA聚合酶延伸D-环中的丝链的游离3′-末端,以合成新的互补链。互补链随着它伸长而置换模板的原始配对的配偶体链。在一个实施方案中,使一对扩增引物中的一个或多个在与模板(其任选地是双链的)接触之前与一种或多种重组酶试剂接触。在本文所述的任何方法中,模板(靶序列)的扩增包括:使重组酶试剂与至少一对扩增引物中的一个或多个接触,由此形成一个或多个“正向”和/或“反向”RPA引物。任选地除去尚未与一个或多个引物结合的任意重组酶试剂。任选地,然后使一个或多个正向RPA引物与模板链接触,所述模板链任选地具有与至少一个RPA引物互补的区域。可以使模板链杂交。使RPA引物与互补的模板接触会任选地导致所述引物和模板之间的杂交。任选地,用一种或多种聚合酶(例如,在有dNTP存在下)使引物的3′末端沿着模板延伸,以产生双链核酸和置换的模板链。扩增反应可以包括这样的接触和延伸的重复循环,直到可实现所需的扩增程度。任选地,通过并行RPA反应来扩增核酸的置换链。任选地,如下扩增核酸的置换链:(a)使它与依次与一个或多个互补的引物接触;和(b)通过本文所述的任意策略,延伸互补的引物。在一个实施方案中,所述一种或多种引物包括“正向”引物和“反向”引物。使两种引物和模板接触会任选地导致在所述第一链的第一部分处的第一双链结构和在所述第二链的第二部分处的双链结构。任选地,用一种或多种聚合酶延伸正向引物和/或反向引物的3′末端,以产生第一和第二双链核酸以及核酸的第一和第二置换链。任选地,所述第二置换链彼此至少部分地互补,且可以杂交以形成子代双链核酸,后者可以在后续扩增循环中充当双链模板核酸。任选地所述第一置换链和所述第二置换链与所述第一引物或所述第二引物至少部分地互补,且可以与所述第一引物或所述第二引物杂交。在本文所述的任意方法或步骤或组合物或阵列的一个替代实施方案中,所述载体任选地包括超过一个序列的固定化的引物。在模板核酸链与第一互补的固定化的引物杂交后,然后可以延伸所述第一引物,并可以使模板和引物部分地或完全地彼此分离。然后可以使延伸的引物与第二固定化的引物(其具有与所述第一引物不同的序列)对合,并可以延伸所述第二引物。然后可以使两种延伸的引物分离(例如,从彼此完全地或部分地变性),且可以再用作用于延伸其它固定化的引物的模板。可以重复该过程,以提供扩增的固定化的核酸分子。在一个实施方案中,该扩增会产生固定化的引物延伸产物,所述产物具有彼此互补的2种不同序列,其中所有引物延伸产物在5'末端处固定化至所述载体。从本文中的任意方法产生的扩增的核酸可以用于许多不同的目的,包括测序、筛选、诊断、原位核酸合成、监测基因表达、核酸指纹法等。任选地,调节模板浓度,使得固定化的模板通常分布成彼此具有足够的距离,使得从各个模板产生的克隆簇几乎没有或基本上没有彼此重叠,或者不会在扩增或复制过程中或之后彼此污染。任选地,本文中的任意扩增方法包括下述步骤:在模板核酸与固体载体接触之前,调节模板核酸的浓度,使得各个模板分子与以至少10000、100000、400000、500000、1,000,000或107分子/mm2的密度固定化在固体载体上的引物杂交。任选地,在所述载体上原位扩增各个模板分子,从而产生以初始模板的杂交点为中心分布的克隆群体。链倒转在下述的“倒转”实施方案中,延伸2种或多种引物,以形成2种或多种对应的延伸链。任选地,延伸的2种或多种引物包含基本上相同的序列或基本上由其组成,且对应的延伸链的延伸部分彼此至少部分地不相同和/或互补。倒转的一个示例性的实施方案如下。扩增起始模板(例如,通过模板步移),以产生多个引物-延伸链(为了方便,将其命名为“正向”链)。任选地,所述正向链与起始模板互补。任选地,将所述正向链固定化在载体上。任选地,所述正向链包含基本上相同的序列,例如,所述正向链是彼此基本上相同的。在一个实施方案中,通过延伸一个或多个固定化在载体上的引物(“正向”引物),形成所述正向链。所述正向引物和/或所述正向链任选地在它们的5'末端处或附近与载体连接。任选地,一个或多个引物-延伸的正向链包含3'序列(被称作自杂交序列),该3'序列在未延伸的引物中不存在,且在选择的条件下可以与5'序列杂交(该过程被称作“自杂交”)。所述5'序列任选地是未延伸的正向引物的一部分。在一个实施例中,正向延伸产物在这种杂交后形成“茎-环”结构。任选地,未延伸的正向引物包含在它的3'末端处或附近的、对切割敏感的“可切割的”核苷酸。在一个实施方案中,所述可切割的核苷酸通过“易切断的”核苷间键与至少一个其它核苷酸连接,所述“易切断的”核苷间键可在基本上不切割磷酸二酯键的条件下切断。延伸以后,任选地允许正向-引物延伸产物(即,正向链)自杂交。在另一个实施方案中,在进行自杂交以后,在可切割的核苷酸(例如与相邻核苷酸形成易切断键的核苷酸)的易切断键处切割正向链。所述切割会产生引物-延伸产物(即,延伸的正向链)的2个片段。在一个实施方案中,第一片段包含原始的未延伸的正向引物的至少一部分。任选地,所述第一片段不包含任何延伸的序列。任选地,所述第一片段被固定化(例如,因为未延伸的正向引物已经被固定化)。在一个实施方案中,第二片段包含延伸的序列。任选地,所述第二片段包含未延伸的引物的除了可切割的核苷酸以外的任意3'部分,或者没有包含未延伸的引物的任意部分。任选地,所述第二片段通过它的自杂交序列与所述第一部分杂交。在一个实施例中,所述可切割的核苷酸是被一种或多种酶除去的核苷酸。所述酶可以是例如糖基化酶。所述糖基化酶任选地具有从双链DNA释放可切割的核苷酸的N-糖基化酶活性。任选地,可切割的核苷酸的除去会产生脱碱基的、脱嘌呤的或脱嘧啶的位点。可以任选地进一步修饰脱碱基位点,例如通过另一种酶活性。任选地,通过裂合酶来修饰脱碱基位点,以产生碱基间隙。所述裂合酶例如会在脱碱基位点的3′和/或5′侧切割。裂合酶的切割任选地发生在5'和3'末端处,从而导致除去脱碱基位点和剩下碱基间隙。多种糖基化酶可以识别和除去示例性的可切割的核苷酸诸如5-羟基-尿嘧啶、7,8-二氢-8-氧代鸟嘌呤(8-氧代鸟嘌呤)、8-氧代腺嘌呤、甲酰氨基嘧啶鸟嘌呤(fapy-guanine)、甲基甲酰氨基嘧啶鸟嘌呤、甲酰氨基嘧啶腺嘌呤和黄曲霉毒素B1-甲酰氨基嘧啶鸟嘌呤、5-羟基-胞嘧啶,以形成脱嘌呤位点。一种适合的酶是甲酰氨基嘧啶[fapy]-DNA糖基化酶,也被称作8-氧代鸟嘌呤DNA糖基化酶或FPG。FPG起N-糖基化酶和AP-裂合酶二者的作用。N-糖基化酶活性任选地从双链DNA释放出受损的嘌呤,从而产生脱嘌呤位点(AP位点),其中磷酸二酯主链任选地是完整的。AP-裂合酶活性会在AP位点的3′和5′侧切割,由此除去AP位点和剩下单碱基间隙。在一个实施例中,可切割的核苷酸是8-氧代腺嘌呤,其被具有糖基化酶和裂合酶活性的FPG转化成单碱基间隙。在另一个实施方案中,所述可切割的核苷酸是尿苷。任选地,尿苷被“USER”试剂切割,所述“USER”试剂包括尿嘧啶DNA糖基化酶(UDG)和DNA糖基化酶-裂合酶内切核酸酶VIII,其中UDG催化尿嘧啶碱基的切除,从而形成脱碱基的(脱嘧啶的)位点,同时保留完整的磷酸二酯主链,且其中内切核酸酶VIII的裂合酶活性会在脱碱基位点的3′和5′侧处断裂磷酸二酯主链,从而释放出无碱基的脱氧核糖;此后,任选地使用激酶将切割产物的3’末端上的磷酸酯基团转化成-OH基团。任选地使至少一个切割的片段与聚合酶接触。任选地,可以用聚合酶延伸第一固定化的片段。如果希望如此的话,第二杂交的片段可以充当用于延伸第一片段的模板。在一个实施方案中,形成“倒转的”双链延伸产物。可以任选地以本文所述的任意方式对该倒转的产物进行模板步移。当对倒转的和未倒转的产物均进行模板步移时,形成2种不同延伸产物的簇,其中两种延伸产物具有相同的部分(与未延伸的引物对应)和彼此互补的部分(与延伸产物的延伸部分对应)。在一个实施方案中,通过在有延伸试剂(例如,聚合酶和dNTP)存在下使延伸的正向链与单链“剪接”接头序列接触,可以任选地在延伸的正向链的3'末端处添加目标序列,诸如自杂交序列或新的引物结合位点。该剪接序列任选地包含:与延伸的正向链的3'末端部分基本上互补的3'部分,和与要添加的目标序列基本上互补的5'部分。在使剪接接头与延伸的正向链的3'末端杂交后,使用剪接接头作为模板对所述正向链进行模板依赖性的聚合酶延伸。这样的延伸会导致目标序列向延伸的正向链的3'末端的添加。因而,本文所述的任意引物延伸和/或扩增方法可以包括下述步骤中的任意一个或多个:a)通过模板步移延伸固定化的正向引物,以产生多个任选地相同的延伸的正向链;b)任选地使剪接接头与延伸的正向链的3'末端杂交,并使用剪接接头作为模板对所述正向链进行模板依赖性延伸,由此将另一个3'序列添加至进一步延伸的正向链,其中添加的3'序列的一部分与未延伸的正向引物的一部分互补并与其杂交,以形成茎-环结构;c)在可切割的核苷酸的易切断键处切割所述正向链,所述易切断键位于未延伸的正向引物序列和延伸的正向链序列的接头处或附近;和任选地除去可切割的核苷酸,由此产生2个切割片段,第一片段包含未延伸的正向引物的一部分,该部分与第二片段上的3'引物-互补序列杂交;d)任选地使用第二片段作为模板对第一片段进行聚合酶延伸,以产生倒转的正向链;e)任选地使第二剪接接头与倒转的正向链的3'末端杂交,并使用剪接接头作为模板对所述正向链进行模板依赖性延伸,由此将另一个3'序列添加至倒转的正向链,其中添加的3'序列的一部分是在倒转链中不存在的新引物结合序列;f)通过与新引物接触,选择性地延伸或扩增包含新引物结合序列的倒转链,并通过任意方法(例如,如本文所述的方法)延伸或扩增。所述新引物不结合未倒转链或在步骤(e)中未进一步延伸的倒转链。图8显示了一个示例性的链倒转和步移策略的示意描绘。(A)模板步移,(B)链倒转以产生倒转链,(C)新引物结合序列Pg'在最终的倒转链上的添加。I.克隆扩增方法概述使核酸与适当的引物结合(例如,杂交),所述引物任选地被固定化。为了方便,可以将杂交的核酸命名为“模板”链或“反向链”。该词语“模板”无意暗示与最初引入溶液中的输入核酸的任何特定功能、结构或序列关联,或与通过扩增过程产生的最终核酸产物的任何特定功能、结构或序列关联。在一个实施方案中,正向引物可以与反向链的第一部分杂交。另一种“反向”引物任选地存在,其与反向链的第二不重叠部分基本上相同。在下述情况下,所述2个部分是例如不重叠的:它们不含有彼此相同或互补的任意子部分。在一个实施方案中,所述模板链任选地在与正向引物互补的至少一部分上是单链的,该部分被命名为正向“引物结合序列”或正向PBS。任选地使用反向链作为模板来延伸所述正向引物,以形成延伸的正向链,从而产生杂交的模板(反向链)和所述正向链之间的双链体。所述正向链的引物部分的至少一部分可以与杂交的反向链分离。所述正向链包含可与“反向”引物杂交的反向PBS部分,且该反向引物又可以延伸以形成延伸的反向链。然后可以使正向链和反向链彼此分离,并可以重复该过程,以得到扩增的固定化的核酸分子的克隆群体。任选地,使正向链和反向链彼此分离的任意一个或多个步骤包括部分分离,例如,这样的分离:其使正向链的一部分从反向链的一部分离解,但是不会消除2条链之间的所有结合。任选地,使正向链的一部分从反向链离解,同时相同正向链的另一部分保持与反向链结合(例如,通过杂交)。在部分分离过程中,在反向链上的正向PBS的至少一部分从第一正向链离解。但是,分离是“部分的”,因为正向链和反向链总体上保持彼此结合。例如,反向链的另一部分保持与正向链杂交。任选地,反向链的变性部分与第二正向引物重新杂交。因而,反向链的一部分与第一正向链杂交,同时相同反向链的另一部分与第二正向引物杂交。然后使第二正向引物沿着反向链延伸(使用反向链作为模板),以产生第二正向链。重复的扩增循环(其中一个扩增循环任选地包括杂交、延伸和(部分)分离)会产生核酸的克隆群体。任选地,将一种或多种正向引物固定化在载体上,所述载体缺少任何固定化的反向引物,或反之亦然。在一个实施方案中,将第一正向引物和第二正向引物凑到一起或彼此邻近地固定化。得到的核酸克隆群体包括彼此靠近或邻近地固定化的正向链。在一个实施方案中,将至少106、108、1010、1012或1014个引物固定化在1cm2或cm3的单独载体或固定化位点上。任选地,所有正向引物具有相同的序列,或者具有相同的3'部分。在替代实施方案中,将正向引物和/或反向引物任选地固定化在载体上。可替换地,两种引物未固定化。通常,将核酸克隆扩增在载体上,在所述载体上固定化有引物的多个拷贝。一个示例性的核酸是核酸集合中的一个核酸。例如,所述集合中的各个核酸可以具有在它们的5'和/或3'末端处的一个或多个接头序列和在其间的可变序列,诸如gDNA或cDNA。在一个实施方案中,3'接头具有低Tm区域(其中Tm是DNA分子中的一半处于未变性或双链状态且一半处于变性(例如,随机卷曲)状态时的温度),且5'接头任选地具有更高的Tm区域,或反之亦然。低Tm区域是例如A富集的、T富集的或嘧啶富集的区域,诸如AT(或U)富集的序列,诸如聚胸苷酸、聚腺苷酸、聚尿苷酸以及A、T和U碱基的任意组合。本文描述了示例性的方法。本文所述的方法可以用于许多不同的目的,包括测序、筛选、诊断、原位核酸合成、监测基因表达、核酸指纹法等。在载体上的克隆核酸扩增的非限制性示例性方法如下。A)在载体上的扩增在某些实施方案中,公开的方法、组合物、系统、仪器和试剂盒包括与载体连接的核酸(例如,引物、模板等)。使用任意合适的方法,可以连接所述核酸。在某些实施方案中,核酸分子和载体之间的连接是由共价键合、氢键合(例如由模板与其它核酸(例如,与载体共价连接的引物)的杂交介导的模板核酸与载体的连接)、范德华力、亲和相互作用等介导。可以使用将核酸序列与载体连接的任意合适的方法,包括使用结合对(例如,抗生物素蛋白/生物素;抗原/抗体)。在某些实施方案中,结合对的一个成员与载体连接,结合对的另一个成员与核酸连接,并且所述核酸经由所述结合对的2个成员的相互作用与所述载体连接。所述载体可以由任意材料构成,且具有任意尺寸或形状。可以选择所述载体,以具有仅最少地干扰扩增过程的性质或反应性。在某些实施方案中,所述载体由固体材料构成;可替换地,它可以至少部分地由半固体、流体或液体材料构成。在某些实施方案中,所述载体是球形的、类似球体的、管状的、丸粒形的、棒状的、八面体的、六角形的、正方形的或梯形的形状。在某些实施方案中,所述载体是多孔的。在某些实施方案中,所述载体可以由亲水性的多孔基体(诸如水凝胶)构成。参见,例如,Hinz等人的美国专利公开号2010-0304982;和Agresti等人的美国专利公开号2010-0136544;所有前述申请通过引用并入本文。除了别的以外,提供了新颖的在载体内部或表面上制备固定化克隆扩增子的局部化克隆群体的方法。所述载体可以是例如固体或半固体。所述扩增的克隆群体任选地固定化至载体的外表面,或者还可以在载体的内表面内(例如,其中所述载体是半固体,例如,具有凝胶或基体结构)。示例性的载体可以是固体或半固体。任选地,所述半固体载体包含聚丙烯酰胺、纤维素、聚酰胺(尼龙)和交联的琼脂糖、葡聚糖和聚乙二醇。任选地,公开的方法和组合物包括核酸集合(例如,收集物)中的一个或多个单个成员与载体群体中的一个或多个载体的连接。例如,所述集合中的不同核酸可以与不同的载体连接。得到的载体群体包括多个载体,每个载体包含单个核酸。在某些实施方案中,所述集合的核酸是双链的,且所述集合是变性的,以形成单链核酸群体。在某些实施方案中,所述载体包括引物,且一个或多个单链核酸可以通过与表面上的引物的杂交与载体连接。任选地,在扩增之前,可以适当地稀释核酸集合,并使其与在溶液中的载体群体接触,使得至少40%、50%、60%、70%、80%、90%或95%的载体(或者,在载体群体由一个或几个载体组成的情况下,固定化位点)与不超过一个核酸连接。在某些实施方案中,可以设定核酸数目与载体总数之比,以促进单克隆形成,例如,通过使得到的仅包括单个核酸的载体的数目(或在单一载体上的固定化位点的数目)最大化,或者通过选择特定比例,该比例在统计学上预测会产生比更低或更高比例更多的克隆载体(例如,珠子)。任选地,在本文的任意扩增方法中使用单一载体,其中所述单一载体具有多个可与模板杂交的引物。在这样的一个实施方案中,调节模板集合的浓度,然后使其与固体载体接触,使得集合中的各个模板分子以至少102、103、104、105、4x105、5x105、6x105、8x105、106、5x106或107个分子/mm2的密度进行连接或结合(例如,通过与固定化在固体载体上的引物的杂交)。任选地,在所述载体上在原位扩增各个模板分子,从而产生以初始模板的杂交点为中心分布的克隆群体。任选地,所述扩增从单个扩增的模板产生不超过约102、103、104、105、106、107、108、109、1010、1011、1012、1015或1020个扩增子。任选地,克隆扩增子的集落以至少102、103、104、105、4x105、5x105、6x105、8x105、106、5x106或107个分子/mm2的密度位于固体载体上。在某些实施方案中,可以在使多个核酸结合同一载体的条件下,使核酸集合与一个或多个载体接触。就包括在同一载体的不同区域中平行地克隆扩增核酸的方法而言,这样的接触可以是特别有用的。可以调节核酸数目与载体表面积之比,以促进单克隆形成,例如,通过确保核酸在载体中适当地分布,以利于扩增的核酸的单克隆群体的形成,而没有不同的克隆群体之间的实质性交叉污染。例如,在使用单一载体的情况下,将要扩增的核酸的集合调至这样的稀释度:得到的从各个核酸产生的扩增的克隆群体通常是离散的或分离的,例如,没有重叠。例如,在50%、70%、80%或90%或更多的扩增的克隆群体内的各个核酸中没有散布实质上不同的核酸。任选地,不同的扩增的群体没有与其它扩增群体接触或完全重叠,或者可用选择的检测方法彼此辨别开。在某些实施方案中,所述核酸与载体的表面连接。在某些实施方案中,所述核酸可以连接在载体内。例如,就由水凝胶或其它多孔基质构成的载体而言,所述核酸可以遍布于所述载体的体积(包括在表面上和在载体内)而连接。在某些实施方案中,所述载体(或在载体群体中的至少一个载体)可以与至少一个引物连接,任选地与引物群体连接。例如,所述载体(或至少一个载体)可以包括引物群体。所述群体中的引物可以彼此基本上相同,或者可以包括基本上相同的序列。一个、一些或全部引物可以包括这样的序列:其与一个或多个核酸模板内的序列互补。在某些实施方案中,所述引物群体可以包括至少2个不互补的引物。所述引物可以通过它们的5'末端与载体连接,且具有游离的3'末端。所述载体可以是载玻片的表面或珠子的表面。所述引物具有低解链温度,诸如寡(dT)20,且可以与集合接头的低Tm区域杂交。在引物之间的距离需要短于接头长度以允许模板步移,或者可替换地,具有5'末端长接头的长引物将会增加步移的机会。在某些实施方案中,在引物和模板会彼此杂交以形成核酸双链体的条件下,使载体与引物和模板(或反向链)连接和/或接触。所述双链体可以包括含有模板和引物的互补序列的双链部分,其中所述互补序列的至少一个核苷酸残基彼此碱基配对。在某些实施方案中,所述双链体还可以包括单链部分。所述双链体还可以包括单链部分。所述单链部分可以包括在模板(或引物)内的这样的任意序列:其不与引物(或模板)中的任意其它序列互补。在载体上的克隆核酸扩增的非限制性示例方法如下。在载体上克隆扩增核酸(为了方便,将其命名为反向链),在所述载体上连接有互补的正向引物的多个拷贝。一个示例性的核酸是多个DNA集合分子中的一个,例如多个核酸成员具有一个或多个在它们的5'和/或3'末端处或附近的共有(“接头”)序列和在其间的可变序列,诸如gDNA或cDNA。在一个实施方案中,3'共有部分(例如,接头)具有可呼吸的(例如,低Tm)区域,且5'共有序列(例如,接头)任选地具有不太可呼吸的(例如,更高的Tm)区域,或反之亦然。在另一个实施方案中,5'和3'共有序列都是可呼吸的。所述可呼吸的(例如,低Tm)区域是例如富含A、T和/或U的区域,诸如AT(或U)富集的序列,诸如聚胸苷酸、聚腺苷酸、聚尿苷酸、以及A、T和U碱基或者与这类碱基互补的碱基的任意组合。在本文中描述了示例性的方法。在载体上的克隆核酸扩增的一种非限制性的示例方法显示在图1中。一个示例性方法的非限制性描述如下。将双链DNA文库分子变性,并将单链DNA通过与表面上的引物的杂交与载体连接。设定DNA分子的数目与载体面积或珠子数目之比,以促进单克隆形成。引物通过它们的5'连接在载体上,且具有游离的3'。所述载体可以是载玻片的表面或珠子的表面。所述引物具有低解链温度,诸如寡(dT)20或寡(dA)30,且可以与文库接头的低Tm区域杂交。在引物之间的距离可以短于接头长度以允许模板步移,或者可替换地,具有5'末端长接头的长引物将会增加步移的机会。在载体上克隆扩增核酸,在所述载体上连接有引物的多个拷贝。一个示例性的核酸是多个DNA文库分子的一个核酸,例如,所述DNA文库分子具有在它们的5'和/或3'末端处的一个或多个共有(例如,“接头”)序列和在其间的可变序列,诸如gDNA或cDNA。在一个实施方案中,3'接头具有低Tm区域,且5'接头任选地具有更高的Tm区域,或反之亦然。低Tm区域是例如嘧啶富集的区域,诸如AT(或U)富集的序列,诸如聚胸苷酸、聚腺苷酸、聚尿苷酸、以及A、T和U碱基或者与这类碱基互补的碱基的任意组合。在本文中描述了示例性的方法。B)引物延伸将一种或多种引物(其处于可溶形式或与载体连接)与DNA聚合或延伸反应混合物一起温育,所述混合物任选地包含诸如酶、dNTP和缓冲剂等试剂中的任意一种或多种。使引物(例如,正向引物)延伸。任选地,所述延伸是引物沿着模板的模板依赖性延伸,其包括各自与模板上的连续核苷酸互补的核苷酸的连续掺入,使得延伸的或未延伸的正向引物与反向链互补(也称作反向平行的或互补的)。任选地,所述延伸用具有聚合酶活性或其它延伸活性的酶(诸如聚合酶)实现。所述酶可以任选地具有其它活性,包括3′-5′外切核酸酶活性(校对活性)和/或5′-3′外切核酸酶活性。可替换地,在某些实施方案中,所述酶可以缺少这些活性中的一种或多种。在一个实施方案中,所述聚合酶具有链置换活性。有用的链置换聚合酶的例子包括噬菌体Ф29DNA聚合酶和BstDNA聚合酶。任选地,所述酶在高温是有活性的,例如,在或高于45℃、高于50℃、60℃、65℃、70℃、75℃或85℃。一种示例性的聚合酶是BstDNA聚合酶(ExonucleaseMinus),它是67kDa嗜热脂肪芽孢杆菌(Bacillusstearothermophilus)DNA聚合酶蛋白(大片段)(在登录号2BDP_A中例证),它具有5’-3’聚合酶活性和链置换活性,但是缺少3’-5’外切核酸酶活性。其它聚合酶包括:得自水生栖热菌(Thermusaquaticus)的耐热性DNA聚合酶I(由登录号1TAQ例证)、得自大肠杆菌(Echerichiacoli)的EcoDNA聚合酶I(登录号P00582)、得自Aquifexaeolicus的AeaDNA聚合酶I(登录号067779)、或其功能片段或变体,例如,在核苷酸水平具有至少80%、85%、90%、95%或99%序列同一性。通常,所述延伸步骤生成核酸,所述核酸包含双链的双链体部分,其中2个互补链彼此杂交。在一个实施方案中,步移包括:使所述核酸处于部分变性的条件,所述条件会使核酸链的一部分变性,但是不足以使核酸在它的整个长度完全变性。在一个实施方案中,在步移操作的部分或整个持续期间内,不使核酸处于完全变性的条件。如在本文中所期望的,在下述情况下,可以将核酸分子视作部分变性的:核酸的至少一条链的一部分保持与互补链杂交,而另一部分处于未杂交状态(即使在有互补序列存在下)。所述未杂交的部分的长度任选地是至少5、7、8、10、12、15、17、20或50个核苷酸。杂交的部分的长度任选地是至少5、7、8、10、12、15、17、20或50个核苷酸。任选地,在下述情况下,可以将核酸视作部分变性的:核酸的各个分子的大部分(例如,超过20%、30%、50%或70%)处于部分变性的状态。任选地,低于大部分的量的各个分子是完全变性的,例如,样品中不超过5%、10%、20%、30%或50%的核酸分子。类似地,在下述情况下,任选地认为核酸是完全变性的:它在核酸的超过80%或90%的各个分子中缺乏任何双链性(或缺少与互补链的任意杂交)。在示例性的条件下,至少50%的核酸是部分变性的,但是小于20%或10%是完全变性的。在其它情况下,至少30%的核酸是部分变性的,但是小于10%或5%是完全变性的。类似地,在下述情况下,可以认为核酸是未变性的:核酸中的小量感兴趣的“可呼吸的”部分(例如,PBS)是变性的。在示例性的退火条件下,样品中的核酸分子的至少10%、30%、50%、60%、70%、80%或90%的PBS与对应引物杂交。在一个实施方案中,通过维持双链体在合适的温度范围内,实现部分变性的条件。例如,将核酸维持在这样的温度:该温度足够高以实现一些热变性(例如,高于45℃、50℃、55℃、60℃、65℃或70℃),但是没有高至足以实现完全热变性(例如,低于95℃或90℃或85℃或80℃或75℃)。完全热变性条件是例如这样的条件:其导致大多数链中的大部分(例如,超过10%、20%、30%、40%或50%)与它们的延伸互补物和/或全长互补物完全分离。在一个实施方案中,使核酸处于等温条件,其中在扩增的至少一些部分的过程中,将温度变化限制在有限的范围内(例如,温度变化是在20℃以内,任选地在10℃以内,例如在5℃或2℃以内)。任选地,将温度在50℃、55℃、60℃、65℃或70℃或附近维持至少约10、15、20、30、45、60或120分钟。任选地,在一个或多个扩增循环(例如,进行的1、5、10、20个或所有扩增循环)过程中,任意温度变化是不超过20℃,任选地在10℃以内,例如在5℃或2℃以内。任选地,可以进行热循环(其中温度变化是在等温或非等温范围内)。在一个实施例中,在变性步骤和另一个步骤(诸如退火和/或延伸)之间限制温度变化。在一个实施例中,对于一个或多个扩增循环,变性温度和退火或延伸温度之间的差异不超过20℃,任选地在10℃以内,例如在5℃或2℃以内。例如,对于至少5、10、15、20、30、35个或基本上所有的扩增循环,限制温度。还可以通过其它方式实现部分变性,例如,使用化学变性剂(诸如尿素或甲酰胺,适当地调节过浓度)的化学方式,或使用高或低pH(例如,在4-6或8-9之间的pH)。在一个实施方案中,使用重组酶-聚合酶扩增(RPA),实现部分变性和扩增。本文描述了示例性的RPA方法。在一个实施方案中,设计负链和/或正链的序列,使得引物结合序列或其部分是可呼吸的,即,在选择的条件(例如,扩增条件)下对变性敏感。所述可呼吸的部分任选地比具有类似长度的、具有随机化序列的大部分核酸更敏感,或者比包含可呼吸的序列的链的至少另一部分更敏感。任选地,可呼吸的序列在选择的扩增条件下表现出显著量的变性(例如,至少10%、20%、30%、50%、70%、80%、90%或95%的分子在可呼吸的序列内完全变性)。例如,将可呼吸的序列设计成,50%的链分子在30、35、40、42、45、50、55、60、65或70℃在选择的条件(例如,扩增条件)下完全变性。任选地,核酸链(例如,引物或模板链)的Tm是这样的温度:在该温度时,在选择的试剂条件下,双链体的克隆群体的至少期望的比例变成完全单链的,其中单个双链体包含与它的全长互补物杂交的目标核酸链。如果没有指定比例,在默认时,期望的比例是50%。在替代实施方案中,期望的比例任选地是至少10%、20%、30%、40%、50%、60%、65%、70%、75%、80%、85%、90%、95%或99%。还例如,在下述情况下,可以认为序列是可呼吸的:在选择的扩增条件下,使用预测解链温度(Tm)的已知理论计算,可呼吸的序列的理论上预测的解链温度是不超过20、30、35、40、45、50、55、60或65℃。在一个实施例中,热稳定性、解链行为和/或Tm是根据Breslauer等人,Proc.Nat.Acad.Sci.83,3746-50(1986)的教导的理论预测温度。在一个示例性的计算中,如下预测Tm:其中ΔH是针对螺旋起始因子而调节过的碱基堆积相互作用的焓;ΔS是针对螺旋起始因子和针对盐对系统熵的贡献而调节过的碱基堆积的熵,且R是普适气体常量(1.987Cal/℃*Mol)。其它细节和假设参见:SantaLucia,J.(1998)Proc.Nat.Acad.Sci.USA95,1460);Rychlik,W.andRhoads,R.E.(1989)Nucl.AcidsRes.17,8543;和BorerP.N.等人.(1974)J.Mol.Biol.86,843。在另一个实施方案中,通过已知方法经验地测量Tm(例如,Spink,MethodsCellBiol.2008;84:115-41;Meunier-Prest等人,NucleicAcidsRes.2003December1;31(23):e150;Brewood等人,NucleicAcidsRes.2008September;36(15):e98.)。在一个实施方案中,在每条链上的至少一个PBS是可呼吸的——例如,正向PBS和反向PBS都是可呼吸的。任选地,核酸(诸如正向链或反向链)包含2个可呼吸的序列。例如,5'部分和3'部分可以是可呼吸的。在通过加热或高温实现部分变性的情况下,一种示例性的可呼吸的PBS可以是嘧啶富集的(例如,具有高含量的A和/或T和/或U)。所述PBS包含例如聚腺苷酸、聚胸苷酸或聚尿苷酸序列或聚嘧啶束。任选地将一种或多种扩增引物或其它引物(例如,固定化的引物)设计成与这些引物结合序列相应地互补。核酸链的一个示例性的PBS包含聚胸苷酸序列,例如,至少10、15、20、25或30个胸苷核苷酸的段,而对应的引物具有与PBS互补的序列,例如,至少10、15、20、25或30个腺苷核苷酸的段。示例性的低熔点引物任选地具有高比例(例如,至少50%、60%、65%、70%、75%、80%、85%90%95%或100%)的核苷碱基,当引物与互补的模板杂交时,所述核苷碱基通常(例如,在选择的扩增条件下)与互补碱基形成不超过2个氢键。这样的核苷碱基的例子包括A(腺嘌呤)、T(胸腺嘧啶)和U(尿嘧啶)。示例性的低熔点引物任选地具有高比例的下述任意一种或多种:A(腺嘌呤)、T(胸腺嘧啶)和/或U(尿嘧啶)核苷酸或其衍生物。在一个实施方案中,所述衍生物包含与A(腺嘌呤)、T(胸腺嘧啶)和/或U(尿嘧啶)互补的核苷碱基。引物的与PBS杂交的部分任选地具有至少50%、60%、65%、70%、75%、80%、85%、90%95%或100%的A(腺嘌呤)、T(胸腺嘧啶)或U(尿嘧啶)核苷酸或它们的任意组合。在另一个实施例中,引物的与PBS杂交的部分包含聚腺苷酸序列(例如,长度为至少5、10、15、20、25或30个核苷酸)。其它示例性的引物包含(NAx)n重复序列。任选地,n(小写字母)是2-30,例如,3-10,例如4-8。“N”(大写字母)是任意核苷酸,且任选地,N是C或G。“A”是腺嘌呤的速记约定,且“x”表示重复序列中的腺嘌呤残基的数目,例如2、3、4、5、6、10或更大。示例性的引物包含(CAA)n、(CA)n、(CAAA)n或甚至(GAA)n的多个重复序列。任选地,仅一条链(例如,正向链或反向链)具有可呼吸的PBS。在另一个实施方案中,正向链和反向链二者都具有可呼吸的PBS。所述可呼吸的PBS任选地与引物互补,所述引物被固定化在载体上,或者未固定化(例如,呈可溶形式)。任选地,包含可呼吸的PBS的链被固定化在载体上,或者未固定化(例如,呈可溶形式)。任选地,两个引物均被固定化,或者两条链均被固定化。任选地两个引物未固定化,或两条链未固定化。扩增循环任选地包括呼吸、退火和延伸。任选地使要扩增的核酸处于这样的条件:所述条件适合这些步骤中的至少一个步骤或为其优化。在一个实施方案中,使所述核酸处于这样的条件:其适合这些步骤中的超过一个步骤(例如,退火和延伸、或呼吸和延伸)。在某些情况下,这些步骤中的所有3个步骤可以在相同条件下同时进行。在一个示例性的方法中,使核酸处于允许或促进呼吸的条件。在一个实施方案中,在下述情况下,认为发生了“呼吸”:双链的双链体的2条链彼此实质上杂交,但是在感兴趣的局部部分(例如,末端或引物结合位点)上是变性的。核酸的一个或多个可呼吸的序列(例如,具有低Tm部分的正向和/或反向PBS)从它所杂交的第一互补链(例如,正向或反向链)局部地变性(“呼吸”),并且因而可用于与其它第二链杂交。一个示例性的第一链是得自第一引物的引物延伸产物。一个示例性的第二链是例如第二未延伸的引物(例如,PBS-互补的寡核苷酸,其包含例如dT或dA序列)。任选地,所述第一链和第二链被固定化在载体上,且可以紧密地定位(例如,足够接近以允许步移)。呼吸条件任选地是部分变性的条件,在该条件下,PBS通常是变性的,但是核酸的另一部分保持处于杂交的或双链的状态。任选地,可以在反应混合物中包括DNA解螺旋酶,以促进部分变性。任选地,然后使核酸处于促进退火的条件,例如,降低温度,以实现可呼吸的PBS和第二链之间的杂交。在一个实施方案中,使用相同的条件来促进呼吸和延伸。在另一个实施方案中,退火条件不同于呼吸条件——例如,退火条件是非变性条件或不如呼吸条件有利于变性的条件。在一个实施例中,退火条件包括比呼吸条件更低的温度(诸如37℃),在所述呼吸条件中,使用更高的温度(例如,60-65℃)。任选地,在一个或多个扩增循环(例如,大多数扩增循环,或基本上所有的扩增循环)的过程中,避免完全变性的条件。延伸条件通常允许或非常适合引物延伸。在一个实施方案中,所述选择的延伸条件与退火条件和/或呼吸条件相同或不同。在一个实施方案中,对于所有3个步骤(例如,等温扩增)使用相同的条件集合,以致于使样品处于第一条件集合持续的时间段会实现呼吸、退火和延伸的多个扩增循环。在一个实施方案中,通过例如链置换DNA聚合酶,诸如BstDNA聚合酶大片段、KlenowDNA聚合酶、phi29DNA聚合酶、VentDNA聚合酶、任意功能片段和/或变体或这样的酶的任意组合,进行链延伸。所述链置换能力任选地通过部分变性的核酸的双链体部分而促进延伸。任选地,将PBS-呼吸和引物延伸步骤中的一个或多个重复多次,以扩增最初的核酸。在将一种或多种核酸试剂(例如,引物)固定化至载体的情况下,引物-延伸产物保持基本上连接至所述载体,例如,借助于未延伸的延伸引物在扩增之前与所述载体的连接,或通过与这样的引物的杂交。任选地,在所述载体上的离散部位周围形成克隆扩增子的局部化克隆群体。一个示例性的离散部位是初始核酸链与载体的连接点,并且从所述连接点,使用初始核酸或它的拷贝作为模板,通过引物延伸,直接地或间接地产生在克隆群体内的其它核酸。任选地,制备要扩增的一个或多个核酸的群体的样品。所述核酸群体可以呈单链或双链形式;任选地一个或多个核酸各自包含具有已知3'末端序列和已知5'末端序列的核酸链,所述末端序列与在扩增中使用的一个或多个引物基本上相同的或互补。核酸链的3'部分可以例如与固定化的引物互补,而5'部分可以与可溶性的引物相同。所述5'和/或3'部分可以是在所述群体内的各个核酸所共有的(“通用的”)或不变的。任选地,在所述群体内的核酸各自包含在共有部分之间的变体(例如,未知)序列,诸如基因组DNA、cDNA、mRNA、配对片段、外显子组等。所述集合可以例如具有足够的成员,以确保对应的遗传性资源(例如,基因组或外显子组)的超过50%、70%或90%覆盖度。II.组合物、阵列和试剂盒本文还提供了组合物,其包含下述物质中的任一个、或任意子集、或全部:至少一个反向核酸链,固定化在至少一个载体上的多个正向引物,在溶液中的多个反向引物,和聚合酶。如本文所述,所述正向引物和/或反向引物任选地是低熔点的或富含腺嘌呤、胸腺嘧啶或尿嘧啶。一种示例性的组合物包含核酸链(“反向链”)的克隆群体,其中每个克隆群体的各个反向链包含在3'末端处的低熔点(例如,可呼吸的)引物结合序列和/或在5'末端上的低熔点的引物序列。所述组合物任选地包括多个反向引物,所述反向引物与在反向链的5'部分或末端上的低熔点的引物序列基本上相同。所述组合物任选地包括多个正向引物,所述正向引物与在反向链的3'部分或末端上的低熔点引物结合序列基本上互补。在一个实施方案中,所述正向引物和/或所述反向引物通过与载体的连接而固定化。例如,所述正向引物被固定化,所述反向引物未被固定化,或反之亦然。一种示例性的组合物包含下述的任意一个或多个:(1)反向核酸链,(2)固定化在载体上的多个低熔点正向引物,(3)在溶液中的多个低熔点反向引物,和(4)聚合酶。任选地,所述组合物另外包含一个或多个比未延伸的正向引物更长的延伸的正向链,且任选地是一个或多个反向链的全长互补物。在一个实施方案中,一个或多个延伸的正向链与互补的反向链杂交,其中所述反向链任选地也与另一个不同的正向引物杂交或与不同的正向链杂交。所述不同的正向链任选地是反向链的低于全长的互补物。所述组合物可以含有本文所述的任意一种或多种试剂,和/或遭受本文所述的任意一个或多个操作或条件(例如,温度)。任选地,所述组合物包含多个在空间上隔开的克隆群体,所述克隆群体与一个或多个固体载体连接。例如,多个在空间上隔开的克隆群体与同一载体连接。所述组合物任选地不含非聚合酶的其它酶,例如,重组酶或逆转录酶或解螺旋酶或切口酶。任选地,所述组合物包含可通过本文所述的任意一种或多种方法生产的核酸的集合。例如,所述集合可以包含固定化的核酸,所述核酸占据表面上的一个或多个分离的区域,每个区域包含多个相同的核酸链和任选地的多个与其杂交的相同互补链,其中互补链除了借助于与固定化的核酸杂交以外没有与固体载体附着或连接或结合。任选地,在这样的区域内的各个核酸链的定位使得,另一个核酸链在表面上位于该链的长度距离内。任选地,在每平方毫米的固定核酸的表面上,存在至少一个分离的区域。例如,在每平方毫米的固定核酸的表面上的分离的区域的数目大于102、大于103、大于104、大于105、大于106、大于107、或大于108。扩增的克隆群体的集合可以形成阵列,所述阵列可以是一维的(例如,通常单克隆的微米珠的队列)、或二维的(例如,扩增的克隆群体位于平面载体上)、或三维的。阵列的各个克隆群体任选地、但不一定定位或排列成使得它们被访问或是可访问的。任选地,不同的克隆群体彼此隔开适当的距离,所述距离通常足以允许不同的克隆群体彼此区分开。在一个实施方案中,局部化克隆群体以有序或无序(例如,随机)图样散布在平面衬底上。示例性的阵列的部件是核酸的各个可辨别的克隆群体,其中任选地,所述部件分布在一个或多个载体上。在一个示例性的微米珠实施方案中,阵列包含多个微米珠,其中各个微米珠通常包含核酸的单克隆群体,且不同的微米珠通常包含不同的克隆群体(例如,其存在序列差异)。任选地,所述微米珠分布或包装在平面衬底上的单层内。在其它实施方案中,所述阵列包含单一(例如,平面)载体,所述单一载体包含多个空间上离散的核酸克隆群体,其中不同的克隆群体任选地存在序列差异。任选地,在各个克隆群体内的一个或多个核酸可以直接连接至平面衬底。在另一个实施例中,各个克隆群体的核酸连接至微米珠,例如如本文所讨论的。所述克隆微米珠任选地以随机或有序方式接近地一起包装在平面衬底上面。任选地,超过20%、30%、50%、70%、80%、90%、95%或99%的微米珠与至少1、2、4或6个其它微米珠接触。任选地,小于10%、20%、30%、50%、70%、80%、90%、95%或99%的微米珠与1、2、4或6个其它微米珠接触。任选地,在阵列上的部件(诸如固定化位点或扩增的DNA克隆群体)通常是彼此离散的或分离的。例如,50%、70%、80%或90%或更多的阵列部件与相同阵列上的其它部件没有接触或没有完全重叠,或者可使用选择的检测方法彼此辨别开。任选地,所述部件可以彼此部分地重叠,只要它们保持彼此可辨别。本文还提供了试剂盒,其包含本文所述的任意一种或多种试剂(例如,核酸或酶或载体)。例如,试剂盒可以含有一种或多种引物,所述引物任选地被固定化。一个示例性的试剂盒包含2种引物,其中一种引物的变性温度任选地偏离另一种引物至少10、20、30或40℃。任选地,低熔点引物包含腺嘌呤/胸腺嘧啶/尿嘧啶富集的部分,诸如聚腺苷酸束酶,诸如本文描述的那些,例如,长度为至少10、15、20、25或30个核苷酸的聚腺苷酸、聚胸苷酸或聚尿苷酸序列。低熔点引物任选地被固定化,其中高熔点引物任选地未固定化。任选地,所述试剂盒另外含有一种或多种本文所述的载体,所述载体包含固定化的引物。一种示例性的载体包含平面表面。在使用多个载体的情况下,所述试剂盒可以包含承载相同引物的微米珠。所述试剂盒任选地含有一种或多种聚合酶,例如,链置换聚合酶和/或本文所述的扩增试剂的任意组合。所述试剂盒还可以包含关于稀释要扩增的模板的最初群体的说明书和/或稀释介质。III.用途从本文所述的方法制备的扩增的和/或固定化的核酸分子可以用于许多不同的用途,包括测序、筛选、诊断、原位核酸合成、监测基因表达、核酸指纹法、法医学、诊断等。本文所述的任意方法或多个核酸可以用于提供序列分析所用的核酸分子。例如,通过本文所述的任意方法生产的一种或多种核酸分子(例如,扩增子)可以与至少一种测序分析引物和/或至少一种探针接触。任选地,至少一种测序分析引物是或包含寡核苷酸。在一个实施方案中,至少一种探针包含一个或多个核苷酸或一个或多个寡核苷酸。用作序列分析引物或探针的寡核苷酸例如可以与至少一个固定化引物的至少一个相同序列杂交,例如,所述寡核苷酸任选地具有与固定化引物相同的序列。在一个实施方案中,如下进行序列分析:使一个或多个要分析的靶核酸分子与一个或多个序列分析引物和/或探针接触,除去任何未杂交的探针,并测定连接的探针的标记。在另一个实施方案中,如下进行序列分析:使一个或多个要分析的靶核酸分子与一个或多个序列分析引物和/或探针接触,并检测至少一个靶核酸和至少一个标记的序列分析引物和/或探针之间的任何杂交。在一个实施方案中,所述序列分析方法包括:通过使任意邻近杂交的寡核苷酸探针与序列分析引物连接,延伸一个或多个与靶核酸分子杂交的序列分析引物,除去任何未连接的探针,并测定连接的探针的标记。在另一个实施方案中,如下进行序列分析:使一个或多个要分析的靶核酸分子与一个或多个序列分析引物和标记的核苷酸探针和模板依赖性的聚合酶接触,允许所述聚合酶将标记的核苷酸掺入序列分析引物的聚合酶延伸产物中,除去任何未掺入的核苷酸,并测定掺入的核苷酸的身份。所述核苷酸探针例如被荧光地标记,和/或从它的标记确定掺入的核苷酸的身份。在另一个实施方案中,所述核苷酸探针未被标记,且借助于由掺入产生的副产物来测量核苷酸在聚合酶延伸产物中的存在或掺入。例如,任选地通过测量pH或离子或电流的变化(例如通过使用场效应晶体管),检测核苷酸在延伸产物中的掺入。在本文所述的任何方法中,探针(例如,核苷酸或寡核苷酸)任选地可通过聚合酶或连接酶进一步延伸。可替换地,探针任选地不可通过聚合酶或连接酶延伸。这样的不可延伸的探针任选地在序列分析过程中变得可延伸(例如,在确定它们的身份以后)。任选地,核苷酸探针包括A、G、C、T碱基,其中在探针的查询位置处具有不同碱基的核苷酸探针具有不同的荧光标记。任选地,全部的或少于全部的(例如,至少一个)测序分析引物或测序分析探针包含标记的核苷酸/寡核苷酸。任选地,所述标记的核苷酸/寡核苷酸都具有相同的标记,或者被差别化地标记。在一个实施方案中,所述标记的核苷酸/寡核苷酸被荧光标记。例如,使用标记的和未标记的核苷酸的混合物。任选地,平行地测定多个不同的序列。例如,所述序列分析是存在于至少2个(例如,至少10个、100个、1000个、106个、109个或1012个)不同的分离的区域中的核酸分子的平行序列分析。序列分析技术可以是基于聚合酶的序列分析,例如Sanger序列分析。序列分析技术的例子包括通过合成的序列分析,或使用可逆终止子的序列分析,或基于连接的序列分析,例如,使用SOLiD的双碱基编码。还提供了用于执行本文所述的任意方法的仪器,所述仪器包括本文提及的任意一种或多种试剂或装置。例如,所述仪器可以包括一种或多种载体,每种载体包含多个固定化的引物(其任选地是相同的)。例如,所述仪器可以包括核酸聚合酶或连接酶和/或多个核苷酸(任选地经过标记)以及用于部分地分离退火的核酸链的装置。用于分离退火的核酸链的示例性装置包括受控的加热装置,例如,可以使试剂维持在恒定温度的加热装置。所述仪器任选地包括本文所述的一种或多种反应物的来源和用于检测一个或多个信号的检测器装置,所述信号在将所述反应物中的一种或多种施加于所述核酸分子以后产生。用于检测的装置任选地具有足以区分载体的分离的固定化位点或者区分多个载体(如果是微米珠的形式)的分辨率。任选地,所述仪器包括这样的载体:其具有固定化在平面表面上的引物。在一个实施方案中,所述仪器包括电荷耦合器件(CCD),所述CCD任选地与成像装置可操作地连接。在一个实施方案中,每个固定化位点是单独的珠子,且其中每个珠子在扩增以后包含扩增子的克隆群体。任选地,每个珠子可以在扩增之前、过程中或之后分布在阵列中或表面上。所述阵列例如是任意孔阵列,其中承载扩增子的珠子单个地分布在单独的孔中。任选地,所述阵列是大规模FET阵列。任选地,通过本文中的任意方法制备的至少一些克隆群体在检测或分析(例如,通过光学或电化学检测)时显得彼此离散,和/或在空间上分离。在通过H+离子的产生来检测核苷酸掺入的一个实施方案中,这样的离子可以在缓冲溶液中仅仅扩散短距离,例如<100nm。这种有限的扩散能力会确保在一个克隆群体中产生的H+通常不会干扰附近的克隆群体,且仅仅可被直接在克隆群体下面的传感器明显检测到。下述实施例纯粹为了例证目的而提供,且无意限制本公开内容或权利要求的范围。实施例实施例1使5’-双生物素标记的寡(dT)35与DynaBeadsMyOne抗生蛋白链菌素C1磁珠结合。在杂交缓冲液中混合8000万寡(dT)35-结合的珠子和800ulDNA模板(0.01pg/ul)。DNA模板序列如下:TTTTTTTTTTTTTTTTTTTTCCACTACGCCTCCGCTTTCCTCTCTATGGGCAGTCGGTGATTCGTGGAAGACGGGGGCAGTCTATACCCCTGTGGCGACCACTGCGCGGTGGTTTGCTAGGAGAGAATGAGGAACCCGGGGCAG。执行下述扩增方案,以使DNA模板与珠子杂交:95℃2min,50℃1min,40℃1min,30℃1min,25℃2min。用洗涤缓冲液洗涤珠子,并用Exo-Klenow如下延伸引物:向洗过的珠子添加10xNEB缓冲液2(40ul)、25mMdNTP(4ul)、4ulExo-Klenow(40u/ul)和352ul水,并在室温温育10分钟。再次洗涤珠子,并如下进行模板-步移反应。首先,制备下述反应混合物:500万珠子10xThermoPol缓冲液10ul25mMdNTP1ulP2引物(CTGCCCCGGGTTCCTCATTCT)50uM2ul100xBSA10ulBstDNA聚合酶大片段8u/ul10ulH2O67ul将该反应混合物在摇动下在60℃温育45分钟和90分钟。洗涤珠子,并使用下述反应物,用TaqManqPCR定量在珠子上扩增的DNA:TaqMan正向引物:AGTCGGTGATTCGTGGAAGACTaqMan反向引物:CTCATTCTCTCCTAGCAAACCACTaqMan探针:Fam-CCCCTGTGGCGACCAC-NFQ计算在模板步移反应之前和之后的扩增倍数,并相对于反应时间绘图。在30分钟或之前,观察到足够用于检测目的的扩增。实施例2使用下述模板,如实施例1所述进行模板与珠子的结合:TTTTTTTTTTTTTTTTTTTTCCACTACGCCTCCGCTTTCCTCTCTATGGGCAGTCGGTGATTCGTGGAAGACGGGGGCAGTCTATACCCCTGTGGCGACCACTGCGCGGTGGTTTGCTAGGAGAGAATGAGGAACCCGGGGCAG如实施例1所述进行模板-步移反应,例外是,将5ul1uMP2引物(CTGCCCCGGGTTCCTCATTCT)和5ul8u/ulBstDNA聚合酶大片段加入反应物中,并在摇动下在一定温度范围(具体地,46℃、51℃、58℃、60℃、63℃、65℃)温育珠子45分钟。使用下述试剂,用在实施例1中所述的TaqManqPCR扩增珠子上的DNA模板:TaqMan正向引物:AGTCGGTGATTCGTGGAAGACTaqMan反向引物:CTCATTCTCTCCTAGCAAACCACTaqMan探针:Fam-CCCCTGTGGCGACCAC-NFQ计算在模板步移反应之前和之后的δCt,并相对于反应温度绘图,如图5所示。该图显示了温度对模板步移反应的影响。实施例3如在实施例1中所述制备寡(dT)35珠子,并将8000万寡(dT)35-结合的珠子与800ul2种DNA模板(以等摩尔比)的混合物(在0.04pg/ul)一起在杂交缓冲液中温育。DNA模板序列如下。DNA模板1:TTTTTTTTTTTTTTTTTTTTCCACTACGCCTCCGCTTTCCTCTCTATGGGCAGTCGGTGATTCGTGGAAGACGGGGGCAGTCTATACCCCTGTGGCGACCACTGCGCGGTGGTTTGCTAGGAGAGAATGAGGAACCCGGGGCAGDNA模板2:TTTTTTTTTTTTTTTTTTTTCCACTACGCCTCCGCTTTCCTCTCTATGGGCAGTCGGTGATGAAACAGTTGATCATGGACAACCATATTCTGCTGTACGGCCAAGGCGGATGTACGGTACAGCAGATACTAAGATGATGAAGAGAATGAGGAACCCGGGGCAG如在实施例1中所述,进行模板与珠子的结合和模板-步移,例外是,加入20ul8u/ulBstDNA聚合酶大片段,并将珠子在摇动下在60℃温育45分钟。洗涤珠子,并在96-孔qPCR板中稀释至大约5个珠子/孔。用下述引物和探针进行96个双链体TaqManqPCR反应。TaqMan正向引物1:AGTCGGTGATTCGTGGAAGACTaqMan反向引物1:CTCATTCTCTCCTAGCAAACCACTaqMan探针1:Vic-CCCCTGTGGCGACCAC-NFQTaqMan正向引物2:GAAACAGTTGATCATGGACAACCATTaqMan反向引物2:TCATCTTAGTATCTGCTGTACCGTACATTaqMan探针2:Fam-CCGCCTTGGCCGTACAG-NFQ图6显示了96个双链体TaqManqPCR反应的Ct值。下表1总结了Ct值。珠子群体的实验百分比与基于单克隆扩增模型和泊松分布计算的概率相一致。表196孔100拷贝截止值阳性计数百分比(%)概率(%)FAMCt<377.00Vica<348.00FAMCt<37且VicCt<341.00空孔或珠子81.0084.3884.98单模板珠子14.0014.5814.41FAM和Vic1.001.040.61实施例4如在实施例1中所述制备珠子,但是使用5’-双生物素标记的寡(dA)35替代寡(dT)35作为珠子-固定化的引物。如在实施例1中所述,使下述DNA模板与制备的珠子结合:AAAAAAAAAAAAAAAAAAAACCACTACGCCTCCGCTTTCCTCTCTATGGGCAGTCGGTGATTCGTGGAAGACGGGGGCAGTCTATACCCCTGTGGCGACCACTGCGCGGTGGTTTGCTAGGAGAGAATGAGGAACCCGGGGCAG引物未用Exo-Klenow延伸。如在实施例1所述进行模板步移,例外是,加入20ul120u/ulBstDNA聚合酶大片段,并将珠子在37℃温育3分钟,然后在摇动下在60℃温育45分钟和90分钟。使用TaqManqPCR和下述试剂,定量在珠子上的扩增的DNA:TaqMan正向引物:AGTCGGTGATTCGTGGAAGACTaqMan反向引物:CTCATTCTCTCCTAGCAAACCACTaqMan探针:Fam-CCCCTGTGGCGACCAC-NFQ计算在模板步移反应之前和之后的扩增倍数,并相对于反应时间绘图,如图7所示。在90分钟的模板步移反应以后,在珠子上的DNA模板扩增了约100,000倍。实施例5使5’-双生物素标记的寡(dA)35与DynaBeadsMyOne抗生蛋白链菌素C1磁珠结合。将8000万寡(dA)35-结合的珠子与800ul大肠杆菌DH10B基因组DNA片段文库(在0.1pg/ul)一起在杂交缓冲液中混合。将杂交缓冲液用作阴性对照。DH10B片段文库具有下述结构。AAAAAAAAAAAAAAAAAAAA---P1接头---150bp至200bpDH10B基因组DNA片段---P2接头在热循环仪上运行下述程序,以使DNA模板与珠子杂交:95℃2min,50℃1min,40℃1min,30℃1min,25℃2min。洗涤珠子,并如下进行模板步移反应:500万带有杂交的DH10B文库的珠子,或阴性对照珠子10xThermoPol缓冲液10ul25mMdNTP1ulP2引物(CTGCCCCGGGTTCCTCATTCT)50uM2ul100xBSA10ulBstDNA聚合酶大片段120u/ul10ulH2O67ul将珠子在37℃温育3分钟,然后在摇动下在60℃温育45分钟。然后洗涤珠子,并如下用荧光标记染色:与靶向DH10B片段文库中的P1接头序列的cy5标记的寡核苷酸杂交。将染色的珠子放在显微镜载玻片上,并在荧光显微镜上成像。珠子的白光图像和珠子的cy5荧光图像的移位叠加揭示,珠子的白光图像为黑色点,cy5-标记的珠子为红色点。观察到约15%的珠子被cy5阳性染色,剩余的珠子是阴性的。如下进行模板步移的另一个示例性方案:杂交和引物延伸:在1xNEBBuffer2中稀释模板至100pM的终浓度。将模板在95℃加热3min,然后保持在冰上。如下制备杂交/反应混合物:将10μl反应混合物加入StarLight流动池的选定泳道中,并将流动池在37℃温育20分钟。用1ml1xTMAX缓冲液洗涤每个泳道2次。模板步移:如下制备步移反应混合物:将10μl反应混合物加入每个泳道中,并将流动池在60℃温育20分钟。用1ml1xTMAX缓冲液洗涤每个泳道2次,并根据需要对核酸进行分析。实施例6本实施例描述了在基质形式的载体上的核酸克隆扩增,随后使用IonTorrentPGMTM测序仪对得到的扩增的群体进行测序,所述测序仪是基于离子的测序系统,其使用化学敏感的场效应晶体管(chemFET)检测核苷酸掺入的副产物。示例性的实施方案显示在图3中。在一个实施方案中,模板步移的至少一种引物被固定化在单个孔的表面例如,底壁)上,其中单个孔与对应的晶体管可操作地连接。模板制备:如在LifeTechnologiesSOLiD4.0用户手册(UserManual)中所述,制备文库。简而言之,使用CovarisS2系统,剪切分离自大肠杆菌菌株DH10B的2ug基因组DNA。对剪切的DNA进行末端修复,并用SOLiDLibraryColumnPurificationKit进行纯化。根据在SOLiDTM4System(AppliedBiosystems,LifeTechnologies)的用户手册的附录C中的操作,通过使单链的互补寡核苷酸IONAdaptorOligo1和IONAdaptorOligo1’彼此杂交,制备双链接头(“IONAdaptor1”)。IONAdaptorOligo1包括30聚体长(即,30个核苷酸长度)的引发序列,且IONAdaptorOligo1’包括在5’末端的该30聚体引发序列的互补物以及在3’末端的额外2个胸苷残基(“TT”)。IONAdaptorOligo1与IONAdaptorOligo1’的杂交会形成双链接头“IonAdaptor1”,后者包括30-聚体双链引发序列,且具有一个平端和一个“粘性”末端,所述“粘性”末端包括2个额外T残基的3’突出端。在如下所述的PCR步骤中使用第三引物,即IONAdaptorAPCR引物,它仅含有IONAdaptorOligo1的前20个核苷酸。类似地,使用SOLiD4.0用户手册的附录C中的操作,通过使互补的单链寡核苷酸IonT-TailedAdapterOligo2和IonA-TailedAdapterOligo2’杂交,制备第二双链接头(“IONAdaptor2”)。IONT-tailedAdaptorOligo2的长度是52聚体,且包括在5’末端的30个核苷酸的引发序列,继之以在3’末端处的22个胸苷(“T”)残基段。IONA-tailedAdaptorOligo2’的长度是50聚体,且包括在5’末端的20个腺嘌呤(“A”)残基段,继之以与IONT-tailedAdaptorOligo2的引发序列互补的30-核苷酸段。IONT-tailedAdaptorOligo2与IONA-tailedAdaptorOligo2’的杂交会形成双链接头“IonAdaptor2”,其包括30聚体双链引发序列(其侧接20聚体聚腺苷酸/聚胸苷酸双链体),且具有一个平端和一个“粘性”末端,所述“粘性”末端包括2个额外T残基的3’突出端。将双链接头IONAdaptor1和IonAdaptor2连接至末端修复的DNA。对连接产物进行大小选择,并使用下述引物进行8个扩增循环:IONAdaptorAPCR引物(其仅含有IONAdaptorOligo1的前20个核苷酸)和IONT-tailedAdaptorOligo2。对扩增的反应产物进行大小选择,得到最终的改造的双链DNA文库,其具有209bp的中间大小。核酸的等温扩增:将如上所述得到的改造的双链文库与聚合物基质混合,所述聚合物基质包括30聚体聚腺苷酸引物(这些基质在本文中被称作“SNAPP”,其代表支架化的核酸聚合物颗粒(ScaffoldedNucleicAcidPolymerParticles),并且基本上如在Hinz等人的美国专利公开号20100304982中所述制备)。使模板与颗粒对合:使双链文库与SNAPP颗粒对合。简而言之,将1000万个SNAPP在缓冲液中洗涤2次(每次洗涤如下进行:用吸管上下抽吸以再悬浮SNAPP,然后通过离心将SNAPP沉淀)。在缓冲液中稀释dsDNA接头连接的且经过大小选择的文库,使得文库以每个SNAPP1个双链模板分子的平均比例加入,总体积为100ul。通过运行下述热循环程序,使模板文库与SNAPP杂交:95℃保持3分钟50℃保持1分钟40℃保持1分钟30℃保持1分钟25℃保持2分钟将模板对合的SNAPP在缓冲液中洗涤2次。等温模板扩增反应和加工:将对合的和洗过的SNAPP再悬浮于下述扩增反应混合物中:1XPhi29DNA聚合酶反应缓冲液、0.1mg/mLBSA、1uMIONAdaptorAPCR引物、1mM等摩尔dNTP混合物和100UPhi29酶(NEB#M0269L)然后在1000RPM摇动下,如下在恒温混合器中温育包括SNAPP的扩增反应混合物:30℃保持6小时65℃保持30分钟使SNAPPS沉淀,并在LifeTEXBuffer中洗涤2次。然后使在SNAPP上的双链的扩增的DNA变性,如下除去没有与SNAPP共价连接的互补链:在IONDenaturingSolution(125mMNaOH,0.1%Tween-20)中进行2次洗涤,每次洗涤在室温温育5分钟。然后将SNAPPS在LifeTEXBuffer(10mMTris,1mMEDTA,0.01%TritonX-100)中洗涤2次。然后如下所述,使用IonTorrentPGMTM测序仪,对SNAPP进行基于离子的测序反应:使用IONTORRENTPGMTM测序仪的测序将包括扩增的DNA的SNAPP在退火缓冲液(AnnealingBuffer)中洗涤2次,所述AnnealingBuffer包括含有0.2%Tween-20的pH7.2的Gibco牌PBS(1.54mM磷酸二氢钾、155.17mM氯化钠、2.71mM磷酸氢二钠)。将5ulION测序引物(部件编号602-1021-03,在核苷酸、酶和对照试剂盒(Nucleotides,EnzymeandControlsKit)中提供,部件编号4462916,来自IonPGMTM314测序试剂盒(SequencingKit),部件编号4462909;IonTorrentSystems,它是LifeTechnologiesCorp.,Carlsbad,CA的子公司)加入洗涤过的SNAPP,并如下在热循环仪中杂交:95℃保持2分钟37℃保持2分钟将对合的SNAPP在退火缓冲液(AnnealingBuffer)中洗涤2次,在最后一次洗涤后,在SNAPP沉淀物上剩余大约7ul缓冲液。将1ul离子测序聚合酶(IonSequencingPolymerase)(部件编号602-1023-01,在核苷酸、酶和对照试剂盒(Nucleotides,EnzymeandControlsKit)中提供,部件编号4462916,来自IonPGMTM314测序试剂盒(SequencingKit),部件编号4462909;IonTorrentSystems,它是LifeTechnologiesCorp.,Carlsbad,CA的子公司)加入SNAPP中,并将混合物在室温温育5分钟。将SNAPP在水浴中轻柔地声处理10秒,以分散任何团块。加入2ul50%甘油(在退火缓冲液中稀释),并将样品装载上IonTorrentPGMTM314测序芯片,该芯片得自IonSequencing314Kit(部件编号4462909,IonTorrentSystems,LifeTechnologies)。简而言之,通过加入50ul退火缓冲液(部件编号603-1047-01,被包括在PGMReagentsKit中,部件编号4465455,IonTorrentSystems)来引发芯片。将10ul样品注射进芯片的端口中,然后将芯片离心10分钟。使用标准的核苷酸流动次序,进行PGMTM测序运行55个循环。使用该方法,制备了共21个具有最低Q17质量(允许至多2%误差)的队列,其代表DH10b序列的1391个映射碱基。在这些测序读出中包括18个满足Q20质量标准(仅允许1%误差)的队列,其代表956个映射碱基。得到的最长队列是109个具有Q20质量(1%误差,在该情况下,1个碱基错配)的碱基。最长的完美映射的读出(即无误差读出)是95个碱基长度。实施例7:“双”步移在该实施例中,正向引物和反向引物均具有可呼吸的PBS,所述PBS易于在等温的选择的扩增条件下局部变性。因此,每个PBS具有与新的未延伸的引物重新结合的对应趋势。将正向引物固定化在载体上,因此,正向PBS在从第一正向引物离解后可以与靠近所述第一正向引物固定化的第二不同正向引物重新杂交。类似地,反向PBS倾向于从第一可溶性的反向引物离解,并与第二可溶性的反向引物重新杂交,后者然后延伸。进行下述扩增反应:杂交:在1XSSPEt缓冲液中为100pM总浓度的模板,通过加热(95℃保持3分钟)预变性,并保持在冰上。将12ul加入每个泳道中。使混合物在75℃保持2min、在50℃保持1min、在40℃保持1min、在30℃保持1min、在25℃保持2分钟。用0.1XSSPEt(2x1ml)洗涤泳道。引物延伸:制备下述主混合物:5μl10XNEBBuffer2;0.5μl100mMdNTP;1μlKlenow(NEB5u/ul,M0212L);43.5μldH2O(共50μl)。将12uL反应混合物加入所有泳道中,并在37℃温育30min。用2xSSC+0.1%SDS、1XTMAX(1ml)洗涤泳道,并与1XNEBThermoPol缓冲液一起在60℃温育40min,用2xSSC+0.1%SDS、1XTMAX(1ml)再次洗涤。模板步移:制备下述主混合物:10μl10XNEBThermoPolBuffer;2μl100mMdNTP;50μl可溶性的引物PE;40μlBst(NEB120u/ul);47μldH2O(共100μl)。将12μL主混合物加入所有泳道中,并在60℃温育30min。取出12μl上清液,并1:100稀释,将5μl用于Taqman测定。用2xSSC+0.1%SDS、1XTMAX(1ml)洗涤泳道。在HiDi洗涤(2X12uL,5min)中,用1XTMAX(2x1ml)洗涤泳道。就TaqMan反应而言,用下述物质制备反应混合物:10μlTaqManFastUniversalMasterMix,NoUNG;1μl20x引物探针混合物;4μlH2O;5μl储备溶液(共:20μl)。使混合物处于95℃(20秒)和40个热循环(95℃3秒,60℃30秒),然后收集数据。使用2种可呼吸的引物(固定化的“正向”引物和可溶性的远端“反向”引物,在下表2中称作Pe或Pd)的扩增比使用单独一种可呼吸的引物的扩增更有效。表2本领域技术人员会认识到或仅仅使用例行实验就能够确定许多与本文所述的本发明的具体实施方案等效的方案。本发明的范围无意限于上面的描述。除非另外从上下文中会明白,否则任何特征可以与任意其它特征相组合地进行声明,或者声明为不存在与其它特征的组合。特征可以是可表征发明或可限制权利要求的范围的任意信息片段,例如任意变化、步骤、部件、性质、组合物、方法、步骤、程度、水平、组分、材料、物质、元件、模式、变量、方面、度量、量、选项、实施方案、条款、描述术语、权利要求要素或限制。通常,本文描述的特征意图是任选的,除非在说明书中明确地指示是必要的。指示某个特征在说明书中被视作任选的语言的非限制性例子包括术语诸如“变化”、“其中”、“而”、“当……时”、“任选地”、“包括”、“优选的”、“特别的”、“推荐的”、“建议的”、“特定的”、“应当”、“替代性的”、“典型的”、“代表性的”、“不同的”、“例如”、“等”、“可以”、“可能”、“实施例”、“实施方案”或“方面”、“在某些”、“实施例”、“示例性的”、“例子”、“如果”或这类术语的任意组合和/或变化。某个特征是任选的任何指示意图为包含与所述任选特征有关的封闭或排除性或否定性语言的权利要求提供充分的支持(例如,根据美国法典第35篇第112条或欧洲专利法第83和84条)。排除性语言明确地排除了所描述的特定特征包括任何额外主题。例如,如果指示A可以是药物X,这样的语言意图为明确指定A仅由X组成、或A不包含除X外的任何其它药物的权利要求提供支持。“否定性”语言明确地将任选特征本身排除于权利要求的范围之外。例如,如果指示要素A可以包括X,这样的语言意图为明确指定A不包含X的权利要求提供支持。排除性或否定性术语的非限制性例子包括“仅仅”、“单独地”、“由……组成”、“基本上由……组成”、“单独”、“无”、“在没有(例如,相同类型、结构和/或功能的其它项目)存在下”、“排除”、“不包括”、“不”、“不会”、“不可”或这类语言的任何组合和/或变化。类似地,除非上下文另外指示,否则诸如“一个”、“一种”、“所述”或“该”这样的指示词(referent)意图支持单数和/或复数对象。例如,“一条狗”意图包括对于一条狗、不超过一条狗、至少一条狗,多条狗等等的支持。指示单数的定性术语的非限制性例子包括“单一”、“一”、“单独”、“仅仅一个(种)”、“不超过一个(种)”等等。指示(可能的或实际的)复数的定性术语的非限制性例子包括“至少一个(种)”、“一个(种)或多个(种)”、“超过一个(种)”、“二个(种)或更多个(种)”、“多元(multiplicity)”、“多个”、“……的任何组合”、“……的任何变换”、“……中的任何一个(种)或多个(种)”等等。如果群体成员中的一个、超过一个或所有成员存在于指定的产品或过程中、在指定的产品或过程中使用、或以其它方式与指定的产品或过程相关,那么在群体的一个或多个成员之间包含“或”的权利要求或描述被认为是得到满足的,除非指示相反情形或以其它方式从上下文显而易见。此外,应当理解,本发明包括本文所述的任意一个或多个特征的所有变化、组合和变换。可以从权利要求中明确地排除任意一个或多个特征,即使具体排除未在本文中予以明确阐述。还应当理解,用于方法中的试剂的公开意图与根据本文公开的具体方法或本领域已知的其它方法使用该试剂的方法同义(并为其提供支持),除非本领域普通技术人员有不同的理解。另外,在说明书和/或权利要求公开方法的情况下,本文公开的任意一种或多种试剂可以用于该方法中,除非本领域普通技术人员有不同的理解。在本说明书中所引用的所有出版物和专利均通过引用并入本文,如同明确地且单独地指出每篇单独的出版物或专利通过引用并入。通过GID或登录号提及的Genbank记录,特别是任何多肽序列、多核苷酸序列或其注解,通过引用并入本文。对任何出版物的引用是针对其在提交日期前的公开内容,并且不应解释为承认由于先前发明而使本发明丧失先于这些出版物的权利。在本文中给出范围的情况下,端点被包含在内。此外,应当理解,除非另外指示或以其它方式从上下文显而易见并且如本领域普通技术人员所理解,以范围表述的数值在本发明的不同实施方案中可呈现处于所述范围内的任何具体数值或子范围,其精确至该范围的下限单位的十分之一,除非上下文另外清楚地指明。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1