一种人补体C1q/TNFα相关蛋白‑2(hCTRP2)的抗原肽及其抗体的制作方法与工艺
一种人补体C1q/TNFα相关蛋白-2(hCTRP2)的抗原肽及其抗体技术领域本发明涉及应用化学合成法合成人补体C1q/TNFα相关蛋白-2的抗原肽,并利用该抗原肽免疫新西兰大白兔,通过制备抗血清、硫酸铵分级沉淀及亲合层析制备了高质量的抗体。具体来说涉及一种人补体C1q/TNFα相关蛋白-2的抗原肽、利用抗原肽制备的抗体及其抗体的制备方法。
背景技术:
补体C1q/TNFα相关蛋白(C1qandtumornecrosisfactorrelatedprotein,CTRP)是一类在结构和功能上与脂联素类似的分泌蛋白。CTRP在多种组织中有着广泛的表达,而脂联素仅在脂肪组织特异表达,CTRP由四个不同结构域组成:一个N-末端的信号肽、一个短的可变结构域、一个胶原结构域和一个与补体蛋白C1q同源的C-末端球形结构域。目前,已成功克隆了13种CTRP的cDNA序列。虽然CTRP在结构上具有相似性,但它们分别参与不同的生理过程,如代谢、炎症反应、宿主防御、凋亡、细胞分化、器官形成、自体免疫和冬眠等。CTRP蛋白都是以三聚体作为分泌的基本结构单元,也可以形成6聚体、12聚体、18聚体以及更高形式的多聚体等;CTRP3、CTRP5、CTRP6和CTRP10的三聚体通过二硫键进一步聚集成更有序的低聚物。CTRP除了形成同源低聚物,还可以作为异源低聚体分泌(如CTRP1/CTRP6、CTRP2/CTRP7和脂联素/CTRP2等)。CTRP2的生物学功能及结构与脂联素最为相似。在C2C12肌管细胞中,CTRP2能够快速激活AMPK、ACC及p44/42MAPK的磷酸化信号通路。全长CTRP2、CTRP2球状结构域(gCTRP2)或者原核表达的脂联素刺激C2C12肌管细胞16h,可以观察到肝糖原的积累量上升了6-8倍,CTRP2也能够显著促进脂肪酸的氧化。Wong等认为,CTRP2可以作为一种潜在的胰岛素增敏剂。CTRP2在人、鼠、大鼠、牛、猪和斑马鱼等物种中都有非常高的保守性。脂联素通过与脂联素膜受体相互作用并由脂联素受体来传递相关信号的,作为一种较脂联素具有更多功能的CTRP蛋白,其作用机理研究还不清楚。首先对与脂联素结构最为类似的CTRP2作用机理、表达分布和生理功能的探索将有助于研究其他CTRP作用机理和生理功能。然而,由于CTRP蛋白之间存在高度同源性,并且CTRP与其它蛋白如脂联素、TNF等蛋白之间也存在同源,找到CTRP2的特异抗原肽片段并制备高度特异性的相应抗体为深入开展CTRP2的作用机理及应用研究奠定坚实基础。
技术实现要素:
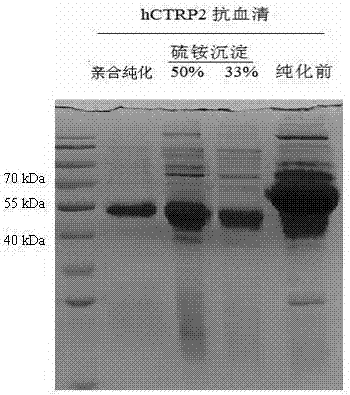
基于此,本发明提供一种人补体C1q/TNFα相关蛋白-2的抗原肽、利用抗原肽制备的抗体及其抗体的制备方法,根据该方法可获得高质量的识别人CTRP2抗体。解决上述问题的技术方案如下:(1)抗原肽的合成:经NCBI数据库比对和抗原肽分析软件的分析结果,设计并合成了hCTRP2的N-端抗原肽59DRGDSGEEGPP69和C-端抗原肽259IYADQDDPNE269各一段,抗原肽分别与KLH和BSA进行化学耦联;(2)免疫新西兰大白兔:将KLH耦联的C-端及N-端抗原肽2毫升(0.5-1.0mg/ml)分别与等体积的弗氏完全佐剂混合到完全乳化,采用皮下注射的方式对新西兰雄性大白兔进行免疫,皮下注射部位主要集中于兔子的颈、脖及背部,共注射15-18个点左右(每个点注射100-200μl乳化抗原)。每只兔子于免疫前从耳静脉取1-2毫升血液,37°C培养箱中温育30min,再置4°C冰箱内过夜,3000g离心15min,取血清并加入终浓度为0.02%叠氮钠,置4°C冰箱中保存备用。初次免疫后的第3周,对各免疫的兔子进行再次免疫,再次免疫采用不完全弗氏佐与抗原肽充分完全乳化(每只兔子使用抗原肽0.5mg);间隔2周后进行第2次免疫加强免疫(每只兔子使用抗原肽0.5mg),第2次加强免疫的方法与第一次加强免疫完全相同,于第2次加强免疫的后的第10天,从免疫兔子的耳静脉采血1-2ml。采血及制备抗血清的方法与免疫前采用的方法完全相同;(3)抗血清效价的测定:将10µg/mlBSA耦联的抗原肽包被96孔酶标板,采用间接ELISA的方法对抗血清的效价进行测定,方法如下:1)包被:用0.05MpH9.6碳酸盐包被缓冲液将抗原稀释至蛋白质浓度为10μg/mL。每个反应孔中加0.1mL,4℃孵育12h。弃去孔内溶液,用洗涤缓冲液(磷酸盐缓冲液加0.5%吐温-20,PBST)洗3次,每次3-5min(简称洗涤,下同);2)封闭:每孔中加0.1mL5%的脱脂奶粉,4℃孵育12h,弃去孔内溶液,用洗涤缓冲液洗3次,每次3min。(同时做空白孔,阴性对照孔及阳性对照孔);3)加一抗:加经一定比例稀释的抗体0.1mL于上述已包被抗原的反应孔中,置4℃孵育12h。然后用洗涤缓冲液洗3次,每次3-5min(同时做空白孔,阴性对照孔及阳性对照孔);4)加酶标二抗:于各反应孔中,加入稀释5,000倍的辣根过氧化物酶标记的山羊抗小鼠IgG酶标二抗0.1mL。37℃孵育1h,洗涤3次,最后一遍用PBS洗涤;5)加底物液显色:于各反应孔中加入0.1mL新配制的显色液,放置于30℃恒温箱中反应30min;6)终止反应:于各反应孔中加入4M硫酸50μl终止反应;7)结果判定:在ELISA检测仪上,于495nm处,测定各孔的OD值,若大于规定的阴性对照OD值的2.1倍,即为阳性。计算公式:(待测样OD-空白OD)/(阴性对照OD-空白OD),两者比值大于2.1可判读为阳性;(4)抗血清的硫酸铵分级纯化:将血清效价高和背景值低的C-端抗原肽免疫所得的抗血清分别利用50%和33%的硫酸铵进行分级沉淀和透析处理,对抗血清按下述方法进行初步的分离纯化。纯化的方法:取效价最高的兔抗血清,加等体积的生理盐水,搅拌并逐滴加入与稀释血清等体积的饱和硫酸铵至终浓度为50%饱和度,4°C静置4h,3000g离心30min,弃上清,以生理盐水溶解沉淀,再逐滴加饱和硫酸铵至饱和度为33%,4°C静置4h。3000g离心30min,弃上清,沉淀溶于生理盐水中。重复用33%饱和度的硫酸铵盐析分级纯化处理一次,将最后离心所得沉淀以20mMPBS(磷酸盐缓冲液液,pH7.4)溶解并于10kD的透析袋中于20mMPBS中透析去除硫酸铵;(5)抗体的亲合纯化:将经溴化氰活化的树脂与耦联有BSA的hCTRP2的C-端抗原肽进行耦联并制备亲合纯化柱,利用10倍柱体积的20mMPBS(pH7.4)缓冲液对亲合纯化柱进行平衡处理。将经透析去除硫酸铵的抗血清加入到亲合纯化柱中,20倍柱床体积的20mMPBS(pH7.4)洗除非特异吸附在树脂上的抗体后,加入3倍亲合树脂柱体积的0.1M甘氨酸-HCl缓冲液(pH2.4),流速1ml/min,收集解吸附下来的成分,立即以1MNaHCO3中和。用20倍柱床体积的20mMPBS(pH7.4)缓冲液对纯化柱再平衡,加入3倍亲合树脂体积的0.05M二乙胺(pH11)缓冲液,流速1ml/min,收集解吸附下来的成分,立即以1MNaHCO3中和。将上述分别利用酸、碱洗脱下来的含纯化抗体的溶液合并,于10kDa的透析袋中于100倍体积的20mMPBS中透析24小时,每8小时更换透析液一次。透析后的抗体利用截留分子量为10kDa的50ml超滤管浓缩10倍。纯化前后的抗体用10%SDS-聚丙烯酰胺凝胶(SDS-PAGE)电泳分析;(6)hCTRP2全长及球状区蛋白的表达载体构建:利用扩增hCTRP2全长基因的引物对5’-GCCTCGAGAAAAGAGACCCACTGCTTGGCGC-3’和5’-GCTCTAGATACCTCGTTGGGGTCATC-3’,扩增出hCTRP2的全长基因片段,利用扩增hCTRP2球状区基因引物对5’-GCGGATCCGTGGCAGTGACCAAGAGCTAC-3’和5’-GCCTCGAGTCAGATTAGGAAGCCCGTAAAG-3’扩增出C-端球状区基因片段;(7)hCTRP2全长及球状区蛋白的表达:挑取数个BL21阳性克隆转化子,划线接种至含70mg/LAmp(氨苄青霉素)的LB平板,37℃培养过夜,再挑取单菌落接种至20mL含70mg/LAmp的LB液体培养基中,37℃,250rpm,摇床振荡培养至OD600=0.6,加入IPTG至终浓度为1mM,将摇床转速调至200rpm,37℃诱导表达,诱导6h,取1mL菌液于1.5mLEP管中,10,000g,离心3min,得菌体,PBS充分重悬菌体,10,000g,离心3min,得菌体,加入80μl裂解缓冲溶液,裂解菌体,再加入20μlSDS-PAGE5×上样缓冲液,振荡混匀,沸水中加热裂解变性10min,14,000g,4℃离心10min,取上层液,利用12%SDS-PAGE对菌体总蛋白进行电泳分离,电泳结束后利用考马斯亮蓝对凝胶进行染色(具体步骤参照精编分子生物学指南),确定hCTRP2全长及球状功能区蛋白的表达情况;(8)抗体特异性分析:将制备好的hCTRP2全长及球状区蛋白表达菌经IPTG诱导后的菌体总蛋白样品点样到12%的SDS-PAGE胶中,对蛋白质进行电泳分离,在电泳结束后,将凝胶从玻璃板上轻轻剥离并转至转移缓冲液中,浸泡40-60min;按转移凝胶的大小裁剪好滤纸和聚偏氟乙烯(PVDF)膜,滤纸各边应比PVDF膜长2mm,PVDF膜的各边应比PAGE胶的各边长2mm;将PVDF膜用100%甲醇浸泡30s,将PVDF膜及滤纸一并浸入转移缓冲液中,平衡15min;将胶、滤纸及PVDF膜取出,尽量避免污染滤纸和膜,按从下到上:滤纸-膜-胶-滤纸的顺序将其依次放好,尽量避免胶与膜之间产生气泡;打开半干转移仪,将滤纸-膜-胶-滤纸放入转移盘中,盖好电源盖子;接通电源,83mm×75mm大小的膜设定电流100mA,电压15V;实际设定中电压15V不变,按60mm2设1mA的初始电流,设定转膜时间为1h;转移完毕后,将PVDF转移至含5%牛血清白蛋白的TBST中,4℃,封闭12h;封闭结束后,加入稀释2万倍的抗体到PVDF膜中,4℃,孵育12h,利用TBST洗膜3次,每次15分钟;将膜转至含有HRP标记的山羊抗兔IgG中,4℃,孵育12h,利用TBST洗膜3次,每次15分钟;将膜置于一小盒中,加入适量的ECL发光液,反应2分钟,将膜置于暗盒中并于暗室下将X-光片压在膜上;将X-光片利用显影液进行显影和定影处理后,于空气中干燥并拍照分析。在其中一些实施例中,步骤(1)所述的抗原肽序列为:hCTRP2的N-端抗原肽是59DRGDSGEEGPP69hCTRP2的C-端抗原肽是259IYADQDDPNE269。根据权利要求1所述的生产方法,其特征在于,步骤(5)所述的扩增hCTRP2全长及C-端球状区的引物分别如下:扩增hCTRP2全长基因的引物对是:上游引物5’-GCCTCGAGAAAAGAGACCCACTGCTTGGCGC-3’和下游引物5’-GCTCTAGATACCTCGTTGGGGTCATC-3’;扩增hCTRP2球状区基因的引物对是:上游引物5’-GCGGATCCGTGGCAGTGACCAAGAGCTAC-3’和下游引物5’-GCCTCGAGTCAGATTAGGAAGCCCGTAAAG-3’。根据权利要求1所述的生产方法,其特征在于,步骤(6)所述的表达菌株为大肠杆菌BL21。根据权利要求1所述的生产方法,其特征在于,以IPTG诱导可以表达hCTRP2全长和C-端球状区蛋白的大肠杆菌表达菌的菌体总蛋白为检测对象,利用Westernblot对纯化的抗体的特异性进行分析,Westernblot结果表明,通过上述方法制备的抗体具有很高的灵敏度和特异性。根据权利要求1-5任一项所述的生产方法制得的抗原肽、抗体、hCTRP2的全长及球状区蛋白。本方法制备的抗体具有灵敏度高和特异性强的优点,抗体在经2万倍的释稀后仍能高效地检测到目标蛋白,但没有检测到目标蛋白外的非特异蛋白条带。利用本方法制备的hCTRP2的抗体完全能够满足检测hCTRP2蛋白的要求。附图说明图1是抗血清效价的测定图;图2是抗体纯化结果的SDS-PAGE分析图;图3是载体构建示意图;图4是hCTRP2全长及球状区蛋白的诱导表达结果分析图;图5是纯化抗体的Westernblot检测结果,此图也是抗体特异性验证的结果图。具体实施方式实施例1本发明选用的大肠杆菌表达菌株BL21、载体扩增菌株TOP10和表达载体pET32均购自于美国Invritrogen公司。所用培养基及主要试剂的配方如下:1)LB液体培养基:NaCl10g,蛋白胨10g,酵母提取物5g,蒸馏水1L,高压灭菌,室温保存;2)LB/Amp平板:NaCl10g,蛋白胨10g,酵母提取物5g,蒸馏水1L,琼脂粉15g,高压灭菌后,冷却至70℃以下,加入0.7mL浓度为100mg/ml的氨苄青霉素(Ampicillin),充分混均后倒板,4℃避光保存;3)50×TAE琼脂糖凝胶电泳缓冲液:Tris碱121g,冰乙酸28.6mL,0.5mol/LEDTA(pH8.0)50mL,加蒸馏水定容至500mL,室温保存;4)100mg/mL氨苄青霉素保存液:氨苄青霉素1g,加蒸馏水溶解并定容至10mL,分装后于-20℃保存;5)5×SDS-PAGE上样缓冲液:1MTris-HCl(pH6.8)1.25mL,SDS0.5g,BPB25mg,甘油2.5mL,加去离子水溶解后定容至5mL,分装(约500μL每份)后于室温保存,使用每份加入25μLβ-巯基乙醇混匀;6)5×SDS-PAGE电泳缓冲液:Tris15.1g,甘氨酸94g,SDS5.0g,加入约800mL去离子水,充分搅拌溶解后定容至1L,室温保存;7)考马斯亮蓝R-250染色液:考马斯亮蓝R-2500.25g,加入225mL甲醇、46mL的冰乙酸、225mL去离子水并搅拌均匀,滤纸去除颗粒物质后,室温保存;8)考马斯亮蓝脱色液:冰乙酸50mL,甲醇150mL,去离子水300mL,充分混合后,室温保存;9)PBS的配制:在800mL蒸馏水中溶解8gNaCL,0.2gKCL,1.44g磷酸氢二钠和0.24g磷酸二氢钾,用盐酸调节溶液的pH值至7.4,加水定容至1L。本实施例所述的一种人补体C1q/TNFα相关蛋白-2(hCTRP2)的抗原肽及其抗体的制备方法,主要包括以下步骤:(1)抗原肽的合成:经NCBI数据库比对和抗原肽分析软件的分析结果,设计并合成了hCTRP2的N-端和C-端抗原肽各一段,合成的抗原肽序列如下:SEQIDNO:5:hCTRP2的N-端抗原肽是59DRGDSGEEGPP69;SEQIDNO:6:hCTRP2的C-端抗原肽是259IYADQDDPNE269。合成的抗原肽分别与KLH和BSA进行化学耦联;(2)免疫新西兰大白兔:将KLH耦联的C-端及N-端抗原肽分别与弗氏完全佐剂混合到完全乳化,采用皮下注射的方式对新西兰雄性大白兔进行初次免疫,初次免疫使用的抗原肽质量在0.5-1.0mg之间,皮下注射部位主要集中于兔子的劲、脖及背部,共注射15-18个点左右,于注射前从耳静脉取1-2毫升血液,37°C培养箱中温育30min,再置4冰箱内过夜,3000g离心15min,取血清并加入终浓度为0.02%叠氮钠,置4冰箱中保存备用。初次免疫后的第2周,对各免疫的兔子进行加强免疫,加强免疫采用不完全弗氏佐与抗原充分完全乳化(每只兔子使用抗原0.5mg);间隔2周后进行第2次加强免疫(每只兔子使用抗原肽0.5mg),第2次加强免疫的方法与第一次加强免疫完全相同,于第2次加强免疫的后的第10天,从耳静脉采血1-2ml。采血及制备抗血清的方法与免疫前采用的采血及抗血清制备的方法完全相同;(3)抗血清效价的测定:将10µg/mlBSA耦联的抗原肽包被96孔酶标板,采用间接ELISA对抗血清的效价进行测定,方法如下:1)包被:用0.05MpH9.6碳酸盐包被缓冲液将抗原稀释至蛋白质浓度为10μg/mL。每个反应孔中加0.1mL,4℃孵育12h。弃去孔内溶液,用洗涤缓冲液(PBST)洗3次,每次3-5min(简称洗涤,下同);2)封闭:每孔中加0.1mL5%的脱脂奶粉,4℃孵育12h,弃去孔内溶液,用洗涤缓冲液洗3次,每次3min。(同时做空白孔,阴性对照孔及阳性对照孔);3)加一抗:加经一定比例稀释的抗体0.1mL于上述已包被抗原的反应孔中,置4℃孵育12h。然后用洗涤缓冲液洗3次,每次3-5min(同时做空白孔,阴性对照孔及阳性对照孔);4)加酶标二抗:于各反应孔中,加入稀释5,000倍的辣根过氧化物酶标记的山羊抗兔IgG酶标二抗0.1mL。37℃孵育1h,洗涤3次,最后一遍用PBS洗涤;5)加底物液显色:于各反应孔中加入0.1mL新配制的显色液,放置于30℃恒温箱中反应30min;6)终止反应:于各反应孔中加入4M硫酸50μl,终止反应;7)结果判定:于495nm处,测定各孔的OD值,若大于规定的阴性对照OD值的2.1倍,即为阳性。计算公式:(待测样OD-空白OD)/(阴性对照OD-空白OD),两者比值大于2.1可判读为阳性。经ELISA检测结果表明,N-端抗原肽免疫兔子所得抗血清的效价高于320,000倍,但N-端抗原肽在稀释较低倍数时表现出了较高的背景值(如图1所示);C-端抗原肽免疫兔子所得的抗血清的效价都高于1,280,000倍,且C-端抗原肽在稀释较低倍数时背景值也非常低(如图1所示);ELISA结果表明,C-端抗原肽较N-端抗原肽具有更高的特异性和免疫原性,利用C-端抗原肽免疫兔子制备的抗血清具有更高的效价和特异性;(4)抗血清的初步纯化:将血清效价高和背景值低的C-端抗原肽免疫所得的抗血清分别利用50%和33%的硫酸铵进行分级沉淀和透析处理,对抗血清进行初步的分离纯化;纯化的方法如下:取效价最高的兔抗血清,加等量生理盐水,搅拌并逐滴加入与稀释血清等量的饱和硫铵至终浓度为50%饱和度,4°C静置4h,3000g离心30min,弃上清,以生理盐水溶解沉淀,再逐滴加饱和硫铵至饱和度为33%,4°C静置4h。3000g离心30min,弃上清,沉淀溶于生理盐水中。重复用33%饱和度的硫铵盐析处理,将最后离心所得沉淀以20mMPBS(pH7.4)溶解并于10kD的透析袋中于20mMPBS中透析去除硫铵;(5)抗体的亲合纯化:将经溴化氰活化的树脂与耦联有BSA的hCTRP2的C-端抗原肽进行耦联并制备亲合纯化柱,利用10倍柱体积的20mMPBS(pH7.4)缓冲液对亲合纯化柱进行平衡处理。将经透析去除硫铵的抗血清加入到亲合纯化柱中,20倍柱床体积的20mMPBS(pH7.4)洗除非特异吸附在树脂上的抗体后,加入3倍亲合树脂体积的0.1M甘氨酸-HCl缓冲液(pH2.4),流速1ml/min,收集解吸附下来的成分,立即以1MNaHCO3中和。用20倍柱床体积的20mMPBS(pH7.4)缓冲液对纯化柱再平衡,加入3倍亲合树脂体积的0.05M二乙胺(pH11)缓冲液,流速1ml/min,收集解吸附下来的成分,立即以1MNaHCO3中和。将上述分别利用酸、碱洗脱下来的含纯化抗体的溶液合并,于10kDa的透析袋中于100倍体积的20mMPBS中透析24小时,每8小时更换透析液一次。透析后的抗体利用截留分子量为10kDa50ml超滤管浓缩10倍。SDS-PAGE对纯化前后的抗体进行电泳分析,电泳结果表明,经硫铵分级沉淀后,可以除去抗体中的部分非免疫球蛋白成分,但仍有一些杂蛋白的存在,而在经亲合层析后,在SDS-PAGE结果中几乎检测不到分子量在50kDa外的非免疫球蛋白成分(结果如图2所示);(6)hCTRP2全长及球状区蛋白的表达载体的构建:利用扩增hCTRP2全长基因的引物对:SEQIDNO:1:5’-GCCTCGAGAAAAGAGACCCACTGCTTGGCGC-3’;和SEQIDNO:2:5’-GCTCTAGATACCTCGTTGGGGTCATC-3’。扩增出hCTRP2的全长基因片段利用扩增hCTRP2球状区基因的引物对:SEQIDNO:3:5’-GCGGATCCGTGGCAGTGACCAAGAGCTAC-3’;和SEQIDNO:4:5’-GCCTCGAGTCAGATTAGGAAGCCCGTAAAG-3’。扩增出C-端球状区基因片段;①用BamHI和XhoI双酶切PCR产物经电泳后切胶回收目标片段,获得目的片断hCTRP2的全长及球状区DNA片段,反应体系如下(所用内切酶及缓冲液均购自大连TAKARA公司):PCR产物15μL10×K缓冲液5μLXhoI5UBamH5U无菌水至50μL②用BamHI和XhoI双酶切pET32,获得载体片断,反应体系如下(所用内切酶及缓冲液均购自大连TAKARA公司):质粒pET3215μL10×K缓冲液5μLXhoI5UBamH5U无菌水至50μL③由①及②步后所得目的片断和载体片断,DNA凝胶收回试剂盒回收,该试剂盒购自大连TAKARA公司,具体操作按试剂盒说明书进行;表达载体的构建示意图见图3所示。④回收得到的目的片断和载体用T4DNA连接酶(购自大连TAKARA公司)进行连接反应,反应体系如下:质粒pET32片段1μL目的片段落3μL10×缓冲液1μLT4DNA连接酶0.5μL无菌水至10μL连接产物转化大肠杆菌TOP10菌株,涂布LB氨苄平板,挑取平板上生长的转化子,于LB氨苄液体培养基中扩大培养后提取质粒,对质粒进行酶切和测序验证,得重组表达载体pET32/hCTRP2和pET32/ghCTRP2。将重组表达载体pET32/hCTRP2和pET32/ghCTRP2。分别热激转化大肠杆菌BL21感受态细胞,涂板,37℃恒温培养箱中培养12小时,于LBAmp抗性平板筛选得到重组载体的BL21转化子。(7)hCTRP2全长及球状区蛋白的表达:挑取数个BL21转化子,划线接种至含70mg/LAmp的LB平板,37℃培养过夜,再挑取单菌落接种至20mL含70mg/LAmp的LB液体培养基中,37℃,250rpm,摇床振荡培养至OD600=0.6;加入IPTG至终浓度为1mM,将摇床转速调至200rpm,37℃诱导表达,诱导6h;取1mL菌液于1.5mLEP管中,10,000g,离心3min,得菌体;PBS充分重悬菌体,加入20μlSDS-PAGE5×上样缓冲液,振荡混匀,沸水中加热裂解变性10min,14,000g,4℃离心10min,取上清液;利用12%SDS-PAGE对蛋白质进行电泳分离,电泳结束后,利考马斯亮蓝对凝胶进行染色(具体步骤参照精编分子生物学指南),确定hCTRP2全长及球状功能区蛋白的表达;hCTRP2蛋白理论分子量约为30kDa,其N端融合了Trx片段,Trx的理论分子量约为20kDa,hCTRP2与Trx融合蛋白的表达产物理论分子量大小约50kDa(目标蛋白质的分子量在45-55kDa之间),SDS-PAGE结果表明,IPTG诱导1小时,Trx-hCTRP2已经大量表达,当诱导表达的时间超过2小时,Trx-hCTRP2蛋白的表达不再显著增加(结果如图4左侧部分所示)。hCTRP2球状区蛋白的理论分子量约为15kDa,其N端融合了Trx片段,Trx的理论分子量约为20kDa,hCTRP2与Trx融合蛋白的表达产物理论分子量大小约35kDa,SDS-PAGE结果表明,IPTG诱导1小时,Trx-ghCTRP2开始大量表达(结果如图4右侧部分所示)。(8)抗体特异性分析:将制备好的hCTRP2及ghCTRP2表达菌的经IPTG诱导的菌体总蛋白样品点样到12%的SDS-PAGE胶中,对蛋白质进行电泳分离,在电泳结束后,将凝胶从玻璃板上轻轻剥离并转至转移缓冲液中,浸泡40-60min;按转移凝胶的大小裁剪好滤纸和PVDF膜,滤纸各边应比PVDF膜长2mm,PVDF膜的各边应比PAGE胶的各边长2mm;将PVDF膜用100%甲醇浸泡30s,将PVDF膜及滤纸一并浸入转移缓冲液中,平衡15min;将胶、滤纸及PVDF膜取出,尽量避免污染滤纸和膜,按从下到上:滤纸-膜-胶-滤纸的顺序将其依次放好,尽量避免胶与膜之间产生气泡;打开半干转移仪,将滤纸-膜-胶-滤纸放入转移盘中,盖好电源盖子;接通电源,83mm×75mm大小的膜设定电流100mA,电压15V;实际设定中电压15V不变,按60mm2设1mA的初始电流,设定转膜时间为1h;转移完毕后,将PVDF膜转移至含5%牛血清白蛋白的TBST中,4℃,封闭12h;封闭结束后,加入稀释2万倍的抗体到PVDF膜中,4℃,孵育12h,利用TBST洗膜3次,每次15分钟;将膜转至含有HRP标记的山羊抗兔IgG中,4℃,孵育12h,利用TBST洗膜3次,每次15分钟;将膜置于一小盒中,加入适量的ECL发光液,反应2分钟,将膜置于暗盒内并于暗室中将X-光片压在膜上;将X-光片进行显影和定影处理,X-光片于空气中干燥并拍照分析。WB结果都表明,仅在全长hCTRP2表达菌的菌体总蛋白的约50kDa和球状hCTRP2表达菌的菌体总蛋白的约35kDa处检测到了特异条带,说明制备的抗体具有很高的特异性和灵敏度(结果如图5所示)。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。SEQUENCELISTING<110>怀化学院<120>一种人补体C1q/TNFα相关蛋白-2(hCTRP2)的抗原肽及其抗体<130>2013<160>6<170>PatentInversion3.3<210>1<211>31<212>DNA<213>人工序列<400>1gcctcgagaaaagagacccactgcttggcgc31<210>2<211>26<212>DNA<213>人工序列<400>2gctctagatacctcgttggggtcatc26<210>3<211>29<212>DNA<213>人工序列<400>3gcggatccgtggcagtgaccaagagctac29<210>4<211>30<212>DNA<213>人工序列<400>4gcctcgagtcagattaggaagcccgtaaag30<210>5<211>11<212>PRT<213>人工序列<400>5AspArgGlyAspSerGlyGluGluGlyProPro1510<210>6<211>10<212>PRT<213>人工序列<400>6IleTyrAlaAspGlnAspAspProAsnGlu1510
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1