一种肝靶向肽与重组人内皮抑素融合蛋白及其制备方法与应用与流程
本发明属于医药生物技术领域,更具体地,涉及一种肝靶向肽与重组人内皮抑素融合蛋白及其制备方法与应用。
背景技术:
原发性肝癌(HCC)是我国主要的恶性肿瘤之一,年发病率为10~150/10万人,仅次于肺癌和胃癌,是我国第三位的恶性肿瘤,其年死亡率约34.6/10万人,仅次于肺癌,居第二位。原发性肝癌也是肝硬化患者的主要死亡原因。其在全世界也属于常见病,原发性肝癌在恶性肿瘤发病率中居世界第5位,死亡率居第3位。目前,我国每年新发原发性肝癌约35万例,占全世界新发病例的55%。每年死于原发性肝癌的人数约32万人,占全世界原发性肝癌总死亡人数的45%。目前,原发性肝癌的高发病率,高病死率及其逐年增高的趋势,已成为一个非常严重的国际卫生问题,严重危害了人类的健康。开展创新药物与治疗新靶标的研究对改善肝癌治疗现状具有重要意义。实体肿瘤的生长和转移依赖于新生血管生成学说的提出,为肿瘤治疗开辟了一个新的途径。目前,以肿瘤血管生成为靶点,通过肿瘤血管生成抑制剂(tumorangiogenesisinhibitors,TAI)抑制或破坏肿瘤血管生成,切断肿瘤营养来源而“饿死”肿瘤的癌症新疗法已成为研究热点。根据干预环节的不同,抗血管生成药物分为5类:(1)抑制内皮细胞增生或迁移,如血管抑素(Angiostatin)和内皮抑素(Endostatin);(2)阻止血管内皮细胞外基质降解,如基质金属蛋白酶抑制剂;(3)阻断血管内皮生长因子VEGF和(或)血管内皮生长因子受体VEGFR的产生,如抗VEGF单克隆抗体Becacizumab,VEGFR的酪氨酸抑制剂Sunitinib(SU011248)、Sorafenib(BAY43-9006)及Axitinib(AG-013736)等;(4)干扰VEGF和VEGFR的相互作用,如VEGFR选择性抑制剂SU1498、ZD6474等;(5)抑制胞内信号转导分子从而阻断VEGF/VEGFR信号通路,如胞内信号转导分子PI-3K抑制剂LY94002等。肝癌是血管丰富的实体性肿瘤,大多数肝癌有血管异常增生的现象。在肝癌细胞及其周边的间质中经常发现多种促血管生成的因子过度表达,如血管内皮生长因子(VEGF)、碱性纤维母细胞生长因子(bFGF)、血小板相关生长因子(PDGF)和基质金属蛋白酶(MMP)等。目前,临床上治疗HCC的抗血管生成药物多是阻断血管内皮生长因子VEGF和(或)血管内皮生长因子受体VEGFR信号通路的酪氨酸激酶抑制剂或抗体,容易产生耐药性。内皮抑素(Endostatin,ES)是由细胞外基质成分胶原ⅩⅧ的羧基末端水解而来的一种动物体内天然存在的蛋白,是一种内源性血管形成抑制因子,能有效地抑制机体内病理性血管的形成,具有广谱的抗肿瘤作用。临床研究发现,Down’s综合症病人的ES表达水平较高,实体瘤发病率很低;癌症患者血清中ES的含量有利于总生存时间的延长。体外研究发现,ES特异性地抑制微血管内皮细胞的增殖、迁移、粘附和存活,能有效地抑制鸡胚尿囊膜(CAM)新生血管的形成,而实验性动物研究也证实ES有显著的抗肿瘤作用。目前发现ES可以和内皮细胞(ECs)表面多个非特异性受体结合,抑制ECs在血管形成中的作用。例如:ES以低亲和力结合ECs表面的HS、Glypican-1以及Glypican-4,诱导整合素α5β1(integrinα5β1)、HSP和锚定蛋白Caveolin聚集,活化RhoGAP磷酸酶,使Actin应力纤维和黏着斑解聚,产生抗迁徙和抑制血管形成的作用;ES与纤连蛋白(Fibronectin,FN)竞争性地结合ECs表面的Integrinα5β1,抑制黏着斑激酶(focaladhesionkinase,FAK)/丝裂原活化的蛋白激酶l(mitogen-activatedproteinkinasel,MAPKl)/细胞外信号调节激酶1(extracellularsignalregulatedkinasel,ERKl)信号传导途径,损害ECs与基质之间的相互作用,从而降低ECs迁徙和黏附功能;ES结合VEGF受体KDR(kinaseinsertdomaincontainingreceptor,KDR)细胞膜外的结构域,阻断VEGF/VEGFR信号途径,抑制ECs增殖和迁徙。ES也能直接进入ECs,或者与管周细胞以及细胞外基质成分相互作用,通过调节效应蛋白的表达和活性发挥作用。例如:Es能下调ECs中BCL-2和BCL-XL等抗凋亡蛋白的表达,诱导ECs凋亡;ES抑制某些肿瘤相关的基质金属蛋白酶原(promatrixmetalloproteinases,proMMPs)的激活和水解活性,并MMP-2活性部位结合成稳定的复合物,抑制内皮细胞迁徙和肿瘤细胞侵袭。DNA微阵列研究揭示ES下调了的促血管形成信号通路,包括:调节细胞增殖的Id和AP-1信号、乏氧和代谢适应的HIF-1a信号、参与细胞迁徙的ephrin和TNF-a信号、增殖和抗凋亡NF-κB信号、调节细胞增殖和迁徙的STAT信号、迁徙和抗凋亡的Ets信号以及凝血级联和黏附分子通路。美国EntreMed公司采用毕赤酵母表达系统生产了人内皮抑素,并开展了I、II期临床试验。结果表明ES有良好的安全性,部分难治性晚期肿瘤在药物使用过程中处于稳定状态,少数病例肿瘤缓慢缩小。我国以大肠杆菌表达系统生产了新型重组人内皮抑素(recombinanthumanendostatin,rh-ES,商品名Endostar,恩度),其氨基末端经过基因修饰加上了9个氨基酸序列(MGGSHHHHH),形成6个组氨酸标签,从而简化了纯化工艺,蛋白质活性和稳定性也有了明显提高。中国食品药品监督管理局(SFDA)在2005年9月批准了恩度联合NP(诺维本+顺铂)方案治疗晚期非小细胞肺癌(non-smallcelllungcarcinoma,NSCLC)的适应症。目前临床上已将恩度与放疗、化疗联合用于治疗多种肿瘤。但治疗时恩度在体内容易扩散降解,导致相对平均的组织分布,未能在病灶部位形成有效的抗肿瘤浓度,为了达到临床效果,只有加大药物剂量;然而,加大剂量会引起较严重的毒副作用,如心脏功能受损、腹泻等,尤其是对胚胎形成、伤口愈合等生理状态下的血管形成存在潜在的不良影响。提高ES的器官靶向性,将药物有效地输送至病变部位,可提高药物的治疗指数,减少其毒副作用。有研究发现,将肿瘤靶向肽Arg-Gly-Asp(RGD)或肿瘤穿膜肽CRGDKGPDC融合到ESN端多肽片段或ESC端上,可增强ES多肽及ES体内抗肿瘤的功能。环子孢子蛋白(Circumsporozoiteprotein,CSP)是疟原虫子孢子表面一种重要的抗原,子孢子利用其与肝细胞表面受体相互作用从而识别、粘附在肝细胞表面。通过静脉注射,重组CSP在几分钟内就能结合到肝细胞表面,表明CSP有高效而特异的肝细胞靶向性。CSP约含400个氨基酸,由N端保守I区、中央重复区和C端保守Ⅱ区构成。近年研究显示CSPN端保守I区可与肝细胞表面的受体---硫酸乙酰肝素蛋白聚糖(heparansulfateproteoglycans,HSPG)特异性地结合,表明CSPI区除包含保守序列KLKQP,保守序列的上游还含有硫酸肝素结合序列,将这一含KLKQP和硫酸肝素结合序列的肽段称为I-plus。Ancsin等研究证实,CSPI-plus以饱和的方式结合肝素和硫酸肝素凝胶柱,并抑制重组CSP与肝素凝胶的结合。Robertson等将CSPI-plus固定在聚乙二醇脂质体顶端制备成含CSP脂质体,体内外实验均表明其能特异地结合HSPGs从而靶向肝组织。小鼠静脉给药后,含CSP脂质体15分钟即可快速地从小鼠外周血清除,定量分析显示小鼠肝脏含CSP脂质体的浓度为心脏、肾脏和肺脏的数百倍,为脾脏的12倍。以上研究结果提示CSPI-plus是一个良好的肝靶向载体。
技术实现要素:
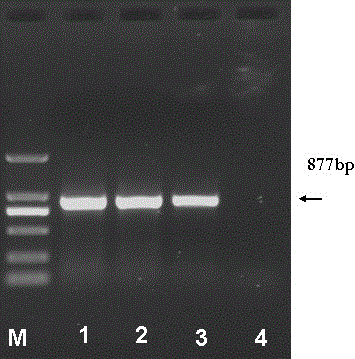
本发明的目的是针对现有技术存在的不足,并基于CSPI-plus高效而特异的肝细胞靶向性和重组内皮抑素的高效抑制血管形成作用,提供一种肝靶向肽与重组人内皮抑素融合蛋白(ES-CSP)。该融合蛋白可利用肝靶向肽CSPI-plus高效特异的肝细胞靶向性将重组人内皮抑素导向肝脏,特异性抑制肝脏肝癌血管形成,可提高药物的治疗指数,减少其毒副作用。本发明另一目的在于提供一种新型的融合基因,将来源于恶性疟原虫环子孢子蛋白编码CSPI-plus19个氨基酸的肝靶向肽序列拼接在氨基末端加有9个氨基酸序列(MGGSHHHHH)的新型重组人内皮抑素基因的C端而得。本发明另一目的在于提供肝靶向肽与重组人内皮抑素融合蛋白(ES-CSP)的应用。本发明的目的通过以下技术方案予以实现:一种肝靶向肽与重组人内皮抑素融合蛋白,其氨基酸序列如SEQIDNO:1所示。一种肝靶向肽与重组人内皮抑素融合蛋白基因,其特征在于,其核苷酸序列如SEQIDNO:2所示。一种肝靶向肽与重组人内皮抑素融合蛋白的制备方法,包括如下步骤:S1.肝靶向肽与重组人内皮抑素融合蛋白基因构建:利用SOE-PCR方法在人内皮抑素基因的羧基端加入核苷酸序列如SEQIDNO:3所示的CSPI-plus基因序列,在内皮抑素基因氨基端加入核苷酸如SEQIDNO:4所示的基因片段;S2.将上述融合蛋白基因构建重组表达载体;S3.将重组表达载体转化宿主细胞,获得表达融合蛋白的工程菌,发酵培养;S4.纯化分离得到肝靶向肽与重组人内皮抑素融合蛋白。为了将得到的融合蛋白基因方便构建重组载体,S1所述融合蛋白基因构建中利用SOE-PCR方法在人内皮抑素基因的羧基端和氨基端还分别加入酶切位点序列。优选地,利用SOE-PCR方法在人内皮抑素基因的羧基端加入酶切位点序列为XhoI限制性内切酶切位点序列,利用SOE-PCR方法在人内皮抑素基因的氨基端加入酶切位点序列为NdeI限制性内切酶切位点序列。进一步地,S1所述融合蛋白基因构建具体步骤为:先以引物组1扩增出人内皮抑素基因,再以引物组2和引物组3采用SOE-PCR方法在人内皮抑素基因的羧基端加入核苷酸序列如SEQIDNO:3所示的CSPI-plus基因序列,在内皮抑素基因氨基端加入核苷酸如SEQIDNO:4所示的基因片段,引物组1由引物P1和P2组成,引物组2由引物P3和P4组成,引物组3由引物P3和P5组成,引物P1、P2、P3、P4和P5的核苷酸序列如SEQIDNO:5~9所示。运用NCBI服务器中的CDD程序和http://expasy.org网站提供的ProtParam、ProtScale、NPS@等相关生物信息学分析工具对制备得到的肝靶向肽与重组人内皮抑素融合蛋白的物理化学性质、功能域、疏水性、蛋白质二级结构进行预测分析。结果显示ES-CSP为阳离子蛋白,含211个氨基酸,其中酸性氨基酸残基(Asp+Glu)和碱性氨基酸残基(Arg+Lys)含量分别为18和27个,分子量为23326.4Da,理论等电点为9.69,不稳定指数为39.19,蛋白质比较稳定,在哺乳动物体内半衰期为30h,在酵母和大肠杆菌中半衰期分别可大于20h和10h,GRAVY指数(两亲性指数)为-0.465,用ProtScale进行亲水性/疏水性分析显示该蛋白的亲水氨基酸数量大于疏水氨基酸,为亲水性蛋白,NPS@分析显示该蛋白二级结构以α-螺旋、延伸链和无规则卷曲为主要结构元件,表明,该融合蛋白适合体外重组表达。一种重组表达载体,由载体的多克隆位点插入如上所述肝靶向肽与重组人内皮抑素融合蛋白基因。优选地,所述重组表达载体为重组原核表达载体。更优选地,所述重组表达载体为pET21b-ES-CSP。重组表达载体pET21b-ES-CSP的构建步骤为:在成功地克隆融合基因的基础上进一步构建融合基因的原核表达质粒,对构建成功的重组质粒pMD20-T-ES-CSP和原核表达载体pET21b分别进行XhoI和NdeⅢ双酶切并以T4DNA连接酶连接后转化。经菌落PCR初步鉴定为阳性的克隆摇菌,抽取质粒进行XhoI和NdeⅢ双酶切鉴定,结果表明重组质粒含有与预期大小一致的条带,经DNA测序分析,无碱基错配,最终确定重组表达质粒pET21b-ES-CSP构建成功。一种重组株,含有如上所述的重组表达载体。重组株的具体构建步骤为:将构建成功的重组原核表达质粒转化宿主菌E.coliBL21(DE3),利用异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-thiogalactopyranoside,IPTG)诱导表达,采用十二烷基硫酸钠-聚丙烯酸胺凝胶电泳(SodiumDodecylSulfate-Polyacrylaminegelelectrophoresis,SDS-PAGE)、蛋白质印迹(WesternBlot)方法对表达产物进行分析鉴定,结果显示表达的蛋白为目的蛋白ES-CSP,表明融合蛋白表达成功。分别对影响外源基因表达的常规表达条件(诱导温度、诱导菌体起始浓度、诱导剂pH、诱导剂浓度、诱导时间)进行优化,发现ES-CSP/pET21b重组质粒在大肠杆菌BL21(DE3)宿主菌中最佳表达条件为:诱导温度为37℃、起始菌浓度为OD600约0.6、诱导剂IPTG的终浓度为0.06mM、诱导时间为4小时。诱导表达的目的蛋白以包涵体形式存在,超声破菌,洗涤收集包涵体,用6M盐酸胍溶解包涵体,再稀释后梯度复性。由于目的蛋白含有6×His氨基酸,用HisTrapHP亲和层析柱进行分离纯化,再分别用含50mM、100mM、300mM咪唑的Tris盐洗脱液洗脱目的蛋白,分段收集洗脱液,SDS-PAGE分析结果表明,100mM咪唑的洗脱液中含有大量目的蛋白,50mM、300mM咪唑的洗脱液中几乎不含目的蛋白。纯化后的目的蛋白经去盐后浓缩备用。如上所述肝靶向肽与重组人内皮抑素融合蛋白在制备抑制肝脏肝癌血管形成药物中的应用。与现有技术相比,本发明具有如下有益效果:本发明首次将来源于疟原虫环子孢子蛋白的肝靶向肽CSPI-plus与新型人内皮抑素nrhES进行融合,利用CSPI-plus高效特异的肝细胞靶向性将新型人内皮抑素nrhES导向肝脏,使其在肝脏富集,从而提高内皮抑素抑制血管形成的特异性,达到治疗肝癌的效果,减少全身用量,降低毒副反应,提高量效比。附图说明图1.ES基因扩增和融合基因重组示意图。图2.套式PCR克隆含有ES基因的核苷酸片段;M:DL2000DNAMarker;1、2、3、4分别为以2.0、1.5、1.0、0.0μlcDNA为模板,PCR扩增的含有ES基因的DNA片段。图3.SOEPCR重组ES-CSP融合基因;M::DL2000DNAMarker;1、2、3、4、5分别为以0.0、2.0、1.5、1.0、0.5μlES基因片段为模板,SOEPCR扩增的ES-CSP融合基因。图4.ES-CSP融合基因TA克隆PCR和双酶切鉴定;M:DL10000DNAMarker;1、2:重组质粒pMD20-T-ES-CSP双酶切;3:SOEPCR扩增的ES-CSP融合基因。图5.重组原核表达质粒ES-CSP/pET21b单酶切、双酶切鉴定;M:DL10000DNAMarker;1:表达质粒pET21b-ES-CSP双酶切;2:表达质粒pET21b-ES-CSP单酶切。图6.融合蛋白ES-CSP的SDS-PAGE和Western-blotting鉴定;M:蛋白标准Marker;1、3、5、B1:未诱导的重组菌株全菌蛋白;2、4、6、B2:诱导的重组菌株全菌蛋白。图7.融合蛋白ES-CSP对人肝癌细胞HepG2细胞靶向性;A:DAPI染核;B:PE标记的抗Anti-ES。图8.融合蛋白ES-CSP对HUVEC的抑制作用。图9.融合蛋白ES-CSP对HUVEC对细胞迁移的抑制作用。图10.融合蛋白ES-CSP抑制鸡胚尿囊膜新生血管的形成。具体实施方式下面结合附图和具体实施方式对本发明作出进一步地详细阐述,但实施例并不对本发明做任何形式的限定。实施例1S1.ES基因的克隆细胞培养及总RNA提取:胚胎肝细胞L-02培养在含双抗(100U/ml青霉素,100ug/ml链霉素)及10%胎牛血清的1640细胞培养液中,至细胞铺满,按TIANGENTRNzol总RNA提取试剂盒说明操作,每10cm2面积加入1mlTRNzol,提取细胞总RNA。RNA的检测:取RNA样品2µL,加入加样缓冲液,80V1.0%琼脂糖凝胶电泳20min。EB染色,凝胶成像仪检测RNA完整性;使用无RNA酶的超纯水以1∶50稀释总RNA产物,核酸蛋白分析仪读数,分析RNA样品的浓度及纯度。1.8≤OD260/OD280≤2.0为纯RNA。引物设计:根据NCBI公布的胶原ⅩⅧ及其羧基末端ES的基因序列和恶性疟原虫CSPI-plus基因序列,用PrimerPremier5.0生物软件设计引物P1~P5,引物P1、P2、P3、P4和P5的核苷酸序列如SEQIDNO:5~9所示。P1(20bp):CCGCACCACAGCTCCTACGT(SEQIDNO:5);P2(20bp):TACTGCACCCTGCCTGACCC(SEQIDNO:6);P3(55bp):GGAATTCCATATGGGGGGTTCTCATCACCATCACCATCACAGCCACCGCGACTTC(SEQIDNO:7);P4(55bp):TTTTATGTTTTGGTTTCCTTAATTTCTCGTTGTCCTTGGAGGCAGTCATGAAGCT(SEQIDNO:8);P5(55bp):GGCCGCTCGAGTTAACCATCCGCTGGTTGCTTTAATTTTTTATGTTTTGGTTTCC(SEQIDNO:9);套式PCR克隆ES基因:从胚胎肝细胞L-02中提取总RNA,按Invitrogen的反转录试剂盒说明做逆转录反应(以oligodT为引物),以获得的cDNA为模板,以P1和P2为引物,扩增ES基因,大小为877bp的序列。具体步骤为:向0.2mlEppendorf管中逐项加入如下成分:PCR反应体系的配制均在冰浴中进行,PCR扩增参数为:94℃预变性5min,94℃变性反应60sec,60℃退火反应40sec,72℃扩增反应90sec,进行30次循环,于72℃延伸10min。用DNAPurificationKit纯化PCR产物,DNA测序分析,ES基因序列与Genebank上ES的基因序列一致(如图2)。S2.SOEPCR重组ES-CSP融合基因(如图1)以P1、P2扩增的877bp序列为模板,以引物P3、P4、P5扩增ES-CSP融合基因。引物P3为ESN端序列,并在5‘端加入编码MGGSHHHHH的基因序列和NdeI限制性内切酶位点,引物P4含有ESC端互补序列和编码CSPI-plus19个氨基酸的部分序列,引物P5含有与P4相同序列、编码CSPI-plus19个氨基酸的其余部分序列和XhoI限制性内切酶位点,具体过程如下:向0.2mlEppendorf管中逐项加入下表所列成分:PCR反应体系的配制均在冰浴中进行,PCR扩增参数为:94℃变性反应60sec,67℃退火反应40sec,72℃扩增反应90sec,进行10次循环,取出Eppendorf管加入:94℃变性反应60sec,68℃退火反应40sec,72℃扩增反应90sec,进行25次循环,于72℃延伸10min。用DNAPurificationKit纯化PCR产物,将目的片段克隆入pMD20-T载体,得到重组质粒pMD20-T-ES-CSP,转化大肠杆菌DH5α,经过蓝白斑筛选、菌液PCR鉴定、酶切鉴定及DNA测序分析后,表明获得含有nrhES和CSPI-plus序列的融合基因、拼接组合的顺序及方向完全正确,说明融合基因重组成功(如图3和图4)。S3.ES-CSP融合基因表达质粒的构建将重组质粒pMD20-T-ES-CSP和表达载体pET21b分别用限制性内切酶NdeI和XhoI进行双酶切,经1.2%琼脂糖凝胶电泳分离,用琼脂糖凝胶回收试剂盒回收ES-CSP融合基因片段和载体pET21b,然后用T4连接酶连接过夜,连接产物转化E.coliDH5α感受态细胞,转化菌种涂于含有氨苄青霉素的平板,培养16~18h后,挑取单菌落培养后进行菌液PCR、酶切鉴定及DNA测序验证(如图5),结果表明融合基因表达质粒pET21b-ES-CSP构建成功。S4.融合蛋白ES-CSP的表达和鉴定S41.将pET21b-ES-CSP质粒转化已制备好的表达宿主菌E.coliBL21(DE3)感受态细胞,经氨苄抗性筛选,挑取pET21b-ES-CSP阳性单菌落到5mlLB液体培养基中,37℃、220rpm振摇过夜,然后将此菌液按1:100比例接种到新鲜的LB液体培养基中,37℃、220rpm振摇至OD600约0.6时,加入终浓度为1.0mmol/L的IPTG诱导4h。离心收集菌细胞加入1×SDS-PAGEBuffer,煮沸5min,离心,取上清进行SDS-PAGE(结果见图6)。SDS-PAGE结果表明:诱导后菌体在23KD附近有明显表达条带并与预期相符。由于融合蛋白含有6×His标签,采用鼠源His单克隆抗体为一抗进行WesternBlotting,结果显示诱导后的含重组质粒表达菌株在23kDa处有一条特异性条带而未诱导的没有,进一步证实了表达的蛋白为带有His标签的目的蛋白。S42.融合蛋白ES-CSP表达条件的优化和活性蛋白的制备对影响外源基因表达的常规表达条件(诱导菌体起始浓度、诱导温度、诱导培养基pH、诱导剂浓度、诱导时间)进行优化。将转化菌接种于含100μg/ml氨苄青霉素的LB培养基中,37℃振荡培养过夜。次日,按照体积比1:100的比例将过夜培养菌液加入到装有50ml含100μg/ml氨苄青霉素的LB培养基的250ml三角瓶中振荡培养,分别在菌体浓度生长至OD600约0.2、0.4、0.6、0.8、1.0、2.0时,分别加入诱导剂IPTG至终浓度为0.00、0.06、0.12、0.24、0.48、0.96、1.92mmol后置于42℃、37℃、32℃、及28℃培养温度下进行诱导表达,并分别于诱导后1h、2h、3h、4h、5h、6h、7h、8h收菌。表达产物经15%SDS-PAGE电泳检测,结果表明pET21b-ES-CSP重组质粒在大肠杆菌BL21(DE3)宿主菌中最佳表达条件为:诱导温度为37℃、起始菌浓度为OD600约0.6、诱导剂IPTG的终浓度为0.06mM、诱导时间为4小时。按优化后的条件诱导基因工程重组菌,表达产物经复性后,利用HisTrapHP亲和层析柱进行亲和色谱纯化,RP-HPLC检测表达的ES-CSP的纯度,结果显示经诱导表达复性纯化后的ES-CSP融合蛋白的纯度达到93%,可以进行下一步的活性实验。S43.ES-CSP融合基因编码融合蛋白的生物学信息分析运用NCBI服务器中的CDD程序和http://expasy.org网站提供的ProtParam、ProtScale、NPS@等相关生物信息学分析工具对融合蛋白的物理化学性质、功能域、疏水性、蛋白质二级结构进行预测分析。结果显示ES-CSP为阳离子蛋白,含211个氨基酸,其中酸性氨基酸残基(Asp+Glu)和碱性氨基酸残基(Arg+Lys)含量分别为18和27个,分子量为23326.4Da,理论等电点为9.69,不稳定指数为39.19,蛋白质比较稳定,在哺乳动物体内半衰期为30h,在酵母和大肠杆菌中半衰期分别可大于20h和10h,GRAVY指数(两亲性指数)为-0.465,用ProtScale进行亲水性/疏水性分析显示该蛋白的亲水氨基酸数量大于疏水氨基酸,为亲水性蛋白,NPS@分析显示该蛋白二级结构以α-螺旋、延伸链和无规则卷曲为主要结构元件,表明,该融合蛋白适合体外重组表达。运用NCBI服务器中的CDD程序对其保守结构域进行搜索显示该融合蛋白含有ES结构域和配体结合位点;并运用SWISS-MODEL全自动模式模型预测ES-CSP的空间构象,结果显示:找到的最匹配的模板代码为:1bn1D(2.90Å);序列的匹配度为:99.44%;评价参数:5.64e-100,表明该方法表达的融合蛋白具有内皮抑制素ES活性结构域。S5.融合蛋白ES-CSP对肝细胞靶向作用S51.ES-CSP的细胞结合实验:以含5.0、2.5、1.25μg/mlES、ES-CSP的培养基培养正常肝、心、脾、肺和肾来源的细胞及人肝癌细胞,选择不同的时间点收集细胞,依次加入Anti-ES与PE标记的二抗,进行细胞免疫荧光试验,采用荧光显微镜和流式细胞仪检测细胞表面的荧光强度(结果见图7),可见含有ES-CSP的HepG2细胞有亮红色荧光,提示ES-CSP对人肝癌细胞HepG2细胞具有较高的结合活性。S52.将人肝癌细胞株HepG2注入Balb/c裸鼠腋窝下,构建裸鼠肝癌移植瘤模型,随机分为空白对照(生理盐水)组、ES组、ES-CSP组。由小鼠尾静脉给药,分别于给药后15、30、60、120min眼眶采血,离心分离血清,ELISA法检测血清中人内皮抑素浓度。小鼠采血后立即处死,分别取肝、肾、心脏、脾、肺和肿瘤组织制备匀浆,ELISA测定各样品中人内皮抑素浓度,并计算肝靶向和肝癌靶向指数。制作小鼠肝、肾、心脏、脾、肺和肿瘤组织切片,依次加入Anti-ES与PE标记的二抗,荧光显微镜图像分析系统上进行图像分析。S6.融合蛋白ES-CSP抑制血管生成作用S61.MTT法测定ES-CSP对细胞的抑制作用以人脐静脉内皮细胞(HUVEC)为研究对象。取对数生长期的细胞,细胞计数后加入96孔细胞培养板中,细胞贴壁后,加入10.0、5.0、2.5、1.25、0.625、0.312、0.156、0.0μg/mlES、ES-CSP,6个复孔,培养48h,MTT法测定490nm处OD值,计算细胞的生长抑制率。抑制率(%)=(1-实验组平均OD/对照组平均OD)×100%(结果见图8)。结果显示,ES-CSP可以抑制HUVEC的增殖,并具有一定的浓度依赖性。S62.流式细胞术检测ES-CSP对细胞生长周期及凋亡的影响以人脐静脉内皮细胞(HUVEC)为研究对象,取对数生长期的细胞,细胞计数后调整至细胞浓度为5×104个/ml,加入6孔细胞培养板中(2ml/孔),细胞贴壁后,分别加入一定浓度的ES、ES-CSP、设空白对照组,收集细胞,采用PI单染流式细胞术测定周期变化情况,采用AnnexinV与PI双染流式细胞术检测细胞凋亡情况。S63.划痕实验、Transwell检测ES-CSP对细胞迁移的影响以人脐静脉内皮细胞(HUVEC)为研究对象。划痕实验:先用marker笔在6孔板背后,用直尺比着,均匀得划横线,大约每隔0.5~1cm一道,横穿过孔。每孔至少穿过5条线。在孔中加入约5×105个细胞。第二天用枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜。用PBS洗细胞3次,去除划下的细胞,分别加入含有1.25μg/ml的ES无血清培养基和含有1.25μg/ml的ES-CSP的无血清培养基,同时设置空白对照,即不含任何物质的无血清培养基。放入37℃、5%CO2培养箱培养。按0,6,12,24小时取样,拍照(结果如图9),结果表明,ES-CSP具有ES抑制HUVEC迁移的生物活性。Transwell:取对数生长期的细胞,细胞计数后调整至细胞浓度为1×106个/ml,在Transwell小室上室内分别加入无血清培养液的细胞悬液100μl,下室加含10%FBS和药物的条件培养基600μl,孵箱培养18h。取出小室弃除上室液体,用棉签擦尽上室未穿膜的细胞,室温下10%甲醛固定30min,常规苏木精染色,200倍光境下计数5个视野的迁移细胞数,取其平均值,计算迁移抑制率。每组重复3次。抑制率(%)=(1-实验组穿膜细胞数/对照组穿膜细胞数)×100%.S64.鸡胚尿囊膜(CAM)模型验证ES-CSP对新生血管形成的作用取第7天的鸡胚,通过光照找到胚头,用手钻轻轻剥去直径约为1cm的蛋壳,小心去除壳膜,暴露鸡胚尿囊膜。分别加入30μl生理盐水(NS)、50和250μg/mlES、ES-CSP于鸡胚尿囊膜上,用封口膜封住缺口,放入恒温箱内培养(37℃、湿度70%)。72h后取出鸡胚,局部采用丙酮和无水乙醇固定10min。剪下鸡胚尿囊膜照相观察(结果如图10),可见,ES-CSP能够抑制鸡胚尿囊膜新生血管的形成。SEQUENCELISTING<110>广东药学院<120>一种肝靶向肽与重组人内皮抑素融合蛋白及其制备方法与应用<130><160>9<170>PatentInversion3.3<210>1<211>211<212>PRT<213>ES-CSP融合基因的氨基酸全序列<400>1MetGlyGlySerHisHisHisHisHisHisSerHisArgAspPheGln151015ProValLeuHisLeuValAlaLeuAsnSerProLeuSerGlyGlyMet202530ArgGlyIleArgGlyAlaAspPheGlnCysPheGlnGlnAlaArgAla354045ValGlyLeuAlaGlyThrPheArgAlaPheLeuSerSerArgLeuGln505560AspLeuTyrSerIleValArgArgAlaAspArgAlaAlaValProIle65707580ValAsnLeuLysAspGluLeuLeuPheProSerTrpGluAlaLeuPhe859095SerGlySerGluGlyProLeuLysProGlyAlaArgIlePheSerPhe100105110AspGlyLysAspValLeuArgHisProThrTrpProGlnLysSerVal115120125TrpHisGlySerAspProAsnGlyArgArgLeuThrGluSerTyrCys130135140GluThrTrpArgThrGluAlaProSerAlaThrGlyGlnAlaSerSer145150155160LeuLeuGlyGlyArgLeuLeuGlyGlnSerAlaAlaSerCysHisHis165170175AlaTyrIleValLeuCysIleGluAsnSerPheMetThrAlaSerLys180185190AspAsnGluLysLeuArgLysProLysHisLysLysLeuLysGlnPro195200205AlaAspGly210<210>2<211>636<212>DNA<213>ES-CSP融合基因的核苷酸全序列<400>2atggggggttctcatcaccatcaccatcacagccaccgcgacttccagccggtgctccac60ctggttgcgctcaacagccccctgtcaggcggcatgcggggcatccgcggggccgacttc120cagtgcttccagcaggcgcgggccgtggggctggcgggcaccttccgcgccttcctgtcc180tcgcgcctgcaggacctgtacagcatcgtgcgccgtgccgaccgcgcagccgtgcccatc240gtcaacctcaaggacgagctgctgtttcccagctgggaggctctgttctcaggctctgag300ggtccgctgaagcccggggcacgcatcttctcctttgacggcaaggacgtcctgaggcac360cccacctggccccagaagagcgtgtggcatggctcggaccccaacgggcgcaggctgacc420gagagctactgtgagacgtggcggacggaggctccctcggccacgggccaggcctcctcg480ctgctggggggcaggctcctggggcagagtgccgcgagctgccatcacgcctacatcgtg540ctctgcattgagaacagcttcatgactgcctccaaggacaacgagaaattaaggaaacca600aaacataaaaaattaaagcaaccagcggatggttaa636<210>3<211>57<212>DNA<213>肝靶向肽CSPI-plus的核苷酸序列<400>3gacaacgagaaattaaggaaaccaaaacataaaaaattaaagcaaccagcggatggt57<210>4<211>27<212>DNA<213>人内皮抑素氨基端加入的核苷酸序列<400>4atggggggttctcatcaccatcaccat27<210>5<211>20<212>DNA<213>引物P1<400>5ccgcaccacagctcctacgt20<210>6<211>20<212>DNA<213>引物P2<400>6tactgcaccctgcctgaccc20<210>7<211>55<212>DNA<213>引物P3<400>7ggaattccatatggggggttctcatcaccatcaccatcacagccaccgcgacttc55<210>8<211>55<212>DNA<213>引物P4<400>8ttttatgttttggtttccttaatttctcgttgtccttggaggcagtcatgaagct55<210>9<211>55<212>DNA<213>引物P5<400>9ggccgctcgagttaaccatccgctggttgctttaattttttatgttttggtttcc55
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1