鱼类繁殖中的神经激肽B拮抗剂的制作方法
本发明属于鱼类繁殖的领域,并且具体来说涉及具有神经激肽B(NKB)和神经激肽F(NKF)拮抗剂活性的肽模拟物以及它们在抑制或延迟鱼类生殖系统的成熟中的用途。
背景技术:
生殖功能受到中枢和外周因子的复杂网络的严密调控,在这些因子中最重要的是GnRH。最近,已将神经肽kisspeptin(由Kiss1编码)和神经激肽B(NKB,由Tac3编码)置于生殖不同阶段的决定性地位(Navarro VM.Front Endocrinol.2012;3:48.)。在人类中的研究揭示出编码NKB或神经激肽3受体(NK3R)的基因的功能失活突变导致低促性腺素性功能减退症和不育症。
神经激肽B(NKB)是肽的速激肽家族的成员。在人类中,速激肽3(tac3)或tac3受体(NKBR)基因中的失活突变与青春期欠缺和先天性低促性腺素性功能减退症相关。这表明NKB可能在人类生殖中具有关键作用。
NKB具有通过垂体上的受体的直接作用和通过促性腺激素释放激素(GnRH)神经元上的受体的间接作用。NKB结合到它们的同源受体,刺激它们的活性,这进而为促性腺激素分泌提供专性信号,由此门控支持生殖的下游事件。NKB是下丘脑-垂体-性腺轴的重要调控物,并且是多种调控物例如甾类激素反馈、营养和代谢调控的靶点。
能量稳态和繁殖是动物生命中最重要的过程,并且是密切相关的。能量稳态和繁殖的正确调控对于健康和存活来说是根本的。繁殖是能量密集性过程,并且用于能量平衡和繁殖的调控物的精确相互作用允许这两个过程的协同调控。在所研究的大多数鱼类中,性腺尺寸的季节性变化与血清生长激素(GH)浓度负相关,例如,当促黄体激素(LH)浓度高时,由于性腺尺寸增加,因此GH浓度低,并伴有非常缓慢的身体生长。
鱼类具有大量多种多样的繁殖策略,可以在不同的环境生态位中发现,并且使用不同的性成熟定时方式。当与其他脊椎动物相比时,鱼类具有几种独特特征。与其中垂体中的细胞是混合的四足动物相反,在鱼类中存在特定细胞在某些区域中的独特组织。鱼类具有促性腺物质被GnRH调控的双重模式,其将神经腺体和神经血管两类组分相组合。此外,分泌不同神经肽的不同神经末梢对垂体进行神经支配。然而,仍不了解在鱼类中NKB或NKF神经元是否投射到垂体。
到目前为止,已在从无脊椎动物到哺乳动物的广泛物种中鉴定到大量速激肽。Tac1通过可选剪接编码物质P(SP)和NKA两者。Tac2/Tac3产生NKB肽,并且Tac4编码血红素激肽-1。
已鉴定到三类哺乳动物速激肽受体(NK1、NK2和NK3),并且它们分别对SP、NKA和NKB具有偏好性结合亲和性。哺乳动物TAC1和TAC4产生2种有活性的神经肽,而TAC3是仅产生1种神经肽即NKB的唯一TAC。
最近从许多鱼类物种中鉴定到速激肽(tac)和tac受体基因(Biran 2012,PNAS 109:10269-10274)。系统发育分析显示,鱼的Tac3和哺乳动物的神经激肽基因产生自一个谱系。在不同鱼类物种之间,在编码NKB的区域中发现高度一致性,它们都共有共同的C-端序列。尽管鱼的Tac3基因编码两种假设的速激肽,但哺乳动物的直系同源物仅编码一种。被称为神经激肽F(NKF)的第二个鱼类假设肽是独特的,并且在所有试验的鱼类物种之间被发现是保守的。
在生命的前几周中,斑马鱼的tac3a mRNA水平逐渐提高,并在青春期时达到峰值。在斑马鱼的脑中,在与繁殖相关的特定脑区域中观察到tac3a和tac3b mRNA(Biran等,2008,Biol Reprod 79:776-786)。此外,在成熟的雌性斑马鱼中单次ip注射NKBa或NKF显著提高LH水平,并且tac3a和两个tac3r基因受到雌激素上调(Biran等,2012,同上),表明NKB/NKBR系统可能参与鱼类繁殖的神经内分泌控制,并且在脊椎动物中,NKB系统在繁殖的神经内分泌控制中的作用在进化上是保守的。
罗非鱼由于它们的高生长潜力、短的代时、产卵的容易性和疾病抗性,已变成商业上最重要的养殖淡水鱼之一。
已显示(Biran等,2014,Endocrinology 155,4831-42),由鱼脑分泌并参与繁殖的最近鉴定到的被称为神经激肽B(NKB)和神经激肽F(NKF)的神经肽,可以通过直接(通过在垂体水平上激活特定受体)或间接(通过脑)机制刺激促卵泡激素(FSH)和LH的释放。
属于本发明的某些发明者的WO 2013/018097公开了NKB和NKF激动剂,其用于鱼类中的激素调控,并且具体来说用于提前初情期的出现,调控排卵和产卵的时间安排和量,繁殖的同步化或刺激,增强配子的发育,增强卵黄发生,诱导GnRH,诱导Kisspeptine,提高下丘脑神经激素的水平,提高LH或FSH的水平和诱导卵母细胞成熟。
G.Drapeau等(Regul.Peptides,31,125,1990)公开了化合物SR142801(Trp7,β-Ala8-神经激肽A,4-10)作为哺乳动物中速激肽NK3受体的强力拮抗剂。
O'Harte,F.(J.Neurochem.57(6),2086-2091,1991)公开了被称为Ranakinin的肽类似物,这是一种使用神经激肽B从湖蛙(Rana ridibunda)的脑分离的NK1速激肽受体激动剂。
在哺乳动物中已知几种小分子非肽类NKB拮抗剂,例如:SB-222200(Sarau等,2000,J Pharmacol Exp Ther 295:373-381);奥沙奈坦(SR-142,801)和塔尼坦(talnetant)(SB 223412)(Sarau等,1997,J Pharmacol Exp Ther 281:1303-1311)。
尽管以前的出版物公开了用于提高受精和缩短成熟时间的鱼类NKB肽激动剂或哺乳动物NK-3拮抗剂,但现有的出版物都没有公开鱼类中的NKB拮抗剂。对用于在鱼类中延迟成熟和控制繁殖参数的这些拮抗剂,存在着未满足的需求。
发明概述
本发明是基于在鱼类中通过NKB拮抗剂抑制tac-3受体活性可以延迟或抑制成熟和繁殖这一发现。令人吃惊地发现,NKB和NKF肽的序列中特定氨基酸残基的改变,导致它们对鱼类生殖系统的成熟的活性从激动变为拮抗。还提供了抑制鱼类成熟和在鱼类中处理激素依赖性问题或过程的方法,以及NKB和NKF拮抗剂在药物或食物组合物中的用途。抑制或消除鱼类繁殖的具有外周活性的基于肽的NKB和NKF拮抗剂(在本文中被称为肽模拟物)或其他拮抗剂,除了其他过程之外,尤其可以引起生长速率提高和性别决定的改变。
根据第一方面,本发明提供了符合式I的肽模拟物:
X1-NMeVal-X4-Leu-Met-Z (式I)
其中:
所述肽模拟物由5-10个氨基酸构成;
X1是一段1-6个天然或非天然氨基酸残基和任选的N-端封端组成部分或修饰;
NMeVal是N-甲基-缬氨酸残基或N-甲基-D-缬氨酸残基;
X4是-NH(CH2)n-CO-,其中n是2-6;并且
Z表示所述肽的C-端,其可能被酰胺化、酰化、还原或酯化。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,X1包含至少一个采取L或D构型的芳香族氨基酸残基。
根据其他实施方式,X1包含D-Trp残基。
根据某些实施方式,X1包含至少一个带负电荷的(酸性)氨基酸残基。
根据某些实施方式,所述C-端被酰胺化。
根据某些实施方式,X1由2或3个氨基酸和封端的N-端构成。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,X1由2或3个包含芳香族残基、带负电荷的(酸性)残基的氨基酸残基和N-端封端组成部分构成。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述X1包含选自脂族氨基酸残基和极性的不带电荷的残基的残基。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述脂族残基选自Ala、Ile、Leu。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述极性的不带电荷的残基选自Ser和Thr。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,X1包含选自Phe、DPhe、Trp和DTrp的芳香族残基,选自Glu和Asp的带负电荷的(酸性)残基,以及琥珀酰基(Succ)N-端封端组成部分。每种可能性代表本发明的独立的实施方式。
根据其他实施方式,X1包含选自Phe和DTrp的芳香族残基、Asp残基、琥珀酰基(Succ)N-端封端组成部分和任选地选自Ile和Ser的残基。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述肽模拟物符合式II:
X1-NMeVal-βAla-Leu-Met-NH2(式II)
其中,X1选自:Succ-Asp-Phe,Succ-Asp-DPhe,Succ-Asp-Trp,Succ-Asp-DTrp,Succ-Asp-Ile-Phe,Succ-Asp-Ile-DPhe,Succ-Asp-Ile-Trp,Succ-Asp-Ile-DTrp,Succ-Asp-Ser-Phe,Succ-Asp-Ser-DPhe,Succ-Asp-Ser-Trp,Succ-Asp-Ser-DTrp,Succ-Glu-Phe,Succ-Glu-DPhe,Succ-Glu-Trp,Succ-Glu-DTrp,Succ-Glu-Ile-Phe,Succ-Glu-Ile-DPhe,Succ-Glu-Ile-Trp,Succ-Glu-Ile-DTrp,Succ-Glu-Ser-Phe,Succ-Glu-Ser-DPhe,Succ-Glu-Ser-Trp和Succ-Glu-Ser-DTrp。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,提供了一种肽模拟物,其由5-10个氨基酸残基构成并包含在SEQ ID NO:7中提出的序列:
NMeVal-βAla-Leu-Met(SEQ ID NO:7)。
根据某些实施方式,所述肽模拟物包含SEQ ID NO:7的序列、至少一个芳香族氨基酸残基和至少一个带负电荷的氨基酸残基。
根据某些实施方式,所述肽模拟物包含SEQ ID NO:7的序列、至少一个芳香族氨基酸残基、至少一个带负电荷的氨基酸残基和至少一个选自脂族氨基酸残基和极性的不带电荷的残基的残基。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述肽模拟物包含封端的N-端。
根据某些实施方式,所述肽模拟物包含酰胺化的C-端。
根据某些实施方式,所述肽模拟物由5、6、7、8、9或10个氨基酸残基和任选的N-端封端基团构成。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述肽模拟物由5-10个氨基酸残基、酰胺化的C-端和N-端封端组成部分构成。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述肽模拟物由6-7个氨基酸残基构成,其包含SEQ ID NO:7的序列和选自下列的序列:Succ-Asp-Phe,Succ-Asp-DPhe,Succ-Asp-Trp,Succ-Asp-DTrp,Succ-Asp-Ile-Phe,Succ-Asp-Ile-DPhe,Succ-Asp-Ile-Trp,Succ-Asp-Ile-DTrp,Succ-Asp-Ser-Phe,Succ-Asp-Ser-DPhe,Succ-Asp-Ser-Trp,Succ-Asp-Ser-DTrp,Succ-Glu-Phe,Succ-Glu-DPhe,Succ-Glu-Trp,Succ-Glu-DTrp,Succ-Glu-Ile-Phe,Succ-Glu-Ile-DPhe,Succ-Glu-Ile-Trp,Succ-Glu-Ile-DTrp,Succ-Glu-Ser-Phe,Succ-Glu-Ser-DPhe,Succ-Glu-Ser-Trp和Succ-Glu-Ser-DTrp。
根据某些实施方式,所述至少一个N-端封端组成部分是二羧酸残基。根据某些实施方式,所述至少一个N-端封端组成部分选自:琥珀酰基,草酰基,丙二酰基,戊二酰基,己二酰基,庚二酰基(pimaloyl),辛二酰基和乙酰基。每种可能性代表本发明的独立的实施方式。
根据某些特定实施方式,所述肽模拟物选自:
Succ-Asp-Ile-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:1,Ant-1);
Succ-Asp-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:2,Ant-2);
Succ-Asp-Ser-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:3,Ant-3);
Succ-Asp-Ile-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:4,Ant-4);
Succ-Asp-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:5,Ant-5);和
Succ-Asp-Ser-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:6,Ant-6);
其中Succ表示琥珀酰基。
应该明白地理解,以前知道的肽不包含在本发明中。
根据某些实施方式,所述肽模拟物还包含增强通透性的组成部分。本领域中已知的主动或被动促进或增强化合物进入细胞的通透性的任何组成部分,可用于本发明的肽模拟物中。可以将增强通透性的组成部分直接地或通过间隔物或连接物连接到肽组成部分中的任何位置。
根据另一方面,本发明提供了一种包含式I的肽模拟物的组合物。
根据某些实施方式,所述包含符合式I的肽模拟物的组合物选自药物组合物和食物组合物。
根据某些实施方式,所述组合物包含符合式I的肽模拟物,其中X1包含至少一个采取L或D构型的芳香族氨基酸残基。
根据某些实施方式,所述组合物包含符合式I的肽模拟物,其中X1包含D-Trp残基。
根据某些实施方式,所述组合物包含符合式I的肽模拟物,其中X1包含至少一个带负电荷的(酸性)氨基酸残基。
根据某些实施方式,所述组合物包含符合式I的肽模拟物,其中所述C-端被酰胺化。
根据某些实施方式,所述组合物包含符合式I的肽模拟物,其中X1由2或3个氨基酸和封端的N-端构成。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述组合物包含符合式I的肽模拟物,其中X1由2或3个氨基酸残基构成,包含芳香族残基、带负电荷的(酸性)残基、酰胺化的C-端和N-端封端组成部分。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述组合物包含符合式I的肽模拟物,其中X1包含选自脂族氨基酸残基和极性的不带电荷的残基的残基。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述组合物包含符合式I的肽模拟物,其中所述脂族残基选自Ala、Ile和Leu。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述组合物包含符合式I的肽模拟物,其中所述极性的不带电荷的残基选自Ser和Thr。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述组合物包含符合式I的肽模拟物,其中X1包含选自Phe、DPhe、Trp和DTrp的芳香族残基,选自Glu和Asp的带负电荷的(酸性)残基,以及琥珀酰基(Succ)N-端封端组成部分。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述组合物包含符合式I的肽模拟物,其中X1包含选自Phe和DTrp的芳香族残基,Asp残基,琥珀酰基(Succ)N-端封端组成部分,和任选的选自Ile和Ser的残基。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述组合物包含符合式II的肽模拟物:
X1-NMeVal-βAla-Leu-Met-NH2(式II);
其中,X1选自:Succ-Asp-Phe,Succ-Asp-DPhe,Succ-Asp-Trp,Succ-Asp-DTrp,Succ-Asp-Ile-Phe,Succ-Asp-Ile-DPhe,Succ-Asp-Ile-Trp,Succ-Asp-Ile-DTrp,Succ-Asp-Ser-Phe,Succ-Asp-Ser-DPhe,Succ-Asp-Ser-Trp,Succ-Asp-Ser-DTrp,Succ-Glu-Phe,Succ-Glu-DPhe,Succ-Glu-Trp,Succ-Glu-DTrp,Succ-Glu-Ile-Phe,Succ-Glu-Ile-DPhe,Succ-Glu-Ile-Trp,Succ-Glu-Ile-DTrp,Succ-Glu-Ser-Phe,Succ-Glu-Ser-DPhe,Succ-Glu-Ser-Trp和Succ-Glu-Ser-DTrp。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述组合物包含肽模拟物,其由5-10个氨基酸残基构成并包含序列NMeVal-βAla-Leu-Met(SEQ ID NO:7)。
根据某些实施方式,所述组合物包含肽模拟物,其包含SEQ ID NO:7的序列、至少一个芳香族氨基酸残基和至少一个带负电荷的氨基酸残基。
根据某些实施方式,所述组合物包含肽模拟物,其包含SEQ ID NO:7的序列、至少一个芳香族氨基酸残基、至少一个带负电荷的氨基酸残基和至少一个选自脂族氨基酸残基和极性的不带电荷的残基的残基。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述组合物包含含有封端的N-端的肽模拟物。
根据某些实施方式,所述组合物包含含有酰胺化的C-端的肽模拟物。
根据某些实施方式,所述组合物包含肽模拟物,其由5、6、7、8、9或10个氨基酸残基和任选的N-端封端基团构成。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述组合物包含肽模拟物,其由5-10个氨基酸残基、酰胺化的C-端和N-端封端组成部分构成。每种可能性代表本发明的独立的实施方式。
根据某些实施方式,所述组合物包含肽模拟物,其由6-7个氨基酸残基构成,包含SEQ ID NO:7的序列和选自下列的序列:Succ-Asp-Phe,Succ-Asp-DPhe,Succ-Asp-Trp,Succ-Asp-DTrp,Succ-Asp-Ile-Phe,Succ-Asp-Ile-DPhe,Succ-Asp-Ile-Trp,Succ-Asp-Ile-DTrp,Succ-Asp-Ser-Phe,Succ-Asp-Ser-DPhe,Succ-Asp-Ser-Trp,Succ-Asp-Ser-DTrp,Succ-Glu-Phe,Succ-Glu-DPhe,Succ-Glu-Trp,Succ-Glu-DTrp,Succ-Glu-Ile-Phe,Succ-Glu-Ile-DPhe,Succ-Glu-Ile-Trp,Succ-Glu-Ile-DTrp,Succ-Glu-Ser-Phe,Succ-Glu-Ser-DPhe,Succ-Glu-Ser-Trp和Succ-Glu-Ser-DTrp。
根据某些实施方式,所述至少一个N-端封端组成部分选自:琥珀酰基,草酰基,丙二酰基,戊二酰基,己二酰基,庚二酰基,辛二酰基,乙酰基和其他二羧酸残基。每种可能性代表本发明的独立的实施方式。
根据某些特定实施方式,所述组合物包含选自下列的肽模拟物:
Succ-Asp-Ile-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:1,Ant-1);
Succ-Asp-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:2,Ant-2);
Succ-Asp-Ser-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:3,Ant-3);
Succ-Asp-Ile-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:4,Ant-4);
Succ-Asp-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:5,Ant-5);和
Succ-Asp-Ser-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:6,Ant-6);
其中Succ表示琥珀酰基。
每种可能性代表本发明的独立的实施方式。
符合本发明的药物组合物包含如上所定义的NKB或NKF拮抗性肽模拟物和任选的可接受的载体、稀释剂、盐或赋形剂。
符合本发明的食物组合物包含如上所定义的NKB拮抗性肽模拟物和任选的食物添加剂。本领域中已知的任何食物添加剂可用于符合本发明的食物组合物中。这包括但不限于颜色添加剂、口味添加剂等。营养物包括但不限于蛋白质、糖类、脂肪、矿物质、维生素等,也可以包含在本发明的食物组合物中。符合本发明的食物组合物除了至少一种有活性的NKB或NKF拮抗剂之外,还可以包含营养物和食物添加剂。
根据某些实施方式,所述食物组合物包含用至少一种NKB或NKF拮抗剂包衣的食物颗粒。
如上所定义的用作NKB拮抗剂的药物或食物组合物,也在本发明的范围之内。
包含符合本发明的肽模拟物的组合物,可以通过本领域中已知的任何方式或途径,包括肠胃外施用和肠内施用,施用到鱼类。根据某些实施方式,肠胃外施用包括但不限于任何类型的注射。根据某些实施方式,肠内施用包括但不限于口服施用、包括作为食物添加剂施用,通过浸泡施用、包括作为饮用水的添加剂施用,以及通过管饲的胃内施用。
根据某些实施方式,所述组合物作为定期的食物或水消费的一部分施用到鱼类。
根据某些实施方式,所述组合物在被鳃吸收的水体中被施用到鱼类。
根据另一方面,本发明还提供了一种包含NKB拮抗剂的组合物,其用于抑制鱼类繁殖或成熟的至少一种参数。
符合本发明的NKB拮抗剂是能够结合到鱼的速激肽3(tac3)受体并抑制其活性的化合物。NKF拮抗剂也在NKB拮抗剂的定义范围之内。
根据某些实施方式,所述用于抑制鱼类繁殖或成熟的至少一种参数的组合物包含选自下列的肽模拟物:如上所定义的式I的肽模拟物,如上所定义的式II的肽模拟物,以及5-10个氨基酸残基的包含SEQ ID NO:7的序列的肽模拟物。
根据某些实施方式,所述用于抑制鱼类繁殖或成熟的至少一种参数的组合物包含选自下列的肽模拟物:
Succ-Asp-Ile-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:1,Ant-1);
Succ-Asp-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:2,Ant-2);
Succ-Asp-Ser-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:3,Ant-3);
Succ-Asp-Ile-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:4,Ant-4);
Succ-Asp-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:5,Ant-5);和
Succ-Asp-Ser-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:6,Ant-6);
其中Succ表示琥珀酰基。每种可能性代表本发明的独立的实施方式。
根据其他实施方式,所述用于抑制鱼类繁殖或成熟的至少一种参数的组合物包含非肽类NKB拮抗剂。
根据某些特定实施方式,所述用于抑制鱼类繁殖或成熟的至少一种参数的组合物包含选自下列的非肽类NKB拮抗剂:(S)-(2)-N-(a-乙基苯甲基)-3-甲基-2-苯基喹啉-4-甲酰胺(也被称为SB-222200);(S)-(1)-N-{{3-[1-苯甲酰基-3-(3,4-二氯苯基)哌啶-3-基]丙-1-基}-4-苯基哌啶-4-基}-N-甲基乙酰胺(也被称为奥沙奈坦和SR-142,801),以及(S)-(2)-N-(a-乙基苯甲基)-3-羟基-2-苯基喹啉-4-甲酰胺(也被称为塔尼坦和SB 223412)。每种可能性代表本发明的独立的实施方式。
根据另一方面,本发明提供了一种抑制鱼类繁殖或成熟的至少一种参数的方法,所述方法包括向鱼类施用包含NKB拮抗剂的组合物。
根据某些实施方式,所述组合物选自药物组合物和食物组合物。
能够结合到鱼的tac3受体并抑制其活性的任何NKB拮抗性化合物,都可用于这一方面。
根据某些实施方式,所述方法包括向鱼类施用包含选自下列的肽模拟物的组合物:如上所定义的式I的肽模拟物,如上所定义的式II的肽模拟物,以及5-10个氨基酸残基的包含SEQ ID NO:7的序列的肽模拟物。
根据某些实施方式,所述组合物包含选自下列的肽模拟物:
Succ-Asp-Ile-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:1,Ant-1);
Succ-Asp-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:2,Ant-2);
Succ-Asp-Ser-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:3,Ant-3);
Succ-Asp-Ile-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:4,Ant-4);
Succ-Asp-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:5,Ant-5);和
Succ-Asp-Ser-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:6,Ant-6);
其中Succ表示琥珀酰基。
每种可能性代表本发明的独立的实施方式。
根据其他实施方式,所述组合物包含非肽类NKB拮抗剂。
根据某些特定实施方式,所述组合物包含选自下列的非肽类NKB拮抗剂:
(S)-(2)-N-(a-乙基苯甲基)-3-甲基-2-苯基喹啉-4-甲酰胺(也被称为SB-222200);(S)-(1)-N-{{3-[1-苯甲酰基-3-(3,4-二氯苯基)哌啶-3-基]丙-1-基}-4-苯基哌啶-4-基}-N-甲基乙酰胺(也被称为奥沙奈坦和SR-142,801),以及(S)-(2)-N-(a-乙基苯甲基)-3-羟基-2-苯基喹啉-4-甲酰胺(也被称为塔尼坦和SB 223412)。每种可能性代表本发明的独立的实施方式。
在抑制鱼类繁殖或成熟的至少一种参数的方法中施用的符合本发明的药物组合物,包含NKB拮抗剂和任选的可接受的载体、稀释剂、盐或赋形剂。
在抑制鱼类繁殖或成熟的至少一种参数的方法中施用的符合本发明的食物组合物,包含NKB拮抗剂和任选的食物添加剂。符合本发明的食物组合物也可以包括营养物和食物添加剂,包括但不限于蛋白质、糖类、脂肪、矿物质、维生素等。
鱼类繁殖或成熟的至少一种参数的抑制包括但不限于:延迟或消除总的来说初情期或特别是早熟的初情期;调控性别决定和分化(在性别已决定后性腺发育的过程)和产卵(卵和精子的排出)。在其范围内还包括处理鱼类中与繁殖相关联的激素依赖性问题或过程。
根据某些实施方式,鱼的繁殖或成熟的抑制导致被处理的鱼的体重增加。
符合本发明的鱼包括来自于任何纲、亚纲、目、科或属的任何类型的鱼,包括养殖鱼、食用鱼和观赏鱼。根据某些非限制性实施方式,所述鱼选自罗非鱼、鲤鱼、鲑鱼、鲈鱼、鲶鱼和鲻鱼。
根据本发明的方法,NKB拮抗剂向鱼类的施用可以通过本领域中已知的任何方式来进行,包括但不限于肠胃外施用、口服施用和通过浸泡施用。
根据某些实施方式,所述NKB拮抗剂作为食物或水消费的一部分施用到鱼类。
根据某些实施方式,所述化合物在被鳃吸收的水体中被施用到鱼类。
从后文中给出的详细描述,本发明的其他实施方式和完整适用范围将变得显而易见。然而,应该理解,详细描述和具体实例尽管指明了本发明的优选实施方式,但仅仅是为了说明而给出的,因为对于本领域技术人员来说,从该详细描述,在本发明的精神和范围之内的各种不同改变和修改,将变得显而易见。
附图简述
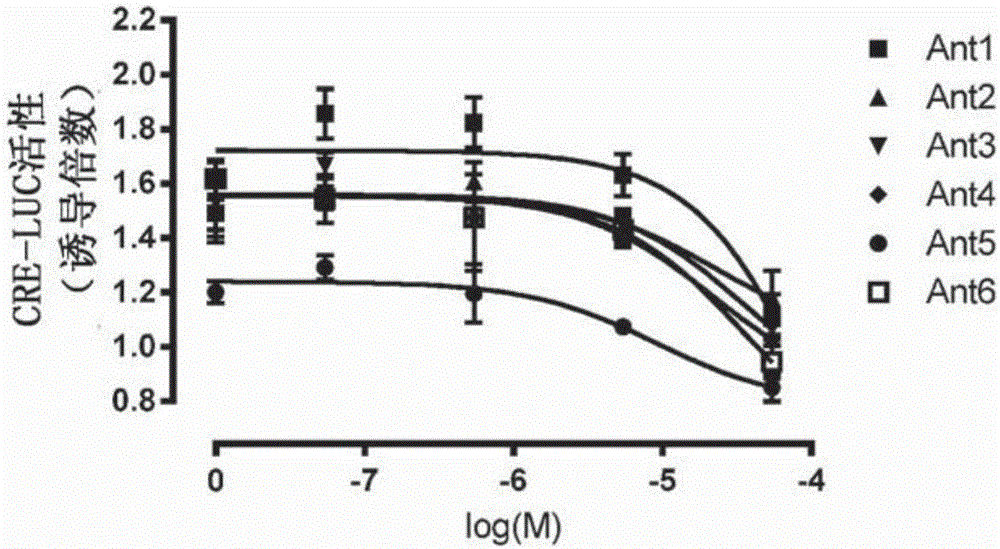
图1A和1B示出了在罗非鱼中6种肽模拟物在抑制信号转导中的效果(图1A CRE活化,图1B SRE活化)。每种拮抗剂以不同浓度与1*10-8M(=0.1nM)的NKB同时添加。罗非鱼NKB将萤光素酶活性提高1.8倍,并且示出了由各种不同多肽引起的响应降低。图1C演示了在比较中,各种不同NKB和NKF类似物在CRE活化模型中的激动剂活性。
图2A和2B示出了在斑马鱼中6种肽模拟物在抑制信号转导中的效果(图2A CRE活化,图2B SRE活化)。斑马鱼NKB将信号转导活性提高超过3倍。当每种拮抗剂以不同浓度与1*10-8M(=0.1nM)的NKB同时添加时,试验所述肽模拟物的效果。
图3A和3B证实了在用罗非鱼tac3r转染的COS-7细胞中,NKB拮抗剂SB222200对CRE-Luc的影响,使用人类受体和配体作为阳性对照。图3A,与hNKB、罗非鱼NKB或罗非鱼NKF相比,单独的非肽类拮抗剂对萤光素酶活性的影响。图3B,与0.1nM天然配体(NKB或NKF)同时添加的不同浓度的拮抗剂对萤光素酶活性的影响。
图4A和4B描述了在用罗非鱼tac3r转染的COS-7细胞中,NKB拮抗剂奥沙奈坦(SR-142,801)对CRE-Luc的影响,此时将人类受体和配体用作阳性对照。图4A,与hNKB、罗非鱼NKB或罗非鱼NKF相比,0.1nM(10-8M)的单独的非肽类拮抗剂对萤光素酶活性的影响。图4B,与0.1nM天然配体(NKB或NKF)同时添加的不同浓度的拮抗剂的影响。
图5A和5B描绘了在罗非鱼中试验SB222200(浓度为10、100或500μg/kg体重)对FSH(图5A)和LH(图5B)释放的NKB拮抗活性的体内实验的结果。
图6示出了与对照鱼相比,来自于处理过的鱼的睾丸的性腺的组织学观察。鱼的睾丸组织在胞囊中。
图7用NKB拮抗剂SB222200、NKB拮抗剂Ant-4或对照注射的鱼的精液量。
图8用SB222200或NKB拮抗剂Ant-4注射14天的鱼中的11-酮基睾酮(11KT)水平。
图9对SB2222000或NKB拮抗剂Ant-6注射(每48h注射500μg/kg BW,共2周,n=每组25条鱼)做出响应,成年雄性罗非鱼的生长速率。
图10–用SB222200或NKB拮抗剂Ant-6注射的鱼的性成熟指数(GSI)。
图11在第27天,被注射的鱼的睾丸中的增殖细胞核抗原(PCNA)表达水平。
图12A和12B幼鱼对拮抗剂饲养做出响应的生长。图12A使用和不使用拮抗剂时鱼的生长速率(gr)。图12B图12A的鱼的代表性照片。左侧的3条鱼是对照鱼,右侧的3条鱼用拮抗剂Ant-6饲养。
图13示出了在用鲑鱼tac3r转染的COS-7细胞中,4号和6号NKB拮抗剂对CRE-Luc的影响。
发明详述
本发明提供了鱼类繁殖的抑制剂和用于控制它们的成熟和生长的方法。本发明是基于tac-3配体NKB和NKF的基于肽的或小分子拮抗剂对速激肽3受体(tac-3受体)活性的抑制作用。
根据本发明的某些实施方式,所述NKB拮抗剂是符合下式的基于肽的化合物(肽模拟物):
X1-X2-X3-NMeVal-X4-Leu-Met-NH2
其中
X1是任何氨基酸或非天然氨基酸模拟物,或者为空(无氨基酸);
X2是任何氨基酸或非天然氨基酸模拟物,或者为空(无氨基酸);
X3是任何氨基酸,优选为D芳香族氨基酸,最优选为D-Trp,或者为空(无氨基酸);
X4是–NH(CH2)n-CO-类型的间隔物,其中n=2-6,或者是–(Pro)n-类型的间隔物,其中n=1-6。
本发明提供了具有5-10个氨基酸和任选的N-端封端组成部分的肽模拟物,其中所述肽模拟物选自:
i.式I的化合物:X1-NMeVal-X4-Leu-Met-Z,其中:X1是一段1-6个天然或非天然氨基酸残基;NMeVal是N-甲基-缬氨酸残基或N-甲基-D-缬氨酸残基;X4是-NH(CH2)n-CO-,其中n是2-6;并且Z表示所述肽的C-端,其可能被酰胺化、酰化、还原或酯化;
ii.式II的化合物:X1-NMeVal-X4-Leu-Met-NH2,其中,X1选自:Succ-Asp-Phe,Succ-Asp-DPhe,Succ-Asp-Trp,Succ-Asp-DTrp,Succ-Asp-Ile-Phe,Succ-Asp-Ile-DPhe,Succ-Asp-Ile-Trp,Succ-Asp-Ile-DTrp,Succ-Asp-Ser-Phe,Succ-Asp-Ser-DPhe,Succ-Asp-Ser-Trp,Succ-Asp-Ser-DTrp,Succ-Glu-Phe,Succ-Glu-DPhe,Succ-Glu-Trp,Succ-Glu-DTrp,Succ-Glu-Ile-Phe,Succ-Glu-Ile-DPhe,Succ-Glu-Ile-Trp,Succ-Glu-Ile-DTrp,Succ-Glu-Ser-Phe,Succ-Glu-Ser-DPhe,Succ-Glu-Ser-Trp和Succ-Glu-Ser-DTrp,并且X4是βAla;以及
iii.包含序列NMeVal-βAla-Leu-Met(SEQ ID NO:7)的化合物。
还提供了包含符合本发明的肽模拟物的组合物和它们的使用方法。
根据某些特定实施方式,本发明的组合物包含选自Ant-1至Ant-6的化合物作为活性成分:
Succ-Asp-Ile-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:1,Ant-1);
Succ-Asp-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:2,Ant-2);
Succ-Asp-Ser-Phe-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:3,Ant-3);
Succ-Asp-Ile-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:4,Ant-4);
Succ-Asp-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:5,Ant-5);和
Succ-Asp-Ser-D-Trp-N(Me)Val-βAla-Leu-Met-NH2(SEQ ID NO:6,Ant-6)。
本发明的肽优选地使用本领域中已知的常规合成技术来合成,例如通过化学合成技术,包括肽模拟物方法。这些方法包括全固相合成、部分固相合成方法、片段缩合、经典溶液合成。固相肽合成程序在本领域中是公知的。专业技术人员可以使用自动化肽合成仪,使用标准化学方法例如t-Boc或Fmoc化学方法来合成本发明的任何肽。合成肽可以通过制备型高效液相色谱来纯化,并且其组成可以通过氨基酸测序来确认。肽和通透性组成部分的偶联可以使用本领域中已知的任何方法,通过固相或溶液相化学方法来进行。本发明的一些优选化合物可以方便地使用溶液相合成方法来制备。本领域中已知的制备化合物如本发明的化合物的其他方法也可以使用,并包含在本发明的范围之内。
符合本发明的N-端封端或修饰是指通过将化学组成部分共价附连到末端胺来改变肽的序列,引起改变的电荷、活性和/或对氨基肽酶切割的稳定性。
增强通透性的组成部分的非限制性实例包括:疏水组成部分例如脂肪酸、甾类和大体积芳香族或脂族化合物,可能具有细胞膜受体或载体的组成部分,例如甾类化合物、维生素和糖、天然和非天然氨基酸和转运肽。根据某些实施方式,所述疏水组成部分是脂类组成部分或氨基酸组成部分。
增强通透性的组成部分可以直接或通过间隔物连接到肽组成部分中的任何位置。根据特定实施方式,将细胞通透性组成部分连接到肽组成部分的氨基端。所述任选的连接间隔物可以具有不同长度和构象,包括任何适合的化学结构,包括但不限于胺、酰胺、氨基甲酸酯、硫醚、氧醚、磺酰胺键等。这些间隔物的非限制性实例包括氨基酸、砜酰胺衍生物、氨基硫醇衍生物和氨基醇衍生物。
当在本文中使用时,术语“肽”或“基于肽的”意味着涵盖天然的(遗传编码的)、非天然的和/或化学修饰的氨基酸残基,每个残基以具有氨基和羧基端并通过肽或非肽键彼此相连为特征。在整个本说明书和权利要求书中,氨基酸残基用单字母或三字母代码表示,正如在本领域中公知的。本发明的肽和肽模拟物优选地以直链形式使用,尽管可以设想在环化不严重干扰肽的特征的情况下,也可以使用环状形式的肽。
在本发明中使用的氨基酸是可商购的或者可以通过常规合成方法得到的氨基酸。某些残基可能需要特殊方法才能并入到肽中,并且肽序列的顺序、趋异或趋同合成方法可用于本发明。天然编码的氨基酸及其衍生物按照IUPAC惯例用三字母代码表示。当没有注明时,可以使用L或D异构体中的任一者。当氨基酸之前带有“D”时,使用D异构体。
本领域技术人员已知的氨基酸的保守替换,在本发明的范围之内。保守氨基酸替换包括将一个氨基酸用另一个具有相同类型的官能团或侧链例如脂族、芳香族、带正电荷的、带负电荷的氨基酸代替。这些替换可以提高口服生物可利用性、对靶蛋白的亲和性、代谢稳定性、在中枢神经系统中的穿透、对特定细胞群体的靶向等。专业技术人员将会认识到,对肽、多肽或蛋白质序列进行的改变、添加或缺失了被编码序列中的单个氨基酸或小部分氨基酸的个体替换、缺失或添加,当所述变化导致氨基酸被化学上相似的氨基酸替换时,是“保守修饰的变体”。提供功能上相似的氨基酸的保守替换表,在本领域中是公知的。
下面是将氨基酸分类成6组的实例,每个组含有彼此来说是保守替换的氨基酸:
1)丙氨酸(A),丝氨酸(S),苏氨酸(T);
2)天冬氨酸(D),谷氨酸(E);
3)天冬酰胺(N),谷氨酰胺(Q);
4)精氨酸(R),赖氨酸(K);
5)异亮氨酸(I),亮氨酸(L),甲硫氨酸(M),缬氨酸(V);以及
6)苯丙氨酸(F),酪氨酸(Y),色氨酸(W)。
其他分成多少有些不同的组(例如脂族、极性、非极性、亲水的、疏水的等)的分类法也本领域中也是已知的,并且可用于符合本发明的氨基酸替换。
在本发明的范围内还包括本发明的肽的盐、类似物和肽的化学衍生物。
当在本文中使用时,术语“盐”是指肽分子的羧基的盐和氨基或胍基的酸加成盐两者。羧基的盐可以通过本领域中已知的手段形成,并且包括无机盐例如钠盐、钙盐、铵盐、铁盐或锌盐等,以及与有机碱的盐例如与胺例如三乙醇胺、哌啶、普鲁卡因等形成的盐。酸加成盐包括例如与无机酸例如乙酸或草酸的盐。这里描述的盐也包括添加到肽溶液以增强水凝胶形成和/或含钙矿物质的矿化的离子性组分。
当在本文中使用时,“化学衍生物”是指含有一个或多个通常不是肽分子的一部分的化学组成部分的肽,所述化学组成部分例如游离羧基的酯和酰胺、游离氨基的酰基和烷基衍生物、游离羟基的磷酸酯和醚。这些修饰可以通过将肽的目标氨基酸残基与能够与所选侧链或末端残基反应的有机衍生试剂进行反应,引入到分子中。优选的化学衍生物包括被磷酸化、C-端酰胺化或N-端乙酰化的肽。
当在本文中使用时,本发明的肽的“功能衍生物”涵盖可以从作为侧链出现在残基上的官能团或N-或C-端基团,通过本领域中已知的手段制备的衍生物,并且只要它们仍是可药用的,即它们不破坏肽的活性,不为包含它的组合物提供有毒性质并且对其抗原性没有不利影响,即可包含在本发明中。这些衍生物可以包括例如羧基的脂族酯,通过与氨或与伯胺或仲胺反应产生的羧基的酰胺,通过与酰基组成部分(例如烷酰基或碳环芳酰基)反应形成的氨基酸残基的游离氨基的N-酰基衍生物,或通过与酰基组成部分反应形成的游离羟基(例如丝氨酰或苏氨酰残基的游离羟基)的O-酰基衍生物。
术语“肽类似物”表示除了一个或多个氨基酸变化或酰胺键的一个或多个修饰/替换之外,具有符合本发明的氨基酸序列的分子。肽类似物包括使用天然或非天然氨基酸残基的氨基酸替换和/或添加,以及在自然界中不发生的化学修饰。肽类似物包括肽模拟物。肽模拟物意味着本发明的肽被修饰,使得它包括至少一个非编码的残基或非肽键。这些修饰包括例如一个或多个残基的烷基化以及更具体来说甲基化,天然氨基酸的插入或被非天然氨基酸代替,酰胺键被其他共价键代替。本发明的肽模拟物可以任选地包含至少一个作为酰胺替换键的键,例如脲键、氨基甲酸酯键、磺酰胺键、肼键或任何其他共价键。适合的“类似物”的设计可以用计算机辅助。符合本发明的其他肽类似物包含采取逆转顺序的特定肽或肽类似物序列,即氨基酸以与天然蛋白中或被鉴定为有活性的特定肽或类似物中出现的氨基酸顺序相反的顺序偶联在肽序列中。不论是完全还是部分非肽的,符合本发明的肽模拟物提供的化学组成部分的空间排布,近似于所述肽模拟物所基于的肽中基团的三维排布。作为这种相似的活性位点结构的结果,所述肽模拟物对生物系统有影响,其类似于所述肽的生物活性。
修饰的氨基酸残基是其中任何基团或键通过缺失、添加或被不同的基团或键替换而被修饰的氨基酸残基,只要所述氨基酸残基的官能性得以保留即可,或者如果官能性改变(例如将酪氨酸用取代的苯丙氨酸替换),只要所述修饰不损害含有所述修饰残基的肽的活性即可。
根据本发明,“肽偶联物”是指包含直接或通过连接物共价连接有另一个肽类或非肽类组成部分的血管促进肽序列的分子。
术语“连接物”是指目的在于将细胞通透性组成部分与肽或肽模拟物共价相连的化学组成部分、任何类型的直接化学键或间隔物。所述间隔物可用于允许在所述增强通透性的组成部分与所述肽之间保持一定距离。
“通透性”是指药剂或物质穿透、渗透或扩散通过屏障、膜或皮肤层的能力。“细胞通透性”或“细胞穿透”组成部分是指本领域中已知的能够促进或增强分子通过膜的穿透的任何分子。非限制性实例包括:疏水性组成部分例如脂类、脂肪酸、甾类和大体积芳香族或脂族化合物,可能具有细胞膜受体或载体的组成部分例如甾类、维生素和糖,天然和非天然氨基酸,转运肽,纳米粒子和脂质体。
术语“生理上可接受的载体”或“稀释剂”或“赋形剂”是指非常适合于药物制备的水性或非水性流体。此外,术语“可药用载体或赋形剂”是指至少一种载体或赋形剂,并且包括载体和/或赋形剂的混合物。术语“治疗剂”是指可用于在患者中治疗(包括预防、诊断、缓解或治愈)失常、病痛、疾病或损伤的任何药品、药物或预防药剂。
药理学
除了其他考虑因素之外,本发明的新的活性成分是肽、肽类似物或肽模拟物这一事实,要求配方适合于这些类型的化合物的递送。尽管一般来说,由于对胃酸或肠道酶类的消化敏感性,肽不太适合于口服施用,但新的方法正被使用,以便设计和提供代谢稳定且口服生物可利用的肽模拟物类似物。
本发明的药物组合物可以通过任何适合的手段施用,例如口服、表面、鼻内、皮下、肌肉内、静脉内、动脉内、关节内、病灶内、通过吸入或肠胃外施用,并且被特别配制成用于所述施用途径。所述组合物根据施用途径进行配制。
本发明的药物组合物可以通过本领域中公知的方法来制造,例如利用常规的混合、溶解、成粒、研磨、粉碎、糖丸制造、磨细、乳化、包胶、包埋或冷冻干燥方法。
因此,按照本发明使用的药物组合物可以以常规方式,使用一种或多种生理上可接受的载体来配制,所述载体包含赋形剂和辅助剂,其便于将所述活性化合物加工成可以制药使用的制备物。适合的配方取决于所选的施用途径。
可以口服使用的药物组合物包括由明胶制成的推入配合的胶囊,以及由明胶和增塑剂例如甘油或山梨糖醇制成的软的密封胶囊。推入配合的胶囊可以含有与填充剂例如乳糖、粘合剂例如淀粉、润滑剂例如滑石或硬脂酸镁以及任选地稳定剂相混合的活性成分。在软胶囊中,可以将活性化合物溶解或悬浮在适合的液体例如脂族油、液体石蜡或液体聚乙二醇中。此外,可以添加稳定剂。
对于注射来说,可以将本发明的化合物配制在水性溶液中,优选地在生理上相容的缓冲液例如Hank’s溶液、Ringer’s溶液或生理盐水缓冲液中。对于透粘膜施用来说,在配方中使用适合于待渗透的屏障的渗透剂。这些渗透剂例如聚乙二醇在本领域中是公知的。
糖衣丸的芯被提供有适合的包衣。为此目的,可以使用浓糖溶液,其可以任选地含有阿拉伯树胶、滑石、聚乙烯吡咯烷酮、卡伯波凝胶、聚乙二醇、二氧化钛、漆溶液(lacquer solution)和适合的有机溶剂或溶剂混合物。可以向片剂或糖衣丸包衣添加染料或颜料,用于鉴别或表征活性化合物剂量的不同组合。
对于颊施用来说,所述组合物可以采取以常规方式配制的片剂或含片的形式。
对于吸入施用来说,将符合本发明用途的变体,使用适合的推进剂例如二氯二氟甲烷、三氯一氟甲烷、二氯四氟乙烷或二氧化碳从加压包装或喷雾器以提呈气溶胶喷剂的形式方便地递送。在加压气溶胶的情况下,剂量单位可以通过提供阀以递送计量的量来确定。在吸入器或吹入器中使用的例如明胶的胶囊和药筒,可以被配制成含有肽和适合的粉剂基料例如乳糖或淀粉的粉末混合物。
用于肠胃外施用的药物组合物包括水溶性形式的活性成分的水性溶液。此外,活性化合物的悬液可以被制备成适合的油性注射悬液。适合的天然或合成的载体在本领域中是公知的(Pillai等,Curr.Opin.Chem.Biol.5,447,2001)。任选地,所述悬液也可以含有适合的稳定剂或提高化合物的溶解性的试剂,以允许制备高浓度溶液。或者,活性成分可以采取粉剂末形式,在使用前用适合的介质例如无菌无热原水重构。
适合在本发明的情形中使用的药物组合物包括其中以有效实现所需目的的量包含活性成分的组合物。更具体来说,治疗有效量意味着化合物的有效预防、缓解或改善待治疗受试者的疾病症状的量。治疗有效量的确定完全在本领域技术人员的能力范围之内。
本文中描述的肽的毒性和治疗效能,可以在细胞培养物或实验动物中通过标准制药程序来确定,例如通过确定受试化合物的IC50(提供50%抑制的浓度)和LD50(引起50%的试验动物死亡的致死剂量)。从这些细胞培养物测定和动物研究获得的数据,可用于配制多种在人类中使用的剂量。所述剂量可能随着使用的剂型和利用的施用途径而变。准确的配方、施用途径和剂量,可以由医生个人根据患者的状况来选择(例如Fingl等,1975,《治疗学的药理学基础》(The Pharmacological Basis of Therapeutics),Ch.1p.1)。
根据本发明的某些实施方式,这些药物组合物的施用剂量在约0.1mg/kg至约50mg/kg体重的范围内。
取决于待治疗病症的严重性和响应性,施用计划也可以是缓慢释放组合物的单次施用,其中治疗过程持续几天至几周,或直至实现治愈或实现疾病状态的减弱。当然,待施用的组合物的量取决于待治疗的受试者、病痛的严重性、施用方式、处方医生的判断和所有其他相关因素。
在某些实施方式中,肽的递送可以通过使用保护性赋形剂来增强。这通常通过将所述肽与组合物复合以为它提供对酸和酶水解的抗性或通过将所述多肽包装在具有适合抗性的载体例如脂质体中来实现。保护用于口服递送的多肽的手段在本领域中是公知的(参见例如美国专利号5,391,377,其描述了用于治疗剂的口服递送的脂质组合物)。
通过使用持续释放蛋白质“包装”系统,可以维持高的血清半衰期。这些持续释放系统对于本领域技术人员来说是公知的。在一个优选实施方式中,用于蛋白质和肽的ProLease生物可降解微球递送系统(Tracy,1998,Biotechnol.Prog.14,108;Johnson等,1996,Nature Med.2,795;Herbert等,1998,Pharmaceut.Res.15,357),一种由聚合物基质中含有蛋白质的生物可降解聚合微球构成的干粉,其可以使用或不使用其他试剂复合成干制剂。
在某些实施方式中,本发明的组合物的剂型包括但不限于生物可降解的注射用储库(depot)系统例如基于PLGA的注射用储库系统、不基于PLGA的注射用储库系统和注射用可生物降解凝胶或分散系。每种可能性代表本发明的独立实施方式。当在本文中使用时,术语“可生物降解的”是指至少部分由于与周围组织流体中存在的物质相接触或通过细胞作用而在其表面处随时间侵蚀或降解的组分。具体来说,可生物降解的组分是聚合物,例如但不限于基于乳酸的聚合物例如聚丙交酯如聚(D,L-丙交酯)即PLA,基于乙醇酸的聚合物例如聚乙交酯(PGA)如来自于Durect的聚(D,L-丙交酯-乙交酯共聚物)即PLGA(来自于Boehringer的 RG-504、 RG-502、 RG-504H、 RG-502H、 RG-504S、 RG-502S,来自于Durect的),聚己内酯例如聚(e-己内酯)即PCL(来自于Durect的),聚酸酐,聚(癸二酸)SA,聚(蓖麻油酸(ricenolic acid))RA,聚(延胡索酸)FA,聚(脂肪酸二聚体)FAD,聚(对苯二甲酸)TA,聚(间苯二甲酸)IPA,聚(对-{羧基苯氧基}甲烷)CPM,聚(对-{羧基苯氧基}丙烷)CPP,聚(对-{羧基苯氧基}己烷)CPH,多胺,聚脲酸酯,聚酯酰胺,聚原酸酯{CHDM:顺/反式-环己基二甲醇,HD:1,6-己二醇,DETOU:(3,9-二亚乙基-2,4,8,10-四氧螺十一烷)},聚对二氧环己酮,聚羟基丁酸酯,聚亚烷基草酸酯,聚酰胺,聚酯酰胺,聚脲酸酯,聚缩醛,聚缩酮,聚碳酸酯,聚原碳酸酯,聚硅氧烷,聚磷腈,琥珀酸酯,透明质酸,聚苹果酸,聚氨基酸,聚羟基戊酸酯,聚亚烷基琥珀酸酯,聚乙烯吡咯烷酮,聚苯乙烯,合成的纤维素酯,聚丙烯酸类,聚丁酸,三嵌段共聚物(PLGA-PEG-PLGA),三嵌段共聚物(PEG-PLGA-PEG),聚(N-异丙基丙烯酰胺)(PNIPAAm),聚氧化乙烯-聚氧化丙烯-聚氧化乙烯三嵌段共聚物(PEO-PPO-PEO),聚戊酸,聚乙二醇,聚羟基烷基纤维素,几丁质,壳聚糖,聚原酸酯和共聚物、三元共聚物,脂类例如胆甾醇、卵磷脂,聚(谷氨酸-谷氨酸乙酯共聚物)等,或其混合物。
在某些实施方式中,本发明的组合物包含可生物降解的聚合物,其选自但不限于PLGA、PLA、PGA、聚己内酯、聚羟基丁酸酯、聚原酸酯、聚烷酸酐、明胶、胶原蛋白、氧化型纤维素、聚磷腈等。每种可能性代表独立的实施方式。
鱼食组合物
本发明的食物组合物可以是常规特种鱼食的一部分或与其混合。鱼食通常由用于待滋养的鱼类型的饲料构成,并包括蛋白质、油类、维生素和其他添加剂。
根据某些非限制性实例,本发明的拮抗剂组合物被包含在颗粒化固体组合物中,其含有约15至50%的蛋白质或蛋白质水解物、约2至5%的脂肪和约3至10%的粗纤维以及少量辅剂例如矿物质、维生素和/或微量元素。
包含本发明的拮抗剂的鱼食组合物使用本领域中已知的方法来制备。例如,从所述组合物制造直径通常为0.5-20毫米的颗粒,并在储存和使用之前进行干燥。颗粒的内聚性可以通过将少量明胶溶解在水中来提高。如果水溶性乳清粉提供大量蛋白质内含物,则优选地用少量油或脂肪包被颗粒表面,以防止颗粒在与水接触后过早崩解。可以将带有明胶的组合物以常规方式发泡,以产生总体密度与水相近的细胞颗粒。这些颗粒漂浮在水中并保持相对长的时间可被鱼接近。对许多鱼类来说,沉到底部的颗粒不再可用。通过将添加物均匀分配在基本组合物中并随后从获得的混合物制造颗粒,也可以将本发明的拮抗剂与常规组成的商品化鱼饲料混合。根据某些实施方式,将食物颗粒用本发明的化合物包被并用于饲养鱼类。
尽管为了说明本发明已参考各种不同的具体实施方式对本发明进行了描述,但这些具体公开的实施方式不应被当作限制性的。在本申请人在本文中的公开的基础上许多其他具体实施方式将出现在本领域技术人员面前,并且本申请人打算只受随附的权利要求书中所定义的本发明的精神和范围的限制。
实施例
下面的实施例证实了本发明的化合物作为鱼类NKB的拮抗剂的体外和体内活性。
实施例1:肽模拟物的设计和合成
基于下述考虑,设计了本发明的某些肽模拟物:
i)通过添加偶联到Asp残基的封端组成部分例如琥珀酰基(Succ)对肽的N-端进行修饰,使得所述肽缺少对氨基肽酶的降解敏感的末端氨基。这出人意料地产生将活性肽从11个氨基酸缩短到7个氨基酸的能力;
ii)将Phe残基用D-Trp替换阻止了激动剂紧密配合到所述NK受体。这将所述肽的活性从激动剂改变成拮抗剂,并且也使肽稳定化以抵抗内肽酶的降解。
iii)将Val残基N-甲基化以强加构象限制,这使生物活性构象稳定,由此提供了受体选择性和代谢稳定性,防止被内肽酶降解。
iv)将残基Gly用βAla(β丙氨酸)替换,导致生物活性构象的构象柔性提高,并促进激动剂转变成拮抗剂。
v)羧基端中的甲酰胺基团对于结合和受体活化来说是必需的,并防止被羧肽酶降解。
通过自动化固相方法,使用Fmoc活性酯化学合成所述肽模拟物。疏水性氨基酸例如Fmoc-D-Trp-OH与NMe-Val-肽基-树脂的困难的偶联,使用HATU在DMF中进行两次,每次5小时。化合物通过HPLC纯化至≥95%纯度。
实施例2:体外试验
存在两条信号转导途径,一条通过cAMP/PKA(蛋白激酶A)中继,第二条通过Ca2+/PKC。PKA途径被CRE(cAMP响应元件)激活,PKC通过SRE(甾类响应元件)激活。
为了区分PKC和PKA信号转导途径,使用受到血清响应元件(SRE;Invitrogen)或环AMP(cAMP)响应元件(CRE;Invitrogen)转录调控的荧光素酶(LUC)来利用灵敏的LUC报告基因测定法。将罗非鱼tac3ra和tac3rb(GenBank登记号分别为KF471674和KF471675)或斑马鱼tac3ra和tac3rb(分别为JF317292和JF317293)克隆在pcDNA3.1表达载体(Zeo-;Invitrogen)中CMV启动子的控制之下。
瞬时转染、细胞程序和刺激流程总体按照(Levavi-Sivan等,2005,Mol Cell Endocrinol 236:17-30;Biran等,2008,同上;Biran等,2012,同上;Biran等,2014同上)。简单来说,将COS-7细胞在增补有10%FBS、1%谷氨酰胺、100U/ml青霉素和100mg/ml链霉素(Biological Industries)的DMEM中,在5%CO2下生长直至合生。用pc-tac3ra、pc-tac3rb(以3μg/板的量)、报告质粒(以2μg/板的量)和pCM进行共转染。
转染使用FuGENE 6.0试剂(Roche)进行。将细胞血清饥饿36h,用介质或各种不同浓度的人类NKB、罗非鱼NKB、罗非鱼NKF、斑马鱼NKBa、NKBb或斑马鱼NKF刺激6h,然后收获并分析。
如前所述,测定从收获的细胞制备的裂解物的萤光素酶活性和β-半乳糖苷酶活性,后者作为内部标准用于归一化由试验质粒指导的萤光素酶活性。转染实验使用独立分开的三组进行一式三份。
所使用的配体浓度从1nM至1μM。处理在三个独立实验中进行一式四份。
每种拮抗剂以不同浓度添加,并使用恒定浓度的野生型NKB或NKF,所述配体的剂量(10-8M)给出接近于ED50的响应。结果通过Prism软件,按照非线性回归单位点竞争曲线进行分析。
在罗非鱼中试验了NKB拮抗剂的效果,此时每种拮抗剂以不同浓度与10-8M(=0.1nM)的NKB同时添加。罗非鱼NKB将萤光素酶活性提高1.8倍。各种不同的拮抗剂将这种响应降低约60%(图1A)。使用SRE响应获得了类似结果(图1B)。相反,罗非鱼NKB和NKF类似物(公开在WO 2013/018097中)在两种测定中都显示出具有激动活性,正如在图1C的CRE测定法中所演示的。
在信号转导活性的诱导中,斑马鱼NKB比罗非鱼的肽更加高效,并将CRE-LUC增加超过3倍。当每种拮抗剂以不同浓度与10-8M(=0.1nM)的NKB同时添加时,试验了NKB拮抗剂的效果。各种不同的拮抗剂将所述响应降低约60%(图2A)。使用SRE响应获得了类似结果(图2B),而NKB激动剂不是抑制性的而是刺激性的,并给出了与图1C类似的结果。
结论是,本发明的NKB拮抗剂肽模拟物能够抑制NKB信号转导。
实施例3.NKB的非肽拮抗剂
在体外和体内试验了已知的NKB小分子拮抗剂的效果。所述化合物是:SB-222200(Sarau等,2000,同上);奥沙奈坦(SR-142,801)和塔尼坦(SB 223412,(Sarau等,1997,同上))。
当将人类受体和配体用作阳性对照时,在用罗非鱼tac3r转染的COS-7细胞中试验了NKB拮抗剂SB222200对CRE-Luc的影响。
如图3A中所示,单独的非肽拮抗剂对萤光素酶活性没有影响,而0.1nM(=10-8M)的hNKB、罗非鱼NKB或罗非鱼NKF将萤光素酶活性分别提高1.7和2.3倍。
当不同浓度的拮抗剂与0.1nM本源配体(NKB或NKF)同时添加时,获得了典型的抑制曲线,证实了SB222200对罗非鱼NKB受体的拮抗效能(图3B)。
当将人类受体和配体用作阳性对照时,在用罗非鱼tac3r转染的COS-7细胞中试验了NKB拮抗剂奥沙奈坦(SR-142,801)对CRE-Luc的影响。单独的非肽拮抗剂对萤光素酶活性没有影响,而0.1nM(=10-8M)的hNKB、罗非鱼NKB或罗非鱼NKF将萤光素酶活性分别提高2.5和1.6倍(图4A)。然而,当不同浓度的拮抗剂与0.1nM本源配体(NKB或NKF)同时添加时,获得了典型的抑制曲线,显示了奥沙奈坦(SR-142,801)对罗非鱼NKB受体的拮抗效能(图4B)。
在罗非鱼中,在体内进一步试验了SB222200对促性腺激素释放的NKB拮抗活性。用不同剂量的NKB非肽拮抗剂SB222200(10、100或500μg/kg体重)注射性成熟的雌性罗非鱼(0.62±0.22%;n=10/处理),在注射后0、1、2、4和8小时时从鱼的尾部血管系统取血。按照Aizen等,2007(Aizen等,2007,Gen Comp Endocrinol,vol.153,pp 323-332),使用特异性ELISA确定促性腺激素FSH和LH的水平。结果显示,尽管在对照组中没有记录到显著变化,但从注射后已经1小时开始,在FSH(图5A)和LH(图5B)水平两者中记录到明显的逐渐降低。
实施例4.体内实验
对所选的在体外反式激活测定法中显示出有效的拮抗剂进行了体内试验。
将成年雄性罗非鱼(BW 90g)用盐水和25%DMSO、SB2222000或NKB拮抗剂Ant-4ip注射(每48h 500μg/kg BW共2周,n=每组20条鱼)。在注射后,每两天将鱼从尾部血管取血到添加肝素的注射器中。在第7和14天,将来自于每个组的5条鱼取血,剥开测量精液量,并获取性腺用于组织学研究。分析血浆的LH、FSH和11KT。从尾部血管系统收集血样并离心(在4℃下3000rpm离心20分钟)以获得血浆样品,将其储存在-20℃下直至测定。对于FSH和LH按照(Aizen等,2007,Gen Comp Endocrinol,vol.153,pp 323-332)进行ELISA,并且对于11KT(11-酮基睾酮,鱼中参与精子发生的主要雄激素)按照Hurvitz等,2005(Gen Comp Endocrinol 140:61-73)进行ELISA。
图6代表了处理过的鱼与对照鱼相比,来自于睾丸的性腺的组织学观察。鱼的睾丸组织在胞囊中。正如图中证实的,暴露到NKB拮抗剂Ant-4的鱼含有更多部分空的具有成熟原精虫(成熟精子)的胞囊。用NKB拮抗剂注射的鱼的精液量呈现在图7中。从右至左:来自于用SB222200注射的鱼的精液;来自于对照鱼的精液;来自于用NKB拮抗剂#4注射的鱼的精液。用SB222200或NKB拮抗剂Ant-4注射的鱼中的11KT水平示出在图8中。11KT是鱼中的主要雄激素并参与精子发生。在处理期间,对于对照鱼来说,从0至12天血浆11KT水平逐渐升高,而对于用SB222200或NKB拮抗剂Ant-4(#4)注射的鱼来说,这种升高被明显抑制。
实施例5.罗非鱼的体内生长
将成年雄性罗非鱼(BW 60g)用盐水和25%DMSO、SB2222000或NKB拮抗剂Ant-6ip注射(每48h 500μg/kg BW共2周,n=每组25条鱼)。每7天对鱼称重。正如在图9中指示的,在处理完成后7天即第21天,观察到显著的生长。
性成熟指数(GSI)是性腺质量占身体总质量的比例的计算值。也计算了注射过的鱼的GSI值(图10)。在第27天,将鱼处死并从它们的睾丸提取总RNA。增殖细胞核抗原(PCNA)是在真核细胞中充当DNA聚合酶δ的因子的DNA夹状物,并且对于复制来说是必需的。测定在27天后注射过的鱼的睾丸中PCNA的基因表达(图11)。
实施例6.幼罗非鱼的饲养
在本研究中使用105日龄的雌性罗非鱼。用肽模拟物拮抗剂包被的鱼颗粒饲料进行的喂养始于3个月零12天的鱼龄。NKB拮抗剂饮食(Ant-2、Ant-3、Ant-6)以7.5mg/kg饲料(鱼体重的2%至3%)的量使用。鱼每日在白天喂养两次。确定鱼的生长速率。如图12A和12B中所指示的,喂养含有NKB拮抗剂饮食的鱼比对照鱼生长得明显更快(体重增加约25%)。在它们的内部器官中没有观察到变化(正如由器官的照片所确定的)。
实施例7.在鲑鱼中的体外实验
与实施例2中在罗非鱼和斑马鱼中进行的体外实验相似,在鲑鱼中试验了NKB活性的抑制。将鲑鱼tac3受体克隆在pcDNA3.1表达载体(Zeo-;Invitrogen)中CMV启动子的控制之下。转染使用FuGENE 6.0试剂(Roche)进行。将细胞血清饥饿36h,用介质或各种不同浓度的罗非鱼NKB刺激6h,然后收获并分析。测定从收获的细胞制备的裂解物的萤光素酶活性和β-半乳糖苷酶活性两者,后者作为内部标准用于归一化由试验质粒指导的萤光素酶活性。转染实验使用独立分开的三组进行一式三份。所使用的配体浓度从1nM至1μM。处理在三个独立实验中进行一式四份。每种拮抗剂(NKB-ant 4和NKB-ant 6)以不同浓度添加,并使用恒定浓度的野生型NKB(10-8M),其给出接近于ED50的响应。结果通过Prism软件,按照非线性回归单位点竞争曲线进行分析。
当鲑鱼tac3被转染时,NKB将萤光素酶活性提高1.8倍。正如在图13中证实的,#4和#6两种拮抗剂成功地将这种响应降低约60%。
序列表
<110> 耶路撒冷希伯来大学伊萨姆研究发展有限公司(Yissum Research Development Company of The Hebrew University of Jerusalem Ltd.)
<120> 鱼类繁殖的拮抗剂(ANTAGONISTS OF FISH REPRODUCTION)
<130> SCT166852-60
<160> 7
<170> PatentIn version 3.5
<210> 1
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> ACETYLATION with Succinyl
<220>
<221> MOD_RES
<222> (4)..(4)
<223> MeVal
<220>
<221> MOD_RES
<222> (5)..(5)
<223> bAla
<220>
<221> MOD_RES
<222> (7)..(7)
<223> AMIDATION
<400> 1
Asp Ile Phe Xaa Xaa Leu Met
1 5
<210> 2
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> ACETYLATION with Succinyl
<220>
<221> MOD_RES
<222> (3)..(3)
<223> MeVal
<220>
<221> MOD_RES
<222> (4)..(4)
<223> bAla
<220>
<221> MOD_RES
<222> (6)..(6)
<223> AMIDATION
<400> 2
Asp Phe Xaa Xaa Leu Met
1 5
<210> 3
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> ACETYLATION with Succinyl
<220>
<221> MOD_RES
<222> (4)..(4)
<223> MeVal
<220>
<221> MOD_RES
<222> (5)..(5)
<223> bAla
<220>
<221> MOD_RES
<222> (7)..(7)
<223> AMIDATION
<400> 3
Asp Ser Phe Xaa Xaa Leu Met
1 5
<210> 4
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> ACETYLATION with Succinyl
<220>
<221> MOD_RES
<222> (3)..(3)
<223> D-Trp
<220>
<221> MOD_RES
<222> (4)..(4)
<223> MeVal
<220>
<221> MOD_RES
<222> (5)..(5)
<223> bAla
<220>
<221> MOD_RES
<222> (7)..(7)
<223> AMIDATION
<400> 4
Asp Ile Trp Xaa Xaa Leu Met
1 5
<210> 5
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> ACETYLATION with Succinyl
<220>
<221> MOD_RES
<222> (2)..(2)
<223> D-Trp
<220>
<221> MOD_RES
<222> (3)..(3)
<223> MeVal
<220>
<221> MOD_RES
<222> (4)..(4)
<223> bAla
<220>
<221> MOD_RES
<222> (6)..(6)
<223> AMIDATION
<400> 5
Asp Trp Xaa Xaa Leu Met
1 5
<210> 6
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> ACETYLATION with Succinyl
<220>
<221> MOD_RES
<222> (3)..(3)
<223> D-Trp
<220>
<221> MOD_RES
<222> (4)..(4)
<223> MeVal
<220>
<221> MOD_RES
<222> (5)..(5)
<223> bAla
<220>
<221> MOD_RES
<222> (7)..(7)
<223> AMIDATION
<400> 6
Asp Ser Trp Xaa Xaa Leu Met
1 5
<210> 7
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> MeVal
<220>
<221> MOD_RES
<222> (2)..(2)
<223> bAla
<400> 7
Xaa Xaa Leu Met
1
- 还没有人留言评论。精彩留言会获得点赞!