发酵生产DHA的方法与流程
本发明属于微生物发酵领域,具体涉及一种发酵生产DHA的方法。
背景技术:
裂殖壶菌(Schizochytriumlimacimum)主要从海洋环境中获得,为满足其合适生长条件及大量合成DHA油脂的需求,实现裂殖壶菌大规模发酵生产,一般选择使用成分极为复杂的培养基进行培养,授权公告号CN101519676A的专利公开了发酵培养基的组分,其成分复杂,使用葡萄糖、酵母膏、硫酸钠、磷酸钠、磷酸氢二钾、玉米浆、叶绿素、VB1、VB12、味精、海盐、七水硫酸镁、谷氨酸、贝塔胡萝卜素、VB6等组成的复合培养基,培养基成分复杂,在发酵过程中还需要调整pH,对发酵条件要求较高,原料成本较高,因此,需要通过不断优化裂殖壶菌发酵培养基的配方,降低DHA生产成本,从而能够大量生产绿色、安全、廉价的DHA(二十二碳六烯酸)含量高DHA藻油,进而降低含DHA终端产品价格,降低DHA的使用门槛,使其在普通大众消费者中能够得到大力的推广和普及使用。另一方面,在目前的玉米加工产业中,主要获取的是玉米淀粉,全世界淀粉产量4500万吨,其中80%以上是玉米淀粉。而目前的玉米加工产业中,玉米加工副产物一般被加工为饲料,玉米加工副产物的剩余价值没有得到有效开发。本领域的常识,“玉米加工副产物”是指在玉米加工为淀粉过程中废弃的用于加工为饲料的部分,其主要成分为玉米浆(玉米浸渍物)、玉米皮、玉米麸,有时会有少量的玉米胚芽饼,蛋白质含量10%-25%,粗纤维7%-10%;因此,对于本领域技术人员而言,“玉米加工副产物”的概念是清楚的。以湿法生产玉米淀粉的工厂为例,规模较大、生产技术先进的大厂的玉米加工副产物主要为玉米皮,玉米皮占到玉米原料的14%,其他玉米加工副产物有玉米浆、玉米麸、玉米胚芽饼,目前较为先进的处理方式主要是将玉米皮与干燥和浓缩玉米浆及部分麸料、胚芽饼混合制成玉米纤维蛋白饲料。(甘在红,邵彩梅.玉米深加工淀粉副产物的蛋白选择和应用(J).新饲料,2007(9):42-45)。将玉米加工副产物仅加工为饲料并没有很好的挖掘出玉米加工副产物的剩余价值,玉米加工副产物还有很大的进一步利用的空间,而且玉米加工副产物中还含有2%的亚油酸,其在生物合成途径上是DHA的前体化合物,所以应用玉米加工副产物作为裂殖壶菌发酵生产DHA的原料有着天然优势。而且目前市面上常见的DHA产品还存在氧化稳定性较差的缺点,根据GB26400-2010中的表述,DHA藻油必须贮存于密封、避光、充氮容器中,并且于-5℃以下冻存。
技术实现要素:
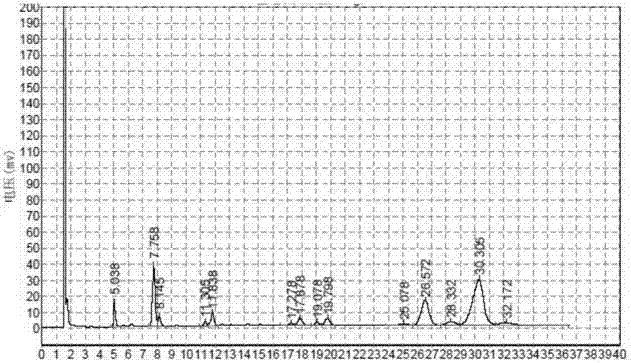
本发明的目的在于克服现有技术的缺陷,提供一种发酵生产DHA的方法。本发明的方法,最终制备的产物中DHA的含量显著上升,并且DHA中的脂肪酸发生显著,十六烷酸的含量显著上升,其含量可达到45.8%,具有意想不到的技术效果,同时,产物中DHA的含量也显著上升,可达到47%,并且DHA油脂的氧化稳定性显著提升,氧化诱导期由之前的1.1小时提高到21.2小时,最高可达22.6h,产生了意想不到的技术效果。本发明是通过以下的技术方案实现的,本发明涉及一种发酵生产DHA的方法,包括如下步骤,以玉米加工副产物作为原料,采用裂殖壶菌(Schizochytriumsp.)进行发酵,得到产物DHA。优选地,所述方法包括如下步骤:步骤一,采用常规方法,对裂殖壶菌(Schizochytriumsp.)进行摇瓶种子培养和种子扩大培养;步骤二,取种子扩大培养的种子液,放入装有发酵培养基的发酵生产罐进行放大培养,处理,获得DHA。优选地,所述摇瓶培养包括如下步骤:取摇瓶种子培养基,接入裂殖壶菌,按体积比计,接种量为1-10%,摇床转速180rpm、25.0℃的条件下进行摇瓶培养。优选地,所述种子扩大培养包括如下步骤:取摇瓶种子培养48小时后获得的种子液,接入5-50L的种子培养罐,按体积比计,接种量为3-5%,摇床转速180rpm、25.0℃、通气比为1.2vvm的条件下,进行种子扩大培养。优选地,所述种子培养基的组分为,每1L培养基中,葡萄糖40-60.0g,酵母抽提物4-6g,蛋白胨2-4g,MgSO41-3g,KH2PO41-3g,余量为水。优选地,所述种子培养基的组分为,每1L培养基中,葡萄糖50.0g,酵母抽提物5.0g,蛋白胨3.0g,MgSO42.0g,KH2PO42.0g,余量为水。优选地,所述放大培养包括如下步骤:取种子扩大培养48小时后获得的种子液,接入100-500000L发酵生产罐中进行培养,所述发酵生产罐中装有发酵培养基,发酵,得到DHA。优选地,所述发酵培养基的组分含量如下,每1L培养基中,含有玉米加工副产物80-160g,葡萄糖10-30g,酵母抽提物5-15g,MgSO40.5-1.5g,KH2PO42-4g,Na2SO45.0-12.0g,海水晶5-20g,余量为水。优选地,所述发酵培养基的组分含量如下,每1L培养基中,含有玉米加工副产物120g,葡萄糖20.0g,酵母抽提物10.0g,MgSO41.0g,KH2PO43.0g,Na2SO45.0-12.0g,海水晶15g,余量为水。优选地,所述发酵培养基的制备包括如下步骤:取玉米加工副产物,之后加入相应的水,直接通入蒸汽加热,保持121℃,0.1MPa的条件1-3小时,加入其余物质,进行全罐实消,获得发酵培养基。优选地,所述玉米加工副产物与葡萄糖的含量比为3-5:1。优选地,所述玉米加工副产物与酵母抽提物的含量比为10-15:1。优选地,所述处理包括如下步骤:离心或过滤,收集菌体,50-80℃下干燥,粉碎,采用正己烷萃取,回收正己烷,得富含DHA的油脂,得到DHA。优选地,步骤二中,所述放大培养包括如下步骤:按体积比计算,取种子扩大培养的种子液与发酵培养基的比例为4:100;通气比0.5-1.5vvm,通过控制搅拌转速调节溶氧水平,发酵1-3天控制溶氧值15-25%,发酵4-7天控制溶氧值5-20%,从发酵第3天开始流加300-700g/L的玉米加工副产物溶液,流加速度为10g每升每小时。与现有技术相比,本发明具有如下的有益效果:现有技术中通常分别采用葡萄糖作为唯一的碳源和酵母浸粉作为唯一的氮源,本发明的方法利用玉米加工副产物,实现部分替代常规方法中的葡萄糖及酵母浸粉,完全替代发酵原料中的其它所有有机组分,降低了生产成本,更加利于工业化规模生产;本发明方法的整个发酵过程中,无需调控pH值,降低了生产成本,提高了生产效率;本发明的方法能够最大限度的使用玉米加工副产物中的各组分,根据甘在红等的研究结果,玉米副产物中含有丰富糖类、可观的蛋白质、氨基酸等组分,这些有机组分分别是微生物生长过程中所需的碳源及氮源,并且玉米加工副产物还有诸多微量元素及生物素,利于微生物的生长及产物积累。本发明的方法,最终制备的产物中DHA的含量显著上升,并且DHA中的脂肪酸发生显著,十六烷酸的含量显著上升,其含量可达到45.8%,具有意想不到的技术效果,同时,产物中DHA的含量也显著上升,可达到47%,并且DHA油脂的氧化稳定性显著提升,氧化诱导期由之前的1.1小时提高到21.2小时,最高可达22.6h,产生了意想不到的技术效果。本发明涉及的裂殖壶菌(Schizochytriumsp.)已经在《一种裂殖壶菌的发酵生产工艺》(公告号CN101824442B)中公开,属于现有技术。附图说明通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:图1为使用玉米加工副产物部分替换葡萄糖及酵母浸粉后的脂肪酸组成图;图2为使用玉米加工副产物部分替换葡萄糖及酵母浸粉前的脂肪酸组成图。具体实施方式下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。实施例1本实施例涉及一种发酵生产DHA的方法,包括如下步骤:步骤1,配制种子培养基;所述种子培养基的组分为,每1L培养基中,葡萄糖50.0g,酵母抽提物5.0g,蛋白胨3.0g,MgSO42.0g,KH2PO42.0g,余量为水;pH为6.0,121℃,灭菌30min;步骤2,配制发酵培养基;(a)葡萄糖100.0g/L,酵母浸粉15.0g/L,叶绿素1g/L,VB10.1g/L,VB120.1g/L,VB60.1g/L,味精8g/L,谷氨酸4g/L,生物素0.1g/L,β胡萝卜素0.1g/L,MgSO41.0g/L,KH2PO43.0g/L,Na2SO412.0g/L,海水晶15g/L,余量为水,发酵过程中控制pH5.5-6.5。(b)玉米加工副产物120g/L,葡萄糖20g/L,酵母抽提物5g/L,MgSO41.0g/L,KH2PO43.0g/L,Na2SO412.0g/L,海水晶15g/L,余量为水,发酵过程中pH自然。步骤3,摇瓶种子培养和种子扩大培养;在250mL三角瓶中加入50mL种子培养基,接种量4%,在培养温度25℃,摇床转速180rpm条件下培养2天;步骤4,发酵培养;在250mL三角瓶中加入50mL发酵培养基,将裂殖壶菌以4%的接种量接入发酵培养基;分别采用组分为(a)和(b)的发酵培养基进行发酵;培养基初始pH为6.0,摇床转速180rpm,在26℃的条件下培养7天。培养结束后,6000g离心10min将菌体与发酵液分离,80℃高温干燥6h后,测其生物量,DHA含量及DHA氧化稳定性;发酵结果如表1所示。表1使用玉米加工副产物前后的发酵产物对比培养基成分生物量g/LDHA含量%DHA藻油氧化稳定性/hI40±233-381.1±0.1II45±240-4521.2±2注:DHA含量测定方法按照GB26400-2010中所规定的测定方法进行。DHA藻油的氧化稳定性以氧化诱导期计量,采用瑞士Metrohm公司产743Rancimat进行,进样量为4mL,测试温度120℃,空气流量20L/h。图1为使用玉米加工副产物部分替换葡萄糖及酵母浸粉后的脂肪酸组成图;图2为使用玉米加工副产物部分替换葡萄糖及酵母浸粉前的脂肪酸组成图。由图1和图2的对比,以及表1的结果可知,相对于传统的发酵培养基,本实施例的方法最终制备的产物中DHA的含量显著上升,可达到40-45%,并且DHA油脂的氧化稳定性显著提升,氧化诱导期由1.1小时提高到21.2小时,产生了意想不到的技术效果。并且DHA中的脂肪酸发生显著,十六烷酸的含量显著上升,其含量可达到35-45%,具有意想不到的技术效果。实施例2本实施例涉及一种发酵生产DHA的方法,包括如下步骤:步骤1,配制种子培养基;所述种子培养基的组分为,每1L培养基中,葡萄糖50.0g,酵母抽提物5.0g,蛋白胨3.0g,MgSO42.0g,KH2PO42.0g,余量为水;pH为6.0,121℃,灭菌30min;步骤2,配制发酵培养基;所述发酵培养基的组分为,每1L培养基中,含有玉米加工副产物120g,葡萄糖20.0g,酵母抽提物10.0g,MgSO41.0g,KH2PO43.0g,Na2SO412.0g,海水晶15g,余量为水;121℃,灭菌30min,冷却备用;步骤3,摇瓶种子培养和种子扩大培养;取1mL-80℃冰箱冻存的裂殖壶菌(Schizochytriumsp.)菌种甘油管,接种至含有200mL上述种子培养基的500mL三角瓶中,在25℃的摇床中以180rpm转速培养48小时;再取120mL培养液按4%接种量接入装有60L种子培养基的100L种子罐中,在培养温度25℃,搅拌转速180rpm,通气比1.2vvm的条件下,培养48小时;步骤4,放大培养;将60L二级种子液接入含300L如上所述种子培养基的500L种子罐中,在25℃培养条件下,控制溶解氧浓度维持在20%,培养48小时;将300L三级种子液接入含30000L如上述发酵培养基的50000L发酵罐中,维持发酵温度25℃,前3天控制溶氧值维持在25%左右,发酵第3天开始补加500.0g/L的玉米加工副产物溶液,流加速度为10g每升每小时,并通过调节转速控制溶氧值维持在15%左右,至发酵第6天停止流加。第8天结束发酵,6000g离心10min收集菌体(过滤同样可以),50-80℃下干燥,粉碎,采用正己烷萃取,回收正己烷,得富含DHA的油脂,此时菌体干重达50.7g/L,DHA产量7.52g/L,DHA含量47%,DHA氧化诱导期为22.6h,十六烷酸的含量显著上升,其含量可达到45.8%。同时,申请人发现,当裂殖壶菌(Schizochytriumsp.)采用本实施例配方的种子培养基和发酵培养基配方,同时在本实施例的发酵条件下进行发酵时,能够实现最好的效果,各种指标均为最高,适宜实际的工业化生产,具有非常高的实践生产应用价值。实施例3本实施例涉及一种发酵生产DHA的方法,包括如下步骤:步骤1,配制种子培养基;所述种子培养基的组分为,每1L培养基中,葡萄糖40.0g,酵母抽提物4.0g,蛋白胨2.0g,MgSO41.0g,KH2PO41.0g,余量为水;pH为6.0,121℃,灭菌30min;步骤2,配制发酵培养基;所述发酵培养基的组分为,每1L培养基中,含有玉米加工副产物80g,葡萄糖10.0g,酵母抽提物5.0g,MgSO40.5g,KH2PO42.0g,Na2SO45.0g,海水晶5g,余量为水;121℃,灭菌30min,冷却备用;步骤3,摇瓶种子培养和种子扩大培养;取1mL-80℃冰箱冻存的裂殖壶菌(Schizochytriumsp.)菌种甘油管,接种至含有200mL上述种子培养基的500mL三角瓶中,在25℃的摇床中以180rpm转速培养48小时;再取120mL培养液按5%接种量接入装有60L种子培养基的100L种子罐中,在培养温度25℃,搅拌转速180rpm,通气比1.2vvm的条件下,培养48小时;步骤4,放大培养;将60L二级种子液接入含300L如上所述种子培养基的500L种子罐中,在25℃培养条件下,控制溶解氧浓度维持在20%,培养48小时;将300L三级种子液接入含30000L如上述发酵培养基的50000L发酵罐中,维持发酵温度25℃,前3天控制溶氧值维持在25%左右,发酵第3天开始补加500.0g/L的玉米加工副产物溶液,流加速度为10g每升每小时,并通过调节转速控制溶氧值维持在15%左右,至发酵第6天停止流加。第8天结束发酵,6000g离心10min收集菌体,菌体干燥、粉碎破壁与油脂提取后取样检测,此时菌体干重达50.0g/L,DHA产量7.01g/L,DHA含量43%,DHA氧化诱导期为21.9h,十六烷酸的含量达到40.8%。实施例4本实施例涉及一种发酵生产DHA的方法,包括如下步骤:步骤1,配制种子培养基;所述种子培养基的组分为,每1L培养基中,葡萄糖60.0g,酵母抽提物6.0g,蛋白胨4.0g,MgSO43.0g,KH2PO43.0g,余量为水;pH为6.0,121℃,灭菌30min;步骤2,配制发酵培养基;所述发酵培养基的组分为,每1L培养基中,含有玉米加工副产物160g,葡萄糖30.0g,酵母抽提物15.0g,MgSO41.5g,KH2PO44.0g,Na2SO412.0g,海水晶20g,余量为水;121℃,灭菌30min,冷却备用;步骤3,摇瓶种子培养和种子扩大培养;取1mL-80℃冰箱冻存的裂殖壶菌(Schizochytriumsp.)菌种甘油管,接种至含有200mL上述种子培养基的500mL三角瓶中,在25℃的摇床中以180rpm转速培养48小时;再取120mL培养液按5%接种量接入装有60L种子培养基的100L种子罐中,在培养温度25℃,搅拌转速180rpm,通气比1.2vvm的条件下,培养48小时;步骤4,放大培养;将60L二级种子液接入含300L如上所述种子培养基的500L种子罐中,在25℃培养条件下,控制溶解氧浓度维持在20%,培养48小时;将300L三级种子液接入含30000L如上述发酵培养基的50000L发酵罐中,维持发酵温度25℃,前3天控制溶氧值维持在25%左右,发酵第3天开始补加500.0g/L的玉米加工副产物溶液,流加速度为10g每升每小时,并通过调节转速控制溶氧值维持在15%左右,至发酵第6天停止流加。第8天结束发酵,6000g离心10min收集菌体,菌体干燥、粉碎破壁与油脂提取后取样检测,此时菌体干重达50.3g/L,DHA产量7.05g/L,DHA含量44%,DHA氧化诱导期为21.5h,,十六烷酸的含量达到42.1%。同时,申请人意外地发现,若能够在发酵培养基中,控制玉米加工副产物与葡萄糖的含量比为3-5:1;或者控制玉米加工副产物与酵母抽提物的含量比为10-15:1,能够实现效果较好的发酵结果,同时不会造成玉米加工副产物、葡萄糖或酵母抽提物的浪费;申请人还发现,在制备发酵培养基时,取玉米加工副产物,之后加入相应的水,直接通入蒸汽加热,保持121℃,0.1MPa的条件1-3小时,加入其余物质,进行全罐实消,获得发酵培养基更加利于发酵,提高发酵的效率。综上所述,现有技术中通常分别采用葡萄糖作为唯一的碳源和酵母浸粉作为唯一的氮源,本发明的方法利用玉米加工副产物,实现部分替代常规方法中的葡萄糖及酵母浸粉,完全替代发酵原料中的其它所有有机组分。本发明方法的整个发酵过程中,无需调控pH值,降低了生产成本,提高了生产效率;本发明的方法能够最大限度的使用玉米加工副产物中的各组分,根据甘在红等的研究结果,玉米副产物中含有丰富糖类、可观的蛋白质、氨基酸等组分,这些有机组分分别是微生物生长过程中所需的碳源及氮源,并且玉米加工副产物还有诸多微量元素及生物素,利于微生物的生长及产物积累。本发明的方法,最终制备的产物中DHA的含量显著上升,并且DHA中的脂肪酸发生显著,十六烷酸的含量显著上升,其含量可达到45.8%,具有意想不到的技术效果,同时,产物中DHA的含量也显著上升,可达到47%,并且DHA油脂的氧化稳定性显著提升,氧化诱导期由之前的1.1小时提高到21.2小时,最高可达22.6h,产生了意想不到的技术效果。以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1