高度选择性核酸扩增引物的制作方法
本申请要求2013年2月7日递交的美国临时申请号61/762,117的优先权。该申请的内容通过引用以其全文并入本文。
技术领域
本发明涉及引物依赖的核酸扩增反应,特别是DNA扩增反应(如PCR),以及用于这样的反应的引物、反应混合物和试剂盒以及采用其的测定。
背景技术:
引物依赖的核酸扩增反应需要“特异性”,反应可以包括扩增产物(“扩增子”)的检测,即引物与核酸链中预期的位置的退火以及仅结合预期的靶序列的引物的延伸。常规地,通过使引物足够长,使得在扩增反应条件下,主要是在引物退火步骤过程中,引物只到达核酸链中的一个位置获得特异性。
某些扩增反应旨在在等位基因变体(例如单核苷酸多态性(SNP))之间进行区分。做到这一点的一种方法是扩增所有的变体并通过等位基因特异性杂交探针(如分子信标探针)在它们之间进行区分。对于这样的方法,扩增引物与所有变体平等互补从而扩增包括在等位基因之间变异的序列的区域,并且探针鉴定存在于所扩增的产物中的等位基因。参见例如Tyagi et al.(1998)Nature Biotechnology 16:49-53。如果所研究的序列是等位基因,如存在于与另一个等位基因的混合物中的SNP,例如野生型(WT)变体,由于占优势的等位基因的扩增倾向压过稀有等位基因的扩增,使用探针进行区分具有大约3%(在1,000,000个分子的备选等位基因的存在下不少于大约30,000个靶等位基因分子)的实际检测限。
在等位基因之间进行区分的另一个途径是使用选择性针对所研究的序列的引物。对于这样的方法,引物与等位基因之间变异的序列互补,并且可以通过标记的引物、DNA结合染料或标记的探针(在这种情况下,探针检测所有等位基因扩增子的共同序列)检测扩增产物。典型地,高度特异性的引物具有15-30个核苷酸的长度。这样的针对一个等位基因的常规引物具有非常有限的相对于另一个等位基因的选择性。已知将引物变短会提高其选择性,但是因为该提高是来自特异性的消耗,并且因为短引物不大可能与其靶序列在典型退火温度形成稳定杂交,将引物变短对于分析等位基因的混合物价值有限。
已经开发了引物的其它修饰以提高它们的选择性同时保留其特异性。一种这样的方法是ARMS(“扩增阻滞突变系统”)。ARMS引物具有与被研究的序列变体互补但与另一个或另一些等位基因错配的3'-末端核苷酸。参见Newton et al.(1989)Nucleic Acids Res.17:2503-2516;和Ferrie et al.(1992)Am.J.Hum.Genet.51:251-262。ARMS依赖于某些DNA聚合酶的阻滞特性,即倾向于不延伸具有这样的错配的引物-靶杂交体。已经证实ARMS可有效用于确定杂合性(纯合WT、杂合或纯合突变体(MUT)),但其具有用于其它用途的大约1%的实际检测限(在1,000,000个分子的备选等位基因的存在下不少于大约10,000个靶等位基因分子)。
另一个方法是使引物成为发夹以提高其选择性。参见,Tyagi et al.欧洲专利EP 1 185 546(2008),其公开了制备与所研究的序列互补但与另一个或另一些等位基因错配的发夹环;以及Hazbón和Alland(2004)J.Clin.Microbiol.42:1236-1242,其公开了制备与所研究的序列变体互补但与另一个或另一些等位基因错配的发夹引物的3'臂的末端核苷酸,与ARMS一样。这些修饰也具有大约1%的实际检测限(在1,000,000个分子的备选等位基因的存在下不少于大约10,000个靶等位基因分子)。
韩国首尔Seegene生命科学院的Jong Yoon Chun及其同事已经设计了一类他们称为“双引发寡核苷酸(DPO)”的引物。参见Chun et al.(2007)Nucleic Acids Res.35(6)e40;Kim et al.(2008)J.Virol.Meth.149:76-84;Horii et al.(2009)Lett.Appl.Microbiol.49:46-52;WO 2006/095981 A1和WO 2007/097582 A1。DPO引物由以下三段组成:长的5'高温段(例如长20-25个核苷酸),五个脱氧核糖肌苷的中央分离段,以及3'引发段(一般长8-12个核苷酸),其与预期的靶序列互补但与其它靶序列错配。靶序列与所有三段互补,但由于其长度更短,3'段的Tm低于5'段的Tm,并且归因于所述五个脱氧核糖肌苷,分离段具有最低的Tm。设计DPO引物使得只有当5'段和3'段都与靶链杂交时才产生扩增。根据Chun et al.(2007),所述分离段被选择为五个脱氧核糖肌苷是因为3-4个和6-8个脱氧核糖肌苷不能给出好的结果;这样定位所述3'段从而提供40-80%的GC含量,并且提供的所述5'段的长度足以提高其Tm高于要在3'-RACE扩增中使用的退火温度(Nucleic Acids Res.35(6)e40的第二页)。Chun et al.报告,通过使用两对DPO引物,在CYP2C19中成功进行了SNP(G→A突变)的基因分型(纯合野生型、杂合或纯合突变体)。四个DPO引物中,一个具有12个核苷酸长的3'段,其与两个等位基因均完全互补(perfectly complementary);一个具有9个核苷酸长的3'段,其与两个等位基因均完全互补;并且两个具有位于中部即位于从3'末端数第四个核苷酸位置的可变异核苷酸的8个核苷酸长的3'段。通过凝胶电泳的方式完成基因分型。
存在这样的情况,其中期望在非常丰富的第二等位基因存在下检测非常稀有的第一等位基因。这已经被称为“灵敏度”。换句话说,所述引物不仅必须是“特异性的”(去到基因组中正确的位置),和必须是“选择性的”(拒绝与靶序列类似的野生型或其它丰富的序列),并且其必须具有高度选择性,即“灵敏得”足以在丰富的野生型或其它丰富的第二序列的存在下检测非常少的突变体或其它稀有的第一序列。参见Makarov和Chupreta的国际专利申请WO 2012/112 582 A2的第[0004]段。
为了提高灵敏度同时保持特异性和选择性,Swift Biosciences(Ann Arbor,Michigan,美国)的Vladimir Makarov及其同事公开了“不连续的多核苷酸[“引物”]设计”(WO 2012/112 582 A2的第[0051]段),其已经被商业化为myTTM引物。这样的引物可以被视为长的常规引物,其由两个寡核苷酸组成从而建立八个核苷酸的3'引发序列;并加入与该序列的5'末端和与其它另一个寡核苷酸的3'末端互补的尾以形成高温的茎。通过所述茎,两个寡核苷酸非共价结合并在与靶序列结合时形成稳定的三路交汇(three-way junction)。具有八个核苷酸的3'末端的寡核苷酸被称为“引物”,并且其它另一个寡核苷酸被称为“固定子(fixer)”。所述固定子的功能是提供特异性,即结合所述引物至基因组中预期的位置。因此其是长的,典型地大约长30个核苷酸。尾的功能是在扩增条件下杂交两个寡核苷酸,因此尾也相当长,形成长20-25个核苷酸的茎。八个核苷酸的3'区域的功能以选择性进行引发。该不连续杂交“有效稳定引物寡核苷酸的[引发]区域之间的结合,即使该区域小至八个碱基,从而提高PCR的效率。”(WO 2012/112582 A2)。WO 2012/112582 A2的实施例9-11中公开了进一步的改善。如同在ARMS中,与野生型靶错配的核苷酸形成3'末端核苷酸;扩增反应中包括第三个寡核苷酸,封闭寡核苷酸(“封闭子”)(其5'末端核苷酸与引物的3'末端核苷酸重叠并与野生型靶互补);并且引物的3'末端核苷酸由锁核酸(“LNA”)形成。对于K-ras和B-raf基因中多核苷酸多态性的检测,该发明公开了在14,000个野生型中一个突变体的检测灵敏度(大致0.01%)。
仍然有单个寡核苷酸引物的需要,所述引物具有在非常大量的第二靶序列的存在下检测并优选定量稀有第一靶序列(例如突变体靶序列)的数量,所述第二靶序列有少至单个核苷酸的与第一靶序列的不同,例如野生型序列。
技术实现要素:
本发明包括用于引物依赖的核酸扩增方法的多部分引物,其特别包括聚合酶链式反应(PCR)方法,其能够在稀有预期的靶(例如突变体DNA靶)和区别在于单个核苷酸取代(有时被称为多核苷酸多态性,简称SNP)的密切相关的序列(例如野生型DNA靶)之间进行区分。
本发明包括引物依赖的核酸扩增方法,例如PCR方法,其利用根据本发明的多部分引物并且其能够在一群丰富的密切相关的序列中选择性扩增一个或多个稀有靶序列。这样的预期的靶序列可以是稀有突变体序列,例如在恶性细胞中发现的序列、在正常细胞中发现的其它的丰富野生型群体。对于如利用DNA依赖的DNA聚合酶的PCR方法的方法,所预期的靶和相关序列是样品中存在的DNA序列,或者它们是样品中存在的通过逆转录反应由RNA序列(包括mRNA序列)所形成的cDNA序列。可以在与随后的扩增相同的反应混合物中进行逆转录,或者其可以在扩增之前单独进行。可以将多部分引物用作逆转录反应中的引物。本发明还包括扩增和检测方法,其包括扩增产物或“扩增子”的检测。下面的说明书包括实施例描述了多部分引物连同由DNA靶开始的PCR扩增反应。本领域技术人员会理解如何将这些教导应用于多部分引物连同其它引物依赖的核酸扩增方法。
本发明还包括含有用于进行这样的扩增方法(包括这样的扩增和检测方法)的试剂盒。
另外本发明尤其提出分子诊断的主要目的,其用于发现在含有非常丰富的正常细胞的临床样品中检测极其稀有的癌细胞的灵敏的和特异性的手段(借助于鉴定体细胞突变),并且能够定量确定它们的丰度。能够这么做有多个优点,包括:
1、治疗之后检测癌细胞的存在和丰度的能力(如在白血病患者的骨髓移植之后)。利用本发明将使临床医师能够确定(相当毒性的)药物的使用是否能够停止。本发明将使临床研究能够进行以确定可以由身体在没有药物治疗的情况下处理的最小剩余疾病的水平。此外,可以在治疗之后随时间监测患者以检测然后能够通过合适的手段进行治疗的更高水平的表象。
2、快速检测和定量在手术过程中获取的活检标本中稀有癌细胞的能力(处于太低的水平而不能被病理医生在显微镜中看到)。利用本发明将使外科医生能够合理决定手术的程度,省得去除未受影响的组织。
3、检测通过血中稀有循环肿瘤细胞的自然破坏过程释放进入血浆的DNA分子中关键突变的能力。利用本发明将能够早期检测肿瘤,这些细胞已经获得转移的能力,这给临床医师提供早期介入的机会。
4、监测其基因遗传表明在他们的生命过程中能够产生威胁生命的肿瘤(如在许多乳腺癌中)的患者的能力。利用本发明将能够定期进行监测以确定是否已经发生关键体细胞突变,使得可以在所述疾病的非常早的阶段提供治疗介入。
本领域技术人员将想到本发明的其它应用。
“稀有”和“丰富”是指预期的靶序列与密切相关序列的比是至少在1/103至1/107的范围内(即一千分之一、一万分之一、十万分之一、一百万分之一或一千万分之一)。“密切相关”是指与预期的靶序列有一个、两个或最多几个核苷酸的不同的序列。与野生型序列在特定位置有单个核苷酸不同的突变体靶序列通常被称为是或具有多核苷酸多态性(SNP)。
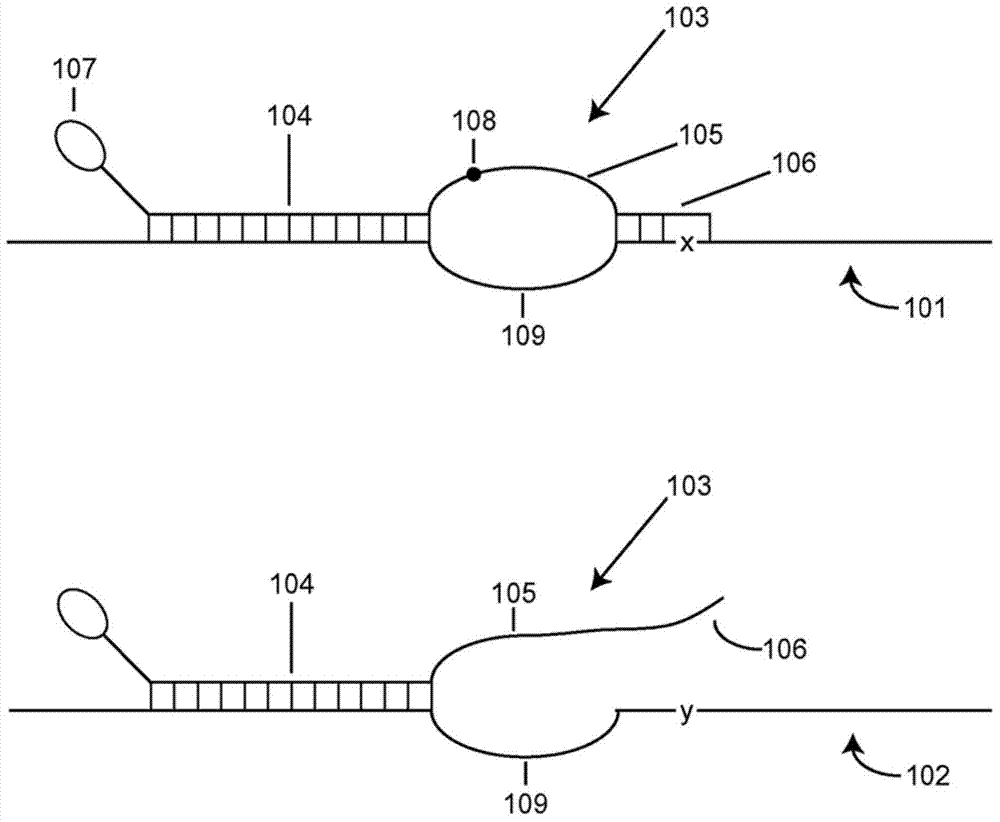
根据本发明的方法包括针对至少一个预期的靶序列(例如突变体DNA靶序列)的引物依赖的核酸扩增,其可以很少在含有丰富的密切相关的、未预期的靶序列(例如野生型DNA靶序列)的样品或反应混合物中存在。这些方法利用含有针对每个稀有靶的根据本发明的多部分引物的反应混合物。所述引物的三个部分彼此互相合作以产生极度选择性的扩增。图1是根据本发明的引物的代表示意图。图1包括两个示意图:上面的示意图显示在杂交条件(如在PCR循环的退火步骤过程中存在的)下相对于其预期的靶101(其可以是稀有的)的多部分引物103;和下面的示意图显示相对于密切相关的序列(本文中称为非预期的或错配的靶102)的相同的引物。预期的靶101和非预期的靶102具有相同的核苷酸序列,除了预期的靶101具有一个或多个核苷酸“x”(优选单个核苷酸),所述x不同于错配的靶102中的相应核苷酸,这里称为“y”。例如,非预期的靶序列102可以是野生型人DNA序列,且预期的靶序列101可以是含有SNP的突变体癌细胞序列。上面的示意图描绘了与预期的靶链101杂交的引物103。在5'至3'的方向中,所述引物包括锚定序列(anchor sequence)104、桥序列(bridge sequence)105和足序列(foot sequence)106。引物103任选可以包括5'尾107以赋予附加的功能性。其还任选包括封闭基团108。在扩增开始的引物退火过程中,锚定序列104与预期的靶101杂交,如在锚定序列和其结合位点之间的短垂直线所常规表示的(表示互补核苷酸的配对)。桥序列105与靶101在序列109(本发明人称其为“插入序列”)处是错配的(不是互补的),并造成双链体结构中的“泡”。足序列106与预期的靶101杂交并由DNA聚合酶引发复制。下面的示意图描绘了与非预期的、错配的靶102杂交的相同引物103。如所述,错配的靶102与预期的靶101在相对于引物足106的序列中有至少一个核苷酸改变(x至y)的不同。如所示,在扩增开始的引物退火过程中,锚定序列104与非预期的靶102在锚定序列结合位点处杂交。再次地,桥序列105与插入序列109错配。但是,足序列106不与靶102杂交,并且靶102不被引发复制。
在根据图1的理想扩增反应条件下,预期的靶101(即便是稀有的)将总会被复制,并且非预期的靶102(即便是丰富的)将永远不会被复制。然而,引发是一个统计问题。例如,引物以一定的频率发生到靶(go on target)和脱靶(go off target)、完全匹配和错配。结果,完美靶并不总是被复制,而错配的靶有时被复制。因此,选择性扩增和检测稀有靶既取决于完美靶被复制的频率又取决于错配的靶被复制的频率。用于本发明的多部分引物具有三个连续的序列(锚定序列、桥序列和足序列),其互相配合以实现实际扩增反应(包括扩增和检测测定)中非常高的选择性。锚定序列用于将所述引物以与常规引物的杂交没有什么不同的有效的方式与所述靶序列杂交,其在预期的靶和非预期的错配的靶中是相同的(或者几乎相同)。下文中更全面描述的桥序列和足序列配合以赋予引物特异性,即针对预期的靶超过错配的靶的特异性。本发明人已经发现,如果桥序列和足序列配合以使得预期的靶不太可能而不是可能复制的话,则可以实现高度的选择性。此外,本发明人使得桥序列能够快速(rabidly)和有效复制。桥序列优选为DNA序列。所实现的结果是预期的靶序列的扩增,其开始时是延迟的,但是一旦开始则正常进行;但是非预期的、错配的靶序列的扩增更加显著延迟但是一旦开始则正常进行。相对于匹配的靶,错配的靶的增加的延迟是由所述引物实现的选择性的提高。之所以实现了这样的提高的选择性,是因为被DNA聚合酶所复制的非预期的靶序列的概率至多为要被复制的预期的靶序列的概率的1/1,000、优选至多1/10,000以及更优选至多1/100,000。
通过参考图1,所述引物包括锚定序列104,其在扩增反应的引物退火步骤(其包括引物退火温度)过程中将所述引物与预期的靶和密切相关的靶序列中的结合位点杂交。在这方面,锚定序列与常规引物一样,并且像常规引物一样发挥功能。它可以与靶并与密切相关的序列完全互补,或者它可以含有一个或多个错配的核苷酸。在其被使用的扩增反应中,它通常具有至少等于或高于所述退火温度的解链温度Tm以增强杂交。在大多数实施例中,锚定序列的Tm高于引物退火温度3℃和10℃之间。到不被封闭基团阻止的程度下,在本发明中所使用的多部分引物的锚定序列的全部或部分被DNA聚合酶所复制。因为以高的、正常的PCR效率快速进行指数扩增,在复制的部分中含有非天然核苷酸、核苷酸模拟物和非天然核苷酸间键被限制到允许由DNA聚合酶快速和有效复制的类型和数量。本发明人倾向于锚定序列为DNA序列。
典型地,锚定序列104形成长15-40个核苷酸、优选长15-30个核苷酸以及更优选长20-30个核苷酸的探针-靶杂交体。如上所述,在引物退火期间较短的锚定序列必须仍然与其靶序列杂交,这通常意味着它们的Tm必须至少为50℃(例如66-72℃)。它可以与靶完全互补,或者它可以含有一个或多个错配;例如当人们正在研究其序列对锚定序列是可变的靶的情况下,人们可以选择这样的锚定序列104,其为没有与任何版本的靶完全互补但在引物退火期间与所有的变体杂交的共有序列。本发明人倾向于如典型地针对常规PCR引物那样,形成通常在15-30个碱基对范围内的锚定序列/靶杂交体的DNA锚定序列。本发明人在下面的实施例中证实锚定序列,其长24个核苷酸,其为DNA并且其与靶序列完全互补。除了其靶序列(即,预期的靶序列和非预期的、错配的靶序列),多部分引物不引发其它反应混合物中的其它序列。尽管常规引物必须被设计以实现该功能,对于锚定序列的要求并不严格,因为足序列帮助区分存在于样品中或可能存在于样品中的其它序列。
通过参见图1,引物包括足序列106,其与区域中预期的靶序列互补,所述区域包括核苷酸(SNP核苷酸),或在一些情况下包括两个核苷酸,所述核苷酸与非预期的、错配的靶序列不同。足序列可以与预期的靶序列完全互补,或者它可以含有一个或在一些情况下甚至两个核苷酸,所述核苷酸与预期的靶序列和非预期的靶序列是错配的。与错配的靶序列相比,足序列106总是与预期的靶序列更互补至少一个核苷酸。在扩增期间足序列被复制。因为以高、正常的PCR效率快速进行指数扩增,含有非天然核苷酸、核苷酸模拟物和非天然核苷酸间键被限制到允许由DNA聚合酶快速和有效复制的类型和数量。本发明人倾向于足序列为DNA序列。因为期望扩增子的后续指数扩增以高、正常的PCR效率进行,在足序列中含有非天然核苷酸、核苷酸模拟物和非天然核苷酸间键被限制到允许由DNA聚合酶有效复制的类型和数量。在优选的实施方案中,足序列为DNA序列,其与预期的靶序列完全互补并含有与非预期的靶序列中的核苷酸错配的单个核苷酸。
足序列106与预期的靶序列形成杂交体,杂交体长至少5个核苷酸,例如,在5-8个碱基对的范围内,优选在6-8个碱基对的范围内并且更优选长度不超过7个核苷酸,例如在6-7个碱基对的范围内。当锚定序列与预期的靶序列杂交时,对于足序列而言仅有一个结合位点。在引物设计中要考虑的问题是,因为足序列被缩短了,增加了可以具有另一个可能的结合位点的机会,特别是如果足序列被缩短至仅5个核苷酸。如本发明人在实施例中所证实的,当在足序列106的任意核苷酸位置上可以发生错配的核苷酸vs非预期的靶时,本发明人倾向于错配的核苷酸或者为3'末端核苷酸,如ARMS引物中的(Newton et al.(1989)Nucleic Acids Res.17:2503-2516;和Ferrie et al.(1992)Am.J.Hum.Genet.51:251-262),或者在来自足序列的3'端中残余一个核苷酸,本发明人有时称其为“3'倒数第二个核苷酸”。
通过再次参见图1,引物包括桥序列105,其被选中以使得在多部分引物与靶分子退火期间其不能与插入序列109杂交。桥序列或者,如果它含有封闭基团,其3'部分被DNA聚合酶复制。因为期望以高、正常的PCR效率快速进行扩增子的指数扩增,在桥序列的被复制部分中含有非天然核苷酸、核苷酸模拟物和非天然核苷酸间键被限制到允许由DNA聚合酶快速和有效复制的类型和数量。优选为DNA的桥序列。
在靶中,桥序列105与其相对的插入序列109形成在引物/预期的靶杂交体中的泡。泡的周长为桥序列105的长度加上插入序列109的长度,加上4(来自锚定序列杂交体的一对核苷酸和来自足序列杂交体的一对核苷酸)。桥序列和插入序列不必长度相等:任一个序列可以短于另一个序列。在某些实施方案中,插入序列的长度可以为零。在优选实施方案中,其长至少六个核苷酸。在更优选的实施方案中,其中桥序列和插入序列的长度的总和为至少24个核苷酸,本发明人倾向于插入序列具有至少八个核苷酸、更优选至少十个核苷酸的长度。桥序列应当至少长六个核苷酸。某些优选的实施方案具有长度相等的桥序列和插入序列。泡的周长可以短至16个核苷酸并且长至52个核苷酸,例如16-52个核苷酸、20-52个核苷酸或28-44个核苷酸。
作为设计多部分引物的一般性考虑,增加泡的周长并缩短足序列增加预期的靶在扩增中的延迟。在由特定数量的预期的靶序列所启始的反应中合成预定的可检测数量的扩增子所需的PCR循环数量(阈值循环,该反应的CT)可通过例如观察所插入染料Green的荧光强度(其强度反映在每个PCR循环期间存在的扩增子的数量)来进行测量。这提供了一种用于测量DNA聚合酶延伸多部分引物/非预期的靶杂交体的概率相对于DNA聚合酶延伸多部分引物/预期的靶杂交体的概率的差异的方法。鉴于扩增以指数倍增进行,10个循环的CT差异表示多部分引物/非预期的靶杂交体的延伸的概率为多部分引物/预期的靶杂交体的延伸的概率的1/1,000;13.3个循环的CT差异表示概率为1/10,000;大约16.6个循环的CT差异表示概率为1/100,000;以及20个循环的CT差异表示概率为一百万分之一。
在根据本发明的利用多部分引物的测定中,如通过向反应混合物加入Green染料获得的从每个PCR循环测量荧光强度的ΔCT所反映出的,在针对错配的靶序列所观察到的较高阈值循环和针对相同数量(例如106个复制)的预期的靶序列所观察到的较低阈值循环之间的差异应当为至少10个循环、优选至少12个循环、更优选至少14个循环、甚至更优选至少17个循环、甚至更优选至少18个循环以及最优选20个或更多个循环。在根据本发明的多部分引物替换精心设计的常规PCR引物的扩增反应中,在使用预期的靶序列所获得的阈值循环中存在延迟(ΔCT)。延迟的量取决于所比较的常规引物被设计得如何精良,但典型地与仅由多部分引物的锚定序列组成的常规引物相比,延迟为至少两个扩增循环,通常至少三个循环,并且有时至少八个循环或甚至十个循环。
根据本发明的方法的优选实施方案包括检测由稀有靶序列的扩增得到的产物。扩增的产物的检测可以在扩增之后分开进行,例如通过凝胶电泳。在优选的实施方案中,检测试剂被包括于扩增反应混合物中,在这种情况下,检测可以是“实时的”,即在扩增进程期间的多个时机进行,或者是“终点的”,即在扩增反应结束之后进行,优选通过不打开反应容器的同相(homogeneous)检测。检测试剂包括DNA结合染料,例如Green、产生扩增产物的信号的双标记荧光探针,例如分子信标探针,以及结合染料和由从染料的激发所刺激的荧光探针的组合。此外,如本文所述,引物自身可以包括荧光标记,荧光标记仅当引物被掺入至扩增子时(或者备选地,当引物结合至互补的扩增子时)发出荧光。
本发明包括用于扩增至少一种靶序列的反应混合物。反应混合物包括用于每种预期的靶序列的引物对,每个引物对中的一个引物为如本文所述的多部分引物。反应混合物还包括用于扩增靶的试剂,包括脱氧核糖核苷三磷酸、扩增缓冲液和DNA聚合酶。用于根据本发明的测定方法的优选反应混合物还包括检测试剂,即DNA结合染料、杂交探针(或二者都包括),或者每个多部分引物的5'功能尾。如果起始样品含有RNA,扩增反应混合物还可以包括逆转录酶和用于逆转录反应的引物。
本发明还包括用于进行针对一种或多种预期的靶序列的上述扩增反应和扩增与检测反应的试剂盒的产品。试剂盒包括寡核苷酸和建立根据本发明的反应混合物所需的试剂。用于起始样品是RNA的试剂盒可以包括用于逆转录的试剂。
本发明的一个或多个实施方案的细节阐述于以下说明书中。从说明书和权利要求书可以明显得到本发明的其它特征、目的和优点。
附图说明
图1是在本发明中有用的多部分引物的示意图,所述引物与其预期的靶序列杂交并与和预期的靶序列有一个或多个核苷酸取代的不同的错配序列杂交。
图2是扩增循环的示意图,其中本发明的多部分引物先被复制,以及在接下来的两个循环中所得到的扩增子随后的复制。
图3是根据本发明的多部分引物的示意图,其显示用于放置封闭基团的位置,所述封闭基团终止DNA聚合酶的复制。
图4是几种示例性任选的5'功能部分的示意图。
图5显示由以下所获得的实时荧光结果:常规线性引物和或者1,000,000个预期的靶序列或者1,000,000个非预期的、错配的靶序列(其在位于引物结合的序列的中部的单个核苷酸处彼此不同)。
图6显示由以下所获得的实时荧光结果:ARMS引物和或者1,000,000个预期的靶序列或者有单个核苷酸不同的1,000,000个非预期的、错配的靶序列,其中引物中的“查询(interrogating)核苷酸”(其与预期的靶序列中的相应核苷酸互补,但与非预期的靶序列中的相应核苷酸不互补)为引物的3'末端核苷酸;并且该图还显示了由类似引物所获得的结果,其中查询核苷酸位于该引物3'端的倒数第二个核苷酸处。
图7显示由根据本发明的多部分引物在以下反应中所获得的实时荧光结果:反应含有或者1,000,000分子的引物的预期的靶序列或者1,000,000分子的引物的非预期的靶序列(其中多部分引物具有在足序列的倒数第二个位置处的查询核苷酸)。
图8显示由根据本发明的多部分引物在以下一系列反应中所获得的实时荧光结果:每个反应含有1,000,000个非预期的靶序列和或者:0、10、100、1,000、10,000、100,000或者1,000,000个预期的靶序列。
图9是显示图8中所显示的每个反应所观察的阈值循环vs每个反应中存在的预期的靶的数量的对数之间的反向线性关系的图,并且该图中的虚线表示含有1,000,000个非预期的靶序列和不含有预期的靶序列的反应所获得的阈值循环。
图10是显示用与图8和图9中所示实验所使用的相同稀释系列所获得的结果的图,其使用了三种其它方面相同的多部分引物,其足序列长为或者6、7或者8个核苷酸(其中查询核苷酸位于每个足序列中的倒数第二个位置)。
图11是显示用与图8、图9和图10中所示实验所使用的相同稀释系列所获得的结果的图,其使用了在靶分子中具有相同长度的插入序列的三种多部分引物,其桥序列形成不同周长的泡。
图12显示由以下所获得的一系列实时荧光结果的图:根据本发明的其它方面相同的多部分引物和或者1,000,000个预期的靶序列或者1,000,000个非预期的靶序列(其与预期的靶序列不同在于单核苷酸多态性),其中引物的足序列中的查询寡核苷酸(其与预期的靶序列中的相应核苷酸互补,但与非预期的靶序列中的相应核苷酸不互补)位于相对于引物3'端的不同位置。
图13显示由以下所获得的一系列实时荧光结果的图:根据本发明的多部分引物和或者1,000,000个预期的靶序列或者有单个核苷酸不同的1,000,000个非预期的靶序列,其中在靶分子中桥序列的长度加上插入序列的长度保持恒定(即泡的周长相同),但其中在靶分子中由桥序列和插入序列形成的泡的对称性(那些序列的相对长度)是变化的。
图14是显示所观察的阈值循环和在一系列反应中V600E突变体人B-raf靶序列的数量的对数之间的反向线性关系的图,其中每个反应含有1,000,000个野生型人B-raf靶序列和或者:10、100、1,000、10,000、100,000或1,000,000个V600E突变体人B-raf靶序列。虚线表示由反应所获得的阈值循环,反应含有来自1,000,000个野生型人B-raf靶序列的DNA并且不含有来自V600E突变体人B-raf靶序列的DNA。
图15是显示所观察的阈值循环和在一系列反应中存在的突变体靶序列的数量的对数之间的反向线性关系的图,其中每个反应含有分离自培养的正常人细胞的基因组DNA中存在的10,000个野生型靶序列和或者:10、30、100、300、1,000、3,000或10,000个分离自培养的在EGFR基因中具有T790M突变的人癌症细胞的基因组DNA中存在的突变体靶序列。虚线表示由反应所获得的阈值循环,所述反应含有10,000个野生型靶序列并且不含有来自癌细胞的DNA。
图16显示与图9中所示的实验结果类似的实验结果,除了Applied Biosystems的PRISM 7700荧光分光光度热循环仪被用于替代Bio-Rad的IQ5荧光分光光度热循环仪进行所述实验。
图17显示由根据本发明的多部分引物在以下反应中所获得的实时荧光结果:反应含有或者1,000,000分子的引物的预期的靶序列或者1,000,000分子的引物的非预期的靶序列(其中多部分引物具有在足序列的倒数第二个位置处的查询核苷酸)(图A),以及,缺少3'倒数第二个和3'末端核苷酸的截短形式的引物的实时荧光结果(图B)。
图18是根据本发明的两种多部分引物的示意图,其可以用于针对两个密切相关的预期的靶序列的多重反应。
图19是两种多部分引物和两种分子信标探针的示意图,其可以用于针对两个密切相关的预期的靶序列的多重反应。
具体实施方式
本发明(至少部分)基于用于引物依赖的扩增反应的多部分引物的独特设计。因此,本发明公开了多部分引物的设计和特征,当它们与存在于原始样品中的模板杂交时呈现出非凡的选择性。由于该非凡的选择性,本发明人将本发明的多部分引物称之为“超级选择性”引物。
突出的是,一旦在突变的模板上起始合成,所得到的扩增子高效指数扩增,并且实时数据提供了评估在原始样品中存在的突变体模板的丰度的常规方法。以下所述的实验证实了超级选择性引物有足够的鉴别能力来抑制野生型序列的合成到这样的程度,使得少至10个分子的突变体序列能够在含有1,000,000个分子的野生型序列的样品中得到可靠的检测,甚至是当突变体和野生型之间的唯一差别为多核苷酸多态性。
1.引物依赖的扩增反应
在本发明的方法中有用的引物依赖的扩增反应可以是任何合适的指数扩增方法,其包括聚合酶链式反应(PCR),对称的或非对称的,连接酶链式反应(LCR),切口平移酶扩增反应(NEAR),链置换扩增(SDA),基于核酸序列的扩增(NASBA),转录介导的扩增(TMA)和滚环循环扩增(RCA)。优选地,方法利用PCR。在非对称的PCR扩增方法中(例如不对称PCR),一个引物(限制性引物)以限制性的量存在使得在完成扩增之前被耗尽,其后使用其余引物(过量引物)发生线性扩增。在本发明中有用的非对称的PCR方法是LATE-PCR(参见例如欧洲专利EP 1,468,114;和Pierce et al.(2005)Proc.Natl.Acad.Sci.USA 102:8609-8614)。如果使用非对称的扩增方法,多部分引物优选为过量引物。优选的方法还包括数字PCR(参见例如Vogelstein and Kinzler(1999)Proc.Natl.Acad.Sci.USA 98:9236-9241),其中期望从在含有大量野生型分子的反应中存在的单个突变体模板分子检测大量的扩增子。
如果扩增反应利用RNA依赖的DNA聚合酶(一个例子为NASBA),那么扩增反应是等温的。本发明人将扩增产物的合成的重复轮次称为“循环”,但是它们不是热循环。对于这样的扩增,由根据本发明的多部分引物引发的“预期的靶序列”和“非预期的靶序列”是在原始样品中和在扩增反应混合物中存在的RNA序列,其中它们与DNA聚合酶和多部分引物一起存在。
如果扩增反应利用DNA依赖的DNA聚合酶(一个例子为PCR),那么原始样品可以含有DNA或者RNA靶。对于这样的扩增,由根据本发明的多部分引物引发的“预期的靶序列”和“非预期的靶序列”是或者在原始样品中存在的DNA序列或者通过逆转录原始样品中存在的RNA序列所制备的DNA序列。如果多部分引物被用于逆转录,那么“预期的靶序列”和“非预期的靶序列”是RNA以及cDNA。如果分开的、外部的引物被用于逆转录,那么“预期的靶序列”和“非预期的靶序列”是cDNA。在任一种情况下,“预期的靶序列”和“非预期的靶序列”是存在于具有DNA聚合酶和多部分引物的扩增反应混合物中的核酸序列。引物依赖的扩增反应包含引物退火、引物延伸和链变性(解链)的重复热循环。引物退火可以在低于引物延伸温度的温度下进行(例如,三个温度的PCR),或者引物退火和引物延伸可以在相同的温度下进行(例如,两个温度的PCR)。反应的总体热参数(profile)可以包括特定循环的重复,或者温度/次数在一个或多个循环期间可以改变。例如,一旦扩增已经开始并且多部分引物的引发序列被延长,适合于更长引物的更高退火温度可以被用于完成扩增反应。
根据本发明的测定方法包括扩增的靶序列的检测。根据本发明的方法不限于特定的检测方案(scheme)。可以在扩增之后进行检测,如通过凝胶电泳。备选地,可以在单个试管、孔或者其它反应容器中在扩增反应期间(实时)或在扩增反应结束(终点)时使用扩增期间存在的试剂进行同相检测。备选地,通过使用微流体装置,扩增的产物可以被移至室中,在室中它们与一种或多种检测试剂或分离试剂(如固定化的捕获探针)接触。检测试剂包括双链DNA结合染料,例如SYBR Green,以及一旦杂交则产生信号的荧光或发光标记的杂交探针,例如分子信标探针或探针或在扩增期间裂解的探针,例如5'-核酶()探针。
2.多部分引物
如上所述,本发明的方法包括用于每个稀有靶序列的多部分引物的使用。用多部分引物进行的扩增针对引物103以及预期的靶序列101(图1)的示例于图2中。首先,显示为正向引物的引物103与靶序列101退火并由DNA聚合酶使用链101作为模板进行延伸以产生延伸产物201。通过参见中间的图,在下一个扩增循环中,链202(其包含引物103和延伸产物201)变成反向引物(常规引物203)的模板。反向引物203退火并由DNA聚合酶使用链202作为模板进行延伸以产生延伸产物204。将会观察到的是,延伸产物204包括与引物103完全互补的序列。延伸产物204包括不考虑链101的序列的这样完全互补的序列。即,如果引物103在更早的循环(顶部的图)中已经被延伸,所得到的链202(中间的图)总是包括引物103的完全互补体。在下一个扩增循环中(较下的图),链205(其包含反向引物203和延伸产物204)含有引物103的完全互补体;并且引物103与链205结合并由DNA聚合酶进行延伸以产生延伸产物206。因此,图2在多部分引物退火并延伸产生扩增子202的任何时候应用于错配的靶序列102以及预期的靶序列101。
如前面段落所示,图2显示了在反向引物203延伸期间引物103的整体的复制。这为下一个循环建立了长引发区域,即与锚定序列104、桥序列105和足序列106互补的序列。在某些实施方案中,可能不期望以这样长度的引发区域进行扩增的剩余部分。图3示例了具有封闭基团以在较晚的循环中缩短引发区域的多部分引物的使用。众所周知,封闭基团用于停止DNA聚合酶的延伸。例如,封闭基团可以是六乙二醇(HEG)。特别地,如图3顶部的图所示,如果桥序列105是长的,那么可能期望将封闭基团108置于桥序列105中。较晚的扩增循环中的引发区域由足序列106的核苷酸加上位于封闭基团108的3'的桥序列105的核苷酸组成。备选地,如图3底部的图所示,可能期望将封闭基团108A置于锚定序列104中。在这样的实施方案中,较晚的扩增循环中的引发区域包括足序列106的核苷酸加上、桥序列105的核苷酸加上位于封闭基团108A的3'的锚定序列104的核苷酸。
如上所述,用于本发明的多部分引物可以包括功能部分,与锚定序列104连接的5'尾。本发明并不限制这样的基团可以发挥的功能或其结构。几个功能部分的例子示例于图4中。每个图均显示了具有锚定序列104和位于锚定序列的5'端的不同功能基团的多部分引物103。功能基团401简单地为寡核苷酸尾,其能够被用于与捕获探针杂交或与标记的探针杂交。如所描绘的,尾401不与引物103内的另一序列互补。因为含有尾401的引物中封闭基团108B的存在,DNA聚合酶并不复制尾401,并且尾401总是单链并且可用于结合捕获探针或标记的探针,不考虑互补扩增子是单链的还是双链的。寡核苷酸401可作为用于将所得到的扩增子固定于捕获探针的阵列上具体位置或固定于与分布式阵列的不同元件连接的捕获探针的“邮政编码(zip code)”。另一功能部分包括通过接头403与锚定序列104连接的生物素基团402。因为引物中封闭基团108B的存在,DNA聚合酶并不复制接头403,并且接头403总是单链的。生物素基团402使得从引物合成的扩增子能够获得另外的功能。例如,生物素基团允许扩增子被通过连接基团固定于固相表面(如顺磁珠)的链霉亲和素蛋白强烈捕获。另一功能部分是具有茎环结构的发夹寡核苷酸404,茎环结构包含单链的环405和双链的茎406,其用淬灭剂407(优选非荧光淬灭剂如Dabcyl或Black Hole Quencher 2)和相互作用的荧光部分408(优选荧光团)标记。反向引物203的延伸(图2)将通过标记的发夹404、来自荧光部分408的分离的淬灭剂407继续进行,从而产生荧光信号。参见Nazarenko et al.(1997)Nucleic Acids Res.25:2516-2521。引物103中包含标记的发夹404导致指示扩增的荧光信号。又一个功能部分是通过寡核苷酸序列414和封闭基团108B与锚定序列104连接的分子信标探针409。该功能部分具有引物的另外功能,即,使得当产生复制201时,栓系的(tethered)分子探针与靶链(预期的靶序列和错配的靶序列二者)从引物103的下游杂交。分子信标探针409包含环410和与相互作用的淬灭剂412和荧光部分413共价连接的茎411,使得探针409与延伸产物201的杂交打开茎411并产生指示扩增的荧光信号。不同于发夹404,发夹409不被复制,因为在这种情况下引物103含有封闭基团108B。图4底部的图描绘了发夹404的变体,其中分子信标的茎417的5'末端序列与桥序列105的一部分互补并且环包含锚定序列104。结果,借由与互补扩增子链的杂交,所得到的杂交体的刚性(rigidity)分离相互作用的淬灭剂415和荧光部分416,从而产生指示扩增的荧光信号。
除了其靶序列(即,预期的靶序列和非预期的、错配的靶序列),多部分引物不引发其它反应混合物中的其它序列。桥序列的3'部分加上足序列并不一起形成作为这样的不相关的序列的引物的序列。
通过参考图1,在本发明的方法中有用的多部分引物如下发挥作用。在合成的第一轮中,例如在第一轮PCR循环中,其可以在高温变性步骤之后,锚定序列104与靶序列(预期的靶序列101和非预期的、错配的靶序列102两者)杂交。桥序列105不与靶序列杂交。足序列106优选与预期的靶序列101杂交,但是一定程度上它也与非预期的、错配的靶序列102杂交。杂交体以一定的频率形成并分离。DNA聚合酶也以一定的频率结合所形成的杂交体并起始引物的延伸。对于预期的靶序列101,当比较PCR扩增和使用多部分引物和106个拷贝的预期的靶序列101(有或者无非预期的靶序列102的拷贝)的具有SYBR Green检测的检测测定以及使用相应的常规引物(其与多部分引物中的锚定序列类似)的相同的测定时,杂交体形成和聚合酶结合/延伸的组合频率导致预期的靶序列101不能有效复制,本发明人在PCR阈值循环中将其测量为至少两个循环的CT的延迟。对于非预期的、错配的靶序列102,杂交体形成和聚合酶结合/延伸的组合频率导致极其无效率的复制,本发明人在这样的测定中将其测量为在用多部分引物和106个拷贝的错配的靶序列102获得的CT和用多部分引物和106个拷贝的预期的靶序列101(有或者无非预期的靶序列102的拷贝)获得的CT之间的差异(ΔCT)。由多部分引物引起的预期的靶序列的延迟为至少两个PCR循环,并且可以更大,例如四个循环或甚至5-10个循环。在非预期的、错配的靶序列和预期的靶序列之间的差异(ΔCT)为至少十个PCR循环,优选更多。随着扩增通过另外的循环进行,预期的靶序列将被复制,并且最终错配的靶序列也是这样。从两个靶序列合成的拷贝含有多部分引物并因此是相同的。
在多部分引物起始扩增之前存在于待测试样品中的靶核酸分子上的扩增子的合成之后,无论起始发生于第一循环中或者以后的循环中,所得到的扩增子然后在后续循环中以正常的、高的效率快速地指数扩增,其中多部分引物作为扩增子的常规引物。例如,对于扩增子的复制,多部分引物以与长20-50个核苷酸的常规PCR引物相同的方式发挥作用。这意味着,一旦扩增已经开始了,不仅足序列作为引物。一个可能性是整个(或至少是除了位于封闭基团5'的功能部分之外的整个,如401、403和409)被复制并作为用于扩增子复制的引物。
在那些在多部分引物中具有封闭基团的实施方案中,封闭基团的目的是防止引物5'端的一些部分的复制。封闭基团是本领域技术人员熟悉的。例如,封闭基团可以是六乙二醇或缺乏含氮碱基的脱碱基核苷酸。封闭基团可以置于锚定序列104的5'端以防止功能部分的复制,如封闭基团108B相对于功能部分401、403或409的放置;或者其可以置于锚定序列104内的任何位置,如封闭基团108A的放置;或者其可以置于桥序列105内,如封闭基团108的放置;就是只要当模板分子为扩增子时所复制的缩短的序列的长度足以作为有效的引物即可。为了说明,假设多部分引物具有六个核苷酸长的足序列并且人们希望35个核苷酸被复制。如果桥序列105长二十四个核苷酸,锚定序列104的五个核苷酸必须在封闭基团的下游(即,3'),以实现所期望的引物长度。
3.命名法
在以下所公开的实施例中,使用两种命名法来指本发明的大量多部分引物。
在一种命名法中,多部分引物以这样的形式指代,例如“24-14-5:1:1”引物是指长24个核苷酸的锚定序列、长14个核苷酸的桥序列以及长七个核苷酸的足序列(包含,从足序列5'端的、与突变体(MUT)和野生型(WT)靶均互补的五个核苷酸、与WT靶中的相应核苷酸不互补但与MUT靶中的相应核苷酸互补的一个查询核苷酸,以及,最后与两个靶均互补的一个核苷酸)。因为查询核苷酸位于引物3'端内侧的一个核苷酸,本发明人将该核苷酸称之为位于“3'-倒数第二个位置”。
通过将桥序列与位于锚定序列的结合序列和足序列的结合序列之间的靶序列的区域(本发明人将其称之为“插入序列”)进行比较,可以看到在下面一些实施例中的插入序列长十四个核苷酸,其长度与桥序列的长度相同,而在其它实施例(如实施例8)中,插入序列与桥序列具有不同的长度。为了详细说明插入序列的长度,有时采用第二种命名法。在该情况下,多部分引物“24–18/10–5:1:1”是指其5'-锚定序列长24个核苷酸,其桥序列长18个核苷酸并且其与模板中的长10个核苷酸的插入序列相对存在,以及其3'-足序列长7个核苷酸并由与突变体和与野生型模板二者完全互补的5'段组成,接着是只与突变体模板中的相应核苷酸互补的查询序列,接着是与突变体和野生型模板中的相应核苷酸均互补的3'核苷酸。
选择桥序列的序列,使得其与插入序列不互补,以防止桥序列与插入序列在引物退火期间杂交。代替彼此退火的是,当锚定序列和足序列均与模板杂交时,桥序列和插入序列形成单链“泡”。本发明人有时称桥序列和插入序列的组合为泡。例如,名称24-14/14-5:1:1可以被认为是具有“14/14泡”。
“泡的周长”被定义为桥序列中的核苷酸的数量加上插入序列中核苷酸的数量加上锚定序列的3'核苷酸及其互补序列加上足序列的5'-末端核苷酸及其互补序列的总合。因此,由24-14/14-5:1:1多部分引物(14/14泡)与模板分子的结合所形成的泡的周长为14+14+2+2,其等于长32个核苷酸。下面的表列出了在下面的实施例中所使用的一些引物,采用了该第二种形式。
在PCR测定中所采用的示例性的引物
在每个超级选择性引物内的桥序列用下划线标出,并且其足序列中的查询核苷酸由下划线并加粗的字母表示。引物排列成反映它们在对比实验中的用途的组。
4.用途
本发明并不局限于特定的预期的靶、特定的扩增方法或特定的仪器。为了对比的目的,本发明人在实施例1-8中呈现了几种系列实验,其利用相同的预期的靶、EGFR突变L858,以质粒DNA起始的同相PCR测定,其利用Green检测并使用相同的热循环仪,Bio-Rad IQ5荧光分光光度热循环仪。本发明人已经进行了给出与实施例中所报道的结果一致的结果的其它测定。这样的测定已经利用了其它预期的靶,包括人EGFR突变体T790M和人B-raf突变体V600E;已经利用了基因组DNA;已经包括了具有分子信标探针的检测;已经利用了不同的PCR参数;以及已经利用了不同的仪器,ABI PRISM 7700荧光分光光度热循环仪。
实施例1是对照测定,其中使用长21个核苷酸的常规PCR正向引物扩增完全匹配的预期的靶序列并且还扩增不同之处在于位于引物结合的序列的接近中部处的单核苷酸多态性的非预期的、错配的靶序列(如在其它实施例中,这里也使用常规PCR反向引物)。在初始扩增反应混合物中包含SYBR使得双链扩增产物能够进行同相检测,其结合双链扩增子时显著增加它们的荧光。结果,在每个PCR扩增循环的链延长阶段结束时所测量的SYBR荧光强度给存在的扩增子的数量提供了精确的指示。图5中呈现的实时荧光动力学曲线(荧光强度vs扩增循环数)表明扩增在1012个扩增子的数量级上产生了足够的双链产物,以在其中已经大致进行20个PCR循环的点上给出高于背景的可检测信号(阈值循环,缩写为“CT”),其典型地是针对以106个模板起始的PCR测定。图5还显示出相对于非预期的、错配的靶,正向引物对预期的靶具有更小的选择性,即,当以错配的靶开始时,在阈值循环(CT)中没有显著的延迟。与错配的杂交体的稳定性相比,完全互补的杂交体的稳定性只有很小的热力学差异(导致实际上观察不到的由较少可能形成的错配的引物-靶的杂交体所得到的扩增子的出现的延迟)。
实施例2记载了两个另外的对照,其中错配的靶中取代的核苷酸首先被置于常规正向引物的3'末端核苷酸处,众所周知的ARMS技术,并且然后被置于常规正向引物的3'末端核苷酸内侧的一个核苷酸处。本发明人有时将引物序列内位置的核苷酸称之为“查询核苷酸”,所述核苷酸将与存在或不存在单核苷酸多态性的靶中的核苷酸相对。这些对照的实时动力学曲线示于图6中,其中可以看到,对于预期的靶,CT仍然接近20个循环,表明对于所预期的靶,扩增反应如实施例1中所报道的扩增一样有效。但是,对于错配的靶,CT延迟了几个循环。在引物具有位于足序列的3'-末端的查询核苷酸的情况下,图6A,延迟大致为10个循环(11个循环),其表明一千倍的倾向于预期的完全匹配的靶的选择性(210为1,024)。在查询核苷酸位于足序列的3'端的倒数第二个位置的情况下,CT某种程度上更小,大约8个循环。通过将实施例1和2进行比较,看到预期的靶的扩增效率并未被在引物的3'端或接近3'端放置查询序列所降低,但预期的相对于不同之处在于单个核苷酸的非预期的靶的选择性得到提高。本发明人理解选择性是受限的,因为由于酮-烯醇互变异构,偶尔存在错配的查询核苷酸与靶序列中不互补的核苷酸的一定的碱基配对,并因此确实发生一定的不期望的延伸,因此产生扩增子的概率是所要形成的杂交体的概率乘以所得到的杂交体形成可以被延伸的结构的概率的积。
实施例3显示了根据本发明的多部分引物的同样的实验。本发明人将这里所使用的引物记载为24-14-5:1:1。第一个数字24是锚定序列的核苷酸长度。第二个数字14是桥序列的核苷酸长度(并且在该实验中,在如本文所述的其它实验中,除了本发明人明确指出的以外,否则靶中的插入序列与桥序列长度相同)。后面三个数字(5:1:1)描述了足序列,给出了查询核苷酸的5'的核苷酸的数量,然后是查询核苷酸的数量(对于本文所述的所有实验其为1),以及最后查询核苷酸3'的核苷酸的数量。因此,在这种情况下,足序列为具有倒数第二位的查询核苷酸的长七个核苷酸的序列。这些采用SYBR的荧光强度来测量在每个热循环完成之后存在的扩增子的数量(在每个循环的链延长阶段结束时进行确定)的实时测定的结果示于图7中。通过比较图5和7可以看到,在这种情况下预期的完全匹配的靶的CT被延迟了大约3个循环。还可以看到,非预期的靶(含有与足序列中的查询核苷酸不互补的单核苷酸多态性)的CT被延迟得甚至更多,给出了在预期的靶序列和非预期的靶序列之间大约19个循环的ΔCT,其在选择性中大约为500,000倍的差异(219为524,288)。
虽然不希望受任何理论的束缚,本发明人认为以下是真实的:
A.即便足序列被锚定杂交体栓系于模板,足序列仍是如此的短,并且它被这样大的泡(其包含引物的桥序列和模板中的插入序列)从锚定杂交体分开,并且退火温度对于短的足序列是如此之高,以至于在任何给定的时刻(在PCR测定的退火阶段的平衡调节下),只有非常少部分的存在于待测样品中的模板分子与足序列在任何给定的时刻杂交。
B.此外,在足序列和靶序列之间确实形成的杂交体相对很弱,因此它们存留期间的平均时间非常地短(可能为一百微秒)。
C.作为在任何给定的时刻存在的杂交体的降低的概率和所得到的弱杂交体的降低的平均存留时间的结果,在杂交体(甚至为完全互补的杂交体)和DNA聚合酶分子之间形成稳定的(可延伸的)复合体的概率极其低。
D.在用优选的多部分引物设计所进行的PCR测定中这可以视为扩增子出现中的大致10个循环的延迟,扩增子是由完全互补(“突变体”)靶制得的(即,不是如当常规线性引物被用于106个完全互补的靶时存在的大约20的CT),Ct为大约30。CT值增加10个热循环表明,在DNA聚合酶分子和完全互补的足杂交体之间形成稳定的复合体的概率为当常规线性引物在相同的反应条件下被采用时的概率的1/1,000。
E.在这些相同的PCR条件下,采用相同的优选的多部分引物设计,用错配的(“野生型”)靶所获得的CT值比用完全互补的靶发生的CT值几乎晚20个循环。因此,与在相同的条件下使用常规线性引物替代多部分引物所发生的CT值相比,来自这些错配的靶的扩增子的出现中有大约30个循环的延迟。因此,在DNA聚合酶和含有结合错配的足靶序列的足序列的杂交体之间形成稳定复合体的概率是非常更低的。该CT值30个循环的增加表明,在DNA聚合酶分子和错配的足杂交体之间形成稳定复合体的概率为当常规线性引物在相同的反应条件下被采用时的概率的1/1,000,000,000。
F.这种在非预期的靶序列和DNA聚合酶分子之间形成可延伸的复合体的显著更低的概率是以下区别元素的产物:(i)错配的杂交体的更低的稳定性(与完全互补的杂交体的稳定性相比)显著降低在任何给定的时刻存在的错配杂交体的部分(与在任何给定的时刻能够存在的完全互补的杂交体的部分相比);以及(ii)错配的杂交体的更低的稳定性导致杂交体的平均保留时间更短,从而显著降低DNA聚合酶分子(经受恒定的布朗运动)发现杂交体(与其形成稳定化的复合体)的能力。
实施例4显示,用实施例3的测定可以很容易地区分由仅含有106个拷贝的非预期的靶序列的样品和在存在106个拷贝的非预期的靶序列的情况下含有十个或更多个拷贝的预期的靶序列的样品所获得的不同的结果。针对一系列稀释(在含有106个拷贝的非预期的靶序列的反应混合物中的106、105、104、103、102、101个拷贝的预期的靶序列)所获得的实时PCR结果示于图8中,并且针对这些结果所确定的CT示于图9中,其中它们被针对预期的靶序列的起始拷贝数的对数进行作图。通过参考这些图可以看到,对于预期的靶序列的浓度每降低千分之一,SYBR荧光的CT被延迟大约10个循环,并且具有10个拷贝的预期的靶序列加上106个拷贝的非预期的靶序列的样品与没有预期的靶序列和106个拷贝的非预期的靶序列的样品区被分开;即,能够检测在相应野生型序列的100,000个拷贝的群体中的一个突变体序列。而且,测定是定量的,具有对应于起始反应混合物中的突变体拷贝数的对数的阈值循环。
这些结果确认了根据本发明的选择性引物的用途的以下方面:
A.一旦多部分引物在PCR测定的退火阶段期间与DNA聚合酶结合形成杂交体,该稳定化的杂交体在PCR测定的延长阶段期间延伸,并且然后所得到的扩增子被高效扩增(就好像使用经典线性引物进行反应)。这可以从以下事实中看到:在样品中原始存在的突变体模板的数量以因子1,000降低导致显著数量的扩增子出现的大约10个热循环的延迟(例如在其结果示于图8和图9中的实验中,具有100,000个突变体模板的样品的CT值大约为27,而具有100个突变体模板的样品的CT值大约为37)。如果存在的扩增子的数量在每个热循环有效倍增,那么在十个循环之后应当有1,024倍的扩增子(即,210)。这些结果确认了由待测样品中存在的突变体模板所产生的扩增子随后被有效扩增。
B.发生扩增子的有效扩增是因为一旦多部分引物掺入产物扩增子(扩增子“+”链)的5'端,在合成的下一个循环中产生的互补扩增子(扩增子“-”链)在其3'端具有与多部分引物的整个序列完全互补的序列。结果,对于扩增子(相对于原始模板分子),多部分引物的行为好像它们是用于扩增子的进一步扩增的经典线性引物。
C.从待测样品中存在的完全互补的突变体模板非常选择性地产生扩增子(与从待测样品中存在的错配野生型模板产生的扩增子相比),与一旦扩增子合成则由引物有效扩增扩增子组合,使得所得到的实时数据能够用于定量测量在待测样品中存在的突变体模板分子的数量。
如从含有不同数量的突变体模板分子的样品所获得的CT值所反映出来的,在待测样品中存在的靶分子数量的对数和用于合成预定量的扩增子的热循环数量之间存在反向线性关系(在指数扩增反应,如PCR测定中)。参见Kramer&Lizardi(1989)Nature 339:401-402。如同例如在其结果示于图9中的实验中,CT vs在每个待测样品中存在的预期的(突变体)模板分子数量的对数的曲线的线性表明由野生型模板没有产生显著量的扩增子(即使在每个样品中存在1,000,000个野生型模板分子)。如果本来有由野生型模板产生的显著量的扩增子,那么仅含有少量突变体模板的样品的CT值本来会更少(即,结果本来不会形成直线,因为由丰富的非预期的靶分子合成的不需要的扩增子的出现将阻碍来自非常稀有的预期的靶分子的扩增子的出现)。
如实施例5中所报道的,本发明人研究了多部分引物的足序列长度对使用具有一系列以下三种探针的实施例4的测定的扩增反应的效果:24-14-4:1:1、24-14-5:1:1和24-14-6:1:1。锚定序列的长度保持在24个核苷酸。桥序列的长度保持在14个核苷酸,保持靶序列之间的相同单个核苷酸的差异,并且查询核苷酸的位置保持在从足序列3'末端的倒数第二个位置。通过从4到5到6改变查询核苷酸位置的5'的核苷酸数量,足序列的长度在6个核苷酸到7个核苷酸到8个核苷酸之间变化。所获得的CT值总结于表1中并针对预期的靶序列的起始拷贝数量的对数作图于图10中。拟合直线1001(足序列长6个核苷酸)、1002(足序列长7个核苷酸)和1003(足序列长8个核苷酸)到该数据。如上针对图9所报道的,可以看到所有三种引物均提供了定量数据。还可以看到拟合的线1001、1002和1003接近平行,表明对于所有三个足序列长度,在CT和起始拷贝数量的对数之间存在相同的定量关系。图10还显示了缩短足序列的长度延迟了CT,但如图10中所看到的,缩短足序列的长度也给从106至101个拷贝的预期的靶序列的数据更好的直线拟合(即,足序列长度越短,在待测样品中由丰富的非预期的靶分子所合成的扩增子将越不可能阻碍由存在于相同的样品中的稀有的预期的靶分子所合成的扩增子)。
如实施例6中所报道的,本发明人还使用具有一系列以下三种引物的实施例4的测定研究了由多部分引物的桥序列和预期的和非预期的靶序列的插入序列形成的泡的周长对扩增的效果:24-10-5:1:1、24-14-5:1:1和24-18-5:1:1。本发明人将锚定序列的长度保持在24个核苷酸;本发明人将足序列保持在5:1:1;并且本发明人从10到14到18个核苷酸来改变桥序列的长度,并且针对每个多部分引物选择锚定序列的序列,使得靶中的插入序列会与该引物中的桥序列为相同的长度。结果,当它们的足序列与靶杂交时由三种引物的每一种所形成的泡的周长(以核苷酸的形式表示)(包括由锚定序列杂交体和足序列杂交体所贡献的四个核苷酸)分别为24、32和40。所获得的CT值总结于表2中并针对预期的靶序列的起始拷贝数量的对数作图于图11中。直线1101(泡周长24个核苷酸)、1102(泡周长32个核苷酸)和1103(泡周长40个核苷酸)被拟合于该数据。如上针对图9和图10所报道的,可以看到所有三种引物均提供了定量数据。还可以看到拟合的线1101、1102和1103接近平行,表明对于所有三个泡周长,在CT和起始拷贝数量的对数之间存在相同的定量关系。图11还显示了增加泡的周长延迟了CT,但如图11中所看到的,增加泡周长也给从106至101个拷贝的预期的靶序列的数据更好的直线拟合(即,泡越大,在待测样品中由丰富的非预期的靶分子所合成的扩增子将越不可能阻碍由存在于相同的样品中的稀有的预期的靶分子所合成的扩增子)。
这些实验性观察结果证实更短的足序列长度和/或更大的泡导致相当地更不可能形成杂交体,并且更短的足序列长度和/或更大的泡导致针对错配的野生型模板提高的选择性,其由CT vs预期的靶分子的数量的对数的图的增强的线性所证明。为了理解为什么会这样,本发明人检查了在PCR测定的退火阶段过程中存在的平衡条件下足序列杂交体形成的热力学。以下是本发明人的理解:
A、在本发明人的PCR测定中存在非常高浓度的多部分引物(因为需要足够的可用多部分引物以掺入能在每个反应中合成的大约1013个扩增子)。结果,在这些PCR测定的退火阶段过程中存在的平衡条件下,几乎每个模板分子都快速结合多部分引物的锚定序列。此外,因为锚定序列是长的(例如24个核苷酸),在锚定序列和模板分子之间的键非常强并且平均长时间持续存在(也许以分钟形式被测量到)。在平衡状态下,在非常小部分的这些锚定复合体中,短的足序列也与模板分子杂交。在任何给定瞬间,其足序列没有被杂交的锚定复合体的浓度为“[A]”,并且其足序列被杂交的锚定复合体的浓度为“[B]”。描述这两种状态的内在关系的经典平衡常数(“k”)为:
k=[B]/[A] 方程1
热力学上,在平衡状态形成杂交体的概率取决于杂交强度(焓)和确定两个序列能够相互作用形成杂交体的概率的物理关系(熵)二者。平衡常数可以由焓(一旦其足序列未被杂交的锚定复合体向被杂交的足序列转换则存在焓,ΔH)的变化并由熵(一旦其足序列未被杂交的锚定复合体向被杂交的足序列转换则存在熵,ΔS)的变化并根据以下经典公式来确定:
(ΔH-TΔS)=-RT ln(k) 方程2
其中R为热力学气体常数,T为以开氏度表示的温度,并且ln(k)是平衡常数的自然对数。重新整理该方程以获得k的表达式:
k=e-(ΔH-TΔS)/RT 方程3
其中e=2.71828。对于非常相同的反应,具有杂交的足序列的复合体的分数(Θ)由以下方程表示:Θ=[B]/([A]+[B])。但是,因为[B]变得非常小(因为是采用多部分引物的反应的情况),Θ接近于0,并且Θ的方程表达如下:
方程4
由于方程4中Θ的表达几乎与方程1中k的表达相同,本发明人可以用Θ取代方程3中的k,以获得将非常低丰度的引物-模板复合体(其具有杂交的足(Θ))与经典热力学参数(ΔH和ΔS)关联起来的方程如下:
Θ=e-(ΔH-TΔS)/RT 方程5
对于在PCR条件下发生的核酸杂交反应,量(ΔH-TΔS)是正值,因此,e升高至负数,给出Θ的分数值。(ΔH-TΔS)的值越小,分数Θ越小。此外,在PCR反应的退火阶段过程中,T是常数。因此,要理解Θ如何改变为多部分引物设计中的改变的结果,本发明人仅需要考虑针对每个引物设计的ΔH和ΔS的值的幅度,以理解当多部分引物与预期的靶杂交时相较于它们与非预期的靶杂交时该设计的作用。
B.熵是分子复合体能够形成的构象上不同的状态的数量的量度。因此,当锚定复合体的足序列与其靶杂交时,复合体能够形成的拓扑结构上不同的状态的数量从高的数量变成低的数量。因此,一旦形成足杂交体,熵的变化(ΔS)为负值。
C.焓是分子复合体的稳定性的量度,其以在含有复合体的溶液中存在的能量的量表示。因为高温是解离核酸杂交体所必需的,当复合体分开时加入热能并且一旦形成复合体则释放热能。因此,一旦形成足杂交体,焓的变化(ΔH)也为负值。
D.当多部分引物被用于PCR测定时,具有杂交的足序列的复合体的分数(Θ)被方程5很好地描述。在上述实验(其中足序列的长度是变化的或者泡的周长是变化的)中,唯一的变量是ΔH和ΔS。对于足杂交体的形成,ΔH和ΔS是负的,并且量(ΔH-TΔS)(其被称为吉布斯自由能(ΔG))是正的。结果,量TΔS比ΔH更负。就计算具有杂交的足序列的复合体的分数(Θ)而言,ΔH负的幅度越小,Θ将越小。类似地,ΔS负的幅度越大,Θ将越小。
E.为了确定不同足序列长度对具有足杂交体的复合体的分数(Θ)的作用,有必要认识到,在其它都相等的情况下,ΔH负得越少,足杂交体的长度越短。结果,在任何给定的时刻,足杂交体的长度越短,具有足杂交体的引物-靶复合体的比例越低。
F.类似地,为了确定不同泡周长对具有足杂交体的复合体的分数(Θ)的作用,有必要认识到,在其它都相等的情况下,ΔS负得越多,泡周长越大。结果,在任何给定的时刻,泡周长越大,具有足杂交体的引物-靶复合体的比例越低。
G.鉴于这些认识,现在看看多部分引物中足序列的设计是如何有助于区分完全互补的靶序列(预期的靶序列)和错配的靶序列(非预期的靶序列)。例如,用于其结果示于图8和图9中的实验的多部分引物具有不同长度的足序列(“6:1:1”或“5:1:1”或“4:1:1”)。这些命名表明每个足序列的总长度分别为8个核苷酸、7个核苷酸或者6个核苷酸,具有位于从引物3'端的倒数第二个位置的查询核苷酸(其或者与预期的靶序列中相应的核苷酸互补或者与非预期的靶序列中相应的核苷酸不互补)。
H.本发明人将该关键核苷酸定位于倒数第二位的原因是本发明人相信,当倒数第二个碱基对不能形成(由于错配)时该末端碱基对也不能形成(即使足序列的3'核苷酸与靶中的相应核苷酸互补),因为分离的碱基对极其不可能在PCR测定的退火温度(大约60℃)下稳定。因此,对于给定的足序列,错配的杂交体将比完全互补的杂交体短两个碱基对。
I.这里是这意味着什么(概念上):为了阐明这一点,假定温度(T)=1,并且假定气体常数(R)=1,因为它们是常数。想象形成具有6:1:1足序列的完全互补杂交体的ΔH值为-16以及形成具有6:1:1足序列的较短的错配杂交体的ΔH值为-12。还想象这两种杂交体二者的ΔS值(其由泡周长确定)为-20。结果,完全互补的杂交体的ΔG值为4(记为20-16),并且错配的杂交体的ΔG值为8(记为20-12)。将这些值代入方程5,用预期的靶形成的杂交体的Θ的概念值(Θm)等于e-4,其为值0.0183。相比之下,用非预期的靶形成的杂交体的Θ的概念值(Θw)等于e-8,其为值0.000335。因此,在该概念性实施例中,完全互补的杂交体的丰度为错配的杂交体的丰度的54.6倍。尽管该计算阐明了与用要存在的预期的靶形成的足杂交体的概率(在任意给定的时刻)相比,使用根据本发明的多部分引物导致用要存在的非预期的靶形成的足杂交体低得多的概率(在任意给定的时刻),并且尽管与由预期的靶合成的扩增子的CT相比,该差异当然导致由非预期的靶合成的扩增子的CT的更大的延迟,该概念性实施例的Θm和Θw实际值不同。
J.现在让本发明人对具有5:1:1足序列的多部分引物进行相同的概念性计算。在该情况下,形成具有5:1:1足序列的完全互补的杂交体的ΔH值为-14并且形成具有4:1:1足序列的错配的杂交体的ΔH值为-10;并且所得到的ΔG值(对于相同大小的泡,其ΔS=-20)如下:完全互补的杂交体的ΔG值为6(记为20-14=6),并且错配的杂交体的ΔG值为10(记为20–10)。将这些值代入方程5,用预期的靶形成的杂交体的Θ的概念值(Θm)等于e-6,其为值0.00248。相比之下,用非预期的靶形成的杂交体的Θ的概念值(Θw)等于e-10,其为值0.0000454。令人惊讶的是,在该概念性实施例中,完全互补的杂交体的丰度也为错配的杂交体的丰度的54.6倍。
K.现在让本发明人对具有4:1:1足序列的多部分引物进行相同的概念性计算。在该情况下,形成具有4:1:1足序列的完全互补的杂交体的ΔH值为-12并且形成具有4:1:1足序列的错配的杂交体的ΔH值为-8;并且所得到的ΔG值(对于相同大小的泡,其ΔS=-20)如下:完全互补的杂交体的ΔG值为8(记为20-12=8),并且错配的杂交体的ΔG值为12(记为20–8)。将这些值代入方程5,用预期的靶形成的杂交体的Θ的概念值(Θm)等于e-8,其为值0.000335。相比之下,用非预期的靶形成的杂交体的Θ的概念值(Θw)等于e-12,其为值0.00000614。并且甚至令人更惊讶的是,在该概念性实施例中,完全互补的杂交体的丰度也为错配的杂交体的丰度的54.6倍。因此,本发明人得出结论,即使更短的足导致更低的Θ值,以及即使更短的足导致提高的CT值,从严格的热力学角度看,没有理由相信,更短的足序列导致预期的靶序列和非预期的靶序列之间区分得更强。
L.此外,即使增加的泡周长也降低Θ值,很明显增加泡的周长,虽然使得更不可能形成杂交体,并没有改变与由非预期的杂交体所形成的足杂交体相比的由预期的靶形成的足杂交体的平衡比。
M.就经典热力学分析而言,可以看到对于任何给定的多部分引物(其中形成足杂交体的分子复合体的分数极其低),以预期的靶形成的足杂交体的分数(Θm)与以非预期的靶形成的足杂交体的分数(Θw)的比既不被增加泡的周长(其改变ΔS)影响,也不被减少的足序列的长度(其改变ΔH)影响,而是这些变化降低Θm和Θw二者的值,但不改变比(Θm/Θw),其是焓的差异(ΔHm-ΔHw)的函数。结果,从经典热力学的观点,相较于非预期的杂交体,影响预期的杂交体的相对丰度的唯一事情是它们焓值的差异,并且该差异是形成的碱基对的数量差异的结果,无论足序列的长度多长其是相同的。描述比(Θm/Θw)的热力学方程如下:
方程6
图10和图11中所示的实验结果证实,增加泡的周长和减少足序列的长度显著提高根据本发明的多部分引物的选择性,即,在多部分引物设计中的这些改变,尽管降低足杂交体的丰度,但是显著提高了区分(discriminatory)率(Θm/Θw),因为区分率的这种提高被用106个预期的靶分子所获得的CT和用106个非预期的靶分子所获得的CT之间的CT值的差异(ΔCT)的增大所证实。这些观察结果表明,根据本发明的多部分引物的非凡选择性存在另外的原因(也许为非热力学原因)。
当设计根据本发明的多部分引物以降低在PCR扩增测定的退火阶段的平衡条件下的任何时刻存在的足靶的比例时发生的增强的选择性的解释不可能在于ARMS的区分结果,因为不管那些引物的丰度如何,DNA聚合酶分子拒绝不具有包括引物的3'末端核苷酸的碱基对的杂交体的程度是相同的。然而,从实验结果可以明显看出,另外的区分机制使得当引物被设计为稀有地形成足杂交体时存在非凡的选择性能够出现。
虽然不希望受任何理论的束缚,这就是为什么本发明人相信减少足序列的长度和增加的泡的周长增强选择性的原因。该解释在于本发明人预料不到的发现:在PCR测定退火阶段期间存在的相对高温下,非常短的足杂交体在它们解离之前仅存在非常短的时间(也许以数十或数百微秒形式被测量到)。此外,杂交体越短并且泡周长越大,该杂交体存在期间的平均时间越短。本发明人推测,特定类型的杂交体的平均持续时间越短,DNA聚合酶分子越不可能遇到那些杂交体之一并然后与该杂交体形成稳定的能够进行链延长的复合体。这里的关键点是,杂交体是否会与DNA聚合酶分子形成稳定的复合体是该杂交体的平均持续时间的函数(function)。本发明人相信,当引物的足序列长度减少和引物的泡周长增加时,由特定的多部分引物形成的完全互补杂交体的平均持续时间与由相同类型的多部分引物形成的错配(更短)杂交体的平均持续时间相比更长。因此,更严格的多部分引物设计(更短的足序列、更长的泡)产生活得更短的杂交体,其相当程度上更不可能与DNA聚合酶分子形成稳定的杂交体。结果,较短的足杂交体不只是更不丰富,它们还具有与DNA聚合酶分子形成稳定的复合体的降低的机会,不去这种另外的区分性质说明了多部分引物的非凡选择性的原因。
如实施例7中所报道的,本发明人还研究了改变查询核苷酸在根据本发明的多部分引物的足序列中的位置的作用。本发明人利用了一系列六个引物:24-14-6:1:0、24-14-5:1:1、24-14-4:1:2、24-14-3:1:3、24-14-2:1:4和24-14-1:1:5。本发明人保持锚定序列的长度、桥序列的长度和足序列足序列的长度(七个核苷酸),仅在足序列内改变查询核苷酸的位置。用106个拷贝的预期的靶(突变体)和用106个拷贝的非预期的靶(野生型)针对这些引物的每一个获得的实时荧光结果示于图12中,并且所计算的CT值总结于表3中。结果显示,随着查询核苷酸的位置越来越接近足序列的3'末端,在预期的靶序列和非预期的靶序列之间的区分窗口(ΔCT)逐渐提高。这些结果表明,查询核苷酸的优选位置是位于足序列的3'末端(能够进行ARMS区分)和位于足序列的3'倒数第二个位置的核苷酸(阻止两个碱基对形成,而不是仅阻止一个碱基对形成)。
如实施例8中所报道的,本发明人还研究了在根据本发明的多部分引物的桥序列和预期的以及非预期的靶序列中的插入序列之间形成的泡的形状。本发明人通过选择这两种序列的相对长度来改变“泡的形状”。在进行所述测定中,本发明人利用具有24个核苷酸长的锚定序列和具有5:1:1足序列的一系列引物。本发明人将泡周长保持在32个核苷酸,但是本发明人改变桥序列的长度和插入序列的长度(通过改变锚定序列使得其一旦与模板分子杂交,插入序列会具有期望的长度)。除了测试形成对称的泡的多部分引物(即,具有14个核苷酸的桥序列和使得插入序列为14个核苷酸长的锚定序列的引物(14/14泡)),本发明人还测试了产生非对称泡的多部分引物,泡具有相对更长的桥序列(18/10泡和16/12泡)和具有相对更短的桥序列(12/16泡和10/18泡)。用106个拷贝的预期的靶(突变体)和用106个拷贝的非预期的靶(野生型)针对这些引物的每一个获得的实时荧光结果示于图13中,并且所计算的CT值总结于表4中。结果显示,对称的14/14泡使得在预期的靶序列和非预期的靶序列之间的区分窗口(ΔCT)最大,但仅略微如此。结果,本发明人最优选的泡是对称的。
实施例9报道了利用实施例4的测定方法针对不同的靶B-raf突变V600E(而不是EGFR突变L858R)和针对该突变的24-14-5:1:1多部分引物的实验。图14是CT vs预期的靶模板的起始数量的对数的图。如可以从图14中看到的,该测定提供了在含有106个WT模板的样品和在106个WT模板存在下含有106个MUT模板的样品之间的23.1个循环的ΔCT,其甚至大于实施例4中所获得的相应ΔCT。
实施例10报道了另一个变化,这次利用EGFR突变T790M和使用具有高达10,000个拷贝的野生型靶模板的基因组DNA和24-14-4:1:1多部分引物的PCR扩增。图15是CT vs预期的突变体靶模板的起始数量的对数的图。如可以从图15中看到的,该测定提供了在含有104个WT模板的样品和在104个WT模板存在下含有104个MUT模板的样品之间的12.6个循环的ΔCT。
实施例11报道了与实施例4中EGFR突变L858R的测定类似的测定,其使用不同的荧光分光光度热循环仪ABI PRISM 7700,相同的24-14-5:1:1多部分引物和质粒DNA,除了这次模板没有消化。图16是CT vs预期的靶模板的起始数量的对数的图。如可以从图16中看到的,该测定提供了在含有106个WT模板的样品和在106个WT模板存在下含有106个MUT模板的样品之间的16.4个循环的ΔCT。
图17显示了实施例12中所述的实验的结果。该实验被设计成证实热力学考量相对于酶法(ARMS型)考量在确定本文所述的多部分引物的选择性中的相对贡献。本发明人所做的是不仅使用24-14-5:1:1引物而且使用截短的24-14-5:0:0引物(其省略了3'倒数第二个和末端的核苷酸)来重复实施例3的测定。因此,在后引物的足序列与预期的靶序列和非预期的靶序列二者均完全互补。图17的图A比较了用24-14-5:1:1多部分引物(其足/靶杂交体在3'端变得不稳定)的1,000,000个预期的靶序列的扩增和1,000,000个非预期的靶序列的扩增以区分这两类模板,如以ARMS和热力学所完成的。引物24-14-5:1:1的CT值对于预期的靶序列(曲线1701)为23.1并且对于非预期的靶序列(曲线1702)为40.7,得到17.6个循环的ΔCT。
图17的图B比较了用24-14-5:0:0多部分引物(其足/靶杂交体在3'端没有变得不稳定)的1,000,000个预期的靶序列的扩增和1,000,000个非预期的靶序列的扩增。引物24-14-5:0:0的CT值对于预期的靶序列为39.7并且对于非预期的靶序列为39.4,得到-0.3个循环的ΔCT。
与截短的引物24-14-5:0:0一样,多部分引物24-14-5:1:1与野生型模板中相同的五个核苷酸形成足杂交体(曲线1702),因为该引物的查询核苷酸与单核苷酸多态性不互补,并且在足序列的倒数第二个位置的所得到的错配的碱基对阻止该引物的足序列的相邻的3'末端核苷酸形成分离的碱基对。但是,在由引物24-14-5:0:0与野生型模板形成的杂交体和由引物24-14-5:1:1与野生型模板形成的杂交体之间存在差异,并且该差异为,由引物24-14-5:1:1与野生型模板形成的杂交体中的足序列具有由3'倒数第二的错配引起的两个突出的核苷酸,并且因此经历通过DNA聚合酶的ARMS型区分,而由引物24-14-5:0:0与野生型模板形成的杂交体中的截短的足序列不具有任何突出的3'末端碱基对,并且因此不经历通过DNA聚合酶的ARMS型区分。如果当使用根据本发明的多部分引物时ARMS型区分在选择性中发挥重要作用,本发明人本来预期涉及引物24-14-5:0:0与野生型模板的反应的CT值(曲线1704)本来会比涉及引物24-14-5:1:1与野生型模板的反应的CT值(曲线1702)更低(即,更少的延迟),因为ARMS型区分不能在涉及引物24-14-5:0:0与野生型模板的反应中发挥作用,但能够在涉及引物24-14-5:1:1与野生型模板的反应中发挥区分作用。这些结果表明,当使用根据本发明的多部分引物时,ARMS型区分的作用不存在或者被显著减小(或许是作为由这些高度选择性的核酸扩增引物形成的足杂交体的极其短的平均持续时间的结果)。
根据本发明的测定可以包括当可能存在多个可能的稀有靶之一时寻找任何稀有靶的存在的筛选测定。对于这样的测定,多部分引物被用于每个可能的稀有靶,但是检测不需要鉴定哪个靶存在。因此,SYBR Green染料可以被用作检测试剂,作为能够无区分地发出信号的双标记的杂交探针,作为能够无区分地发出信号的引物上的5'功能序列。采用根据本发明的多部分引物的测定包括扩增和检测,其可以包括在单个反应管、反应孔或其它反应容器中两种或多种稀有靶序列的同时定量,其中需要鉴定哪个靶或哪些靶存在。没有序列同源性并且位于基因组中不同位置的两种或多种稀有靶序列的单个反应管中的扩增和检测(例如位于不同基因中的稀有单核苷酸多态性的同时检测)可以包括针对每个不同的预期的靶序列的特异性的、独特着色的杂交探针,如分子信标探针、探针或与多部分引物下游的扩增产物的任一条链中的独特序列杂交的5'核酶探针。这不仅适用于自由浮动的检测探针,而且也适用于栓系的探针,如图4中的分子信标探针409。备选地,针对每个不同靶序列的多部分引物可以包括标记的发夹,如图4中的发夹404。通过参考图4,两种或多种不同的多部分引物103(其每一种均特异性针对不同的稀有的预期的靶序列,并且每种均以独特着色的荧光标记408、413或416进行标记)可以被用于同时鉴定和定量个体样品中存在的每种预期的靶序列。
5.多重测定
本发明的超级选择性引物的尤其吸引人的特征是其在同时测量相同的临床样品中不同的稀有突变体序列的丰度的多重测定中的潜在用途。这些测定的结果能够针对每个个体提供量身治疗(tailor therapy)的患者特异性信息。
一个有趣的多重标记策略基于这样的认识,因为在桥序列和预期的靶序列之间没有关系,所以测定设计者可以自由选择针对在多重测定中同时存在的不同的超级选择性引物的每一个的明显不同的桥序列。由于每个引物的整个序列变成扩增子的组成部分,所述扩增子在该引物与其突变体靶结合时产生的,桥节段的不同的核酸序列可以作为该扩增子内鉴定从其产生的突变体靶的“序列号”。
这些鉴定桥序列可以相对长(例如长20个核苷酸以确保其独特性),并且引物可以被设计以相应形成模板内的短插入序列。为了同时检测和定量临床样品中存在的不同的突变体靶序列,一组特异性分子信标探针(Tyagi et al.,(1996)Nat.Biotechnol.14,303-308、Tyagi et al.,(1998)Nat.Biotechnol.,16,49-53和Bonnet et al.,(1999)Proc.Natl.Acad.Sci.USA,96,6171-6176)可以被包括于实时、基因扩增反应中,每个均特异性针对超级选择性引物之一的不同桥序列的互补物,并且每个均以不同颜色的荧光团进行标记。
在这些反应中,本发明人倾向于超级选择性正常引物的浓度应当被限制,并且线性反向引物应当过量存在,从而确保反应不会是对称的,并且分子信标能够基本上结合过量合成的所有的靶扩增子,而不与较不丰富的互补的扩增子显著竞争(Pierce et al.,(2005)Proc.Natl.Acad.Sci.USA,102,8609-8614)。这些多重测定甚至能够区别以相同的密码子(codon)存在的不同突变,因为被设计成检测特定突变的超级选择性引物会以与区分野生型靶序列相同的方式区分邻近或备选的突变。
另一个多重策略示于图18中,其是根据本发明的两种多部分引物的示意图,其可以用于针对两个密切相关的预期的靶序列的多重反应。
只要在多重测定的预期的靶序列之间存在序列同源性,独特的序列就可以通过利用针对每个不同的预期的靶序列的独特的桥序列进行引入。如上述结合图2所解释的,反向引物将整个正向(多部分)引物复制入反向产物链,因此,在后续的扩增循环中,整个多部分引物(锚定序列、桥序列和足序列)与由反向引物的延伸得到的产物互补。在多重测定中,重要的是只有一个多部分引物(如此复制的“正确的”引物)杂交并引发该反向产物链。因此,应当理解的是,必须使得“正确的”多部分引物的桥序列足够不同以防止另一个多部分引物引发该反向产物链(所谓的“交叉杂交”)。如此,(自由浮动或栓系至引物的)特异性的、独特着色的杂交探针(其靶向针对桥序列的互补物)将对唯一的预期的靶的扩增发出信号并且不会通过与多部分引物自身杂交而发出假信号。类似地,只有具有独特颜色的发夹尾(图4中的发夹405)的“正确的”多部分引物会与反向产物链杂交并发出信号。
对于区分和定量几乎相同的(彼此之间仅有一个或两个单核苷酸多态性的不同)和在基因组内彼此非常接近的(例如,人K-ras基因的医学显著的变体,其中不同的单核苷酸多态性可存在于密码子12内,每个均指定在该基因的编码蛋白中不同氨基酸的身份(identity))的存在)不同的稀有靶序列的存在,可以使用具有图18或图19中概括出的结构的两种或多种多部分引物。首先看图18,顶部结构103A显示多部分引物,其足序列106A与具体的预期的稀有靶序列完全互补,包括在该靶序列中相应于互补的核苷酸“g”的核苷酸(查询核苷酸)。下面的结构103B显示多部分引物,其足序列106B与不同的具体的稀有的预期的靶序列完全互补,其是足序列106A的靶的变体并且其位于(或者非常接近于)针对足序列106A的预期的靶序列的基因组中的位置。在足序列106B中,核苷酸“h”是查询核苷酸,其与足序列106B的预期的靶序列中相应的核苷酸完全互补。为了能够同时区分,或者区分并定量在同一反应中的这些稀有靶序列的每一个的丰度,引物103A可以被连接至独特结构404A,其在序列405A和406A和荧光团标记408A上不同于引物103B的结构404B中的序列405B和406B和荧光团标记408B。当两种或多种多部分引物(如引物103A和103B)被用于同时区分和定量在相同(或非常类似)的位置的相似的预期的稀有靶序列,往往是这样的情况,它们各自的锚定序列会是相同的或非常类似的(以使引物结合接近要被区分的变体序列存在的期望的位置)。但是,因为在本发明的多部分引物的桥序列及其预期的靶序列之间没有相关性,可以选择引物103A中的桥序列105A,使得其核苷酸序列不同于引物103B中的桥序列105B。这就是本发明的两种或多种多部分引物是如何可以被利用来同时区分和定量稀有的预期的靶序列,所述靶序列是彼此的等位基因并且位于基因组中相同(或非常类似)的位置:
反向引物203(图2)的延伸通过标记的结构404A和404B继续,分别从荧光团标记408A和408B分开淬灭剂407。结果,当它们被掺入扩增子时,如果在每个链延长循环的结束实时测量它们的荧光强度(在扩增反应中,其中扩增子变成双链,如在PCR扩增中),引物103A和103B的每一个将以其独特鉴定颜色发出荧光。备选地,当在扩增反应的退火阶段结束时测量它们的荧光强度时,引物103A和103B的每一个将以其独特鉴定颜色发出荧光,因为由于每个引物(103A或103B)与其完全互补序列在那些扩增子链204(图2)的3'端结合,它们的淬灭基团407变得从它们的荧光团标记(408A或408B)分开,所述扩增子链204的合成是由掺入相同的引物起始的。
图19描绘了使用自由浮动的分子信标探针而不是标记的发夹尾的用于类似测定的引物和探针。在图19中,多部分引物1903A具有足序列1906A,其与具体的第一预期的稀有靶序列完全互补,包括查询核苷酸“r”。多部分引物1903B具有足序列1906B,其与不同的具体的第二稀有靶序列完全互补,所述靶序列是足序列1906A的靶的变体并且其位于(或者非常接近于)足序列1906A的预期的靶序列的基因组中的位置。在足序列1906B中,核苷酸“s”是查询核苷酸。在该实施方案中,查询核苷酸“r”与第二稀有靶向或野生型序列均不互补。并且查询核苷酸“s”与第一稀有靶向序列或野生型序列均不互补。为了能够在同一反应中区分两种稀有靶序列的扩增,以及防止交叉杂交,使得桥序列1905A的序列与桥序列1905B的序列完全不同。包括环1908A、茎1909A、荧光团1910A和淬灭剂1911A的分子信标探针1907A具有特异性针对桥序列1905A的互补物的环。包括环1908B、茎1909B、荧光团1910B和淬灭剂1911B的分子信标探针1907B具有特异性针对桥序列1905B的互补物的环。荧光团1911A和1911B为不同的颜色。利用探针1907A和1907B的检测可以是实时的或终点的。
使得能够同时实时测量由不同的稀有的预期的等位基因靶序列产生的不同扩增子的关键特征在于本发明的多部分引物可以被设计成在它们的标记的发夹尾(例如404A和404B)中和在它们的桥序列(例如105A和105B)中具有完全不同的序列。结果,可以调整退火条件以确保每种类型的引物仅与其合成由相同类型的引物起始的扩增子结合。此外,如果特定类型的引物要结合非同源扩增子,在该引物末端的发出信号的发夹将不会与该扩增子的3'端的序列互补,因此没有荧光发出。作为针对将同时存在于反应中的每种多部分引物简单利用不同桥序列的备选方案,可以通过缩短一个或沿着靶滑动来利用不同的锚定序列。备选地,桥序列的不同长度(如105A和105B)将能够使用不同的锚定序列(如104A和104B)而不会显著改变每个引物的选择性。这会降低在引物103A和含有用于引物103B的引发序列的非同源的扩增子之间形成错配的杂交体的概率,以及降低在引物103B和含有用于引物103B的引发序列的非同源的扩增子之间形成错配的杂交体的概率。
6.设计多部分引物的另外的考量
根据本发明的多部分引物的设计是简单的。本发明人建议设计应当针对特定仪器上的特定的扩增操作步骤,因为仪器会在它们的检测和荧光的表达方面特别地改变。合适的操作是选择设计(锚定序列的长度、桥序列的长度和足序列的长度,以及位于足序列的3'末端核苷酸或者位于3'端倒数第二个核苷酸的查询核苷酸)。然后,通过简单改变桥序列的长度和足序列的长度,以少数尝试就可以优化引物设计以实现所期望的在含有预期的靶的样品和含有非预期的靶的样品之间的大的ΔCT。这涉及使得引物针对扩增预期的靶序列是无效的。设计的考量是上述相对于实施例所讨论的那些。特别地,缩短足序列和增加由桥序列和靶的插入序列形成的泡的大小增加预期的靶的CT的延迟并增加在含有预期的靶的样品和含有非预期的靶的样品之间的ΔCT。
在本发明多部分引物的设计中存在另外的考量。引物必须不引发在样品中存在或可能存在的其它的序列。防止这一点的常规计算机方法是公知的并且很容易地即可获得的。
a.锚定序列
锚定序列通常(但不是必须)与模板序列完全互补,并且它通常可以位于从足序列5'端大约14个核苷酸处并且可以通常长15-40、15-30或20至30(如20至24)个核苷酸。选择它的长度使得其与模板形成杂交体的解链温度在一个合适的范围中,如在几个实施例中的66℃至72℃。
如果因为其靶序列在基因组的其它地方存在,结果是被设计成区分特定多态性的多部分引物中的锚定序列不是足够特异性的,可以通过设计区分相同的多态性但与互补的靶链结合的多部分引物来解决该问题。
b.桥序列
至于桥序列,本发明人建议检查并且如果有必要的话消除瞬时杂交事件,所述事件在如果该序列可以与靶形成低Tm杂交体从而降低其有效长度的情况下可以发生。另外,可以通过调整桥序列的刚性来修饰桥序列的作用,因为不同的核苷酸序列一定程度上具有不同的刚性。参见Goddard et al.(2000)Phys.Rev.Lett.85:2400-2403。
在一个实施例中,桥序列可以长大约至少6(例如7、8、9、10、11、12、13、14、15或20)个核苷酸。可以选择它的核苷酸序列以确保在退火条件下:(i)它不与模板链中的相应“插入序列”(其位于足靶序列和锚定靶序列之间)杂交;(ii)它不与人基因组中的任何序列杂交;(iii)它在测定条件下不形成有效缩短其长度的任何二级结构;以及(iv)它不与用于引发互补模板链的合成的常规反向引物杂交。此外,如果模板链中的插入序列在测定条件下形成有效缩短其长度的二级结构,桥序列的长度可以被增加并且插入序列的长度可以减少相应数量的核苷酸(通过选择更接近于具有相同数量的核苷酸的足靶序列的锚定靶序列来实现)。
桥序列可以被选择为相对短或相对长的认识,以及探针设计者能够针对桥节段选择任意序列的认识,开辟了本发明的超级选择性引物的设计的更多的功能可能性。
例如,如果在模板中天然存在的推定的插入序列的序列是这样,使得它可能在测定条件下形成二级结构,所述引物可以被设计以使得在引物-模板杂交体中建立相对小的插入序列,从而破坏二级结构的形成,并且引物的桥序列可以被选择成具有相对更长的长度,从而保持测定的选择性(参见表4中所示的结果)。此外,引物功能可以通过选择考虑到插入序列和桥序列的灵活性中的差异的桥序列的序列而被精细调节。
另外,针对超级选择性引物选择合适的桥序列明显抑制假阳性扩增子(如引物二聚体)的出现。不同于常规线性引物的设计(其序列由其所结合的模板确定),任意序列可以被用于桥节段。本发明人仔细选择桥序列:(i)不形成二级结构;(ii)与模板的序列、基因组DNA的序列和常规反向引物的序列不相关;以及(iii)当被引入全长引物时,不能使得引物发生自身杂交。
c.由桥序列和插入序列形成的泡的作用
在上述可接受的范围内,由超级选择性引物与原始模板分子杂交所形成的泡的周长越大,野生型扩增子合成的抑制相对于突变体扩增子合成的抑制越大(参见例如图11)。从热力学的角度,较大的泡应当降低野生型杂交体和突变体杂交体二者的平衡丰度,但应当不改变它们的相对丰度。但是,从动力学的角度,考虑撞击将足杂交体连接至靶杂交体的泡的力是合适的,因为泡经受在反应混合物中水分子的随机布朗运动。这建立了具有将足杂交体分开的潜能的力。泡的周长越大,则这种潜在的破坏力就越大。此外,错配的野生型杂交体(其比完全互补的突变体杂交体更弱)更可能被分开。
因此,错配的野生型杂交体,不仅由于它们较低的稳定性而存在更短的时间,而且它们更容易被撞击泡的随机力分开。因此,本发明人认为超级选择性引物的非凡选择性源于影响杂交体稳定性的热力学因素并且源于影响所得到的杂交体的平均持续时间的动力学因素。
d.足序列
足序列位于引物的3'端;它与模板链的区域互补,其中在预期的靶序列及其密切相关的非预期的靶序列之间至少有一个核苷酸的差异,如定位的单核苷酸多态性;并且它通常长七个核苷酸。在足序列中的“查询核苷酸”可以位于足序列的3'端的倒数第二个位置,或位于足序列的3'端。可以改变足序列的长度以改善选择性。足序列可以更短(长六个或甚至五个核苷酸),尤其是如果它具有高G-C含量。如果查询核苷酸会与野生型模板链形成G:T碱基对,相反地,设计引物使得它与互补的模板链结合则是期望的。
如果足序列与靶序列杂交,并且如果DNA聚合酶能够与该杂交体在杂交体分开之前形成功能复合体,那么足序列的延伸可以由DNA聚合酶催化以产生扩增子。应当理解的是,短的足序列(例如长6或7个核苷酸)一般如此之短以至于它们与可能存在于待测样品中的核酸内(例如来自人细胞的基因组DNA中)的大量不同位置存在的序列互补。但是,足序列是如此的短,并且结果是具有如下的解链温度Tm,其在用于扩增的条件下(如用于PCR测定的条件)是如此极其的低,以至于足序列不会与待测核酸样品中任何完全互补的序列形成杂交体,除非引物的锚定序列已经首先与待测核酸内的位置杂交,其仅离所期望的靶序列几个核苷酸。
一旦以本文公开的方式进行设计,引物序列可以在任何合适的计算机程序(如OligoAnalyzer计算机程序(Integrated DNA Technologies,Coralville,IA))的帮助下进行检查,以确保在测定条件下它们不可能形成内部发夹结构或自身二聚体,并确保它们不与常规反向引物形成异二聚体。
7.试剂盒
本发明进一步包括含有用于进行上述扩增方法(包括扩增和检测方法)的试剂的试剂盒。为此目的,用于本文所公开的方法的一种或多种反应成分可以用于检测靶核酸的试剂盒的形式提供。在这样的试剂盒中,在一个或多个容器中提供合适量的一种或多种反应成分或保持在基质上的(例如通过静电相互作用或共价键合)。
本文所述的试剂盒包括一种或多种上述的引物。试剂盒可以包括含有本发明的一种或多种引物的一个或多个容器。试剂盒可以在单个容器中含有单个引物、含有相同的引物的多个容器、含有本发明的两种或多种不同引物的单个容器或者含有不同引物或含有两种或多种引物的混合物的多个容器。本发明的试剂盒涵盖了引物和容器的任意组合和排列。
试剂盒还含有用于实施上述方法的另外的材料。在一些实施方案中,试剂盒含有这些试剂、用于使用根据本发明的引物进行的方法的材料的一些或全部。因此,试剂盒可以包含使用本发明的引物进行PCR反应的试剂的一些或全部。试剂盒的一些或全部成分在与含有本发明的引物的容器分开的形式提供于容器中。试剂盒的另外的成分的实例包括但不限于一种或多种不同的聚合酶、特异性针对对照核酸或针对靶核酸的一种或多种引物、特异性针对对照核酸或针对靶核酸的一种或多种探针、用于聚合反应的缓冲液(以1X或浓缩的形式)以及用于检测聚合产物的一种或多种染料或荧光分子。试剂盒还可以包括以下的一种或多种成分:支持物、终止试剂、修饰试剂或消化试剂、渗透剂以及用于检测检测探针的装置。
在扩增和/或检测过程中使用的反应成分被以各种形式提供。例如,成分(例如,酶、核苷三磷酸、探针和/或引物)可以悬浮于水溶液中或作为冷冻干燥或冻干粉、丸或珠。在后种情况下,当重建时,成分形成用于测定的成分的完全混合物。
试剂盒或系统可以足以用于进行至少一个测定的量含有本文所述成分的任意组合,并且可以进一步包括用于使用组分的记录在有形形式中的说明书。在一些应用中,一种或多种反应成分可以预先测量的单次使用的量在单个(典型地一次性的)管或等价容器中提供。以这样的安排,等待检测靶核酸存在的样品可以被加至所述单个管并直接进行扩增。在试剂盒中提供的组分的量可以是任何合适的量,并且可以取决于所述产品涉及的目标市场。用于确定合适的量的一般指南可见于例如Joseph Sambrook and David W.Russell,Molecular Cloning:ALaboratory Manual,3rd edition,Cold Spring Harbor Laboratory Press,2001和Frederick M.Ausubel,Current Protocols in Molecular Biology,John Wiley&Sons,2003。
本发明的试剂盒可以包含对于实践本发明的方法有用的任意数量的另外的试剂或物质。这样的物质包括但不限于:用于裂解细胞的试剂(包括缓冲液),二价阳离子螯合剂或抑制不想要的核酸的其它试剂,用于确保该引物、聚合酶或其它反应成分正常发挥功能的对照DNA,DNA片段化试剂(包括缓冲液),扩增反应试剂(包括缓冲液)和洗涤溶液。本发明的试剂盒可以在任意温度提供。例如,用于存储含有液体中的蛋白质成分或其复合体的试剂盒,优选将其提供并保持在0℃以下,优选在或者低于-20℃,或者处于其它冷冻状态下。
在其中提供成分的容器可以是任何常规容器,其能够容纳所提供的形式,例如微量离心管、安瓿、瓶或一体测试装置,例如微流装置、药筒、横向流动(lateral flow)或其它类似装置。试剂盒可以包括用于扩增或检测靶核酸的标记的或未标记的核酸探针。在一些实施方案中,试剂盒可以进一步包括使用在本文所述的任何方法(例如使用无需核酸提取和/或纯化的粗基质的方法)中的成分的说明书。
试剂盒还可以包括用于容纳容器或容器的组合的包装材料。用于这样的试剂盒和系统的典型的包装材料包括固体基质(例如玻璃、塑料、纸、箔,微粒等),其以任何的多种构型容纳反应成分或检测探针(例如在小瓶、微量滴定板孔、微阵列等中)。
8.另外的定义
如本文所用,术语“靶核酸”或“靶序列”是指含有靶核酸序列的核酸。靶核酸可以是单链或双链的,并且经常是DNA、RNA、DNA或RNA的衍生物或其组合。“靶核酸序列”、“靶序列”或“目标区域”是指一个特定的序列,其包含单链核酸的序列的全部或一部分。靶序列可以位于核酸模板内,其可以是任何形式的单链或双链核酸。模板可以是纯化的或分离的核酸,或者可以是非纯化的或非分离的。
如本文所用,术语“扩增”及其变体包括用于产生多核苷酸的至少某部分的多个拷贝或互补物的任何过程,所述多核苷酸典型地被称为“模板”。模板多核苷酸可以是单链或双链的。给定模板的扩增能够导致产生一群多核苷酸扩增产物,统称为“扩增子”。扩增子的多核苷酸可以是单链的或双链的,或者是二者的混合物。典型地,模板会包括靶序列,并且所得到的扩增子会包括具有基本上与靶序列相同或基本上互补的序列的多核苷酸。在一些实施方案中,特定扩增子的多核苷酸基本上彼此相同或基本上彼此互补;备选地,在一些实施方案中,在给定扩增子内的多核苷酸可以具有相互变化的核苷酸序列。扩增可以线性或指数形式进行,并且可以涉及给定模板的反复和连续的复制以形成两个或多个扩增产物。一些典型的扩增反应包括基于模板的核酸合成的连续和重复循环,从而产生含有模板的核苷酸序列的至少一些部分和与模板至少共享某种程度的核苷酸序列同一性(或互补性)的多个子多核苷酸的形成。在一些实施方案中,每个核酸合成的情况,其可以被称为扩增的“循环”,包括建立游离的3'端(例如通过dsDNA的一条链的切口)从而产生引物和引物延伸步骤;任选地,还可以包括另外的变性步骤,其中模板被部分或完全变性。在一些实施方案中,一轮扩增包括扩增的单个循环的给定的次数的重复。例如,一轮扩增可以包括特定循环的5、10、15、20、25、30、35、40、50或更多次重复。在一个示例性的实施方案中,扩增包括任何反应,其中特定的多核苷酸模板经受两个连续的核酸合成循环。合成可以包括模板依赖性核酸合成。
术语“引物”或“引物寡核苷酸”是能够与模板核酸杂交的核苷酸并作为根据模板核酸的组成用于核酸合成以掺入延伸核苷酸的起点的核酸链或者寡核苷酸。“延伸核苷酸”是指在扩增期间能够被掺入延伸产物的任何核苷酸,即,DNA、RNA或者DNA或RNA的衍生物,其可以包括标记。
“杂交(hybridization)”或“杂交(hybridize)”或“退火”是指完全或部分互补的核酸链在特定的杂交条件(例如,在严格杂交条件)以平行或优选反向平行方向聚集在一起,以形成稳定的双链结构或区域(有时称为“杂交体”)的能力,其中两个组成链通过氢键结合。虽然氢键典型地在腺嘌呤和胸腺嘧啶或尿嘧啶(A和T或U)或者胞嘧啶和鸟嘌呤(C和G)之间形成,其它碱基对也可以形成(例如Adams et al.,The Biochemistry of the Nucleic Acids,11th ed.,1992)。
术语“严格杂交条件”或“严格条件”是指这样的条件:其中探针或低聚物与其预期的靶核酸序列特异性杂交而不与另一个序列杂交。可以基于众所周知的因素(例如GC含量和序列长度)改变严格条件,并且可以使用分子生物学领域的普通技术人员公知的标准方法进行经验性预测或确定(例如Sambrook,J.et al.,1989,Molecular Cloning,ALaboratory Manual,2nd ed.,Ch.11,pp.11.47-11.57,(Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.))。
如本文所公开,提供许多值的范围。应当理解的是该范围的上限和下限之间的每个中间值(到下限的单位的十分之一,除非上下文另有明确说明)也被具体公开。在所述范围中的任何所述值或中间值和所述范围中的任何其它所述值或中间值之间的每个较小的范围均包括在本发明之内。这些较小范围的上限和下限可独立地包括或排除在该范围内,并且其中任一,两者都不是,或两个界限都包括在较小范围的每个范围也包括在本发明内,服从于所述范围内任何具体排除的限制。当所述范围包括限之一或二者,排除这些所包括的限任一或二者的范围也包括于本发明内。
术语“大约”一般是指所示的数加上或者减去10%。例如“大约10%”可以表示9%至11%的范围,并且“大约1”可以表示从0.9-1.1。从上下文中可以明显知道“大约”的其它意思,如四舍五入,所以,例如,“大约1”也可指从0.5至1.4。
实施例
实施例1:EGFR突变L858R和常规线性引物
使用含有EGFR突变L858R的质粒DNA或含有相应野生型序列的质粒DNA(它们互相之间有多核苷酸多态性的不同)作为模板进行两个PCR扩增和检测测定。使用常规正向和反向引物产生49个核苷酸长的双链扩增产物。正向引物(FP)为常规引物,其含有接近引物序列中部的查询核苷酸。反向引物(RP)为常规引物,其与两个靶序列均完全互补。引物序列和具有突变体等位基因(MUT)的预期的靶序列如下:
FP:5'-ATTTTGGGCGGCCAAACTGC-3' (SEQ ID No.1)
MUT:
3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5'(SEQ ID No.2)
RP:5'-GCATGGTATTCTTTCTCTTCCGCA-3' (SEQ ID No.3)
在正向引物序列中,与突变体靶模板互补但与野生型模板错配的核苷酸为加粗、加下划线并更大。在突变体靶序列中,正向引物的结合位点加下划线,并且反向引物的序列加下划线。此外,在突变体靶序列中,特异性针对突变体的核苷酸加粗、加下划线并更大。使用Integrated DNA Technologies的用于计算DNA杂交体的解链温度的SciTools程序(具体参数:[oligo]=0.06μM;[Na+]=60mM;[Mg2+]=3mM;[dNTPs]=0.25mM),与突变体等位基因结合的正向引物的计算的Tm是67.5℃,并且反向引物所计算的Tm是64.0℃。
通过将115个碱基对的EGFR基因片段(含有EGFR L858R突变或相应的EGFR野生型序列)插入pGEM-11Zf(+)载体(Promega)制备质粒。用限制性内切酶Mse I(New England Biolabs)消化突变体和野生型质粒DNA。消化混合物含有在20μl体积(其含有5mM KAc、2mM Tris-Ac(pH 7.9)、1mM MgAc、1%牛血清白蛋白和100μM的二硫苏糖醇)中的10单位的Mse I和4μg的突变体或野生型基因组DNA。在37℃孵育反应120min,接着在65℃孵育20min以灭活酶。
在30μl体积(其含有50mM KCl、10mM TrisHCl(pH 8.0)、3mM MgCl2、1.5单位的AmpliTaq Gold DNA聚合酶(Life Technologies)、四种脱氧核糖核苷三磷酸(dNTP)每种250μM、60nM的每种引物和Green(Life Technologies))进行PCR扩增。在该系列中,反应混合物含有106个拷贝的突变体模板(MUT)或106个拷贝的野生型模板(WT)。使用0.2ml聚丙烯PCR管(白)在Bio-Rad IQ5荧光光谱热循环仪中进行扩增。热循环配置为95℃10min,接着60个循环的94℃15sec、60℃15sec和72℃20sec。在每个链延伸阶段(72℃)结束时测量Green荧光强度。
作为完成的扩增循环数的函数的实时荧光结果(即SYBR荧光强度)示于图5中,其中曲线501是含有106MUT模板的反应并且曲线502是含有106WT模板的反应。该测定仪器自动计算每个反应的循环阈值(CT)。这些值是20.0(曲线501)和19.7(曲线502)。在该图的左上角是常规正向引物(直线)的示意图,其在中部具有查询核苷酸(圆圈)。
实施例2:EGFR突变L858R和具有3'末端查询核苷酸的常规线性引物
使用如实施例1中所述的突变体(MUT)和野生型(WT)模板进行PCR扩增和检测测定。在该实验中,正向引物是“ARMS引物”,即,与突变体模板完全互补但与WT模板具有3'末端错配的引物,即,在引发序列的3'端具有查询核苷酸。本发明人使用与实施例1中的相同的反向引物。引物序列和具有突变体等位基因(MUT)的预期的靶序列如下:
FP:5'-CAAGATCACAGATTTTGGGC-3' (SEQ ID No.4)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5’(SEQ ID No.2)
RP:5'-GCATGGTATTCTTTCTCTTCCGCA-3' (SEQ ID No.3)
在正向引物序列中,与突变体靶模板互补但与野生型模板错配的核苷酸被加粗、加下划线并且更大。在突变体靶序列中,正向引物的结合位点加下划线,并且反向引物的序列加下划线。此外,在突变体靶序列中,特异性针对突变体的核苷酸加粗、加下划线并更大。使用Integrated DNATechnologies的用于计算DNA杂交体的解链温度的SciTools程序(具体参数:[oligo]=0.06μM;[Na+]=60mM;[Mg2+]=3mM;[dNTPs]=0.25mM),与突变体等位基因结合的正向引物的计算的Tm是60.7℃,并且反向引物所计算的Tm是64.0℃。
如实施例1中所述进行PCR扩增。作为完成的扩增循环数的函数的实时荧光结果(即SYBR荧光强度)示于图6的图A中,其中曲线601是以106个MUT模板起始的反应,而曲线602是以106个WT模板起始的反应。该测定仪器自动计算每个曲线的循环阈值(CT)。那些值是19.4(曲线601)和30.4(曲线602),得到11个循环的ΔCT。在图的上部左侧角落是具有位于引物3'端的查询核苷酸(圆)的常规正向引物(直线)的代表性示意图。
以在其3'端倒数第二个位置具有查询核苷酸的正向引物重复上述实验(本发明人向引物的3'端加了G并去除5'末端的C以保持引物长度)。所得到的正向引物的序列是:
FP:5'-AAGATCACAGATTTTGGGCG-3' (SEQ ID No.5)
使用Integrated DNATechnologies的SciTools程序和上述相同的反应条件,所计算的正向引物结合突变体等位基因的Tm为61.9℃。
作为完成的扩增循环数的函数的实时荧光结果(即SYBR荧光强度)示于图6的图B中,其中曲线603是以106个MUT模板起始的反应,而曲线604是以106个WT模板起始的反应。机器计算的CT值是19.1(曲线603)和27.8(曲线604),得到8.8个循环的ΔCT。在图的上部左侧角落是具有位于引物3'端倒数第二个位置的查询核苷酸(圆)的常规正向引物(直线)的代表性示意图。
实施例3:EGFR突变L858R和24-14-5:1:1多部分引物(实时数据)
使用实施例1中所述的突变体(MUT)和野生型(WT)模板进行两个PCR扩增和检测测定。在该实验中,正向引物(FP)是根据本发明的多部分引物。本发明人使用与实施例1中的相同的反向引物。
在本发明人的命名法中,在该实施例中使用的多部分引物是指这样的形式,如“24-14-5:1:1”引物是指长24个核苷酸的锚定序列、长14个核苷酸的桥序列以及长七个核苷酸的足序列(包含,从足序列的5'端、与MUT和WT靶均互补的五个核苷酸、与WT靶中的相应核苷酸不互补但与MUT靶中的相应核苷酸互补的一个查询核苷酸,以及,最后,与两个靶均互补的一个核苷酸)。因为查询核苷酸位于引物3'端内侧的一个核苷酸,本发明人将该核苷酸称之为位于“3'-倒数第二个位置”。将桥序列与位于锚定序列的结合序列和足序列的结合序列之间的靶序列的区域(本发明人将其称之为“插入序列”)进行比较时,看到在该实施例中的插入序列长十四个核苷酸,其长度与桥序列的长度相同。选择桥序列的序列,使得其与插入序列不互补,以防止桥序列与插入序列在引物退火期间杂交。代替彼此退火的是,当锚定序列和足序列均与模板杂交时,桥序列和插入序列形成单链的“泡”。“泡的周长”被定义为桥序列中的核苷酸的数量加上插入序列中核苷酸的数量加上锚定序列的3'核苷酸及其互补序列加上足序列的5'-末端核苷酸及其互补序列的总合。因此,由该实施例中的多部分引物与该实施例中使用的模板分子的结合所形成的泡的周长为14+14+2+2,其等于长32个核苷酸。
引物序列和具有突变体等位基因(MUT)的预期的靶序列如下:
引物24-14-5:1:1 锚定 桥 足
FP:5'-CTGGTGAAAACACCGCAGCATGTCGCACGAGTGAGCCCTGGGCG-3'(SEQ ID No.6)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
RP:5'-GCATGGTATTCTTTCTCTTCCGCA-3' (SEQ ID No.3)
在多部分正向引物中,桥序列加下划线,并且在足序列中的查询核苷酸加粗、加下划线并且更大。在突变体靶序列中,针对正向引物的锚定序列和针对正向引物的足序列的结合序列加下划线,并且反向引物的序列加下划线。此外,在突变体靶序列中,特异性针对突变体的核苷酸加粗、加下划线并更大。使用Integrated DNATechnologies的用于计算DNA杂交体的解链温度的SciTools程序(具体参数:[oligo]=0.06μM;[Na+]=60mM;[Mg2+]=3mM;[dNTPs]=0.25mM),锚定序列与模板结合的Tm是66.9℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是79.9℃。
如实施例1中所述进行PCR扩增。作为完成的扩增循环数的函数的实时荧光结果(即SYBR荧光强度)示于图7中,其中曲线701是以106个MUT模板起始的反应,而曲线702是以106个WT模板起始的反应。该测定仪器自动计算每个反应的循环阈值(CT)。这些值是22.9(曲线701)和41.1(曲线702),得到18.2个循环的ΔCT。在图的上部左侧角落是具有位于引物3'端倒数第二个位置的查询核苷酸(圆)的多部分引物(桥序列为半圆)的代表性示意图。
实施例4:EGFR突变L858R和24-14-5:1:1多部分引物(选择性扩增)
使用与实施例3中所述的相同的多部分引物、反向引物、预期的靶(MUT)和非预期的靶(WT)进行一系列PCR扩增和检测测定。如实施例3中所述进行扩增。作为完成的扩增循环数的函数的实时荧光结果(即SYBR荧光强度)示于图8中,其中曲线801是以106个WT模板起始的反应,而曲线802-807是每个反应含有106个WT模板分别加上106、105、104、103、102或101个MUT模板的稀释系列。该测定仪器自动计算每个反应的循环阈值(CT)。那些值是41.1(曲线801)、23.3(曲线802)、26.8(曲线803)、30.5(曲线804)、33.8(曲线805)、37.0(曲线806)和39.2(曲线807)。在图的上部左侧角落是具有位于引物3'端倒数第二个位置的查询核苷酸(圆)的多部分引物(桥序列为半圆)的代表性示意图。
图9是作为在含有MUT模板的反应中存在的MUT模板数的对数的函数的每个反应所观察到的CT值(从图8中曲线802至807获得)的图。线901是拟合至数据点的线性相关。虚线902标识了以106个WT模板及无MUT模板起始的扩增的CT值。
实施例5:EGFR突变L858R和减少多部分引物足序列长度的作用
使用具有长七个核苷酸的足序列的相同的24-14-5:1:1引物(SEQ.ID No.6)重复实施例4中所述的实验;并且还使用相同设计的另外两个多部分引物,除了所述另外的引物之一的足序列要长一个核苷酸(24-14-6:1:1)和另一个另外的引物的足序列要短一个核苷酸(24-14-4:1:1)。在所有三种情况下,锚定序列长24个核苷酸、桥序列长14个核苷酸以及靶的插入序列长14个核苷酸,使得在所有情况下泡周长为32个核苷酸。此外,在所有三种情况下,查询核苷酸位于引物的足序列的3'倒数第二个位置。引物序列以及它们的预期的靶序列(MUT)如下:
引物24-14-4:1:1 锚定 桥 足
FP:5'-TGGTGAAAACACCGCAGCATGTCACACGAGTGAGCCCCGGGCG-3' (SEQ ID No.7)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-14-5:1:1 锚定 桥 足
FP:5'-CTGGTGAAAACACCGCAGCATGTCGCACGAGTGAGCCCTGGGCG-3' (SEQ ID No.6)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-14-6:1:1 锚定 桥 足
FP:5'-ACTGGTGAAAACACCGCAGCATGTTGGAGCTGTGAGCCTTGGGCGG-3' (SEQ ID No.8)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
反向引物
RP:5'-GCATGGTATTCTTTCTCTTCCGCA-3' (SEQ ID No.3)
在多部分正向引物中,桥序列加下划线,并且在足序列中的查询核苷酸加粗、加下划线并且更大。在突变体靶序列中,针对正向引物的锚定序列和针对正向引物的足序列的结合序列加下划线,并且反向引物的序列加下划线。此外,在突变体靶序列中,特异性针对突变体的核苷酸加粗、加下划线并更大。使用Integrated DNA Technologies的用于计算DNA杂交体的解链温度的SciTools程序(具体参数[oligo]=0.06μM;[Na+]=60mM;[Mg2+]=3mM;[dNTPs]=0.25mM);24-14-4:1:1锚定序列与模板结合的Tm是68.1℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是80.3℃;24-14-5:1:1锚定序列与模板结合的Tm是66.9℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是79.9℃;以及24-14-6:1:1锚定序列与模板结合的Tm是68.1℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是79.4℃。
对于三个多部分引物设计的每一个,如实施例4所述进行一系列PCR扩增和检测测定,使用以106个WT模板分别加上106、105、104、103、102或101个MUT模板的稀释系列。该测定仪器自动计算每个反应的循环阈值(CT)。从每个反应的实时数据(未显示)所计算的CT值和以106个WT模板及无MUT模板起始的反应所计算的CT值一起列于表1中。
表1
图10是显示作为在每个反应中存在的MUT模板数的对数的函数的所观察到的CT值(对于含有相同引物的每一组反应)的一组图。线1001是拟合至具有六个核苷酸长的足序列(4:1:1)的引物的CT值的线性相关;线1002是拟合至具有七个核苷酸长的足序列(5:1:1)的引物的CT值的线性相关;以及线1003是拟合至具有八个核苷酸长的足序列(6:1:1)的引物的CT值的线性相关。当使用24-14-6:1:1引物时,较低丰度的MUT模板样品给出某种程度上比预测的更早存在的CT值,表明由样品中丰富的WT模板产生的少量不明了的(obscuring)扩增子的存在。
这些结果证实,使用具有更短的足序列的多部分引物(如引物24-14-5:1:1)减少了该问题,并且使用具有最短的足序列的多部分引物(如引物24-14-4:1:1)基本上消除了该问题,使得能够在存在1,000,000个非预期的模板分子的情况下检测和定量少至10个预期的模板分子。
实施例6:EGFR突变L858R和增加多部分引物泡周长的作用
使用具有长14个核苷酸的桥序列(当与其模板杂交时其建立也长14个核苷酸的插入序列)的相同的24-14-5:1:1引物(SEQ.ID No.6)重复实施例4中所述的实验;并且还使用相同设计的另外两个多部分引物,除了所述另外的引物之一的桥序列长18个核苷酸(24-18-5:1:1)和另一个另外的引物的桥序列长10个核苷酸(24-10-5:1:1)。在所有三种情况下,锚定序列长24个核苷酸,足序列是5:1:1,并且这样选择锚定序列使得当引物结合其模板时所建立的插入序列与引物的桥序列长度相同。结果,由该系列的三个多部分引物所形成的泡周长分别长24、32和40个核苷酸。此外,在所有三种情况下,查询核苷酸位于引物的足序列的3'倒数第二个位置。引物序列以及预期的靶序列(MUT)如下:
引物24-10-5:1:1 锚定 桥 足
FP:5'-TGAAAACACCGCAGCATGTCAAGACACTCAGCCCTGGGCG-3'(SEQ ID No.10)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-14-5:1:1 锚定 桥 足
FP:5'-CTGGTGAAAACACCGCAGCATGTCGCACGAGTGAGCCCTGGGCG-3' (SEQ ID No.6)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-18-5:1:1 锚定 桥 足
FP:5'-CGTACTGGTGAAAACACCGCAGCACTGACGACAAGTGAGCCCTGGGCG-3' (SEQ ID No.9)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
反向引物
RP:5'-GCATGGTATTCTTTCTCTTCCGCA-3' (SEQ ID No.3)
在多部分正向引物中,桥序列加下划线,并且在足序列中的查询核苷酸加粗、加下划线并且更大。在突变体靶序列中,针对正向引物的锚定序列和针对正向引物的足序列的结合序列加下划线,并且反向引物的序列加下划线。此外,在突变体靶序列中,特异性针对突变体的核苷酸加粗、加下划线并更大。使用Integrated DNA Technologies的用于计算DNA杂交体的解链温度的SciTools程序(具体参数[oligo]=0.06μM;[Na+]=60mM;[Mg2+]=3mM;[dNTPs]=0.25mM);24-10-5:1:1锚定序列与模板结合的Tm是66.3℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是78.0℃;24-14-5:1:1锚定序列与模板结合的Tm是66.9℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是79.9℃;以及24-18-5:1:1锚定序列与模板结合的Tm是67.9℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是79.3℃。
对于三个多部分引物设计的每一个,如实施例4所述进行一系列PCR扩增和检测测定,使用以106个WT模板分别加上106、105、104、103、102或101个MUT模板的稀释系列。该测定仪器自动计算每个反应的循环阈值(CT)。从每个反应的实时数据(未显示)所计算的CT值和以106个WT模板及无MUT模板起始的反应所计算的CT值一起列于表2中。
表2
图11是显示作为在每个反应中存在的MUT模板数的对数的函数的所观察到的CT值(对于含有相同引物的每一组反应)的一组图。线1101是拟合至形成具有24个核苷酸长的周长的泡的引物的CT值的线性相关;线1102是拟合至形成具有32个核苷酸长的周长的泡的引物的CT值的线性相关;以及线1103是拟合至形成具有40个核苷酸长的周长的泡的引物的CT值的线性相关。与具有更长的足序列的引物所发生的类似,当使用24-10-5:1:1引物(其形成相对小的泡)时,较低丰度的MUT模板样品给出某种程度上比预测的更早存在的CT值,表明由样品中丰富的WT模板产生少量不明了的(obscuring)扩增子的存在。
这些结果证实,使用形成更大的泡的多部分引物(如引物24-14-5:1:1)减少了该问题,并且使用形成最大的泡的多部分引物(如引物24-18-5:1:1)基本上消除了该问题,使得能够在存在1,000,000个非预期的模板分子的情况下检测和定量少至10个预期的模板分子。
实施例7:EGFR突变L858R和在多部分引物的足序列内改变查询核苷酸的位置的作用
使用包括七个核苷酸长的足序列(其中查询核苷酸位于引物3'端的倒数第二个位置)的相同的24-14-5:1:1引物(SEQ.ID No.6)重复实施例3中所述的实验,并且还使用相同设计的另外五个多部分引物,除了足序列的查询核苷酸的位置改变。在所有六种情况下,锚定序列长24个核苷酸、桥序列长14个核苷酸以及足序列长7个核苷酸。引物序列以及预期的靶序列(MUT)如下:
引物24-14-6:1:0 锚定 桥 足
FP:5'-ACTGGTGAAAACACCGCAGCATGTTGCACGAGTGAGCCTTGGGC-3' (SEQ ID No.11)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-14-5:1:1 锚定 桥 足
FP:5'-CTGGTGAAAACACCGCAGCATGTCGCACGAGTGAGCCCTGGGCG-3'(SEQ ID No.6)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-14-4:1:2 锚定 桥 足
FP:5'-TGGTGAAAACACCGCAGCATGTCACACGAGTGAGCCACGGGCGG-3'(SEQ ID No.12)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-14-3:1:3 锚定 桥 足
FP:5'-GGTGAAAACACCGCAGCATGTCAAACGAGTGAGCCACAGGCGGC-3'(SEQ ID No.13)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-14-2:1:4 锚定 桥 足
FP:5'-GTGAAAACACCGCAGCATGTCAAGGAAGTGAGCCACAAGCGGCC-3'(SEQ ID No.14)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-14-1:1:5 锚定 桥 足
FP:5'-TGAAAACACCGCAGCATGTCAAGACAGACTGACCCAAACGGCCA-3'(SEQ ID No.15)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
反向引物
RP:5'-GCATGGTATTCTTTCTCTTCCGCA-3' (SEQ ID No.3)
在多部分正向引物中,桥序列加下划线,并且在足序列中的查询核苷酸加粗、加下划线并且更大。在突变体靶序列中,针对正向引物的锚定序列和针对正向引物的足序列的结合序列加下划线,并且反向引物的序列加下划线。此外,在突变体靶序列中,特异性针对突变体的核苷酸加粗、加下划线并更大。使用Integrated DNATechnologies的用于计算DNA杂交体的解链温度的SciTools程序(具体参数[oligo]=0.06μM;[Na+]=60mM;[Mg2+]=3mM;[dNTPs]=0.25mM);24-14-6:1:0锚定序列与模板结合的Tm是67.9℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是79.0℃;24-14-5:1:1锚定序列与模板结合的Tm是66.9℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是79.9℃;24-14-4:1:2锚定序列与模板结合的Tm是68.1℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是80.0℃;24-14-3:1:3锚定序列与模板结合的Tm是67.0℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是78.9℃;24-14-2:1:4锚定序列与模板结合的Tm是65.6℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是78.2℃;以及24-14-1:1:5锚定序列与模板结合的Tm是66.6℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是78.1℃。
如实施例1中所述进行PCR扩增。作为完成的扩增循环数的函数的实时荧光结果(即,SYBR荧光强度)示于图12的六个图中,其中每个图均标识了所使用的多部分引物。在每个图中,编号为奇数的曲线是起始含有106个MUT模板的样品所获得的结果,并且编号为偶数的曲线是起始含有106个WT模板的样品所获得的结果。表3列出了每个引物两个靶的机器计算的CT值,并且还显示了差异(ΔCT)。
表3
实施例8:EGFR突变L858R和改变多部分引物泡对称性的作用
使用形成对称的泡(其包括14个核苷酸长的桥序列和来自模板的14个核苷酸长的插入序列)的相同的24-14-5:1:1引物(SEQ.ID No.6)重复实施例3中所述的实验;并且该实验还使用与突变体靶(SEQ ID No.2)形成不同非对称的泡的另外的四个多部分引物。“非对称的泡”指由桥序列和具有不同长度的模板中的插入序列所形成的泡。在该实验中,被比较的所有多部分引物具有24个核苷酸长的锚定序列、5:1:1足序列以及不同长度的桥序列(其长为18、16、14、12或10个核苷酸)。针对每个多部分引物,选择锚定序列的身份(identity)使得桥序列的长度加上插入序列(由锚定序列和足序列二者与模板结合形成)的长度的和等于28。结果,这五个多部分引物的每一个形成的泡的周长总是相同的。该实验的目的是确定非对称的泡的形成是否影响引物的选择性。引物序列以及预期的靶序列(MUT)如下:
引物24-18/10-5:1:1 锚定 桥 足
FP:5'-TGAAAACACCGCAGCATGTCAAGACACACGACAAGTGAGCCCTGGGCG-3' (SEQ ID No.16)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-16/12-5:1:1 锚定 桥 足
FP:5'-GGTGAAAACACCGCAGCATGTCAATCCAACAAGTGAGCCCTGGGCG-3'(SEQ ID No.17)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-14/14-5:1:1 锚定 桥 足
FP:5'-CTGGTGAAAACACCGCAGCATGTCGCACGAGTGAGCCCTGGGCG-3'(SEQ ID No.6)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-12/16-5:1:1 锚定 桥 足
FP:5'-TACTGGTGAAAACACCGCAGCATGGACGACGAGCCCTGGGCG-3'(SEQ ID No.18)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-10/18-5:1:1 锚定 桥 足
FP:5'-CGTACTGGTGAAAACACCGCAGCACTGACGGCCCTGGGCG-3'(SEQ ID No.19)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5'(SEQ ID No.2)
反向引物
RP:5'-GCATGGTATTCTTTCTCTTCCGCA-3' (SEQ ID No.3)
在多部分正向引物中,桥序列加下划线,并且在足序列中的查询核苷酸加粗、加下划线并且更大。在突变体靶序列中,针对正向引物的锚定序列和针对正向引物的足序列的结合序列加下划线,并且反向引物的序列加下划线。此外,在突变体靶序列中,特异性针对突变体的核苷酸加粗、加下划线并更大。使用Integrated DNATechnologies的用于计算DNA杂交体的解链温度的SciTools程序(具体参数[oligo]=0.06μM;[Na+]=60mM;[Mg2+]=3mM;[dNTPs]=0.25mM);24-18/10-5:1:1锚定序列与模板结合的Tm是66.3℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是79.1℃;24-16/12-5:1:1锚定序列与模板结合的Tm是67.0℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是78.5℃;24-14/14-5:1:1锚定序列与模板结合的Tm是66.9℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是79.9℃;24-12/16-5:1:1锚定序列与模板结合的Tm是66.3℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是79.5℃;以及24-10/18-5:1:1锚定序列与模板结合的Tm是67.9℃,并且整个多部分引物与所得到的互补扩增子结合的Tm是79.3℃。
如实施例1中所述进行PCR扩增。作为完成的扩增子循环数的函数的实时荧光结果(即,SYBR荧光强度)示于图13的五个图中,其中每个图均标识了泡,泡能够由桥序列的长度和靶的插入序列的长度形成(例如,“18/10泡”表示使用正向引物24-18/10-5:1:1,其能够与靶形成长10个核苷酸的插入序列)。在每个图中,编号为奇数的曲线是起始含有106个MUT模板的样品所获得的结果,并且编号为偶数的曲线是起始含有106个WT模板的样品所获得的结果。表4列出了每个引物两个靶的机器计算的CT值,并且还显示了差异(ΔCT)。
表4
实施例9:B-raf突变V600E
本发明人使用具有靶向B-raf突变V600E(其为单核苷酸多态性)的根据本发明的多部分引物的实施例4的方法。用于比较的目的,本发明人对引物采用了24-14-5:1:1的设计。引物序列以及预期的靶序列(MUT)如下:
B-raf引物 锚定 桥 足
FP:5'-AGACAACTGTTCAAACTGATGGGAAAACACAATCATCTATTTCC-3'(SEQ ID No.20)
MUT:3'-GGTCTGTTGACAAGTTTGACTACCCTGGGTGAGGTAGCTCTAAAGGACATCGATCTGGTTTTAGTGGATAAAAA-5' (SEQ ID No.21)
反向引物
RP:5'-ATAGGTGATTTTGGTCTAGC-3' (SEQ ID No.22)
在多部分正向引物中,桥序列加下划线,并且在足序列中的查询核苷酸加粗、加下划线并且更大。在突变体靶序列中,针对正向引物的锚定序列的结合序列和针对正向引物的足序列的结合序列加下划线,并且反向引物的序列加下划线。使用Integrated DNATechnologies的用于计算DNA杂交体的解链温度的SciTools程序(具体参数:[oligo]=0.06μM;[Na+]=60mM;[Mg2+]=3mM;[dNTPs]=0.25mM),锚定序列与模板结合的Tm是63.5℃,整个多部分引物与所得到的互补扩增子结合的Tm是71.1℃,并且反向引物结合所计算的Tm是56.1℃。
通过将合成的寡核苷酸插入pGEM-11Zf(+)载体(Promega)制备质粒,其对应于含有B-raf V600E突变或B-raf野生型序列的116bp的EGFR基因片段。用限制性内切酶Mse I(New England Biolabs)消化突变体和野生型质粒DNA。消化混合物含有在20μl体积(其含有5mM KAc、2mM Tris-Ac(pH 7.9)、1mM MgAc、1%牛血清白蛋白和100μM的二硫苏糖醇)中的10单位的Mse I和4μg的突变体或野生型基因组DNA。在37℃孵育反应120min,接着在65℃孵育20min以灭活酶。
在含有50mM KCl、10mM Tris-HCl(pH 8.0)、3mM MgCl2、1.5个单位AmpliTaq Gold DNA聚合酶、250μM的每种脱氧核糖核苷三磷酸(dNTP)、60nM的每种引物和Green的30μl体积中进行PCR扩增。使用0.2ml聚丙烯PCR管(白)在Bio-Rad IQ5荧光光谱热循环仪中进行扩增。热循环配置为95℃10min,接着60个循环的94℃15sec、60℃20sec和72℃20sec。在每个链延伸阶段(72℃)结束时测量Green荧光强度。
使用含有106个WT模板分别加上106、105、104、103、102或101个拷贝的MUT模板的稀释系列进行一系列PCR扩增和检测测定。本发明人还包括了仅含有106个WT模板的样品。根据实时荧光数据(未显示),测定仪器自动计算针对每个反应的阈值循环(CT)。对于B-raf V600E突变体稀释系列,那些值是27.7(106个MUT模板)、31.1(105个MUT模板)、34.1(104个MUT模板)、37.6(103个MUT模板)、43.0(102个MUT模板)、46.9(101个MUT模板)和50.8(106个WT模板并且无MUT模板)。图14是在含有MUT模板的每个反应中观察的作为该反应中存在的MUT模板数的对数的函数的CT值的图。线1401是拟合至数据点的线性相关。虚线1402标识了以106个WT模板及无MUT模板起始的扩增的CT值。
实施例10:人基因组DNA中EGFR突变T790M
使用含有EGFR突变T790M(分离自细胞系H1975,其含有EGFR T790M突变)的人基因组DNA和含有相应野生型序列(分离自获自Coriell Cell Repositories的人基因组DNA)(其与EGFR基因有单核苷酸多态性的不同)的人基因组DNA作为模板进行一系列PCR扩增和检测测定。正向引物是根据本发明的24-14-4:1:1多部分引物。反向引物是常规线性引物。引物序列以及预期的靶序列(MUT)如下:
T790M引物 锚定 桥 足
FP:5'-GCCTGCTGGGCATCTGCCTCACCTAATAATCTACAACAATCAG-3' (SEQ ID No.23)
MUT:3'-CACGGCGGACGACCCGTAGACGGAGTGGAGGTGGCACGTCGAGTAGTCGTCGAGTACGGGAAGCCGACGGAGGACC-5' (SEQ ID No.24)
反向引物
RP:5'-GAGGCAGCCGAAGGGCATGAGC-3' (SEQ ID No.25)
在多部分正向引物中,桥序列加下划线,并且在足序列中的查询核苷酸加粗、加下划线并且更大。在突变体靶序列中,针对正向引物的锚定序列的结合序列和针对正向引物的足序列的结合序列加下划线,并且反向引物的序列加下划线。使用Integrated DNATechnologies的用于计算DNA杂交体的解链温度的SciTools程序(具体参数:[oligo]=0.06μM;[Na+]=60mM;[Mg2+]=3mM;[dNTPs]=0.25mM),锚定序列与模板结合的Tm是72.5℃,整个多部分引物与所得到的互补扩增子结合的Tm是73.9℃,并且反向引物结合所计算的Tm是68.2℃。
用限制性内切酶Mse I消化突变体和野生型人基因组DNA。消化混合物在20μl体积(其含有5mM KAc、2mM Tris-Ac(pH 7.9)、1mM MgAc、1%牛血清白蛋白和100μM的二硫苏糖醇)中含有10单位的Mse I和4μg的突变体或野生型基因组DNA。在37℃孵育反应120min,接着在65℃孵育20min以灭活酶。
在含有50mM KCl、10mM Tris-HCl(pH 8.0)、3mM MgCl2、1.0个单位AmpliTaq Gold DNA聚合酶、250μM的每种脱氧核糖核苷三磷酸(dNTP)、60nM的每种引物和Green的20μl体积中进行PCR扩增。使用0.2ml聚丙烯PCR管(白)在Bio-Rad IQ5荧光光谱热循环仪上进行扩增。热循环配置为95℃10min,接着60个循环的94℃15sec、55℃15sec和72℃20sec。在每个链延伸阶段(72℃)结束时测量Green荧光强度。
使用含有10,000个WT模板分别加上10,000、3,000、1,000、300、100、30或10个拷贝的MUT模板的稀释系列进行一系列PCR扩增和检测测定。本发明人还包括了仅含有10,000个WT模板的样品。根据实时荧光数据(未显示),测定仪器自动针对每个反应计算阈值循环(CT)。对于该T790M稀释系列,那些值是29.2(10,000个MUT模板)、31.1(3,000个MUT模板)、32.7(1,000个MUT模板)、35.5(300个MUT模板)、38.2(100个MUT模板)、38.8(30个MUT模板)、40.7(10个MUT模板)和42.8(10,000个WT模板并且无MUT模板)。图15是观察含有MUT模板的每个反应作为该反应中存在的MUT模板数的对数的函数的CT值的图。线1501是拟合至数据点的线性相关。虚线1502是以10,000个WT模板及无MUT模板起始的扩增的CT值。
实施例11:在Applied Biosystems PRISM 7700荧光分光光度热循环仪中定量的EGFR突变L858R
使用不同的热循环仪器Applied Biosystems PRISM 7700荧光分光光度热循环仪,进行与实施例4中所报道的测定类似的实验以扩增和检测EGFR基因中的突变L858R。使用含有EGFR突变L858R的质粒DNA和含有相应野生型序列(其在EGFR基因中具有单核苷酸多态性的不同)的质粒DNA作为模板进行一系列PCR扩增和检测测定。与实施例4中所使用的模板相反,在该实验中,没有用限制性内切酶消化模板。用与实施例3中相同的多部分正向引物和常规反向引物进行扩增。引物序列以及预期的靶序列(MUT)如下:
引物24-14-5:1:1 锚定 桥 足
FP:5'-CTGGTGAAAACACCGCAGCATGTCGCACGAGTGAGCCCTGGGCG-3'(SEQ ID No.6)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
RP:5'-GCATGGTATTCTTTCTCTTCCGCA-3' (SEQ ID No.3)
在多部分正向引物中,桥序列加下划线,并且在足序列中的查询核苷酸加粗、加下划线并且更大。在突变体靶序列中,针对正向引物的锚定序列的结合序列和针对正向引物的足序列的结合序列加下划线,并且反向引物的序列加下划线。使用Integrated DNATechnologies的用于计算DNA杂交体的解链温度的SciTools程序(具体参数:[oligo]=0.06μM;[Na+]=60mM;[Mg2+]=3mM;[dNTPs]=0.25mM),锚定序列与模板结合的Tm是66.9℃,整个多部分引物与所得到的互补扩增子结合的Tm是79.9℃,并且反向引物结合所计算的Tm是68.2℃。
在含有50mM KCl、10mM Tris-HCl(pH 8.0)、3mM MgCl2、2.0个单位AmpliTaq Gold DNA聚合酶、250μM的每种脱氧核糖核苷三磷酸(dNTP)、60nM的每种引物和Green的40μl体积中进行PCR扩增。使用0.2ml聚丙烯PCR管(透明的)在Applied Biosystems PRISM 7700荧光分光光度热循环仪上进行扩增。热循环配置为95℃10min,接着55个循环的94℃15sec、60℃20sec和72℃20sec。在每个链延伸阶段(72℃)结束时测量Green荧光强度。
使用含有106个WT模板分别加上106、105、104、103、102或101个拷贝的MUT模板的稀释系列进行一系列PCR扩增和检测测定。本发明人还包括了仅含有106个WT模板的样品。根据实时荧光数据(未显示),测定仪器自动针对每个反应计算阈值循环(CT)。那些值是21.2(106个MUT模板)、24.9(105个MUT模板)、28.3(104个MUT模板)、32.2(103个MUT模板)、36.0(102个MUT模板)、37.6(101个MUT模板)和38.7(106个WT模板并且无MUT模板)。图16是作为在含有MUT模板的反应中存在的MUT模板数的对数的函数的每个反应所观察到的CT值的图。线1601是拟合至数据点的线性相关。虚线1602是以106个WT模板及无MUT模板起始的扩增的CT值。
实施例12:当多部分引物被用于PCR测定中时ARMS区分的作用
为了研究根据本发明的多部分引物的运转(functioning),本发明人重复了实施例3中所述的实验,不仅使用那里所述的24-14-5:1:1引物,而且使用了截短的24-14-5:0:0引物,其为具有相同的锚定序列、相同的桥序列和相同的五个足序列的5'核苷酸的引物。它缺少足序列的最后两个3'核苷酸。因此,它的足序列与预期的、突变体靶和非预期的、野生型靶二者均完全互补。采用了这两个多部分引物中的每一个的反应的引物序列和预期的靶序列(MUT)如下:
引物24-14-5:1:1 锚定 桥 足
FP:5'-CTGGTGAAAACACCGCAGCATGTCGCACGAGTGAGCCCTGGGCG-3' (SEQ ID No.6)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
引物24-14-5:0:0 锚定 桥 足
FP:5'-CTGGTGAAAACACCGCAGCATGTCGCACGAGTGAGCCCTGGGC-3' (SEQ ID No.26)
MUT:3'-CCTTGCATGACCACTTTTGTGGCGTCGTACAGTTCTAGTGTCTAAAACCCGCCGGTTTGACGACCCACGCCTTCTCTTTCTTATGGTACGTCTT-5' (SEQ ID No.2)
反向引物
RP:5'-GCATGGTATTCTTTCTCTTCCGCA-3' (SEQ ID No.3)
在多部分正向引物中,桥序列加下划线,并且在足序列中的查询核苷酸加粗、加下划线并且更大。在突变体靶序列中,针对正向引物的锚定序列的结合序列和针对正向引物的足序列的结合序列加下划线,并且反向引物的序列加下划线。使用Integrated DNATechnologies的用于计算DNA杂交体的解链温度的SciTools程序(具体参数:[oligo]=0.06μM;[Na+]=60mM;[Mg2+]=3mM;[dNTPs]=0.25mM),锚定序列和引物二者与模板结合的Tm是66.9℃,引物24-14-5:1:1与所得到的互补扩增子结合的Tm是79.9℃,并且引物24-14-5:0:0与所得到的互补扩增子结合的Tm是79.0℃。
如实施例3中所述进行PCR扩增。记录每个反应的作为完成的扩增循环数的函数的实时荧光结果(即,SYBR荧光强度)。图17的图A显示含有引物24-14-5:1:1的反应所获得的结果,其中曲线1701是含有106个MUT模板的反应并且曲线1702是含有106个WT模板的反应;以及图17的图B显示含有引物24-14-5:0:0的反应所获得的结果,其中曲线1703是含有106个MUT模板的反应并且曲线1704是含有106个WT模板的反应。该测定仪器自动计算每个曲线的循环阈值(CT)。引物24-14-5:1:1的CT值是23.1(曲线1701)和40.7(曲线1702),得到17.6个循环的ΔCT;并且引物24-14-5:0:0的CT值是39.7(曲线1703)和39.4(曲线1704),得到-0.3个循环的ΔCT(表明这两个反应得到基本上相同的结果)。
前述实施例和优选实施方案的说明应当被认为是说明性质的,而不是用于限制由权利要求书所定义的本发明。容易理解的是,许多变化和上述特征的组合可以在不脱离如权利要求书所阐述的本发明的范围的情况下被利用。这样的变化不视为背离本发明的范围,并且所有这些变化都包括在以下权利要求的范围之内。本文引用的所有参考文献都通过引用以其整体并入本文。
- 还没有人留言评论。精彩留言会获得点赞!