一种移植用水凝胶微球的体外筛选方法与流程
本发明涉及生物医学领域,是一种体外研究炎症细胞在水凝胶微球表面粘附的模型。
背景技术:
水凝胶微球是一种广泛应用于细胞移植免疫隔离工具,在体内微球与机体的组织/细胞会发生相互作用,从而决定了其生物相容性,最终影响到移植或治疗的效果。目前对微球生物相容性的研究大多集中于动物体内的研究,但是由于体内实验成本高,周期长,稳定性和重复性差,结论并不统一。因此需要寻找一个简单快速有效的体外模型,研究炎症细胞在水凝胶微球表面的粘附程度,为设计良好生物相容性的微球表面提供理论指导。
技术实现要素:
针对上述问题,本专利研究一种用于包埋移植细胞的水凝胶微球的体外筛选方法。
为实现上述目的,本发明采用的技术方案为:
a、在孔板中直径20-40mm,高1-2cm,加入0.5-2ml高压灭菌的琼脂糖溶液(浓度1-2%,50-80℃),待其冷却后凝固在孔板底部;
b、将制备好的凝胶微球(50-200μl/well)加入孔板中;
c、将炎症细胞接种于孔板中,接种密度5×105—1×107cells/well,同时于孔板的每个小孔中加入2-4ml的炎症细胞培养液;
d、将孔板置于37℃,含5%(v/v)co2/95%(v/v)空气的培养箱中的二维摇床上,培养前4h每隔10-30min,以80-160rpm振动5-10min,以利于细胞与微球表面充分接触;之后,将孔板静置培养0-20h,显微镜下观察计算孔板的每个小孔中微球表面炎症细胞粘附得分,0-3.3分适用于细胞移植,越大越不适于细胞移植。
所述的凝胶微球为二价金属离子络合的海藻酸盐微球、透明质酸微球、琼脂糖微球、明胶微球或果胶微球。
所述凝胶微球为基于上述凝胶微球的通过聚阳离子络合形成的水凝胶微胶囊。所述聚阳离子为壳聚糖及其衍生物,α或ε聚赖氨酸,聚鸟氨酸、聚精氨酸,聚胺及其衍生物、聚酰胺及其衍生物、聚酰亚胺及其衍生物中的一种或二种以上。
所述的凝胶微球粒径为1-10毫米或1-1000微米。
所述细胞为成纤维细胞、内皮细胞、巨噬细胞或成骨细胞中一种或二种以上。
所述的凝胶微球表面细胞培养工艺为在二维摇床上的前期间歇振动培养与后期静置培养结合的培养工艺。
本发明的优点:
1、体外模型研究炎症细胞在水凝胶微球表面的粘附行为,实验成本低,可控性大,重复性强。
2、采用二维摇床的培养工艺,一定程度上克服重力的影响,增加细胞与微球相互作用机率。
3、采用的微球表面细胞接种密度依据微球在体内产生的炎症细胞数,最大限度的模拟体内反应。
4、该模型可推广应用与其他生物医用的球形体系,研究其与细胞的相互作用,设计合理的具有良好生物相容性表面的生物载体。
附图说明
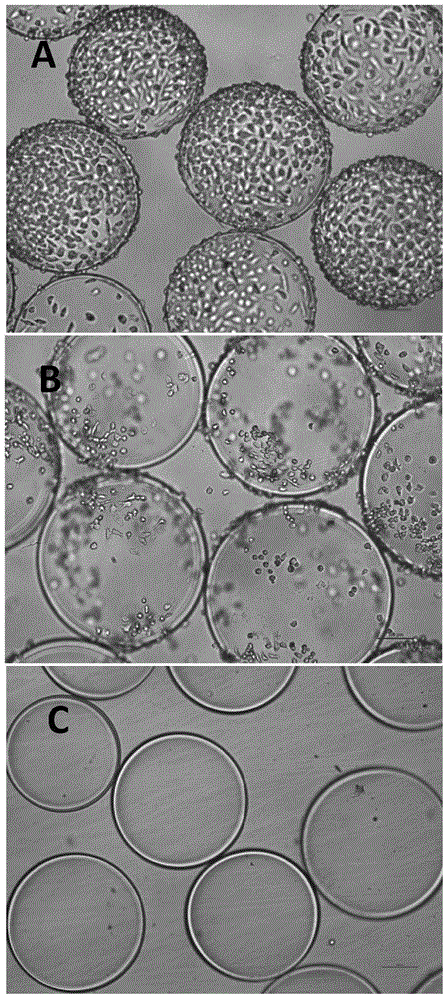
图1不同水凝胶微球表面细胞的粘附行为的光学显微镜照片,图中标尺为100μm。
具体实施方式
实施例1
1、在12孔板(直径22.1mm)中加入0.8ml高压灭菌后的2%琼脂糖溶液,静置放置,待其冷却后自动凝固在孔板底部。
2、将制备好的粒径为400μm的海藻酸钠-壳聚糖微球加入孔板中,每孔加50μl。
3、将培养瓶中融合度为80%的小鼠成纤维细胞消化离心后,培养基(1640培养基,其中以20mm的hepes为缓冲体系)重悬为1×106cells/ml,每个孔中加1ml细胞混悬液。
4、将孔板置于37℃,5%(v/v)co2/95%(v/v)空气的培养箱中的二维摇床上,培养前4h每隔30min,以160rpm的速度振动10min。之后静置培养,12h后显微镜下观察发现微球表面有较多的炎症细胞粘附,而且细胞均呈现伸展粘附状态(如图1a)。
5、根据细胞粘附评分法则(参考文献:1、actabiomaterialia,biocompatibilityandphysicochemicalcharacteristicsofalginate–polycationmicrocapsules.2011.)计算微球表面细胞粘附得分为5.48±0.12。
由于该水凝胶微球表面炎症细胞粘附程度较大,该水凝胶微球不适用于细胞移植。
实施例2
1、在12孔板(直径22.1mm)中加入1ml高压灭菌后的1.5%琼脂糖溶液,静置放置,待其冷却后自动凝固在孔板底部。
2、将制备好的粒径为400μm的海藻酸钠-壳聚糖微球加入孔板中,每孔加50μl。
3、将培养瓶中融合度为100%的小鼠成纤维细胞消化离心后,培养基重悬为1×106cells/ml,每个孔中加1ml细胞混悬液。
4、将孔板置于37℃,5%(v/v)co2/95%(v/v)空气的培养箱中的二维摇床上,培养前4h每隔30min,以160rpm的速度振动10min。之后静置培养,12h后显微镜下观察发现微球表面有较多的炎症细胞粘附,而且细胞均呈现伸展粘附状态(如图1b)。
5、根据细胞粘附评分法则计算微球表面细胞粘附得分为4.4±0.95。
由于该水凝胶微球表面炎症细胞粘附程度较大,该水凝胶微球不适用于细胞移植。可用于组织工程支架或体外细胞培养微载体。
实施例3
1、在12孔板(直径22.1mm)中加入1ml高压灭菌后的1.5%琼脂糖溶液,静置放置,待其冷却后自动凝固在孔板底部。
2、将制备好的粒径为400μm的海藻酸钠-壳聚糖-海藻酸钠凝胶微球加入孔板中,每孔加50μl。
3、将培养瓶中融合度为100%的小鼠成纤维细胞消化离心后,培养基重悬为1×106cells/ml,每个孔中加1ml细胞混悬液。
4、将孔板置于37℃,5%(v/v)co2/95%(v/v)空气的培养箱中的二维摇床上,培养前4h每隔30min,以160rpm的速度振动10min。之后静置培养,12h后显微镜下观察发现微球表面基本没有炎症细胞粘附(如图1c)。
5、根据细胞粘附评分法则计算微球表面细胞粘附得分为0,因此该水凝胶微球适用于细胞移植。
- 还没有人留言评论。精彩留言会获得点赞!