用于纯化抗体或抗体片段的拟肽亲和配体的制作方法
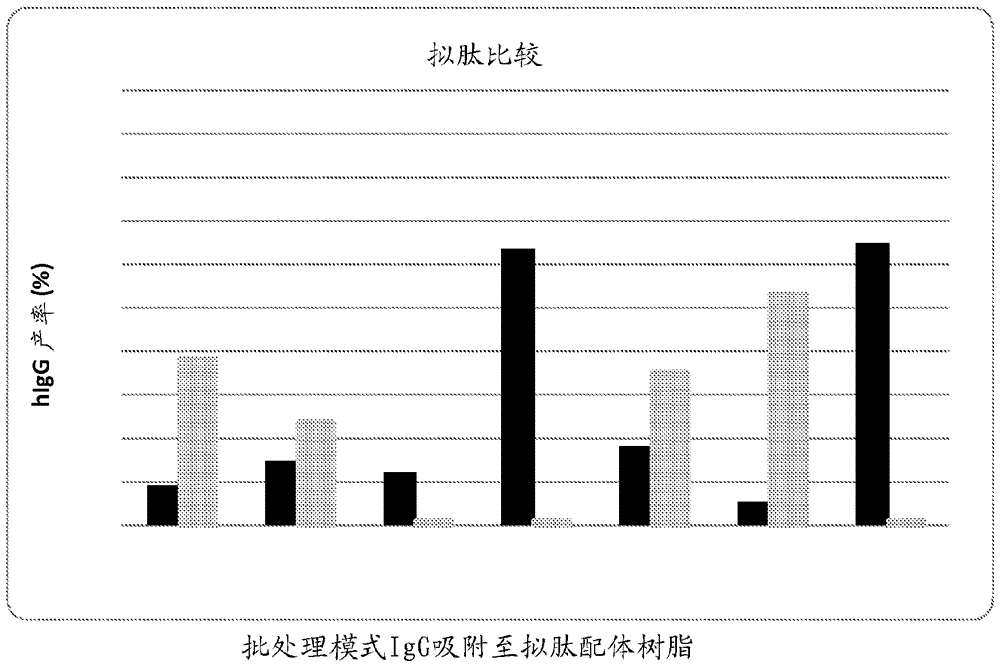
发明背景单克隆抗体和fc-融合蛋白已经作为一类重要的治疗性蛋白出现,所述治疗性蛋白用于治疗许多无法应付的疾病,例如癌症、自身免疫性疾病、免疫缺陷、皮肤病症和神经病症。这些产品占整个医药市场的40%,其中2011年体量为350亿美元。然而,基于抗体的治疗对于消费者是非常昂贵的。它们的高价格部分是由于分离和纯化这些生物分子的高成本。纯化成本的重大贡献由普遍使用蛋白a或蛋白g亲和层析捕获步骤所导致。尽管其对于igg的选择性高,但这些蛋白配体具有高成本和低化学和生化稳定性的问题。基于蛋白a/g的层析介质的平均成本范围为8,000–15,000美元/升树脂。蛋白配体显示出对于周期性应用于去除污染物的碱性(0.1–1.0mnaoh)清洗程序的不良化学耐受性。此外,它们易于被原料中存在的酶蛋白水解性降解。这些化学和酶促试剂可引起从树脂的配体降解和渗漏,导致柱寿命更短且产品主流中可能存在毒性和免疫原性渗滤液。发明概述工业界和学术界中已经进行了广泛研究以发现用于抗体的廉价、但具选择性且稳健的亲和配体。已经提出各种合成的化合物(包括三嗪骨架(triazinicscaffold)、氨基酸和肽)用于选择亲和配体用于生物治疗剂的下游处理。拟肽代表尚未探索用于设计亲和配体的一个类型,尽管该类化合物具有用于此类应用的理想特征。首先,拟肽上的官能团的展示类似于肽的官能团的展示,这暗示拟肽可以具有与肽配体显示的亲和性和选择性水平相当的亲和性和选择性水平。其次,由于采用胺的所谓的合成“子单体”方案,拟肽可以探索比上述提及的化合物可得的宽得多的化学多样性。这使得能够微调它们的组成以实现更高的目标特异性和亲合力。最后,拟肽对蛋白水解完全耐受,且因此对于从含有活性酶的流体(像全血浆及其级分)纯化抗体是有利的。因此,拟肽是蛋白a的一种经济的替代品。除了生物药物的纯化以外,这些配体可以进一步应用于诸如诊断和过程控制的领域中。尽我们所知,还没有人提出将拟肽配体用于igg的纯化。因此,本发明的第一个方面是特异性结合至抗体诸如igg、和/或抗体fc片段、和/或fc-融合蛋白的拟肽配体。在一些实施方案中,此类拟肽配体长度为4至7个残基或单体。此类拟肽配体任选地,但在一些实施方案中优选地,偶联至固体支持物。本发明的一个进一步方面是从含有抗体或抗体fc片段或fc-融合蛋白的液体组合物结合所述抗体或抗体fc片段或fc-融合蛋白的方法,其包括以下步骤:(a)提供固体支持物,其包含与之结合的如本文所述的拟肽配体,(b)使所述组合物与所述固体支持物接触,使得抗体或fc片段结合至所述化合物;和(c)从具有结合至所述固体支持物的所述抗体或fc片段的所述固体支持物分离所述液体组合物。下面记载的说明书中详细解释本发明的前述和其他目的和方面。附图简述图1.批处理模式igg抗体吸附至含有各种拟肽配体的toyopearlaf-氨基650m树脂。流通级分中的igg(黑色)表明没有吸附至树脂的higg相对于上样的higg质量的百分数。洗脱级分(灰色)表明磷酸盐缓冲盐水(pbs)中结合且洗脱(0.1m甘氨酸,ph2.5)的人igg相对于上样的igg的初始浓度的百分数。通过elisa确定所有级分中的higg的浓度。未修饰的树脂充当阴性对照。对于各树脂一式两份进行结合试验。图2.来自higg吸附实验的洗脱和流通级分的还原sds-page分析。指定“ft”和“洗脱物”的泳道分别是流通和洗脱的级分。标记“上样的higg”的泳道是与各测试树脂孵育的吸附前的higg溶液。higg的重链和轻链在还原sds-page凝胶上分别以~55和~25kda迁移。流通物中观察到的条带代表没有结合树脂的higg,而在洗脱物中观察到的条带代表吸附且随后在低ph洗脱的higg。说明性实施方案的详述现在下文将参考其中显示本发明的实施方案的附图更完全地描述本发明。然而,本发明可以以许多替代形式体现并且不应被解释为限于本文所述的实施方案。相同数字是指整个附图描述中的相同要素。本文中使用的术语仅用于描述具体实施方案的目的,且不旨在限制本发明。除非上下文另有明确指出,如本文所使用,单数形式“一(a)”、“一(an)”和“该(the)”意在同样包括复数对象。应进一步理解,当在本说明书中使用时,术语“包含(comprises)”和/或“包含(comprising)”,指定所述特征、整数、步骤、操作、要素和/或组分的存在,但不排除一种或多种其他特征、整数、步骤、操作、要素、组分和/或其组群的存在或添加。除非另有定义,本文使用的所有术语(包括技术术语和科学术语)具有与本发明所属领域普通技术人员通常理解的相同含义。应进一步理解,术语,诸如常用字典中定义的那些,应当被理解为具有与它们在本申请和相关领域的背景下的含义一致的含义,并且不应以理想化或过于正式的含义进行解释,除非本文中明确如此定义。本发明的说明书中使用的术语仅用于描述具体实施方案的目的,且不旨在限制本发明。本文中提到的所有出版物、专利申请、专利和其他参考文献都以其整体通过引用并入。此外,如本文所使用,“和/或”是指且涵盖,一个或多个相关所列项的任何和所有可能组合,以及当以替代方式(“或”)解释时缺乏组合。1.定义.如本文所使用的官能团可以是任何合适的基团或取代基,包括但不限于h,直链和环状的烷基、烯基和炔基,其可能被诸如以下的基团取代和/或官能化:烷氧基、卤素、巯基、叠氮基、氰基、甲酰基、羧基、羟基、硝基、酰基、芳基氧基、烷硫基、氨基、烷基氨基、芳基烷基氨基、取代的氨基、酰基氨基、酰基氧基、酯、硫酯、羧酸硫酯、醚、酰胺、脒基、硫酸酯、亚硫酰基(sulfoxyl)、磺酰基、磺酰基、磺酸、磺酰胺、脲、烷氧基酰基氨基,氨基酰基氧基、胍基、醛、酮、亚胺、腈、磷酸酯、硫醇、环氧化物、过氧化物、硫氰酸酯、脒、肟、腈、重氮基等,如下面进一步讨论的,这些术语包括这些基团的组合(例如,烷基化基团)。如本文中单独或者作为另一基团的部分使用的“烷基”,是指直链,支链,或环状,饱和或不饱和的,含有1或2至10个或20个碳原子或更多碳原子的烃。烷基的代表性实例包括,但不限于,甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、正戊基、异戊基、新戊基、正己基、3-甲基己基、2,2-二甲基戊基、2,3-二甲基戊基、正庚基、正辛基、正壬基、正癸基等。如本文所使用的“低级烷基”,在优选的一些实施方案中,是烷基的子集,并且是指含有1至4个碳原子的直链或支链烃基。低级烷基的代表性实例包括,但不限于,甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基等。术语“烷基”或“低级烷基”,除非另有指示,旨在包括取代和未取代的烷基或低级烷基,且这些基团可以被选自以下的基团取代:卤代(例如,卤代烷基)、烷基、卤代烷基、烯基、炔基、环烷基、环烷基烷基、芳基、芳基烷基、杂环、杂环烷基、羟基、烷氧基(由此生成聚烷氧基,诸如聚乙二醇)、烯基氧基、炔基氧基、卤代烷氧基、环烷氧基、环烷基烷基氧基、芳基氧基、芳基烷基氧基、杂环氧基、杂环烷基氧基、巯基、烷基-s(o)m、卤代烷基-s(o)m、烯基-s(o)m、炔基-s(o)m、环烷基-s(o)m、环烷基烷基-s(o)m、芳基-s(o)m、芳基烷基-s(o)m、杂环-s(o)m、杂环烷基-s(o)m、氨基、羧基、烷基氨基、烯基氨基、炔基氨基、卤代烷基氨基、环烷基氨基、环烷基烷基氨基、芳基氨基、芳基烷基氨基、杂环氨基、杂环烷基氨基、二取代的-氨基、酰基氨基、酰基氧基、酯、酰胺、磺酰胺、脲、烷氧基酰基氨基、氨基酰基氧基、硝基或氰基,其中m=0、1、2或3。烷基可以是饱和或不饱和的,因此,当烷基取代基含有一个或多个不饱和键(例如,一个或两个双键或三键)时,如本文所使用的术语“烷基”包括烯基和炔基。烷基可以任选地含有一个或多个杂原子(例如,一个、两个或三个或更多个独立地选自o、s和nr’的杂原子,其中r’是任何合适的取代基,诸如刚刚上面对于烷基取代基所述的),以形成如下面具体描述的线性杂烷基或杂环基。如本文所使用的“烯基”是指如上所述含有至少一个其中两个碳原子之间的双键的烷基。如本文所使用的“炔基”是指如上所述含有至少一个其中两个碳原子之间的三键的烷基。如本文所使用的“亚烷基”是指如上所述的烷基,其中去除一个末端氢以形成二价取代基。如本文中单独或者作为另一基团的部分使用的“杂环基(heterocyclicgroup)”或“杂环(heterocyclo)”,是指脂族(例如,完全或部分饱和杂环)或芳香的(例如,杂芳基)单环或双环环系统。单环系统的实例为含有1、2、3或4个独立地选自氧、氮和硫的杂原子的任何5元或6元环。5元环具有0-2个双键,且6元环具有0-3个双键。单环系统的代表性实例包括,但不限于,氮杂环丁烷、吖庚因,氮杂环丙烷、二氮杂䓬、1,3-二氧杂环戊烷、二氧杂环己烷、二噻烷、呋喃、咪唑、咪唑啉、咪唑烷、异噻唑、异噻唑啉、异噻唑烷、异噁唑、异噁唑啉、异噁唑烷、吗啉、噁二唑、噁二唑啉、噁二唑烷、噁唑、噁唑啉、噁唑烷、哌嗪、哌啶、吡喃、吡嗪、吡唑、吡唑啉、吡唑烷、吡啶、嘧啶、哒嗪、吡咯、吡咯啉、吡咯烷、四氢呋喃、四氢噻吩、四嗪、四唑、噻二唑、噻二唑啉、噻二唑烷、噻唑、噻唑啉、噻唑烷、噻吩、硫代吗啉、硫代吗啉砜、噻喃、三嗪、三唑、三噻烷等。二环系统的实例为稠合至如本文所定义的任何芳基、如本文所定义的环烷基或如本文所定义的另一单环系统的任何上述单环系统。二环系统的代表性实例包括但不限于,例如,苯并咪唑、苯并噻唑、苯并噻二唑、苯并噻吩、苯并噁二唑、苯并噁唑、苯并呋喃、苯并吡喃、苯并噻喃、苯并二噁英、1,3-苯并二氧杂环戊烯、噌啉、吲唑、吲哚、吲哚啉、吲哚嗪、萘啶、异苯并呋喃、异苯并噻吩、异吲哚、异吲哚啉、异喹啉、酞嗪、嘌呤、吡喃并吡啶、喹啉、喹嗪、喹喔啉、喹唑啉、四氢异喹啉、四氢喹啉、噻喃并吡啶等。这些环包括其季铵化的衍生物,并且可以任选地被选自以下的基团取代:卤代、烷基、卤代烷基、烯基、炔基、环烷基、环烷基烷基、芳基、芳基烷基、杂环、杂环烷基、羟基、烷氧基、烯基氧基、炔基氧基、卤代烷氧基、环烷氧基、环烷基烷基氧基、芳基氧基、芳基烷基氧基、杂环氧基、杂环烷基氧基、巯基、烷基-s(o)m、卤代烷基-s(o)m、烯基-s(o)m、炔基-s(o)m、环烷基-s(o)m、环烷基烷基-s(o)m、芳基-s(o)m、芳基烷基-s(o)m、杂环-s(o)m、杂环烷基-s(o)m、氨基、烷基氨基、烯基氨基、炔基氨基、卤代烷基氨基、环烷基氨基、环烷基烷基氨基、芳基氨基、芳基烷基氨基、杂环氨基、杂环烷基氨基、二取代的-氨基、酰基氨基、酰基氧基、酯、酰胺、磺酰胺、脲、烷氧基酰基氨基、氨基酰基氧基、硝基或氰基,其中m=0、1、2或3。如本文中单独或者作为另一基团的部分使用的“芳基”,是指具有一个或多个芳香环的单环碳环系统或双环碳环稠合环系统。芳基的代表性实例包括薁基、茚满基、茚基、萘基、苯基、四氢萘基等。除非另有说明,术语“芳基”意欲包括取代和未取代的芳基,且这些基团可以被关于上述烷基和低级烷基所述的相同基团取代。如本文中单独或者作为另一基团的部分使用的“芳基烷基”,是指通过如本文所定义的烷基附加至母体分子部分的如本文所定义的芳基。芳基烷基的代表性实例包括,但不限于苄基、2-苯基乙基、3-苯基丙基、2-萘-2-基乙基等。如本文所使用的“杂芳基”如关于上述杂环所述。如本文中单独或者作为另一基团的部分使用的“烷氧基”,是指通过氧基-o-附加至母体分子部分的如本文所定义的烷基或低级烷基(且因此包括取代的变体,诸如聚烷氧基)。烷氧基的代表性实例包括,但不限于甲氧基、乙氧基、丙氧基、2-丙氧基、丁氧基、叔丁氧基、戊基氧基、己基氧基等。如本文所使用的“卤素/卤代”是指任何合适的卤素,包括-f、-cl、-br和-i。如本文中单独或者作为另一基团的部分使用的“酰基”,是指-c(o)r基团,其中r是任何合适的取代基诸如芳基、烷基、烯基、炔基、环烷基或如本文所述的其他合适的取代基。如本文中单独或者作为另一基团的部分使用的“烷硫基”,是指通过如本文所定义的含硫部分附加至母体分子部分的如本文所定义的烷基。烷硫基的代表性实例包括,但不限于,甲硫基、乙硫基、叔丁硫基、己硫基等。如本文中单独或者作为另一基团的部分使用的“烷基氨基”,是指基团-nhr,其中r是烷基。如本文中单独或者作为另一基团的部分使用的“芳基烷基氨基”,是指基团-nhr,其中r是芳基烷基。如本文中单独或者作为另一基团的部分使用的“二取代的氨基”,是指基团-nrarb,其中ra和rb独立地选自基团烷基、卤代烷基、烯基、炔基、环烷基、环烷基烷基、芳基、芳基烷基、杂环、杂环烷基。如本文中单独或者作为另一基团的部分使用的“酰基氨基”,是指基团–nrarb,其中ra是如本文所定义的酰基,且rb选自基团氢、烷基、卤代烷基、烯基、炔基、环烷基、环烷基烷基、芳基、芳基烷基、杂环、杂环烷基。如本文中单独或者作为另一基团的部分使用的“酰基氧基”,是指基团–or,其中r是如本文所定义的酰基。如本文中单独或者作为另一基团的部分使用的“酯”,是指-c(o)or基团,其中r是任何合适的取代基诸如烷基、环烷基、烯基、炔基或芳基。如本文中单独或者作为另一基团的部分使用的“酰胺”,是指-c(o)nrarb基团或–n(ra)c(o)rb基团,其中ra和rb是任何合适的取代基诸如烷基、环烷基、烯基、炔基或芳基。如本文所使用的“亚硫酰基(sulfoxyl)”是指式–s(o)r的化合物,其中r是任何合适的取代基诸如烷基、环烷基、烯基、炔基或芳基。如本文所使用的“磺酰基”是指式–s(o)(o)r的化合物,其中r是任何合适的取代基诸如烷基、环烷基、烯基、炔基或芳基。如本文所使用的“磺酸酯”是指式–s(o)(o)or的化合物,其中r是任何合适的取代基诸如烷基、环烷基、烯基、炔基或芳基。如本文所使用的“磺酸”是指式–s(o)(o)oh的化合物。如本文中单独或者作为另一基团的部分使用的“磺酰胺”,是指-s(o)2nrarb基团,其中ra和rb是任何合适的取代基诸如h、烷基、环烷基、烯基、炔基或芳基。如本文中单独或者作为另一基团的部分使用的“脲”,是指–n(rc)c(o)nrarb基团,其中ra、rb和rc是任何合适的取代基诸如h、烷基、环烷基、烯基、炔基或芳基。如本文中单独或者作为另一基团的部分使用的“烷氧基酰基氨基”,是指–n(ra)c(o)orb基团,其中ra、rb是任何合适的取代基诸如h、烷基、环烷基、烯基、炔基或芳基。如本文中单独或者作为另一基团的部分使用的“氨基酰基氧基”,是指–oc(o)nrarb基团,其中ra和rb是任何合适的取代基诸如h、烷基、环烷基、烯基、炔基或芳基。如本文所使用的“固体支持物”可以包含任何合适的材料,包括有机材料(例如,有机聚合物),金属(例如,钛),无机材料(例如,二氧化硅)及其复合材料。固体支持物可以是任何合适的形状或形式,包括膜、容器诸如微量滴定板孔(例如,其底板和/或壁)、颗粒(例如,由天然或合成的聚合物、无机材料诸如玻璃或二氧化硅、其复合材料等形成的珠),诸如用于层析柱填料等。如本文所使用的“偶联基团”可以是任何合适的反应性基团,例如,烯烃、炔烃、醇、硫醇、氢硒基、膦酰基、羧酸、甲酰基、卤化物或胺基,其由母体分子直接展示或借助居间接头基团的方式(例如,脂族、芳族或混合的脂族/芳族基团诸如烷基、芳基、芳基烷基或烷基芳基烷基等)展示。2.化合物.可用于实施本发明的化合物包括式i-iv的化合物:,,,和其中:r是–oh、-nh2、-or’或–nhr’,其中r’是固体支持物;r1’、r2’、r3’、r4’、r5’、r6’和r7’各自独立地是c1至c4亚烷基;r1是碱性基团,诸如碱性芳族基团,其实例包括但不限于吡啶基-、喹啉基-和异喹啉基-、吖啶基-、吡嗪基-、喹喔啉基-、咪唑基-、苯并咪唑基-、嘌呤基-、吡唑基-、吲唑基-、嘧啶基-、喹唑啉基-、哒嗪基-、噌啉基-等;r2是芳族基团,其实例包括但不限于(a)未取代的,例如苯基-、苄基-、萘基-及其相关基团或衍生物;或(b)取代的,例如吲哚基-及其相关基团或衍生物;和(c)通过官能化(例如羟基化、胺化、羧化等,烷基化、烯基化、炔基化等)获得的前述的衍生物及其衍生物;r3是碱性基团,诸如碱性脂族基团,其实例包括但不限于:伯胺、仲胺、叔胺和季胺,胍基-,和相关基团;或能够形成氢键的亲水部分,例如氨基甲酰基-、羟基-、脲等;r4是h(或对于式iv的化合物,还是脂族基、芳族基团、酸性基团、亲水基团、碱性基团或偶联基团)。r5是芳族基团、碱性基团或碱性芳族基团,诸如对于上述r1和r2所定义(或对于式iii的化合物,还是脂族基团、酸性基团、亲水基团或偶联基团),r6是h,或酸性基团诸如羧基、磺酸基等(或对于式ii的化合物,还是脂族基团、芳族基团、亲水基团、碱性基团或偶联基团);r7是h或关于上述r1至r6给出的任何基团,或适合于将拟肽配体与另一以下物质共价偶联的偶联基团:(a)天然的,例如,蛋白、多核苷酸、脂质、肽及其衍生物,或(b)合成的化合物,例如药物、有机化合物、有机金属化合物、无机化合物,或(c)表面,例如层析树脂、膜、金属表面、纤维、自组装结构或其衍生物。在一些实施方案中,所述固体支持物包含颗粒(例如,多孔聚合物珠,像层析树脂的珠)。在一些实施方案中,所述固体支持物包含无机材料(例如,二氧化硅、二氧化钛、氧化锆等)。在一些实施方案中,所述固体支持物包含有机聚合物材料(例如,聚醚砜、pmma等)。本发明的拟肽化合物,诸如式i-iv的化合物可以根据已知的技术来制备,所述技术包括但不限于描述于以下中的那些:n.j.brown,j.johansson,和a.e.barron,acc.chem.res.41,1409–1417(2008);n.p.chongsiriwatana,j.a.patch,a.m.czyzewski,m.t.dohm,a.ivankin,d.gidalevitz,r.n.zuckermann,和a.e.barron,pnas105,2794–2799(2008);k.e.drexler,peptidescience96,537–544(2011);b.c.gorske,b.l.bastian,g.d.geske,和h.e.blackwell,j.am.chem.soc.129,8928–8929(2007);t.hara,s.r.durell,m.c.myers,和d.h.appella,j.am.chem.soc.128,1995–2004(2006);r.d.haynes,r.j.meagher,j.-i.won,f.m.bogdan,和a.e.barron,bioconjugatechem.16,929–938(2005);k.kirshenbaum,a.e.barron,r.a.goldsmith,p.armand,e.k.bradley,k.t.v.truong,k.a.dill,f.e.cohen,和r.n.zuckermann,pnas95,4303–4308(1998);y.-u.kwon和t.kodadek,j.am.chem.soc.129,1508–1509(2007);g.maayan,m.d.ward,和k.kirshenbaum,pnas106,13679–13684(2009);s.m.miller,r.j.simon,s.ng,r.n.zuckermann,j.m.kerr,和w.h.moos,drugdevelopmentresearch35,20–32(1995);p.mora,i.masip,n.cortés,r.marquina,r.merino,j.merino,t.carbonell,i.mingarro,a.messeguer,和e.pérez-payá,j.med.chem.48,1265–1268(2005);j.e.murphy,t.uno,j.d.hamer,f.e.cohen,v.dwarki,和r.n.zuckermann,pnas95,1517–1522(1998);k.t.nam,s.a.shelby,p.h.choi,a.b.marciel,r.chen,l.tan,t.k.chu,r.a.mesch,b.-c.lee,m.d.connolly,c.kisielowski,和r.n.zuckermann,naturematerials9,454–460(2010);j.t.nguyen,m.porter,m.amoui,w.t.miller,r.n.zuckermann,和w.a.lim,chem.biol.7,463–473(2000);p.e.nielsen,编,pseudo-peptidesindrugdiscovery,第1版(wiley-vch,2004);s.h.park和i.szleifer,j.phys.chem.b115,10967–10975(2011);j.a.patch和a.e.barron,j.am.chem.soc.125,12092–12093(2003);i.peretto,r.m.sanchez-martin,x.wang,j.ellard,s.mittoo,和m.bradley,chem.commun.2312–2313(n.d.);m.c.pirrung,k.park,和l.n.tumey,j.comb.chem.4,329–344(2002);m.m.reddy和t.kodadek,proc.nat.acad.sci.usa102,12672–12677(2005);m.m.reddy,r.wilson,j.wilson,s.connell,a.gocke,l.hynan,d.german,和t.kodadek,cell144,132–142(2011);t.j.sanborn,c.w.wu,r.n.zuckermann,和a.e.barron,biopolymers63,12–20(2002);t.schröder,n.niemeier,s.afonin,a.s.ulrich,h.f.krug,和s.bräse,j.med.chem.51,376–379(2008);n.h.shah,g.l.butterfoss,k.nguyen,b.yoo,r.bonneau,d.l.rabenstein,和k.kirshenbaum,j.am.chem.soc.130,16622–16632(2008);a.statz,j.kuang,c.ren,a.barron,i.szleifer,和p.messersmith,biointerphases4,fa22–fa32(2009);a.r.statz,j.p.park,n.p.chongsiriwatana,a.e.barron,和p.b.messersmith,biofouling24,439–448(2008);p.a.wender,d.j.mitchell,k.pattabiraman,e.t.pelkey,l.steinman,和j.b.rothbard,proc.nat.acad.sci.usa97,13003–13008(2000);c.w.wu,s.l.seurynck,k.y.c.lee,和a.e.barron,chem.biol.10,1057–1063(2003);r.n.zuckermann,j.m.kerr,s.b.h.kent,和w.h.moos,j.am.chem.soc.114,10646–10647(1992);r.n.zuckermann,e.j.martin,d.c.spellmeyer,g.b.stauber,k.r.shoemaker,j.m.kerr,g.m.figliozzi,d.a.goff,和m.a.siani,j.med.chem.37,2678–2685(1994)。b.使用方法.本发明的拟肽可用于结合、收集、纯化等任何类型的抗体或抗体片段(例如,fc片段、fab片段和scfv片段),包括天然和重组(包括嵌合)抗体、工程改造的多体、单结构域抗体及其组合,诸如二价抗体和骆驼科动物免疫球蛋白,和单克隆和多克隆抗体两者,或fc-融合蛋白。所述抗体可以是任何物种来源的,包括哺乳动物(兔、小鼠、大鼠、牛、山羊、绵羊、美洲驼、骆驼,羊驼等)、禽类(例如,鸡、火鸡等)、鲨鱼等,所述抗体包括如上所示的其片段、嵌合体及其组合。所述抗体可以是任何类型的免疫球蛋白,包括但不限于igg、iga、ige、igd、igm、igy等。在一些实施方案中,所述抗体或fc片段(包括其融合蛋白)被携带于生物流体诸如血液或血液级分(例如,血清,血浆),蛋黄和/或白蛋白,组织或细胞生长培养基,组织裂解物或匀浆物等。因此,如上所示,本发明提供从含有抗体或抗体fc片段的液体组合物结合所述抗体或抗体fc片段的方法,其包括以下步骤:(a)提供如上所述的包含化合物的固体支持物(b)使所述组合物与所述固体支持物接触,使得抗体或fc片段或fc-融合蛋白结合至所述化合物;和(c)从具有结合至所述固体支持物的所述抗体或fc片段或fc-融合蛋白的所述固体支持物分离所述液体组合物;和任选地(但在一些实施方案中优选地)(d)从所述固体支持物分离所述抗体或fc片段或fc-融合蛋白。所述方法可以以与采用蛋白a的方式类似的方式或通过其对于本领域技术人员显而易见的变型来实施。例如,根据已知的技术,可以连续实施接触和分离步骤,(例如,通过柱层析),其后然后可以实施分离步骤(例如,通过洗脱)。在一些实施方案中,诸如当待由其收集抗体或fc片段或fc-融合蛋白的液体组合物包含生物流体时,所述液体组合物进一步包含至少一种蛋白水解酶。拟肽结合配体有利地对蛋白水解酶的降解是耐受的。此外,可以通过用光反应基团诸如苯甲酮基团替代拟肽的任何侧链残基而实施所有上面提及的目标抗体的光亲和标记。以下非限制性实施例中更详细地解释本发明。实施例1四聚体拟肽配体的固相合成和所得亲和吸附剂用于纯化人多克隆或单克隆抗体的用途从n-至c-末端编号的所选基团是:咪唑基、吲哚基-、胍基-和甲基-。相应地,用于拟肽合成的胺分别是组胺、色胺、胍基丁胺和甲胺。方案1中呈现如下:层析树脂toyopearlaf-氨基-650m被选为用于合成的固体支持物。合成包括以下步骤:1.经由二异丙基碳二亚胺活化(以下被称为dic)偶联n,n'-二甲基甲酰胺(dmf)中的溴乙酸。用dmf洗涤树脂且用nmp平衡。2.偶联n-甲基吡咯烷酮(nmp)中的甲胺。用nmp洗涤树脂且用dmf平衡。3.通过dic偶联溴乙酸。用dmf洗涤树脂且用nmp平衡。4.偶联胍基丁胺。用nmp洗涤树脂且用dmf平衡。5.通过dic偶联溴乙酸。用dmf洗涤树脂且用nmp平衡。6.偶联nin-boc-色胺。用nmp洗涤树脂且用dmf平衡。7.通过dic偶联溴乙酸。用dmf洗涤树脂且用nmp平衡。8.偶联nim-boc-组胺。用nmp、随后用dmf洗涤树脂,且最后用dcm平衡树脂。通过在室温用75%tfa(三氟乙酸)/dcm洗涤树脂两次而去除boc保护基团。相继用dcm、dmf和dcm洗涤树脂。然后真空干燥树脂,装入层析柱,在20%v/v甲醇/水中溶胀,且在磷酸盐缓冲盐水(pbs)(ph7.4)中平衡。制备人多克隆igg于pbs中的5mg/ml溶液,且以67cm/h的线性速度注入柱中。以200cm/h的线性速度用10个柱体积的平衡缓冲液洗涤柱之后,以270cm/h的线性速度用0.2m乙酸盐缓冲液(ph4)洗脱结合的抗体。最终用0.1mnaoh水溶液再生树脂。实施例2将拟肽直接制备至含胺树脂制备程序:使用先前描述的方法用biotagealstra自动肽合成仪在微波辅助下以0.1mmol/ml负载率将拟肽直接合成至toyopearlaf-氨基650m树脂(tosohbiosciences)(fara等人tet.lett.200647,1011-1014;olivos等人org.lett.2002,4(23),4057-4059)。在50℃使用n,n,n′,n′-四甲基-o-(1h-苯并三唑-1-基)脲六氟磷酸盐(hbtu)以二异丙基乙胺作为偶联剂在二甲基甲酰胺中将甘氨酸的fmoc-保护的单体n-(-3-胍丙基)甘氨酸、n-(异丁基)甘氨酸、n-(3-(boc-氨基)-丙基)甘氨酸和n-(苄基)甘氨酸偶联至拟肽(huang等人pnas2012,109(49),19922-19927.)。偶联之后,使用20%哌啶/dmf脱保护仲胺。将剩余残基使用子单体方法偶联至拟肽序列。用二异丙基碳二亚胺(15分钟,75℃),随后用相应的胺置换氯化物且用碘化钾作为催化剂(1小时,50℃),将氯乙酸偶联至前述残基。以下胺用于卤素置换程序中:2-丙胺、组胺和色胺(zuckerman等人j.am.chem.soc.2003,125,8841).使用90%三氟乙酸、5%三异丙基甲硅烷和5%h2o,随后用三氟乙酸、甲醇和水连续洗涤而在树脂上直接脱保护配体。固定的拟肽上的取代基如下面表1中给出,其中各种“r”基团对应于上式。拟肽当从树脂游离(未共价偶联至树脂)时的结构在下表2中给出。表1idpv-p-g001pv-p-g003pv-p-g004pv-p-g005pv-p-g006pv-p-g012r1-2-咪唑-2-咪唑-2-咪唑-2-咪唑-2-咪唑-2-咪唑r1’-ch2ch2--ch2ch2--ch2ch2--ch2ch2--ch2ch2--ch2ch2-r2-3-吲哚-3-吲哚-c6h5-3-吲哚-c6h5-3-吲哚r2’-ch2ch2--ch2ch2--ch2ch2--ch2ch2--ch2--ch2ch2r3-nh-(c=nh)-nh2(胍基)-nh-(c=nh)-nh2(胍基)-nh-(c=nh)-nh2(胍基)-nh-(c=nh)-nh2(胍基)-nh-(c=nh)-nh2(胍基)-nh2r3’-ch2ch2ch2--ch2ch2ch2--ch2ch2ch2--ch2ch2ch2--ch2ch2ch2--ch2ch2ch2-r4hhhhr4’n/an/an/an/ar5-ch2ch2--3-吲哚r5’-3-吲哚-ch2ch2-r6-ch(ch3)2-ch(ch3)2r6’n/an/a表2pv-p-g001pv-p-g003pv-p-g004pv-p-g005pv-p-g006pv-p-g012。igg与树脂的结合:以批处理模式测试拟肽亲和配体结合人igg分子的能力。制备树脂的50%浆料,其中将200ul(~100mg树脂)转移至离心柱中。用dh2o充分洗涤树脂,且在higg暴露之前用pbs平衡。用pbs将higg(equitech-bio)稀释至0.5mg/ml。平衡之后,以固定比率(2mghigg/ml树脂)将0.5mg/mlhigg添加至树脂,且允许在22℃在剧烈振荡下孵育45分钟。孵育之后,以500xg离心树脂2分钟,其中收集该步骤的滤液且称为“流通”级分。随后用pbs洗涤树脂2次。将洗脱缓冲液(0.1m甘氨酸,ph2.5)添加至树脂,且允许在22℃剧烈混合10分钟。离心(500xg,持续2分钟)之后,从树脂洗脱结合的higg且收集在滤液中。使用基于elisa的定量测定(bethyl,目录号e80-104)确定流通或洗脱级分中发现的higg的量。通过流通或洗脱级分中的higg的浓度除以上样材料的浓度而确定higg产率百分数(图1)。还进行sds-page以分析吸附实验的级分(图2)。这些数据表明,拟肽g001、g003、g005和g012可用于使igg结合至树脂。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1