一种生物相容性良好的可注射水凝胶及其制备方法和应用与流程
本发明涉及生物技术应用领域,具体涉及一种生物相容性良好的可注射水凝胶及其制备方法和应用。
背景技术:
水凝胶是一种在水中溶胀,但不溶于水,并在其结构内部保持一定水分(20%以上)的一类亲水性高分子三维网络。它除了有良好的生物相容性外,还具有较高的水渗透性,有一定的强度,类似于生物体的软组织,这些特征使水凝胶可作为生物材料。水凝胶具有优良的理化性质和生物学性质,可控制药物释放,并具有生物粘附、生物相容和可生物降解等特性,目前己用于缓释、脉冲释放、触发式释放等新型给药系统的研制。适当的水凝胶制备方法能够预先将未成为凝胶的高分子物质与药物或细胞混合,然后注入人体或动物体内之后形成凝胶,自然地将药物或细胞固定,因而被称为可注射性水凝胶。此类凝胶不使用有机溶剂,注射过程创伤小,因而目前在组织工程、药物控释等领域得到了重视。而且通过注射的方法将具有一定流动性的生物材料植入体内,因此很容易充满整个具有不规则形状的缺损部位。可注射水凝胶体系可由酸碱度、温度的变化或多价离子的存在而产生溶液-凝胶相转变,或通过共价键而形成水凝胶。物理交联型水凝胶是指由于分子缠结和离子、氢键、疏水相互作用的存在而形成的网络结构。大致可分为离子交联型和温度响应型两种。形成物理交联水凝胶的条件之一就是体系中物理交联点的形成。物理交联点的形成可以通过多种方式,如离子间的相互作用、疏水相互作用、结晶及氢键作用等。化学交联型水凝胶是运用传统合成的方法或光聚合、辐射聚合等技术,引发共聚或缩聚反应产生共价键而形成的共价交联网络。化学交联水凝胶结构比较稳定,强度较高,反应可控制性较好,易于操作。
技术实现要素:
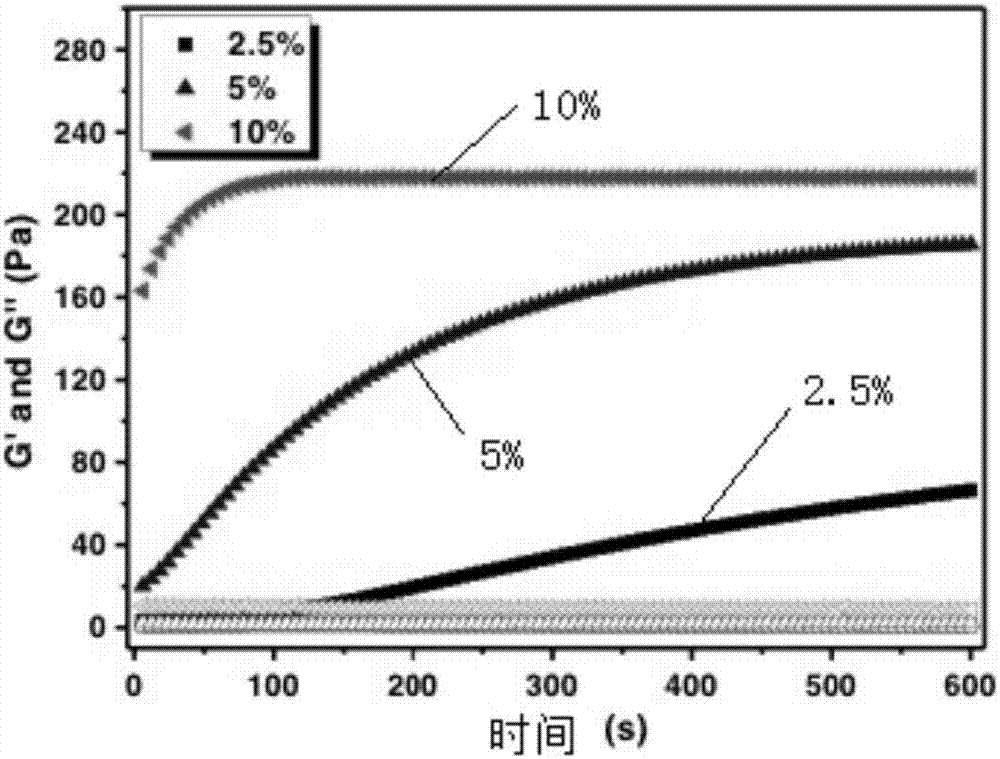
发明目的:本发明的第一个目的是提供一种具有良好生物相容性的可注射凝胶。本发明的第二个目的是提供上述具有良好生物相容性的可注射凝胶的制备方法。本发明的第三个目的是提供一种具有良好生物相容性的可注射凝胶的应用。技术方案:为了解决上述技术问题,本发明提供了一种具有良好生物相容性的可注射凝胶,首先使用末端带双键的聚乙二醇双丙烯酸脂和二胺通过双键和胺基的迈克尔加成反应制备获得HPBAE,调节双键和二胺的比例,能够获得端基为双键的HPBAE,HPBAE和巯基化的生物大分子在温和的条件下即获得生物相容性良好的可注射水凝胶。本发明的HPBAE命名为超支化聚beta氨基酯,其合成路线的结构式如下:其中,上述聚乙二醇双丙烯酸脂的分子量为258g/mol、575g/mol或700g/mol,所述二胺为乙二胺、己二胺,所述巯基化的生物大分子为巯基化的透明质酸。其中,上述巯基化的透明质酸质量分数为0.5%-1%。其中,上述HPBAE质量分数含量为2.5%~20%的可注射水凝胶。一种具有良好生物相容性的可注射凝胶的制备方法,包括以下步骤:1)将聚乙二醇双丙烯酸脂(PEGDA)和二胺配置到DMSO溶液中,按照一定的投料比,在油浴中反应,控制反应时间能够获得不同分子量的HPBAE;2)反应结束后,用冰乙醚洗涤三次反应产物,然后在冻干机中冻干即可得到HPBAE;3)在冰水浴中,将巯基化的透明质酸配置成水溶液备用;4)将上述HPBAE配置成不同浓度的水溶液;5)将HPBAE水溶液和巯基化透明质酸溶液快速混合均匀,即可获得可注射凝胶。其中,上述步骤1)中聚乙二醇双丙烯酸脂的浓度是30wt%;二胺的浓度是30wt%;聚乙二醇双丙烯酸脂和二胺的投料摩尔比为2.5:1;反应温度80℃。其中,上述步骤2)中巯基化透明质酸购买自ESI.BIO公司或者实验室自主合成,透明质酸分子量220kD,巯基取代度为40%,配制的浓度为0.5~1wt%。其中,上述步骤3)中HPBAE的浓度是2.5~20wt%。其中,上述步骤4)中HPBAE和巯基化透明质酸的混合的体积比为1:1。上所述的一种具有良好生物相容性的可注射凝胶在制备新型给药系统方面的应用。有益效果:本发明具有以下优点:本发明制备方法简单易行、无需外加任何催化剂,合成得到产物结构简单可控,具有良好的生物相容性、材料来源广泛、生产效率高,所制备的可注射水凝胶具有强度可调、降解可控、生物相容性良好的特点。附图说明图1是本发明中合成可注射凝胶的成胶时间随着不同HPBAE及其浓度的曲线;图2是本发明实施例1的水凝胶典型的流变学曲线,使用HPBAE为PEGDA(700Da)和己二胺合成的,巯基化透明质酸的终浓度为0.5%;图3是本发明合成的HPBAE及其形成的水凝胶降解产物的细胞毒性测试结果;图4是本发明水凝胶原位负载第三代脂肪干细胞的死活细胞共染色评价;绿色代表活细胞,红色代表死细胞;图中标尺为200微米;图5超支化聚beta氨基酯(HPBAE)合成式;图6本发明实施例1的超支化聚beta氨基酯(HPBAE)核磁氢谱,1HNMR(CDCl3,ppm):δ6.32(d,2H),6.03(m,1H),5.76(d,2H),4.19(d,2H),4.06(d,2H),3.62(m,2H),3.50(m,2H),2.3-2.7(m,6H);图7本发明实施例3的超支化聚beta氨基酯(HPBAE)核磁氢谱,1HNMR(CDCl3,ppm):δ6.42(d,2H),6.23(m,1H),5.83(d,2H),4.39(d,2H),4.26(d,2H),3.72(m,2H),3.61(m,2H),2.3-2.7(m,6H),1.21(m,6H)。具体实施方式下面结合具体实施例进一步说明本发明的技术方案,以下结合实例进一步说明本发明,但这些实例并不用来限制本发明。准备实验使用的器具,清洗保持其干净,烘干保证除水。DMSO使用前用分子筛过夜除水。各种分子量的PEGDA(258、575、700Da)和二胺(乙二胺、己二胺)均购自Sigma公司。配置PEGDA和二胺的溶液。实施例1具有良好生物相容性的可注射凝胶的制备1)取25mL洁净反应瓶,按照PEGDA700Da和己二胺的摩尔比例2.5:1混合配置到DMSO溶液中,混合均匀后,密封后将反应瓶放入90℃油浴中,磁力搅拌500rmp/min;己二胺浓度是10wt%;PEGDA700Da的浓度是30wt%;2)反应4小时后,从油浴中取出反应瓶,冷却至室温,加入3倍体积的冰乙醚,磁力搅拌500rmp/min,3min;然后室温静置30min,待溶液明确分层后,小心吸出上层乙醚;再加入3倍冰乙醚萃取三次;3)将乙醚萃取的HPBAE置入-80℃冰箱中放置2小时,然后将该产物放入冻干机中冻干4小时,即获得超支化且端基为双键的HPBAE;4)将制备的HPBAE配置成质量百分比为20%,10%,5%的水溶液(现配现用);5)将从ESI.BIO公司(巯基化透明质酸)按照使用方法配置质量百分比成1%或0.5%的水溶液(现配现用);透明质酸分子量220kD,巯基取代度为40%。6)将配制的HPBAE水溶液和巯基化透明质酸水溶液按照体积比1:1混合,混合均匀后,1分钟后即可获得水凝胶。实施例2具有良好生物相容性的可注射凝胶的制备1)取25mL洁净反应瓶,按照PEGDA258Da和己二胺的摩尔比例2.5:1混合配置到DMSO溶液中,混合均匀后,密封后将反应瓶放入70℃油浴中,磁力搅拌500rmp/min;己二胺的浓度是30wt%;PEGDA258Da的浓度是50wt%;2)反应4小时后,从油浴中取出反应瓶,冷却至室温,加入3倍体积的冰乙醚,磁力搅拌500rmp/min,3min;然后室温静置30min,待溶液明确分层后,小心吸出上层乙醚;再加入3倍冰乙醚萃取三次;3)将乙醚萃取的HPBAE置入-80℃冰箱中放置2小时,然后将该产物放入冻干机中冻干4小时,即获得超支化且端基为双键的HPBAE;4)将制备的HPBAE配置成质量百分比为10%,5%,2.5%的水溶液(现配现用);5)将从ESI.BIO公司(巯基化透明质酸)按照使用方法配置质量百分比成1%或0.5%的水溶液(现配现用);透明质酸分子量220kD,巯基取代度为40%。6)将配制的HPBAE水溶液和巯基化透明质酸水溶液按照体积比2:1混合,混合均匀后,1分钟后即可获得水凝胶。实施例3具有良好生物相容性的可注射凝胶的制备1)取25mL洁净反应瓶,按照PEGDA575Da和乙二胺的摩尔比例2.5:1混合配置到DMSO溶液中,混合均匀后,密封后将反应瓶放入80℃油浴中,磁力搅拌500rmp/min;乙二胺浓度是50wt%;PEGDA575Da的浓度是10wt%;2)反应4小时后,从油浴中取出反应瓶,冷却至室温,加入3倍体积的冰乙醚,磁力搅拌500rmp/min,3min;然后室温静置30min,待溶液明确分层后,小心吸出上层乙醚;再加入3倍冰乙醚萃取三次;3)将乙醚萃取的HPBAE置入-80℃冰箱中放置2小时,然后将该产物放入冻干机中冻干4小时,即获得超支化且端基为双键的HPBAE;4)将制备的HPBAE配置成质量百分比为20%,10%,5%的水溶液(现配现用);5)将从ESI.BIO公司(巯基化透明质酸)按照使用方法配置质量百分比成1%或0.5%的水溶液(现配现用);透明质酸分子量220kD,巯基取代度为40%。6)将配制的HPBAE水溶液和巯基化透明质酸水溶液按照体积比1:1混合,混合均匀后,1分钟后即可获得水凝胶。实验例1:水凝胶时间测试实验本发明实施例1~3中获得的水凝胶进行时间测试采用文献报道方法(TaichiIto,etal.Biomaterials2007,28:975–983)。测试结果参见图1。实验例2:本发明合成的HPBAE降解产物细胞毒性评价实验本发明实施例1~3中合成的HPBAE降解产物的细胞毒性评价如下,配置100mg/ml的聚合物溶液(pH=7.4磷酸盐缓冲液),过滤灭菌处理后,置于37度恒温摇床中,降解48小时,取降解产物备用测试细胞毒性。HPBAE的细胞毒性则是取无菌的HPBAE溶液直接备用。将第三代的脂肪干细胞按照1万个细胞/孔种植到96孔板中,加入培养基培养12小时后,加入一定量的HPBAE或其降解产物,加入培养基,共培养48小时后,使用alamarBlue试细胞毒性。实验结果参见图3。实验例3:本发明的水凝胶原位负载脂肪干细胞实验将本发明实施例1~3中合成的水凝胶原位负载脂肪干细胞实验如下,将第三代脂肪干细胞消化计数,1*107细胞/ml。将细胞和HA-SH混合后,加入HPBAE溶液,混合均匀后,数秒到数分钟即可得到负载干细胞的水凝胶。实验结果参见图4。以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1