内酯酶及利用内酯酶降解α-玉米赤霉烯醇的方法与流程
本申请涉及一种内酯酶,尤其涉及一种可提高对α-玉米赤霉烯醇降解效率的内酯酶。
背景技术:
霉菌毒素是霉菌或其它真菌分泌的有毒有害的次级代谢产物。粮食饲料中霉菌的生长和霉菌毒素的产生可能发生在粮食的成熟、运输、加工和储存等各个不同的环节。被霉菌毒素污染的饲料可引起动物中毒,影响免疫机能,降低生产能力,甚至造成严重的公共卫生问题。霉菌毒素污染已成为限制饲料业和养殖业发展的重要因素之一,每年约有25%的农作物受到不同程度霉菌毒素污染,以美国和加拿大为例,霉菌毒素的污染使家畜业和饲料业每年损失约50亿美元。中国每年因饲料霉变导致的直接经济损失也高达100亿元,而长江以南地区由于气候较为潮湿,饲料霉变情况更为严重。
为防止霉菌毒素对畜牧业的损害,人们陆续开发出多种物理和化学手段来吸附或降解饲料中的霉菌毒素。目前市场上广泛使用吸附法来去除饲料中的霉菌毒素,但吸附剂往往不能选择性的吸附毒素,造成其它营养物质的流失,同时,排出体外的毒素也会造成二次污染。相对而言,生物脱毒法利用酶在温和的条件下特异性的降解霉菌毒素,不使用有害的化学试剂,无营养物质的流失,被认为是最佳的脱毒方法。开发高效的霉菌毒素降解酶,是解决霉菌毒素污染问题,挽回饲料业和畜牧业巨大损失的重要手段。
玉米赤霉烯酮(zearalenone,zen)是一类由镰刀菌属真菌产生的类雌激素毒素,具有二羟基苯甲酸内酯结构(如图1所示),是目前全球污染最严重的三种霉菌毒素之一,最初由baldwin等人从发霉玉米中分离得到。zen主要存在于玉米、小麦、大麦和黍等农作物及其制品中,能导致摄入者出现早熟、生殖周期紊乱等雌激素紊乱症,给种植业和养殖业带来巨大损失。zen 还具有强致癌性,能够引起乳腺癌、食管癌等发病率增加。zen已知存在6种常见的天然衍生物,其中,玉米赤霉烯醇(zearalenol,zol,如图1所示)一般与zen共同污染作物。玉米赤霉烯醇可分为α-玉米赤霉烯醇(α-zearalenol,α-zol)和β-玉米赤霉烯醇(β-zearalenol,β-zol),主要存在形式是α-zol,其毒性为zen的三十余倍。
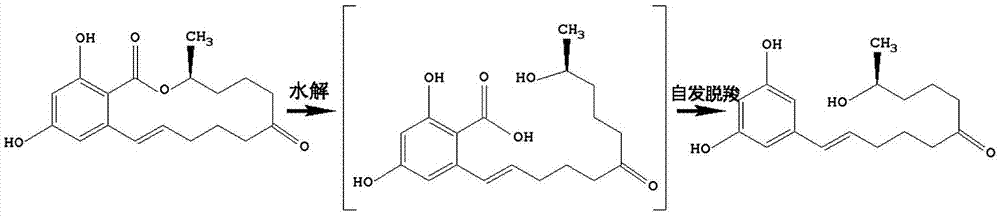
naokotakahashi-ando从粉红粘帚菌(gliocladiumroseum)中分离出的一种大环内酯水解酶(lactonehydrolase,简称内酯酶)zhd101是目前研究最为广泛的玉米赤霉烯酮降解酶。通过水解zen的二羟基苯甲酸内酯键,使其环形结构打开变成直链形结构(如图2所示),然后自发脱羧形成断裂产物。水解产物不能与雌激素受体结合,从而消除毒性。zhd101编码基因已成功在异源宿主中实现表达,但经产物分析发现,由于zhd101对zol的降解活性较低,当不足量的zhd101存在时,并不能降解体系中共存的少量zol,而α-zol仍具有很强的雌激素毒性。仅当大量的zhd101存在时,才能完全降解zol,实现zen的完全脱毒。因此,提高zhd101对高毒性α-zol的降解活力,具有很高的应用价值。
因此,本申请拟通过基因改造以提高zhd101对α-zol的活力,同时维持对特异性底物zen的活力,提升其对玉米赤霉烯酮及其衍生物的降解效率。
技术实现要素:
本申请的目的在于改造现有的内酯酶zhd101,利用结构分析及定点突变技术,有效提高zhd101对zen的天然共生剧毒衍生物α-zol的活性,提升zhd101的脱毒效果,进而增加zhd101之工业应用价值。
本申请的另一目的在于提供一种降解α-zol的方法,其系利用本申请改造后之zhd101突变体对α-zol进行降解,以提高对α-zol的降解效率。
为达上述目的,本申请之一较广义实施方式为提供一种内酯酶,其氨基酸序列系为将序列编号5第167个氨基酸由缬氨酸(valine)突变成组氨酸(histidine)的序列。该序列编号5的氨基酸序列系于序列编号2的氨基酸序列n端增加一段包含14个氨基酸的pet46载体序列。编码该序列编号2之基因系从粉红粘帚菌(gliocladiumroseum)所分离出来的zhd101基因。该内酯 酶之氨基酸序列系为序列编号8之氨基酸序列。该内酯酶系用于提高对α-玉米赤霉烯醇的降解效率。
又,本申请之另一较广义实施方式为提供一种降解α-玉米赤霉烯醇的方法,其系利用一内酯酶对α-玉米赤霉烯醇进行降解,其中该内酯酶之氨基酸序列系为将序列编号5第167个氨基酸由缬氨酸(valine)突变成组氨酸(histidine)的序列。该序列编号5的氨基酸序列系于序列编号2的氨基酸序列n端增加一段包含14个氨基酸的pet46载体序列。编码该序列编号2之基因系从粉红粘帚菌(gliocladiumroseum)所分离出来的zhd101基因。该内酯酶之氨基酸序列系为序列编号8之氨基酸序列。该内酯酶提高对α-玉米赤霉烯醇的降解效率。
附图说明
图1显示玉米赤霉烯酮(zen)及玉米赤霉烯醇(zol)的结构。
图2显示zhd101对zen的水解反应。
图3显示zhd101的核苷酸序列。
图4显示zhd101的氨基酸序列。
图5显示利用pet46载体表达的zhd101的氨基酸序列。
图6显示突变引物序列。
图7显示zhd101突变体的氨基酸序列。
图8显示野生型和突变体内酯酶蛋白的活性比较图。
具体实施方式
体现本申请特征与优点的一些典型实施例将在后段的说明中详细叙述。应理解的是本申请能够在不同的实施方式上具有各种的变化,其皆不脱离本申请的范围,且其中的说明及图示在本质上系当作说明之用,而非用以限制本申请。
为增加玉米赤霉烯酮降解酶的工业应用价值,本申请系从粉红粘帚菌(gliocladiumroseum)中克隆出内酯酶(lactonehydrolase)zhd101基因,其所表达的蛋白为一种大环内酯酶。通过研究此内酯酶结构后,针对其活性区参与底物相互作用的氨基酸进行突变,以增加酶对底物衍生物α-玉米赤霉 烯醇(α-zearalenol,α-zol)的活力。以下将详述本申请改造内酯酶的方法及其所得到的改良的内酯酶。
首先,将粉红粘帚菌的内酯酶zhd101作为目标基因,野生型的内酯酶基因全长为795个碱基对(以序列编号1标示,如图3所示),编码264个氨基酸(以序列编号2标示,如图4所示),利用聚合酶链式反应(polymerasechainreaction,pcr)进行基因扩增,所用的引物为5’-gacgacgacaagatgcgtactcgtagcactatatcta-3’(正向引物,序列编号3)和5’-gaggagaagcccggttaaaggtgtttctgagtagtctca-3’(反向引物,序列编号4)。获得的扩增产物,利用pet46ek/lic试剂盒将基因连入pet46质粒载体中。诱导表达后编码的氨基酸序列除了zhd101的序列外,其n端还有一段包含14个氨基酸的载体序列,序列全长为278个氨基酸(以序列编号5标示,如图5所示)。
为提高该内酯酶对高毒性底物衍生物α-zol的活力,本申请利用定点突变技术(site-directedmutagenesis),以pet46-zhd101质粒为模板进行pcr,其中使用的突变引物见图6,其中正向引物以序列编号6标示,反向引物以序列编号7标示。此一突变设计系将内酯酶zhd101氨基酸序列(序列编号2)中的第153个氨基酸由缬氨酸(valine)突变成组氨酸(histidine),而由于利用pet46质粒载体诱导表达后的蛋白其n端同样具有一段包含14个氨基酸的载体序列,因此,突变蛋白的氨基酸序列系为将序列编号5中的第167个氨基酸由缬氨酸(valine)突变成组氨酸(histidine)的序列,并以v167h表示本申请之突变体内酯酶,其氨基酸序列以序列编号8标示,如图7所示。之后加入限制性内切酶dpni于37℃下反应以去除原始模板。将纯化后的反应产物转化大肠杆菌感受态细胞中,用抗生素进行初步筛选,进行dna测序以确定成功突变的基因。
将构建好的野生型(wt)和突变体(v167h)内酯酶的重组质粒转化入大肠杆菌bl21(de3)感受态细胞中,在含有100μg/mlampicillin的lb培养皿中筛选菌株。把筛选出的菌株接种到5mllb内培养,再放大菌量至200mllb培养,最终放大到6l的lb培养基中培养。在od值到达0.6至0.8时,加入1mm的iptg诱导酶蛋白的大量表达。经过3小时的蛋白质诱导表达后,将菌液以 6000rpm转速离心10分钟将细胞收集下来。加入裂解缓冲液(lysisbuffer),利用超声波细胞破碎机(sonicator)破菌,再以16000rpm转速离心30分钟,收集上清液用以准备下一步的纯化。为了得到高纯度的酶蛋白,本申请用快速蛋白质液相层析仪(fastproteinliquidchromatography;fplc)依次利用镍离子层析柱以及deae阴离子交换柱分离出蛋白纯度达95%以上的野生型及突变体内酯酶蛋白,并以5mg/ml浓度在25mmtris,150mmnacl,ph7.5条件下保存于-80℃。
为验证野生型(wt)和突变体(v167h)内酯酶的差异,本申请进一步测定二者对zen和α-zol的活力。内酯酶的活性测试方法下所述:
每个反应的混合物(210μl)处于25mmtris,150mmnacl,ph7.5的缓冲液中,包括5μl底物(5mg/mlzen或5mg/mlα-zol)和5μl酶(0.25mg/ml野生型或突变型内酯酶)。30℃反应10min之后,通过加入50μl1nhcl和300μl甲醇,反应终止。接着将反应混合物过滤,然后取20μl用高效液相色谱仪进行分析。样品被60%的乙腈以0.6ml/min的流速洗脱下来,吸亮度检测在254nm。剩余底物的量在hplc曲线下根据峰面积计算出来。对于野生型和突变型的酶活分别测定三次取平均值。
图8为野生型(wt)和突变体(v167h)内酯酶蛋白的活性比较图。将val167(v167)突变成his(h)后,突变体v167h对底物α-zol的活力比野生型对α-zol的活力提高了3.7倍,同时,突变体维持了野生型对zen的活力。此结果表明,突变体v167h在维持对zen的活力的同时,也提高了对α-zol的活力。
综上所述,为了增加内酯酶zhd101的对玉米烯酮霉素的脱毒效果,本申请深入研究了内酯酶zhd101的结构,针对其活性区或具有关键性特性的氨基酸进行突变,以增进酶对α-zol底物的活力。根据本发明,将氨基酸序列上第167个氨基酸由缬氨酸(valine)突变为组氨酸(histidine)后可以增加酶蛋白对α-zol底物的活力,对α-zol底物的活力为野生型的3.7倍,同时突变体对zen的活力保持与野生型相同。换言之,本申请亦提供一种降解α-zol的方法,系利用内酯酶zhd101之突变体v167h对α-zol进行降解,且此方法可大大提升α-zol降解效率。因此,本申请通过结构分析所进行的突变可明显地增加内酯酶zhd101对玉米烯酮霉素的脱毒效果,进而增进其 在饲料工业中的应用价值。故本申请所提出的内酯酶zhd101突变体及利用zhd101突变体降解α-zol的方法极具产业价值,特依法提出申请。
纵使本发明已由上述实施例详细叙述而可由熟悉本领域的技术人员进行多种修饰,其皆不脱离本申请所附权利要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!