蛋白包被的聚合物基底的制作方法
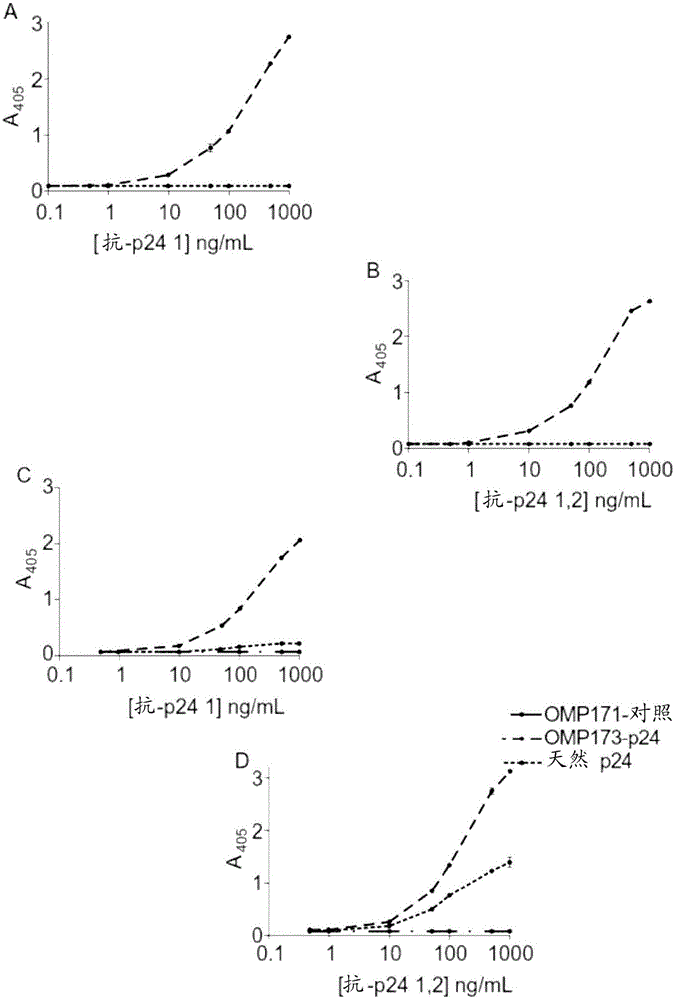
背景存在对用于许多应用例如诊断生物传感器、免疫诊断试剂、外科植入物和用于亲和纯化的生物加工介质的各种材料上固定蛋白的简单、可放大规模的方法的需求。在全部应用中,保持蛋白结构和功能并且为了最大性能效率将它在基底上正确地定向是非常重要的。存在许多用于在表面上固定蛋白的策略,如Nakanishi,K.等人.((2008)CurrentProteomics5:161-175)中综述的。物理吸附是通常使用的基于蛋白与表面的疏水相互作用或离子相互作用的方法。它方法上简单,但较不允许定量控制或定向控制;它可以通过解折叠改变蛋白的功能性质,并且重复性和效率是可变的。这意味着当结合时,蛋白可能不正确地定向用于分析物结合,或者可能完全地或部分地变性并且是非功能的。许多这些方法是复杂的,具有许多方法步骤并且难以放大规模用于大量制造。方法还导致有关蛋白的功能的大百分数损失;例如,少于10%的吸附于塑料ELISA板的抗体是有活性的,而化学偶联,例如胺偶联导致75%-100%活性损失(ButlerJ.E.等人.(1992)JImmunolMethods150:77-90;ButlerJ.E.等人.(1992)JImmunolMethods150:77-90;Esser,P.(2010)ThermoScientificApplicationNote11b;Johnsson,B.等人.(1995)JMolecularRecognition8:125-131)。结合蛋白至表面的其他方法包括表面的官能化,例如通过胺化或羧化以允许蛋白共价偶联至表面,或包被表面以介导结合(例如,链霉亲和素包被或生物素包被、聚赖氨酸包被、蛋白A包被或镍包被的表面)。其他方法包括通过加入结合至源自细菌的生物塑料PHA的结合标签(例如PhaF)来修饰蛋白。此类基于共价偶联的方法提供了稳定的连接,可以被应用于一系列蛋白并具有良好的重复性。然而,定向可以是可变的,并且化学衍生法可以改变蛋白的功能并且要求稳定的、相互作用的表面。利用蛋白上的标签(诸如六聚组氨酸/Ni-NTA或生物素/抗生物素蛋白)的生物捕获方法提供稳定的连接并特异性和以可重复的定向结合蛋白质,但配偶体试剂必须先在表面上被充分地固定化。WO2002057780描述了蛋白与金表面在自组装单层中的结合,其中蛋白的生物功能部分正确地定向并保持其活性的接近100%。该技术包括使用β-桶结构的细菌外膜蛋白(OMP)的经修饰的变体作为支架,在支架上可以融合其他感兴趣的蛋白和肽。在金上,支架具有内在的自组装性质并且被用作融合配偶体的锚点。融合配偶体被正确地定向并且保持功能。OMP与金表面的结合依赖于蛋白的修饰以在OMP的适当位置包括半胱氨酸残基,使得当半胱氨酸与金表面形成共价键时,蛋白被正确地定向并直接偶联至表面。这些方法具有以下缺点:需要蛋白中的特定的氨基酸介导与表面的反应、修饰表面以接受来自半胱氨酸的共价键合以及存在两亲分子诸如硫酯或硫烷以稳定蛋白单层。需要蛋白附接于表面的应用是普遍的,经常需要小区域上的高蛋白密度以使测定灵敏度最大化。塑料具有用作基于蛋白的测定中的基底的许多优势。但是,塑料表面的疏水性质导致蛋白的非特异结合和变性。本发明的目的在于克服或改善与现有技术相关的一些问题。公开内容简述在本发明的第一个方面中,提供了用于将跨膜蛋白固定在聚合物基底上的方法,所述方法包括:i)提供于除垢剂中的跨膜蛋白的样品;ii)提供聚合物基底;iii)将i)的蛋白样品与ii)的聚合物基底一起孵育;和iv)降低所述蛋白样品的除垢剂的浓度至该除垢剂的1x临界胶束浓度(CMC)或低于该除垢剂的1x临界胶束浓度(CMC);其中,蛋白通过物理吸附变得固定在基底上。跨膜蛋白可以锚定、或可以被修饰以锚定用于展示的异源蛋白或肽。因此,当结合至聚合物基底时,跨膜蛋白能够展示锚定于,优选以定向的和有功能的方式锚定于,该跨膜蛋白的蛋白或肽。因此,锚定的肽和/或蛋白可以空间上远离聚合物基底的表面以协助展示。锚定的蛋白或肽可以是有功能的。跨膜蛋白包含头(head)和足(foot),所述头和足被包含一个或更多个跨膜链的主体(body)彼此隔开。“锚”意指,跨膜蛋白可以在该蛋白的头的环中和/或该蛋白的头的N端和/或C端包含异源肽和/或蛋白。“修饰以锚定”意指,跨膜蛋白被工程化以在该蛋白的头包含N端和/或C端,和/或在该蛋白的头包含一个或更多个环。异源肽和/或蛋白可以在蛋白的头的工程化N端和/或C端提供,或在蛋白的头的工程化环中提供,用于展示。因此,本发明的跨膜蛋白:i)在该蛋白的头的环中包含异源肽和/或蛋白;ii)在该蛋白的头的N端和/或C端包含异源肽和/或蛋白;iii)被工程化以在该蛋白的头包含N端和/或C端;和/或iv)被工程化以在该蛋白的头包含一个或更多个环。异源肽和/或蛋白可以在蛋白的头的工程化N端和/或C端提供,或在蛋白的头的工程化环中提供,用于展示。优选地,跨膜蛋白包含异源肽和/或蛋白。可以提供间隔物以在跨膜蛋白和用于展示的肽和/或蛋白之间产生空间距离。在一个实施方案中,蛋白样品可以包含大于1xCMC,例如1.5xCMC、2xCMC、2.5xCMC或更高的除垢剂浓度。蛋白样品的除垢剂浓度是使得蛋白保留在溶液中的浓度。当蛋白处于高浓度时,例如1.5μM,蛋白更容易在低除垢剂浓度中沉淀;因此蛋白样品可以具有约2xCMC溶液的除垢剂浓度以保持蛋白溶解。蛋白与聚合物基底的结合通过降低除垢剂浓度至1xCMC或低于1xCMC实现。除垢剂浓度优选保持高于0xCMC以允许蛋白保持在溶液中一段时间并可以结合至基底。降低可以通过稀释或透析、或任何其他适当的方法实现。可以在蛋白样品与聚合物基底的孵育(步骤iii)之前降低除垢剂浓度。可选择地,可以在与聚合物基底孵育时或孵育后降低除垢剂浓度。蛋白的除垢剂浓度的降低使得跨膜蛋白能够结合至聚合物基底,其中通过跨膜蛋白锚定的肽或蛋白优选地是有功能的并被定向用于展示。除垢剂浓度的降低使得跨膜蛋白能够结合至聚合物基底,不需要蛋白的一级结构或二级结构的修饰,或基底的修饰或官能化。稀释可以包括添加水、缓冲液或任何其他适当的稀释剂。稀释剂可以包括除垢剂,条件是与稀释剂混合的作用是蛋白样品的除垢剂的浓度降低至1xCMC或低于1xCMC,优选地0.05xCMC至1xCMC。降低蛋白样品的除垢剂浓度的步骤还可以通过例如增加蛋白存在于其中的溶液的体积有效地降低蛋白浓度。稀释足以允许蛋白保持在溶液中一段与基底结合的充足时间,但除垢剂浓度足够低以允许蛋白物理吸附至聚合物基底。所述方法还可以包括洗涤基底。所述方法还可以包括将基底灭菌。在其中提供蛋白的除垢剂可以是任何离子型、非离子型或两性离子型除垢剂。在本发明的第二方面中,提供了包含固定于其上的跨膜蛋白的聚合物基底,其中所述跨膜蛋白通过物理吸附固定于所述基底上,并且其中所述跨膜蛋白锚定、或被修饰以锚定用于展示的异源蛋白或肽。当结合至(即,固定于)聚合物基底时,跨膜蛋白能够以定向的和有功能的方式展示锚定于该跨膜蛋白的蛋白或肽。因此,通过固定的跨膜蛋白锚定的肽和/或蛋白可以在空间上远离聚合物基底的表面,以协助展示。锚定的蛋白或肽可以是有功能的。使用跨膜蛋白通过充当小肽或蛋白的锚克服了将此类肽或蛋白以有功能的和定向的方式结合至聚合物基底的困难。因此,通过在固定于聚合物基底上的跨膜蛋白上展示肽和/或蛋白,该肽和/或蛋白保持功能、结构和/或可以以能够与其他组分相互作用的方式定向。跨膜蛋白可以如关于第一方面所定义的。因此,可以提供一种包含固定于其上的跨膜蛋白的聚合物基底,其中所述跨膜蛋白通过物理吸附固定于所述基底上,并且其中所述跨膜蛋白:i)在该蛋白的头的环中包含异源肽和/或蛋白;ii)在该蛋白的头的N端和/或C端包含异源肽和/或蛋白;iii)被工程化以在该蛋白的头包含N端和/或C端;和/或iv)被工程化以在该蛋白的头包含一个或更多个环。异源肽和/或蛋白可以在蛋白的头的工程化N端和/或C端提供,或在蛋白的头的工程化环中提供,用于展示。优选地,跨膜蛋白包含异源肽和/或蛋白。可以提供间隔物以在跨膜蛋白和用于展示的肽和/或蛋白之间产生空间距离。异源肽和/蛋白可以是有功能的。优选地,跨膜蛋白不使用交联剂固定。因此,蛋白被固定于聚合物基底上,而无使得蛋白能够与其结合的表面的官能化或修饰。交联剂包括例如标签、结合配偶体例如生物素和链霉亲和素、蛋白A等。优选地,跨膜蛋白不包含对底物结合结构域的修饰,所述底物结合结构域可以在蛋白的足中提供。例如,蛋白在底物结合结构域中包含其天然一级序列和/或二级序列。优选地,跨膜蛋白可以不包含使其能够与聚合物基底共价结合的修饰。优选地,跨膜蛋白在不存在稳定剂诸如脂质,例如脂质单层时被固定。本文中,稳定剂不包括除垢剂。优选地,跨膜蛋白是β-桶蛋白。优选地,跨膜蛋白是孔蛋白,优选地是革兰氏阴性菌的外膜蛋白(OMP),更优选地是OmpA或OmpF。在本发明的第三方面中,提供了一种包含聚合物基底的产品,所述聚合物基底包含固定于其上的跨膜蛋白,其中所述跨膜蛋白通过物理吸附固定于所述基底上,并且其中所述跨膜蛋白锚定、或被修饰以锚定用于展示的异源蛋白或肽。聚合物基底可以如关于本发明的第二方面所定义的。因此,提供了一种包含聚合物基底的产品,所述聚合物基底包含固定于其上的跨膜蛋白,其中所述跨膜蛋白通过物理吸附固定于所述聚合物基底上,并且其中所述跨膜蛋白:i)在所述蛋白的头的环中包含异源肽和/或蛋白;ii)在所述蛋白的头的N端和/或C端包含异源肽和/或蛋白;iii)被工程化以在所述蛋白的头包含N端和/或C端;和/或iv)被工程化以在所述蛋白的头包含一个或更多个环。异源肽和/或蛋白可以在蛋白的头的工程化N端和/或C端提供,或在蛋白的头的工程化环中提供,用于展示。优选地,跨膜蛋白包含异源肽和/或蛋白。在本发明的第四方面中,提供了结合样品中的组分的方法,所述方法包括:i)提供包含固定于其上的跨膜蛋白的聚合物基底,其中所述跨膜蛋白通过物理吸附固定于所述基底上,并且其中所述跨膜蛋白锚定用于展示的异源蛋白或肽;ii)向所述基底添加样品;iii)将所述基底与样品保持在允许任何组分结合至所述基底的条件下。方法可以任选地包括洗涤基底以去除任何未结合的材料;检测结合的组分的存在或不存在;和/或洗脱任何结合的组分。方法可用于筛选样品的感兴趣的组分,或从样品纯化感兴趣的组分,或固定来自样品的感兴趣的组分,例如用于进一步反应。方法可以包括在聚合物基底上固定跨膜蛋白,如本文所述。跨膜蛋白可以如关于本发明的第一方面和其他方面所定义的。聚合物基底可以如关于本发明的第二方面和其他方面所定义的。因此,方法可以包括:i)提供包含固定于其上的跨膜蛋白的聚合物基底,其中所述跨膜蛋白通过物理吸附固定于所述基底上,并且其中所述跨膜蛋白锚定用于展示的异源蛋白或肽;ii)向所述基底添加样品;iii)将所述基底与样品保持在允许任何组分结合至所述基底的条件下,其中所述聚合物基底聚合物基底包含固定于其上的跨膜蛋白,其中所述跨膜蛋白通过物理吸附被固定于聚合物基底上,并且其中所述跨膜蛋白:i)在所述蛋白的头的环中包含异源肽和/或蛋白;ii)在所述蛋白的头的N端和/或C端包含异源肽和/或蛋白;iii)被工程化以在所述蛋白的头包含N端和/或C端;和/或iv)被工程化以在所述蛋白的头包含一个或更多个环。异源肽和/或蛋白可以在蛋白的头的工程化N端和/或C端提供,或在蛋白的头的工程化环中提供,用于展示。优选地,跨膜蛋白包含异源肽和/或蛋白。在第五个方面,提供了介导锚定的肽和/或蛋白与样品中的组分相互作用的方法,所述方法包括:i)提供包含固定于其上的跨膜蛋白的聚合物基底,其中所述跨膜蛋白通过物理吸附固定于所述基底上,并且其中所述跨膜蛋白锚定用于展示的异源蛋白或肽;ii)向所述基底添加包含组分的样品;iii)将所述基底与样品保持在允许所述组分与锚定的肽和/或蛋白相互作用的条件下。跨膜蛋白可以如关于本发明的第一方面和其他方面所定义的。聚合物基底可以如关于本发明的第二方面和其他方面所定义的。因此,方法可以包括:i)提供包含固定于其上的跨膜蛋白的聚合物基底,其中所述跨膜蛋白通过物理吸附固定于所述基底上,并且其中所述跨膜蛋白锚定用于展示的异源蛋白或肽;ii)向所述基底添加包含组分的样品;iii)将所述基底与样品保持在允许所述组分与锚定的肽和/或蛋白相互作用的条件下,其中所述聚合物基底包含固定于其上的跨膜蛋白,其中所述跨膜蛋白通过物理吸附固定于聚合物基底上,并且其中所述跨膜蛋白:i)在所述蛋白的头的环中包含异源肽和/或蛋白;ii)在所述蛋白的头的N端和/或C端包含异源肽和/或蛋白;iii)被工程化以在所述蛋白的头包含N端和/或C端;和/或iv)被工程化以在所述蛋白的头包含一个或更多个环。异源肽和/或蛋白可以在蛋白的头的工程化N端和/或C端提供,或在蛋白的头的工程化环中提供,用于展示。优选地,跨膜蛋白包含异源肽和/或蛋白。组分可以是细胞,使得肽和/或蛋白可以充当细胞生长、发育和分化的效应物。肽和/或蛋白可以介导酶促反应,或可以充当催化剂。例如,肽和/或蛋白可以是生长因子或信号蛋白,或可以诱导细胞过程诸如信号传导途径等。设想,本发明的聚合物基底可以经由一种或更多种跨膜蛋白锚定两种或更多种不同的肽和/或蛋白,例如以同时提供不同的功能。因此,例如,可以在基底上提供细胞附着和生长因子的组合。在本发明的第六方面中,提供了包含聚合物基底的外科植入物,所述聚合物基底包含固定于其上的跨膜蛋白,其中所述跨膜蛋白通过物理吸附固定于所述基底上,并且其中所述跨膜蛋白锚定、或被修饰以锚定用于展示的异源蛋白或肽。跨膜蛋白可以如关于本发明的第一方面和其他方面所定义的。聚合物基底可以如关于本发明的第二方面和其他方面所定义的。在本发明的第七方面中,提供了一种孵育物(incubation),所述孵育物包含聚合物基底、跨膜蛋白和浓度为1xCMC或低于1xCMC的除垢剂。本发明的此方面涉及本发明的聚合物基底的生产中的中间物。任何适当的方法可以被用于降低除垢剂浓度,如本文中描述的。设想,跨膜蛋白中的一些可以固定于孵育物中的所述基底上。优选地,跨膜蛋白锚定、或被修饰以锚定用于展示的异源蛋白或肽。优选地,跨膜蛋白通过物理吸附变得固定于基底上。跨膜蛋白可以如关于本发明的第一方面和其他方面所定义的。聚合物基底可以如关于本发明的第二方面和其他方面所定义的。在本发明的第八方面中,提供了一种试剂盒,所述试剂盒包含聚合物基底和跨膜蛋白,所述跨膜蛋白锚定、或被修饰以锚定用于展示的异源蛋白或肽。跨膜蛋白可以如关于本发明的第一方面和其他方面所定义的。聚合物基底可以如关于本发明的第二方面和其他方面所定义的。在本发明的第九方面中,提供了一种跨膜蛋白,所述跨膜蛋白锚定、或被修饰以锚定用于展示的异源蛋白或肽。跨膜蛋白包含头和足,所述头和足被一个或更多个跨膜链彼此隔开。“锚”意指,跨膜蛋白可以在该蛋白的头的环中包含异源肽和/或蛋白,和/或在该蛋白的头的N端和/或C端包含异源肽和/或蛋白。“修饰以锚定”意指,跨膜蛋白被工程化以在该蛋白的头包含N端和/或C端,和/或在该蛋白的头包含一个或更多个环。优选地,跨膜蛋白:i)在所述蛋白的头的环中包含异源肽和/或蛋白;ii)在所述蛋白的头的N端和/或C端包含异源肽和/或蛋白;iii)被工程化以在所述蛋白的头包含N端和/或C端;和/或iv)被工程化以在所述蛋白的头包含一个或更多个环。异源肽和/或蛋白可以在蛋白的头的工程化N端和/或C端提供,或在蛋白的头的工程化环中提供,用于展示。优选地,跨膜蛋白包含异源肽和/或蛋白。跨膜蛋白可以是如本文定义的蛋白,例如如表7中定义的OMP蛋白。在本发明的第十方面中,提供了编码跨膜蛋白的核酸序列,其中所述跨膜蛋白锚定、或被修饰以锚定用于展示的异源蛋白或肽。跨膜蛋白可以如关于本发明的第一方面和其他方面所定义的。附图简述本发明的实施方案在下文中参考附图被进一步描述,其中:图1示出了基于β桶支架蛋白OmpA的定向进化的结合塑料的β桶蛋白的设计。OMP0是OmpA的原始的金结合的修饰版本,具有截短的N端和C端、用于亲和纯化的6xHis标签和用于与金共价结合的在蛋白的“足”的半胱氨酸。图2示出了用抗-HIV1-P24(A、C)和抗-HIV1/2P24(B、D)单克隆抗体,检测聚苯乙烯板(A、B)和Polysorp板(C、D)上固定的P24抗原和P24融合蛋白。图3示出了在用展示不同生物学性质的一系列OMP蛋白包被的96孔聚苯乙烯板上MG63骨细胞的培养物。空白代表未经修饰的聚苯乙烯孔且OMP154是未经修饰的支架蛋白,在OMP154中加入4个氨基酸RGDS产生OMP153,一种能够显著增强细胞附着的蛋白。图4是OMP18和天然蛋白A的IgG结合功能测定的示意图。OMP18的结构在图中示出。步骤1中,将蛋白附接至塑料表面;步骤2中,将IgG结合至任何有功能的IgG结合结构域;步骤3中,缀合至碱性磷酸酶的不能与蛋白A结构域结合的抗-IgG抗体结合至已经在表面上的任何IgG;和步骤4中,进行比色的酶促反应以辨别具有固定的IgG的表面。图5示出了检测功能蛋白在表面上的存在的免疫测定的结果。这些数据清楚地证明,融合至OMPβ桶支架锚的蛋白AIgG结合结构域的固定化在塑料表面上保持大得多的功能。优势的规模是出乎预料的,并且与亲水表面相比,在疏水表面上的优势特别明显。甚至在亲水表面上,OMP18蛋白示出了比天然蛋白A强得多的功能。图6示出了3D打印成开放格状3D圆盘的聚乳酸聚合物。用OMP0(未经修饰的OmpA)和OMP5(被工程化以展示FLAG表位的OMP0)处理圆盘。蛋白处理后,可以用碱性磷酸酶缀合的抗-FLAG抗体检验所有表面以定量蛋白附接。图7示出了用碱性磷酸酶缀合的抗体和PNPP检测FLAG表位。误差棒代表标准差。注意,此处OmpA指OMP0。在无蛋白和OMP0处理的表面上观察到相似水平的非特异性结合,而显著更多的抗体结合至OMP5处理的表面。图8示出了在A.OMP36处理的聚合物纤维、B.无蛋白纤维上生长的DAPI染色的PC12细胞。两幅图像都使用10x物镜捕获。图9示出了3T3成纤维细胞在OMP36处理的板上的附着和生长。图10示出了聚苯乙烯上包被的OMPFGF与培养基中可溶性FGF2的比较。图11OMP59和OMP171的比对。存在于OMP59上但从OMP171缺失的细胞外环和长C端在OMP171序列上以虚线示出。α螺旋间隔物序列以斜体示出,OMP171中的突变残基加有下划线。OMP171的C端独有的两个额外的亲水残基以粗体示出并且半胱氨酸残基以*标出。图12是示出了在此实验中检验的蛋白的结构的示意图。图13OMP0和OMP154的氨基酸序列的比对。延长的环1以斜体在OMP154序列上示出。OMP154中缺失的环和截短的C端尾巴以虚线在OMP154序列上示出。小基序的插入位点用黑色三角示出。在OMP154中,存在于OMP0的半胱氨酸被突变成甘氨酸(加下划线)。图14示出了通过去除信号结构域和C端结构域并加入N端his标签和在位置10加入半胱氨酸而修饰的OMP0“野生型”的核酸序列和氨基酸序列。TM1是残基49-84;OL1是残基85-126;TM2是残基127-165;TM3是残基175-213;OL2是残基214-249;TM4是残基250-285;TM5是残基301-345;OL3是残基346-387;TM6是残基388-427;TM7是残基436-465;OL4是残基466-507;TM8是残基508-540;半胱氨酸是残基28-30。TM—跨膜链(穿过膜的链),OL—外环(细胞外环)。图15示出了OMP9环1环状排列(circularpermutation)的核酸序列和氨基酸序列。图16示出了OMP13环3环状排列的核酸序列和氨基酸序列。图17示出了OMP14环4环状排列的核酸序列和氨基酸序列。图18示出了OMP140短环、α螺旋间隔物、C端his标签、无半胱氨酸的核酸序列和氨基酸序列。图19示出了OMP154(具有短环和截短的C端,但环1被延长的OMP0)的核酸序列和氨基酸序列。图20示出了OMP170短环、n端his标签、在aa122的半胱氨酸的核酸序列和氨基酸序列。图21示出了OMP171的核酸序列和氨基酸序列,OMP171如170但在his标签后具有α螺旋间隔物。图22示出了蛋白在不同除垢剂浓度的固定化。在96孔板中以示出的除垢剂浓度稀释OMP18蛋白(终浓度0.1μM)。6h后洗涤并干燥一组孔,而在第二组孔中允许吸附进行24h。洗涤后,用小鼠IgG探测表面并用抗-小鼠AP缀合物和PNPP底物比色反应检测。用0.125xCMC的DM中的OMP18吸附24h获得最佳结果。图23示出了基底上的蛋白的饱和程度。OMP18浓度的作用。在0.125xCMC的除垢剂中将OMP18稀释至不同终浓度并吸附24h。如本文所述进行小鼠IgG结合测定。结果证明了,表面被所有除垢剂中100nM(0.1μM)蛋白几乎饱和,并且这被选作用于吸附的标准浓度。图24是OMP9和OMP18斑点实验的扫描。在每孔中放置白色纸塞以获得孔底部的清楚的扫描。图25示出了假设的6条链的桶蛋白。环状排列导致N端和C端以及β链的重新定位。图26示出了来自polybead实验的样品的SDSPAGE分析。将5μL人血清装载在泳道1,所有其他泳道装载1mL样品的20μL。HSA是人血清白蛋白。VH是IgG的~50kDa的重链,且VL是~25kDa的轻链。样品在具有1mMDTT的SDS上样染料中并在95℃加热5min。图27示出了0%SDS孔用SDW洗涤。全部洗涤一式三份进行,并且示出的数据是三个孔的平均值。存在大于3个A405单位的非常高的读数,因为允许与PNPP底物溶液的反应进行15min。图28示出了用TweenTM洗涤后OMP203和OMP18的检测。使用Tween20。图29示出了洗涤频率对免疫测定信号的作用。使用TweenTM20。与PNPP的孵育在室温进行5min。图30示出了来自用如X-轴上示出的多种试剂洗涤后的免疫测定的数据。图31示出了来自OMP203检测的吸光度读数。图32示出了在用展示多种ECM基序的OMP蛋白包被的聚苯乙烯上MG63细胞的培养物的结果。图33是Alvetex的多孔的3D结构的电子显微照片。图34示出了在经OMP蛋白处理的3D聚苯乙烯上碱性磷酸酶缀合的IgG的检测结果。图35示出了在1%tritonX-100中浸没数天后的PLA上的OMP蛋白的抗体检测。图36示出了来自动态光散射实验的数据。图示出了平均粒径经1小时时段的变化。图37示出了预稀释后OMP203检测的免疫测定的结果。详述本发明是基于通过物理吸附用蛋白使聚合物表面官能化的不同方法。本发明的方法使跨膜蛋白能固定于聚合物基底上,不需要共价结合,并且仍然保持物理吸附的优点,即,不需要蛋白或基底的化学修饰,并且不需要存在稳定化合物诸如硫酯和硫烷。本发明的方法使跨膜蛋白能够被用作用于展示的蛋白和/或肽的锚。由于被锚定的肽和/或蛋白不直接固定于聚合物表面,它们保持功能和/或结构,并且被定向用于展示。因此,跨膜蛋白以这样的方式结合至基底,该方式使得跨膜蛋白能够被用作用于展示的锚。本发明使得跨膜蛋白能够如下地固定于聚合物基底上:i)非共价地(例如通过范德瓦尔斯相互作用或离子结合);ii)不需要修饰跨膜蛋白的底物结合结构域(例如足)(例如,修饰一级结构或二级结构)以包含底物结合残基;iii)不使基底官能化或修饰基底以使得跨膜蛋白能够与其结合;和/或iv)不存在稳定剂诸如脂质。另外,本发明的方法使得iv)跨膜蛋白能够锚定用于展示的肽和/或蛋白,优选地使得该肽和/或蛋白是有功能的并被定向用于展示。优选地,被锚定的肽和/或蛋白被定向远离聚合物基底的表面,使得它可用于展示。跨膜蛋白的高疏水性质意指,它们在溶液中沉淀,除非被高浓度的除垢剂(高于1xCMC,优选地2xCMC)稳定。这也防止此类蛋白结合至表面。预期,除垢剂的存在将防止蛋白通过疏水相互作用结合至表面,并且固定化至多是无效的。但是,出乎预料地发现,在低除垢剂浓度中稀释蛋白使跨膜蛋白能够以使锚定的肽和/蛋白有功能并且被定向的展示的方式固定于聚合物表面。根据本发明的固定跨膜蛋白至聚合物基底不同于现有技术的固定化方法。令人惊讶的是,发明人已经示出了,当蛋白通过跨膜蛋白被锚定至表面时,本发明的方法产生大的功能增加。本发明的巨大优势由如图2中示出的HIV抗原(P24蛋白)与跨膜蛋白(OMP170-型支架)的融合例证。本文中,基底包括蛋白可以固定于其的表面。基底可以采取能够接收蛋白固定于其上的任何适当的形式。基底优选地是固体(即,不是凝胶或液体)。基底可以包括光滑表面或可以是有纹理的。基底或其表面可以是网状物、纤维、珠、针织物或梭织物、孔或微孔板、组织培养瓶或任何其他表面。基底至少在其结合表面上包含聚合物材料。基底可以包含一种或更多种不同的聚合物。基底优选地包含裸露的聚合物表面,意指,它未被其他材料(例如蛋白诸如生物素或链霉亲和素)包被以协助蛋白质结合至基底,或未被例如通过酰胺化或羧化官能化以介导结合。聚合物(聚合物基底)可以包括塑料、丝或其他蛋白纤维(例如毛发、毛皮(角蛋白丝)、肌动蛋白丝、胶原蛋白丝等)以及石墨烯。聚合物可以是塑料。聚合物是本领域技术人员已知的,并且可以包括乙烯基树脂(polyvinyl)、聚乙烯(PE),包括例如聚乙烯对苯二甲酸酯(PET)和高密度聚乙烯(HDPE)和低密度聚乙烯(LDPE)、聚丙烯酸酯(亚克力)、聚苯乙烯(PS),包括耐冲击聚苯乙烯(HIPS)、硅酮、聚酯(例如聚乳酸(PLA)或聚乳酸羟基乙酸共聚物(PGLA))、聚氨酯、聚丙烯(PP)、聚酰胺(尼龙)、丙烯腈丁二烯苯乙烯(ABS)、聚乙烯/丙烯腈丁二烯苯乙烯(PE/ABS)、酚醛塑料(bakelite)、橡胶、胶乳、聚碳酸酯(PC)、聚碳酸酯/丙烯腈丁二烯苯乙烯(PC/ABS)和聚氯乙烯,包括例如聚偏二氯乙烯(PVDC)。聚合物可以是天然的或合成的。除了制造基底的有机聚合物以外,基底可以包含非有机添加剂或有机添加剂,以重量计从10%至50%。聚合物可以是生物可降解的。聚合物基底可以是疏水的、亲水的、两亲的或其两种或更多种的组合。在一个实施方案中,至少部分聚合物基底是疏水的。本文中,膜指围绕细胞以将细胞内部从周围环境分开的细胞膜(也被称为质膜或细胞质膜)。本文中术语膜包括内膜和外膜二者。术语“膜外的”指膜以外的,酌情地,例如细胞外的、周质的或细胞质空间。本文中对周质的、细胞质的或细胞外的提及是关于蛋白在膜中的原始定位做出的。细胞膜包括磷脂双层,磷脂双层中包埋了蛋白以帮助通讯和转运穿过细胞膜。因此,如本文中定义的跨过膜的蛋白为跨过磷脂双层的蛋白。异源肽或蛋白意指,该肽或蛋白部分在自然中不天然地与提及的产品缔合。它还可称为外来的。因此,锚定的肽或蛋白序列或间隔物可以是与跨膜蛋白异源的,意味着,这些肽和/或蛋白在自然中不在跨膜蛋白中找到。工程化蛋白或核酸序列是已经被人工修饰的蛋白或核酸序列,例如使用重组蛋白或DNA技术以提供与天然核酸或蛋白序列的一级序列、二级序列或三级序列不同的核酸序列或蛋白。蛋白可以被工程化以与天然蛋白空间上不同,这也可以被描述为工程化二级结构或三级结构。在本发明中,肽或蛋白是由肽键连接的一串氨基酸。蛋白也可以被称为多肽。氨基酸可以是天然的、非天然的或其组合。它们可以是L-氨基酸或D-氨基酸。肽和蛋白可以是化学合成的或从天然来源或重组来源纯化的。蛋白可以具有二级结构,和任选地三级结构。另一方面,肽描述通常缺乏二级结构或三级结构的短的、线性的氨基酸链。肽可以包含2个或更多个氨基酸残基。蛋白可以包含20个或更多个氨基酸残基。如本文使用的,术语“核酸序列”指任何长度的单链或双链的脱氧核糖核苷酸聚合物或核糖核苷酸聚合物,但优选地至少15个核苷酸,并且作为非限制性实例,包括基因的编码序列和非编码序列、有义和反义序列互补物、外显子、内含子、基因组DNA、cDNA、前mRNA、mRNA、rRNA、siRNA、miRNA、tRNA、核酶、重组多肽、经分离的和经纯化的天然存在的DNA或RNA序列、合成的RNA和DNA序列、核酸探针、引物和片段。本文中,跨膜蛋白指其以天然形式位于细胞膜中并且跨过膜的蛋白。本文中跨膜蛋白还可以称为整合膜蛋白或跨膜蛋白(transmembraneprotein)。跨膜蛋白包含被包含一个或更多个跨膜链的主体空间上分离的头和足。“跨(spanning)”意指,它延伸穿过细胞膜的至少大部分脂质双层。因此,出于本发明的目的,“跨膜的”可以包括延伸超过膜边界或不完全延伸穿过膜边界的蛋白。它们可以与能够运输穿过膜但不如本文定义的跨越膜的蛋白区分开。跨膜蛋白可以是单次通过(pass)蛋白,意味着它跨越膜一次,或可以是多次通过蛋白,意味着它跨越膜一次或更多次。跨膜蛋白可以包含一个或更多个多肽。通常,在其天然形式中,跨膜蛋白可以在运送通过细胞膜、离子交换、细胞信号传导或通讯、作为接头或酶的功能或在膜生物合成中起作用。“通过(pass)”意指由蛋白跨越膜,或基本上跨越膜。因此,单次通过蛋白将跨越膜一次,具有在头或足的任一个处的N端,和在头或足的另一个的C端。因此,单次通过蛋白将不具有膜外环。2次通过蛋白将跨越膜两次,使得N端和C端都从头或足伸出。2次通过蛋白将包含单个转角(turn)或环。可选择地,跨膜蛋白可以被称为X条链的蛋白,意味着它们具有跨越脂双层的规定数目的链。本文中,当提及跨越穿过脂双层时,术语“通过(pass)”和“链”可以互换使用。跨膜蛋白将本质上包含二级结构,使得它具有将存在于膜并且如本文定义地跨越膜的大小和形状。因此,该术语将不包括基本上缺乏二级结构的短肽序列或线性序列。另外,预计,被锚定至膜并且主要存在于膜外的蛋白将不适合于在本发明中使用。本领域技术人员将理解,术语“跨膜的”不应被严格地解释以至于从本发明排除部分延伸超过膜边界或仅延伸穿过膜边界之间的大部分区域的蛋白。跨膜蛋白可以包含α螺旋结构。此类跨膜蛋白可以在细菌细胞的内膜中或真核细胞的质膜中找到,并且有时在外膜中找到。跨膜蛋白的大部分是α螺旋。可选择地,跨膜蛋白可以包含β桶构型。此类蛋白在革兰氏阴性菌的外膜、革兰氏阳性菌的细胞壁和线粒体和叶绿体的外膜中找到。多次通过蛋白可以包含连接二级结构的单元(例如β-链)的连接(例如转角)。此类连接可以暴露于水相,诸如细胞溶胶周质或细胞外液体。本文描述的跨膜蛋白将在水中聚集。本发明的跨膜蛋白可以是天然存在的或可以是重组的。本发明的跨膜蛋白可以是工程化的。用于在本发明中使用的优选的跨膜蛋白是包含β桶结构的那些。β桶蛋白包含大β-折叠,所述大β-折叠采用中空的、圆柱状结构或桶形。在β桶中,β折叠的β链以反向平行的方式排列,尽管一些β-桶蛋白已被鉴定包含平行的链。疏水残基可以被定向至桶的外侧,并且亲水残基面向内侧。β桶中相邻的β链可以序列上相邻(被称为“上下β桶”)或序列上不相邻(被称为希腊钥匙或希腊钥匙桶)。β桶蛋白可以包含任何数量的链,例如从8至22条β链。β桶蛋白可以包含偶数的β链或奇数的β链。跨膜蛋白的邻近的链或螺旋诸如β桶各自由转角或环连接。转角是蛋白的二级结构的元件,其中氨基酸链改变方向。转角包括紧密转角(包括α、β、γ、δ和π-转角)、多转角(multipleturns)、发夹转角。转角通常由该转角的残基之间的氢键的性质定义。转角,特别是β转角,通常在跨膜蛋白的周质末端找到。β转角也被称为β弯曲(β-bend)或紧密转角。β转角是蛋白的区域,其中多肽链以约180°在其自身上向后折叠。转角可以包含2至6个氨基酸残基,更优选地β转角的4个氨基酸。β转角可以包含脯氨酸和甘氨酸残基。β桶蛋白中的每个转角可以被编号,例如T1、T2等。通常,转角不是膜外的。跨膜蛋白的环通常长于转角,并且可以延伸出膜进入膜外空间。环示出了高的序列可变性,并且通常缺乏二级结构。与通常可以是疏水性质的跨膜蛋白的跨膜部分(例如β链或桶结构)相比,环可以是亲水性质。环可以被标为L1、L2等。跨膜蛋白将通常在膜的一侧包含转角,在另一侧包含环。本文中,主要包含环的蛋白末端被称为蛋白的头。本文中,主要包含转角的蛋白末端被称为蛋白的足。在外膜蛋白中(即革兰氏阴性菌、叶绿体和线粒体的外膜蛋白中),环通常全部在蛋白的面向细胞外空间的一侧发现。本文中,这是外膜蛋白的头。包含转角和端(termini)的末端通常面向周质空间,并且在本文中被称为蛋白的足。一个或更多个α螺旋链跨越膜,形成蛋白的主体。在内膜蛋白或真核膜蛋白中,环可以在蛋白的面向周质或细胞质的末端上找到。因此,在本文中,头被定义为包含膜外结构域例如环的大部分的末端。足是主要包含转角的末端,具有比蛋白的另一个末端更少的膜外结构域。N端和C端是蛋白的末端,C端包含游离羧基(COOH)并且N端包含游离氨基(NH2)基团。本文中,对端的提及包括对末端N残基或末端C残基、或N端尾巴或C端尾巴、或其部分的提及。对于跨膜蛋白,尾是与从膜伸出的N端或C端相邻的部分,即,尾是在跨膜链和N端或C端残基之间的部分。尾可以包含2个或更多个氨基酸残基,例如2个、5个、10个、15个、20个、30个、40个、50个或更多个氨基酸残基。OmpA蛋白的尾在图14中示为残基17至48(N端)和180至207(C端)。在一个优选的实施方案中,蛋白的工程化包括排列蛋白的环以包括N端和/或C端尾,优选地其中尾包含氨基酸17至48(N端)和/或180至207的氨基酸序列、或其部分。跨膜蛋白可以是整合膜蛋白,优选地是β桶蛋白,优选地是孔蛋白。跨膜蛋白可以是离子通道、配体的受体、酶或其他。β桶蛋白包括孔蛋白,其天然地起离子和其他不能扩散穿过细胞膜的小分子的转运体的作用。环设在β链之间。孔蛋白包括革兰氏阴性菌的外膜蛋白(OMP),其为外膜的孔蛋白。这些包括OmpA,也被称为OmpII,一种8条链的β桶,以及OMPF,其为16条链的β桶的同三聚体(也被称为孔蛋白ompF外膜蛋白1A)。其他β桶蛋白包括存在于线粒体和叶绿体中的蛋白质原移位酶;以及脂质运载蛋白(lipocalins)。用于在本发明中使用的跨膜蛋白可以是真核的或原核的。它可以是细菌的。它可以是植物源的,或哺乳动物。用于在本发明中使用的跨膜蛋白将是可被本领域技术人员获得的。用于在本发明中使用的已知β桶蛋白的实例包括:(CurrOpinStruct.Biol2011Aug21(4)523-531):8条链的蛋白:鼠疫耶尔森菌(Yersiniapestis)的Ail(PDBID:3QRA、3QRC);脑膜炎奈瑟氏菌(Neisseriameningitides)的NspA(1P4T);大肠杆菌(E.coli)的OmpA(1QJP、IBXW、1G90、2GE4、2JMM);肺炎克雷伯菌(Klebsiellapneumonia)的OmpA(2K0L);嗜肺军团菌(Legionellapneumophila)的OmpA(3LDT);大肠杆菌(Escherichiacoli)的OmpW(2F1V、2F1T);大肠杆菌的OmpX(1QJ8、1ORM、1Q9F、1Q9G、1QJ9);铜绿假单胞菌(Pseudomonasaeruginosa)的OprG(2X27);大肠杆菌的PagP(1MM4、1MM5、3GP6、1THQ);铜绿假单胞菌的PagL(2ERV);Thermusthermophiles的TtoA(3DZM);10条链的蛋白:大肠杆菌的OmpT(1I78);脑膜炎奈瑟氏菌的OpcA(1K24、2VDF);鼠疫耶尔森菌的Pla(2X55、2X56);12条链的蛋白:大肠杆菌的EspP(2QOM);铜绿假单胞菌的EstA(3KVN);大肠杆菌的Hbp(3AEH);流感嗜血杆菌(Haemophilusinfluenza)的Hia(2GR8);鼠伤寒沙门氏菌(Salmonellatyphimurium)的LpxR(3FID);弗氏志贺菌(Shigellaflexneri)的IcsA(3ML3);脑膜炎奈瑟氏菌的NalP(1UYN、1UYO);大肠杆菌的NanC(2WJQ、2WJR);大肠杆菌的OMPLA(1QD5、1QD6、1FW2、1FW3、1ILD、1ILZ、1IMO);铜绿假单胞菌的OprM(1WP1);大肠杆菌的TolC(1EK9);大肠杆菌的Tsx(1TLW、1TLY、1TLZ);霍乱弧菌(Vibriocholera)的VceC(1YC9);14条链的蛋白:金黄色葡萄球菌(Staphylococcusaureus)的α-HL(7AHL、3M2L、3M3R、3M4D、3M4E);大肠杆菌的FadL(1T16、3DWN、2R4L、2R4N、2R4O、2R4P、2R88、2R89、2R8A、1T1L);铜绿假单胞菌的FadL(3DWO);大肠杆菌的OmpG(2F1C、2IWV、2IWW、2JQY、2WVP、2X9K);皮氏罗尔斯通菌(Ralstoniapickettii)的TbuX(3BRY);恶臭假单胞菌(Pseudomonasputida)的TodX(3BS0、3BRZ);16条链的蛋白:百日咳杆菌(Bordetellapertussis)的FhaC(2QDZ、2NJT);MspA(1UUN);食酸丛毛单胞菌(Comamonasacidovorans)的Omp32(1E54);代尔夫特食酸菌(Delftiaacidovorans)的Omp32(2FGQ、2FGR);肺炎克雷伯菌的OmpK36(1OSM);大肠杆菌的OmpC(2J1N、2J4U、2XE1、2XE2、2XE3、2XE5、2XG6);大肠杆菌的OmpF(2ZFG、1BT9、3FYX、1GFM、1GFN、1GFO、1GFP、1GFQ、3HW9、3HWB、1HXT、1HXU、1HXX、3K19、3K1B、1MPF、3O0E、2OMF、2OPF);铜绿假单胞菌的OprP(2O4V);大肠杆菌的PhoE(1PHO);Gdpa,荚膜红细菌(Rhodobactercapsulatus),(2POR);Gdpa,Rhodopseudomonasblastica,(1H6S、1PRN、2PRN、3PRN、5PRN、6PRN、7PRN、8PRN);PorB,脑膜炎奈瑟氏菌,(3A2R、3A2S、3A2T、3A2U);18条链的蛋白:荧光假单胞菌pf-5(Pseudomonasfluorescenspf-5)的BenF(3JTY);LamB,大肠杆菌,(1MPM、1MPN、1MPO、1MPQ、1AF6、1MAL);鼠伤寒沙门氏菌的LamB(2MPR);铜绿假单胞菌的OpdK,(2QTK);铜绿假单胞菌的OprD(2ODJ)或鼠伤寒沙门氏菌的ScrY(1A0T、1A0S、1OH2);19条链的蛋白:小家鼠(Musmusculus)的VDAC1(3EMN);智人(Homosapiens)的VDAC1(2K4T、2JK4);22条链的蛋白:大肠杆菌的BtuB(1NQE、1NQF、2GUF、2GSK、1NQG、1NQH、1UJW、2YSU、3M8B、3M8D);大肠杆菌的Cir(2HDI、2HDF);百日咳杆菌的FauA(3EFM);大肠杆菌的FecA(1KMO、1PNZ、1KMP、1PO0、1PO3);FepA,大肠杆菌(1FEP);FhuA,大肠杆菌(1BY3、1BY5、1FCP、2FCP、1FI1、2GRX、1QFF、1QFG、1QJQ、1QKC);FptA,铜绿假单胞菌(1XKW);FpvA,铜绿假单胞菌(2W75、2O5P、2W16、2W6T、2W6U、2IAH、2W76、2W77、2W78、1XKH);HasR,黏质沙雷氏杆菌(Serratiamarcescens)(3CSL、3CSN、3DDR);ShuA,痢疾志贺菌(Shigelladysenteriae),转运体(3FHH);以及24条链的蛋白:大肠杆菌的PapC(3FIP)aGdp-一般扩散孔蛋白。PDBID在括号中提供。列出的PDBID的另外的信息可以在蛋白质数据库(www.rcsb.org)中找到。本文中,术语“OMPXX”或“ORLAXX”,其中X是已经关于用于在本发明中使用的优选支架使用的数值。术语“OMP”是非限制性的,并且任何如本文定义的适当的跨膜蛋白可以被如关于任何特定“OMPXX”或“ORLAXX”支架修饰以实现本发明。用于在本发明中使用的优选的跨膜蛋白是图14的OMP0。另外优选的跨膜蛋白是表7中定义的OMPXX的任一个。本发明在其范围内包括如关于每个“OMPXX”具体描述修饰的跨膜蛋白,以及使用方法和包含如本文描述的此类蛋白的产品。适当的跨膜蛋白可以通过二级结构的分析鉴定。蛋白二级结构通过残基间氢键定义,所述氢键导致三维结构的形成。根据残基和所得键的数量和类型,二级结构包括α螺旋、β折叠和多种转角。氨基酸的形成二级结构的能力不同,使得能够从氨基酸序列预测肽或蛋白的二级结构。在本发明中可以使用任何适当的预测方法以从一级结构鉴定跨膜蛋白,特别是β桶蛋白(例如,参见:Barton(1995)CurrentopinioninstructuralbiologyVol5p372-376;Jones(1999)JournalofMolecularBiologyVol292p195-202;Pirovano和Herringa(2010)Chapter19:ProteinSecondarystructureprediction.In:MethodsinMolecularBiology–DataMiningTechniquesforthelifesciencesEds.OCarugo和FEisenhaber,HumanaPressDOI10.1007/978-1-60327-241-4)。在本发明中,此类方法可以在跨膜蛋白的修饰期间使用以预测折叠,并且从而预测经修饰的或合成的蛋白序列的二级结构。临界胶束浓度(CMC)被定义为高于该除垢剂的浓度则自发形成胶束的浓度。在高于CMC的浓度,除垢剂与亲脂蛋白形成复合物。低于CMC时,除垢剂仅分配到膜中,不溶解膜蛋白。跨膜蛋白的β桶核心的高疏水性质意味着,它们在溶液中沉淀,除非被高浓度的除垢剂(大于1xCMC)稳定。这也防止此类蛋白结合至表面。CMC将根据除垢剂变化,例如SDS具有7-10mM的CMC;十二烷基麦芽糖苷具有0.15mM的CMC;辛基葡萄糖苷具有20-25mM的CMC。因此,对于SDS,7-10mM的除垢剂浓度被表示为1xCMC。十二烷基麦芽糖苷的0.3mM的除垢剂浓度被表示为2xCMC,等等。稀释因子将取决于样品中蛋白和除垢剂的起始浓度、以及需要的稀释后的工作浓度,并且可以由本领域技术人员基于使用已知的稀释技术计算以提供1xCMC或低于1xCMC的CMC,以及蛋白浓度,其中该蛋白在除垢剂的该浓度中保持溶解充足的时间以结合至基底。蛋白是否溶解可以由本领域技术人员使用可用的溶解度测定容易地确定。如果蛋白是不溶的,它将沉淀并形成浑浊的溶液。浊度可以被测量,例如通过在400nm测量吸光度。可选择地,简单的目视评价可以被使用以检测表明蛋白不再溶解的浑浊的溶液。本发明的方法包括降低i)的蛋白样品的除垢剂浓度至1xCMC或低于1xCMC。优选地,CMC保持在0以上。因此,CMC可以被降低至0.05xCMC至1xCMC、0.075xCMC至1xCMC、优选地0.1xCMC至1xCMC、或0.05xCMC至0.9xCMC、0.075xCMC至0.9xCMC、优选地0.1xCMC至0.9xCMC、或0.05xCMC至0.8xCMC、0.075xCMC至0.8xCMC、优选地0.1xCMC至0.8xCMC、或0.05xCMC至0.7xCMC、0.075xCMC至0.7xCMC、优选地0.1xCMC至0.7xCMC、或0.05xCMC至0.6xCMC、0.075xCMC至0.6xCMC、优选地0.1xCMC至0.6xCMC、或0.05xCMC至0.5xCMC、0.075xCMC至0.5xCMC、优选地0.1xCMC至0.5xCMC、或0.05xCMC至0.4xCMC、0.075xCMC至0.4xCMC、优选地0.1xCMC至0.4xCMC,或0.05xCMC至0.3xCMC、0.075xCMC至0.3xCMC、优选地0.1xCMC至0.3xCMC、或从0.05xCMC至0.2xCMC、0.075xCMC至0.2xCMC、优选地0.1xCMC至0.2xCMC。优选地,这些值是蛋白样品已经与聚合物基底孵育后的孵育混合物的除垢剂浓度,尽管设想,除垢剂浓度的降低可以在孵育之前进行。在这些参数内,防止蛋白在溶液中沉淀成颗粒,而是促进蛋白与聚合物基底附接。任何特定除垢剂的合适的稀释因子可以由本领域技术人员通过检验具有锚定至用于展示的肽和/或蛋白的跨膜蛋白的基底的饱和程度和当与基底孵育时蛋白的溶解度容易地确定。适当的稀释因子提供至少60%、65%、70%、75%、80%、85%、90%或至少95%的基底的饱和度,并且蛋白在溶液中保持至少6小时,优选地至少8小时,优选地至少10小时,和最优选地过夜(即12至24小时)。饱和可以使用如以下描述的结合测定确定。可以使用任何适当的除垢剂。优选的除垢剂是稳定蛋白并防止蛋白沉淀出溶液但允许蛋白与基底相互作用并结合至基底的那些。最优选地,除垢剂可以选自由正辛基葡萄糖苷、十二烷基麦芽糖苷或Thesit组成的组。除垢剂可以单独使用,或与一种或更多种其他除垢剂组合,所述其他除垢剂优选地选自以上定义的那些。优选地,相同的除垢剂被用于加至蛋白以提供蛋白样品,和当除垢剂在与稀释剂组合的稀释中使用时二者。适当的缓冲液包括磷酸盐缓冲液、Tris缓冲液、HEPES缓冲液、MES缓冲液、TES缓冲液、甘氨酸缓冲液、乙酸盐缓冲液以及被本领域技术人员公认的任何其他缓冲液。蛋白可以在溶液中提供,或作为干燥的产品。优选地,蛋白在向其中加入除垢剂的缓冲液中提供。当蛋白以干燥的产品提供时,所述方法可以包括在适当的缓冲剂例如ROG-8(50mMTrisHCl,0.1mMEDTA,1%OG)中溶解蛋白的另外的步骤。在本发明的方法中,蛋白样品的除垢剂浓度可以在与基底孵育之前降低。另外地或可选择地,除垢剂浓度可以在样品和基底孵育之后降低。在一个实施方案中,稀释剂可以在与样品孵育之前加至基底,这有效地降低孵育后样品的除垢剂浓度。因此,步骤ii)可以包括在基底与蛋白孵育之前向聚合物基底添加稀释剂。因此,所述方法可以包括:i)提供于除垢剂中的跨膜蛋白的样品;ii)提供聚合物基底;iii)向聚合物基底添加稀释剂,使得在添加蛋白样品后提供1x或低于1x的CMC;iv)将i)的蛋白样品与iii)的聚合物基底孵育;其中,蛋白通过物理吸附变得固定在基底上。所述方法可以包括:i)提供于除垢剂中的跨膜蛋白的样品;ii)提供聚合物基底;iii)降低蛋白样品的除垢剂浓度,使得当与基底孵育时CMC为1x或低于1x;iv)将iii)的蛋白样品与ii)的聚合物基底孵育;其中,蛋白通过物理吸附变得固定在基底上。蛋白可以以任何适当的方式添加至基底,例如它可被形成图案(例如斑点状的)。孵育优选地在室温或低于室温(但高于0℃)进行。优选地,孵育保持至少6小时,优选地至少8小时,优选地至少10小时,并且最优选地12-24小时。24小时是最佳的孵育时间段。在一个实施方案中,所述方法另外包括洗涤基底。基底可以用任何适当的缓冲液、水或包含除垢剂或乙醇的溶液洗涤,例如TBS、PBS、HEPES、TE、70%乙醇、Tween或去离子水,优选地无菌的。洗涤具有从基底去除任何未结合的材料和任何残留的除垢剂的目的。基底可被干燥。它还可被灭菌。它可以被包装用于销售。跨膜蛋白与基底的结合可以使用本领域任何适当的方法确定,包括例如结合测定。在一个典型的结合测定中,基底可以与能够结合至跨膜蛋白的结合位点或能够结合至从而锚定的肽或蛋白的配体(例如IgG)一起孵育。通过洗涤去除任何未结合的配体。然后结合的配体可以被直接地监测,例如如果该配体包括可以被测量的信号,或被间接地监测,例如通过使用对该配体特异性的第二结合成员。第二结合成员可以是缀合至酶或催化剂或其他标记物诸如荧光标签的抗体,并且检测可以通过与底物一起孵育并测量产生的信号的量来执行。任何适当的信号可以被使用,适当的信号的许多实例将是本领域技术人员已知的并可获得的。优选的信号是可以在电磁光谱中检测的那些,诸如发色团和荧光团、和酶底物系统诸如辣根过氧化物酶/TMB。其他将是本领域技术人员已知的。在后者的情况下,对该配体特异性的结合成员可以与酶结合,所述酶催化信号底物以产生比色输出(colorimetricoutput)。优选的信号是采用扩增系统的那些。可以作用于底物以产生发色团的酶标签是最优选的,例如,辣根过氧化物酶、碱性磷酸酶、β半乳糖苷酶。适当的底物包括TMBABTS、OPD(对于HRP)、pNPP(对于AP)和ONPG(对于β半乳糖苷酶)。生成的信号提供跨膜蛋白与基底结合的程度(即底物的饱和程度)和锚定于其的任何肽或蛋白是否变性、和可用于配体结合的指示。饱和的意指,最大量的蛋白结合至基底,即基底被完全占据。因此,本发明的方法提供了包含固定于其上的跨膜蛋白的聚合物基底,其中所述跨膜蛋白通过物理吸附被固定于所述基底上,并且其中所述跨膜蛋白锚定、或被修饰以锚定用于展示的异源蛋白或肽。“固定的”意指,蛋白被结合至基底并在用包含除垢剂的水和/或缓冲液(例如以0.05%(w/v)的Tween20)洗涤后保持结合。跨膜蛋白可以在基底上均匀地或以预定的图案,例如点状的提供。本发明还可以包括使表面具有图案的方法,所述方法包括应用本发明的跨膜蛋白至具有图案的基底。优选地,所述图案是预定的。使表面具有图案的适当的方法包括平版印刷术、喷墨、液滴注射(dropletinjection)或本领域技术人员已知的其他方法。物理吸附是化合物通过非共价结合,例如范德瓦尔斯相互作用、疏水相互作用、电荷相互作用,物理吸附至表面。物理吸附不是蛋白和基底之间的化学反应并且是非共价结合。本发明的发明人已经示出了,出乎预料地,跨膜蛋白可以通过物理吸附结合至聚合物基底,并且能够展示锚定的肽或蛋白。因此,本发明的方法使得跨膜蛋白能够被固定在聚合物基底上并充当展示可以具有功能并被定向用于展示的肽和/或蛋白的锚。跨膜蛋白与基底的这种结合及其作为以有功能的和定向的方式展示的肽和/或蛋白的锚的有效性意味着,聚合物基底在结合测定以及其他方法学中具有效用。因此,本发明第一次提供了具有固定于其上的跨膜蛋白的基底,其中所述跨膜蛋白锚定、或被修饰以锚定用于展示的异源蛋白或肽。“锚”意指跨膜蛋白可以在该蛋白的头的环中包含异源肽和/或蛋白,和/或在该蛋白的头的N端和/或C端包含异源肽和/或蛋白。因此,跨膜蛋白结合至或融合至肽或蛋白,所述肽或蛋白在该跨膜蛋白的头被展示。因此,跨膜蛋白和肽和/或蛋白可以被表达为单个多肽链。被修饰以锚定意指,跨膜蛋白被工程化以在该蛋白的头包含N端和/或C端,和/或在该蛋白的头包含一个或更多个环,以使其在固定于基底上时能够展示肽或蛋白。因此,肽或蛋白可以在该蛋白的头展示。修饰使得待被锚定的蛋白或肽空间上远离该基底的表面,并且优选地,不被跨膜蛋白或表面空间上阻碍。因此,锚定的肽或蛋白可以是有功能的,并且可用于结合或其他相互作用。工程化以在蛋白的头提供N端和/或C端可以通过环状排列实现。此环状排列意指,蛋白的特征的顺序被改变,对该蛋白的整体三级结构无实质的影响。这可以通过使用本领域可获得的技术工程化跨膜蛋白的一级结构实现。因此,跨膜蛋白可以被工程化以使N端和/或C端从蛋白的头而非足延伸。端可以被工程化以代替环提供、或邻近环提供、从环内提供。在一个实施方案中,N端或C端被工程化以从环延伸。这可以通过将环工程化以包括N端和/或C端实现。优选地,当N端和C端二者都被排列,它们可以被工程化以在相同的环中提供。因此,环的部分可以形成N端且环的部分可以形成C端。在此类情况中,环被分割,形成两个结构域而非一个环结构。因此,环的全部或部分可以被N端和/或C端代替。当蛋白是OMP时,环可以是环1、3或4。当固定于基底上时,工程化的端从基底的表面延伸离开,提供用于蛋白或肽的有效的展示位点。间隔物也可以在一个或两个端的末端上提供,以进一步协助锚定于其的肽或蛋白的展示。在一个实施方案中,环或N端或C端可以包含间隔物序列,所述间隔物序列用于将与其连接的肽或蛋白与基底空间上分开。异源肽和/或蛋白被跨膜蛋白锚定用于展示。这意味着,在跨膜蛋白中提供一个位置,使得当固定于基底上时,肽和/或蛋白与基底的结合表面空间上分开,并且如此是可用于感兴趣的组分接近的(例如,在结合反应中)。优选地,锚定用于展示意指,它空间上与可以防止它与感兴趣的组分相互作用的跨膜蛋白的空间阻碍分开。异源肽或蛋白的展示可以使用如本文描述的检测测定确定。锚定的蛋白优选地保持任何二级结构,从而使其能够保持功能。“保持其二级结构”意指,基本上所有锚定的蛋白(即,结合的蛋白的至少70%、75%、80%、85%、90%、95%、96%、97%、98%或99%)具有其天然的二级结构。蛋白的天然的二级结构是在非变性条件下的折叠结构。尽管设想,蛋白的一些变性可以在结合后发生,蛋白的整体二级结构与天然二级结构是基本上相同的,并且任何变性对蛋白的整体折叠或其结合配体的能力不具有显著的作用。本文中,二级结构也可以被称为构象。当异源肽被插入到跨膜蛋白的环中时,它优选地在跨膜链之间的长环中提供。它优选地向着环的中部提供。环可以在肽序列的插入前被截短。除了肽序列的插入以外,环可以被延长,例如通过间隔物。可选择地,肽序列可以被引至天然的环中,这样环与其天然形式相比被延长。经修饰的环可以比天然环更长或更短。当插入至环中时,异源肽可以是任何适当的长度,但优选是足够短以至于不能采取可以影响跨膜蛋白的二级结构的二级结构。例如,适当的长度可以是从3至70个氨基酸。异源肽序列可以在N端、C端或二者中提供。异源序列(肽或蛋白)可以在端的末端独立地提供,或在形成端的序列内提供。优选地,它在N端提供,优选地在N端的末端提供。端可以如本文描述的被工程化以提供肽或蛋白的锚定(展示)位点。有功能的意指,肽和/或蛋白保持它的天然功能的一个或更多个,例如结合功能、受体功能、信号传导功能或酶促功能。跨膜蛋白包含头和足,所述头和足被包含一个或更多个跨膜链的主体彼此隔开。“锚”意指跨膜蛋白可以在该蛋白的头的环中包含异源肽和/或蛋白,和/或在该蛋白的头的N端和/或C端包含异源肽和/或蛋白。“修饰以锚定”意指跨膜蛋白被工程化以在该蛋白的头包含N端和/或C端,和/或在该蛋白的头包含一个或更多个环。异源肽和/或蛋白可以在蛋白的头的工程化N端和/或C端提供,或在蛋白的头的工程化环中提供,用于展示。因此,跨膜蛋白可以:i)在所述蛋白的头的环中包含异源肽和/或蛋白;ii)在所述蛋白的头的N端和/或C端包含异源肽和/或蛋白;iii)被工程化以在所述蛋白的头包含N端和/或C端;和/或iv)被工程化以在所述蛋白的头包含一个或更多个环。异源肽和/或蛋白可以在蛋白的头的工程化N端和/或C端提供,或在蛋白的头的工程化环中提供,用于展示。异源肽可以是任何肽序列,优选地有功能的肽序列。肽序列可以由以下组成、可以源自以下或可以充当以下:生长因子、参与蛋白-蛋白相互作用或结合的蛋白或肽、抗体结合基序、表位、抗原、过敏原、酶、催化剂、参与与DNA和/或碳水化合物相互作用或结合的蛋白或肽;参与与小分子(药物等)相互作用或结合、细胞结合或细胞信号传导的蛋白或肽;细胞外基质蛋白;以及实际上出于任何目的可以被期望在聚合物基底上展示的任何其他蛋白或肽。用于在本发明中使用的肽和蛋白的具体实例包括蛋白的结合位点,例如FLAG表位(DYKDDDDK);生长因子诸如FGF1或FGF2、白介素、血小板生成素(TPO)、干细胞因子(SCF)、粒细胞巨噬细胞集落刺激因子(GMCSF)、白细胞抑制因子(LIF)、sonichedgehog(Shh);细胞结合基序例如膜外基质蛋白诸如整联蛋白、胶原蛋白、层粘连蛋白或纤连蛋白(例如,如表3中描述)的结合基序;细胞外基质(ECM)蛋白基序,例如RGDS、抗原(例如HIV(例如)p24抗原、BMP-2、玻连蛋白、骨桥蛋白、生腱蛋白-C)以及实际上本领域技术人员已知的任何其他肽和蛋白。肽序列可以包含两个或更多个此类肽序列的任何组合。优选地,肽或蛋白可以是生长因子。肽或蛋白可以是任何生长因子。优选的生长因子是FGF1或FGF2。在一个实施方案中,生长因子可以被锚定至融合蛋白,优选地直接锚定至跨膜蛋白的N端或C端。优选地,间隔物可以在跨膜蛋白和生长因子之间提供。间隔物的提供使得生长因子和跨膜蛋白能够在表达后独立地重新折叠。另外,生长因子与跨膜蛋白的空间分离使得生长因子能够在聚合物表面上方延伸并且具有生长因子的功能,不被跨膜蛋白空间上阻碍。在聚合物表面提供生长因子在细胞培养技术中具有特定应用,例如以促进细胞生长和/或分化。间隔物序列与异源肽和/或蛋白的组合使用通过使肽或蛋白定向离开聚合物基底来改进肽或蛋白的展示。间隔物的提供还可以使得异源蛋白和跨膜蛋白能够在表达后独立地重新折叠,从而增加获得被锚定至跨膜蛋白的有功能的异源肽或蛋白的可能性。由间隔物提供的空间分开使得异源肽或蛋白能够在聚合物表面上方延伸并且是有功能的,不被基底或跨膜蛋白空间上阻碍。间隔物可以在环中和/或在N端和/或C端的末端提供。间隔物可以继而融合至肽或蛋白,例如用于结合。因此,N端和/或C端可以被用于展示更大的序列,因为不太可能施加对二级结构的作用的相同限制。间隔物可以是与跨膜蛋白和/或与该肽和/或蛋白异源的。间隔物可以是锚定至N端或C端,优选N端的游离末端的一个末端的α螺旋序列。间隔物可以在环中提供,优选地邻近异源肽或蛋白。间隔物可以是亲水的、刚性的或半刚性的。间隔物可以包含任何适当的一级序列或二级序列,但优选地缺乏功能诸如信号传导、结合或其他功能。优选的间隔物可以包含α螺旋或PT接头,例如如Poon等人,JBiolChem282:2091-20112006中描述的,或甘氨酸-丝氨酸间隔物接头,例如PL刚性(PLrigid)、2aaGS接头、6aa[GS]x接头、10aa[GS]x接头、10aa柔性的蛋白结构域接头、8aa蛋白结构域接头、Split荧光团接头;Freiburg标准、15aa柔性的甘氨酸-丝氨酸蛋白结构域接头;Freiburg标准、短接头(Gly-Gly-Ser-Gly)、中接头(Gly-Gly-Ser-Gly)x2、长接头(Gly-Gly-Ser-Gly)x3、GSAT接头、SEG、SEG-接头、GSAT-接头、Z-EGFR-1907短接头、Z-EGFR-1907中接头、Z-EGFR-1907长接头、Z-EGFR-1907_SEG-接头、(Gly4Ser)3柔性的肽接头、短融合蛋白接头:具有标准25前缀/后缀的GGSG、具有标准25前缀/后缀的长10AA融合蛋白接头、中6AA融合蛋白接头:具有标准25前缀/后缀的GGSGGS。(http://parts.igem.org/Protein_domains/Linker)。α螺旋序列可以被提供用于融合至异源肽或蛋白,例如如图12的OMP173中所示的。本发明具有以下优势:跨膜蛋白结合至基底的方式使得,结合配偶体能够与在N端和/或C端或环中提供的异源蛋白或肽结合。这与现有技术的方法不同,现有技术的方法中蛋白通常以杂乱无章的方式结合至基底,或需要另外的试剂将蛋白保持在适当位置(例如,脂单层),使得结合成为可能。令人惊讶的是,在本发明中,基本上所有锚定的肽和/或蛋白都以使其能够被展示用于结合或相互作用的方式定向。因此,在本发明中,锚定的肽和/或蛋白的至少70%、75%、80%、85%、90%、95%、96%、97%、98%或99%被定向远离聚合物基底表面,并且被展示用于结合或相互作用。如本文描述的,这可以使用结合测定或本领域可获得的其他技术确定,例如如本文描述的关于结合至基底的确认。跨膜蛋白的N端和/或C端可以被修饰。例如,N端或C端的一个或两者可以被截短,例如以增加疏水性,或以引入如以上描述的异源序列。可以进行对跨膜蛋白基础结构的其他修饰以改善结合性质。这些包括:缺失不与膜整合的大的内部结构域或外部结构域;截短一个或更多个环以降低桶的亲水性;延长一个或更多个环,例如用亲水间隔物以允许蛋白在环上插入和展示;环状排列以改变N端和/或C端的空间定位;引入纯化标签(例如his标签、FLAG标签和其他)。N端或C端的一个或两个可以被修饰以包括一个或更多个氨基酸缺失、置换或插入,以改变其结构和/或功能性质。如本文描述的,跨膜蛋白的一个或更多个环可以被工程化。增加蛋白的疏水性可能是理想的,例如通过截短该蛋白的一个或更多个环(通常是亲水的)。这可以用来增强蛋白与疏水基底的结合,不需要塑料表面的官能化或蛋白的修饰以引入结合部分诸如用于与基底共价结合的特定氨基酸。跨膜蛋白的一个或更多个长的、亲水环的缩短还具有在测定中降低来自血清或其他基质蛋白的非特异性结合的优势。蛋白的疏水性是蛋白聚集和排斥水的倾向的量度。蛋白的疏水性是存在于一级结构中的氨基酸的因子,但也是二级结构的因子。因此,蛋白的不同部分可以是疏水的或亲水的。存在用于分类氨基酸残基的疏水性的多种方法,包括色谱法、可及表面面积法、分配法。该值可以被称为亲水指数。可以使用亲水性图或X射线结构分析来预测沿着氨基酸序列的长度的疏水性。量表是基于20种氨基酸的疏水性质和亲水性质。从5至20个氨基酸的移动的“窗”决定序列(Y坐标)中每个点的总亲水性。然后将这些和对它们的各自位置(X坐标)作图(Kyte和DoolittleJolMol.Bio.(1982)157105-132)。在其中期望改变跨膜蛋白的疏水性,例如以协助蛋白与聚合物基底的结合的实施方案中,亲水性图可以在任何修饰之前和之后预测环的疏水性中有用,以确定建议的修饰是否导致疏水性的期望的改变。在实施方案中,例如,增加蛋白的疏水性可能是理想的,例如通过截短该蛋白的一个或更多个环(通常是亲水的)。用于在本发明中使用的跨膜蛋白是包含至少一个环并因此跨过膜至少两次的那些。用于在本发明中使用的跨膜蛋白可以包含两个或更多个环。跨膜蛋白的每个环的长度和结构可以与该蛋白的一个或更多个其他环不同。当需要修饰蛋白时,任何一个或更多个环可以如本文所述地被截短,例如以增加蛋白的疏水性,并使得能够将固定定向于疏水基底。被截短的环的数量将取决于蛋白和环导致的亲水性期望被降低的程度。这可以是任何具体环的具体序列和长度的因子。使用一级序列分析和任选的方法诸如X射线晶体学和亲水性绘图,技术人员可以评估环和经修饰的跨膜蛋白的预测的亲水性质/疏水性质以确定待被截短的合适的环和截短多少个氨基酸。方法是本领域用于确定疏水性可获得的,包括溶剂相分配、RPLC、TLC。优选的方法包括X射线结构和预测的亲水性图(Kyte和Doolittle)的分析以决定何时将蛋白工程化。待被截短的环的数量可以由数量定义,基于C端位于周质侧的蛋白的天然构型。在2次或3次或更多次通过蛋白中,1个或更多个环可以被截短。在一个优选的实施方案中,除一个环以外的全部环可以被截短。本文中环的编号是基于在胞质溶胶侧的天然C端。“截短的”意指,与其天然形式相比,该环的长度减少。长度的减少通过从环缺失一个或更多个氨基酸残基实现。环被截短的程度将取决于因素诸如通过修饰蛋白将实现的疏水性的程度和缺失对该蛋白的三级结构的影响。因此,“截短”意指,环的全部或部分可以被去除。优选地,根据本发明的经修饰的跨膜蛋白保持其天然三级结构。因此,当跨膜蛋白是β-桶蛋白时,经修饰的蛋白优选地保持β-桶三级确认。因此,优选地,与其天然形式相比,缩短或去除一个或更多个环不显著影响蛋白的最终三级结构。蛋白中的每个环可以与蛋白中的一个或更多个其他环不同地修饰,或以与蛋白中的一个或更多个其他环相同的方式修饰。优选地,环被截短至使其能够不受限制地且优选地不改变蛋白的三级结构地连接跨膜链的长度。优选地,环被截短,使得它不延伸至膜外的水相。如本文描述的跨膜蛋白的一个或更多个环的截短帮助增加蛋白的疏水性,并且还帮助降低与蛋白的非特异性结合。在除垢剂的存在下,蛋白能够与疏水基底结合。因此,蛋白被直接地固定于聚合物基底,不需要标签、官能化或接头序列。优选地,头被定向远离聚合物基底,并且这样头可以用于结合,例如在筛选测定中。优选地,当被固定至基底时,蛋白保持其二级结构和三级结构,并且优选地被正确地定向用于展示结合位点。优选地,蛋白是有功能的。优选地,蛋白被定向用于并且能够结合至分析物或配体。优选地,蛋白在基底表面非-无序地组织,使得多个蛋白以基本上相同的方式定向。优选地,蛋白被定位在基底上,使得任何有功能的位点,诸如结合位点被暴露,优选地指向溶液/反应表面。保留在经修饰的跨膜蛋白中的环可以被修饰以包括亲水残基,所述修饰是通过插入或置换。在环中引入亲水残基的目的是从疏水基底产生排斥,和放置环和它的活性内容在表面上方使得它可被接近。此类亲水残基可以是间隔物肽或其以外的部分。蛋白可以被修饰以包括标签,例如聚组氨酸标签。聚组氨酸标签可以包含6个或更多个组氨酸残基。本文中该标签可以被称为His6标签、6xhis标签或hexa-his标签。其他适当的标签包括FLAG、c-myc或其他小亲和标签。标签可以在C端或N端提供。端可以如本文描述地修饰。标签可以在截短的C端或N端提供。蛋白可以被修饰以去除一个或更多个天然半胱氨酸残基,特别是在与聚合物基底接触的蛋白的那些部分中。因此,一个或更多个环可以被修饰以去除(通过缺失或置换)一个或更多个天然半胱氨酸残基。这样的修饰对于待结合至塑料基底且不要求表现结合至塑料和其他基底诸如金的双官能的蛋白可以是合适的。除了以上描述的修饰,跨膜蛋白可以被修饰以包括一个或数个氨基酸的一个或更多个保守置换而不显著地改变该蛋白的生物学活性和/或三级结构。本领域技术人员将清楚进行此类氨基酸置换的方法。OmpA是8次通过蛋白,意味着,它包含形成桶形且各自跨过膜的8条β链。在一个实施方案中,OmpA可以被修饰以包含3个被截短的细胞外环。优选地,每个环被截短至转角的长度,优选4个氨基酸的β转角的长度。在一个实施方案中,4个细胞外环中的3个被截短。环1被保留并用PT接头和亲水氨基酸修饰(参见图14)。在一个实施方案中,保留的环被延长。优选地,细胞外环通过引入亲水残基被延长。优选地,环通过引入肽间隔物序列和/或亲水残基被延长。此蛋白在本文中被称为OMP154。OMP154的变体在表3中描述。经修饰的跨膜蛋白可以在细胞外环1中包含FLAG表位(DYKDDDDK)。在本文中以此方式修饰的OmpA被称为OMP5。经修饰的跨膜蛋白可以在细胞外环1中包含来自层粘连蛋白的YIGSR基序。在本文中此蛋白被称为OMP36。经修饰的跨膜蛋白可以包含:i)被截短的所有细胞外环,优选地每个细胞外环被截短至β转角的长度;ii)位于蛋白的细胞外末端(头)的N端和C端;iii)被修饰以包括α螺旋间隔物序列的N端;iv)半胱氨酸残基,以使蛋白能够结合至金表面。此蛋白能够结合至金和塑料基底。优选地,蛋白骨架是环状排列的OmpA的β桶(图14)。优选地,α螺旋间隔物是不与IgG结合的金黄色葡萄球菌蛋白AB结构域的突变形式(其序列在Kim等人.(2010)JournalofexperimentalmedicineVol.207p1863-1870中公开)。在本文中此蛋白被称为OMP171。在本文中缺乏α螺旋间隔物的版本被称为OMP171。提供这样的跨膜蛋白的经修饰的版本,其中蛋白融合至间隔物。在一个实施方案中,蛋白是HIV抗原p24,并且本文中该蛋白被称为OMP173。在一个实施方案中,经修饰的跨膜蛋白包含i)被截短的所有细胞外环,优选地每个细胞外环被截短至β转角的长度;ii)位于蛋白的细胞外末端(头)的N端和C端;iii)被修饰以包括α螺旋间隔物序列的N端;iv)在C端提供的His标签,v)蛋白不含半胱氨酸残基。这些修饰允许包含多个半胱氨酸残基的大生长因子的融合并帮助确保只有全长表达的蛋白包含His标签。优选地,蛋白骨架是环状排列的OmpA的β桶。在本文中此蛋白被称为OMP140。OMP140的变体在表4中描述。OMP90和OMP128在OMP59支架中包含FGF1和FGF2(OMP59是具有α螺旋间隔物的OMP9,在图11中示出)。在一个实施方案中,经修饰的跨膜蛋白包含i)位于蛋白的细胞外末端的N端和C端;iii)被截短并融合至金黄色葡萄球菌的蛋白A的IgG结合结构域的N端。这些修饰允许蛋白融合至该蛋白的抗体的Fc区域。本文中此蛋白被称为OMP18。在本发明的一个方面中,提供了一种跨膜蛋白,所述跨膜蛋白锚定、或被修饰以锚定用于展示的异源蛋白或肽。跨膜蛋白包含头和足,所述头和足被一个或更多个跨膜链彼此隔开。“锚”意指,跨膜蛋白可以在该蛋白的头的环中包含异源肽和/或蛋白,和/或在该蛋白的头的N端和/或C端包含异源肽和/或蛋白。“修饰以锚定”意指,跨膜蛋白被工程化以在该蛋白的头包含N端和/或C端,和/或在该蛋白的头包含一个或更多个环。优选地,跨膜蛋白:i)在所述蛋白的头的环中包含异源肽和/或蛋白;ii)在所述蛋白的头的N端和/或C端包含异源肽和/或蛋白;iii)被工程化以在所述蛋白的头包含N端和/或C端;和/或iv)被工程化以在所述蛋白的头包含一个或更多个环。异源肽和/或蛋白可以在蛋白的头的工程化N端和/或C端提供,或在蛋白的头的工程化环中提供,用于展示。优选地,跨膜蛋白包含异源肽和/或蛋白。本发明包括本发明的跨膜蛋白的变体跨膜蛋白。优选地,变体蛋白可以在一级序列中不同,但保持与本发明的经修饰的跨膜蛋白基本相同的二级结构和三级结构。基本相同意指,蛋白在适当的窗(例如10至500个氨基酸)内共享至少40%、优选地50%、60%、70%、80%、90%、95%、96%、97%、98%或99%序列同一性。肽或蛋白序列同一性可以通过本领域可获得的方法确定,例如使用bl2seq中的BLASTP(来自BLAST程序套件,版本2.2.5[Nov2002]),其可以从NCBI公开地获得(ftp://ftp.ncbi.nih.gov/blast/);EMBOSS-needle(可从http:/www.ebi.ac.uk/emboss/align/获得)和GAP(Huang,X.(1994)OnGlobalSequenceAlignment.ComputerApplicationsintheBiosciences10,227-235.);ClustalW(Thompson等人1994,NucleicAcidRes11(22)4673-4680。在一个优选的实施方案中,跨膜蛋白是如本文描述的。优选地,它是OmpA。对跨膜蛋白的修饰可以由任何适当的技术引入,许多适当的技术将是本领域技术人员已知的。例如,重组DNA技术可以被用于向编码跨膜蛋白的核酸序列引入修饰,该核酸序列被表达为经修饰的跨膜蛋白。重组DNA技术在Sambrook(Sambrook,J.和Russell,D.W.(2001)Molecularcloning.ALaboratoryManual.CSHLPress)中提供。在本发明的一个方面中,提供了编码如本文描述的经修饰的跨膜蛋白的核酸序列。编码跨膜蛋白的核酸序列可以被工程化以提供如本文描述的经修饰的跨膜蛋白。OmpA由本领域称为OmpA、con、tolG和tut的基因编码。基因座的名称是b0957和JW0940。编码OmpA的核酸序列在大肠杆菌的基因组中公开(http://bmb.med.miami.edu/sources/1),在本文中在图14中公开。图14中示出的序列是野生型基因的工程化形式。编码细胞外环的序列被加下划线。细胞外环L1由核酸85-126编码;L2由核酸214-249编码;L3由核酸346-387编码;L4由核酸466-507编码。C端脯氨酸由核酸589-591编码。N端甲硫氨酸由核酸1-3编码。环之间的序列编码跨膜蛋白β链,如表1中所示。OmpF(也被称为TOLF或CMLB或COA或CRY或B0929)也可以在本发明中使用。本发明包括编码本发明的跨膜蛋白的变体核酸序列。变体或功能等价序列与编码本发明的跨膜蛋白的序列的序列同一性通过以下确定:在预定的比较窗口比较两个对齐的序列或其片段,并确定相同残基发生的位置的数量。比较窗口可以包含序列的全部或部分,例如窗口包含10、20、30、40、50、100、200、500或1000个或更多个核苷酸。通常,序列同一性被表示为百分比。核苷酸序列的序列同一性的测量是本领域技术人员公知的方法,使用计算机实现的数学算法诸如ALIGN(版本2.0)、GAP、BESTFIT、BLAST(Altschul等人J.Mol.Biol.215:403(1990))、FASTA和TFASTA(WisconsinGeneticSoftwarePackageVersion8,可从GeneticsComputerGroup,AccelrysInc.SanDiego,California获得)和CLUSTAL(Higgins等人,Gene73:237-244(1998)),使用默认参数。优选地,核酸分子在遗传构建体中提供,遗传构建体可以被用于例如在宿主细胞中表达本发明的经修饰的跨膜蛋白。优选地,核酸分子被可操作地连接至调控元件,调控元件是调控与其可操作地连接的编码序列的表达(即转录或翻译)的任何核酸序列。调控序列包括启动子、增强子、转录终止子、起始密码子、剪接信号,包括受体和供体剪接位点、终止密码子、琥珀密码子(ambercodon)或赭石密码子(ochrecodon)、转录因子结合位点、核糖体结合位点、IRES、和靶向序列诸如细胞区室化信号(例如至细胞溶胶、核、质膜、内质网、线粒体、叶绿体、溶酶体、内体或高尔基体)和/或分泌信号。其他调控序列可以是本领域技术人员已知的。本发明的遗传构建体可以包括任何一个或更多个(2个、3个、4个、5个、6个等)调控序列。一个或更多个调控元件可以在5’UTR中提供。另外,还可以提供3’UTR。关于本发明的启动子可以被定义为指导核酸转录的控制序列。启动子包括转录起始位点附近的必要的核酸序列,诸如,在聚合酶II型启动子的情况下,TATA元件。启动子可以任选地包括可以位于距离转录的起始位点最多达数千碱基对的远端增强子或阻遏物元件。组成型启动子和诱导型启动子都可以被包括用于在本发明中使用。任何组成型启动子或诱导型启动子可以被使用。用于大肠杆菌中的异源基因表达的启动子的常见实例为tac、trp、lac、T7、araomp、λ噬菌体;但任何启动子可以被用于表达这些融合蛋白。与诱导型启动子不同,组成型启动子在多数环境条件下起作用。许多不同的组成型启动子可以关于此公开内容的方法使用。用于在本发明中使用的优选的启动子包括T7、ara和tac。本发明的核酸分子可以可操作地连接至选择标记。当在遗传构建体中提供核酸分子时,该构建体可以包含选择标记。在实施方案中,选择标记可以可操作地连接至核酸分子。可选择地,选择标记可以与核酸分子独立地被控制,例如在单独的启动子和/或其他调控元件的控制下。适当的选择标记将是本领域技术人员公知的,并且可以包括在表达后提供可检测的表型的任何核酸序列。通常,表达的多肽是在细胞内可检测的,优选地不会不利地影响细胞。例如,选择标记可以是绿色荧光蛋白或酶,诸如当与适当的试剂接触时生成信号的荧光素酶。其他选择标记包括赋予细胞在某些条件中生长的选择能力的那些,所述某些条件例如缺乏具体的营养物,或在原本将对细胞有害的试剂的存在下。用于在本发明中使用的优选的选择标记包括氨苄青霉素、氯霉素、卡那霉素和四环素抗性,但其他选择标记将是本领域技术人员已知且可获得的。用于在本发明中使用的适当的遗传构建体包括载体,包括例如病毒载体、质粒(环状的或线性的)、噬菌粒(phagemid)、线性DNA。用于在本发明中使用的优选的遗传构建体包括携带用于Omp融合蛋白的过表达的诱导型启动子的质粒。载体可以包括一个或更多个选择标记(如本文定义的)、一个或更多个克隆位点,例如以允许与天然核酸的同源重组、一个或更多个如本文定义的调控元件和一个或更多个复制起始点。当期望时,两个或更多个如本文定义的核酸分子可以在单个载体中提供。这些可以在单独的调控控制下,或被可操作地连接至相同的调控元件。如本文描述的核酸序列或遗传构建体可以在宿主细胞中提供用于本发明的经修饰的跨膜蛋白的表达。用于重组蛋白表达的适当的宿主细胞包括真核细胞或原核细胞,优选后者。适当的宿主细胞将是本领域技术人员已知且可获得的,并且包括例如大肠杆菌、BL21、BL21AI、BLR和Rosetta-2。还可以提供包含如本文所述的遗传构建体的宿主细胞。宿主细胞可以是重组体。本发明提供了结合样品中的组分的方法,所述方法包括:i)提供包含固定于其上的跨膜蛋白的聚合物基底,其中所述跨膜蛋白通过物理吸附被固定于所述基底上,并且其中所述跨膜蛋白锚定用于展示的异源蛋白或肽;ii)向所述基底添加样品;iii)将所述基底与样品保持在允许任何组分结合至所述基底的条件下。优选地,在向基底添加样品后,基底可以被孵育适当的时间段以允许任何分析物结合至基底。孵育期可以根据测定和样品类型变化,但通常可以从5分钟至24小时,更优选地10min至1h,取决于被执行的测定。本发明的方法可以是筛选测定,以检测样品中感兴趣的组分的存在或不存在。在此类测定中,在检测之前,为使测定的准确性最大化,方法可以包括洗涤基底以去除任何未结合的材料的步骤。洗涤可以用任何适当的缓冲液、水或包含除垢剂或乙醇的溶液执行,例如TBS、PBS、HEPES、TE、70%乙醇、Tween或去离子水,优选地无菌的。结合的组分的检测可以使用本领域任何适当的方法执行,例如使用对该分析物特异性的结合配偶体的结合测定。在典型的结合测定中,基底可以与对该分析物特异性的结合配偶体(例如,IgG)一起孵育。然后结合的分析物可以被直接地检测,例如如果该分析物包含可以被测量的信号,或被间接地检测,例如通过使用对第一结合配偶体特异性的第二结合配偶体。第二结合配偶体可以是缀合至酶或催化剂或其他标记物诸如荧光标签的抗体,并且检测可以通过与底物孵育并测量产生的信号的量来执行。任何适当的信号可以被使用,适当的信号的许多实例是本领域技术人员已知的并可获得的。优选的信号是可以在电磁光谱中检测的那些,诸如发色团和荧光团,且酶底物系统诸如辣根过氧化物酶/TMB。其他将是本领域技术人员已知的。在后者的情况下,该配体特异性的结合成员可以与酶结合,所述酶催化信号底物以产生比色输出(colorimetricoutput)。优选的信号是采用扩增系统的那些。可以作用于底物以产生发色团的酶标签是最优选的,例如,辣根过氧化物酶、碱性磷酸酶、β半乳糖苷酶。适当的底物包括TMBABTS、OPD(对于HRP)、pNPP(对于AP)和ONPG(对于β半乳糖苷酶)。色度输出可以视觉上测量,或通过测量光的吸光度的变化定量地测量。方法可以还包括比较生成的信号与标准表,以基于信号获得分析物的量的定量值。样品可以源自人或动物体(例如唾液、全血、血浆、尿液、精液、粪便等)或可以是细胞裂解物或来自生产过程的粗提物。组分可以是任何部分,优选地是能够被结合配偶体结合的部分。配体的非限制性选择包括核酸、抗原、抗体、寡核苷酸、激素、半抗原、激素受体、维生素、类固醇、代谢物、适配体、糖、肽、多肽、蛋白、糖蛋白、细胞、生物体(诸如真菌、细菌、病毒、原生动物和多细胞寄生物)、治疗药物或非治疗药物、或其任何组合或片段。优选地,组分可以是免疫活性蛋白或多肽,诸如抗原性多肽或蛋白。方法还可以被用于从样品纯化感兴趣的组分。这样的方法可以如以上关于筛选方法描述的,其中任何结合的组分而不是检测组分可以从基底洗脱。任何结合的产品可以使用本领域已知的方法从基底被洗脱,所述方法例如盐洗脱、由pH改变洗脱、由竞争物结合洗脱。方法还可以被用于固定来自样品的感兴趣的组分,例如用于进一步反应,例如如本文描述的。例如,肽和/或蛋白可以包含Fc结合结构域(例如来自蛋白A、G或L),其可以用来固定展示Fc结构域的组分(例如,加Fc标签的重组蛋白)。此类固定化可以在例如结合测定、细胞培养等中具有多种用途。方法可以包括在聚合物基底上固定跨膜蛋白,如本文所述。优选地,聚合物基底包含固定于其上的跨膜蛋白,其中所述跨膜蛋白通过物理吸附被固定于所述基底上,并且其中所述跨膜蛋白包含异源肽和/或蛋白。跨膜蛋白包含头和足,所述头和足被一个或更多个跨膜链彼此隔开。“锚”意指,跨膜蛋白可以在该蛋白的头的环中包含异源肽和/或蛋白,和/或在该蛋白的头的N端和/或C端包含异源肽和/或蛋白。“修饰以锚定”意指,跨膜蛋白被工程化以在该蛋白的头包含N端和/或C端,和/或在该蛋白的头包含一个或更多个环。因此,跨膜蛋白可以:i)在所述蛋白的头的环中包含异源肽和/或蛋白;ii)在所述蛋白的头的N端和/或C端包含异源肽和/或蛋白;iii)被工程化以在所述蛋白的头包含N端和/或C端;和/或iv)被工程化以在所述蛋白的头包含一个或更多个环。异源肽和/或蛋白可以在蛋白的头的工程化N端和/或C端提供,或在蛋白的头的工程化环中提供,用于展示。本发明还提供了介导锚定的肽和/或蛋白与样品中的组分相互作用的方法,所述方法包括:i)提供包含固定于其上的跨膜蛋白的聚合物基底,其中所述跨膜蛋白通过物理吸附被固定于所述基底上,并且其中所述跨膜蛋白锚定用于展示的异源蛋白或肽;ii)向所述基底添加包含组分的样品;iii)将所述基底与样品保持在允许所述组分与锚定的肽和/或蛋白相互作用的条件下。优选地,所述方法包括提供包含固定于其上的跨膜蛋白的聚合物基底,如本文描述的。样品可以源自人或动物体(例如唾液、全血、血浆、尿液、精液、粪便等)或可以是细胞裂解物或来自生产过程的粗提物,或可以是反应混合物的细胞培养物。组分可以是能够与锚定的肽或蛋白相互作用的组分。它可以是任何部分,包括例如核酸、抗原、抗体、寡核苷酸、激素、半抗原、激素受体、维生素、类固醇、代谢物、适配体、糖、肽、多肽、蛋白、糖蛋白、细胞、生物体(诸如真菌、细菌、病毒、原生动物和多细胞寄生物)、治疗药物或非治疗药物、或其任何组合或片段。组分可以是免疫活性蛋白或多肽,诸如抗原性多肽或蛋白。优选地,组分是细胞。细胞可以是原核细胞,例如真菌细胞或细菌细胞,或真核细胞,例如哺乳动物细胞,优选人细胞。优选地,在向基底加入样品后,基底可以被孵育适当的时间段以允许肽和/或蛋白与样品的组分的任何反应。孵育期可以根据测定和样品类型变化,但通常可以从5分钟至24小时,更优选地10min至1h,取决于被执行的测定。当组分是细胞时,测定可以在提供与细胞培养物的细胞反应中有用,例如例如提供指示细胞生长、分裂和/或分化,或表达特定特征或功能的肽或蛋白。例如,蛋白可以是当基底与细胞培养物孵育时,与细胞表面上的受体相互作用的生长因子。可选择地,肽可以包含ECM基序,其也可以与细胞表面上的受体相互作用,促进特定细胞特征或分化。用于在细胞结合测定中使用的经修饰的OMP蛋白的实例包括OMP153、154、162-165、167、174-179和180-192(表3和表4)。使用表面包被的基底促进细胞生长和/或分化的方法和细胞培养的方法是本领域已知的,并且它们的教导可以容易地应用至在促进细胞生长和/或分化的细胞培养的方法中使用本发明的基底(参见例如Helgason和Miller(Eds.)(2004)Basiccellcultureprotocols,HumanaPress,ISBN1588292843)。用于在本发明的方法中使用的细胞可以是真核细胞或原核细胞。细胞可以是昆虫细胞、酵母、细菌、植物细胞、藻类和动物细胞,优选哺乳动物细胞。它可以是细胞系。动物和哺乳动物细胞成纤维细胞、干细胞、诱导的多能干细胞、神经元细胞、肝细胞、肌细胞、造血细胞、上皮细胞、原代细胞、转化细胞系。方法还可以在酶测定中有用,例如当肽和/或蛋白编码酶或催化剂时。与样品孵育后,锚定的酶或催化剂与样品中的组分反应以提供反应产物。方法可以包括从基底去除样品和纯化来自其的任何反应产物,或检测反应产物的存在。方法可以被用于固定测定例如细胞培养测定中需要的肽或蛋白。如上所述,例如,肽和/或蛋白可以包含Fc结合结构域(例如来自蛋白A、G或L),其可以用来固定展示Fc结构域的组分(例如,加Fc标签的重组蛋白)。此类固定化可以在例如结合测定、细胞培养等中具有多种用途。本发明还提供了一种孵育物,所述孵育物包含聚合物基底、跨膜蛋白和浓度为1xCMC或低于1xCMC的除垢剂。优选地,跨膜蛋白、基底和除垢剂是如本文描述的。孵育物反映本发明的聚合物基底或产品的制造中的中间物,其中聚合物基底与如本文定义的跨膜蛋白一起孵育,其中孵育中的除垢剂浓度为1xCMC或低于1xCMC。聚合物基底可以是未结合的或与变得固定于其上的跨膜蛋白部分结合。在本发明的第九方面中,提供了一种试剂盒,所述试剂盒包含聚合物基底和跨膜蛋白,所述跨膜蛋白锚定、或被修饰以锚定用于展示的异源蛋白或肽。跨膜蛋白包含头和足,所述头和足被一个或更多个跨膜链彼此隔开。“锚”意指,跨膜蛋白可以在该蛋白的头的环中包含异源肽和/或蛋白,和/或在该蛋白的头的N端和/或C端包含异源肽和/或蛋白。“修饰以锚定”意指,跨膜蛋白被工程化以在该蛋白的头包含N端和/或C端,和/或在该蛋白的头包含一个或更多个环。因此,可以提供一种包含固定于其上的跨膜蛋白的聚合物基底,其中跨膜蛋白通过物理吸附被固定于聚合物基底上,并且其中所述跨膜蛋白:i)在所述蛋白的头的环中包含异源肽和/或蛋白;ii)在所述蛋白的头的N端和/或C端包含异源肽和/或蛋白;iii)被工程化以在所述蛋白的头包含N端和/或C端;和/或iv)被工程化以在所述蛋白的头包含一个或更多个环。异源肽和/或蛋白可以在蛋白的头的工程化N端和/或C端提供,或在蛋白的头的工程化环中提供,用于展示。试剂盒可以另外地包含提供使得跨膜蛋白能够物理吸附至聚合物基底的图表、稀释因子、稀释剂、缓冲液、基底、免疫球蛋白和结合试剂。试剂盒可以被包装用于供应和运输。试剂盒的各组分可以被单独地包装并作为实施本发明的方法的试剂的组合供应。本发明的方法还可以包括在聚合物基底上固定蛋白之前修饰如本文描述的跨膜蛋白的步骤。本发明的步骤还可以包括在塑料基底上固定经修饰的跨膜蛋白之前,修饰编码跨膜蛋白的核酸序列以提供如本文描述的经修饰的跨膜蛋白的步骤,和从宿主细胞表达蛋白的步骤。本发明还提供了一种产品,所述产品包括包含锚定、或被修饰以锚定用于展示的异源蛋白或肽的跨膜蛋白的聚合物基底。跨膜蛋白包含头和足,所述头和足被一个或更多个跨膜链彼此隔开。“锚”意指,跨膜蛋白可以在该蛋白的头的环中包含异源肽和/或蛋白,和/或在该蛋白的头的N端和/或C端包含异源肽和/或蛋白。“修饰以锚定”意指,跨膜蛋白被工程化以在该蛋白的头包含N端和/或C端,和/或在该蛋白的头包含一个或更多个环。因此,可以提供一种包含固定于其上的跨膜蛋白的聚合物基底,其中跨膜蛋白通过物理吸附被固定于聚合物基底上,并且其中所述跨膜蛋白:i)在所述蛋白的头的环中包含异源肽和/或蛋白;ii)在所述蛋白的头的N端和/或C端包含异源肽和/或蛋白;iii)被工程化以在所述蛋白的头包含N端和/或C端;和/或iv)被工程化以在所述蛋白的头包含一个或更多个环。异源肽和/或蛋白可以在蛋白的头的工程化N端和/或C端提供,或在蛋白的头的工程化环中提供,用于展示。产品可以包括微孔板、组织培养瓶或组织培养板、塑料珠、纤维、网状基底、医疗装置诸如外科植入物、聚合物的微米粒或纳米粒。提供了一种外科植入物,包括包含固定于其上的跨膜蛋白的聚合物基底,其中跨膜蛋白通过物理吸附固定于基底上,并且其中蛋白保持其天然二级结构。实施例为了研究我们的基于β-桶的蛋白与聚合物的结合和功能,我们采取以下方法;1.用于检测聚合物上的蛋白的免疫测定比较OMP18(融合至OmpA的SPA的两个IgG-结合B结构域)和天然金黄色葡萄球菌蛋白A(五个IgG-结合结构域)。在多种聚合物上检测加FLAG标签的OMP蛋白用特异性抗体检测融合至OMP支架的人HIVp24抗原并与天然抗原比较2.细胞培养比较与OMP0支架蛋白和包含ECM蛋白基序或在OMP支架上展示的生长因子的多种构建体的细胞附着。IgG与天然蛋白A或用β桶状支架锚定的蛋白A结构域的结合对于将有效作为第二独立蛋白的锚的任何支架,当蛋白被吸附至表面时,它必须增强该蛋白的功能。为了检查β桶状支架的此作用,使用一系列IgG-结合蛋白OMP18进行了实验,OMP18具有融合至OMP9支架的N末端的金黄色葡萄球菌蛋白A的IgG-结合B结构域的串联重复。OMP9在图1中示出,并且是金结合β桶状蛋白,包含全部细胞外环、用于金结合的半胱氨酸残基、环状排列的N端和C端和截短的N端,该截短的N端在OMP18中融合至金黄色葡萄球菌蛋白A的IgG-结合B-结构域的串联重复。此后一结构域结合至抗体的Fc区域,暴露抗原结合区域。OMP18可以以比吸附的或胺偶联的蛋白A更大的效力在金生物传感器表面捕获IgG抗体(未公开的数据)。为了检验这是否是经由OMP支架拴系至塑料的蛋白A结构域的情况,我们在图4中描述的免疫测定的类型中比较OMP18与蛋白A在聚苯乙烯表面上的固定化。在此情境下,我们设想,正确定向的蛋白将比不正确定向的蛋白或变性的蛋白结合更大量的抗体,从而获得来自免疫检测的更强的信号。OMP18和蛋白A与塑料孔板的蛋白吸附使用一个疏水的24孔板(Corning)和一个“亲水的”板(Corning)。OMP18(Lot15910BE16511LH)以70μg/mL(2μM)在PBS(磷酸盐缓冲盐水)+0.25%OG(正辛基葡萄糖苷)中且天然金黄色葡萄球菌蛋白A(SigmaCat.No.P7387;Lot055K09261)以84μg/mL(2μM)在PBS+0.25%OG中。向两个板的孔施加300μL蛋白溶液。仅用PBS+0.25%OG制备空白孔(无蛋白)。将板在室温(RT)在振荡平台(振荡器)上孵育过夜。将孔用每种蛋白包被,一式三份。免疫测定以在塑料上比较OMP18与天然蛋白A用Tris-缓冲的盐水+0.05%(v/v)Tween20(本文中被称作TBS-T)洗涤孔1次。注意,除非另有说明,所有洗涤和孵育用300μL溶液进行。向每个类型的两个孔中加入2μg/mL的于Tris-缓冲的盐水+0.05%(v/v)Tween20+3%(w/v)BSA(本文中被称作TBS-TB)中的小鼠IgG(SigmaCatNo.I5381,Lot.025K7580),并且TBS-T被加至无抗体对照孔并在RT在振荡器上孵育1h。去除小鼠IgG溶液和TBS-T溶液,并用TBS-T洗涤孔三次。向所有孔添加在TBS-T中1/5000稀释的兔抗-小鼠IgG-AP缀合物(SigmaCat.No.A3688,Lot.103K9157)。将各孔在室温下在振荡器上保持1h。去除缀合物,并用3xTBS-T洗涤孔。向每孔加入200μL(PNPP)底物并在室温、黑暗中孵育30min。通过加入去离子水中的50μL3MNaOH溶液停止反应。将孔的内容物与0.75mL去离子水混合并在Shimadzu1240分光光度计中测量在405nm的吸光度。原始数据在表1中并在图5中绘制为条形图。表1.来自每孔的A405读数。在PLA上使用加Flag-标签的OMP支架作为一种疏水聚合物,我们认为聚乳酸(PLA)将是我们可以将其与OMP蛋白附接的材料的优良候选物。为了评价这点,我们从KDalgarno教授(NewcastleUniversity)得到一些3D打印的PLA圆盘。圆盘的结构在图6中示出。蛋白吸附于PLA圆盘上在处理期间使用疏水的48孔板(Nunc)支持圆盘。在如之前的包含稀释的除垢剂的PBS中将OMP0(在位置10包含半胱氨酸残基以使得能够与金结合的经修饰的OmpA蛋白;(对于Omp0的序列,参见图13).)(Lot.91012BE12313)和OMP5(Lot.8910BE18213)稀释至32μM。向每个PLA圆盘加入600μL,用缺乏蛋白的相同溶液处理对照圆盘。用封口膜(parafilm)密封48孔板并在4℃保存16小时。用灭菌的500μL去离子水(Lot.251013YD)洗涤每个PLA圆盘两次以去除多余的未附接的蛋白。OMP5是在细胞外环1中具有FLAG表位的OmpA。FLAG表位是DYKDDDDK。OMP5的抗体检测在TBS-T中制备M2抗-FLAG碱性磷酸酶缀合的抗体(SigmaCatNo.A9469;Lot.091M6287)的1:1000稀释液。将经处理的PLA圆盘转移到新的48孔板(Nunc)并向每个PLA圆盘添加500μL稀释的抗体。室温下30分钟后,去除抗体溶液,并将每个圆盘在500μLTBS-T中孵育5分钟,重复2次。向每个PLA圆盘添加500μL1步PNPP试剂(SigmaCatNo.;Lot.NI14473612),在室温5分钟后,通过加入500μL1MNaOH(Lot.)终止反应。从包含PLA圆盘的每孔取出200μL溶液并将其转移至96孔板。使用ThermoScientificMultiskanFC酶标仪在405nm测量每孔的吸光度。原始数据在表2中并在图7中绘制为条形图。表2.每孔在405nm的吸光度。空白OmpAOMP50.4120.3120.880.3350.3611.0860.3690.3740.877OMP支架在聚酯纤维和聚苯乙烯板上展示ECM基序的用途之前已经示出了,OMP的经修饰的OmpA蛋白在金上组装为定向的单层7以及向β-桶加入整联蛋白结合基序可以改进细胞与金表面的附接9。在此处详述的实验中,检查了这些蛋白与聚酯纤维的结合是否改进细胞的附接。使用OMP蛋白与从静电纺聚酯纤维制造的圆盘用具有聚乙烯核心的静电纺聚丙烯纤维制造的圆盘从AppliedCellBiotechnologiesInc.获得并且使用透析用OMP36包被以从蛋白溶液去除除垢剂。OMP36包含来自层粘连蛋白的YIGSR基序。一旦用蛋白处理后,用细胞接种纤维圆盘并通过显微术估算附接的细胞的数量。蛋白处理聚合物纤维。将静电纺的聚合物样品与ROG-8缓冲液中的10μg/mL的5mLOMP36(Lot.22605BE23407)置于Spectra/Porrcdispodialyser(15000道尔顿分子量截留;Lot.3205922),用无蛋白的ROG-8处理一式两份样品。将透析袋置于包含800mL透析缓冲液(50mMTris,0.1mMEDTA)的1升烧杯中,使用磁力搅拌器缓慢地搅拌溶液。除去透析缓冲液并在2小时、30小时、38小时和4天更换为新鲜的缓冲液。5天后,从透析管中取出聚合物样品并用去离子水洗涤。用细胞检验静电纺聚合物纤维在加入细胞之前,将聚合物圆盘浸泡在70%乙醇中10分钟以将其灭菌;之后在PBS(Lot.15307SP)中快速洗涤以去除任何残留的乙醇。用胰蛋白酶/EDTA收获PC12神经元细胞(传代27次,~90%融合)并以1x106细胞/mL悬浮于RPMI1640介质(包含10%胎牛血清)。将3ml细胞加至一式两份的OMP36处理的聚合物圆盘和无蛋白的ROG-8处理的聚合物圆盘。细胞在湿润的培养箱中、在37℃、5%CO2孵育过夜。16小时后,在室温下将圆盘在包含4%w/v多聚甲醛(BDH;Lot.K32259648)的PBS中浸泡10分钟,之后在包含1μg/mLDAPI(Lot.50307SP)的PBS中浸泡30分钟。使用荧光显微镜使细胞可视化。DAPI染色清楚地示出了每个纤维材料上的许多细胞的细胞核,但在OMP36处理的纤维上有更多的细胞。在聚苯乙烯板上吸附的OMP支架与细胞以上示出了,即使当β桶状分子被吸附在聚酯纤维上时,它们仍能够改进细胞附着。然后检查仅通过在板上干燥蛋白是否能够在聚苯乙烯组织培养多孔板上实现类似的效果。聚苯乙烯板的蛋白处理。与之前相同,在4℃,将6孔和12孔组织培养改性的(亲水的)NunclonΔ板(Nunc)与OMP36在具有0.25%OG的PBS中孵育16小时。6孔板含有500μL蛋白/孔,24孔板含有300μL蛋白/孔。孵育后,用去离子水洗涤每孔两次,然后喷洒70%乙醇以灭菌。将板放置在细胞培养橱10分钟以允许大多数乙醇蒸发,然后用无菌PBS洗涤每孔。用3T3鼠科动物成纤维细胞检验蛋白处理的板用胰蛋白酶/EDTA收获3T3成纤维细胞(传代147次,~70%融合),并以5x104细胞/ml重悬于Dulbecco’s改良的Eagle’s培养基(含有10%胎牛血清)。6孔板中3个未处理的孔和3个蛋白处理的孔各自用3mL细胞接种。24孔板中4个未处理的孔和4个蛋白处理的孔各自用750μL细胞接种。将板在37℃、5%C02在湿润的细胞培养箱中孵育过夜。孵育16小时后,丢弃每板的培养基,在室温下将每个板在包含4%w/v多聚甲醛(BDH;Lot.K32259648)的PBS中浸泡30分钟,之后在包含1μg/mLDAPI(Lot.50307SP)的PBS中浸泡10分钟。使用荧光显微镜使细胞可视化,并计数每孔的自由随机视野中的细胞的数量。数据在图9中示出的条形图中绘制。用OMP36处理聚苯乙烯板改进细胞与聚苯乙烯的附着。OMP支架用于展示生长因子用于细胞培养的用途第一细胞培养实验的目标在于提高细胞与表面的附着,随着蛋白技术被开发以允许在OMP支架中插入更大的蛋白和肽,我们扩大了我们的兴趣以包括更大得多的靶诸如生长因子。被选择作为工程化的靶的前两种生长因子是成纤维细胞生长因子1(FGF1,酸性FGF)和成纤维细胞生长因子2(FGF2,碱性FGF)。此处记录的工作包括将FGF1和FGF2附接至聚苯乙烯板并用小鼠3T3成纤维细胞检验效果的实验。蛋白处理聚苯乙烯板在包含0.25%正辛基葡萄糖苷的Dulbecco’s磷酸盐缓冲盐水(D-PBS,来自Sigma,Lot.090512SP)中制备500μL2μM蛋白溶液:OMP0(Lot.230511)、OMP90(FGF1;Lot.170809BE201009)和OMP128(FGF2;Lot120111BE170111)。将100μL每种蛋白溶液加至96孔聚苯乙烯板的4个孔,之后每孔加入100μLD-PBS。将96孔板包裹在封口膜中并在4℃-8℃保存过夜。16小时后,去除蛋白溶液并用100μL去离子水中的1%Triton-X-100洗涤每孔,之后用100μL去离子水洗涤两次。将96孔板晾干,然后在塑料中密封并在4℃-8℃保存。用3T3成纤维细胞检验FGF处理的板用胰蛋白酶/EDTA收获鼠科动物3T3成纤维细胞(传代157次,~90%融合),并以1x104细胞/ml重悬于Dulbecco’s改良的Eagle’s培养基(DMEM;包含10%胎牛血清)。12个蛋白包被的孔和4个未处理的孔各自用200μL细胞悬浮液接种。用200μL包含12.5ng/mL可溶的FGF2(R&DSystems)的细胞悬液接种另外的4个未处理的孔。将用细胞接种的板在37℃、5%CO2在湿润的培养箱中孵育18小时。丢弃含有未附着的细胞的培养基,向每孔加入100μl包含4%w/v多聚甲醛(BDH;Lot.K32259648)的D-PBS,室温下30分钟后,用100μL结晶紫溶液(Pro-LabDiagnostics;Lot.K12560)代替D-PBS,继续孵育30分钟后,丢弃染色溶液,用100μL去离子水洗涤每孔3次。使用倒置显微镜检查接种有细胞的孔,每孔选择1个随机视野并计数所有可见的细胞。数据在以下图10中示出。当在12.5ng/mL可溶FGF2的存在下培养成纤维细胞时,OMP90(FGF1)和OMP128(FGF2)二者都重复观察到的促有丝分裂作用。用OMP0(OmpA支架)处理聚苯乙烯孔对24小时后观察的细胞的数量没有作用。当蛋白在金包被的玻璃盖玻片上自组装为定向的蛋白单层是,OMP90和OMP128的促有丝分裂作用是相似的。β桶蛋白支架的工程化变体Leckband,D.和Langer,R.(1991)描述用于稳定固定蛋白的方法。BiotechnolBioeng37:227–237).此处描述的研究已经用大肠杆菌OmpA蛋白的衍生物进行。表达克隆的构建在每个情况中,将氨基酸的新序列回译成DNA序列并为了在大肠杆菌中表达,进行密码子优化。由外部承包商IntegratedDNATechnologies(IDT)在保密条件下且无对新的基因的目的或功能的任何知识而将DNA片段合成为盒或全基因。关于每个碱基支架类型的更多细节在以下(向前2.5.3)提供。使用在其他地方(Sambrook,J.和Russell,D.W.(2001)Molecularcloning.ALaboratoryManual.CSHLPress)详细描述的标准分子生物学技术进行β桶蛋白的新的修饰的表达克隆的分子构建。首先用限制分析鉴定正确的构建体,并且由外部承包商BeckmanCoulterGenomics在保密条件下且无关于序列的目的或功能的任何知识而通过DNA测序验证。新的β桶蛋白被用作用于感兴趣的其它蛋白和肽的融合体的支架,用于如以下章节所述的在塑料上固定。融合至HIVP24抗原的OMP170-型支架为了示例该技术的显著优势,我们创造了融合至HIVP24蛋白的OMP170-型β桶蛋白的变体并且证明了明显改进的被抗体识别。实验在Book55中记录。OMP170和OMP171是具有截短的环和截短的C端的两种支架蛋白。它们也具有完整的半胱氨酸,使得该蛋白可以在金和塑料二者上使用。另外,OMP170在N端具有分隔融合位点与β桶的α螺旋间隔物——这分隔结构域并允许更有效的重新折叠。α螺旋间隔物是不结合IgG的金黄色葡萄球菌蛋白AB结构域的突变形式。构建是基于由Kim等人Kim,H.K.(2010)NontoxigenicProteinAvaccineformethicillin-resistantStaphylococcusaureusinfectionsinmice.JExpMedicine207:1863-1870报道的D结构域的突变版本。OMP171与OMP59的比对在图11中示出,OMP59是具有α螺旋间隔物的OMP9。融合蛋白的构建和纯化将具有源自主要亚型(C、B、A、D、F、G、H、J、K、CRF01_AG和CRF03_AB)的人HIVP24蛋白共有序列的新的重组融合蛋白融合至OMP171支架蛋白(图12)。通过回译氨基酸序列产生用于融合至OMP支架的P24共有序列的编码序列,并且为了在大肠杆菌中表达,进行密码子优化。使用标准分子生物学技术(Sambrook,以上)将其与支架编码序列连接。天然P24为从CapricornInc.购买的重组HIVP24抗原(CatNo.HIV-007-B0646,Lot.HIV130759)。如以下所述,从包涵体纯化并重新折叠OMP171和OMP173(参见以下一般方法)。在塑料板上固定化在PBS缓冲液中将天然P24稀释至4μg/mL。在含有0.25%(w/v)OG的PBS中将OMP171和OMP173稀释至2μM。将200μL稀释的蛋白加至96-孔未处理的聚苯乙烯板(Corning#3370)和Polysorp板(Nunc#475094)的孔。允许蛋白在4℃结合过夜,并且然后用200μL高压灭菌的去离子水(SDW)洗涤3次并立即使用。用抗-P24抗体检测从Capricorn购买两种类型的单克隆抗-P24抗体:1.来自小鼠的抗-HIV1-P24单克隆抗体(CatNo.HIV-018-48294,Lot.HIV122936);2.来自小鼠的抗-HIV1/2P24单克隆抗体(CatNo.HIV-018-48304,Lot.HIV111641)。1.用TBS-TB阻断孔。30min室温。2.在TBS-TB中将两种抗体各自稀释至终浓度0.5ng/mL、1ng/mL、10ng/mL、50ng/mL、100ng/mL、500ng/mL和1000ng/mL。将每个浓度的200μL加至每种类型的抗原表面的3个孔。通过仅加入TBS-TB在每个表面上进行零对照。30min室温。3.用200μLTBS-T洗涤孔三次。4.将在TBS-TB中的200μL二级抗体,山羊抗-小鼠IgG碱性磷酸酶缀合物的1/10000稀释液(SigmaCat.No.A3688,Lot.103K9157)加至每孔。30min室温。5.用200μLTBS-T洗涤孔三次。6.向每孔加入100μL对硝基苯基磷酸盐液体底物(Sigma)。于室温15min。7.通过向每孔加入50μL3MNaOH停止反应。8.使用酶标仪测量A405。数据图在图2中示出。用聚苯乙烯板上的任一种抗体根本无法识别直接吸附至表面的天然P24抗原。在Polysorp板上,天然P24显示出与两种抗体的信号,但与抗-HIV1/2P24相比,抗-HIV1-P24单克隆的信号相当微弱。作为与β桶支架的融合体展示的P24蛋白在具有两种抗体的两种类型的板上给出优异的结果。与天然P24相比,结果比预期的好得多,并且不存在与支架自身(OMP171)的非特异性结合。这些数据表明,与天然P24相比,经由β桶支架锚结合至表面的P24对抗体识别是高度有功能的,最可能归因于正确结构以活跃的、可接近的定向的展示。有益效果比我们预期的或认为可能的大得多。因此,β桶支架技术满足当固定于表面上时保留融合配偶体的功能的重要要求和显著改善目前现有技术。经修饰的β桶支架用于展示小肽基序3-50个氨基酸的小肽基序的展示提出与较大蛋白不同的挑战。它们可能不被从表面提升的足够高,并且可能在大量蛋白中保持隐蔽且不可接近。这是一个劣势,因为小基序展示的主要应用之一是在细胞培养中,其中基序需要被充分地暴露以与细胞被膜的组分相互作用。为此我们设计了允许在具有亲水氨基酸和半刚性PT接头(OMP154型)的延长的环上插入小基序的支架骨架。PT接头是天然存在的氨基酸序列(Poon,D.K.Y.等人.(2006)DirectDemonstrationoftheFlexibilityoftheGlycosylatedProline-ThreonineLinkerintheCellulomonasfimiXylanaseCexthroughNMRSpectroscopicAnalysis,JBiolChem282:2091-2011)。融合蛋白的构建和纯化OMP0支架蛋白被修饰以去除4个细胞外环中的3个,基础的经修饰的支架被命名为OMP154。OMP0和OMP154之间的区别在图14的比对中示出。编码OMP154的基因在IDT合成并使用标准分子生物学操作(Sambrook,以上)克隆和验证并使用我们的标准方法(参见以下的一般方法)纯化。一旦OMP154骨架支架蛋白完成,在其中进行如表3中示出的多种插入。表3:具有在OMP154的长环中展示的基序的新蛋白的列表这些蛋白通过完整编码序列的基因合成产生,或通过使用标准方法(Sambrook,以上)在pOMP154表达质粒的环中间的克隆位点插入编码感兴趣的基序的小双链寡核苷酸盒产生。蛋白如以下标题为一般方法的部分所述的表达和纯化。在聚苯乙烯上固定小肽基序如之前一样,在包含稀释的除垢剂溶液的PBS中制备1μM的蛋白。如之前一样,将其加至孔板的每个孔。16小时后,用灭菌的200μL去离子水洗涤每孔两次以去除多余的未附接的蛋白。在小肽基序处理的板上培养MG63细胞用70%乙醇喷洒经蛋白处理的96孔板,并将其置于细胞培养中10分钟以使乙醇蒸发。然后用D-PBS洗涤每孔以去除任何未蒸发的乙醇。MG63骨肉瘤细胞(传代5次)生长至~80%融合后,用胰蛋白酶/EDTA收获。以1x104细胞/mL将细胞重悬于DMEM(包含10%胎牛血清)。向96孔板的每孔加入100μL细胞悬浮液,然后将板在湿润的细胞培养箱中在37℃、5%CO2孵育16小时。在经小肽基序处理的板上培养的细胞的定量使用细胞内酸性磷酸酶以在PNPP试剂中产生颜色变化,用PNPP测定来提供每孔中附着的细胞的数量的半定量评价。通过在PNPP试剂缓冲液(0.1M乙酸钠pH5+0.1%TritonX-100;Lot.220113SP)中溶解1mg/mlPNPP(SigmaLot.SLBC5466V)来制备PNPP试剂。从所有孔去除细胞培养基,向每孔加入100μLPNPP试剂,将96孔板裹在铝箔中并在37℃孵育2小时。通过向每孔加入10μL1MNaOH(Lot.021111DS)停止反应。轻轻晃动后,从每孔转移85μL至新的96孔板并使用ThermoFisherMultiskanFc酶标仪测量在405nm的吸光度。结果与我们用来自不同蛋白的宽范围的作用预测的一致,与空白孔相比,OMP154通过降低表面的疏水性并且从而使细胞更容易地附着,改进细胞附着。用大百分比的检测蛋白观察到了相似的改进水平。与OMP154相比,当在表面OMP153、177和178上生长时,MG63细胞显示了增加的细胞附着。OMP153展示RGDS基序,RGDS基序在纤连蛋白、玻连蛋白、骨桥蛋白等中发现并且是与许多不同细胞类型相互作用的非常强的整联蛋白结合基序。OMP177和OMP178都展示玻连蛋白基序,玻连蛋白基序是在矿化骨(mineralisedbone)中发现的ECM组分。结果清楚地示出,基于OMP154的蛋白以这样的方式展示它们的工程化基序,使得它们可被细胞接近以相互作用。数种检测的蛋白显著地增强骨肉瘤细胞系MG63的附着。融合至生长因子的OMP140型支架为了示例用于展示固定于组织培养板上的生长因子的技术的明显优势,我们创造了融合至如表4中列出的多种生长因子的OMP140-型β桶蛋白的变体。ORL140是具有截短的细胞外环和截短的C端的支架蛋白。它在C端具有his标签,这确保只有全长表达蛋白携带该his标签并且可以通过金属亲和层析纯化。这允许大蛋白诸如生长因子的融合并缓解过表达大蛋白时可能发生的成熟前翻译终止的担心。它的半胱氨酸残基也被去除。大多数生长因子具有对于保持结构和功能必需的多个内部的二硫桥;存在于支架中的半胱氨酸可以干扰这些特定的二硫桥的形成,且支架的无半胱氨酸的变体缓解这一问题。注意,除了C端His标签、缺乏半胱氨酸残基和缺乏C端NQ残基以外,OMP140与OMP171相同(参见图9)。融合蛋白的构建和纯化由IDT合成OMP140编码序列并使用标准方法(Samboork,以上)克隆至表达载体中。通过将编码生长因子的合成盒(在OMP设计并为大肠杆菌进行密码子优化)连接至pOMP140中,使它们在融合蛋白的N端而创造一系列与OMP140的新融合蛋白。目前创造的构建体的列表在表4中示出。表4.生长因子与OMP140的融合如3.1节所述表达并纯化蛋白,但它们的重新折叠条件不同:标准重新折叠缓冲液补充有1mMDTT和0.4M精氨酸。一般方法蛋白纯化和重新折叠通过IPTG诱导,OMP蛋白在1升LB选择培养基中在大肠杆菌BL21菌株中作为包涵体表达。在BugBuster溶液(Novagen)中裂解细胞,并使用BugBuster使用指南中的洗涤方案富集包涵体。在HTBB缓冲液(20mMNaPO4、0.5MNaCl、20mM咪唑、8M尿素pH7.4,过滤并排气)中溶解包涵体。在具有分部收集器的AKTAPrime系统上使用预编程的结合-洗涤-洗脱法——洗脱是在HTBB+250mM咪唑中的分步洗脱,用HisTrapHP柱(GEHealthcare)上的固定化金属亲和层析纯化溶解的制备物。收集来自洗脱液的峰级分并用SDSPAGE确定纯度。将对于感兴趣的蛋白的认为>95%同质的级分合并并使用Vivaspin离心浓缩器浓缩至体积<1mL。通过在重新折叠缓冲液(50mM乙醇胺、0.1mMEDTA、1%OG、1mMDTT)中稀释(以至少1于10的因子)使经纯化的蛋白重新折叠。通过在SDSPAGE上的带移估计重新折叠的程度,并在必要时用圆二色谱学和功能测定(此处未示出)进行进一步确认。SDSPAGE根据生厂商的说明使用来自Invitrogen的NuPAGESDSPAGE凝胶、缓冲液和染色剂。除垢剂对OMP18的结合的作用为了检验除垢剂的作用,我们考虑一些生物学中常用的除垢剂允许OMP蛋白结合至聚苯乙烯表面的适合性。以下表5列出了除垢剂及其性质。为了得到除垢剂的实际的比较,我们使用CMC作为确定浓度的因子,例如22.5mM的OG被定义为1xCMC,或0.3mM的DM被定义为2xCMC等。在第一个实验中,在大约CMC的不同浓度使用全部三种除垢剂以固定OMP186小时或24小时并进行以上的免疫检测。在包含2xCMC的除垢剂的PBS中制备1μM浓度的OMP18蛋白。将其以系列稀释加至96孔板的孔中以得到每种除垢剂的2xCMC、1xCMC、0.5xCMC和0.25xCMC。在6小时后洗涤并处理一组孔,将第二组孵育24小时。洗涤并干燥后,如上所述进行免疫测定,但使用1μg/mL的单个小鼠IgG浓度。数据在图22中以图形方式示出。在CMC或高于CMC的高除垢剂浓度,蛋白很少结合至表面,如来自免疫测定的低信号指出的。在所有情况中,在最低除垢剂浓度没有观察到沉淀。在每个情况中,与Orla蛋白孵育6-24h给出最佳结果。OMP18浓度的作用此实验的目的是确定OMP18浓度对表面性能的影响。它可用于对某些应用限制表面上的蛋白的量,并且控制表面密度的能力是人们期望的。在96孔未处理的聚苯乙烯板的孔中,于PBS缓冲液中的0.125xCMC除垢剂中将OMP18稀释至不同浓度。每孔含有200μL溶液,并将板在4℃孵育过夜。洗涤和干燥后,如上所述以1μg/mL小鼠IgG进行免疫检测。数据在图23中以图形方式示出。数据示出了,加入100nM的蛋白,表面接近饱和,以及可能通过改变蛋白浓度(和如以上所示,除垢剂浓度)控制覆盖率。表面上的图案布点使表面上的蛋白形成图案对于多种应用诸如阵列、细胞培养、药物研发等等将是有用的。本文描述的方法应服从于打印和形成图案。将10μLOMP9(对照蛋白)和OMP18(OMP9支架上的IgG-结合结构域)的斑点用移液管吸取至6孔聚苯乙烯板的底部并在室温、可调湿度室(himiditychamber)中吸附过夜(在这些条件下,斑点不干燥过夜)。每斑点中,0.4xCMC的除垢剂中的蛋白的终浓度为5μM。将孔用2mLTBS-T洗涤2次并用水洗涤一次并干燥。用2mLTBS-T+3%BSA阻断1h。然后向每孔加入1mL0μg/mL、0.1μg/mL或1μg/mL的于TBS-T+3%BSA中的小鼠IgG并孵育15min。用2mLTBS-T洗涤3次后,加入1mL抗-小鼠IgG-AP缀合物1/10000稀释物并在RT孵育15min。将孔用2mLTBS-T洗涤3次并用水洗涤一次。加入BCIP/NBT底物(0.5mL)并在RT孵育15min。通过用2mL水洗涤3次停止反应,并将孔干燥。板的扫描在图25中示出。阴影表示蛋白被结合的区域。这些与放置斑点的位置一致。在此情况中,10μL溶液展开为斑点,平均直径为5.5mm。此斑点尺寸对于细胞培养应用将是有益的。应该可能通过使用更小体积的更高浓度的蛋白产生更小的斑点。注意,一般存在多克隆抗体与OMP9的一些交叉反应性。这些数据表明,用于在表面固定OMP蛋白的方法应当能服从于更精确且复杂的图案化和蚀刻技术。用Omp蛋白使聚苯乙烯珠官能化我们已经证明了塑料平面上的OMP蛋白的改进的功能,并且需要验证这些功能上的优势和改进能否在对于许多应用诸如生物加工中重要的颗粒和珠上重现。为了示例这一点,我们用OMP85蛋白(融合至Omp支架的蛋白G结构域)或天然形式的葡萄球菌蛋白A包被聚苯乙烯珠,并试图使用经包被的珠作为捕获试剂从人血清纯化IgG。从PolysciencesInc.获得1μm直径的polybead。在20mLPBS+0.01%SDS中制备0.5gpolybead的悬浮液以得到包含2.5%固体即4.55x1010颗粒/mL的制备物。在终体积为2mL、包含1mL的2.5%polybead、0.5mg蛋白和浓度为0.125xCMC的十二烷基麦芽糖苷(DM)的PBS中进行蛋白A或OMP85与polybead的结合。通过混合1mLpolybead和1mLPBS制备另外的“未处理”的样品。完全混合后,将它们全部置于4℃过夜。离心polybead,并通过在1mLTBS-T中重新悬浮并离心洗涤3次。然后,将每种沉淀重新悬浮于0.5mLTBST并加入0.5mL人血清并在室温孵育10min。离心polybead并用1mLTBS-T洗涤沉淀4次。保留上清液用于在SDSPAGE上分析。通过将经洗涤的沉淀重新悬浮于1mL50mM乙酸钠pH2.5之后立即离心并用50μL3MNaOH中和上清液来洗脱结合的IgG。如图26中所示,在SDSPAGE上分析样品。来自polybead实验的样品的SDSPAGE分析。将5μL人血清装载在泳道1,所有其他泳道装载1mL样品的20μL。HSA是人血清白蛋白。VH是~50kDa的IgG的重链,且VL是~25kDa的轻链。样品在具有1mMDTT的SDS上样染料中并在95℃加热5min。来自未处理的珠的洗脱液中不存在IgG,而OMP85处理的珠在洗脱液中包含经纯化的IgG。蛋白A处理的珠也具有经纯化的IgG,但量如此小以至于它们在以上示出的凝胶扫描中不可见。这清楚地证明了,OMP85可以结合至polybead并且对于IgG结合是高度有功能的。蛋白包被的表面对用多种试剂洗涤的持久性为了检查用经修饰的Omp蛋白包被的表面的持久性,我们检验了经包被的表面对经常使用的洗涤剂和清洁剂的回复性。使用标准方案用omp蛋白包被孔板,然后用清洁剂洗涤,之后如前述的免疫检测。在预实验中,用不同浓度的SDS洗涤OMP203包被的孔,然后用缀合至碱性磷酸酶的抗-FLAG单克隆抗体进行检测。结果示于图27中。用SDW洗涤0%SDS孔。全部洗涤以一式三份进行,且以3个孔的平均数示出数据。存在大于3个A405单位的非常高的读数,因为允许与PNPP底物溶液的反应进行15min。结论:SDS不除去大量蛋白,表明一旦蛋白与塑料表面附接,它们不被强除垢剂取代。在用OMP203和OMP18包被的孔上进行类似的实验,但此次使用不同浓度的Tween20。数据在图28中示出。再次,蛋白证明了对用Tween20洗涤的回复性。由于大多数标准ELISA方案需要多次除垢剂洗涤,检验1-7个洗涤循环的作用。用包含除垢剂的溶液以不同洗涤次数洗涤OMP203包被的孔(Book59p44,p55)。用水(SDW)洗涤一组的三个孔,而用除垢剂以最高达7次洗涤其他孔。数据示于图29中。还检验了各种各样的其他洗涤条件。用OMP18或OMP203包被板。此次在用水洗涤前,将孔与检验洗涤溶液在RT孵育15min,并如上所述完成检测测定。注意,OMP18测定要求结合小鼠IgG后,用抗-小鼠AP缀合物检测。结果示于图30中。来自用多种试剂洗涤后的免疫测定的数据在X轴上示出。DMSO是二甲基亚砜;Arg–精氨酸;OG–辛基葡萄糖苷;EDTA是乙二胺四乙酸;使用HellmanexTMII。注意,仅用水洗涤未处理的孔。每个数据点是来自3个孔的读数的平均值。检测的洗涤条件都不能从表面除去显著量的蛋白。此数据证明了结合至聚苯乙烯的OMP蛋白在面对使用苛刻的试剂诸如强酸、强碱、离液剂(chaotroph)诸如尿素和精氨酸以及常见除垢剂和溶剂洗涤时的回复性。OMP蛋白与聚苯乙烯的结合非常稳健并且难以取代。为了检验长期暴露于洗涤剂的作用,将用OMP203包被的板与洗涤剂孵育过夜并通过使用抗-FLAG-AP缀合物的免疫测定分析。数据示于图31中。读数又非常高并且高于酶标仪的饱和限值。但是,与之前的数据相比,在孔之间存在更大的变异程度,并且3MNaOH浸泡具有明显地降低的信号,表明3MNaOH浸泡已经去除或破坏表面结合的蛋白。然而,表面结合的OMP203蛋白证明了对包括苛刻的洗涤缓冲液诸如纯HellmanexII、6MGuHCl、8M尿素、1%TritonX100的所有其他试剂中浸泡过夜的非凡的回复性。细胞与Orla蛋白包被的聚苯乙烯的增强的附着使用我们的标准方案,用展示多种细胞外基质(ECM)源的基序的OMP蛋白(参见下页的表)包被Sarstedt疏水96孔板的孔,一式三份。用70%乙醇喷洒板并将其置于细胞培养橱柜,10分钟后丢弃残留的乙醇,并用200μLDulbecco’s磷酸盐缓冲盐水洗涤每孔。使用胰蛋白酶从75cm2细胞培养瓶收获MG63人骨肉瘤细胞,并将其接种至蛋白包被的孔上,向每孔加入包含1x104细胞/mL的200μL细胞悬浮液。在湿润的细胞培养箱中在37℃孵育细胞过夜。蛋白基序氨基酸数量基序的来源OMP154对照蛋白0N/AOMP153RGDS4纤连蛋白OMP162IKVAV5层粘连蛋白α1OMP164PHSRN5纤连蛋白OMP203可变(CS3)结构域110纤连蛋白表6:用MG63细胞检验的蛋白的细节,所有蛋白是基于OMP154蛋白,在相同的延长的环中具有不同大小的插入。孵育16小时后,使用酸性磷酸酶测定评估每孔中附着的细胞的数量。在此测定中,用包含除垢剂的酸性缓冲液破坏细胞。这暴露细胞内的酸性磷酸酶,该酶将无色的磷酸对硝基苯酯(Pnpp)转化成黄色的化合物对硝基苯酚。孔中更多的细胞将引起Pnpp向对硝基苯酚的转化的增加,这可以容易地通过测量在405nm的光的吸光度检测。从每孔去除培养基,并向每孔加入包含0.1%TritonX-100和1mg/mLPnpp的100μL0.1M乙酸钠pH5。将板包裹在铝箔中并在37℃孵育2小时。通过向每孔加入10μL1MNaOH停止反应。从每孔转移85μL溶液至新的96孔板并使用酶标仪测量在405nm的吸光度(Book58pp10-25)。图32示出了在用展示多种ECM基序的Orla蛋白包被的聚苯乙烯上培养MG63细胞的结果。结论:与用对照OMP154蛋白包被的孔相比,展示不同大小和来自不同ECM蛋白的ECM基序的OMP蛋白能够增加附着的MG63细胞的数量。3D聚苯乙烯的蛋白官能化用于聚苯乙烯板的标准聚苯乙烯包被方案可以适应于蛋白包被其他聚苯乙烯材料诸如3D细胞培养材料Alvetex,Alvetex是ReinnervateLtd.的商标(参见图33)。使用的蛋白浓度从1.6μM升高至15μM,以适应Alvetex的增加的表面积(Book52pp137-141)。用对照OmpA蛋白处理Alvetex的3个样品,用IgG结合蛋白OMP85处理3个样品。用2mL包含0.05%Tween20的Tris缓冲盐水(TBS-T)洗涤经处理的样品2次。在TBS-T中将碱性磷酸酶缀合的抗-小鼠IgG1:10,000稀释,向每个Alvetex样品加入500μL稀释的抗体并在室温孵育1小时。用500μLTBS-T洗涤每个样品2次后,加入600μL磷酸对硝基苯酯(Pnpp)试剂。10分钟后,从每孔去除1mLPnpp试剂,用分光光度计在405nm测量吸光度。图34:在经OMP蛋白处理的3D聚苯乙烯上检测碱性磷酸酶缀合的IgG。结论:与用对照OmpA蛋白包被的表面相比,用OMP85处理3D聚苯乙烯增加IgG的结合。OMP蛋白可被用于使许多不同格式的聚苯乙烯官能化;2D板和瓶、珠和3D结构。与聚(乳酸)的蛋白附接至今,大多数研究已经检查了在聚苯乙烯的多种格式上使用ompA蛋白。用于蛋白附接的相同方法可被用于蛋白包被其他材料诸如聚乳酸(PLA)。在此实例中,使用用于聚苯乙烯的相同稀释法(Book58pp28-53)将OMP5(展示FLAG表位的ompA)固定于3D打印的PLA3mmx8mm支架上。图6示出了3D打印的2mmx8mmPLA圆盘的网格结构。用OMP5(经修饰以展示FLAG表位的ompA)处理18个PLA圆盘,FLAG表位可以使用抗-FLAG抗体容易地检测。制备OMP5的32μM溶液,向每个PLA圆盘加入37.5μL蛋白和562.5μL磷酸盐缓冲盐水。将圆盘在4℃-8℃孵育过夜,在第二天用500μL无菌去离子水洗涤圆盘3次。将圆盘分成6组,每组3个圆盘,将每组在37℃在TritonX-100的1%溶液中浸泡不同天数。·未用TritonX-100处理·在1%TritonX-100中浸泡1天·在1%TritonX-100中浸泡2天·在1%TritonX-100中浸泡3天·在1%TritonX-100中浸泡4天·在1%TritonX-100中浸泡7天在每个时间点从所有样品中去除并置换1%TritonX-100溶液,以防止从样品去除的任何蛋白重新附接。在最后时间点,用500μLTBS-T洗涤全部圆盘然后在包含1μL/mLM2碱性磷酸酶缀合的抗-FLAGIgG的500μL中在室温孵育30分钟。用500μLTBS-T洗涤每个圆盘3次,然后转移至新的48孔板。向每个圆盘加入500μLPnpp试剂,在室温下10分钟后,通过加入500μL1MNaOH终止反应。从每个圆盘取出200μLPnpp试剂并置于96孔板中,使用酶标仪测量所有样品在405nm的吸光度。图35示出了在1%tritonX-100中浸没数天后的PLA上的OMP蛋白的抗体检测。结论:用OMP5处理PLA增加M2抗-FLAG抗体与PLA的结合。将OMP5处理的PLA在1%tritonX-100中浸泡1天减少M2抗-FLAG抗体与PLA的结合。将PLA在1%tritonX-100中浸泡更长时间不进一步减少抗体的结合。蛋白的预稀释用于将omp支架结合至塑料表面的方法依赖于除垢剂的稀释。标准方案要求在原处稀释,即先向表面加入稀释剂,然后向稀释剂加入蛋白溶液。对于一些技术诸如微滴或纳米滴图案化而言,此两步法难以精确实现。在此情况下,将需要在外部预稀释并以单个液滴应用至表面。我们知道,变性的omp蛋白不能够直接稀释于不含除垢剂的缓冲液中,因为它们沉淀并从溶液中析出。但是,稀释保存于除垢剂中的重新折叠的蛋白的作用是未知的。进行一系列实验以检验预稀释和短期保存的作用。a)动态光散射在含有2xCMC(0.3mM)的DM(十二烷基麦芽糖苷)的PBS中制备蛋白omp208的0.1mg/mL溶液。在MalvernZetasizer-纳米仪器上通过动态光散射测量确定此溶液中的蛋白的平均粒径为7.9nm(±0.9nm)。然后在包含PBS的比色皿(cuvette)中制备2mg/mL的omp208溶液的20x稀释液,并且在1h期间监测平均粒径。实验进行两次,并且在每个时间点读取3个读数。数据在图36中示出。图36示出了来自动态光散射实验的数据。图示出了在1小时的期间内平均粒径的变化。数据示出了,在稀释后,粒径从~8nm增加至45-55nm,但之后在此水平稳定1h。这些数据表明,在稀释后立即出现一些聚集,但聚集物处于45-55nm的稳定状态持续至少1h。b)预稀释后的免疫测定我们检验了预稀释是否影响omp蛋白与塑料表面的物理吸附。制备omp203的稀释液:2μMomp203,PBS中0.1xCMC的DM。稀释后立刻将200μL该溶液加至96孔未处理的聚苯乙烯板中的3个孔(时间0)。然后,以最长至6h的每小时间隔,从预稀释的溶液中取200μL样品并加至同一板上的孔,每次一式三份。在6h,还准备一组对照孔,其中根据标准操作将蛋白在孔中直接稀释(在图38的图中这作为-1样品绘图)。图37示出了预稀释后omp203检测的免疫测定的结果。数据示出了,预稀释后蛋白结合塑料的能力在至少6h内保持不受损害。表7:遍及本说明书的描述和权利要求,词语“包括”和“包含”和它们的变化形式意指“包括但不限于”,并且它们不预期(并且不)排除其他部分、添加剂、组分、整数或步骤。贯穿本说明书的描述和权利要求书,单数包括复数,除非上下文另有要求。特别是,当使用不定冠词时,本说明书应理解为考虑复数以及单数,除非上下文另有要求。应理解,结合本发明的特定方面、实施方案或实施例描述的特征、整数、特性、化合物、化学部分或基团适用于本文描述的任何其他方面、实施方案或实施例,除非与其不相容。本说明书(包括任何附随的权利要求书、摘要和附图)中公开的所有特征、和/或这样公开的任何方法或过程的所有步骤可以以任何组合被组合,除了其中这样的特征和/或步骤中的至少一些是互相排斥的组合。本发明不受任何前述实施方案的细节的限制。本发明延伸至本说明书(包括任何附随的权利要求书、摘要和附图)中公开的特征的任何新颖的一个或任何新颖的组合,或延伸至这样公开的任何方法或过程的步骤的任何新颖的一个或任何新颖的组合。读者的注意力关注到当前与本说明书一起递交或在本说明书之前递交的与本申请有关的并且随本说明书公开供公众查阅的所有论文和文件,并且所有这样的论文和文件的内容通过引用被并入本文。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1