靶向分子及其用途的制作方法
本发明涉及以选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞为靶的靶向分子、含有该靶向分子的靶向剂、载体、复合物及医药组合物、对与所述细胞相关的疾病进行处置、检査、诊断或监测的方法、及对所述细胞进行标记、监测或成像的方法等。
背景技术:
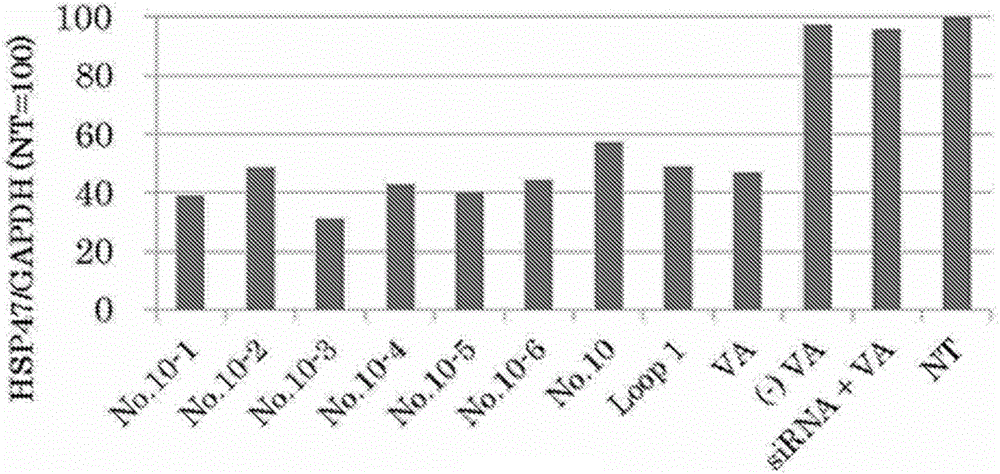
:人类通过化学疗法克服了很多疾病,但是也一直为以往使用低分子药剂的化学疗法中因药剂对除作为治疗靶的细胞以外的细胞也发挥作用而产生的副作用所苦恼。近年来,为了克服这个问题,对将药剂递送至所期望细胞的技术的开发不断推进。作为将药剂递送至所期望的细胞的方案之一,可列举出使用该细胞的特异性靶向分子。例如,已知类视黄醇或其衍生物作为星状细胞、肺、骨髓、肾脏、肠道中的细胞外基质产生细胞、癌相关成纤维细胞、癌细胞的特异性靶向分子发挥功能(专利文献1~9、非专利文献1)。但是,仍然存在对靶向分子的进一步需求。现有技术文献专利文献专利文献1:WO2006/068232专利文献2:WO2008/120815专利文献3:WO2009/036368专利文献4:WO2009/116257专利文献5:WO2010/014117专利文献6:WO2010/026766专利文献7:WO2010/029760专利文献8:WO2011/158933专利文献9:WO2013/073667非专利文献非专利文献1:Satoetal.,NatBiotechnol.2008;26(4):431-42技术实现要素:发明所要解决的课题本发明的目的在于提供以选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞为靶的靶向分子、含有该靶向分子的靶向剂、载体、复合物及组合物、对与所述细胞相关的疾病进行处置的方法及对所述细胞进行标记的方法等。用于解决课题的手段本发明者为了解决上述课题进行了持续深入的研究,结果发现了包含RBP的细胞结合区的氨基酸序列的肽等作为星状细胞等的特异性靶向分子发挥功能,从而完成了本发明。即,本发明涉及以下技术方案。<1>一种靶向分子,其为以选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞为靶的靶向分子,该靶向分子选自由下述(1)~(3)组成的组,(1)包含RBP的细胞结合区的氨基酸序列的肽、(2)具有与(1)的肽同等的靶向能力的该肽的突变肽、(3)具有与(1)或(2)的肽同等的靶向能力的肽模拟物。<2>根据上述<1>所述的靶向分子,其中,细胞结合区为RBP的环1、环2、及环1和环2的功能性片段。<3>根据上述<1>或<2>所述的靶向分子,其中,细胞结合区包含选自序列号3及4中的氨基酸序列。<4>根据上述<1>~<3>中的任一项所述的靶向分子,其包含选自序列号3、4、6~13中的氨基酸序列。<5>根据上述<1>~<4>中的任一项所述的靶向分子,其中,肽模拟物为基于(1)或(2)的肽的反转-变型肽(retro-inversotypepeptide)。<6>一种用于以选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞为靶的靶向剂,其包含上述<1>~<5>中的任一项所述的靶向分子。<7>一种向选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞递送物质的载体,其通过上述<1>~<5>中的任一项所述的靶向分子进行靶向。<8>一种复合物,其用式(1)表示,X-Y-Z(1)式(1)中,X为包含上述<1>~<5>中的任一项所述的靶向分子的靶向部分,Y为结合部分,Z为包含由药物、标记及载体组成的组中的物质的功能性部分。<9>根据上述<8>所述的复合物,其中,载体进一步包含药物和/或标记。<10>一种组合物,其包含选自由上述<1>~<5>中的任一项所述的靶向分子、上述<6>所述的靶向剂、上述<7>所述的载体及上述<8>或<9>所述的复合物组成的组中的成分。<11>根据上述<10>所述的组合物,其中,所述组合物包含对与选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞相关的疾病进行处置的药物且用于对该疾病进行处置。<12>根据上述<11>所述的组合物,其中,疾病选自由纤维化及肿瘤性疾病组成的组。<13>根据上述<10>所述的组合物,其中,所述组合物包含对选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞的活性或增殖进行控制的药物且用于对所述靶细胞的活性或增殖进行控制。<14>根据上述<10>所述的组合物,其用于向选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞递送物质。<15>根据上述<10>所述的组合物,其中,所述组合物含有标记且用于对选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞进行标记、监测或成像。<16>根据上述<10>所述的组合物,其中,所述组合物含有标记且用于对与选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞相关的疾病进行检査、诊断或监测。<17>一种对与选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞相关的疾病进行处置的方法,所述方法包含将含有对该疾病进行处置的药物的有效量的上述<8>或<9>所述的复合物或者上述<11>或<12>所述的组合物给予需要它的对象的工序。<18>一种对选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞或包含该靶细胞的组织进行标记、监测或成像的方法,所述方法包含将含有标记的有效量的上述<8>或<9>所述的复合物或者上述<15>所述的组合物给予需要它的对象的工序。<19>一种对与选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞相关的疾病进行检査、诊断或监测的方法,所述方法包含将含有标记的有效量的上述<8>或<9>所述的复合物或者上述<16>所述的组合物给予需要它的对象的工序。发明效果通过本发明,能够将加工性优异的肽用作靶向分子,能够增加制剂设计的自由度,能够开发出更多样的靶向制剂。另外,通过本发明,能够向纤维化或肿瘤等难以治疗的疾病的原因细胞特异性地递送各种各样的药物,因此可以预期对医疗及兽医疗做出巨大贡献。附图说明图1是采用大鼠肝星状细胞(HSC)、将作为靶向分子使用RBP的环1~3时的siRNA的转染效率用siRNA的靶基因即大鼠HSP47的抑制程度表示的图表。纵轴表示以未处理细胞为100计的大鼠HSP47相对于内部标准的大鼠GAPDH的相对表达量。图表中,“VL”是指代替RBP的各种环使用了视黄醇的组(即VA/LipoTrust/siRNA)、“L”是指代替RBP的各种环使用了DMSO的组(即LipoTrust/siRNA)、“w/oLT”是指不含LipoTrustTMSR而使用了siRNA与肽的混合物的组、“NT”是指未处理组。图2是采用大鼠肝星状细胞(HSC)、将作为靶向分子使用RBP的环1或其片段时的siRNA的转染效率用siRNA的靶基因即大鼠HSP47的抑制程度表示的图表。纵轴表示以未处理细胞为100计的大鼠HSP47相对于内部标准的大鼠GAPDH的相对表达量。图表中,“VA”是指代替各种肽使用了视黄醇的组(即VA/LipoTrust/siRNA)、“(-)VA”是指代替各种肽使用了DMSO的组(即LipoTrust/siRNA)、“siRNA+VA”是指不含LipoTrustTMSR而含有视黄醇与siRNA的混合物的组、“NT”是指未处理组。图3是采用大鼠肝星状细胞(HSC)、将作为靶向分子使用RBP的环1(L1)或其突变肽(E3K6、D3K4、D3K12)时的siRNA的转染效率用siRNA的靶基因即大鼠HSP47的抑制程度表示的图表。纵轴表示以未处理细胞为100计的大鼠HSP47相对于内部标准的大鼠GAPDH的相对表达量。图表中,“VA”是指代替各种肽使用了视黄醇的组(即VA/LipoTrust/siRNA)、“(-)VA”是指代替各种肽使用了DMSO的组(即LipoTrust/siRNA)、“NT”是指未处理组。图4是采用大鼠肝星状细胞(HSC)、将作为靶向分子使用RBP的环1(L1)或其反转变型肽(RI)时的siRNA的转染效率用siRNA的靶基因即大鼠HSP47的抑制程度表示的图表。纵轴表示以未处理细胞为100计的大鼠HSP47相对于内部标准的大鼠GAPDH的相对表达量。图表中,“VA”是指代替各种肽使用了视黄醇的组(即VA/LipoTrust/siRNA)、“(-)VA”是指代替各种肽使用了DMSO的组(即LipoTrust/siRNA)、“NT”是指未处理组。图5是采用大鼠星状细胞(HSC)中、将作为靶向分子使用RBP的环1(L1)或其乱序肽时的siRNA的转染效率用siRNA的靶基因即大鼠HSP47的抑制程度表示的图表。纵轴表示以未处理细胞为100计的大鼠HSP47相对于内部标准的大鼠GAPDH的相对表达量。图表中,“scr”是指使用了乱序肽的组、“VA”是指代替各种肽使用了视黄醇的组(即VA/LipoTrust/siRNA)、“DMSO”是指代替各种肽使用了DMSO的组(即LipoTrust/siRNA)、“NT”是指未处理组。图6是采用人纤维肉瘤细胞系HT-1080、将作为靶向分子使用RBP的环1(L1)时的siRNA的转染效率用siRNA的靶基因即人HSP47的抑制程度表示的图表。纵轴表示以未处理细胞为100计的人HSP47相对于内部标准的人GAPDH的相对表达量。图表中,“scr”是指乱序肽的组、“VA”是指代替各种肽使用了视黄醇的组(即VA/LipoTrust/siRNA)、“DMSO”是指代替各种肽使用了DMSO的组(即LipoTrust/siRNA)、“NT”是指未处理组、“1st”、“2nd”分别是指相同内容的实验的第1次的结果和第2次的结果。具体实施方式只要本说明书中没有另外定义,则本说明书中使用的全部技术术语及科学术语具有与本领域技术人员的通常理解相同的含义。本说明书中引用的全部专利、申请、公开的申请及其他出版物(包括在线信息)其全部内容通过参照纳入本说明书内。本发明的一个侧面涉及一种靶向分子,其为以选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞为靶的靶向分子,该靶向分子选自下述(1)~(3)组成的组,(1)包含RBP的细胞结合区的氨基酸序列的肽、(2)具有与(1)的肽同等的靶向能力的该肽的突变肽、(3)具有与(1)或(2)的肽同等的靶向能力的肽模拟物。本说明书中,“靶向分子”是指具有促进将与其结合的物质递送至特定的靶的靶向能力的分子。本发明中,靶是选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞,本发明的靶向分子具有促进将与其结合的物质递送至这些靶细胞的能力、即靶向能力。这里,“促进递送”是指与不存在靶向分子的情况相比,将物质迅速且/或大量地递送至靶细胞、且/或使其摄入,这可通过例如将带有标记或药物的靶向分子、或与含有标记或药物的组合物结合的靶向分子添加到靶细胞的培养物中、然后将规定时间后的标记的存在部位或药物的效果与添加了靶向分子未结合的标记或药物等的情况比较来容易地确认(例如参照本说明书的例2~6)。当靶向分子存在时的靶细胞中的标记的量或药物的作用与不存在靶向分子时相比增大时,则递送得到促进。作为增大的程度,没有限定,例如可以为5%以上、10%以上、15%以上、20%以上、25%以上、30%以上、40%以上、50%以上、60%以上、70%以上、80%以上、90%以上、100%以上、150%以上、200%以上、300%以上等。另外,优选靶向分子存在时的靶细胞中的标记的量或药物的作用与不存在靶向分子时相比,伴有统计学上的显著差异地增大。本说明书中,“星状细胞”典型地是指具有维生素A(VA)储藏能力的星状的细胞。由于该性质,“星状细胞”有时也被称为“维生素A储藏细胞”。作为星状细胞,已熟知肝脏的肝星状细胞(也被称为Ito细胞),除肝脏以外,已知胰脏、声带等也存在同样的细胞(例如参照Madroetal.,MedSciMonit.2004Jul;10(7):RA166-70、Jaster,MolCancer.2004Oct06;3(1):26、Fujaetal.,CellTissueRes.2005;322(3):417-24等),本发明中的星状细胞包含这些细胞。已知星状细胞在炎症等的刺激下发生活化,呈现以α平滑肌肌动蛋白(αSMA)的表达为特征的肌成纤维细胞样的表现型,随着增殖,大量产生成为纤维化原因的胶原(例如FallowfieldandIredale,ExpertOpinTherTargets.2004Oct;8(5):423-35、上述Madroetal.,2004、上述Jaster,2004等)。本发明中的星状细胞包含未发生活化的静止(quiescent)星状细胞及活化星状细胞这两者。本说明书中,“肌成纤维细胞”是指以αSMA的表达为特征的成纤维细胞,出现在各种脏器。肌成纤维细胞由存在于各种脏器、循环血液中的成纤维细胞等间质细胞分化而来,被认为与各种脏器纤维化、各种脏器的再生相关(例如Selmanetal.,AnnInternMed.2001Jan16;134(2):136-51等)。肌成纤维细胞可以通过使用了经可检测标记的抗α-SMA抗体的免疫染色等来鉴定。本说明书中,“癌相关成纤维细胞(CAF)”是指存在于癌病变的内部和/或周围的α-SMA(平滑肌肌动蛋白)阳性的成纤维细胞(例如参照专利文献2等)。CAF帮助存在于其附近的癌细胞增殖,被认为与癌的进展等相关。CAF可以通过将癌组织、从癌组织分离的细胞用经可检测标记的抗α-SMA抗体进行免疫染色等来鉴定。CAF在结肠癌、肺癌、前列腺癌、乳腺癌、胃癌、胆管癌、基底细胞癌等各种癌中已确认其存在。本发明中,某种细胞是否为CAF用以下的方法判定。即,将存在于癌病变的内部和/或周围的细胞用抗CAF的标记物即α-SMA的标记抗体、例如FITC标记抗α-SMA抗体、Cy3标记抗α-SMA抗体进行免疫染色,检测到α-SMA的判定为是CAF。本发明中的伴随CAF的癌没有特别限定,可列举出例如脑肿瘤、头颈部癌、乳腺癌、肺癌、食道癌、胃癌、十二指肠癌、阑尾癌、结肠癌、直肠癌、肝癌、胰腺癌、胆囊癌、胆管癌、肛门癌、肾癌、尿管癌、膀胱癌、前列腺癌、阴茎癌、睾丸癌、子宫癌、卵巢癌、外阴癌、阴道癌、皮肤癌等实体癌。另外,CAF虽然典型地是伴随癌的细胞,但是只要具有同样的性质,则也可以是伴随除癌以外的恶性实体肿瘤、例如纤维肉瘤、恶性纤维组织细胞瘤、脂肪肉瘤、横纹肌肉瘤、平滑肌肉瘤、血管肉瘤、kaposi肉瘤、淋巴管肉瘤、滑膜肉瘤、软骨肉瘤、骨肉瘤等肉瘤的细胞,这些也包含在本发明的范围内。CAF可存在于上述癌所存在的各种脏器、例如脑、头颈部、胸部、四肢、肺、心脏、胸腺、食道、胃、小肠(十二指肠、空肠、回肠)、结肠(结肠、盲肠、阑尾、直肠)、肝脏、胰脏、胆囊、肛门、肾、尿管、膀胱、前列腺、阴茎、睾丸、子宫、卵巢、外阴、阴道、皮肤、横纹肌、平滑肌、滑膜、软骨、骨、甲状腺、肾上腺、腹膜、肠系膜等。本说明书中,“肿瘤”包括良性肿瘤及恶性肿瘤(癌)。本发明中,“癌”包括上皮性恶性肿瘤及非上皮性恶性肿瘤这两者,例如,没有限定,包括纤维肉瘤、恶性纤维组织细胞瘤、脂肪肉瘤、横纹肌肉瘤、平滑肌肉瘤、血管肉瘤、kaposi肉瘤、淋巴管肉瘤、滑膜肉瘤、软骨肉瘤、骨肉瘤等肉瘤、脑肿瘤、头颈部癌、乳腺癌、肺癌、食道癌、胃癌、十二指肠癌、阑尾癌、结肠癌、直肠癌、肝癌、胰腺癌、胆囊癌、胆管癌、肛门癌、肾癌、尿管癌、膀胱癌、前列腺癌、阴茎癌、睾丸癌、子宫癌、卵巢癌、外阴癌、阴道癌、皮肤癌等癌瘤、进而包括白血病、恶性淋巴瘤等。本发明中的肿瘤细胞可存在于身体的任意部位、例如脑、头颈部、胸部、四肢、肺、心脏、胸腺、食道、胃、小肠(十二指肠、空肠、回肠)、结肠(结肠、盲肠、阑尾、直肠)、肝脏、胰脏、胆囊、肛门、肾、尿管、膀胱、前列腺、阴茎、睾丸、子宫、卵巢、外阴、阴道、皮肤、横纹肌、平滑肌、滑膜、软骨、骨、甲状腺、肾上腺、腹膜、肠系膜、骨髓、血液、血管系、淋巴节等淋巴系、淋巴液等。本说明书中,“STRA6表达细胞”是指在细胞表面表达STRA6的细胞。STRA6(stimulatedbyretinoicacid6,视黄酸激活基因6)为RBP(retinolbindingprotein,视黄醇结合蛋白)的高亲和性受体,其存在于细胞表面。因此,以包含RBP的细胞结合区的氨基酸序列的肽为基础的本发明的靶向分子被认为具有靶向STRA6表达细胞的能力。STRA6被认为具有将RBP所搬运的视黄醇摄入细胞内的功能。STRA6在癌细胞(例如结肠癌细胞)、视网膜色素上皮(RPE)细胞、支持细胞(Sertolicell)、星状细胞等中已确认到其表达(SunandKawaguchi,IntRevCellMolBiol.2011;288:1-41)。STRA6的基因序列是已知的(例如GenBank登录号AY359089、AY358748(人)、NM_001029924(大鼠)、AF062476(小鼠)等),也开发了抗体,因此STRA6的表达可通过下述已知的核酸或蛋白检测方法进行检测,例如没有限定,利用了抗STRA6抗体的免疫沉降法、EIA(enzymeimmunoassay,酶免疫分析法)(例如ELISA(emzyme-linkedimmunosorbentassay,酶联免疫吸附法)等)、RIA(radioimmunoassay,放射免疫法)(例如IRMA(immunoradiometricassay,免疫放射测定法)、RAST(radioallergosorbenttest,放射过敏原吸附试验)、RIST(radioimmunosorbenttest,放射免疫吸附试验)等)、免疫印迹法、免疫组化法、免疫细胞化学法、流式细胞法、利用了编码STRA6的核酸或其独特片段或该核酸的转录产物(例如mRNA)或与剪接产物特异性地杂交的核酸的各种杂交反应法、Northern杂交法、Southern杂交法、各种PCR法等。STRA6的表达优选在蛋白水平进行检测,但也可以用基因水平的检测代替。因此,本发明中的“STRA6表达细胞”不仅仅是指已知STRA6表达的细胞,而且包括通过上述方法确认了STRA6的表达的任意细胞。一个方式中,靶细胞选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞及肿瘤细胞组成的组。特定方式中,靶细胞选自由星状细胞、肌成纤维细胞及癌相关成纤维细胞组成的组。进一步的特定方式中,靶细胞选自由星状细胞及肌成纤维细胞组成的组。本说明书中,“RBP”是指血中存在的细胞外蛋白即血清RBP。RBP为在各种动物种中已确认其存在的已知蛋白,其核酸序列及氨基酸序列可从GenBank等数据库获得。例如,人RBP的核酸序列以GenBank登录号NM_006744(序列号1)、氨基酸序列以GenBank登录号NP_006735(序列号2)登记。但是,由于生物个体间存在发生不损害蛋白的生理学功能的氨基酸序列或基因序列的突变的可能性,因此本发明中的RBP或RBP基因并不限于具有与公知序列相同的序列的核酸或蛋白,也可包括相对于该序列具有1个或2个以上、典型地1个或数个、例如1个、2个、3个、4个、5个、6个、7个、8个、9个或10个碱基或氨基酸不同的序列的RBP或RBP基因。本发明中的RBP可以是任意动物种的RBP,优选脊椎动物、更优选哺乳动物、特别优选为人的RBP。本说明书中,“RBP的细胞结合区”是指与和本发明中的靶细胞的结合相关的RBP的区域。一个方式中,RBP的细胞结合区选自由环1~3及其功能性片段组成的组。环1~3是向收纳视黄醇的RBP的口袋的开口部的周围突出的环状的结构,例如人RBP中,分别由序列号2的氨基酸序列的第46~59个、第75~89个及第107~121个氨基酸构成。环1~3的功能性片段为环1~3的片段中具有靶向靶细胞的能力者,这可以通过例如如本说明书的例2中所记载的那样,制作多个环1~3不同的片段,研究其对靶细胞是否具有靶向能力等来发现。例如,本发明中的人RBP的环1的功能性片段的特定方式为包含最小功能区即序列号6的氨基酸序列的片段。优选的方式中,RBP的细胞结合区选自由环1、环2及它们的功能性片段组成的组。更优选的方式中,RBP的细胞结合区选自由环1及其功能性片段组成的组。特定方式中,环1及环2为人RBP的环,例如分别具有序列号3及4的氨基酸序列。特定方式中,人RBP的环1的功能性片段由选自序列号6~13中的氨基酸序列构成。本说明书中,“包含RBP的细胞结合区的氨基酸序列的肽”(以下有时也简称为“含细胞结合区的肽”)是指包含上述RBP的细胞结合区的氨基酸序列且具有靶向靶细胞的能力的任意肽。因此,所述肽不仅由RBP的细胞结合区的氨基酸序列构成,而且包括包含在RBP的细胞结合区的氨基酸序列的N末端、C末端或这两者上追加的氨基酸序列者。追加的氨基酸序列包括不丧失该肽的靶向能力的任意序列。追加的氨基酸序列是否丧失了肽的靶向能力可通过将包含追加的氨基酸序列和RBP的细胞结合区的氨基酸序列的肽、仅由RBP的细胞结合区的氨基酸序列构成的肽、及不包含RBP的细胞结合区的氨基酸序列的肽的靶向能力进行实验比较、或者对包含追加的氨基酸序列的肽进行立体结构分析或立体结构预测等来评价。例如,当包含追加的氨基酸序列和RBP的细胞结合区的氨基酸序列的肽的递送能力(即将与肽结合的物质递送至靶细胞的能力)与仅由RBP的细胞结合区的氨基酸序列构成的肽的递送能力相比较低、且与不含有RBP的细胞结合区的氨基酸序列的肽的递送能力同等或更低时、或根据立体结构分析或立体结构预测可知追加的氨基酸序列隐藏了RBP的细胞结合区时可评价为追加的氨基酸序列使肽的靶向能力丧失。含细胞结合区的肽典型地为10个氨基酸长以上、优选为10~50个氨基酸长、更优选为10~30个氨基酸长、进一步优选为10~20个氨基酸长、特别优选为10~14个氨基酸长。含细胞结合区的肽可以在不使该肽的靶向能力丧失的范围内进行修饰。修饰是否使肽的靶向能力丧失可通过未经修饰的含细胞结合区的肽、经修饰的含细胞结合区的肽、及未经修饰的不含细胞结合区的肽的靶向能力的实验比较等来进行评价。例如,经修饰的含细胞结合区的肽的递送能力与未经修饰的含细胞结合区的肽相比较低、且与未经修饰的不含细胞结合区的肽的靶向能力同等或更低时,可评价为其修饰使肽的靶向能力丧失。修饰可以对肽的全部氨基酸进行,也可以对部分氨基酸进行。修饰对部分氨基酸进行时,其可以对特定种类的氨基酸进行、也可以对特定位置的氨基酸进行。并不是为了对进行修饰的氨基酸的种类或位置进行限定,但认为对除含细胞结合区的肽的最小功能区以外的氨基酸进行修饰不会使该肽的靶向能力丧失的可能性高。作为对含细胞结合区的肽进行修饰的非限定例,可列举出例如生物素化、肉豆蔻酰基化、辛酰基化、棕榈酰基化、乙酰基化、马来酰亚胺化、甲基化、丙二酰基化、酰胺化、酯化、法呢基化、香叶基化、磷氧化、硫氧化、棕榈酰基化、PEG化、各种标记(例如本说明书中记载的标记)的付加等。本说明书中,“具有与包含RBP的细胞结合区的氨基酸序列的肽同等的靶向能力的该肽的突变肽”(以下有时也简称为“突变肽”)是指在含细胞结合区的肽、特别是其细胞结合区具有1个或2个以上(例如数个)的氨基酸的突变、但具有与该肽同等或更高的靶向能力的任意的肽。作为突变,可列举出例如氨基酸的缺失、替换、付加,关于涉及突变的氨基酸的个数,当突变涉及细胞结合区时,例如可以为1~10个、1~9个、1~8个、1~7个、1~6个、1~5个、1~4个、1~3个、1~2个的范围。更具体而言,涉及细胞结合区的突变的氨基酸的个数例如可以为1、2、3、4、5、6、7、8、9或10个。关于涉及突变的氨基酸的个数,当突变涉及除含细胞结合区的肽的细胞结合区以外的部分时,只要该部分不会使肽的靶向能力丧失,则关于细胞结合区的突变可以多于上述的个数。氨基酸的替换可以为保守性替换。保守性替换在本
技术领域:
中是公知的概念,是指按照不实质性地改变肽的功能的方式,将原氨基酸替换为理化特性类似的其他氨基酸。氨基酸的理化特性由于其侧链不同而被赋予不同特征,保守性替换的一个例子包括替换为具有与原氨基酸属于同一组的侧链的氨基酸。氨基酸根据侧链的结构、性质的不同,可分类为具有碱性侧链的组(赖氨酸、精氨酸、组氨酸等)、具有酸性侧链的组(天冬氨酸、谷氨酸等)、具有非电荷极性侧链的组(天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸等)、具有非极性侧链的组(甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸、色氨酸、半胱氨酸等)。因此,作为保守性替换,可列举出属于上述各组的氨基酸之间的替换。作为保守性替换的非限定例,可列举出例如由赖氨酸与精氨酸、丝氨酸与苏氨酸、谷氨酸与天冬氨酸、谷氨酰胺与天冬酰胺、缬氨酸与亮氨酸与异亮氨酸构成的各组内的氨基酸之间的替换。突变肽是否具有与含细胞结合区的肽同等或更高的靶向能力,可以通过例如没有限定,将带有标记或药物的突变肽或含细胞结合区的肽、或者与含有标记或药物的组合物结合的突变肽或含细胞结合区的肽添加到靶细胞的培养物中,然后将添加了突变肽的靶细胞在规定时间后的标记的存在部位或药物效果与添加了含细胞结合区的肽的情况进行比较来容易地确认。当添加了突变肽时的靶细胞中的标记的量、药物的作用与添加了含细胞结合区的肽时相比为同程度或者增大时,则突变肽具有与含细胞结合区的肽同等或更高的靶向能力。本说明书中,“肽模拟物”是指具有与特定的肽(特别是天然存在的α肽)具有同等的性质或功能的物质、特别是可模仿与特定的肽的侧链的拓扑结构具有同等的官能团的空间配置的物质。作为肽模拟物,没有限定,可列举出例如反转变型肽等。反转变型肽是将具有与基准肽的氨基酸相反的手性的氨基酸(例如基准肽的氨基酸为L体时,为D体的氨基酸)按照与基准肽的氨基酸序列相反的顺序结合而成的,其具有与基准肽同样的侧链的拓扑结构。本发明的靶向分子可以通过用于制造肽或肽模拟物的已知的任意方法、没有限定、例如固相合成法、液相合成法等化学合成法或基因工程合成法等来制造(例如参照N.LeoBenoiton,ChemistryofPeptideSynthesis,CRCPress,2005等)。本发明的另一个侧面涉及一种用于以选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞为靶的靶向剂(或靶向组合物),其含有本发明的靶向分子。本说明书中,“剂”及“组合物”可互换地使用,是指多种成分(例如化合物)的混合物。“剂”及“组合物”可以是用于特定用途的,此时,可适当地含有适于该用途的成分。本发明的靶向剂具有促进与其结合的物质递送至靶细胞的能力(靶向能力)。这里,靶向能力是指与上文所记载的本发明的靶向分子同样的能力、即与不存在靶向剂时相比,将物质迅速且/或大量地递送至靶细胞、且/或摄入的能力。本发明的靶向剂除了本发明的靶向分子外,还可以含有对与递送至靶细胞的物质(例如药物、载体、标记等)的相互作用有用的成分,没有限定,例如连接子等。作为连接子,只要是可将靶向分子与递送物结合则没有特别限定,可以使用已知的任意连接子。作为本发明的靶向剂可含有的连接子的例子,例如Glycine-Glycine-Glycine(三甘氨酸)等的肽连接子、甘油、聚乙二醇、聚丙二醇、乙二醇-丙二醇共聚物、聚乙烯醇、单糖类、多糖类、聚酯、聚醚、聚乳酸等生物降解性聚合物等的非肽连接子等。本发明的另一侧面涉及一种向选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞递送物质的载体,其通过本发明的靶向分子进行靶向。其中,下文中,有时将通过本发明的靶向分子进行靶向的载体称为“靶向载体”、将未通过本发明的靶向分子进行靶向的载体区别地仅称为“载体”。本说明书中,“载体”是指将其担载的1种或2种以上的物质(例如药物、标记等)容易地从身体的1个部分输送到靶细胞或组织、和/或靶细胞内或组织内的物质。载体可以由单一的化合物构成、也可以由多个同种或不同种的化合物构成。优选的方式中,载体可包括能够通过本发明的靶向分子进行靶向的已知的任意载体。作为所述可靶向(即主动靶向)的载体,没有限定,可列举出例如聚合物载体等具有直链状或分枝状的线状结构的载体、或者脂质体、树状物、纳米颗粒、高分子胶束等具有颗粒状结构的载体(颗粒状载体)等(例如MarcucciandLefoulon,DrugDiscovToday.2004Mar1;9(5):219-28、Torchilin,EurJPharmSci.2000Oct;11Suppl2:S81-91等)。载体可以是阳离子性、也可以是非阳离子性(例如阴离子性、中性)。一个方式中,载体为阳离子性。另外,载体还可以是与所担载的物质形成lipoplex或polyplex的载体。lipoplex例如可在阳离子性脂质与具有阴性电荷的物质(例如DNA等核酸)之间形成,polyplex例如可在聚阳离子与具有阴性电荷的物质之间形成。本发明的载体没有限定,例如可以将脂质、聚合物等作为构成成分。作为脂质的非限定例,可列举出甘油磷脂等磷脂、鞘磷脂等鞘脂、胆固醇等甾醇、大豆油、罂粟油等植物油,矿物油,卵黄卵磷脂等卵磷脂类等。作为脂质的更具体的例子,可列举出二肉豆蔻酰磷脂酰胆碱(DMPC)、二棕榈酰磷脂酰胆碱(DPPC)、二硬酯酰磷脂酰胆碱(DSPC)、二油酰磷脂酰胆碱(DOPE)、二亚油酰磷脂酰胆碱(DLPC),胆固醇等甾醇、N-(α-三甲基胺基乙酰基)-二(十二烷基)-D-谷氨酰氯(TMAG)、N,N’,N”,N”’-四甲基-N,N’,N”,N”’-四棕榈基精胺(TMTPS)、2,3-二油烯氧基-N-[2(精胺甲酰胺)乙基]-N,N-二甲基-1-丙烯胺三氟乙酸酯(DOSPA)、N-[1-(2,3-二油烯氧基)丙基]-N,N,N-三甲基氯化铵(DOTMA)、二(十八烷基)二甲基氯化铵(DODAC)、二(十二烷基)溴化铵(DDAB)、1,2-二油烯氧基-3-三甲基胺基丙烷(DOTAP)、3β-[N-(N’,N’-二甲基胺基乙烷)胺基甲酰基]胆固醇(DC-Chol)、1,2-二肉豆蔻酰氧基丙基-3-二甲基羟基乙基铵(DMRIE)、O,O’-二(十四烷基)-N-(α-三甲基胺基乙酰基)二乙醇胺氯化物(DC-6-14)等。脂质可以为阳离子性脂质,也可以为非阳离子性脂质,例如为阴离子性脂质或中性脂质。一个方式中,本发明的载体含有阳离子性脂质。阳离子性脂质对于将具有负电荷的核酸分子等导入细胞内是特别有用的。作为脂质的另一个非限定例,可列举出WO2012/170952中记载的阳离子性脂质及PEG结合脂质(PEG-脂质)、WO2013/185116中记载的可离子化脂质等。所述阳离子性脂质为式I所示的化合物:式中,R1及R2独立地选自由C10~C18烷基、C12~C18链烯基及油烯基组成的组,R3及R4独立地选自由C1~C6烷基、及C2~C6烷醇基组成的组,X选自由-CH2-、-S-及-O-组成的组或不存在,Y选自-(CH2)n、-S(CH2)n、-O(CH2)n-、噻吩基、-SO2(CH2)n-及酯基,n=1~4、a=1~4、b=1~4、c=1~4、Z为抗衡离子。作为所述阳离子性脂质的非限定例,可列举出例如以下的脂质。作为所述PEG-脂质的非限定例,可列举出例如1,2-二肉豆蔻酰基-sn-甘油-3-磷酯酰乙醇胺-N-PEG(PEG-DMPE)、1,2-二棕榈酰基-sn-甘油-3-磷酯酰乙醇胺-N-PEG(PEG-DPPE)、1,2-二硬脂酰-sn-甘油-3-磷酯酰乙醇胺-N-PEG(PEG-DSPE)、1,2-二油酰基-sn-甘油-3-磷酯酰乙醇胺-N-PEG(PEG-DOPE)、PEG神经酰胺等。PEG的分子量没有特别限定,例如可以为约550~约2000、更具体而言,可以为约550、约750、约1000、约1250、约2000等。作为PEG的非限定例,可列举出例如PEG550、PEG750、PEG1000、PEG1250、PEG2000等。所述可离子化脂质为式II所示的化合物或其药学上可容许的盐:式中,n及m独立地为1、2、3或4,R1及R2独立地为C10~C18烷基或C12~C18链烯基,X为-CH2-、S、O、N或不存在,L为C1~4亚烷基、-S-C1~4亚烷基、-O-C1~4亚烷基、-O-C(O)-C1~4亚烷基、-S(O)2-C1~4亚烷基、或作为所述可离子化脂质的非限定例,可举出例如以下的脂质。本发明的载体可以含有1种或2种以上的脂质。一个方式中,本发明的载体含有阳离子性脂质和可离子化脂质。特定方式中,本发明的载体含有阳离子性脂质、可离子化脂质及PEG-脂质。作为本发明的载体中所含的脂质的组合的非限定例,可列举出例如HEDC及S104的组合,HEDC、S104、DOPE、胆固醇及PEG-DMPE的组合,DODC、DOPE、胆固醇及PEG-脂质的组合,HEDODC、DOPE、胆固醇及PEG-脂质的组合,DC-6-14、DOPE及胆固醇的组合等。作为本发明的载体中所含的脂质的组合的特定的非限定例,可列举出例如HEDC:S104(1:1的摩尔比)、HEDC:S104:DOPE:胆固醇:PEG-DMPE(4:4:6:5:1的摩尔比)、DODC:DOPE:胆固醇:PEG-脂质(25:5:19:1的摩尔比)、HEDODC:DOPE:胆固醇:PEG-脂质(25:5:19:1的摩尔比)、DC-6-14:DOPE:胆固醇(4:3:3的摩尔比)等。作为聚合物的非限定例,可列举出以聚乙二醇(PEG)、聚乙烯亚胺(PEI)或聚赖氨酸(例如聚-L-赖氨酸(PLL))等阳离子性聚合物(聚阳离子)、聚乳酸(PLA)、聚羟基乙酸(PGA)、乳酸-羟基乙酸共聚物(PLGA)等非阳离子性聚合物和/或它们的衍生物为基础的聚合物。本发明中,“通过靶向分子进行靶向”是指靶向分子与应诱导至靶细胞的物质(例如载体、药物、标记等递送物)以能够发挥其靶向能力的方式相互作用(例如结合)。作为靶分子与应诱导至靶细胞的物质的相互作用的非限定例,可列举出例如共价结合、离子结合、静电结合、疏水结合、范德华力、抗生物素蛋白-生物素结合等已知的任意化学结合。靶向分子例如可以按照至少和与靶细胞的相互作用相关的部分(例如RPB的环1~3的功能性部分、特别是包含序列号6的氨基酸序列的环2的功能性部分)露出至应诱导至靶细胞的物质的外部的方式存在以能够与靶细胞相互作用。作为使靶向分子的至少和与靶细胞的相互作用相关的部分露出至载体的外部的方法,可列举出例如将靶向分子与应诱导至靶的物质混合、或使靶向分子与应诱导至靶的物质结合等。本发明的靶向载体可以通过1个或2个以上的靶向分子进行靶向。一个方式中,本发明的靶向载体通过对靶向靶细胞有效的量的靶向分子进行靶向。本发明的对靶向靶向载体有效的靶向分子的具体的量(例如相对于载体的构成成分的摩尔比等)例如可以通过使用例2中记载的方法等来研究通过不同量的靶向分子进行靶向的载体的靶向能力等来确定。本发明的对靶向载体的靶向有效的靶向分子的量没有限定,例如相对于载体的构成成分(含有多个构成成分时为主成分),可以为1000:1~1:1000、100:1~1:100、50:1~1:50、40:1~1:40、30:1~1:30、25:1~1:25、20:1~1:20、10:1~1:10、8:1~1:8、6:1~1:6、5:1~1:5、4:1~1:4、3:1~1:3或2:1~1:2的摩尔比。本发明的靶向载体所担载的递送物没有特别限制,优选为能够在生物体内从给予部位物理移动到靶细胞存在的部位的大小。因此,本发明的靶向载体对于原子、化合物、蛋白、核酸等分子自不必说,还可以搬运载体(vector)、病毒颗粒、细胞、由1个以上的要素构成的药物释放系统、微型设备等物体。所述递送物优选具有对靶细胞产生某种影响的性质,包括例如对靶细胞进行标记的物质(例如标记)或对靶细胞的活性或增殖进行控制(例如对其进行增强或抑制)的物质(例如药物)。本发明的靶向载体中的通过靶向分子的靶向可以通过将载体与靶向分子以特定的比例混合、或使靶向分子结合于载体的构成成分等来实现。靶向分子在载体上的结合方法已知有各种方法(例如Torchilin,NatRevDrugDiscov.2005Feb;4(2):145-60、Nobsetal.,JPharmSci.2004Aug;93(8):1980-92、上述MarcucciandLefoulon,2004等)。靶向分子与载体的构成成分的结合可以在载体制备后进行、也可以在载体制备前针对特定的构成成分进行、也可以在载体制备的过程中进行。另外,靶向分子可以与载体的构成成分直接结合、也可以介由连接子结合。本发明的另一侧面涉及一种下式表示的复合物,X-Y-Z(1)式中,X为包含本发明的靶向分子的靶向部分、Y为结合部分Z为包含选自由药物、标记及载体组成的组中的物质的功能性部分。本发明的复合物中的靶向部分可以由本发明的靶向分子构成,也可以为在本发明的靶向分子附着有适于与结合部分结合的连接基团等而成的。靶向部分所含的本发明的靶向分子为了适于与结合部分结合可以以不损害靶向能力的程度进行修饰。适于与特定物质化学结合的连接基团或修饰在本
技术领域:
中是熟知的(例如上述Torchilin,2005、上述Nobsetal.,2004、上述MarcucciandLefoulon,2004等)。另外,靶向部分可以含有单一的靶向分子、也可以含有多个靶向分子。靶向部分含有多个靶向分子时,靶向分子可以相同也可以不同。此外,靶向部分还可以介由单一的结合部分与单一的功能性部分结合,也可以介由单一或多个结合部分与多个功能性部分结合。靶向部分与多个结合部分和/或功能性部分结合时,该结合部分和/或功能性部分可以相同也可以不同。本发明的复合物中的结合部分可以是化学结合、也可以是连接子。化学结合包括共价结合、离子结合、静电结合、疏水结合、范德华力、抗生物素蛋白-生物素结合等已知的任意结合。连接子是能够介由自身通过化学结合将靶向部分与功能性部分结合的化学部分。适于特定的不同的2种物质的化学结合的连接子在本
技术领域:
中是熟知的。作为连接子的非限定例,可列举出例如Glycine-Glycine-Glycine(三甘氨酸)等肽连接子、甘油、聚乙二醇、聚丙二醇、乙二醇-丙二醇共聚物、聚乙烯醇、单糖类、多糖类、聚酯、聚醚、聚乳酸等生物降解性聚合物等非肽连接子等。结合部分可以与单一的靶向部分结合、也可以与多个靶向部分结合。另外,结合部分可以与单一的功能性部分结合、也可以与多个功能性部分结合。当结合部分与多个靶向部分和/或功能性部分结合时,该靶向部分或功能性部分可以相同也可以不同。本发明的复合物中的功能性部分所含的药物没有特别限定,包括与靶细胞相关的任意药物。所述药物可以是与靶细胞本身相互作用的物质、也可以是与靶细胞的周围环境、例如存在于靶细胞周围的非靶细胞或细胞间物质(例如细胞外基质)相互作用的物质。一个方式中,药物是对靶细胞的活性或增殖进行控制(例如抑制、维持或促进)的物质。特定方式中,药物是对靶细胞的活性或增殖进行抑制的物质。作为所述药物的特定的具体例子,没有限定,可列举出TGFβ(Transforminggrowthfactor-beta,转化生长因子β)抑制物质、HGF(Hepatocytegrowthfactor,肝细胞生长因子)或其产生促进物质、PPARγ(Peroxisomeproliferator-activatedreceptorgamma,过氧化物酶体增殖物激活受体γ)配体、血管紧张素抑制物质、PDGF(Platelet-derivedgrowthfactor,血小板衍生生长因子)抑制物质、松弛素或其产生促进物质、抑制细胞外基质成分的产生和/或分泌的物质、细胞活性抑制物质、细胞增殖抑制物质、细胞凋亡诱导物质、促胶原分解物质、促胶原分解物质的抑制物质、PAI-1(Plasminogenactivatorinhibitor-1,纤溶酶源激活物抑制剂-1)抑制物质、α1抗胰蛋白酶抑制物质、血管紧张素原抑制物质等。作为TGFβ抑制物质,没有限定,可列举出例如切断型TGFβII型受体(Qietal.,ProcNatlAcadSciUSA.1999;96(5):2345-9)、可溶性TGFβII型受体(Georgeetal.,ProcNatlAcadSciUSA.1999;96(22):12719-24)、抗TGFβ抗体等TGFβ活性抑制物质、或针对TGFβ的RNAi(RNAinterference)分子、核酶、反义核酸等TGFβ产生抑制物质、表达它们的载体等。一个方式中,TGFβ抑制物质抑制TGFβ1的活性和/或产生。作为HGF或松弛素的产生促进物质,没有限定,可列举出例如对HGF或松弛素进行编码的核酸、包含其的表达构建物、包含它们的表达载体等。作为PPARγ配体,没有限定,可列举出例如15-脱氧-Δ12,14-前列腺素J2、nitrolinoleicacid、氧化LDL(Lowdensitylipoprotein,低密度脂蛋白)、长链脂肪酸、类花生酸等内因性配体、或曲格列酮、吡格列酮、罗格列酮、巴格列酮、来格列酮等噻唑烷二酮系药剂、非甾体性抗炎症药等外因性配体等。作为血管紧张素抑制物质,没有限定,可列举出例如替米沙坦、氯沙坦、缬沙坦、坎地沙坦酯、奥美沙坦酯、伊贝沙坦等血管紧张素受体拮抗物质等。血管紧张素中包括血管紧张素I、II、III及IV。另外,作为血管紧张素受体,没有限定,可列举出例如血管紧张素1型受体(AT1)等。作为PDGF抑制物质,没有限定,可列举出例如抗PDGF抗体等PDGF活性抑制物质、或针对PDGF的RNAi分子、核酶、反义核酸等PDGF产生抑制物质、表达它们的载体(vector)等。作为抑制细胞外基质成分的产生和/或分泌的物质,没有限定,可列举出例如抑制胶原、蛋白多糖、细胞粘合素、纤连蛋白、血小板反应蛋白、骨桥蛋白、骨粘连蛋白、弹性蛋白等细胞外基质成分的表达的RNAi分子、核酶、反义核酸等物质、或显性失活突变物等具有显性失活效果的物质、表达它们的载体等。作为抑制胶原的产生/分泌的药物,没有限定,可列举出例如各种类型的胶原的合成过程中共同的细胞内输送及分子成熟所必需的胶原特异性分子伴侣即HSP(Heatshockprotein,热休克蛋白)47的抑制物质、例如针对HSP47的RNAi分子(例如WO2011/072082中记载的siRNA分子等)、核酶、反义核酸等HSP47表达抑制物质、或HSP47的显性失活突变物等具有显性失活效果的物质、表达它们的载体等。作为细胞增殖抑制物质,没有限定,可列举出例如烷化剂(例如异环磷酰胺、尼莫司汀、环磷酰胺、达卡巴嗪、美法仑、雷莫司汀等)、抗肿瘤性抗生物质(例如依达比星、表柔比星、柔红霉素、阿霉素、吡柔比星、博来霉素、培洛霉素、米托蒽醌、丝裂霉素C等)、抗代谢剂(例如吉西他滨、依诺他滨、阿糖胞苷、替加氟·尿嘧啶、替加氟·吉莫斯特·氧嗪酸钾配合剂、去氧氟尿苷、羟基脲、氟尿嘧啶、氨甲喋呤、巯基嘌呤等)、依托泊甙、伊立替康、长春瑞滨、多西他赛、紫杉醇、长春新碱、长春地辛、长春碱等生物碱,以及铂尔定、顺铂、奈达铂等铂络合物、洛伐他汀、辛伐他汀等他汀等。作为细胞活性抑制物质,没有限定,可列举出例如阿米洛利等钠通道抑制物质等。作为细胞凋亡诱导剂,没有限定,可列举出例如compound861、胶霉毒素、阿托伐他汀等。作为促胶原分解物质,没有限定,可列举出例如各种胶原酶或其产生促进物质等。作为胶原酶的例子,没有限定,例如MMP(Matrixmetalloproteinase,基质金属蛋白酶)1、2、3、9、13、14等MMP家族等。作为胶原酶的产生促进物质,没有限定,可列举出例如对胶原酶进行编码的核酸、包含其的表达构建物、包含它们的表达载体等。作为促胶原分解物质的抑制物质,没有限定,可列举出例如TIMP(Tissueinhibitorofmetalloproteinase即基质金属蛋白酶抑制剂、TIMP1及TIMP2等)。因此,作为对该物质进行抑制的物质,没有限定,可列举出例如抗TIMP的抗体等TIMP活性抑制物质、针对TIMP的RNAi分子(例如WO2012/044620中记载的siRNA分子等)、核酶、反义核酸等TIMP产生抑制物质、表达它们的载体等。作为PAI-1抑制物质,没有限定,可列举出例如针对PAI-1的抗体等PAI-1活性抑制物质、针对PAI-1的RNAi分子、核酶、反义核酸等PAI-1产生抑制物质、表达它们的载体等。作为α1抗胰蛋白酶抑制物质,没有限定,可列举出例如抗α1抗胰蛋白酶的抗体等PAI-1活性抑制物质、针对α1抗胰蛋白酶的RNAi分子、核酶、反义核酸等α1抗胰蛋白酶产生抑制物质、表达它们的载体等。作为血管紧张素原抑制物质,没有限定,可列举出例如抗血管紧张素原的抗体等血管紧张素原活性抑制物质、针对血管紧张素原的RNAi分子、核酶、反义核酸等血管紧张素原产生抑制物质、表达它们的载体等。本说明书中,RNAi分子是指具有RNAi活性的任意分子,例如没有限定,包含siRNA(smallinterferingRNA,小干扰RNA)、miRNA(microRNA,微小RNA)、shRNA(shorthairpinRNA,短发卡RNA)、ddRNA(DNA-directedRNA,DNA导向RNA)、piRNA(Piwi-interactingRNA,Piwi蛋白相互作用RNA)、rasiRNA(repeatassociatedsiRNA,重复相关siRNA)等RNA及它们的改性体。另外,本说明书中的核酸包括RNA、DNA、PNA或它们的复合物。本说明书中,标记是指可使其本身或带有其的物质被直接或间接地检测到的任意物质。标记可以选自本领域技术人员公知的任意标记、例如气体或在生理条件下产生气体的物质、任意的放射性同位素、磁性体、发生核磁共振的元素(例如氢、磷、钠、氟等)、对发生核磁共振的元素的弛豫时间产生影响的物质(例如金属原子或含有其的化合物)、与标记化物质结合的物质(例如抗体)、荧光物质、荧光团、化学发光物质、酶、生物素或其衍生物、抗生物素蛋白或其衍生物等。本说明书中,标记只要是可检测到的即可,其中包括可通过已知的任意检测手段检测到的任意标记。作为检测方法,没有限定,可列举出例如利用肉眼、光学检査装置(例如光学显微镜、荧光显微镜、相位差显微镜、体内成像装置等)、X射线装置(例如单纯X射线装置、CT(计算机断层摄影)装置等)、MRI(磁共振成像)装置、核医学检査装置(闪烁扫描装置、PET(positronemissiontomography,正电子发射断层成像)装置、SPECT(singlephotonemissioncomputedtomography,单光子发射计算机断层成像)装置等)、超声检査装置及温度记录装置的方法等。适于各检测方法的标记是本领域技术人员已知的,例如在Lecchietal.,QJNuclMedMolImaging.2007;51(2):111-26等中有记载。作为适于使用肉眼及光学检査装置检测的标记,可列举出例如各种荧光标记及发光标记。作为具体的荧光标记,没有限定,可列举出例如可以使用CyTM系列(例如CyTM2、3、5、5.5、7等)、DyLightTM系列(例如DyLightTM405、488、549、594、633、649、680、750、800等)、AlexaFluor(R)系列(例如AlexaFluor(R)405、488、549、594、633、647、680、750等)、HiLyteFluorTM系列(例如HiLyteFluorTM488、555、647、680、750等)、ATTO系列(例如ATTO488、550、633、647N、655、740等)、FAM、FITC、TexasRed、GFP、RFP、Qdot等。作为适于体内成像的荧光标记,可列举出例如生物体透过性高、发出不易受到自身荧光影响的波长、例如近红外波长的荧光的标记、或荧光强度强的标记。作为所述荧光标记,没有限定,可列举出例如CyTM系列、DyLightTM系列、AlexaFluor(R)系列、HiLyteFluorTM系列、ATTO系列、TexasRed、GFP、RFP、Qdot及它们的衍生物等。作为具体的发光标记,没有限定,例如可以使用鲁米诺、荧光素、光泽精(lucigenin)、水母素等。作为适于使用X射线装置检测的标记,可列举出例如各种造影剂。作为具体的造影剂,没有限定,例如可以使用碘原子、碘离子、含碘化合物等。作为适于使用MRI装置检测的标记,可列举出例如发生核磁共振的元素或对发生核磁共振的元素的弛豫时间产生影响的物质等。发生核磁共振的元素包括例如氢、磷、钠、氟等。作为对发生核磁共振的元素的弛豫时间产生影响的物质,没有限定,可列举出各种金属原子或含有1种或2种以上的该金属原子的化合物、例如1种或2种以上的该金属原子的络合物等。具体而言,没有限定,例如可以使用钆(III)(Gd(III))、钇-88(88Y)、铟-111(111In)、及它们与二亚乙基三胺五乙酸(DTPA)、四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)、(1,2-乙二基二次氮基)四乙酸(EDTA)、乙二胺、2,2’-二吡啶(bipy)、1,10-菲咯啉(phen)、1,2-双(二苯基膦基)乙烷(DPPE)、2,4-乙酰丙酮(acac)、草酸盐(ox)等配位体的络合物、超常磁性氧化铁(SPIO)、氧化锰(MnO)等。作为适于使用核医学检査装置检测的标记,可列举出例如各种放射性同位素或含有1种或2种以上的该放射性同位素的化合物、例如1种或2种以上的该放射性同位素的络合物等。作为放射性同位素,没有限定,例如可以使用锝-99m(99mTc)、铟-111(111In)、碘-123(123I)、碘-124(124I)、碘-125(125I)、碘-131(131I)、铊-201(201Tl)、碳-11(11C)、氮-13(13N)、氧-15(15O)、氟-18(18F)、铜-64(64Cu)、镓-67(67Ga)、氪-81m(81mKr)、氙-133(133Xe)、锶-89(89Sr)、钇-90(90Y)等。另外,作为含有放射性同位素的化合物,没有限定,可列举出例如123I-IMP、99mTc-HMPAO、99mTc-ECD、99mTc-MDP、99mTc-替曲膦、99mTc-MIBI、99mTcO4-、99mTc-MAA、99mTc-MAG3、99mTc-DTPA、99mTc-DMSA、18F-FDG等。作为适于使用超声检査装置检测的标记,没有限定,可列举出例如生物体容许性的气体或在生理条件下产生气体的物质、脂肪酸或含有这些物质的物质。作为气体,没有限定,可列举出例如空气、稀有气体(noblegas)、氮、N2O、氧、二氧化碳、氢、不活性稀有气体(例如氦、氩、氙或氪)、氟化硫(例如六氟化硫、十氟化二硫、三氟甲基五氟化硫)、六氟化硒、卤代硅烷(例如四甲基硅烷)、低分子烃(例如C1~7烷烃(甲烷、乙烷、丙烷、丁烷、戊烷等)、环烷烃(环丁烷、环戊烷等)、链烯(乙烯、丙烯、丁烯等)等)、含氟气体、氨等,作为在生理条件下产生气体的物质,没有限定,可列举出例如十二氟戊烷(DDFP)、在生理条件下气化的全氟化碳(日本特开2010-138137)等,作为含有上述物质的物质,可列举出含有上述物质的纳米颗粒、脂质体等。作为含氟气体,没有限定,可列举出例如卤代烃气体(例如溴氯二氟甲烷、氯二氟甲烷、二氯二氟甲烷、溴三氟甲烷、氯三氟甲烷、氯五氟乙烷、二氯四氟乙烷、全氟化碳)、氟化酮(例如全氟丙酮等)、氟化醚(例如全氟二乙基醚等)等。作为全氟化碳,没有限定,可列举出例如全氟烷烃(例如全氟甲烷、全氟乙烷、全氟丙烷、全氟丁烷、全氟-正丁烷、全氟戊烷、全氟己烷、全氟庚烷等)、全氟链烯(例如全氟丙烯、全氟丁烯(例如全氟丁-2-烯等)、全氟丁二烯等)、全氟炔烃(例如全氟丁-2-炔等)、全氟环烷烃(例如全氟环丁烷、全氟甲基环丁烷、全氟二甲基环丁烷、全氟三甲基环丁烷、全氟环戊烷、全氟甲基环戊烷、全氟二甲基环戊烷、全氟环己烷、全氟甲基环己烷、全氟环庚烷等)等。作为适于使用超声检査装置检测的标记,还可以使用已市售的标记。作为市售的超声检査用标记,没有限定,可列举出例如第1代的Albunex(Mallinckrodt)、Echovist(SHU454、Schering)、Levovist(SHU508、Schering)、Myomap(Quadrant)、Quantison(Quadrant)、Sonavist(Schering)、Sonazoid(GEHealthcare)等、第2代的Definity/luminity(Bristol-MyersSquibbMedicalImaging)、Imagent-imavist(Alliance)、Optison(GEHealthcare)、biSphere/cardiosphere(POINTBiomedical)、SonoVue(BR1,Bracco)、AI700/imagify(Acusphere)等、第3代的Echogen(SonusPharmaceuticals)等(Reddyetal.,WorldJGastroenterol.2011Jan7;17(1):42-8)。另外,适于使用超声检査装置检测的标记除上述标记以外,在日本特开平5-194278、日本特开平8-310971、日本特开平8-151335、日本特开2002-308802、WO2004/069284、WO2005/120587等中也有记载。本发明的复合物的功能性部分所含的标记没有特别限定,可以从上述任意的标记中选择。另外,本发明的复合物的功能性部分所含的药物可以用上述任意的标记进行标记。本发明的复合物的功能性部分所含的载体也没有特别限定,可以从上述任意的载体中选择。该载体可以担载有上述1种或2种以上的药物和/或标记。本发明的复合物的功能性部分所含的药物、标记和/或载体为了适于与结合部分结合,可以以不损害其功能的程度进行修饰。适于与特定的物质化学结合的修饰在本
技术领域:
中是熟知的。作为所述修饰的非限定例,可列举出例如用于形成二硫键的修饰(例如硫醇化等)、用于点击化学的修饰(例如叠氮化、炔烃化等)、用于形成抗生物素蛋白-生物素结合的修饰(例如抗生物素蛋白化、生物素化等)等。功能性部分可以含有单一的标记、药物或载体,也可以含有多个标记、药物或载体或者它们的组合。当功能性部分含有多个标记、药物或载体时,它们可以相同也可以不同。另外,功能性部分上可以介由单一的结合部分结合有单一的靶向部分,也可以介由单一或多个结合部分结合有多个靶向部分。当功能性部分与多个结合部分和/或靶向部分结合时,该结合部分和/或靶向部分可以相同也可以不同。一个方式中,本发明的复合物具有化合物的形态。作为具有化合物的形态的本发明的复合物的非限定例,可列举出例如靶向分子介由(或不介由)连接子与标记化合物或治疗化合物、或者结合有标记化合物和/或治疗化合物的载体化合物(例如聚合物)结合而成的复合物等。另一方式中,本发明的复合物具有组合物的形态。作为具有组合物的形态的本发明的复合物的非限定例,可列举出例如靶向分子介由(或不介由)连接子与结合有标记化合物或治疗化合物的载体组合物(例如脂质体)结合而成的组合物等。本发明的另一侧面涉及一种组合物,其含有选自由本发明的靶向分子、靶向剂、靶向载体及复合物组成的组中的成分。本发明的组合物除了本发明的靶向分子、靶向剂、靶向载体和/或复合物以外,还可以包含追加的成分、例如适于其用途的成分(例如药物等活性成分、或标记、赋形剂等添加剂等)。本发明的组合物可以是用于疾病处置的医药组合物。本发明的医药组合物可以含有1种或2种以上的药学上可容许的添加物(例如表面活性剂、载体、稀释剂、赋形剂等)。药学上可容许的添加物在医药领域中是熟知的,例如Remington'sPharmaceuticalSciences,18thEd.,MackPublishingCo.,Easton,PA(1990)等中有记载,将其整体援引于本说明书中。本发明的复合物及组合物由于能够向选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞或其附近特异性地递送药物等,因此能够用于与该靶细胞相关的疾病、例如纤维化或肿瘤性疾病的处置。用于所述用途时,本发明的复合物及组合物含有对该疾病进行处置的药物、例如抑制靶细胞的活性或增殖的药物。有时将用于所述用途的本发明的复合物及组合物也称为处置用化合物或处置剂(或处置用组合物)。本说明书中,“处置”包含以疾病的治愈、暂时的缓解或预防等为目的的医学上可容许的全部种类的预防和/或治疗性的介入。例如,本说明书中的“处置”包括包含与靶细胞相关的疾病进展的延迟或停止、病变的退缩或消失、该疾病发病的预防或复发的防止等各种目的的医学上可容许的介入。因此,本发明的处置用化合物或处置剂包括用于对与靶细胞相关的疾病进行治疗的治疗用化合物或治疗剂(或治疗用组合物)、及用于对与靶细胞相关的疾病进行预防的预防用化合物或预防剂(或预防用组合物)。作为与星状细胞相关的疾病,没有限定,可列举出例如肝纤维化、肝硬化、胰纤维化、声带瘢痕形成、声带粘膜纤维化、喉的纤维化等纤维化(参照专利文献1)。作为与肌成纤维细胞相关的疾病,没有限定,可列举出例如肝纤维化、肝硬化、声带瘢痕形成、声带粘膜纤维化、喉的纤维化、肺纤维化、胰纤维化、骨髓纤维化、心肌梗塞、心肌梗塞后的心肌纤维化、心肌纤维化、心内膜心肌纤维化、脾纤维化、隔膜纤维化、舌粘膜下纤维化、肠道纤维化(例如伴有炎症性肠疾病的肠道纤维化等)、后腹膜纤维化、子宫纤维化、硬皮病、乳腺纤维化等各种脏器纤维化。作为与癌相关成纤维细胞相关的疾病,没有限定,可列举出例如脑肿瘤、头颈部癌、乳腺癌、肺癌、食道癌、胃癌、十二指肠癌、阑尾癌、结肠癌、直肠癌、肝癌、胰腺癌、胆囊癌、胆管癌、肛门癌、肾癌、尿管癌、膀胱癌、前列腺癌、阴茎癌、睾丸癌、子宫癌、卵巢癌、外阴癌、阴道癌、皮肤癌、纤维肉瘤、恶性纤维组织细胞瘤、脂肪肉瘤、横纹肌肉瘤、平滑肌肉瘤、血管肉瘤、kaposi肉瘤、淋巴管肉瘤、滑膜肉瘤、软骨肉瘤、骨肉瘤等实体癌。作为与肿瘤细胞相关的疾病,没有限定,可列举出例如身体的任意部位、例如脑、头颈部、胸部、四肢、肺、心脏、胸腺、食道、胃、小肠(十二指肠、空肠、回肠)、结肠(结肠、盲肠、阑尾、直肠)、肝脏、胰脏、胆囊、肛门、肾、尿管、膀胱、前列腺、阴茎、睾丸、子宫、卵巢、外阴、阴道、皮肤、横纹肌、平滑肌、滑膜、软骨、骨、甲状腺、肾上腺、腹膜、肠系膜、骨髓、血液、血管系、淋巴节等淋巴系等的任意的良性肿瘤及恶性肿瘤等肿瘤性疾病。作为恶性肿瘤的非限定例,可列举出纤维肉瘤、恶性纤维组织细胞瘤、脂肪肉瘤、横纹肌肉瘤、平滑肌肉瘤、血管肉瘤、kaposi肉瘤、淋巴管肉瘤、滑膜肉瘤、软骨肉瘤、骨肉瘤等肉瘤、脑肿瘤、头颈部癌、乳腺癌、肺癌、食道癌、胃癌、十二指肠癌、阑尾癌、结肠癌、直肠癌、肝癌、胰腺癌、胆囊癌、胆管癌、肛门癌、肾癌、尿管癌、膀胱癌、前列腺癌、阴茎癌、睾丸癌、子宫癌、卵巢癌、外阴癌、阴道癌、皮肤癌等癌瘤、以及白血病、恶性淋巴瘤等。作为与STRA6表达细胞相关的疾病,除了上述与肿瘤细胞相关的疾病以外,还可列举出与选自由RPE细胞、支持细胞、星状细胞组成的组中的细胞相关的疾病、例如色素性视网膜炎、老年性黄斑变性、支持细胞瘤、星状细胞瘤等。本发明的复合物及组合物可以用于对选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞的活性或增殖进行控制(例如抑制、维持或促进),此时,其含有对靶细胞的活性或增殖进行抑制的药物。本发明的靶向分子、靶向剂、靶向载体、复合物及组合物可以用于向选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞递送物质。被递送的物质没有特别限定,例如包括上述本发明的靶向载体可担载的递送物、或本发明的复合物的功能性部分所含的上述药物或本说明书中记载的标记等。物质的递送可以在体外或体内进行。本发明的复合物及组合物由于能够向选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞递送标记,因此能够用于对该靶细胞或包含该细胞的组织进行标记。有时将用于所述用途的本发明的复合物及组合物也称为标记用化合物或标记剂(或标记用组合物)。本发明的标记用化合物或标记剂包含标记。标记的非限定例包括上述示出的例子。本发明的标记用化合物或标记剂可以用于上述靶细胞或包含该细胞的组织的检测或成像。有时将用于所述用途的本发明的标记剂也特别地称为检测用化合物或检测剂(或检测用组合物)、或者成像用化合物或成像剂(或成像用组合物)。细胞或组织的标记、检测或成像可以在体外或体内进行。另外,细胞或组织的检测或成像可以非破坏性地、优选非侵袭性地进行。这里,“非破坏性地”是指不破坏作为检测或成像对象的组织,例如,当作为对象的组织为肝脏时,虽然包括开腹使肝脏露出、或利用内窥镜获得肝脏表面的图像等,但不包括将肝脏切开对其内部进行探查。另外,“非侵袭性地”是指不有意地对生物体造成伤害地对检测剂或成像剂中所含的标记进行检测,典型地包括从生物体外进行检测,也包括从口腔、鼻腔、肛门、尿道、耳道、阴道等天然的开口部插入内窥镜或超声探针等检测器进行检测。本发明的标记用化合物或标记剂可以用于与靶细胞相关的疾病的检査或诊断。例如,已知星状细胞或肌成纤维细胞在纤维化的病灶中增殖,因此若在某组织中检测到的标记的量越多,则其中存在的星状细胞或肌成纤维细胞也越多,可作为该组织受纤维化侵扰的指标(例如参照专利文献7)。另外,癌相关成纤维细胞或肿瘤细胞由于局部存在于癌组织或肿瘤组织中,因此若在对象身体的特定部位检测到大量标记,则可作为该部位存在癌或肿瘤的指标。有时将用于所述用途的本发明的标记用化合物或标记剂也特别地称为检査用化合物或检査剂(或检査用组合物)、或者诊断用化合物或诊断剂(或诊断用组合物)。这里,疾病的检査虽然包括例如将测定得到的指标(例如来自标记剂的信号强度)与规定的基准(例如规定的临界值)比较、然后基于此给出与疾病相关的检査结果(例如阳性或阴性的检査结果)等,但不包括对疾病进行确定。因此,疾病的检査无需医生的判断。而疾病的诊断包括医生基于各种信息对疾病进行确定。本发明的标记用化合物或标记剂还可用于与靶细胞相关的疾病的监测。有时将用于所述用途的本发明的标记用化合物或标记剂也特别地称为监测用化合物或监测剂(或监测用组合物)。这里,疾病的监测是指对特定对象的疾病的推移、例如疾病的缓和、恶化、持续等进行经时监测。当靶细胞在特定疾病中显示特征性表现时,例如没有限定,当靶细胞在特定疾病中异常地增殖时,本发明的检测用化合物、检测剂、成像用化合物及成像剂还可以用于该疾病的检査、诊断或监测。所述特定疾病包括与靶细胞相关的疾病。因此,本发明的检测用化合物、检测剂、成像用化合物及成像剂有时成为本发明的检査用化合物、检査剂、诊断用化合物、诊断剂、监测用化合物或监测剂的一个方式。本发明的标记用化合物或标记剂还可以用于对处置与靶细胞相关的疾病的效果进行评价。有时将用于所述用途的本发明的标记用化合物或标记剂也特别地称为评价用化合物或评价剂(或评价用组合物)。本发明的复合物及组合物可以通过包括经口及非经口这两者的各种路径给予,例如没有限定,可列举出经口、静脉内、肌肉内、皮下、局部、直肠、动脉内、门静脉内、心室内、经粘膜、经皮、鼻内、腹腔内、肺内及子宫内等路径,也可以制成适于各给予路径的剂型。所述剂型及制剂方法可以适当采用任意的公知的剂型及制剂方法(例如参照标准药剂学、渡辺喜照等编、南江堂、2003年、Remington'sPharmaceuticalSciences,18thEd.,MackPublishingCo.,Easton,PA(1990)等)。例如作为适于经口给予的剂型,没有限定,可列举出散剂、颗粒剂、片剂、胶囊剂、液剂、悬浮剂、乳剂、凝胶剂、糖浆剂等,另外作为适于非经口给予的剂型,可列举出溶液性注射剂、悬浮性注射剂、乳浊性注射剂、用时制备型注射剂等注射剂。非经口给予用制剂可以是水性或非水性的等渗性无菌溶液或悬浮液的形态。本发明的复合物及组合物可以以任意的形态供给,从保存稳定性的观点出发,可以以可用时制备的形态,例如以在医疗现场或其附近可由医生和/或药剂师、护士或其他医学辅助人员等制备的形态提供。此时,本发明的复合物及组合物以1个或2个以上的含有其所需的构成要素中的至少1个的容器的形式提供,在使用之前、例如24小时前以内、优选3小时前以内、进一步优选在马上要使用之前制备。在进行制备时,可以适当使用在进行制备的场所通常可获得的试剂、溶剂、调剂器具等。本发明的另一个侧面还涉及本发明的靶向载体、复合物或组合物、或者包含其构成要素的用于制备本发明的靶向载体、复合物及组合物、用于向靶细胞递送物质、用于对靶细胞的活性或增殖进行控制、用于对与靶细胞相关的疾病进行处置、检査、诊断或监测、用于对靶细胞或包含其的组织进行标记、监测或成像、用于对与处置靶细胞相关的疾病的效果进行评价的试剂盒或试剂包、以及这样的以试剂盒或试剂包形式提供的本发明的靶向载体、复合物或组合物或其必要构成要素。本发明的试剂盒或试剂包中所含的本发明的靶向载体、复合物或组合物的各构成要素如在上文有关本发明的靶向载体、复合物或组合物的内容中已记载的。本试剂盒除上述外,还可以包含有关本发明的靶向载体、复合物或组合物的制备方法、使用方法(例如给予方法等)等的指示、例如使用说明书、记录有有关使用方法的信息的介质、例如软盘、CD、DVD、蓝光光盘、存储卡、USB存储器等。另外,本发明的试剂盒或试剂包虽然可以包含用于完成本发明的靶向载体、复合物或组合物的全部构成要素,但也可不必包含全部构成要素。因此,本发明的试剂盒或试剂包可以不包含在医疗现场、实验机构等通常可获得的试剂或溶剂、例如无菌水、生理盐水、葡萄糖溶液等。本发明的另一侧面涉及一种对选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞的活性或增殖进行控制的方法,该方法包括将含有对所述靶细胞的活性或增殖进行控制的药物的有效量的本发明的复合物或组合物给予需要它的对象、或者细胞或组织的工序。这里,靶细胞的活性或增殖的控制包括该活性或增殖的抑制、维持或促进。因此,上述方法中的有效量是指例如可对靶细胞的活性或增殖进行抑制、维持或促进的量。靶细胞的活性或增殖的维持包括在靶细胞的活性或增殖经时地得到抑制或促进的状态下将该活性或增殖维持到初始的状态。待给予本发明的复合物或组合物的细胞或组织典型地包括靶细胞,可以存在于生物体内、也可以存在于生物体外。因此,包含将本发明的复合物或组合物给予细胞或组织的工序的上述方法包括在体外(invitro)、离体(exvivo)或体内(invivo)进行。本发明的另一侧面涉及一种对与选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞相关的疾病进行处置的方法,该方法包含将含有对所述疾病进行处置的药物的有效量的本发明的复合物或组合物给予需要它的对象的工序。这里,有效量例如是指预防该疾病的发症及再发、或者治愈该疾病的量。与靶细胞相关的疾病及对其进行处置的药物如在上文有关本发明的处置用化合物及处置剂的内容中已记载的。本发明的另一侧面涉及一种对选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞或包含该靶细胞的组织进行标记、监测或成像的方法,该方法包含将含有标记的有效量的本发明的复合物或组合物给予需要它的对象、或者细胞或组织的工序。这里,有效量是指例如可检测到靶细胞或靶组织地进行标记的量。另外,作为所述方法中的标记,例如可以使用本说明书中记载的标记。待给予本发明的复合物或组合物的细胞或组织可以包括靶细胞,可以存在于生物体内、也可以存在于生物体外。因此,包含将本发明的复合物或组合物给予细胞或组织的工序的上述方法包括在体外、离体或体内进行。本发明的另一侧面涉及一种对与选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞相关的疾病进行检査、诊断或监测方法,该方法包含将含有标记的有效量的本发明的复合物或组合物给予需要它的对象的工序。这里,有效量是指例如可检测到靶细胞或靶组织地进行标记的量。另外,作为所述方法中的标记,例如可以使用本说明书中记载的标记,与靶细胞相关的疾病为在上文有关本发明的处置用化合物及处置剂的内容中已记载的。当靶细胞在该疾病中显示特征性表现时,例如没有限定,当靶细胞在特定疾病中异常地增殖时,与靶细胞相关的疾病的检査、诊断或监测还可以通过用含有标记的有效量的本发明的复合物或组合物对靶细胞进行检测或成像来进行。本发明的另一侧面涉及一种对处置与选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞相关的疾病的效果进行评价的方法,该方法包含将含有标记的有效量的本发明的复合物或组合物给予需要它的对象的工序。这里,有效量是指例如可检测到靶细胞或靶组织地进行标记的量。另外,作为所述方法中的标记,例如可以使用本说明书中记载的标记,与靶细胞相关的疾病如在上文有关本发明的处置用化合物及处置剂的内容中已记载的。本发明的另一侧面涉及一种向选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞及STRA6表达细胞组成的组中的靶细胞递送物质的方法,该方法包含将所述物质通过本发明的靶向分子、靶向剂或靶向载体进行靶向的工序、将经靶向的所述物质给予包括对象、或靶细胞的介质的工序。所递送的物质没有特别限定,可列举出例如含有标记、药物、标记和/或药物的载体等。本发明的递送方法包括在体外、离体或体内进行。本发明的各种方法中的本发明的复合物或组合物的有效量优选不带来超过通过给予所带来的好处的不良影响。本发明的各种方法中的本发明的复合物或组合物的有效量可基于使用了培养细胞等的体外试验、小鼠、大鼠、狗或猪等实验动物、疾病动物模型中的试验来适当确定,这样的试验方法是本领域技术人员所熟知的。本发明的方法中给予对象的复合物或组合物的具体用量可在考虑有关需要给予的对象的各种条件、例如靶的种类、方法的目的、治疗内容、疾病的种类、症状的严重程度、对象的一般健康状态、年龄、体重、对象的性别、饮食、给予的时间及频率、并用的药物、对治疗的反应性及对治疗依从性等来确定。本发明的复合物或组合物的1日总给予量没有限定,例如可以为约1μg/kg~约1000mg/体重kg、约10μg/kg~约100mg/体重kg、约100μg/kg~约10mg/体重kg。或者,可以基于患者的表面积来计算给予量。作为给予路径,包括经口及非经口这两者的各种路径、例如包括经口、静脉内、肌肉内、皮下、局部、直肠、动脉内、门静脉内、心室内、经粘膜、经皮、鼻内、腹腔内、肺内及子宫内等路径。给予频率根据所使用的制剂或组合物的性状、如上所述的对象的条件的不同而不同,例如可以为1日多次(即1日2、3、4次或5次以上)、1日1次、数日(即2、3、4、5、6、7日等)1次、1周数次(例如1周2、3、4次等)、1周1次、数周(即2、3、4周等)1次。本发明的标记、检测、成像、检査、诊断、监测和/或评价方法可进一步包含对含有标记的本发明的复合物或组合物中所含的标记进行检测的工序。标记可以在检测时含有在复合物或组合物中,也可以与其分离地存在。标记的检测可通过利用可检测出标记的任意方法来进行,例如没有限定,可列举出肉眼、光学检査装置(例如光学显微镜、荧光显微镜、相位差显微镜、体内成像装置等)、X射线装置(例如单纯X射线装置、CT(计算机断层摄影)装置等)、MRI(磁共振成像)装置、核医学检査装置(闪烁扫描装置、PET装置、SPECT装置等)、超声检査装置及温度记录装置的方法等。适于各检测方法的标记是本领域技术人员已知的(例如参照上述Lecchietal.,2007等),非限定的例子如在上文中所记载的。一个方式中,在体内对靶细胞进行检测或成像。所述检测或成像没有限定,可以使用光学检査装置(例如体内成像装置等)、X射线装置(例如单纯X射线装置、CT(计算机断层摄影)装置等)、MRI(磁共振成像)装置、核医学检査装置(闪烁扫描装置、PET装置、SPECT装置等)、超声检査装置及温度记录装置等适于体内检测的任意装置,适于所述检测的标记也是本领域技术人员已知的(例如参照上述Lecchietal.,2007等)。通过在体内对靶细胞进行检测或成像,能够确定靶细胞的存在部位(例如脏器或器官)、与靶细胞相关的疾病的病灶。因此,本发明还涉及一种确定靶细胞的存在部位和/或与靶细胞相关的疾病的病灶的方法,其包含将含有标记的本发明的复合物或组合物的有效量给予需要它的对象。所述方法可有助于与靶细胞相关的疾病的诊断。另外,通过在体外或体内对标记进行检测,还能够获得靶细胞的数量、分布等有助于与靶细胞相关的疾病的诊断的信息。因此,本发明还涉及一种帮助与靶细胞相关的疾病的诊断的方法,其包含将含有标记的本发明的复合物或组合物的有效量给予需要它的对象。该方法进一步包含将有助于与靶细胞相关的疾病的诊断的信息提供给医生的工序。本发明的与靶细胞相关的疾病的检査及诊断方法、及帮助与靶细胞相关的疾病的诊断的方法还可以进一步包含将对象的标记的检测结果与作为基准的标记的检测结果进行比较的工序。作为基准的标记的检测结果例如可以是已知不具有与靶细胞相关的疾病的对象(也称为“阴性对象”)的标记的检测结果(也称为“阴性基准”)、或已知具有与靶细胞相关的疾病的对象(也称为“阳性对象”)的标记的检测结果(也称为“阳性基准”)。作为基准的标记的检测结果可以是多个阴性对象或阳性对象的检测结果的平均值或中央值。因此,本发明的与靶细胞相关的疾病的检査方法还可以进一步包含例如当对象的标记的检测结果与阴性基准为同等(例如与其不具有显著差异)时给出阴性检査结果的工序、和/或当对象的标记的检测结果显著超过阴性基准时给出阳性的检査结果的工序、和/或当对象的标记的检测结果与阳性基准为同等(例如与其不具有显著差异)时给出阳性检査结果的工序等。本发明的检测、成像、检査、诊断、监测和/或评价方法中的标记的检测结果可以为所检测的标记的信号强度和/或信号分布。这里,标记的信号强度是指由标记发出的各种信号、例如荧光信号、发光信号、磁性信号、放射性信号等的强度或与其类似的测定值,典型地可通过适当的检测手段进行测定。检测手段的具体例子如上文所述。信号强度可以是从对象整体获得的,也可以是从对象的特定部位或区域获得的。另外,信号强度可以是所测定部位的面积或体积的平均值,也可以是累积值。信号强度经时地发生变化时,本方法的信号强度可以是某个特定时点的强度,也可以是某个期间累积的强度。随着疾病的进展,靶细胞的数量、活性等增大时,信号强度的增大可作为疾病存在或进展的指标、相反信号强度的降低可作为疾病改善的指标。标记的信号分布是指从标记发出的信号的有关对象的位置的信息,其可以是2维的信号分布,也可以是3维的信号分布。通过将信号分布与解剖学上的脏器的位置关系、或CT像、MRI像、超声图像等组织的结构信息相对照,能够确定信号是由哪个组织发出的。当信号分布经时地发生变化时,本方法的信号分布可以是某个特定时点的分布,也可以是某个期间累积的分布。当随着疾病的进展靶细胞的存在区域扩大时,信号分布的扩大可作为疾病存在或进展的指标,相反信号分布的缩小可作为疾病改善的指标。本发明的方法中也可以对信号强度和信号分布组合地进行评价。通过对检测到了哪个位置哪种程度的强度的信号进行评价,能够进行更精确的判定、提供更准确的信息。本发明的监测方法还可以进一步包含将第1时点的标记的检测结果与比第1时点靠后的第2时点的标记的检测结果进行比较。例如,当检测结果为有关靶细胞的数量的指标(例如来自被摄入到靶细胞内的标记的信号强度、信号分布等)时,若第2时点的指标比第1时点的指标小,则表示靶细胞的数量减少,当与靶细胞相关的疾病由于靶细胞的增殖而恶化时,意味着该与靶细胞相关的疾病改善。例如这里,若第2时点的信号强度比第1时点的信号强度低,则可以给出疾病改善的结果,而相反若第2时点的信号强度比第1时点的信号强度高,则可以给出疾病恶化的结果。另外,例如若第2时点的信号分布比第1时点的信号分布缩小,则可以给出疾病改善的结果、而相反若第2时点的信号分布比第1时点的信号分布扩大,则可以给出疾病恶化的结果。本发明的评价方法可进一步包含将处置前的第1时点的标记的检测结果与比第1时点靠后的处置后的第2时点的标记的检测结果进行比较、或将第1处置后的第1时点的标记的检测结果与第1处置后进行的第2处置后的第2时点的标记的检测结果进行比较。例如,当检测结果为有关靶细胞的数量的指标(例如来自被摄入至靶细胞的标记的信号强度、信号分布等)时,第2时点的指标比第1时点的指标小表示靶细胞的数量减少,若与靶细胞相关的疾病随着靶细胞的增殖而恶化,则意味着该与靶细胞相关的疾病改善、即处置的效果阳性。例如,这里若第2时点的信号强度比第1时点的信号强度低,则疾病由于处置而改善,因此可以给出处置成功的结果,而相反若第2时点的信号强度比第1时点的信号强度高,则疾病由于处置而恶化,可以给出处置不怎么成功或不成功的结果。另外,例如若第2时点的信号分布比第1时点的信号分布缩小,则疾病由于处置而改善,因此可以给出处置成功的结果,而相反若第2时点的信号分布比第1时点的信号分布扩大,则疾病由于处置而恶化,可以给出处置不怎么成功或不成功的结果。本说明书中,术语“对象”是指任意的生物个体、优选动物、更优选哺乳动物、进一步优选人的个体。本发明中,对象可以是健康的(例如没有特定的或任意的疾病),也可以患有某种疾病,当试图对与靶细胞相关的疾病进行处置、检査、诊断、监测等时,典型地是指患有该疾病或具有患病危险的对象,当试图对处置与靶细胞相关的疾病的效果进行评价时,典型地是指接受或预备接受针对该疾病的治疗的对象。实施例通过以下的例子对本发明进行更详细的说明。这些例子仅仅是为了例证,并不是对本发明的范围进行限制。例1靶向分子-载体复合物的制作作为靶向分子,准备以下的肽:表1肽名序列序列号RBP环1AKKDPEGLFLQDNI3No.10KDPEGLFLQD6No,10-1AKKDPEGLFLQDN7No.10-2AKKDPEGLFLQD8No.10-3KKDPEGLFLQDNI9No.10-4KDPEGLFLQDNI10No.10-5KKDPEGLFLQD11No.10-6KDPEGLFLQDN12No.10-7KKDPEGLFLQDN13RBP环2AKGRVRLLNNWDVCA4RBP环3KYWGVASFLQKGNDD5上述肽均可从Sigma-Genosys获得。作为阳性对照,准备维生素A(全反式视黄醇、SigmaAldrich)。将维生素A以10mM的浓度溶解于DMSO中,制备原液,冷冻保存至使用时。作为结合靶向分子的载体,准备含有脂质体形成性阳离子性脂质DC-6-14的LipoTrustTMSR(北海道Systemscience);作为载体所担载的药物,准备针对HSP47的siRNA(HSP47C、北海道Systemscience)。siRNA的序列如下所示(序列中,小写字母表示RNA、大写字母表示DNA)。正义链:5’ggacaggccucuacaacuaTT3’(序列号14)反义链:5’uaguuguagaggccuguccTT3’(序列号15)将siRNA以10mg/ml的浓度溶解于无核酸酶的水(Ambion,Cat.No.AM9937)中,制备原液,冷冻保存至使用时。将LipoTrustTMSR以每阳离子性脂质为1mM的浓度溶解于无核酸酶的水(Ambion,Cat.No.AM9937)中,将所得的脂质体溶液10μl加入微量离心管,向其中加入1μl以规定浓度溶解于DMSO的上述各肽的原液(对于在图1示出结果的实验:1.1mM、1.25mM、2.5mM、3.4mM、5mM或10mM,对于在图2示出结果的实验:90mM)或上述维生素A原液,利用涡流搅拌15秒钟。向该混合液中加入上述siRNA原液1.5μl进行混合,然后加入5%葡萄糖水溶液(大塚糖液5%、大塚制药)17.5μl进行混合。将如此得到的脂质体-肽(或维生素A)-siRNA复合物(lipoplex)溶液遮光静置在室温15分钟。另外,作为对照,准备不含有LipoTrustTMSR的肽与siRNA的混合物。例2siRNA向星状细胞的导入siRNA导入的2日前,将按照Schaefer等(Schaeferetal.,Hepatology.1987Jul-Aug;7(4):680-7)的方法从大鼠肝脏制备的肝星状细胞(HSC)以0.2×105个/孔的密度均匀播种于6孔板上,在含有10%胎牛血清(ThermoHyClone,Cat.No.SH30070.03)、2%L-谷氨酰胺(SigmaAldrich,Cat.No.G7513)及1%青霉素/链霉素(SigmaAldrich,Cat.No.G1146)的Dulbecco'sModifiedEagle培养基(D-MEM,SigmaAldrich,Cat.No.D6546;以下称为“培养用培养基”)中培养。除去培养用培养基,向各孔新加入培养用培养基900μl、在37℃下孵育30分钟以上。向例1中得到的各种lipoplex溶液30μl中加入5%葡萄糖水溶液100μl、调至130μl,将所得的混合溶液中的100μl加入对应的孔中。此时的siRNA的终浓度为11.5μg/ml。在37℃、5%CO2下孵育30分钟后,除去含有lipoplex溶液的培养基,更换为培养用培养基,进行通常培养24~36小时。各样品的总RNA的提取使用RNeasyMinikit(Qiagen)进行。首先,除去培养用培养基,将事先在RNeasyMinikit所带的RLT溶液中混合2-巯基乙醇(2ME、Wako)1%(v/v)而制备的RLT/2ME溶液每孔350μl地分注到各孔中。将全部细胞溶解物用QIAshredder(Qiagen)均质化,在4℃下以12000rpm离心2分钟,然后按照制造者的指示提取总RNA。得到的RNA用NanoDrop2000(ThermoFisherScientific)定量,用RT-PCR合成cDNA。反应液由每根管逆转录酶混合物(SuperScriptVILOMasterMix,Invitrogen,11755-250)4μl、各样品的总RNA16μl(含有100~500ng以上的RNA)合计20μl构成,使其在25℃下反应5分钟、在42℃下反应60分钟、接着在85℃下反应5分钟,然后在4℃下保存。HSP47的表达抑制用定量PCR进行分析。作为标准模板,使用了未处理细胞样品的10倍稀释系列(原液、10倍稀释溶液及100倍稀释溶液)。向MicroAmp(Optical96-wellReactionPlate,AppliedBiosystems,Cat.No.4306737)的各孔中加入由无菌水22μl、PowerSYBR(R)Green(AppliedBiosystems,Cat.No.4367669)25μl及引物混合物1μl构成的48μl的预混合物。引物组合分别含有以下所示的HSP47或针对内部标准基因即GAPDH的引物组各50μM。大鼠HSP47:5’TGACCTGCAGAAACATCTGG3’(正向引物、序列号16)5’AGGAAGATGAAGGGGTGGTC3’(反向引物、序列号17)GAPDH(内部标准、人/大鼠共通)5’ACCATCTTCCAGGAGCGAGA3’(正向引物、序列号18)5’GCATGGACTGTGGTCATGAG3’(反向引物、序列号19)向所对应的孔中加入从各样品获得的模板cDNA2μl,合计50μl。将板用薄膜密封,放入实时PCR装置(7300RealTimePCRSystem,AppliedBiosystems),在下表的条件下使其反应。表2将结果示于图1~2。图表中,以未处理细胞为100计示出了各条件下的HSP47相对于GAPDH的相对表达量,值越小则HSP47的表达越得到抑制,即表示siRNA越被有效导入。图1所示的结果表示,当使用环1及环2作为靶向分子时可见浓度依赖性的HSP47的表达抑制,特别是使用环1作为靶向分子的复合物所带来的抑制率与维生素A的情况匹敌。另外,图2所示的结果表示,将使用含有自环1的N末端及C末端逐渐短1个氨基酸的肽(肽No.10及No.10-1~10-6)的部分作为靶向分子的复合物所带来的抑制率与环1及维生素A的情况匹敌。下表是将图2所示的结果数值化而得到的。表3靶向分子HSP47表达率(%)VA46.8VA(-)97.4环149.0No.1057.2No.10-139.3No.10-248.5No.10-331.2No.10-442.9No.10-540.4No.10-644.3*VA以7.7μM的终浓度使用、各肽以69.2μM的终浓度使用。以上的结果表示,含有RBP的细胞结合部分的序列的肽作为向星状细胞特异性地递送药物等的靶向分子是有用的。例3利用突变肽的靶向为了验证利用RBP环1的向星状细胞的靶向取决于肽的氨基酸组成、还是取决于氨基酸序列,作为细胞使用大鼠肝星状细胞、作为肽使用RBP环1及下表所示的突变肽,进行与例2同样的实验。含有各肽的lipoplex使用DMSO中的10mM的肽原液、与例1同样地进行制备,加入到含有大鼠肝星状细胞的孔中,使肽的终浓度达到7.7μM、siRNA的终浓度达到11.5μg/ml表4肽名序列序列号RBP环1(L1)AKKDPEGLFLQDNI3突变肽1(E3K6)AKEDPKGLFLQDNI20突变肽2(D3K4)AKDKPEGLFLQDNI21突变肽3(D3K12)AKDDPEGLFLQKNI22其中,突变肽1为将RBP环1的3位的赖氨酸替换为谷氨酸、将6位的谷氨酸替换为赖氨酸而成的肽,突变肽2为将3位的赖氨酸替换为天冬氨酸、将4位的天冬氨酸替换为赖氨酸而成的肽,突变肽3为将3位的赖氨酸替换为天冬氨酸、将12位的天冬氨酸替换为赖氨酸而成的肽。因此,这些突变肽与RBP环1的氨基酸组成相同,但氨基酸序列不同。图3所示的结果启示,在使用突变肽1、2及3作为靶向分子的任一组中,与使用RBP环1作为靶向分子的组相比,HSP47基因表达的抑制程度较低,因此对于基因表达抑制而言,重要的并不是RBP环1的氨基酸组成,而是氨基酸序列本身。例4利用肽模拟物的靶向为了验证RBP的细胞结合部分的肽模拟物是否作为靶向星状细胞的靶向分子发挥作用,作为细胞使用大鼠肝星状细胞、作为肽模拟物使用RBP环1的反转变型肽(RI:d-INDQLFLGEPDKKA-酰胺(具有与序列号3相反的序列的由D-氨基酸构成的肽))、作为对照肽使用RBP环1(L1:序列号3),进行与例2同样的实验。其中,含有各肽的lipoplex使用DMSO中的30mM的肽原液、与例1同样地进行制备,加入包含大鼠肝星状细胞的孔中,使肽的终浓度达到23.1μM、siRNA的终浓度达到11.5μg/ml。从图4所示的结果可知,反转变型肽具有与RBP环1大致相同的靶向能力。由于反转变型肽具有与亲肽类似的侧链的空间立体结构(拓扑结构),因此该结果表示,与作为如例1~3所记载的靶向星状细胞的靶向分子发挥作用的肽具有同样的侧链拓扑结构的肽模拟物也作为靶向星状细胞的靶向分子发挥作用。例5利用乱序肽的靶向为了确认利用RBP环1的向星状细胞的靶向并不依赖于肽的氨基酸组成,而是依赖于氨基酸序列,作为细胞使用大鼠肝星状细胞、作为试验肽使用RBP环1(L1:序列号3)、作为比较肽使用与试验肽的氨基酸组成相同但氨基酸序列不同的乱序肽(scr:AKFQKLEPGDDLNI、序列号23),进行与例2同样的实验。其中,含有各肽的lipoplex使用DMSO中的10mM的肽原液、与例1同样地进行制备,加入包含大鼠肝星状细胞的孔中,使肽的终浓度达到7.7μM、siRNA的终浓度达到11.5μg/ml。根据图5所示的结果,使用RBP环1作为靶向分子的组中,HSP47基因表达率显著降低,而使用乱序肽作为靶向分子的组中,与不使用靶向分子的组(VA(-))的结果大致相同,因此启示对于靶向而言,重要的不是RBP环1的氨基酸组成、而是氨基酸序列本身。例6向癌细胞的靶向为了验证RBP的细胞结合部分的肽是否作为靶向癌细胞的靶向分子发挥作用,作为细胞使用人纤维肉瘤细胞系的HT-1080细胞、作为试验肽使用RBP环1(L1:序列号3)、作为阴性对照肽使用乱序肽(scr:AKFQKLEPGDDLNI、序列号23),进行与例2同样的实验。其中,含有各肽的lipoplex使用DMSO中的10mM的肽原液、与例1同样地进行制备,加入包含HT-1080细胞的孔中,使肽的终浓度达到7.7μM、siRNA的终浓度达到11.5μg/ml。另外,作为针对HSP47的引物组,使用以下引物(针对GAPDH的引物组使用例2中记载的人/大鼠共通的引物)。人HSP47:5’TGACCTGCAGAAACACCTGG3’(正向引物、序列号24)5’AGGAAGATGAAGGGGTGGTC3’(反向引物、序列号25)从图6所示的结果可知,RBP的细胞结合部分的肽与维生素A同样地作为靶向癌细胞的靶向分子发挥作用。由于已知维生素A作为靶向各种癌细胞的靶向分子发挥(参照专利文献2),因此该结果表示,例1~4中记载的肽及肽模拟物也作为靶向各种癌细胞的靶向分子发挥作用。例1~6的结果还启示,本发明的靶向分子具有与专利文献1~9及非专利文献1中记载的维生素A等同等的靶向能力,也适用于这些文献中记载的用途、例如各种脏器纤维化或肿瘤性疾病的处置、检测、成像及诊断、选自由星状细胞、肌成纤维细胞、癌相关成纤维细胞、肿瘤细胞等细胞的标记、检测及成像等。本领域技术人员应理解只要不脱离本发明的精神则可进行大量的各种改变。因此应理解的是,本说明书中记载的本发明的形态仅仅是例示,并不是为了对本发明的范围进行限制。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1