长效肾上腺髓质素衍生物的制作方法
本发明涉及一种长效肾上腺髓质素衍生物。
背景技术:
肾上腺髓质素(adrenomedullin,下面还记述为“AM”)是在1993年从嗜铬细胞瘤组织分离和鉴定的生理活性肽(非专利文献1)。发现之初,已证实AM能够发挥很强的扩张血管的降压作用。例如,专利文献1记述了具有降血压作用的包含人AM的氨基酸序列的肽。
通过随后的研究可知,AM能够发挥心血管保护作用、抗炎症作用、血管生成作用及促进组织修复作用等多种药理作用。此外,为了将AM的药理作用应用在疾病治疗中,对于各种疾病患者开展了AM的给药研究。其中,AM作为炎性肠病、肺动脉高压症、周围血管疾病或急性心肌梗塞的治疗药的有用性受到期待。
例如,专利文献2记述了一种含有如下物质作为有效成分的非细菌性的炎性肠病的预防或治疗剂:具有抑制非细菌性炎症的活性的肾上腺髓质素或其衍生物,或者是具有抑制非细菌性炎症的活性的它们的盐。
专利文献3记述了一种预防或治疗方法,其是对需要预防或治疗的难以使用类固醇制剂、免疫抑制剂或生物制剂或使用效果不明显的炎性肠病的患者进行所述炎性肠病的预防或治疗的方法,所述方法包括对所述患者给予有效量的肾上腺髓质素、具有抑制炎症活性的其修饰形式、或者具有抑制炎症活性的所述肾上腺髓质素或所述修饰形式的盐。
另外,由AM的构效关系研究,对有助于AM生物活性的必需序列进行了确定(非专利文献2~9)。
现有技术文献
专利文献
专利文献1:日本专利第2774769号公报
专利文献2:日本专利第4830093号公报
专利文献3:WO 2012/096411号
非专利文献
非专利文献1:Kitamura K,Kangawa K,Kawamoto M,Ichiki Y,Nakamura S,Matsuo H,Eto T.Adrenomedullin:a novel hypotensive peptide isolated from human pheochromocytoma.Biochem Biophys Res Commun,1993年4月30日,第192(2)卷,pp.553-601
非专利文献2:Belloni,A.S.等,Structure-activity relationships of adrenomedullin in the adrenalgland.Endocr Res,1998年,第24(3-4)卷,p.729-30.
非专利文献3:Champion,H.C.等,Catecholamine release mediates pressor effects of adrenomedullin-(15-22)in the rat.Hypertension,1996年,第28(6)卷,p.1041-6.
非专利文献4:Champion,H.C.,G.G.Nussdorfer,和P.J.Kadowitz,Structure-activity relationships of adrenomedullin in the circulation and adrenal gland.Regul Pept,1999年,第85(1)卷,p.1-8.
非专利文献5:Eguchi,S.等,Structure-activity relationship of adrenomedullin,a novel vasodilatory peptide,in cultured rat vascular smooth muscle cells.Endocrinology,1994年,第135(6)卷,p.2454-8.
非专利文献6:Garcia,M.A.等,Synthesis,biological evaluation,and three-dimensional quantitative structure-activity relationship study of small-molecule positive modulators of adrenomedullin.J Med Chem,2005年,第48(12)卷,p.4068-75.
非专利文献7:Mitsuda,Y.等,Large-scale production of functional human adrenomedullin:expression,cleavage,amidation,and purification.Protein Expr Purif,2002年,第25(3)卷,p.448-55.
非专利文献8:Roldos,V.等,Small-molecule negative modulators of adrenomedullin:design,synthesis,and 3D-QSAR study.ChemMedChem,2008年,第3(9)卷,p.1345-55.
非专利文献9:Watanabe,T.X.等,Vasopressor activities of N-terminal fragments of adrenomedullin in anesthetized rat.Biochem Biophys Res Commun,1996年,第219(1)卷,p.59-63.
技术实现要素:
发明所要解决的问题
肾上腺髓质素是具有各种药理作用的化合物。因此,期待含有肾上腺髓质素作为有效成分的药物应用于各种疾病等的预防或治疗中。但是,肾上腺髓质素是肽。已知通常肽由于在活体内(例如血液中)的代谢反应而导致半衰期短。因此,含有肾上腺髓质素作为有效成分的药物在给药对象(例如人类患者)中的作用时间有可能非常短。如上所述,为了将肾上腺髓质素应用于药物用途中,还有进一步改善的余地。
所以,本发明的目的在于提供一种与天然肾上腺髓质素相比,可长时间持续作用的新型肾上腺髓质素衍生物。
解决问题的技术方案
本发明人对解决所述问题的技术方案进行了各种研究,结果发现通过用特定的修饰基团对天然肾上腺髓质素的N末端氨基进行化学修饰,可在保持天然肾上腺髓质素生物活性的同时,与天然肾上腺髓质素相比,延长血液中半衰期。本发明人基于所述发现完成了本发明。
即,本发明的要旨如下。
(1)由式(I)表示的化合物或其盐、或者它们的水合物,
式(I):A-Ln-B (I),
式中,
A为选自由棕榈酰基和聚乙二醇基所组成的组中的修饰基团,
L为二价的连接基团,
n为整数0或1,
B为由肾上腺髓质素或具有肾上腺髓质素活性的其修饰形式衍生的肽部分,
其中肽部分B通过其N末端氨基与修饰基团A或连接基团L连接。
(2)如所述(1)记载的化合物,其中,所述肾上腺髓质素或具有肾上腺髓质素活性的其修饰形式为选自由下述肽所组成的组中的肽:
(i)由肾上腺髓质素的氨基酸序列组成的肽;
(ii)由肾上腺髓质素的氨基酸序列组成且该氨基酸序列中的两个半胱氨酸残基形成二硫键的肽;
(iii)在(ii)的肽中所述二硫键被亚乙基取代且具有肾上腺髓质素活性的肽;
(iv)在(i)~(iii)任一个肽中缺失、取代或添加1~15个氨基酸且具有肾上腺髓质素活性的肽;
(v)在(i)~(iv)任一个肽中C末端被酰胺化的肽;以及
(vi)在(i)~(iv)任一个肽中在C末端添加甘氨酸残基的肽。
(3)如所述(1)或(2)记载的化合物,其中,所述肾上腺髓质素或其修饰形式为选自由下述肽所组成的组中的肽:
(a)由序列号1的氨基酸序列组成的肽,或者由序列号1的氨基酸序列组成且16位的半胱氨酸残基与21位的半胱氨酸残基形成二硫键的肽;
(b)由序列号3的氨基酸序列组成的肽,或者由序列号3的氨基酸序列组成且16位的半胱氨酸残基与21位的半胱氨酸残基形成二硫键的肽;
(c)由序列号5的氨基酸序列组成的肽,或者由序列号5的氨基酸序列组成且16位的半胱氨酸残基与21位的半胱氨酸残基形成二硫键的肽;
(d)由序列号7的氨基酸序列组成的肽,或者由序列号7的氨基酸序列组成且16位的半胱氨酸残基与21位的半胱氨酸残基形成二硫键的肽;
(e)由序列号9的氨基酸序列组成的肽,或者由序列号9的氨基酸序列组成且14位的半胱氨酸残基与19位的半胱氨酸残基形成二硫键的肽;
(f)由序列号11的氨基酸序列组成的肽,或者由序列号11的氨基酸序列组成且14位的半胱氨酸残基与19位的半胱氨酸残基形成二硫键的肽;
(g)在所述(a)~(f)任一个肽中所述二硫键被亚乙基取代且具有肾上腺髓质素活性的肽;
(h)在所述(a)~(g)任一个肽中缺失、取代或添加1~15个氨基酸残基且具有肾上腺髓质素活性的肽;
(i)在所述(a)~(h)任一个肽中C末端被酰胺化的肽;以及
(j)在所述(a)~(h)任一个肽中在C末端添加甘氨酸残基的肽。
(4)如所述(1)~(3)中任一项记载的化合物的制备方法,所述制备方法包括使由肾上腺髓质素或其修饰形式衍生的肽部分B的前体、选自由棕榈酰基和聚乙二醇基所组成的组中的修饰基团A的前体和二价基团Ln的前体连接而得到由式(I)表示的化合物的连接步骤。
(5)一种药物,所述药物含有所述(1)~(3)中任一项记载的化合物或其药学上可接受的盐、或者它们的药学上可接受的水合物作为有效成分。
(6)如所述(5)记载的药物,所述药物用于预防或治疗循环系统疾病、炎性疾病或周围血管疾病。
(7)一种循环系统疾病、炎性疾病或周围血管疾病的预防或治疗剂,所述预防或治疗剂含有所述(1)~(3)中任一项记载的化合物或其药学上可接受的盐、或者它们的药学上可接受的水合物作为有效成分。
(8)一种药物组合物,所述药物组合物含有所述(1)~(3)中任一项记载的化合物或其药学上可接受的盐、或者它们的药学上可接受的水合物和一种以上的药学上可接受的载体。
(9)如所述(8)记载的药物组合物,所述药物组合物用于预防或治疗循环系统疾病、炎性疾病或周围血管疾病。
(10)一种预防或治疗状况、疾病和/或紊乱的方法,所述方法包含对需要预防或治疗所述状况、疾病和/或紊乱的给药对象,给予有效量的所述(1)~(3)中任一项记载的化合物或其药学上可接受的盐、或者它们的药学上可接受的水合物。
(11)如所述(10)记载的方法,其中,所述状况、疾病和/或紊乱是循环系统疾病、炎性疾病或周围血管疾病。
(12)如所述(1)~(3)中任一项记载的化合物或其药学上可接受的盐、或者它们的药学上可接受的水合物,其用于预防或治疗状况、疾病和/或紊乱。
(13)如所述(12)记载的化合物,其中,所述状况、疾病和/或紊乱是循环系统疾病、炎性疾病或周围血管疾病。
(14)如所述(1)~(3)中任一项记载的化合物或其药学上可接受的盐、或者它们的药学上可接受的水合物用于制备用于预防或治疗状况、疾病和/或紊乱的药物的用途。
(15)如所述(14)记载的用途,其中,所述状况、疾病和/或紊乱是循环系统疾病、炎性疾病或周围血管疾病。
发明效果
根据本发明能够提供一种与天然肾上腺髓质素相比,可长时间持续作用的新型肾上腺髓质素衍生物。
本说明书包括作为本申请的优先权基础的日本国专利申请第2014-058225号说明书和/或附图所记载的内容。
附图说明
图1是表示Pal-h.AM(1-52)、PEG5000-h.AM(1-52)或h.AM(1-52)的浓度与cAMP浓度升高的剂量反应曲线的图。
图2是表示从h.AM(1-52)给药开始时起的持续时间与血浆中AM浓度关系的图。
图3是表示从Pal-h.AM(1-52)给药开始时起的持续时间与血浆中AM浓度关系的图。
图4是表示从PEG5000-h.AM(1-52)给药开始时起的持续时间与血浆中AM浓度关系的图。
图5是表示从h.AM(1-52)、Pal-h.AM(1-52)或PEG5000-h.AM(1-52)给药开始时起的持续时间与平均血压关系的图。
图6是表示对照组、以及0.02、0.1和0.5nmol/kg/hr PEG5000-h.AM(1-52)给药组血浆中AM浓度的图。
图7是表示从PEG5000-h.AM(1-52)给药开始时起的持续时间与对照组及各给药组总得分关系的图。
图8是表示对照组、以及0.02、0.1和0.5nmol/kg/hr PEG5000-h.AM(1-52)给药组的肠道长度的图。
具体实施方式
<1.肾上腺髓质素衍生物>
本发明涉及由式(I)表示的化合物或其盐、或者它们的水合物:
式(I):A-Ln-B (I)。
本说明书中,有时将由式(I)表示的化合物记述为“肾上腺髓质素衍生物”。
本发明中肾上腺髓质素(AM)不仅是由人嗜铬细胞瘤组织分离和鉴定的人来源的肽(序列号1、非专利文献1),也可以是例如猪(序列号3)、犬(序列号5)、牛(序列号7)、大鼠(序列号9)或小鼠(序列号11)等其他非人哺乳动物(例如温血动物)来源的肽(直系同源物)。在活体内,这些肽的氨基酸序列中的两个半胱氨酸残基形成二硫键且C末端被酰胺化。本说明书中,有时将具有二硫键和C末端酰胺基的所述肽记述为“天然肾上腺髓质素”或仅记述为“肾上腺髓质素”。本发明对于所述任一个肽均可适用。
本说明书中,“C末端的酰胺化”是指在活体内,肽的翻译后修饰的一个方式,具体而言是指肽的C末端氨基酸残基的主链羧基向酰胺基形式转化的反应。此外,本说明书中,“半胱氨酸残基的二硫键的形成”或“半胱氨酸残基的二硫键化”是指在活体内,肽的翻译后修饰的一个方式,具体而言是指肽的氨基酸序列中的两个半胱氨酸残基形成二硫键(-S-S-)的反应。许多在活体内产生的生理活性肽,开始被生物合成为分子量较大的前体蛋白,其在细胞内转运的过程中,经历C末端酰胺化和/或半胱氨酸残基的二硫键化这样的翻译后修饰反应,成为成熟的生理活性肽。C末端的酰胺化通常是通过C末端酰胺化酶对前体蛋白发生作用而进行。对于具有C末端酰胺基的生理活性肽,在其前体蛋白中Gly残基连接在酰胺化的C末端羧基,该Gly残基通过C末端酰胺化酶转化为C末端酰胺基。此外,前体蛋白的C末端侧前肽中,存在有例如Lys-Arg或Arg-Arg等碱性氨基酸残基组合的重复序列(水野、生物化学第61卷、第12号、1435~1461页(1989))。半胱氨酸残基的二硫键化可在氧化的条件下进行。在活体内,半胱氨酸残基的二硫键化通常是通过蛋白二硫键异构酶对前体蛋白发生作用而进行。
作为众所周知的生理活性物质的肾上腺髓质素是肽。因此,含有肾上腺髓质素作为有效成分的药物在给药对象(例如人类患者)的活体内可有效起作用的时间有可能为非常短的时间。此外,肾上腺髓质素具有很强的扩张血管作用。因此,当单次给予治疗上有效量的肾上腺髓质素时,由于很强的扩张血管作用,有可能引起不良的副作用(例如,血压过度降低、伴随反射性的交感神经活性增高的心动过速和/或肾素活性增高等)。为了避免产生所述问题,含有肾上腺髓质素作为有效成分的药物需要通过持续静脉输注对给药对象进行给药。这种给药方法有可能对给药对象强加过度的负担。
本发明人发现作为肾上腺髓质素衍生物的由式(I)表示的化合物,可在保持与天然肾上腺髓质素实质上基本相同的生物活性的同时,与天然肾上腺髓质素相比,可显著延长血液中半衰期。因此,通过将由本发明的式(I)表示的化合物应用于可由肾上腺髓质素来预防或治疗的状况、疾病和/或紊乱,能够持续地预防或治疗该状况、疾病和/或紊乱。
式(I)中,B需为由肾上腺髓质素或具有肾上腺髓质素活性的其修饰形式衍生的肽部分。本发明中,“肾上腺髓质素的修饰形式”是指以上描述的天然肾上腺髓质素经化学修饰的肽。此外,本发明中,“肾上腺髓质素活性”是指肾上腺髓质素所具有的生物活性。作为肾上腺髓质素活性可列举如下。
(1)心血管系统:扩张血管作用、降血压作用、增加心输出量/改善心功能不全作用、改善肺动脉高压症作用、血管生成作用、淋巴管生成作用、改善血管内皮功能作用、抗动脉硬化作用、心肌保护作用(例如,缺血再灌注损伤或炎症时的心肌保护作用)、抑制心肌梗塞后重塑的作用、抑制心脏肥大的作用和抑制血管紧张素转换酶的作用。
(2)肾脏与水电解质系统:利尿作用、利尿钠作用、抑制抗利尿激素的作用、降低醛固酮作用、保护肾脏作用(例如,高血压或缺血再灌注损伤时的心肌保护作用)、抑制饮水行为的作用和抑制食盐要求的作用。
(3)脑与神经系统:神经保护/抑制脑损伤的作用、抗炎症作用、抑制凋亡的作用(例如,缺血再灌注损伤或炎症时抑制凋亡的作用)、维持自动调节能的作用和抑制氧化应激的作用。
(4)泌尿生殖系统:改善勃起的作用、改善血流的作用和促进着床的作用。
(5)消化系统:抗溃疡作用、组织修复作用、粘膜生成作用、改善血流的作用、抗炎症作用和改善肝功能的作用。
(6)骨科:刺激成骨细胞的作用和改善关节炎的作用。
(7)内分泌代谢系统:脂肪细胞分化作用、控制脂肪分解的作用、改善胰岛素敏感性的作用和控制胰岛素分泌的作用。
(8)其他:改善循环的作用、抗炎症作用、控制细胞因子的作用、保护器官的作用、抑制氧化应激的作用、组织修复作用(例如,抗褥疮作用)、改善败血症性休克的作用、抑制多器官功能障碍的作用和抑制自身免疫性疾病的作用。
所述降血压作用优选为血管扩张性降压作用。在所述消化系统的抗炎症作用优选为如类固醇抵抗型或类固醇依赖型的炎性肠病(例如,溃疡性大肠炎、克罗恩病或肠道白塞病)这样的炎性肠病的预防或治疗作用。所述肾上腺髓质素活性通过细胞内cAMP的浓度升高来表现。因此,可以将细胞内cAMP的浓度升高作为肾上腺髓质素活性的指标。通过含有由具有上述这样的生物活性的肾上腺髓质素或其修饰形式衍生的肽部分B,由本发明的式(I)表示的化合物可以表现为与天然肾上腺髓质素实质上基本相同的生物活性(即,肾上腺髓质素活性)。
所述肾上腺髓质素或具有肾上腺髓质素活性的其修饰形式优选为选自由下述肽所组成的组中的肽:
(i)由肾上腺髓质素的氨基酸序列组成的肽;
(ii)由肾上腺髓质素的氨基酸序列组成且该氨基酸序列中的两个半胱氨酸残基形成二硫键的肽;
(iii)在(ii)的肽中所述二硫键被亚乙基取代且具有肾上腺髓质素活性的肽;
(iv)在(i)~(iii)任一个肽中缺失、取代或添加1~15个氨基酸且具有肾上腺髓质素活性的肽;
(v)在(i)~(iv)任一个肽中C末端被酰胺化的肽;以及
(vi)在(i)~(iv)任一个肽中在C末端添加甘氨酸残基的肽。
所述(i)~(vi)的肽中,(v)所包含的肽相当于成熟的天然肾上腺髓质素,所述肽由肾上腺髓质素的氨基酸序列组成,C末端被酰胺化且该氨基酸序列中的两个半胱氨酸残基形成二硫键。(i)的由肾上腺髓质素的氨基酸序列组成的肽相当于在经历C末端酰胺化和半胱氨酸残基的二硫键化的翻译后修饰之前的(即,未成熟的)形式的天然肾上腺髓质素。所述(i)~(vi)的肽中,除了以上描述的肽之外的其他肽相当于肾上腺髓质素的修饰形式。
所述(ii)的肽可以将所述(i)的肽的两个半胱氨酸残基的硫醇基通过空气氧化、或使用适合的氧化剂进行氧化转化为二硫键而形成。通过使用所述(ii)的肽,可以使肽部分B的构象类似为天然肾上腺髓质素的构象。由此,由式(I)表示的化合物的肾上腺髓质素活性可以与天然肾上腺髓质素实质上基本相同。
所述(iii)的肽可以通过使所述(ii)的肽的二硫键转化为亚乙基而形成。由二硫键向亚乙基的取代可以通过本技术领域众所周知的方法来进行(O.Keller等,Helv.Chim.Acta,1974年,第57卷,p.1253)。通过使用所述(iii)的肽,可以使肽部分B的构象稳定化。由此,由式(I)表示的化合物可以在活体内中持续地表现肾上腺髓质素活性。
所述(iv)的肽中,缺失、取代或添加的氨基酸残基,优选为1~12个的范围,更优选为1~10个的范围,进一步优选为1~8个的范围,特别优选为1~5个的范围,最优选为1~3个的范围。适合的(iv)的肽是在(i)~(iii)任一个肽中,从N末端侧起缺失1~15位、1~12位、1~10位、1~8位、1~5位或1~3位的氨基酸,且具有肾上腺髓质素活性的肽。所述适合的肽中,也可以进一步缺失、取代或添加1个或更多个(例如,1~5个、1~3个、或者1个或两个)的氨基酸。通过使用所述(iv)的肽,由式(I)表示的化合物的肾上腺髓质素活性可以与天然肾上腺髓质素实质上基本相同。此外,通过使用所述(iv)的肽,由式(I)表示的化合物可以在活体内中持续地表现肾上腺髓质素活性。
所述(vi)的肽可以通过C末端酰胺化酶的作用来使C末端的甘氨酸残基转化为C末端酰胺基,从而转化为所述(v)的肽。因此,通过对给药对象给予所述(vi)的肽,在该给药对象的活体内中经过一定时间后,可以形成C末端被酰胺化的肽。由此,由式(I)表示的化合物可以在活体内持续地表现肾上腺髓质素活性。
所述肾上腺髓质素或其修饰形式更优选为选自由下述肽所组成的组中的肽:
(a)由序列号1的氨基酸序列组成的肽,或者由序列号1的氨基酸序列组成且16位的半胱氨酸残基与21位的半胱氨酸残基形成二硫键的肽;
(b)由序列号3的氨基酸序列组成的肽,或者由序列号3的氨基酸序列组成且16位的半胱氨酸残基与21位的半胱氨酸残基形成二硫键的肽;
(c)由序列号5的氨基酸序列组成的肽,或者由序列号5的氨基酸序列组成且16位的半胱氨酸残基与21位的半胱氨酸残基形成二硫键的肽;
(d)由序列号7的氨基酸序列组成的肽,或者由序列号7的氨基酸序列组成且16位的半胱氨酸残基与21位的半胱氨酸残基形成二硫键的肽;
(e)由序列号9的氨基酸序列组成的肽,或者由序列号9的氨基酸序列组成且14位的半胱氨酸残基与19位的半胱氨酸残基形成二硫键的肽;
(f)由序列号11的氨基酸序列组成的肽,或者由序列号11的氨基酸序列组成且14位的半胱氨酸残基与19位的半胱氨酸残基形成二硫键的肽;
(g)在所述(a)~(f)任一个肽中所述二硫键被亚乙基取代且具有肾上腺髓质素活性的肽;
(h)在所述(a)~(g)任一个肽中缺失、取代或添加1~15个氨基酸且具有肾上腺髓质素活性的肽;
(i)在所述(a)~(h)任一个肽中C末端被酰胺化的肽;以及
(j)在所述(a)~(h)任一个肽中在C末端添加甘氨酸残基的肽。
所述(h)的肽中,缺失、取代或添加的氨基酸残基,优选为1~12个的范围,更优选为1~10个的范围,进一步优选为1~8个的范围,特别优选为1~5个的范围,最优选为1~3个的范围。适合的(h)的肽是在(a)~(g)任一个肽中,从N末端侧起缺失1~15位、1~12位、1~10位、1~8位、1~5位或1~3位的氨基酸,且具有肾上腺髓质素活性的肽。所述适合的肽中,也可以进一步缺失、取代或添加1个或更多个(例如,1~5个、1~3个、或者1个或两个)的氨基酸。通过使用所述(h)的肽,由式(I)表示的化合物的肾上腺髓质素活性可以与天然肾上腺髓质素实质上基本相同。此外,通过使用所述(h)的肽,由式(I)表示的化合物可以在活体内持续地表现肾上腺髓质素活性。
式(I)中,A需为修饰基团。A优选为选自由棕榈酰基、聚乙二醇基、肉豆蔻酰基、糖基(糖基)和肽基所组成的组中的修饰基团,更优选为选自由棕榈酰基和聚乙二醇基所组成的组中的修饰基团。所述糖基优选为由单糖、二糖、寡糖或多糖衍生的一价基团(例如,葡基(グリコシル基))。所述肽基优选为由聚甘氨酸、聚谷氨酸、聚赖氨酸或聚天冬氨酸等衍生的一价基团(例如,通过N末端氨基、C末端羧基或侧链基团形成键的一价基团)。所述聚乙二醇基优选为具有200~40,000的范围的平均分子量,更优选为具有500~20,000的范围的平均分子量,进一步优选为具有500~10,000的范围的平均分子量。当聚乙二醇基的平均分子量为200以上时,由式(I)表示的化合物可以在活体内长时间持续地表现肾上腺髓质素活性。通过用所述修饰基团A对肾上腺髓质素或其修饰形式的N末端氨基进行化学修饰,由式(I)表示的化合物的肾上腺髓质素活性可以与天然肾上腺髓质素实质上基本相同。此外,由式(I)表示的化合物可以在活体内持续地表现肾上腺髓质素活性。
式(I)中,L需为二价的连接基团。二价的连接基团L优选为取代或未取代的二价的烃基,更优选为取代或者未取代的二价的脂肪族烃基、取代或者未取代的二价的脂环基或取代或者未取代的二价的芳香基,进一步优选为取代或者未取代的C1~C10亚烷基、C2~C10亚烯基或C2~C10亚炔基。所述基团优选为含有一个以上的杂原子,更优选为氧代(羰基)、硫代羰基、氨基甲酸酯或碳酰亚氨基等含有一个以上的杂原子的二价基团。所述含有一个以上的杂原子的二价基团,优选为配置于二价的连接基团L的一端或两端,更优选为配置于与肽部分B形成连接的末端。这种情况下,由式(I)表示的化合物通过水解等活体内的代谢反应,在二价的连接基团L的部分被切开,可释放出肾上腺髓质素或具有肾上腺髓质素活性的其修饰形式。特别适合的二价的连接基团L为1-氧代-1,6-己二基。通过具有包括所述特征的二价的连接基团L,由本发明的式(I)表示的化合物可以在活体内持续地表现肾上腺髓质素活性。
式(I)中,n需为整数0或1。当n为0时,由本发明的式(I)表示的化合物为由式(Ia)表示的化合物:
式(Ia):A-B (Ia)。
式(Ia)中,A和B具有与由式(I)所定义的相同的含义。
式(I)中,肽部分B需通过其N末端附近区域的基团与修饰基团A或连接基团L连接。肽部分B优选为通过其N末端氨基与修饰基团A或连接基团L连接。本发明中,肽部分B的“N末端附近的区域的基团”是指肽部分B的从N末端氨基酸残基至第13个残基的氨基酸残基的区域所包含的氨基酸残基的基团(例如,N末端氨基酸残基的α-氨基,或者各氨基酸残基侧链的氨基、羧基、羟基、咪唑基或胍基)、以及与所述氨基酸残基连接的修饰基团。
此外,本发明中,“肽部分B的N末端氨基”是指肽部分B的N末端氨基酸残基的α-氨基。通过为以上描述的连接形式,由本发明的式(I)表示的化合物可以在活体内持续地表现肾上腺髓质素活性。
特别适合的由式(I)表示的化合物中,
A为作为棕榈酰基的修饰基团,
n为0,
B为由肾上腺髓质素或具有肾上腺髓质素活性的其修饰形式衍生的肽部分,
其中肽部分B通过其N末端氨基与修饰基团A相连接;或者
A为作为聚乙二醇基的修饰基团,
L为作为取代或未取代的二价的烃基(所述基团包含一个以上的杂原子)的二价连接基团,
n为1,
B为由肾上腺髓质素或具有肾上腺髓质素活性的其修饰形式衍生的肽部分,
其中肽部分B通过其N末端氨基与修饰基团A或连接基团L连接。
本发明中,由式(I)表示的化合物不仅包含该化合物本身,还包含其盐。当由式(I)表示的化合物为盐的形式时,优选为药学上可接受的盐。作为本发明的化合物的盐的反离子,并没有限制,例如优选为如钠离子、钾离子、钙离子、镁离子、或者取代或者未取代的铵离子这样的阳离子;或者如氯离子、溴离子、碘离子、磷酸根离子、硝酸根离子、硫酸根离子、碳酸根离子、碳酸氢根离子、高氯酸离子、甲酸根离子、乙酸根离子、三氟乙酸根离子、丙酸根离子、乳酸根离子、马来酸根离子、羟基马来酸根离子、甲基马来酸根离子、富马酸根离子、己二酸根离子、苯甲酸根离子、2-乙酰氧基苯甲酸根离子、对氨基苯甲酸根离子、烟酸根离子、肉桂酸根离子、抗坏血酸根离子、帕莫酸根离子、琥珀酸根离子、水杨酸根离子、双亚甲基水杨酸根离子、草酸根离子、酒石酸根离子、苹果酸根离子、柠檬酸根离子、葡萄糖酸根离子、天冬氨酸根离子、硬脂酸根离子、棕榈酸根离子、衣康酸根离子、乙醇酸根离子、谷氨酸根离子、苯磺酸根离子、环己基氨基磺酸根离子、甲磺酸根离子、乙磺酸根离子、羟乙磺酸根离子、苯磺酸根离子、对甲苯磺酸根离子、或者萘磺酸根离子这样的阴离子。当由式(I)表示的化合物为与所述反离子的盐的形式时,该化合物的肾上腺髓质素活性可以与天然肾上腺髓质素实质上基本相同。
由式(I)表示的化合物不仅包含所述化合物本身,还包含该化合物或其盐的溶剂化物。当由式(I)表示的化合物或其盐为溶剂化物的形式时,优选为药学上可接受的溶剂化物。作为可以与所述化合物或其盐形成溶剂化物的溶剂,并没有限制,例如优选为水;或者如甲醇、乙醇、2-丙醇(异丙醇)、二甲基亚砜(DMSO)、乙酸、乙醇胺、乙腈或乙酸乙酯这样的有机溶剂。当由式(I)表示的化合物或其盐为与所述溶剂的溶剂化物的形式时,该化合物的肾上腺髓质素活性可以与天然肾上腺髓质素实质上基本相同。
由式(I)表示的化合物不仅包含所述化合物或下述化合物本身,还包含其受保护的形式。本说明书中,“受保护的形式”是指在一个或更多个的官能团(例如赖氨酸残基的侧链氨基)中引入保护基的形式。此外,本说明书中,“保护基”是指为了防止不希望的反应进行而引入至特定的官能团的基团,在特定的反应条件下可定量地除去,且在除此之外的反应条件下基本上稳定,即为反应惰性的基团。作为可以形成所述化合物的受保护的形式的保护基,并没有限制,例如可列举:叔丁氧基羰基(Boc)、2-溴苄氧基羰基(BrZ)、9-芴基甲氧基羰基(Fmoc)、对甲苯磺酰基(Tos)、苄基(Bzl)、4-甲基苄基(4-MeBzl)、2-氯苄氧基羰基(ClZ)、环己基(cHex)和苯甲酰甲基(Pac);作为氨基的其他保护基:苄氧基羰基、对氯苄氧基羰基、对溴苄氧基羰基、对硝基苄氧基羰基、对甲氧基苄氧基羰基、二苯甲氧基羰基、2-(对联苯基)异丙氧基羰基、2-(3,5-二甲氧基苯基)异丙氧基羰基、对苯基偶氮苄氧基羰基、三苯基磷酰基乙氧基羰基、9-芴基甲氧基羰基、叔戊氧基羰基、二异丙基甲氧基羰基、异丙氧基羰基、乙氧基羰基、烯丙氧基羰基、2-甲基磺酰基乙氧基羰基、2,2,2-三氯乙氧基羰基、环戊氧基羰基、环己氧基羰基、金刚烷氧基羰基、异莰氧基羰基、苯磺酰基、均三甲苯磺酰基、甲氧基三甲基苯磺酰基、2-硝基苯磺酰基、2-硝基苯磺酰基、4-硝基苯磺酰基和4-硝基苯磺酰基;作为羧基的其他保护基:甲酯、乙酯、叔丁酯、对甲氧基苄酯和对硝基苄酯;作为Arg的其他侧链保护基:2,2,4,6,7-五甲基-2,3-苯并二氢呋喃-5-磺酰基、4-甲氧基-2,3,6-三甲基苯磺酰基、2,2,5,7,8-五甲基色满-6-磺酰基和2-甲氧基苯磺酰基;作为Tyr的其他保护基:2,6-二氯苄基、叔丁基和环己基;作为Cys的其他保护基:4-甲氧基苄基、叔丁基、三苯甲基、乙酰胺甲基和3-硝基-2-吡啶次磺酰基;作为His的其他保护基:苄氧基甲基、对甲氧基苄氧基甲基、叔丁氧基甲基、三苯甲基和2,4-二硝基苯基;以及作为Ser和Thr的其他保护基:叔丁基等。当由式(I)表示的化合物为所述保护基的受保护的形式时,该化合物的肾上腺髓质素活性可以与天然肾上腺髓质素实质上基本相同。
此外,由式(I)表示的化合物还包含该化合物的各对映体和非对映体、以及外消旋体这样的该化合物的立体异构体的混合物。
通过具有上述特征,由式(I)表示的化合物基本上不会使肾上腺髓质素活性降低,可在活体内持续地表现肾上腺髓质素活性。
<2.肾上腺髓质素衍生物的药物用途>
由本发明的式(I)表示的化合物在活体内可以持续地表现与作为母体分子的肾上腺髓质素实质上基本相同的生物活性(即肾上腺髓质素活性)。因此,本发明涉及一种含有由本发明的式(I)表示的化合物作为有效成分的药物。
当将由本发明的式(I)表示的化合物应用于药物用途时,可以单独使用该化合物,也可以与一种或更多种药学上可接受的成分组合使用。本发明的药物根据所希望的给药方法,可以配制成在本技术领域通常使用的各种剂型。因此,本发明的药物还可以提供为含有由本发明的式(I)表示的化合物和一种或更多种药学上可接受的载体的药物组合物的形式。本发明的药物组合物除了上述成分之外,还可以包含药学上可接受的一种或更多种载体、赋形剂、粘合剂、媒介物、增溶剂、防腐剂、稳定剂、膨化剂、润滑剂、表面活性剂、油性液体、缓冲剂、舒缓剂、抗氧化剂、甜味剂和调味剂等。
含有由本发明的式(I)表示的化合物作为有效成分的药物的剂型,并没有特别限制,可以是用于肠胃外给药的制剂,也可以是用于口服给药的制剂。此外,本发明的药物的剂型可以是单位剂量形式的制剂,也可以是多次给药形式的制剂。作为用于肠胃外给药的制剂,例如可列举:水或除水之外的药学上可接受的液体的无菌性溶液或混悬液等注射剂。作为可以与注射剂混合的添加剂,并没有限制,例如可列举:如生理盐水、含有葡萄糖或其他辅助剂(例如,D-山梨醇、D-甘露醇或氯化钠)的等张液这样的媒介物;如醇(例如乙醇或者苄醇)、酯(例如苯甲酸苄酯)、多元醇(例如丙二醇或者聚乙二醇)这样的增溶剂;如聚山梨酯80或聚氧乙烯氢化蓖麻油这样的非离子表面活性剂;如芝麻油或大豆油这样的油性液体;如磷酸盐缓冲液或乙酸钠缓冲液这样的缓冲剂;如苯扎氯铵或盐酸普鲁卡因这样的舒缓剂;如人血清白蛋白或聚乙二醇这样的稳定剂;防腐剂及抗氧化剂等。配制的注射剂通常填充到适当的小瓶(例如安瓿瓶)中,保存在适合的环境下直至使用。
作为用于口服给药的制剂,例如可列举:根据需要涂覆有糖衣、水溶性膜的片剂、胶囊剂、酏剂、微囊剂、片剂、糖浆、混悬液等。作为可以与片剂或胶囊剂等混合的添加剂,并没有限制,例如可列举:如明胶、玉米淀粉、黄蓍胶和阿拉伯胶这样的粘合剂;如微晶纤维素这样的赋形剂;如玉米淀粉、明胶和海藻酸这样的膨化剂;如硬脂酸镁这样的润滑剂;如蔗糖、乳糖或糖精这样的甜味剂;如薄荷、白珠油(Akamono oil)或樱桃这样的调味剂等。当制剂为胶囊剂时,可以进一步含有油脂这样的液状载体。
由本发明的式(I)表示的化合物可以在活体内持续地表现与作为母体分子的肾上腺髓质素实质上基本相同的肾上腺髓质素活性。因此,含有由本发明的式(I)表示的化合物作为有效成分的药物可以配制为长效制剂。这种情况下,可以将呈长效制剂剂型的本发明的药物,例如通过埋入皮下或者肌肉内、或肌肉注射来给药。通过将本发明的药物应用于长效制剂,可以长时间持续地表现由本发明的式(I)表示的化合物的肾上腺髓质素活性。
含有由本发明的式(I)表示的化合物作为有效成分的药物,可以与作为药物有帮助的一种或更多种其他药剂同时使用。这种情况下,本发明的药物可以提供为包含由本发明的式(I)表示的化合物与一种或更多种其他药剂的单一药物的形式,也可以提供为包含由本发明的式(I)表示的化合物与一种或更多种其他药剂分别制剂化的多个制剂的药物组合或试剂盒的形式。在药物组合或试剂盒的形式的情况下,可以将各自的制剂同时或分别(例如连续地)给药。
当将由本发明的式(I)表示的化合物应用于药物用途时,由式(I)表示的化合物不仅包含该化合物本身,还包含该化合物的药学上可接受的盐及它们的药学上可接受的溶剂化物。作为由本发明的式(I)表示的化合物的药学上可接受的盐及它们的药学上可接受的溶剂化物,并没有限制,例如优选为如上述举例的盐或溶剂化物。当由式(I)表示的化合物为所述盐或溶剂化物的形式时,可以将该化合物应用于所希望的药物用途。
含有由本发明的式(I)表示的化合物作为有效成分的药物,可以对由肾上腺髓质素进行预防或治疗的各种状况、疾病和/或紊乱进行同样地预防或治疗。作为所述状况、疾病和/或紊乱,并没有限制,例如可举出如下内容:
(1)循环系统疾病:心功能不全、肺动脉高压症、闭塞性动脉硬化症、血栓闭塞性脉管炎、心肌梗塞、淋巴浮肿、川崎病、心肌炎、高血压、高血压所致的器官紊乱和动脉硬化症。
(2)肾脏与水电解质系统疾病:肾衰竭和肾炎。
(3)脑与神经系统疾病:脑梗塞和脑炎。
(4)泌尿生殖系统疾病:勃起功能障碍(ED)。
(5)消化系统疾病:炎性肠病、溃疡性疾病、肠白塞病和肝功能不全。
(6)骨科疾病:关节炎。
(7)内分泌代谢疾病:糖尿病和糖尿病所致的器官紊乱。
(8)其他:败血症性休克、自身免疫性疾病、多器官衰竭和褥疮。
所述循环系统疾病优选为心肌梗塞、肺动脉高压症或心功能不全等疾病。所述消化系统疾病优选为类固醇抵抗型或类固醇依赖型的炎性肠病(例如,溃疡性大肠炎、克罗恩病或肠白塞病)这样的炎性疾病。
由本发明的式(I)表示的化合物具有连接有作为天然的生理活性肽的肾上腺髓质素与修饰基团的结构。因此,由本发明的式(I)表示的化合物安全且毒性低。因此,含有由本发明的式(I)表示的化合物作为有效成分的药物,可以适用于需要预防或治疗所述状况、疾病和/或紊乱的各种给药对象。所述给药对象优选为人或非人哺乳动物(例如,猪、犬、牛、大鼠、小鼠、豚鼠、兔、鸡、羊、猫、猴、狒狒或黑猩猩等温血动物)的受试对象或患者。通过对所述给药对象给予本发明的药物,可以对由肾上腺髓质素进行预防或治疗的各种状况、疾病和/或紊乱进行预防或治疗。
本说明书中,“预防”是指实质上防止状况、疾病和/或紊乱的发生(发病或表现)。此外,本说明书中,“治疗”是指抑制(例如抑制进展)、明显减轻、修复和/或治愈发生(发病或发现)的状况、疾病和/或紊乱。
由本发明的式(I)表示的化合物可以在具有上述状况、疾病和/或紊乱(例如,循环系统疾病、周围血管疾病或炎性疾病)的给药对象中,用于预防或治疗该状况、疾病和/或紊乱。因此,本发明的药物优选为用于预防或治疗上述状况、疾病和/或紊乱的药物,更优选为用于预防或治疗循环系统疾病、炎性疾病或周围血管疾病的药物。此外,本发明涉及一种含有由本发明的式(I)表示的化合物作为有效成分的循环系统疾病、炎性疾病或周围血管疾病的预防或治疗剂。通过将由本发明的式(I)表示的化合物用于预防或治疗上述状况、疾病和/或紊乱,可以持续地预防或治疗该状况、疾病和/或紊乱。
由本发明的式(I)表示的化合物可以在具有上述状况、疾病和/或紊乱(例如,循环系统疾病、周围血管疾病或炎性疾病)的给药对象中,用于预防或治疗该状况、疾病和/或紊乱。因此,本发明的一个实施方式是预防或治疗上述疾病或者状况的方法,所述方法包括对需要预防或治疗上述状况、疾病和/或紊乱的给药对象,给予有效量的由本发明的式(I)表示的化合物或其药学上可接受的盐、或者它们的药学上可接受的水合物。所述状况、疾病和/或紊乱优选为循环系统疾病、周围血管疾病或炎性疾病。通过对需要预防或治疗所述状况、疾病和/或紊乱的给药对象给予由本发明的式(I)表示的化合物,可以预防或治疗该状况、疾病和/或紊乱。
本发明的另一个实施方式是用于预防或治疗所述说明的状况、疾病和/或紊乱的由本发明的式(I)表示的化合物或其药学上可接受的盐、或者它们的药学上可接受的水合物。本发明的其他实施方式是由本发明的式(I)表示的化合物或其药学上可接受的盐、或者它们的药学上可接受的水合物用于制备用于预防或治疗上述状况、疾病和/或紊乱的药物的用途。所述状况、疾病和/或紊乱优选为循环系统疾病、炎性疾病或周围血管疾病。通过将本发明的药物用于预防或治疗上述状况、疾病和/或紊乱,可以持续地预防或治疗该状况、疾病和/或紊乱。
当将含有由本发明的式(I)表示的化合物作为有效成分的药物对给药对象、特别是对人患者给药时,精确的给药量和给药次数要考虑到给药对象的年龄、性别、需要预防或治疗的状况、疾病和/或紊乱的精确状态(例如重症度)、以及给药途径等多种因素,主治医生应最终确定治疗上有效的给药量和给药次数。因此,本发明的药物中,作为有效成分的由式(I)表示的化合物可以以治疗上有效量和次数对给药对象给药。例如,当本发明的药物对人患者给药时,作为有效成分的由式(I)表示的化合物的给药量通常为在每天每60kg体重0.01~100mg的范围,典型地为每天每60kg体重0.01~10mg的范围。
含有由本发明的式(I)表示的化合物作为有效成分的药物的给药途径和给药次数并没有特别限制,可以口服单次或多次给药,也可以肠胃外单次或多次给药。本发明的药物优选为经静脉给药、灌肠给药、皮下给药、肌肉内给药或腹腔内给药这样的肠胃外途径给药,更优选为静脉给药或皮下给药。此外,本发明的药物优选为单次给药。本发明的药物特别优选为用于经静脉或皮下单次给药。作为由本发明的式(I)表示的化合物的母体分子的肾上腺髓质素具有很强的扩张血管作用。因此,当将治疗上有效量的肾上腺髓质素单次给药时,由于很强的扩张血管作用,可能引起血压下降过度、伴随反射性的交感神经活性增高的心动过速和/或肾素活性增高这样的不良的副作用。与此相对,由本发明的式(I)表示的化合物可在保持与天然肾上腺髓质素实质上基本相同的肾上腺髓质素活性的同时,与天然肾上腺髓质素相比,可显著延长血液中半衰期。因此,通过将含有由本发明的式(I)表示的化合物作为有效成分的药物经给药对象的静脉单次给药,可以在抑制由肾上腺髓质素的扩张血管作用引起的不良的副作用的同时,可以持续地预防或治疗给药对象的状况、疾病和/或紊乱。
<3.肾上腺髓质素衍生物的制备方法>
本发明还涉及一种由本发明的式(I)表示的化合物的制备方法。
[3-1.前体准备步骤]
本发明的方法可以包括准备由肾上腺髓质素或其修饰形式衍生的肽部分B的前体、选自由棕榈酰基和聚乙二醇基所组成的组中的修饰基团A的前体和二价基团Ln的前体中至少任一个的步骤。
本发明中,“由肾上腺髓质素或其修饰形式衍生的肽部分B的前体”、“选自由棕榈酰基和聚乙二醇基所组成的组中的修饰基团A的前体”和“二价基团Ln的前体”分别是指肾上腺髓质素或其修饰形式、棕榈酸或聚乙二醇、以及H-Ln-H,或者在下面说明的连接步骤中,肽部分B、修饰基团A和二价基团Ln的一端或两端以通过缩合反应而相互连接的方式,经适当改变或活化的它们的衍生物。肽部分B的前体优选为肾上腺髓质素或其修饰形式本身、或者它们的受保护的形式。修饰基团A的前体优选为棕榈酸或聚乙二醇本身、它们的活化衍生物、或者它们的受保护的形式。当修饰基团A为棕榈酰基时,例如优选为如棕榈酰氯这样的棕榈酸的酸性卤化物。二价基团Ln的前体优选为二价基团Ln的氢加成物H-Ln-H本身、其活化衍生物、或者它们的受保护的形式。当二价基团Ln为1-氧代-1,6-己二基(n为1)时,例如优选为如6-氯己酸N-羟基琥珀酰亚胺酯这样的活性酯。当所述的前体为受保护的形式时,优选为具有上述保护基。本步骤中,通过准备具有上述特征的前体,可以以高收率实施下面说明的连接步骤中的各前体的连接反应。
本步骤中,由肾上腺髓质素或其修饰形式衍生的肽部分B的前体,可以通过本技术领域中通常使用的方法来形成。当肽部分B的前体为肾上腺髓质素或其修饰形式本身时,例如,可以使用固相体系或液相体系的肽合成法,也可以使用由可产生肾上腺髓质素的人或非人哺乳动物的组织或细胞中提取天然肽的方法。或者也可以使用将可产生肾上腺髓质素的人或非人哺乳动物中的肾上腺髓质素进行编码的DNA(例如,序列号2、4、6、8、10或12),在大肠菌或芽殖酵母等的转化体系中大量表达重组蛋白质的方法。或者还可以使用购买预先已制备的肽等。在任一种情况下均包含于本步骤的实施方式。
在由所述方法形成的肽部分B的前体中,通过将该氨基酸序列中的两个半胱氨酸残基的硫醇基二硫键化,可以得到该氨基酸序列中的两个半胱氨酸残基形成有二硫键的前体。此外,在由所述方法形成的肽部分B的前体中,通过将在该氨基酸序列中的两个半胱氨酸残基之间形成的二硫键用亚乙基取代,可以得到该二硫键被亚乙基取代的前体。所述二硫键化反应和亚乙基的取代反应可以根据本技术领域中通常使用的条件来实施。所述二硫键化反应和亚乙基的取代反应可以在本步骤中实施,也可以在下面说明的连接步骤中实施。在任一种情况下均包含于本发明的方法的实施方式中。
当肽部分B的前体、修饰基团A的前体和二价基团Ln的前体中的至少一种为它们的受保护的形式时,在本步骤中,根据预期可以实施在肽部分B的前体、修饰基团A的前体和二价基团Ln的前体中的至少一种中引入一个或更多个保护基的保护步骤,和/或实施对肽部分B的前体、修饰基团A的前体和二价基团Ln的前体的受保护的形式中的至少任一种的一个或更多个保护基去保护的去保护步骤。所述保护步骤和去保护步骤可以通过本技术领域中通常使用的保护化反应和去保护化反应来实施。所述保护步骤和去保护步骤可以在本步骤中实施,也可在下面说明的连接步骤中实施。在任一种情况下均包含于本发明的方法的实施方式中。
[3-2.连接步骤]
本发明的方法需包括使由肾上腺髓质素或其修饰形式衍生的肽部分B的前体、选自由棕榈酰基和聚乙二醇基所组成的组中的修饰基团A的前体、二价基团Ln的前体进行连接而得到由式(I)表示的化合物的连接步骤。
式(I)中,当n为0时,本步骤通过使肽部分B的前体和修饰基团A的前体连接而实施。式(I)中,当n为1时,本步骤通过使肽部分B的前体、修饰基团A的前体、二价基团Ln的前体连接而实施。
本步骤中,将肽部分B的前体、修饰基团A的前体、二价基团Ln的前体连接的方法并没有特别限制。可以使用将本技术领域中通常使用的酸性卤化物(例如酸性氯化物)或活性酯(例如N-羟基琥珀酰亚胺酯)等用作前体的肽键的形成反应。
式(I)中,当n为1时,将肽部分B的前体、修饰基团A的前体、二价基团Ln的前体进行连接的顺序并没有特别限制。例如,可以首先将修饰基团A的前体、二价基团Ln的前体进行连接,然后进一步使该前体的连接物与肽部分B的前体进行连接。或者可以首先将肽部分B的前体、二价基团Ln的前体进行连接,然后进一步使该前体的连接物与修饰基团A的前体进行连接。在任一种情况下均包含于本发明的方法的实施方式中。
实施例
下面,利用实施例对本发明进行更具体地说明。但是,本发明的技术的范围并不限于这些实施例。
<I:化合物的制备>
按照下述方案,合成由肾上腺髓质素(AM)衍生的基团B的前体。将与人肾上腺髓质素的1~52氨基酸残基相对应的肽(h.AM(1-52))分成6个片段(Seg-1~Seg-6)。合成各片段后,分别缩合片段,合成基团B的前体肽。然后,将棕榈酰基(Pal)或聚乙二醇基(PEG)连接到基团B的前体肽,从而合成肾上腺髓质素衍生物。
[化1]
[化2]
Pal-h.AM的合成
PEG5000-h.AM的合成
[I-1:片段1的合成]
Boc-Gln-Gly-OPac
将Boc-Gly-OPac(88.0g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(65.5mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中添加Boc-Gln-OH(81.3g)和1-羟基苯并三唑(48.7g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(65.9mL)。在室温下搅拌反应溶液3小时。减压蒸馏除去N,N-二甲基甲酰胺。加入乙酸乙酯,稀释得到的溶液。用5%碳酸氢钠水溶液、0.5N盐酸水溶液和饱和食盐水洗涤该溶液。用MgSO4干燥有机层后,减压蒸馏除去乙酸乙酯。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的结晶溶解在氯仿/甲醇混合液中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到56g目标物。
Boc-Phe-Gln-Gly-OPac
将Boc-Gln-Gly-OPac(54.8g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(28mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中添加Boc-Phe-OH(35.2g)和1-羟基苯并三唑(19.3g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(26.2mL)。在室温下搅拌反应溶液4小时。向反应溶液中加入水。过滤收集析出的沉淀,用水和二乙醚洗涤。将得到的结晶溶解在氯仿/甲醇混合液中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到68.7g目标物。
Boc-Asn-Phe-Gln-Gly-OPac
将Boc-Phe-Gln-Gly-OPac(67.9g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(26mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中添加Boc-Asn-OH(30.5g)和1-羟基苯并三唑(19.4g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(21.8mL)。在室温下搅拌反应溶液一夜。向反应溶液中加入水。过滤收集析出的沉淀,用水和二乙醚洗涤。将得到的结晶溶解在N,N-二甲基甲酰胺中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到81g目标物。
Boc-Asn-Asn-Phe-Gln-Gly-OPac
将Boc-Asn-Phe-Gln-Gly-OPac(81g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(26mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺/1,3-二甲基-2-咪唑啉酮混合液中。在得到的溶液中添加Boc-Asn-OH(28.9g)和1-羟基苯并三唑(19.2g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(26.0mL)。在室温下搅拌反应溶液一夜。向反应溶液中加入水。过滤收集析出的沉淀,用水、乙腈和二乙醚洗涤。通过所述操作,得到74g目标物。
Boc-Met-Asn-Asn-Phe-Gln-Gly-OPac
将Boc-Asn-Asn-Phe-Gln-Gly-OPac(50.0g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(13.7mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺/1-甲基-2-吡咯烷酮/1,3-二甲基-2-咪唑啉酮混合液中。在得到的溶液中添加Boc-Met-OH(16.4g)和1-羟基苯并三唑(9.4g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(12.6mL)。在室温下搅拌反应溶液一夜。向反应溶液中加入水。过滤收集析出的沉淀,用水、乙腈和二乙醚洗涤。通过所述操作,得到54g目标物。
Boc-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-OPac
将Boc-Met-Asn-Asn-Phe-Gln-Gly-OPac(53.0g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(12.5mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在1-甲基-2-吡咯烷酮/1,3-二甲基-2-咪唑啉酮混合液中。在得到的溶液中添加Boc-Ser(Bzl)-OH(17.7g)和1-羟基苯并三唑(8.5g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(11.5mL)。在室温下搅拌反应溶液一夜。向反应溶液中加入水。过滤收集析出的沉淀,用水、乙腈和二乙醚洗涤。通过所述操作,得到56.5g目标物。
Boc-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-OPac
将Boc-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-OPac(30.0g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(5.9mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在二甲基亚砜/1-甲基-2-吡咯烷酮/1,3-二甲基-2-咪唑啉酮混合液中。在得到的溶液中添加Boc-Gln-OH(7.3g)和1-羟基苯并三唑(5.5g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(7.5mL)。在室温下搅拌反应溶液一夜。向反应溶液中加入水。过滤收集析出的沉淀,用水、乙腈和二乙醚洗涤。通过所述操作,得到24.0g目标物。
Boc-Arg(Tos)-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-OPac
将Boc-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-OPac(16.2g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(2.9mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在二甲基亚砜/1-甲基-2-吡咯烷酮混合液中。在得到的溶液中添加Boc-Arg(Tos)-OH(7.4g)和1-羟基苯并三唑(2.1g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(2.9mL)。在室温下搅拌反应溶液一夜。向反应溶液中加入水。过滤收集析出的沉淀,用水、乙腈和二乙醚洗涤。通过所述操作,得到12.5g目标物。
Boc-Tyr(BrZ)-Arg(Tos)-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-OPac
将Boc-Arg(Tos)-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-OPac(12.5g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(1.7mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在二甲基亚砜/1-甲基-2-吡咯烷酮混合液中。在得到的溶液中添加Boc-Tyr(BrZ)-OH(4.4g)和1-羟基苯并三唑(1.5g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(1.7mL)。在室温下搅拌反应溶液一夜。向反应溶液中加入乙腈。过滤收集析出的沉淀,用乙腈和二乙醚洗涤。通过所述操作,得到11g目标物。
Boc-Tyr(BrZ)-Arg(Tos)-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-OH(片段1)
将Boc-Arg(Tos)-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-OPac(6.0g)溶解在二甲基亚砜中。在得到的溶液中,在30℃下添加甲酸铵水溶液(10mmol/L)(15.6mL)、乙酸(18.7mL)和锌粉(10.2g)。1小时后,从反应溶液中过滤除去锌粉,用二甲基亚砜洗涤。向反应溶液中加入水。过滤收集析出的沉淀,用水、乙腈和二乙醚洗涤。通过所述操作,得到5.5g目标物。
[I-2:片段2的合成]
Boc-Phe-Gly-OPac
将Boc-Gly-OPac(44g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(33mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在二氯甲烷中。在得到的溶液中添加Boc-Phe-OH(36.6g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(27.5mL)。在室温下搅拌反应溶液一夜。用0.5N盐酸水溶液和饱和食盐水洗涤反应溶液。用MgSO4干燥有机层后,减压蒸馏除去二氯甲烷。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的结晶溶解在氯仿中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到38g目标物。
Boc-Ser(Bzl)-Phe-Gly-OPac
将Boc-Phe-Gly-OPac(8.8g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(4.5mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中添加Boc-Ser(Bzl)-OH(6.2g)和1-羟基苯并三唑(2.8g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(3.8mL)。在室温下搅拌反应溶液一夜。向反应溶液中加入水。过滤收集析出的沉淀,用水洗涤。将得到的结晶溶解在氯仿/甲醇混合液中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到11.5g目标物。
Boc-Arg(Tos)-Ser(Bzl)-Phe-Gly-OPac
将Boc-Ser(Bzl)-Phe-Gly-OPac(11.4g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(4.8mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中添加Boc-Arg(Tos)-OH(10g)和1-羟基苯并三唑(2.8g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(4mL)。在室温下搅拌反应溶液一夜。用乙酸乙酯稀释反应溶液,并用5%碳酸氢钠水溶液、0.5N盐酸水溶液和饱和食盐水洗涤。用MgSO4干燥有机层后,减压蒸馏除去乙酸乙酯。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的结晶溶解在乙酸乙酯中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到15.8g目标物。
Boc-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-OPac
将Boc-Arg(Tos)-Ser(Bzl)-Phe-Gly-OPac(15.7g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(4mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Leu-OH·H2O(4.6g)和1-羟基苯并三唑(2.6g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(3.6mL)。在室温下搅拌反应溶液4小时。向反应溶液中加入水。过滤收集析出的沉淀,用水洗涤。将得到的结晶溶解在氯仿/甲醇混合液中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到17.6g目标物。
Boc-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-OH
将Boc-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-OPac(17.6g)溶解在乙酸中。在得到的溶液中,在40℃下添加锌粉(55.2g)。2小时后,从反应溶液中过滤除去锌粉,用乙酸洗涤。减压蒸馏除去乙酸后,用乙酸乙酯稀释溶液。对得到的溶液用0.1N盐酸水溶液和饱和食盐水进行洗涤。用MgSO4干燥有机层后,减压蒸馏除去乙酸乙酯。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的结晶溶解在氯仿中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到13.9g目标物。
Boc-Arg(Tos)-Phe-Gly-OPac
将Boc-Phe-Gly-OPac(8.8g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(4.0mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中添加Boc-Arg(Tos)-OH(10.3g)和1-羟基苯并三唑(2.8g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(3.8mL)。在室温下搅拌反应溶液一夜。用乙酸乙酯稀释溶液。对得到的溶液用5%碳酸氢钠水溶液、0.5N盐酸水溶液和饱和食盐水进行洗涤。用MgSO4干燥有机层后,减压蒸馏除去乙酸乙酯。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的结晶溶解在乙酸乙酯中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到14.7g目标物。
Boc-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-OPac
将Boc-Arg(Tos)-Phe-Gly-OPac(14.5g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(3.9mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Cys(4-MeBzl)-OH(6.9g)和1-羟基苯并三唑(2.8g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(3.8mL)。在室温下搅拌反应溶液3小时。向反应溶液中加入水。过滤收集析出的沉淀,用水和正己烷洗涤。将得到的结晶溶解在氯仿/甲醇混合液中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到17.2g目标物。
Boc-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-OPac
将Boc-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-OPac(9.1g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(1.9mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-OH(9.2g)和1-羟基苯并三唑(1.4g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(1.8mL)。在室温下搅拌反应溶液一夜。向反应溶液中加入水。过滤收集析出的沉淀,用水和二乙醚洗涤。将得到的结晶溶解在N,N-二甲基甲酰胺中。减压蒸馏除去溶剂。加入乙腈。过滤收集析出的沉淀,用乙腈和二乙醚洗涤。通过所述操作,得到16.2g目标物。
Boc-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-OH(片段2)
将Boc-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-OPac(7.1g)溶解在1-甲基-2-吡咯烷酮/N,N-二甲基甲酰胺混合液中。在得到的溶液中,在40℃下添加甲酸铵水溶液(10mmol/L)(12mL)、乙酸(7.2mL)和锌粉(7.8g)。1小时后,从反应溶液中过滤除去锌粉,用N,N-二甲基甲酰胺洗涤。减压蒸馏除去N,N-二甲基甲酰胺,在残渣内加入水。过滤收集析出的沉淀,用水和二乙醚洗涤。将得到的结晶溶解在N,N-二甲基甲酰胺中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到6g目标物。
[I-3:片段3的合成]
Boc-Leu-Ala-OPac
将Boc-Ala-OPac(33.8g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(25mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在二氯甲烷中。在得到的溶液中,添加Boc-Leu-OH·H2O(24.9g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(19.2mL)。在室温下搅拌反应溶液3小时。用0.5N盐酸水溶液和饱和食盐水洗涤反应溶液。减压蒸馏除去二氯甲烷,向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的结晶溶解在氯仿中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到30.1g目标物。
Boc-Lys(ClZ)-Leu-Ala-OPac
将Boc-Leu-Ala-OPac(29.4g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(16.5mL)。在得到的混合物中加入二异丙基醚。过滤收集析出的沉淀,用二异丙基醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Lys(ClZ)-OH(30.5g)和1-羟基苯并三唑(10.2g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(13.8mL)。在室温下搅拌反应溶液3小时。用乙酸乙酯稀释溶液。用0.5N盐酸水溶液和饱和食盐水洗涤该溶液。减压蒸馏除去乙酸乙酯,向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的结晶溶解在氯仿/甲醇混合液中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到47.5g目标物。
Boc-Gln-Lys(ClZ)-Leu-Ala-OPac
将Boc-Lys(ClZ)-Leu-Ala-OPac(47.3g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(15.6mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Gln-OH(17.6g)和1-羟基苯并三唑(9.8g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(13.3mL)。在室温下搅拌反应溶液4小时。向反应溶液中加入水。过滤收集析出的沉淀,用水、甲醇和二乙醚洗涤。通过所述操作,得到54.5g目标物。
Boc-Val-Gln-Lys(ClZ)-Leu-Ala-OPac
将Boc-Gln-Lys(ClZ)-Leu-Ala-OPac(54.1g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(15mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Val-OH(14.6g)和1-羟基苯并三唑(9.1g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(13.3mL)。在室温下搅拌反应溶液4小时。向反应溶液中加入水。过滤收集析出的沉淀,用水、甲醇和二乙醚洗涤。通过所述操作,得到59.2g目标物。
Boc-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-OPac
将Boc-Val-Gln-Lys(ClZ)-Leu-Ala-OPac(58.6g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(15mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Thr(Bzl)-OH(14.6g)和1-羟基苯并三唑(8.8g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(11.9mL)。在室温下搅拌反应溶液4小时。向反应溶液中加入水。过滤收集析出的沉淀,用水、甲醇、二乙醚、乙腈和二乙醚洗涤。通过所述操作,得到70.2g目标物。
Boc-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-OPac
将Boc-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-OPac(34.1g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(7.1mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在1-甲基-2-吡咯烷酮中。在得到的溶液中,添加Boc-Cys(4-MeBzl)-OH(10.5g)、1-羟基苯并三唑(4.5g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(6.0mL)。在室温下搅拌反应溶液4小时。向反应溶液中加入水。过滤收集析出的沉淀,用水、甲醇、二乙醚、乙腈和二乙醚洗涤。通过所述操作,得到38.4g目标物。
Boc-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-OPac
将Boc-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-OPac(37.6g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(6.5mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在二甲基亚砜/1-甲基-2-吡咯烷酮/1,3-二甲基-2-咪唑啉酮混合液中。在得到的溶液中,添加Boc-Thr(Bzl)-OH(9.3g)和1-羟基苯并三唑(4.2g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(5.6mL)。在室温下搅拌反应溶液4小时。向反应溶液中加入水。过滤收集析出的沉淀,用水、甲醇、二乙醚、乙腈和二乙醚洗涤。将残渣溶解在氯仿/2,2,2-三氟乙醇混合液中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到42.0g目标物。
Boc-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-OH(片段3)
将Boc-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-OPac(15.3g)溶解在二氯甲烷/2,2,2-三氟乙醇混合液中。在得到的溶液中,在30℃下添加甲酸铵水溶液(10mmol/L)(10mL)、乙酸(6mL)和锌粉(32g)。30分钟后,从反应溶液中过滤除去锌粉,用二氯甲烷/2,2,2-三氟乙醇混合液洗涤。减压蒸馏除去溶剂,向残渣中加入盐酸水溶液。过滤收集析出的沉淀,用水、二乙醚洗涤。将得到的结晶溶解在N,N-二甲基甲酰胺中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到14.1g目标物。
[I-4:片段4的合成]
Boc-Tyr(BrZ)-Gln-OPac
将Boc-Gln-OPac(36.5g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(20mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐添加在N,N-二甲基甲酰胺中。在得到的混合物中添加Boc-Tyr(BrZ)-OH(54g)和1-羟基苯并三唑(14.8g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(20mL)。在室温下搅拌反应溶液一夜。用乙酸乙酯稀释反应溶液。用5%碳酸氢钠水溶液、0.5N盐酸水溶液和饱和食盐水洗涤该溶液。用MgSO4干燥有机层后,减压蒸馏除去乙酸乙酯。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的结晶添加在乙酸乙酯/甲醇混合液中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到29.8g目标物。
Boc-Ile-Tyr(BrZ)-Gln-OPac
将Boc-Tyr(BrZ)-Gln-OPac(29g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(9mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐添加在N,N-二甲基甲酰胺中。在该混合物中添加Boc-Ile-OH·1/2H2O(10.5g)和1-羟基苯并三唑(5.9g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(8mL)。在室温下搅拌反应溶液一夜。向反应溶液中加入乙腈。过滤收集析出的沉淀,用乙腈和二乙醚洗涤。通过所述操作,得到32.0g目标物。
Boc-Gln-Ile-Tyr(BrZ)-Gln-OPac
将Boc-Ile-Tyr(BrZ)-Gln-OPac(25.5g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(7mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐添加在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Gln-OH(7.7g)和1-羟基苯并三唑(4.5g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(6mL)。在室温下搅拌反应溶液一夜。向反应溶液中加入乙腈。过滤收集析出的沉淀,用乙腈和二乙醚洗涤。通过所述操作,得到27.3g目标物。
Boc-His-Gln-Ile-Tyr(BrZ)-Gln-OPac
将Boc-Gln-Ile-Tyr(BrZ)-Gln-OPac(19.6g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(5mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐添加在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-His(Tos)-OH(9.0g)和1-羟基苯并三唑(3.0g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(4mL)。在室温下搅拌反应溶液一夜。向反应溶液中加入乙腈。过滤收集析出的沉淀,用乙腈和二乙醚洗涤。通过所述操作,得到18.3g目标物。
Boc-His-Gln-Ile-Tyr(BrZ)-Gln-OH(片段4)
将Boc-His-Gln-Ile-Tyr(BrZ)-Gly-OPac(15.0g)溶解在二氯甲烷/2,2,2-三氟乙醇/乙酸混合液中。在得到的溶液中,在40℃下添加锌粉(43.9g)。30分钟后,从反应溶液中过滤除去锌粉,用二氯甲烷/2,2,2-三氟乙醇混合液洗涤。减压蒸馏除去溶剂,向残渣中加入水。过滤收集析出的沉淀,用水、盐酸水溶液、水、二乙醚、乙腈和二乙醚洗涤。将得到的结晶溶解在N,N-二甲基甲酰胺中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到9.5g目标物。
[I-5:片段5的合成]
Boc-Ala-Pro-OPac
将Boc-Ala-OH(95g)、Pro-OBzl·HCl(127g)和1-羟基苯并三唑(7g)添加到二氯甲烷中。在得到的溶液中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(96mL)。在室温下搅拌反应溶液一夜。减压蒸馏除去二氯甲烷,用乙酸乙酯稀释残渣。用5%碳酸氢钠水溶液、0.5N盐酸水溶液和饱和食盐水洗涤有机层。减压蒸馏除去乙酸乙酯,向残渣中加入正己烷。过滤收集析出的沉淀,用正己烷洗涤。通过所述操作,得到158g的结晶。将27.1g的所述结晶溶解在甲醇中。在得到的溶液中,添加5%Pd-C(5g)。在反应溶液中通入氢气。反应完成后,过滤并除去5%Pd-C。减压蒸馏除去甲醇。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到19.7g的结晶。将19.7g的所述结晶溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加苯甲酰甲基溴(14.4g)和三乙胺(10.1mL)。搅拌反应溶液1小时。用乙酸乙酯稀释反应溶液。对得到的溶液用5%碳酸氢钠水溶液、0.5N盐酸水溶液和饱和食盐水进行洗涤。用MgSO4干燥有机层后,减压蒸馏除去乙酸乙酯。加入正己烷。过滤收集析出的沉淀,用正己烷洗涤。通过所述操作,得到25.2g目标物。
Boc-Val-Ala-Pro-OPac
将Boc-Ala-Pro-OPac(25.8g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(14.7mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐添加在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Val-OH(14.5g)和1-羟基苯并三唑(9.5g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(12.8mL)。在室温下搅拌反应溶液一夜。用乙酸乙酯稀释反应溶液。对得到的溶液用5%碳酸氢钠水溶液、0.5N盐酸水溶液和饱和食盐水进行洗涤。用MgSO4干燥有机层后,减压蒸馏除去乙酸乙酯。向残渣中加入正己烷。过滤收集析出的沉淀,用正己烷洗涤。将得到的结晶溶解在乙酸乙酯中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到24.4g目标物。
Boc-Asn-Val-Ala-Pro-OPac
将Boc-Val-Ala-Pro-OPac(24.4g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(11.2mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐添加在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Asn-OH(11.8g)和1-羟基苯并三唑(7.2g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(9.8mL)。在室温下搅拌反应溶液一夜。用乙酸乙酯稀释反应溶液。对得到的溶液用5%碳酸氢钠水溶液、0.5N盐酸水溶液和饱和食盐水进行洗涤。用MgSO4干燥有机层后,减压蒸馏除去乙酸乙酯。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的结晶溶解在氯仿中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到26.5g目标物。
Boc-Asp(OcHex)-Asn-Val-Ala-Pro-OPac
将Boc-Asn-Val-Ala-Pro-OPac(26.5g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(10mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐添加在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Asp(OcHex)-OH(14.2g)和1-羟基苯并三唑(6.4g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(8.6mL)。在室温下搅拌反应溶液一夜。用乙酸乙酯稀释反应溶液。对得到的溶液用5%碳酸氢钠水溶液、0.5N盐酸水溶液和饱和食盐水进行洗涤。用MgSO4干燥有机层后,减压蒸馏除去乙酸乙酯。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到33.8g目标物。
Boc-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OPac
将Boc-Asp(OcHex)-Asn-Val-Ala-Pro-OPac(33.8g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(9.6mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐添加在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Lys(ClZ)-OH(18.0g)和1-羟基苯并三唑(6.2g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(8.4mL)。在室温下搅拌反应溶液一夜。用乙酸乙酯稀释反应溶液。对得到的溶液用5%碳酸氢钠水溶液、0.5N盐酸水溶液和饱和食盐水进行洗涤。用MgSO4干燥有机层后,减压蒸馏除去乙酸乙酯。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的结晶溶解在氯仿中。减压蒸馏除去溶剂。加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到46.0g目标物。
Boc-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OPac
将Boc-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OPac(45.8g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(9.5mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在1-甲基-2-吡咯烷酮/N,N-二甲基甲酰胺混合液中。在得到的溶液中,添加Boc-Asp(OcHex)-OH(12.2g)和1-羟基苯并三唑(5.5g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(7.4mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入水。过滤收集析出的沉淀,用水洗涤。将残渣溶解在氯仿中,减压蒸馏除去溶剂。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到50.3g目标物。
Boc-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OPac
将Boc-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OPac(23.6g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(4.2mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在1-甲基-2-吡咯烷酮/N,N-二甲基甲酰胺混合液中。在得到的溶液中,添加Boc-Lys(ClZ)-OH(7.4g)和1-羟基苯并三唑(2.5g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(3.4mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入水。过滤收集析出的沉淀,用水和二乙醚洗涤。将残渣溶解在氯仿/甲醇混合液中,减压蒸馏除去溶剂。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到24.2g目标物。
Boc-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OPac
将Boc-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OPac(24.0g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(3.4mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在1-甲基-2-吡咯烷酮/N,N-二甲基甲酰胺混合液中。在得到的溶液中,添加Boc-Asp(OcHex)-OH(4.9g)和1-羟基苯并三唑(2.2g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(3.0mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入水。过滤收集析出的沉淀,用水和二乙醚洗涤。将残渣溶解在氯仿/2,2,2-三氟乙醇混合液中,减压蒸馏除去溶剂。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到27.1g目标物。
Boc-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OPac
将Boc-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OPac(27.1g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(3.4mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在1-甲基-2-吡咯烷酮/N,N-二甲基甲酰胺混合液中。在得到的溶液中,添加Boc-Thr(Bzl)-OH(4.6g)和1-羟基苯并三唑(2.1g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(2.9mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入水。过滤收集析出的沉淀,用水和二乙醚洗涤。将残渣溶解在氯仿/2,2,2-三氟乙醇混合液中,减压蒸馏除去溶剂。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到26.0g目标物。
Boc-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OPac
将Boc-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OPac(24.0g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(2.8mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在1-甲基-2-吡咯烷酮/N,N-二甲基甲酰胺混合液中。在得到的溶液中,添加Boc-Phe-OH(3.4g)和1-羟基苯并三唑(1.8g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(2.4mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入水。过滤收集析出的沉淀,用水和二乙醚洗涤。将残渣溶解在N,N-二甲基甲酰胺混合液中。在得到的溶液中,添加乙腈。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到24.3g目标物。
Boc-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OH(片段5)
将Boc-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OPac(24.3g)溶解在乙酸中。在得到的溶液中,在40℃下添加锌粉(36.9g)。2小时后,从反应溶液中过滤除去锌粉,用乙酸洗涤。减压蒸馏除去乙酸,向残渣中加入水。过滤收集析出的沉淀,用水和二乙醚洗涤。将残渣添加在N,N-二甲基甲酰胺混合液中,加入乙腈。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到21.0g目标物。
[I-6:片段6的合成]
Boc-Gly-Tyr(Br-Z)-NH2
将Boc-Tyr(Br-Z)-NH2(49.3g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(21.8mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Gly-OH(18.0g)和1-羟基苯并三唑(14.9g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(20.1mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入碳酸氢钠水溶液。过滤收集析出的沉淀,用水洗涤。将残渣溶解在氯仿/甲醇混合液中,减压蒸馏除去溶剂。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到55g目标物。
Boc-Gln-Gly-Tyr(Br-Z)-NH2
将Boc-Gly-Tyr(Br-Z)-NH2(55g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(21.8mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Gln-OH(27g)和1-羟基苯并三唑(14.9g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(20.1mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入碳酸氢钠水溶液。过滤收集析出的沉淀,用水洗涤。将残渣溶解在氯仿/甲醇混合液中,减压蒸馏除去溶剂。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到59g目标物。
Boc-Pro-Gln-Gly-Tyr(Br-Z)-NH2
将Boc-Gln-Gly-Tyr(Br-Z)-NH2(59g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(19.0mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Pro-OH(19.3g)和1-羟基苯并三唑(12.9g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(17.5mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入碳酸氢钠水溶液。过滤收集析出的沉淀,用水洗涤。将残渣溶解在氯仿/甲醇混合液中,减压蒸馏除去溶剂。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到60.6g目标物。
Boc-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2
将Boc-Pro-Gln-Gly-Tyr(Br-Z)-NH2(60.6g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(15.4mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Ser(Bzl)-OH(24.3g)和1-羟基苯并三唑(11.6g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(15.8mL)。在室温下搅拌反应溶液一夜。从反应溶液中减压蒸馏除去N,N-二甲基甲酰胺。向残渣中加入碳酸氢钠水溶液。过滤收集析出的沉淀,用水和二乙醚洗涤。将残渣溶解在氯仿/甲醇混合液中,减压蒸馏除去溶剂。向残渣中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到17g目标物。
Boc-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2
将Boc-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(16.7g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(4.2mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Ile-OH·1/2H2O(4.8g)和1-羟基苯并三唑(2.9g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(3.9mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入碳酸氢钠水溶液。过滤收集析出的沉淀,用水和二乙醚洗涤。通过所述操作,得到17g目标物。
Boc-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2
将Boc-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(17.9g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(4.0mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Lys(ClZ)-OH(8.0g)和1-羟基苯并三唑(2.7g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(3.7mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入碳酸氢钠水溶液。过滤收集析出的沉淀,用水和甲醇洗涤。通过所述操作,得到22.0g目标物。
Boc-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2
将Boc-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(22.0g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(3.8mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Ser(Bzl)-OH(5.4g)和1-羟基苯并三唑(2.6g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(3.5mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入碳酸氢钠水溶液。过滤收集析出的沉淀,用水和甲醇洗涤。通过所述操作,得到20.2g目标物。
Boc-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(片段6)
将Boc-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(22.2g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(3.0mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在N,N-二甲基甲酰胺中。在得到的溶液中,添加Boc-Arg(Tos)-OH(7.3g)和1-羟基苯并三唑(2.1g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(2.8mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入碳酸氢钠水溶液。过滤收集析出的沉淀,用水和甲醇洗涤。通过所述操作,得到23.1g目标物。
[I-7:受保护的h.AM的片段缩合(1)]
Boc-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2
将Boc-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(1.9g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(0.22mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在1-甲基-2-吡咯烷酮/N,N-二甲基甲酰胺混合液中。在得到的溶液中,添加Boc-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-OH(2.0g)和1-羟基苯并三唑(0.15g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(0.20mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入碳酸氢钠水溶液。过滤收集析出的沉淀,用水和二乙醚洗涤。将残渣溶解在N,N-二甲基甲酰胺中。从得到的溶液减压蒸馏除去N,N-二甲基甲酰胺,加入乙酸乙酯。过滤收集析出的沉淀,用乙酸乙酯洗涤。通过所述操作,得到3.3g目标物。
[I-8:受保护的h.AM的片段缩合(2)]
Boc-His-Gln-Ile-Tyr(BrZ)-Gln-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2
将Boc-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(3.3g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(0.19mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在1-甲基-2-吡咯烷酮中。在得到的溶液中,添加Boc-His-Gln-Ile-Tyr(BrZ)-Gln-OH(0.9g)和3,4-二氢-3-羟基-4-氧代-1,2,3-苯并三嗪(0.13g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(0.18mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入碳酸氢钠水溶液。过滤收集析出的沉淀,用水和二乙醚洗涤。将残渣溶解在N,N-二甲基甲酰胺中。从得到的溶液减压蒸馏除去N,N-二甲基甲酰胺,加入乙腈。过滤收集析出的沉淀,用乙腈洗涤。通过所述操作,得到3.0g目标物。
[I-9:受保护的h.AM的片段缩合(3)]
Boc-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-His-Gln-Ile-Tyr(BrZ)-Gln-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2
将Boc-His-Gln-Ile-Tyr(BrZ)-Gln-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(2.5g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(0.23mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在1-甲基-2-吡咯烷酮/N,N-二甲基甲酰胺混合液中。在得到的溶液中,添加Boc-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-OH(0.78g)和3,4-二氢-3-羟基-4-氧代-1,2,3-苯并三嗪(0.077g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(0.10mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入碳酸氢钠水溶液。过滤收集析出的沉淀,用水和二乙醚洗涤。将残渣溶解在氯仿/2,2,2-三氟乙醇混合液中。从得到的溶液中减压蒸馏除去溶剂,加入乙酸乙酯。过滤收集析出的沉淀,用乙酸乙酯洗涤。通过所述操作,得到2.1g目标物。
[I-10:受保护的h.AM的片段缩合(4)]
Boc-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-His-Gln-Ile-Tyr(BrZ)-Gln-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2
将Boc-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-His-Gln-Ile-Tyr(BrZ)-Gln-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(2.0g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(0.15mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在二甲基亚砜/1-甲基-2-吡咯烷酮/N,N-二甲基甲酰胺混合液中。在得到的溶液中,添加Boc-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-OH(0.56g)和1-羟基苯并三唑(0.091g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(0.12mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入碳酸氢钠水溶液。过滤收集析出的沉淀,用水和二乙醚洗涤。将残渣溶解在氯仿/2,2,2-三氟乙醇混合液中。从得到的溶液中减压蒸馏除去溶剂,加入乙腈。过滤收集析出的沉淀,用乙腈洗涤。通过所述操作,得到1.8g目标物。
[I-11:受保护的h.AM的片段缩合(5)]
Boc-Tyr(BrZ)-Arg(Tos)-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-His-Gln-Ile-Tyr(BrZ)-Gln-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(Boc-保护的h.AM(1-52))
将Boc-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-His-Gln-Ile-Tyr(BrZ)-Gln-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(1.5g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(0.09mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在二甲基亚砜中。在得到的溶液中,添加Boc-Tyr(BrZ)-Arg(Tos)-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-OH(0.40g)和1-羟基苯并三唑(0.081g)。在该混合物中,在冷却下滴加1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(0.11mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入碳酸氢钠水溶液。过滤收集析出的沉淀,用水和二乙醚洗涤。将残渣溶解在氯仿/2,2,2-三氟乙醇混合液中。从得到的溶液中减压蒸馏除去溶剂,加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到1.6g目标物。
[I-12:棕榈酰-h.AM的合成(1)]
Pal-Tyr(BrZ)-Arg(Tos)-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-His-Gln-Ile-Tyr(BrZ)-Gln-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2
将Boc-Tyr(BrZ)-Arg(Tos)-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-His-Gln-Ile-Tyr(BrZ)-Gln-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(0.23g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(0.02mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在氯仿/2,2,2-三氟乙醇混合液中。在得到的溶液中,在冷却下滴加将棕榈酰氯(0.015g)、1-羟基-7-氮杂苯并三唑(0.015g)和二异丙基乙胺(0.014mL)添加至四氢呋喃的溶液,及二异丙基乙胺(0.004mL)。在室温下搅拌反应溶液一夜。从反应溶液中减压蒸馏除去溶剂,加入乙腈。过滤收集析出的沉淀,用乙腈洗涤。通过所述操作,得到0.24g目标物。
[I-13:棕榈酰-h.AM的合成(2)]
Pal-h.AM(1-52)三氟乙酸盐
在Pal-Tyr(BrZ)-Arg(Tos)-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-His-Gln-Ile-Tyr(BrZ)-Gln-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(238mg)中加入对甲酚(1.5mL)和甲硫氨酸(37mg)。在得到的溶液中,在冷却下加入无水氟化氢(6mL)。在-2~-5℃下,处理反应溶液60分钟。从反应溶液中减压蒸馏除去无水氟化氢,加入二乙醚。过滤收集析出的沉淀。将得到的粗肽溶解在50%乙酸水溶液中。在得到的溶液中加入0.1M碘/甲醇溶液(0.24mL)。1分钟后,向该溶液中加入1M抗坏血酸/水(0.24mL)。用反相HPLC从得到的溶液中纯化目标物。对目标物冷冻干燥后,得到38mg的白色粉末。
[I-14:棕榈酰-h.AM的合成(3)]
Pal-h.AM(1-52)乙酸盐
将Pal-h.AM(1-52)三氟乙酸盐(38mg)溶解在5%乙酸水溶液中。将得到的溶液应用于Muromac 1×2(乙酸型)柱(3mL)中,用5%乙酸水溶液洗脱。冷冻干燥洗脱液。对目标物冷冻干燥后,得到32mg的白色粉末。
[I-15:棕榈酰-h.AM的合成(4)]
将Pal-h.AM(1-52)乙酸盐包装在小瓶中
将Pal-h.AM(1-52)乙酸盐(16.5mg)溶解在Milli-Q水(18.3mL)中。将得到的溶液分别以0.30mL分注到小瓶中,冷冻干燥。用6M盐酸水溶液水解3瓶得到的冷冻干燥物。使得到的水解物经受氨基酸分析。通过所述氨基酸分析,对内容量进行定量。收率:38nmol×57瓶。
[I-16:PEG5000-h.AM的合成(1)]
Fmoc-Tyr(BrZ)-Arg(Tos)-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-His-Gln-Ile-Tyr(BrZ)-Gln-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2
将Boc-Tyr(BrZ)-Arg(Tos)-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-His-Gln-Ile-Tyr(BrZ)-Gln-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(0.9g)溶解在三氟乙酸中。在冷却下搅拌得到的溶液10分钟,然后在室温下搅拌50分钟。从反应溶液中减压蒸馏除去三氟乙酸,添加氯化氢的二噁烷溶液(5.5mol/L)(0.05mL)。在得到的混合物中加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。将得到的盐酸盐溶解在二甲基亚砜/N,N-二甲基甲酰胺混合液中。在得到的溶液中,添加碳酸9-芴基甲基琥珀酰亚胺(0.34g)和二异丙基乙胺(0.05mL)。在室温下搅拌反应溶液一夜。在反应溶液中加入水。过滤收集析出的沉淀,用水和乙腈洗涤。将沉淀溶解在氯仿/2,2,2-三氟乙醇混合液中。减压蒸馏除去溶剂,加入二乙醚。过滤收集析出的沉淀,用二乙醚洗涤。通过所述操作,得到0.76g目标物。
[I-17:PEG5000-h.AM的合成(2)]
Fmoc-Tyr-Arg-Gln-Ser-Met-Asn-Asn-Phe-Gln-Gly-Leu-Arg-Ser-Phe-Gly-Cys-Arg-Phe-Gly-Thr-Cys-Thr-Val-Gln-Lys-Leu-Ala-His-Gln-Ile-Tyr-Gln-Phe-Thr-Asp-Lys-Asp-Lys-Asp-Asn-Val-Ala-Pro-Arg-Ser-Lys-Ile-Ser-Pro-Gln-Gly-Tyr-NH2(Cys16-Cys21二硫键形式)
在Fmoc-Tyr(BrZ)-Arg(Tos)-Gln-Ser(Bzl)-Met-Asn-Asn-Phe-Gln-Gly-Leu-Arg(Tos)-Ser(Bzl)-Phe-Gly-Cys(4-MeBzl)-Arg(Tos)-Phe-Gly-Thr(Bzl)-Cys(4-MeBzl)-Thr(Bzl)-Val-Gln-Lys(ClZ)-Leu-Ala-His-Gln-Ile-Tyr(BrZ)-Gln-Phe-Thr(Bzl)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Lys(ClZ)-Asp(OcHex)-Asn-Val-Ala-Pro-Arg(Tos)-Ser(Bzl)-Lys(ClZ)-Ile-Ser(Bzl)-Pro-Gln-Gly-Tyr(Br-Z)-NH2(740mg)中加入对甲酚(6.0mL)和甲硫氨酸(122mg)。在得到的溶液中,在冷却下加入无水氟化氢(24mL)。在-2~-5℃下,处理反应溶液60分钟。从反应溶液中减压蒸馏除去无水氟化氢,加入二乙醚。过滤收集析出的沉淀。将得到的粗肽溶解在50%乙酸水溶液中。在得到的溶液中,加入0.1M碘/甲醇溶液(0.8mL)。30秒后,在该溶液中加入1M抗坏血酸/水(0.8mL)。用反相HPLC从得到的溶液中纯化目标物。对目标物冷冻干燥后,得到134mg的白色粉末。
[I-18:PEG5000-h.AM的合成(3)]
Tyr-Arg-Gln-Ser-Met-Asn-Asn-Phe-Gln-Gly-Leu-Arg-Ser-Phe-Gly-Cys-Arg-Phe-Gly-Thr-Cys-Thr-Val-Gln-Lys(Boc)-Leu-Ala-His-Gln-Ile-Tyr-Gln-Phe-Thr-Asp-Lys(Boc)-Asp-Lys(Boc)-Asp-Asn-Val-Ala-Pro-Arg-Ser-Lys(Boc)-Ile-Ser-Pro-Gln-Gly-Tyr-NH2(Cys16-Cys21二硫键形式)
将Fmoc-Tyr-Arg-Gln-Ser-Met-Asn-Asn-Phe-Gln-Gly-Leu-Arg-Ser-Phe-Gly-Cys-Arg-Phe-Gly-Thr-Cys-Thr-Val-Gln-Lys-Leu-Ala-His-Gln-Ile-Tyr-Gln-Phe-Thr-Asp-Lys-Asp-Lys-Asp-Asn-Val-Ala-Pro-Arg-Ser-Lys-Ile-Ser-Pro-Gln-Gly-Tyr-NH2(Cys16-Cys21二硫键形式)(184mg)溶解在二甲基亚砜(18mL)中。在得到的溶液中加入碳酸叔丁基琥珀酰亚胺(87mg)和二异丙基乙胺(0.06mL)。将反应溶液搅拌5小时。在反应溶液中加入乙酸水溶液后,冷冻干燥。将残渣溶解在二甲基亚砜(20mL)中。在得到的溶液中加入二乙胺(2mL)。将得到的溶液搅拌70分钟。向反应溶液中加入乙酸水溶液进行稀释。用反相HPLC从得到的溶液中纯化目标物。对目标物冷冻干燥后,得到116mg的白色粉末。
[I-19:PEG5000-h.AM的合成(4)]
PEG5000-Tyr-Arg-Gln-Ser-Met-Asn-Asn-Phe-Gln-Gly-Leu-Arg-Ser-Phe-Gly-Cys-Arg-Phe-Gly-Thr-Cys-Thr-Val-Gln-Lys(Boc)-Leu-Ala-His-Gln-Ile-Tyr-Gln-Phe-Thr-Asp-Lys(Boc)-Asp-Lys(Boc)-Asp-Asn-Val-Ala-Pro-Arg-Ser-Lys(Boc)-Ile-Ser-Pro-Gln-Gly-Tyr-NH2(Cys16-Cys21二硫键形式)
将Tyr-Arg-Gln-Ser-Met-Asn-Asn-Phe-Gln-Gly-Leu-Arg-Ser-Phe-Gly-Cys-Arg-Phe-Gly-Thr-Cys-Thr-Val-Gln-Lys(Boc)-Leu-Ala-His-Gln-Ile-Tyr-Gln-Phe-Thr-Asp-Lys(Boc)-Asp-Lys(Boc)-Asp-Asn-Val-Ala-Pro-Arg-Ser-Lys(Boc)-Ile-Ser-Pro-Gln-Gly-Tyr-NH2(Cys16-Cys21二硫键形式)(40mg)溶解在二甲基亚砜(4mL)中。在得到的溶液中,加入PEG5000-NHS(205mg)和二异丙基乙胺(0.001mL)。PEG5000-NHS是由平均分子量为5000的PEG与6-氯己酸N-羟基琥珀酰亚胺酯形成的化合物,是具有平均分子量5000的PEG与N-羟基琥珀酸酰亚胺通过1-氧代-1,6-己二基连接而成的结构的化合物。将反应溶液搅拌一夜。用反相HPLC从反应溶液中纯化目标物。对目标物冷冻干燥后,得到35mg的白色粉末。
[I-20:PEG5000-h.AM的合成(5)]
PEG5000-h.AM(1-52)三氟乙酸盐
在PEG5000-Tyr-Arg-Gln-Ser-Met-Asn-Asn-Phe-Gln-Gly-Leu-Arg-Ser-Phe-Gly-Cys-Arg-Phe-Gly-Thr-Cys-Thr-Val-Gln-Lys(Boc)-Leu-Ala-His-Gln-Ile-Tyr-Gln-Phe-Thr-Asp-Lys(Boc)-Asp-Lys(Boc)-Asp-Asn-Val-Ala-Pro-Arg-Ser-Lys(Boc)-Ile-Ser-Pro-Gln-Gly-Tyr-NH2(Cys16-Cys21二硫键形式)(34mg)中在冰冷却下加入95%三氟乙酸水溶液(5mL),以溶解粗肽。在冰冷却下使得到的混合物反应40分钟。从反应溶液中减压蒸馏除去溶剂。将残渣溶解在Milli-Q水中。用反相HPLC从得到的溶液中纯化目标物。对目标物冷冻干燥后,得到30mg的白色粉末。
[I-21:PEG5000-h.AM的合成(6)]
将PEG5000-h.AM(1-52)乙酸盐包装在小瓶中
将PEG5000-h.AM(1-52)三氟乙酸盐(30mg)溶解在3%乙酸水溶液中。将得到的溶液应用于Muromac 1×2(乙酸型)柱(2mL)中,用3%乙酸水溶液洗脱。冷冻干燥洗脱液。将冷冻干燥物的全量溶解在Milli-Q水(18.3mL)中。将得到的溶液分别以0.30mL分注到小瓶中,冷冻干燥。用6M盐酸水溶液水解3瓶得到的冷冻干燥物。使得到的水解物经受氨基酸分析。通过所述氨基酸分析,对内容量进行定量。收率:37nmol×56瓶。
<II:使用示例>
[II-1:肾上腺髓质素衍生物的细胞内cAMP浓度升高作用]
通过给予肾上腺髓质素(AM),细胞内cAMP的浓度升高。因此,认为AM的作用是通过细胞内cAMP的浓度升高来表现的。所以,在使AM受体表达的培养细胞系(HEK293细胞系)中添加Pal-h.AM(1-52)、PEG5000-h.AM(1-52)或h.AM(1-52),测定细胞内cAMP的产生量。在0.5mM的IBMX的存在下,在汇合的HEK293细胞(细胞数:5×104)中添加10-11~10-6mol/L的Pal-h.AM(1-52)、PEG5000-h.AM(1-52)或h.AM(1-52),培养15分钟。然后,使用cAMP测定用ELISA试剂盒(GE Healthcare,#RPN2251),测定各测试样品的HEK293细胞中的细胞内cAMP浓度。Pal-h.AM(1-52)、PEG5000-h.AM(1-52)或h.AM(1-52)的浓度与cAMP浓度升高的剂量反应曲线如图1所示。予以说明,图中纵轴表示相对于h.AM(1-52)的cAMP浓度升高的最大反应值,测试样品的cAMP浓度升高的相对值(%)。
如图1所示,通过给予Pal-h.AM(1-52)或PEG5000-h.AM(1-52),AM受体表达HEK293细胞中的细胞内cAMP浓度升高。与h.AM(1-52)相比,Pal-h.AM(1-52)和PEG5000-h.AM(1-52)显示为基本相同的最大反应值和pEC50值(h.AM(1-52):8.59±0.90;Pal-h.AM(1-52):8.49±0.12;PEG5000-h.AM(1-52):8.19±0.10)。由所述结果可确定在培养细胞中,Pal-h.AM(1-52)和PEG5000-h.AM(1-52)表现出与h.AM(1-52)基本相同的cAMP浓度升高活性。
[II-2:肾上腺髓质素衍生物的血液中半衰期]
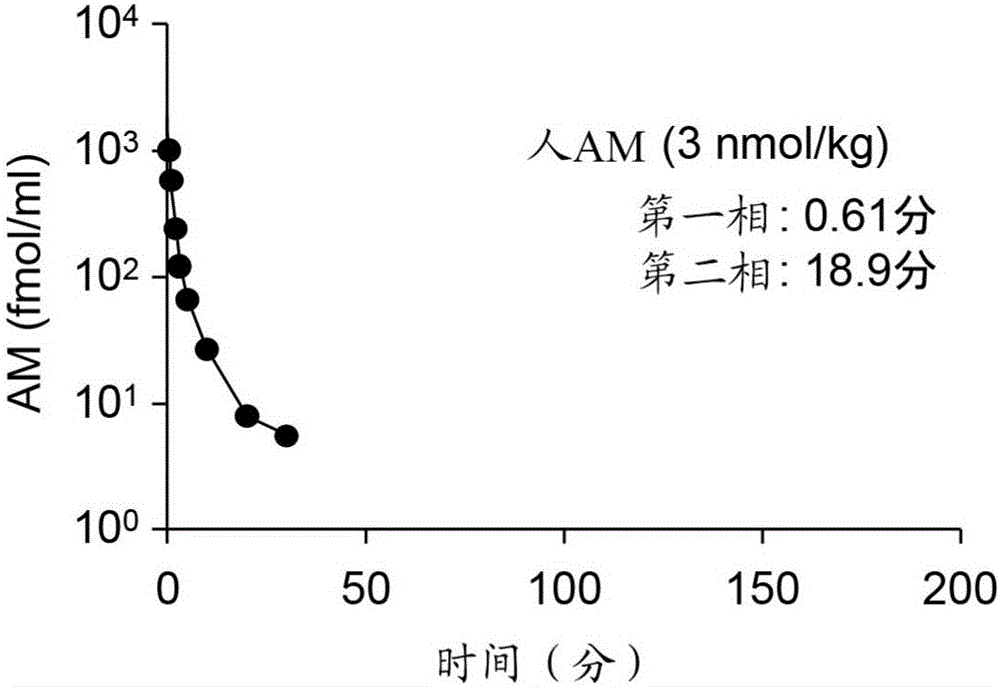
在经麻醉的大鼠的静脉内单次给药Pal-h.AM(1-52)、PEG5000-h.AM(1-52)或h.AM(1-52),观察肾上腺髓质素衍生物的血液中浓度随时间的变化。通过异氟烷吸入对11~14周龄的雄性Wistar大鼠进行麻醉诱导。切开气管后,以1.5~2.5%的异氟烷浓度和0.6~0.8L/分的流量进行吸入麻醉管理。从所述大鼠分离右侧颈静脉,插入相当于26G的导管。接着,从由此处理后的大鼠分离左侧颈动脉,插入相当于23G的导管。通过右侧颈静脉的导管给予溶解在生理盐水中的Pal-h.AM(1-52)、PEG5000-h.AM(1-52)或h.AM(1-52)。经插入到颈动脉的导管,从给药开始时随时间变化采血300μl。在得到的血液样本中,立即添加EDTA-2Na(300μg)和抑肽酶(21μg),进一步在3000转、10分钟的条件下离心分离,得到血浆。用化学发光酶免疫法测定各样本的血浆中AM浓度。由血浆中AM浓度的测定结果,用双隔室模型计算第一相和第二相的血液中半衰期。从h.AM(1-52)、Pal-h.AM(1-52)或PEG5000-h.AM(1-52)给药开始时起的持续时间与血浆中AM浓度的关系分别如图2~4所示。
如图3和4所示,Pal-h.AM(1-52)和PEG5000-h.AM(1-52)的第一相半衰期分别为3.51或6.18分钟,第二相半衰期为123或133分钟。对此,如图2所示,h.AM(1-52)的第一相半衰期为0.61分钟,第二相半衰期为18.9分钟。即与h.AM(1-52)相比,Pal-h.AM(1-52)和PEG5000-h.AM(1-52)的血液中半衰期明显延长。由所述结果可确定通过用棕榈酸或聚乙二醇对肾上腺髓质素分子进行化学修饰,与作为母体分子的肾上腺髓质素相比,血液中半衰期明显延长。
[II-3:肾上腺髓质素衍生物的降压作用]
在经麻醉的大鼠的静脉内,单次给予Pal-h.AM(1-52)、PEG5000-h.AM(1-52)或h.AM(1-52),观察该大鼠的血压的变化经过。通过异氟烷吸入对11~14周龄的雄性Wistar大鼠进行麻醉诱导。切开气管后,以1.5~2.5%的异氟烷浓度和0.6~0.8L/分的流量进行吸入麻醉管理。从所述大鼠分离右侧颈静脉,插入相当于26G的导管。接着,从由此处理后的大鼠,分离左侧颈动脉,插入相当于23G的导管。通过右侧颈静脉的导管给予溶解在生理盐水中的Pal-h.AM(1-52)、PEG5000-h.AM(1-52)或h.AM(1-52)。通过右侧颈静脉的导管,以2.4mL/小时注入生理盐水肝素溶液(生理盐水:100ml;肝素:1000单位)。通过相同导管,以将10nmol/kg的Pal-h.AM(1-52)、PEG5000-h.AM(1-52)或h.AM(1-52)溶解在生理盐水中的形式给药。将插入颈动脉的导管连接到压力换能器。随时间变化测定Pal-h.AM(1-52)、PEG5000-h.AM(1-52)或h.AM(1-52)在给药前的血压和给药后的血压。从h.AM(1-52)、Pal-h.AM(1-52)或PEG5000-h.AM(1-52)给药开始时起的持续时间与平均血压的关系如图5所示。予以说明,图中纵轴表示从各药剂给药时的平均血压减去各药剂给药前的平均血压的差。
如图5所示,由静脉内单次给予10nmol/kg的Pal-h.AM(1-52)、PEG5000-h.AM(1-52)或h.AM(1-52),大鼠的血压下降。在h.AM(1-52)的情况下,给药后2分钟观察到最大降压,在30分钟后,恢复到给药前的血压。对此,Pal-h.AM(1-52)或PEG5000-h.AM(1-52)给药时的最大降压值与h.AM(1-52)时的相比为较低值。此外,在这些衍生物的情况下,在给药后90分钟的降压作用还在持续。由所述结果可确定Pal-h.AM(1-52)和PEG5000-h.AM(1-52)的降压效果徐缓且持续长时间。此外,由本试验所示的肾上腺髓质素衍生物的降压效果与由上述试验所示的血液中半衰期的延长十分一致。
[II-4:肾上腺髓质素衍生物在炎性肠病模型中的治疗效果]
II-4-1:模型的制作
对C57BL/6J Jcl小鼠(6周龄),在异氟烷(2%)吸入麻醉下切开背部皮肤。将装有给药液的渗透压泵(1002型Alzet(注册商标)微渗透压泵)埋入皮下,用缝合线缝合皮肤。将渗透压泵埋入部位的背部皮肤剃毛并消毒。使处理后的小鼠摄取3质量/体积百分比的葡聚糖硫酸钠(Sodium Dextran Sulfate、DSS)(和光纯药工业株式会社)作为饮用水7天,制作成炎性肠病模型。DSS诱发性肠炎广泛地用作炎性肠病的模型。
自DSS摄取开始日起,使用渗透压泵进行肾上腺髓质素衍生物(PEG5000-h.AM(1-52))的持续皮下给药。给药量设为0.02、0.1或0.5nmol/kg/hr,给药速度设为0.2μL/hr。将DSS摄取开始日作为肾上腺髓质素衍生物的给药开始日(0日)。在所述条件下,实施14天给药。对照组中同样地给予生理盐水。在给药开始后第14日,在异氟烷(2%)的吸入麻醉下,从腹部大静脉采集肝素化血液。切开腹部大动脉和腹部大静脉,放血致死。接着,采集从肛门部至回盲部的肠道。
II-4-2:测定
(1)AM浓度
在4℃、1800×g、10分钟的条件下,对按照上述步骤采集的肝素化血液离心分离,得到血浆。用化学发光酶免疫法测定得到的各样本中的血浆中AM浓度。
(2)体重
在给药开始后第3、5、7、10和14日,测定给药对象小鼠的体重。
(3)得分
对在给药开始后第3、5、7、10和14日的给药对象小鼠的体重和大便的性状,根据下面的得分判定的标准进行评价。合计得到的得分值,计算各样本的总得分值。
[表1]
(4)肠道的长度
纵向打开经解剖取出的肠道,除去脂肪组织后,用生理食盐液洗涤。接着,测定肠道的长度。
II-4-3:结果
(1)AM浓度
用平均值±标准误差表示上述步骤中测定的血浆中AM浓度。对照组、以及0.02、0.1和0.5nmol/kg/hr PEG5000-h.AM(1-52)给药组的血浆中AM浓度分别为0.091±0.036、1.430±0.242、3.289±0.525和12.96±2.432fmol/ml。对照组、以及0.02、0.1和0.5nmol/kg/hr PEG5000-h.AM(1-52)给药组的血浆中AM浓度如图6所示。
(2)得分评价
用中间值[平均值±标准误差]表示所述步骤中评价的总得分。在给药开始后第3、5、7、10和14日,对照组的总得分分别为0.0[0.6±0.3]、4.0[3.7±0.4]、6.0[5.4±0.5]、3.5[4.1±0.4]和0.0[0.0±0.0]。在给药开始后第3、5、7、10和14日,0.02nmol/kg/hr PEG5000-h.AM(1-52)给药组的总得分分别为1.0[0.8±0.2]、2.5[2.8±0.5]、5.5[5.7±0.4]、2.5[3.1±0.8]和0.0[0.0±0.0]。在给药开始后第3、5、7、10和14日,0.1nmol/kg/hr PEG5000-h.AM(1-52)给药组的总得分分别为0.0[0.7±0.3]、1.5[1.9±0.5]、5.0[4.1±0.4]、2.0[2.0±0.5]和0.0[0.0±0.0]。在给药开始后第3、5、7、10和14日,0.5nmol/kg/hr PEG5000-h.AM(1-52)给药组的总得分分别为1.0[1.3±0.3]、1.5[1.1±0.3]、3.0[3.0±0.3]、2.0[2.1±0.4]和0.0[0.0±0.0]。从PEG5000-h.AM(1-52)给药开始时起的持续时间、对照组和各给药组的总得分的关系如图7所示。如图7所示,0.1nmol/kg/hr PEG5000-h.AM(1-52)给药组在给药开始后第10日的总得分值、以及0.5nmol/kg/hr PEG5000-h.AM(1-52)给药组在给药开始后第5、7和10日的总得分值与对照组的总得分值相比,均可见显著减少(Steel多重比较检验、p<0.05或P<0.01)。
(3)肠道的长度
以平均值±标准误差表示上述步骤中测定的肠道的长度。对照组、以及0.02、0.1和0.5nmol/kg/hr PEG5000-h.AM(1-52)给药组的肠道的长度分别为65.0±1.3、69.4±1.5、71.4±0.9和72.4±0.9mm。对照组、以及0.02、0.1和0.5nmol/kg/hr PEG5000-h.AM(1-52)给药组的肠道的长度如图8所示。如图8所示,PEG5000-h.AM(1-52)给药组的肠道的长度在全部的浓度处理组中,与对照组的肠道的长度相比,均可见显著性差异(Dunnett多重比较检验、P<0.05或P<0.01)。
本说明书中引用的所有出版物、专利和专利申请直接作为参考而纳入本说明书中。
- 还没有人留言评论。精彩留言会获得点赞!