用于输送药物或排除废物的小分子运输设备的制作方法
本申请要求2015年4月24日提交的第62/152,495号美国临时申请、2015年1月16日提交的第62/104,568号美国临时申请以及2014年6月19日提交的第62/014,617号美国临时申请的权益,该申请在此通过引用以其整体并入用于所有目的。
关于在联邦政府资助的研究与开发下进行的发明的权利的声明
本发明是在美国政府支持下,在国立卫生研究院资助的基金EY022059下做出的。政府具有本发明中的某些权利。
背景
1.技术领域
通常,本发明的实施方案涉及用于治疗眼睛和身体内的其它部位的方法和设备。更具体地,各实施方案涉及用于捕获小分子治疗剂或废料并且将其运输到身体内的结构或从身体内的结构运输的可植入设备。
2.相关技术的描述
在美国,失明的主要原因是糖尿病视网膜病变。糖尿病视网膜病变由视网膜缺血引起,即由毛细血管无灌注引起的视网膜血流不足。毛细管血流的缺乏使视网膜缺氧。在使血液移动离开视网膜的小静脉被堵塞的情况下还发生视网膜静脉阻塞。具有视网膜病的受治疗者随着时间的推移而失去视力,因为他或她的眼睛中的视网膜细胞死亡。
除眼睛外,身体的其它部位可经受由糖尿病或其它疾病引起的血流缺乏。对血流进入身体的特定部位的限制简称为缺血。缺血通常伴随着缺氧,缺氧是指血液输送的氧气(O2)缺乏。缺血损伤通常引起严重的组织缺氧并且最终使组织死亡。
当前用于缺血性疾病的治疗方法是受限制的并且不一定能治疗疾病的主要原因—即缺氧。治疗毛细血管无灌注或缺血部位的主要依靠是激光消融。这一治疗方法是破坏性的、不可逆的,并且可能引起另外的器官损失。氧气的全身应用也是一种选择,而携带纯氧或安排氧气注射预约带有风险性并且对受治疗者来说是不方便的。
视网膜缺血可以通过以上方法治疗,但眼睛中的这种治疗带有额外的缺陷。例如,激光消融和光凝术可导致狭隘的周边视野以及延迟的暗适应。已经开发出用于眼睛的其它治疗方法,诸如玻璃体内注射和睫状体平坦部玻璃体切除术。玻璃体内注射通常需要频繁地重复并且给患者和医疗系统带来显著的风险和成本。玻璃体内注射使用仅抑制缺氧对视网膜组织上的下游影响的治疗剂。将玻璃体的一部分从眼睛移除的睫状体平坦部玻璃体切除术可导致视网膜氧气量不足,同时在晶状体附近引起白内障或其它潜在的氧中毒。事实上,太多的氧气在晶状体附近的眼球内的前部(前区)附近是一件坏事。其还可能增加虹膜新生血管形成以及高眼压的风险。
因此,用于治疗缺血性视网膜和其它疾病的当前医疗设备具有需要克服的许多明显的缺点。
简要概述
大体上描述的是一种微制造的(microfabricated)、可植入医疗设备,该微制造的、可植入医疗设备具有通过中间的不可渗透管连接的两个可渗透袋端部。袋制造成可渗透参与的特定类小分子,诸如双原子氧(O2)或其它“药物”。袋可以尺寸设置成收集并且分配计算数量的小分子,并且通过被动方式即借助于一个区域中具有的分子浓度高于另一个区域来对其进行输送。协助捕获和运输目标小分子的蛋白质也可以包含在设备内。
可渗透袋之间的管可以包括可弯的、可弯曲的材料(诸如金属)的条带,使得外科医生可以使管变弯曲并且使其保持弯曲,以便使设备在体内对齐。例如,设备可以安转成使得其管进入眼球的睫状体平坦部,并且折弯回去以使得其排出袋在视网膜附近。缝合孔和手柄可以被包含以帮助植入。
还描述了由生物相容性硅胶和C型聚对二甲苯微制造的设备的方法。除了别的之外,微制造可包括基于对受治疗者的缺氧的测量而使用定制模具。不仅袋的尺寸可以根据特定患者的缺氧来定制,而且袋的厚度也可以定制。还描述了用于植入设备的方法。
本发明的一些实施方案涉及一种用于在体内收集和重分配预定类小分子的生物相容性可植入装置。该装置包括:可渗透吸收袋,该袋是预定类的小分子可渗透的,袋界定内部;柔性导管,其具有管腔,导管具有不可渗透小分子的部分;以及可折叠或可卷曲的排出囊,该囊是小分子可渗透的,囊界定内部;其中,导管的管腔将吸收袋的内部连接到排出囊的内部。
该装置还包括可弯的条带,该可弯的条带附接到导管并且适合于将导管保持成弯曲或直的形状。可弯的条带可以封闭在导管内,包括箔、片材、杆或管,并且/或由金属组成。吸收袋的至少一部分、导管和排出囊可以由硅胶一体地形成。聚对二甲苯可以涂覆导管的硅胶,从而减小了导管的渗透性。吸收袋、导管和排出囊可以通过微制造生产并且因而具有方形边缘并且高度近似相同。突片可以从吸收袋延伸,该翼片具有穿过其中的缝合孔。手柄可以从吸收袋延伸,手柄适合于用手术工具拖曳。排出囊是环形形状的,环形形状的排出囊的内径等于或大于6毫米。
至少一个支柱可布置在导管内,该至少一个支柱适合于防止导管管腔被夹紧闭合。至少一个支柱可以具有选自以下项组成的组的横截面:I形横截面、O形横截面和X形横截面。导管具有小于或等于6毫米的周长,从而能够适合地穿过睫状体平坦部中的3毫米或更大的切口。
预定类的小分子可包括双原子氧(O2)。全氟化碳可包含在吸收袋内用于氧溶解。血红素蛋白可包含在吸收袋内用于氧运输。血红素蛋白可包括天然、人造或自体的血红蛋白或肌红蛋白。血绿蛋白或血蓝蛋白可包含在吸收袋内用于氧运输。预定类的小分子可包括二氧化碳(CO2)或一氧化二氮(N2O)。预定类的小分子可包括治疗剂或废产物。
氧传感器可邻近排出囊放置,并且天线可附接到氧传感器。氧传感器构造成通过天线由射频(RF)能量来供电。
吸收袋和排出囊具有尺寸设置在小分子的斯托克斯直径的约1倍至5倍之间的孔隙。吸收袋的直径可以为约10毫米(mm),导管可以具有约4mm的周长,并且排出囊的直径可以为约4.5mm。
装置可以附接到人类或非人类生物体的眼球,吸收袋放置在眼球的结膜和巩膜之间,导管通过眼球的睫状体平坦部穿透巩膜,并且排出囊在眼球的后部玻璃体内。
一些实施方案涉及一种制造可植入的小分子的收集和重分配装置的方法。该方法包括:将未固化的生物相容性硅胶涂布在哑铃形半部模具上;使半部模具上的硅胶部分地固化以形成部分固化的硅胶半部;将部分固化的半部中的一个从半部模具中的一个剥离;将未固化的硅胶施加到部分固化的硅胶半部中的一个;使部分固化的半部对齐并且接合;使部分固化的半部进一步固化以形成一体形成的硅胶工件,该一体形成的硅胶工件包括通过导管连接到囊的袋;掩蔽袋的至少一部分和囊的至少一部分;以及使聚对二甲苯沉积在导管上,从而减小导管的渗透性并且形成小分子收集和重分配装置。
该方法可包括将可弯的金属的条带沿着哑铃形半部模具的手柄部分的未固化硅胶放置。该方法可包括测量受治疗者体内的预定类小分子的分压力;以及形成光刻掩模,该光刻掩模根据所测得的受治疗者体内的分压力来设置尺寸。该方法可包括使基板上的光阻剂暴露于掩蔽的电磁辐射;以及使光阻剂显影以形成半部模具。聚对二甲苯可使用化学气相沉积(CVD)沉积。
一些实施方案涉及一种将氧收集和重分配装置手术植入受治疗者的眼球中的方法。该方法可包括:提供氧收集和重分配装置,该氧收集和重分配装置具有可渗透吸收袋、柔性导管、导管内的可弯的金属条带以及可折叠或可卷曲的排出囊,其中导管的管腔将吸收袋的内部连接到排出囊的内部;穿过受治疗者的眼球切割切口,切口长小于3毫米;使具有可弯的金属条带的导管弯曲;拉动排出囊和导管的一部分穿过切口;将吸收袋放置在眼球的结膜和巩膜之间;将吸收袋缝合到巩膜;以及使导管定向成使得排出囊位于眼球的后部玻璃体内。
排出囊可以是环形形状的,并且该方法可以包括使环形形状的排出囊的内径以眼球的光轴为中心,以便保持光路不受遮挡。
通过参考本说明书的剩余部分和附图可实现对本文所公开和提议的实施方案的性质和优点的进一步理解。
附图简述
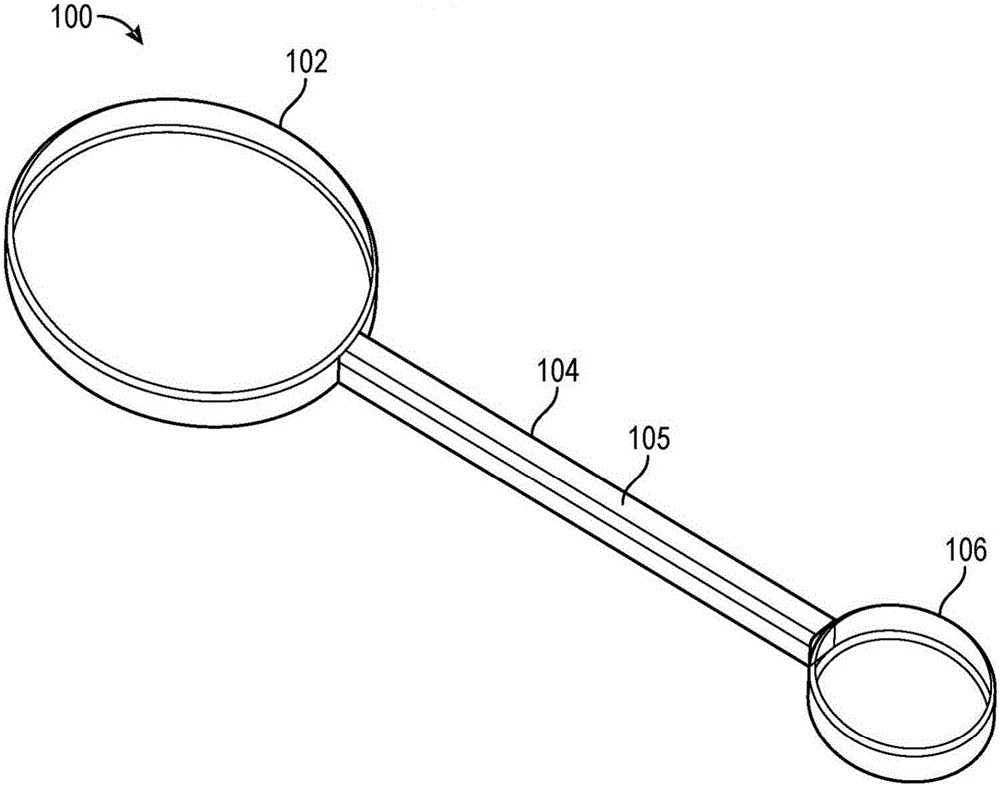
图1示出了根据实施方案的设备。
图2示出了根据实施方案的植入眼球内的设备。
图3示出了根据实施方案的具有缝合孔的设备。
图4是与图3的设备对应的设备的图片。
图5是图3的设备的平面图和横截面图。
图6示出根据实施方案的袋在结膜下空间中的放置。
图7A是根据实施方案的环形囊放置的剖切透视图。
图7B是根据实施方案的环形囊放置的横截面图。
图8示出了根据实施方案的袋在脉络膜空间中的放置。
图9A示出了根据实施方案的制备的顶部半部模具。
图9B示出了根据实施方案的在顶部半部模具上涂布硅胶。
图9C示出了根据实施方案的剥离的部分固化的顶部半部。
图9D示出了根据实施方案的制备的底部半部模具。
图9E示出了根据实施方案的在底部半部模具上涂布硅胶。
图9F示出了根据实施方案的固化的设备。
图10是说明根据实施方案的工艺的流程图。
图11是说明根据实施方案的工艺的流程图。
详细描述
描述了医疗设备、其制造方法以及用于其植入的手术方法。医疗设备在身体内捕获可具有疗效的任何生物或化学活性剂。然后该医疗设备将试剂输送到身体的另一部分。设备还可用于将废物或任何无疗效的材料从身体的一个部位移除到另一个部位。
特别描述为通过被动供氧来治疗缺血性视网膜疾病的示例性设备。该设备根据自然浓度梯度将氧从富氧区运输到缺氧区中。在视网膜缺血的示例性案例中,其可以是从结膜下空间运输到玻璃体腔中。这可以防止视力进一步下降,避免激光光凝,并且可能地避免睫状体平坦部玻璃体切除术。
本申请人拥有的国际公开号WO 2014/055989A1描述了主动式氧合器原型。主动式氧合器原型通过封闭设备内的水的电解来产生氧。然后氧通过导管的预先指定的部分选择性扩散。当其储器耗尽时,设备通过针注射重新补充。
相反,本发明的实施方案可以通过被动输送氧到缺血或缺氧区来治疗缺血。
图1示出了根据实施方案的设备。设备100包括可渗透吸收袋102、不可渗透的导管104和可渗透排出囊106。吸收袋102从富氧区吸收氧气。导管104是用于运输氧气的细管。排出囊106将氧气释放或扩散到目标区域。
吸收袋102、导管104以及排出囊106由已经固化在一起即一体形成的生物相容性硅胶制成。C型聚对二甲苯(Parylene C)涂层105包围导管104,将导管的渗透性降低到非渗透性点。C型聚对二甲苯是具有低于硅胶五个数量级的渗透率的生物相容性聚合物。
材料的“渗透性”通常与参与的物质的尺寸有关。斯托克斯-爱因斯坦半径(Stokes-Einstein radius)或斯托克斯直径(Stokes diameter)是物质的扩散特性的量度。“斯托克斯直径”是分子在其扩散率方面拥有的硬球的当量直径。分子可以穿过具有孔隙的薄材料,该孔隙具有的斯托克斯直径是分子的斯托克斯直径的约1倍至约5倍。
“约”包括在±0.01%、±0.1%、±1%、±2%、±3%、±4%、±5%、±8%、±10%、±15%、±20%、±25%的偏差内或本领域中其它已知的偏差内。
药物(例如,氧气)从排出囊106扩散出、进入身体的缺乏区域降低了设备的内部浓度,这进而将氧气从富氧区吸入设备中。浓度梯度将会继续将氧气从眼睛的外部运输到玻璃体腔的内部。
气泡在设备的表面上的形成可以通过执行疏水和亲水表面改性来阻止。这可以阻止气体在表面上聚集并且仅允许输送溶解的药物。
剂量(dosing)和定向释放(targeted release)可以由设备的材料性能来控制。控制硅胶的厚度可以确定渗透速率(剂量)。由于吸收袋102、导管104以及排出囊106由相同厚度的硅胶一体地形成,因此对在模具上分布多少硅胶进行单一的调节可以确定袋的渗透速率和囊的渗透速率。导管104涂覆有不可渗透的涂层,并且因而其渗透性在理想情况下与多少硅胶分布在模具上相对无关。
吸收袋的直径和排出囊的直径也可以被调节以改变渗透速率。设备的形状以及吸收袋和排出囊的表面面积是取决于应用的并且可以设计用于设备即将执行的具体任务。
除控制厚度之外,人们可以将具有高扩散常数或高氧溶解度的物质(诸如全氟化碳、空气等)注入设备的内部。例如,吸收袋和设备内的全氟化碳可以增加氧溶解度。诸如天然、人造或自体血红蛋白或肌红蛋白的血红素蛋白可以添加在设备内以增加氧气输送。血绿蛋白或血蓝蛋白可以添加到吸收袋和设备的其它部分以增加氧气运输。可以使用具有有益于氧气储存或运输的性能的其它天然或合成的物质。
除双原子氧外的其它小分子也可以被捕获并且运输。设备可以以二氧化碳(CO2)、一氧化二氮(N2O)或其它气体为目标。小分子蛋白质和其它药物可以被明确锁定。这些‘药物’中的任何一种都可以被运输,而不论其被分类为治疗剂、废产物或其它物质。
示例性设备不需要任何电子器件或储器,以允许设备是薄的。为了在眼睛中应用,较薄的设备减小了将覆盖设备的结膜的磨耗和磨损。然而,如果需要的话,可以添加氧气浓度、pH值等的电子监控。
图2示出了根据实施方案的植入眼球内的设备。在布置200中,吸收袋102植入巩膜210的外部和结膜(在图中未示出)的下面。准确地说,其位于结膜上区域中,从角膜缘后部2mm延伸到赤道。在睫状体平坦部处穿透其眼球后,柔性导管104引发弯曲208以使其向后朝向黄斑212且远离晶状体214突出。即,导管104从眼睛的前区216经过中部平面220延伸到后区218。导管104在排出囊106处终止,该排出囊106恰好放置在眼球的光轴222的外部以便使眼睛的光路保持清楚。
导管104优选是小的,以便在手术期间使切口的尺寸最小化。例如,导管可以制作成具有小于6mm的周边或周长,以便适配在3mm或更大的切口内。由于排出囊由薄硅胶制成并且是可折叠的和/或可卷曲的,因此其柔韧性将允许其穿过小的切口进入。
在视网膜缺血的情况下,结膜具有相当高的透氧性。数据大致显示,当眼睛睁开并且巩膜可见时,在兔结膜下方的氧分压是100毫米汞柱(mmHg)。然而,巩膜具有相对低的氧渗透到玻璃体中。缺血性眼睛具有15mmHg的氧浓度。
单独使用被动方式将氧气从结膜下面运输到玻璃体中已经显示是可行的。吸收袋放置在结膜下区域中,安置在巩膜上。导管在睫状体平坦部处穿透巩膜并且朝向周边玻璃体行进。排出囊(有时称为扩散器)放置在那里以为视网膜提供氧气。只要眼睛是睁开的,结膜下区域中的氧气对于缺血性眼睛而言应该是足够的。
玻璃体的凝胶性质阻碍了氧气穿过眼睛内部的快速对流。这虽然通常是有损害的,但可用于设备的益处。局部玻璃体切除术可以允许视网膜附近的区域用盐水代替,以允许氧气快速地对流运输以在需要的视网膜附近达到高的氧浓度,同时使眼睛的前部仅具有扩散运输。这使得晶状体附近的氧分压保持较低,这降低了白内障和其它潜在氧中毒的风险。
实施方案并不局限于眼睛。将氧气从高氧张力的区域输送到具有低氧张力的区域可用于治疗引起缺氧的任何疾病过程,或用于缓和任何低氧条件,优选在发生不可逆损伤之前进行。例如,一个实施方案可以包括给缺氧患者体内的血液充氧的皮下植入物。另一个实施方案可包括将氧气输送到中枢神经系统的部分进而减缓由缺血中风导致的缺氧的植入物。
缺血可以在许多疾病过程中发现于全身各处,并且利用不同形式的因素,实施方案设备可有助于治疗缺血。例如,实施方案可用于输送或操纵体内的其它气体的分布。二氧化碳和一氧化二氮是具有重要生理作用的生物活性气体。其可以被重新分配以便使病变过程正常化。例如,具有慢性阻塞性肺疾的患者可能将二氧化碳保持在病理量。实施方案可用于分流过量的二氧化碳并且避免该气体的毒性累积。示例性实施方案示出在眼睛内和周围的植入;然而,可构想放置在如上面所描述的身体的其它部位中以及其合适的构型。构型可以包括其它部分以有助于与身体的其它部位兼容以及在手术中植入设备。
为了允许设备在手术期间弯曲到外科医生所选定的准确位置,导管可以包含金属片或金属板,该金属片或金属板可以容易地操纵以便刚性地保持设备的形状和位置。
图3示出了根据实施方案的具有缝合孔的设备。设备300包括吸收袋302、导管304和扩散囊306。导管304以薄的聚对二甲苯涂层305覆盖。
包围在导管304内的是可弯的金属条带322,该可弯的金属条带322是生物相容型304号不锈钢管。管是可弯的,使得其可以弯曲并且保持其弯曲形状。或者其可以重新弯曲成直的并且然后保持其直的形状。在其它实施方案中,金属条带可以是薄的金属箔、片材或实心杆。条带322可以由外科医生的手或外科器械弯曲。
设备300包括彼此对称间隔开的突片326,每个突片326具有通孔328。通孔328尺寸设置成适合缝合并且因而有时称为缝合孔。
附接到袋302的手柄324是T形的,以允许镊子或其它手术工具获得对吸收袋材料抓紧而不会将其撕裂。外科医生可以拉动排出囊和导管通过切口,通过手柄324来保持吸收袋。另外,当将吸收袋302缝合在适当位置处时,手柄324可用于将吸收袋302保持在适当位置处。
图4是对应于图3的线条图的设备的图片。设备300由透明硅胶组成,以允许穿过导管的金属管隐约显出。
图5示出了图3中设备的平面图和横截面图。在示例性实施方案中,吸收袋302直径为10mm,其中壁为500μm(微米)。内部高度是720μm,其中顶板厚度和底板厚度各自是360μm,总厚度为1440μm。导管304长12mm,其中宽1.3mm。和吸收袋一样,导管具有720μm的内部高度,其中顶板厚度和底板厚度各自是360μm,总厚度为1440μm。侧壁厚300μm。
管322具有406.4μm(0.016英寸)的内径和508μm(0.02英寸)的外径。排出囊306直径为4.5mm,具有500μm(微米)的壁。内部高度是720μm,其中顶板厚度和底板厚度各自是360μm,总厚度为1440μm,正如吸收袋和导管一样。吸收袋302、导管304和排出囊306具有方形边缘并且都具有近似相同的高度表示其使用光刻技术(lithographictechniques)一起制造。
设备300的吸收袋302的内部可以是全氟化碳566以增加吸收袋对氧气的吸收。形成吸收袋302的包膜的可渗透材料560是硅胶。已经显示有效的特定硅胶是(美国加利福尼亚州卡平特里亚市的)NuSil技术有限公司的MED4-4210,两部分式医疗级硅胶,其中基料和固化剂按重量以10:1的比例混合。形成排出囊306的包膜的可渗透材料564由相同的硅胶形成。
手柄324和具有孔328的突片326与设备300一体地形成。即,这些附属物的硅胶与吸收袋302、导管304和排出囊306的硅胶至少部分地共同固化。如下面将详述的,在使设备的硅胶材料完全固化之前,薄薄的一层未固化硅胶530涂布在设备的部分固化的半部(partially-curedhalves)之间。另外,在金属管322放置在导管304中之前,未固化硅胶530涂布在导管304内。管322使管腔562在硅胶固化时无流动硅胶。
氧传感器568位于排出囊内。氧传感器568通过天线570由来自医师的外部设备的射频(RF)能量来供电。当医师给他或她的读取器通电时,RF能量唤醒氧传感器,以用于排出囊中的氧水平的一个或多个读数。天线570将读数传送到可以对读数进行评估的外部设备。
图6示出了根据实施方案的袋在眼球结膜下空间中的放置。在晶状体614、角膜632、瞳孔634和虹膜636的一侧,吸收袋602安置在结膜638下方。导管604刺穿巩膜610,转向后部,并且在视网膜附近终止。排出袋606与导管604连接,使得吸收袋602的内部以恒定的流体路径连接到排出囊606的内部。
排出囊606是环形(即圆环)形状的。排出囊606的内径定位成使得其围绕光轴622对称地放置。因而,排出囊环绕并且围住视网膜。
图7A和图7B是根据实施方案的环形囊放置的剖视图。排出囊606的切去图示出其具有带有方形边缘的矩形横截面。这是其使用光刻制作方式制造的结果。
环形形状的排出囊606的内径740为6毫米。这使其足够靠近视网膜以有效地分布氧气取得疗效,同时使其离光学空间(optical volume)足够远以便其不干涉眼睛的成像能力。
图8示出了根据实施方案的袋在脉络膜空间中的放置。在该构型中,吸收袋802放置在脉络膜内,恰好在眼睛的色素层外部。
导管804穿透视杆细胞和视锥细胞、水平细胞、双极细胞、无长突细胞、神经节细胞和神经节细胞的向着视神经的轴突。X形支柱805布置在导管804内。X形支柱805存在是为了使导管804的管腔不受夹紧闭合。可替代地或另外,O形和I形支柱可以在导管内形成以便使其保持打开。
图9A至图9F示出了根据实施方案的示例性实施方案的制造过程。
在图9A中,顶部半部模具900包括具有干膜光阻剂(dry film photoresist)944的硅胶基板942,干膜光阻剂944以最终产品的“哑铃形状”定型。
光阻剂被掩模并且暴露于可见光或紫外(UV)光或其它电磁辐射,并且然后显影以形成半个模具。由于这些掩模可以容易地改变,所以患者的设备可以使用定制模具定做。人们可以首先测量受治疗者眼睛的结膜和后部中的氧气或其它类小分子的分压,并且然后形成光刻掩模,该光刻掩膜基于所测量的分压力来设置尺寸。例如,当受治疗者具有他的或她的视网膜的较大的区域缺氧时,可能需要较大的分散囊。
模具的顶部半部具有设备的腔和顶部,而第二底部半部模具具有剩余部分。顶部模具整体用C型聚对二甲苯的涂层946涂覆,以便减小硅胶和模具之间的粘附并且从而增加模具的离模性。
在图9B中,未固化的硅胶948被敷并且刷在顶部模具上以便涂覆底部和侧部。然后其在65℃下持续30分钟被部分固化。
在图9C中,部分固化的硅胶948从顶部模具剥离。然后其接合边缘用未固化的硅胶950涂覆。易成型的延性金属的可弯的管被切割成所需的长度并且插入导管,在哑铃形装置的“手柄部分”内。
在图9D中,底部半部模具包括具有干膜光阻剂954的硅胶基板952,干膜光阻剂954以与顶部模具互补的形状定型。类似于顶部模具的光阻剂,该光阻剂被掩模、暴露以及显影。类似于顶部模具,底部半部模具用C型聚对二甲苯涂覆。
在图9E中,未固化的硅胶958施加在底部模具上以便覆盖底部和侧部。然后其在65℃下持续30分钟被部分固化。可选择地,部分固化的硅胶958可以从模具移除。
在图9F中,顶部部分固化的半部和底部部分固化的半部对齐并且接合在一起。金属管在半部之间。组件在100℃下持续8个小时被完全固化。
然后吸收袋和排出囊被掩蔽,并且组件放置在化学气相沉积(CVD)室内用于使聚对二甲苯沉积在导管周围。C型聚对二甲苯的薄层确保了导管是不可渗透的。设备的其它区域可以选择性地用聚对二甲苯涂覆到不同的深度以改变渗透性。
图10是说明根据实施方案的工艺1000的流程图。在操作1001中,未固化的生物相容性硅胶涂布在哑铃形半部模具上。在操作1002中,半部模具上的硅胶部分地固化以形成部分固化的硅胶半部。在操作1003中,部分固化的半部中的一个从半部模具中的一个剥离。在操作1004中,可弯的金属的条带沿着哑铃形半部模具的手柄部分的未固化硅胶放置。在操作1005中,未固化的硅胶施加到部分固化的硅胶半部中的一个。在操作1006中,部分固化的半部对齐并且接合。在操作1007中,这些部分固化的半部被进一步固化以形成一体形成的硅胶工件,该一体形成的硅胶工件包括通过导管连接到囊的袋。在操作1008中,袋的至少一部分和囊的至少一部分被掩蔽。在操作1009中,聚对二甲苯沉积在导管上,从而减小了导管的渗透性并且形成小分子收集和重分配装置。
图11是说明根据实施方案的过程1100的流程图。在操作1101中,提供具有可渗透吸收袋、柔性导管、导管内的可弯的金属条带以及可折叠或可卷曲的排出囊的氧收集和重分配装置。导管的管腔将吸收袋的内部连接到排出囊的内部。在操作1102中,穿过受治疗者的眼球切割切口,切口小于3毫米长。在操作1103中,具有可弯的金属条带的导管弯曲到适当位置。在操作1104中,拉动排出囊和导管的一部分穿过切口。在操作1105中,吸收袋放置在眼球的结膜和巩膜之间。在操作1106中,吸收袋缝合到巩膜。在操作1107中,导管定向成使得排出囊位于眼球的后部玻璃体内。
已参考各种具体的和说明性实施方案描述本发明。然而,应理解,可做出许多变型和修改,同时保持在所附权利要求的精神和范围内。
- 还没有人留言评论。精彩留言会获得点赞!