一种具有逆转肿瘤多药耐药性功能的两亲性缀合物抗肿瘤纳米药及其制备方法和应用与流程
本发明属于抗肿瘤药物技术领域,特别涉及一种具有逆转肿瘤多药耐药性功能的两亲性缀合物抗肿瘤纳米药及其制备方法和应用。
背景技术:
多药耐药性(MDR)是导致临床上肿瘤化疗失败的主要原因,而三磷酸腺苷(ATP)结合盒(ABC)膜转运蛋白调控的药物外排是MDR机制中最普遍的一种。P-gp糖蛋白是膜转运蛋白中最重要的成员之一,P-gp蛋白能从ATP水解中获得能量,从而将阿霉素、紫杉醇等小分子药物排除到肿瘤细胞外,导致肿瘤细胞中小分子药物富集浓度大大降低,导致肿瘤化疗失败(Nano Today 2011,6,176-185;Curr.Opin.Struct.Biol.2000,10,649-655)。为解决上述问题,前人将P-gp蛋白抑制剂(如异搏定、奎宁、环孢霉素A等)和小分子抗肿瘤药物混合使用,以逆转肿瘤的多药耐药性(Biochem.Pharmacol.1989,38,1727-1736)。然而,由于小分子P-gp抑制剂和抗肿瘤药物普遍存在着生物相容性差、体内停留时间短和对正常组织的毒副作用等缺点,同时由于小分子P-gp抑制剂和抗肿瘤药物之间物理化学性质不同,导致两者的药代动力学存在很大差异,使P-gp抑制剂和抗肿瘤药物不能同时到达肿瘤部位,难以达到协同治疗多药耐药性肿瘤的目的。
随着纳米技术的快速发展,在癌症的化疗中,纳米尺度物质常常被用作药物载体,将药物有效地输送到肿瘤部位。若将小分子抗肿瘤药物和P-gp蛋白抑制剂负载在同一纳米载体内,同时输送到肿瘤细胞,是一种有效克服肿瘤多药耐药性的方法,这些纳米载体包括纳米粒子(J.Control.Release 2009,136,21-29;Biomaterials 2010,31,358-365)、脂质体(Drug Deliv.2009,16,261-267;Front Pharmacol.2014,5,1-22)和聚合物胶束(Science 1998,281,1312-1316;Biomaterials 2011,32,1738-1747)。使用纳米载体共输送小分子抗肿瘤药物和P-gp蛋白抑制剂,不仅能够提高药物在肿瘤部位的富集浓度(Eur.J.Pharm.Biopharm.2010,75,341-353),同时也可抑制P-gp蛋白的活性(Cancer Treat Rev.2008,34,592-602;Int.J.Nanomedicine 2012,7,187-197)。与小分子抗肿瘤药物和P-gp蛋白抑制剂简单物理混合使用相比,纳米载体输送方法的治疗效果有了较大提高。但仍存在如下诸多问题,(1)在到达肿瘤部位之前,小分子抗肿瘤药物和蛋白抑制剂可能会发生泄露(Eur.J.Biochem.1995,228,1020-1029),难以确保两者同时富集到肿瘤部位;(2)大部分载体的载药量非常低;(3)小分子抗肿瘤药物和蛋白抑制剂由于物理化学性质的不同,两者的药代动力学存在很大的差异;(4)纳米载体本身没有治疗作用,且在代谢过程中可能会引起器官毒性和炎症。因此,通过连接剂将小分子抗肿瘤药物和P-gp蛋白抑制剂连接起来构筑抗肿瘤纳米药物能够有效地逆转肿瘤的多药耐药性。
在CN201210475046“一种具有P糖蛋白抑制功能的抗肿瘤前药”公开了由抗肿瘤药物与具有P糖蛋白抑制功能的聚乙二醇琥珀酸酯通过连接器共价连接构成的两亲性物质,也同样通过连接剂将小分子抗肿瘤药物和P-gp蛋白抑制剂连接起来构筑抗耐药肿瘤纳米药物;然而聚乙二醇琥珀酸酯是一种大分子聚合物,仅具有P-gp蛋白抑制功能,且作用机制并不明确,同时需要借助载体(如:聚乙二醇)才可得到稳定且分散均匀的纳米颗粒。
技术实现要素:
本发明的第一目的是提供一种具有逆转肿瘤多药耐药性功能的两亲性缀合物抗肿瘤纳米药,以解决大多数抗肿瘤小分子药物普遍存在的多药耐药性问题,同时解决现有技术中逆转肿瘤多药耐药性都需采用纳米尺寸物质作为载体,而这些纳米载体将药物送到肿瘤细胞内后,其自身需要通过肾脏等器官排出体外,有可能引起肾脏等器官发生炎症或引起一些其它病症等技术性问题。
本发明的第二目的是提供一种具有逆转肿瘤多药耐药性功能的两亲性缀合物抗肿瘤纳米药的制备方法,以解决大多数抗肿瘤小分子药物普遍存在的多药耐药性问题,同时解决现有技术中逆转肿瘤多药耐药性都需采用纳米尺寸物质作为载体,而这些纳米载体将药物送到肿瘤细胞内后,其自身需要通过肾脏等器官排出体外,有可能引起肾脏等器官发生炎症或引起一些其它病症等技术性问题。
本发明的第三目的是上述的两亲性缀合物抗肿瘤纳米药应用于肿瘤和耐药性肿瘤的治疗,以解决大多数抗肿瘤小分子药物普遍存在的多药耐药性问题,同时解决现有技术中逆转肿瘤多药耐药性都需采用纳米尺寸物质作为载体,而这些纳米载体再将药物送到癌细胞内后,其自身需要通过肾脏等器官排出体外,有可能引起肾脏等器官发生炎症或引起一些其它病症等技术性问题。
本发明的技术方案如下:
一种具有逆转肿瘤多药耐药性功能的两亲性缀合物抗肿瘤纳米药,包括由抗肿瘤药物与P-gp蛋白抑制剂奎宁通过连接剂共价连接而成的两亲性缀合物,所述两亲性缀合物在水中自组装得到所述两亲性缀合物抗肿瘤纳米药;所述的抗肿瘤药物为伊立替康、拓扑替康、阿糖胞苷、吉西他滨、艾沙托立宾、曲沙他滨、匹杉琼、喜树碱、10-羟基喜树碱、7-乙基-10-羟基喜树碱、紫杉醇、多西紫杉醇或阿霉素中的一种。
优选为,所述的连接剂含有敏感键且至少含有两个分别用于共价连接所述抗肿瘤药物和所述P-gp蛋白抑制剂奎宁的反应官能团,所述的敏感键是在肿瘤细胞内环境下易断裂的化学键。
优选为,所述的敏感键为二硫键、二硒键、酯键或酰腙键其中的一种。
优选为,所述的连接剂为3,3′-二硫代二丙酸,4,4′-二硫代二丁酸、3,3′-二硒代二丙酸,丁二酸酐、马来酸酐、二乙醇酸酐或2,2′-二硫二乙醇其中的一种。
优选为,所述的两亲性缀合物抗肿瘤纳米药的粒径为小于200nm。
本发明还公开了上述的具有逆转肿瘤多药耐药性功能的两亲性缀合物抗肿瘤纳米药的制备方法,其特征在于,包括以下步骤:
(1)所述的P-gp蛋白抑制剂奎宁与所述的连接剂反应,得到一中间体;
(2)将所述的中间体与所述的抗肿瘤药物反应,得到所述的两亲性缀合物;
(3)将所述的两亲性缀合物溶解在与水互溶的有机溶剂中,然后滴入缓慢搅拌的水中,最后除去有机溶剂,即得到所述的两亲性缀合物抗肿瘤纳米药水溶液。
优选为,所述的有机溶剂为N,,N′-二甲基甲酰胺、二甲基亚砜、四氢呋喃或乙腈其中的一种。
在本发明的一具体实施方式中,由喜树碱、10-羟基喜树碱、7-乙基-10-羟基喜树碱、紫杉醇、多西紫杉醇或阿霉素制备两亲性缀合物抗肿瘤纳米药的过程中,步骤(2)还包括所述的中间体与所述的抗肿瘤药物反应后,加入质子化试剂,得到所述的两亲性缀合物。
优选为,所述的质子化试剂为盐酸或硫酸。
本发明的P-gp蛋白抑制剂奎宁为含羟基的疏水性蛋白抑制剂,同时将抗肿瘤药物分为四类:含羟基的亲水性抗肿瘤药,如伊立替康、拓扑替康、阿糖胞苷、吉西他滨、艾沙托立宾、曲沙他滨;含氨基的亲水性抗肿瘤药,如匹杉琼;含羟基的疏水性抗肿瘤药,如喜树碱、10-羟基喜树碱、7-乙基-10-羟基喜树碱、紫杉醇、多西紫杉醇;含氨基的疏水性抗肿瘤药,如阿霉素。本发明在制备方法上存在多种选择,具体为:中间体的制备有以下三种方法,一、在室温下,将奎宁加入于溶有4,4′-二硫代二丁酸、缩合剂和催化剂的有机溶剂中搅拌反应,得到一端为羧基的中间体;二、在75℃下,将奎宁加入于溶有丁二酸酐、马来酸酐或二乙醇酸酐、催化剂的有机溶剂中搅拌反应,得到一端为羧基的中间体;三、在室温下,将奎宁加入于溶有三光气、缚酸剂的有机溶剂中搅拌反应,然后在室温下,再加入2,2′-二硫二乙醇反应,得到一端为羟基的中间体。步骤(2)两亲性/非两亲性缀合物的制备有以下几种:一、在室温下,将末端为羧基的中间体与含羟基的亲/疏水抗癌药加入到有机溶剂中,再加入缩合剂和催化剂,搅拌反应,得到两亲性缀合物/非两亲性缀合物;二、在室温下,将末端为羟基的中间体加入到溶有三光气、缚酸剂和催化剂的有机溶剂中反应,然后在室温下,加入含羟基的亲/疏水性的抗癌药反应,得到两亲性缀合物//非两亲性缀合物;三、在室温下,将末端含羟基的中间体加入到溶有对硝基苯基氯甲酸酯、三乙胺的有机溶剂中反应,然后加入含氨基亲/疏水性抗癌药得到两亲性缀合物/非两亲性缀合物。
所述的缩合剂为N,N′-二环己基碳二亚胺(DCC)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)的中的一种;所述的催化剂为4-二甲氨基吡啶(DMAP);所述的缚酸剂选自4-二甲氨基吡啶(DMAP)、三乙胺、N,N-二异丙基乙胺中的一种。
本发明还公开了上述的具有逆转肿瘤多药耐药性功能的两亲性缀合物抗肿瘤纳米药在治疗肿瘤和耐药性肿瘤上的应用。
与现有技术相比,本发明的有益效果如下:
本发明的两亲性缀合物在水中可以自组装形成纳米颗粒,无需任何药物输送载体,就能共输送蛋白抑制剂和抗肿瘤药物,通过肿瘤组织的通透性增强与滞留效应,该缀合物抗肿瘤纳米药可以更有效地进入肿瘤多药耐药性细胞,减少对正常细胞的毒副作用;当两亲性缀合物抗肿瘤纳米药进入肿瘤多药耐药性细胞后,在肿瘤微环境条件(酸性或还原性条件)下连接基团发生断裂,同时释放出蛋白抑制剂和抗肿瘤药物,蛋白抑制剂抑制P-gp蛋白的表达,防止抗肿瘤药物被泵出到细胞外,从而提高肿瘤多药耐药性细胞内药物浓度,达到逆转肿瘤多药耐药性的目的。
与CN201210475046“一种具有P糖蛋白抑制功能的抗肿瘤前药”相比,本发明的P-gp蛋白抑制剂奎宁是小分子蛋白抑制剂,作用机制明确;且本发明的抗肿瘤药物既包括亲水性的抗癌药又包括疏水性的抗癌药,而现有技术的聚乙二醇琥珀酸酯是亲水性的,所以要做成两亲性的物质,只能跟疏水性的抗肿瘤药物连接在一起,因此,本发明抗肿瘤药物选择范围较广,可根据病人病理情况进行选择;和本发明的抗肿瘤纳米药不需要借助于载体(例如:聚乙二醇)就可得到稳定且分散均匀的纳米颗粒,而现有技术要借助聚乙二醇高分子聚合物作为药物载体才能在缓冲液中形成均匀分散的体系,得到纳米药物。
附图说明
图1为本发明实施例1的中间体Qu-ss-COOH的反应路线图;
图2为本发明实施例1的两亲性药-药缀合物Ir-ss-Qu的反应路线图;
图3为本发明实施例1的中间体Qu-ss-COOH的1H NMR谱图;
图4为本发明实施例1的中间体Qu-ss-COOH的13C NMR谱图;
图5为本发明实施例1的两亲性药-药缀合物Ir-ss-Qu的1H NMR谱图;
图6为本发明实施例1的两亲性缀合物Ir-ss-Qu纳米药的动态光散射粒径分布图;
图7为本发明实施例1的两亲性缀合物Ir-ss-Qu纳米药的透射电子显微镜图;
图8为本发明实施例1的两亲性缀合物Ir-ss-Qu纳米药的体外药物释放曲线图;
图9为本发明实施例1的两亲性缀合物Ir-ss-Qu纳米药对多药耐药性肿瘤细胞的体外生长抑制作用的效果示意图;
图10为本发明实施例1的两亲性缀合物Ir-ss-Qu纳米药对P-gp蛋白抑制的效果示意图;
图11为本发明实施例1的两亲性药-药缀合物CPT-ss-Qu的合成路线图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应该理解,这些实施例仅用于说明本发明,而不用于限定本发明的保护范围。在实际应用中本领域技术人员根据本发明做出的改进和调整,仍属于本发明的保护范围。
实施例1:本发明的一种由奎宁Qu(式1)和伊立替康Ir(式2)制备的两亲性缀合物Ir-ss-Qu抗肿瘤纳米药
一、两亲性缀合物Ir-ss-Qu抗肿瘤纳米药的制备方法,具体包括以下步骤:
(1)中间体Qu-ss-COOH的合成
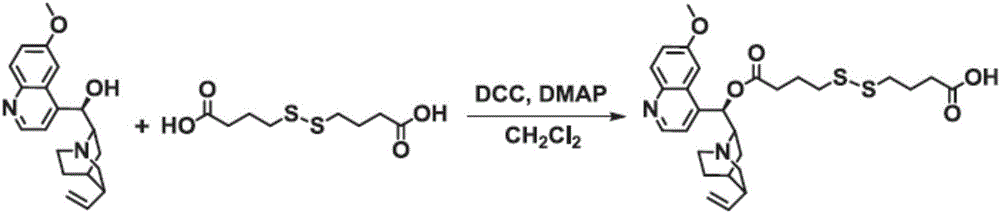
如图1所示,在室温下,分别向250mL干燥洁净的圆底烧瓶中,加入4,4′-二硫代二丁酸(4.77g,20mmol)、二环己基碳二亚胺(2.27g,11mmol)、4-甲氨基吡啶(1.22g,10mmol)和100mL无水四氢呋喃,搅拌反应30min后,然后将溶有奎宁(Qu,3.24g,10mmol)的50mL四氢呋喃溶液逐滴加入到上述反应体系中,继续反应24h,反应结束后,旋蒸除去有机溶剂,得到粗产物,然后经硅胶柱纯化(CH2Cl2∶CH3OH=20∶1,v/v),收集完毕后,旋蒸除去溶剂,即得到白色固体Qu-ss-COOH(3.12g,产率:65.8%),如式3所示。
如图3所示,中间体Qu-ss-COOH的1H NMR(400MHz,CDCl3)δ(ppm):10.62(s,1H),8.70(d,J=4Hz,1H),8.01(d,J=8Hz,1H),7.46(d,J=2Hz,1H),7.38(dd,J=2Hz,J=2Hz,1H),7.25(s,1H),6.81(s,1H),5.65(m,1H),4.99(t,J=28Hz,2H),4.00(s,3H),3.48(s,1H),3.39(s,1H),3.23(t,J=24Hz,1H),2.91(t,J=24Hz,1H),21.70(m,1H),2.55(m,1H),2.46(s,1H),2.36(t,J=16Hz,2H),2.08(m,2H),1.94(m,4H),1.82(m,1H),1.72(m,1H),1.62(m,1H)。
如图4所示,中间体Qu-ss-COOH的13C NMR(100MHz,CDCl3)δ(ppm):177.55,171.57,158.89,147.04,144.48,142.59,139.67,131.64,126.44,122.89,117.94,116.16,101.17,72.18,58.01,56.44,55.27,42.86,38.41,37.74,34.01,32.48,27.53,26.37,25.12,23.76,22.01。
ESI-MS m/z(M+H+)calcd 545.2148,found 545.2158(M+H+)。
(2)两亲性药-药缀合物Ir-ss-Qu的合成
如图2所示,在室温下,向250mL干燥洁净的圆底烧瓶中,分别加入中间体Qu-ss-COOH(2.32g,4.26mmol)、伊立替康(Ir,2.26g,3.85mmol),二环己基碳二亚胺(0.79g,3.85mmol)、4-甲氨基吡啶(0.43g,3.5mmol)和100mL无水CH2Cl2,搅拌反应24h后,过滤除去反应体系中的不溶物,浓缩除去有机溶剂后,再将粗产物过硅胶柱进行纯化(CH2Cl2∶CH3OH=20∶1,v/v),收集完毕后,旋蒸除去有机溶剂,即得到淡黄色固体Ir-ss-Qu(3.8g,产率:69.7%),如式4所示。
如图5所示,两亲性药-药缀合物Ir-ss-Qu的1H NMR(400MHz,CDCl3)δ(ppm):8.71(d,J=4Hz,1H),8.19(d,J=12Hz,1H),7.99(d,J=8Hz,1H),7.83(d,J=4Hz,1H),7.58(dd,J=4Hz,J=4Hz,1H),7.42(d,J=4Hz,1H),7.35(d,J=4Hz,J=4Hz,1H),7.32(d,J=4Hz,1H),7.15(s,1H),6.48(d,J=4Hz,1H),5.82(m,1H),5.67(d,J=16Hz,1H),5.40(d,J=16Hz,1H),5.23(d,J=4Hz,2H),5.01(m,2H),4.40(dd,J=16Hz,J=12Hz,2H),3.94(s,3H),3.34(m,1H),3.09(m,6H),2.90(t,J=24Hz,1H),2.62(m,12H),2.50(m,2H),2.25(m,2H),2.13(m,2H),1.99(m,6H),1.87(m,3H),1.69(m,7H),1.49(m,4H),1.38(t,J=16Hz,3H),0.96(t,J=16Hz,3H)。
两亲性药-药缀合物Ir-ss-Qu的13C NMR(100MHz,CDCl3)δ(ppm):172.24,172.11,167.76,158.12,157.54,153.28,151.62,150.64,147.63,147.29,147.07,146.09,145.56,144.91,143.79,141.84,131.96,131.74,127.75,127.29,127.17,126.18,122.07,120.07,119.09,114.79,101.57,95.96,76.17,73.99,67.31,62.58,59.31,56.73,55.92,50.47,49.50,44.58,44.25,42.68,39.82,37.54,37.27,32.77,32.32,31.99,28.40,27.91,27.70,26.24,24.72,24.58,24.13,23.38,14.23,7.81。
ESI-MS m/z(M+H+)calcd1113.4849,found 1113.4860(M+H+)。
(3)两亲性缀合物Ir-ss-Qu抗肿瘤纳米药的制备
取5mg两亲性药-药缀合物Ir-ss-Qu溶解在1mL DMSO中,室温搅拌溶解5min后,将上述溶液缓慢滴加到3mL剧烈搅拌的超纯水中,滴加完后,继续搅拌30min,然后将纳米药物溶液转移到透析袋(MWCO=1,000g mol-1)中,并用去离子水透析24h,每3h换一次去离子水,将DMSO透析完后,得到两亲性缀合物Ir-ss-Qu纳米药。用动态光散射粒径分布仪和透射电子显微镜对其粒径及形貌进行了表征,结果如图6和图7所示,可以看到两亲性缀合物组装成粒径在110nm左右的球形纳米药。
二、两亲性缀合物Ir-ss-Qu抗肿瘤纳米药的性能测试
(1)两亲性缀合物Ir-ss-Qu抗肿瘤纳米药的体外释放行为
将2mL 0.5mg mL-1的两亲性缀合物Ir-ss-Qu抗肿瘤纳米药物溶液装入透析袋(MWCO=3,500)中,然后将透析袋置于50mL含不同浓度谷胱甘肽(GSH)(0.0mM、1.0mM or 5.0mM)的磷酸缓冲液中,以1.0mM or 5.0mM谷胱甘肽的磷酸缓冲液为实验组,和以0.0mM谷胱甘肽的磷酸缓冲液为对照组。在恒温37℃,每隔一定时间间隔,取出3mL磷酸缓冲液,同时分别补充加入3mL新鲜上述三种磷酸缓冲液到透析液中,最后在365nm激发波长下测定取出样品的荧光发射强度,根据标准曲线计算出伊立替康(Ir)的浓度,释放结果如图8所示,可以看到在还原剂GSH作用下,双硫键断裂能有效的释放出Ir。
(2)两亲性缀合物Ir-ss-Qu抗肿瘤纳米药逆转乳腺癌多药耐药细胞(MCF-7/ADR)体外生长抑制效果
将MCF-7/ADR细胞以每孔1×104个细胞的密度,接种在96孔板中,每孔200μL,细胞置于5%CO2和37℃培养箱内培养过夜,待细胞完全贴壁后,更换新鲜的DMEM培养基,并加入含有不同系列浓度的Ir、Ir/Qu混合物或两亲性缀合物Ir-ss-Qu抗肿瘤纳米药物溶液,每孔50μL,加完结束后,培养箱中继续培养72h;然后每孔加入20μL预先配置好的MTT的PBS溶液(5mg mL-1),继续培养4h后,吸去DMEM培养液,每孔加入200μL DMSO,轻微振荡10min溶解蓝紫色甲瓒,用酶标仪测定490nm处吸光值(A);计算细胞存活率,算出各给药组对MCF-7/ADR细胞的细胞毒性,算出IC50值,进而算出各给药组对MCF-7/ADR细胞的耐药逆转指数,耐药逆转指数(IRDR)=IC50(游离的Ir组)/IC50(各实验处理组),结果如图9和表1所示,通过所得的耐药逆转指数可以得出,两亲性缀合物Ir-ss-Qu抗肿瘤纳米药有效的逆转乳腺癌细胞的多药耐药性。
表1
(3)两亲性缀合物抗肿瘤纳米药对MCF-7/ADR肿瘤细胞P-gp蛋白的抑制效果
将MCF-7/ADR细胞以5.0×105个/孔的密度接种到6孔板中,每孔2mL,然后在培养箱中培养24h后,去除培养基,然后分别加入浓度20μM游离的Qu,Ir、Ir/Qu混合物或两亲性缀合物Ir-ss-Qu抗肿瘤纳米药物为实验组,不加任何药物的为对照组。在37℃孵育24h后,吸去培养液,用预冷的PBS漂洗两遍,消化细胞,4℃下1000rpm离心10min,预冷的PBS洗2次,将细胞重悬于0.1mL PBS中,分别加入5μL PE-anti-human MDR1后,继续孵育30min,然后加入0.4mL PBS,再次离心,PBS洗2次后用BD FACSCalibur流式细胞仪FL2通道测试并分析门内1×104个细胞的荧光。荧光的数值就代表细胞膜表面P-gp蛋白的表达量,测试结果如图10所示,可以看出两亲性缀合物Ir-ss-Qu抗肿瘤纳米药能有效的抑制MCF-7/ADR细胞中P-gp蛋白的表达。
实施例2:本发明的一种由奎宁Qu(式1)和伊立替康Ir(式2)制备的两亲性缀合物抗肿瘤纳米药
一、两亲性缀合物Ir-cc-Qu抗肿瘤纳米药的另一制备方法,具体包括以下步骤:本实施例2除了以下步骤,其他步骤与实施例1相同。
(1)中间体Qu-cc-COOH的合成
取100mL反应瓶,向其分别加入奎宁(324mg,1mmol)、丁二酸酐(500mg,5mmol)、DMAP(122mg,1mmol)和50mL无水CH2Cl2,在氮气保护下,75℃避光反应48小时,反应结束后,先用旋转蒸发仪除去溶剂CH2Cl2,再将粗产物过硅胶柱进行纯化(CH2Cl2∶CH3OH=20∶1,v/v),收集完毕,旋蒸除去有机溶剂,即得到淡黄色固体Qu-COOH(237mg,yield:51.1%)。
(2)两亲性药-药缀合物Ir-cc-Qu的合成
取50mL干燥洁净的圆底烧瓶,向其分别加入Qu-COOH(232mg,0.426mmol)、Ir(226mg,0.385mmol),二环己基碳二亚胺(0.079g,0.385mmol)、4-甲氨基吡啶(0.043g,0.35mmol)和10mL无水CH2Cl2,室温下搅拌反应24h后,过滤除去反应体系中的不溶物,浓缩除去有机溶剂后,将粗产物过硅胶柱进行纯化(CH2Cl2∶CH3OH=20∶1,v/v),收集完毕,旋蒸除去有机溶剂,即得到淡黄色固体Ir-cc-Qu(0.35g,产率:67.1%),如式5所示。
实施例3:本发明的一种由奎宁Qu(式1)和伊立替康Ir(式2)制备的两亲性缀合物Ir-ss-Qu抗肿瘤纳米药
一、两亲性缀合物Ir-ss-Qu抗肿瘤纳米药的又一制备方法,具体包括以下步骤:本实施例3除了以下步骤,其他步骤与实施例1相同
(1)中间体Qu-ss-OH的合成
取240mL反应瓶,向其分别加入奎宁(972mg,3mmol)、三光气(311.6mg,1.05mmol)、DMAP(1.22mg,10mmol)和120mL无水CH2Cl2,在氮气保护下,室温避光反应1小时后,加入溶有2,2′-二硫二乙醇(2.26g,3.85mmol)的50mL CH2Cl2溶液,继续反应24h,反应结束后,用1N HCl洗涤3次,然后用10%的饱和NaHCO3溶液洗涤3次,饱和食盐水洗涤1次,去离子水洗涤2次,用无水Na2SO4干燥过夜,过滤收集有机层,旋蒸除去有机溶剂后,将粗产物过硅胶柱进行纯化(CH2Cl2∶CH3OH=20∶1,v/v),收集浓缩,即得到淡黄色固体Qu-ss-OH(877mg,yield:58%)。
(2)两亲性药-药缀合物Ir-ss-Qu的合成:
取90mL反应瓶,向其分别加入Qu-ss-OH(504mg,1mmol),三光气(95.6mg,0.4mmol)、DMAP(0.488mg,4mmol)和60mL无水CH2Cl2,在氮气保护下,室温避光反应1小时后,加入溶有伊立替康Ir(2.32g,5mmol)的50mL THF溶液,继续反应24h,反应结束后,用1N HCl洗涤3次,然后用10%的饱和NaHCO3溶液洗涤3次,饱和食盐水洗涤1次,去离子水洗涤2次,用无水Na2SO4干燥过夜,过滤收集有机层,旋蒸除去有机溶剂后,将粗产物过硅胶柱进行纯化(CH2Cl2∶CH3OH=20∶1,v/v),收集浓缩后,即得到淡黄色固体Qu-ss-Ir(721.6mg,yield:64.6%),如式6所示。
实施例4:本发明的一种由奎宁Qu(式1)和匹杉琼制备的两亲性缀合物抗肿瘤纳米药
一、两亲性缀合物匹杉琼-ss-Qu抗肿瘤纳米药的制备方法,具体包括以下步骤:
(1)中间体Qu-ss-NPC的合成
先合成Qu-ss-OH,Qu-ss-OH的合成步骤同实施例3中步骤(1);然后取100mL反应瓶,向其分别加入Qu-ss-OH(504mg,1mmol)、对硝基苯基氯甲酸酯(NPC-Cl,201mg,1mmol)、三乙胺(0.15mL,1.1mmol)和60mL无水CH2Cl2,在氮气保护下,室温避光反应24小时后,旋蒸除去有机溶剂,将粗产物过硅胶柱进行纯化(乙酸乙酯∶石油醚=1∶5,v/v),收集浓缩后,即得到淡黄色固体(532mg,yield:79.6%)。
(2)两亲性药-药缀合物匹杉琼-ss-Qu的合成
将Qu-ss-NPC(532mg,0.79mmol)、匹杉琼(440mg,0.79mmol)和三乙胺(0.58mL,4mmol)加入到30mL DMF溶液中,室温搅拌反应24h后,浓缩除去DMF后,分别使用(CH2Cl2∶CH3OH=10∶1,5∶1,v/v)作为淋洗剂过硅胶柱进行纯化,收集浓缩得到蓝色固体匹杉琼-ss-Qu(277.3mg,41%),如式7所示。
实施例5:本发明的一种由奎宁Qu(式1)和喜树碱CPT制备的两亲性缀合物抗肿瘤纳米药
先合成Qu-ss-COOH,Qu-ss-COOH的合成步骤同实施例1中步骤(1);如图11所示,然后取250mL干燥洁净的圆底烧瓶,向其分别加入Qu-ss-COOH(1.16g,2.13mmol)、喜树碱(CPT,0.69g,2mmol)、二环己基碳二亚胺(0.5g,2.5mmol)、4-甲氨基吡啶(0.24g,2mmol)和100mL无水CH2Cl2,室温下搅拌反应24h后,过滤除去反应体系中的不溶物,浓缩除去有机溶剂后,将粗产物过硅胶柱进行纯化(CH2Cl2∶CH3OH=15∶1,v/v),收集完毕后,旋蒸除去有机溶剂,即得到浅黄色固体CPT-ss-Qu(1.25g,产率:73%)。然后将缀合物CPT-ss-Qu中的Qu进行质子化,得到两亲性缀合物CPT-ss-Qu,如式8所示。
实施例6:本发明的一种由奎宁Qu(式1)和紫杉醇PTX制备的两亲性缀合物抗肿瘤纳米药
先合成Qu-ss-COOH,Qu-ss-COOH的合成步骤同实施例1中步骤(1),然后取250mL干燥洁净的圆底烧瓶,向其分别加入Qu-ss-COOH(0.25g,0.45mmol)、紫杉醇(PTX,0.42g,0.5mmol)、二环己基碳二亚胺(103mg,0.5mmol)、4-甲氨基吡啶(48mg,0.4mmol)和100mL无水CH2Cl2,室温下搅拌反应72h后,过滤除去反应体系中的不溶物,浓缩除去有机溶剂后,将粗产物过硅胶柱进行纯化(CH2Cl2∶CH3OH=10∶1,v/v),收集完毕后,旋蒸除去有机溶剂,即得到白色固体粉末PTX-ss-Qu(0.372g,产率:64%)。然后将缀合物PTX-ss-Qu中的Qu进行质子化,即得到两亲性缀合物PTX-ss-Qu,如式9所示。
实施例7:本发明的一种由奎宁Qu(式1)和阿霉素制备的两亲性缀合物抗肿瘤纳米药
先合成Qu-ss-NPC,Qu-ss-NPC的合成步骤同实施例4中步骤(1),然后将Qu-ss-NPC(669mg,1mmol),阿霉素(579mg,1mmol),三乙胺(0.15mL,1mmol)加入到50mL DMF溶液中,室温搅拌反应24h后,浓缩除去DMF,再分别使用(CH2Cl2∶CH3OH=20∶1,v/v)作为淋洗剂过硅胶柱进行纯化,收集浓缩得到红色固体粉末缀合物(0.84g,78%),然后将缀合物中的Qu进行质子化,即得到两亲性缀合物阿霉素-ss-Qu,如式10所示。
以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该发明仅为所述的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属技术领域技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
- 还没有人留言评论。精彩留言会获得点赞!