酶抑制剂耐药性检测方法与装置与流程
本申请要求于2014年4月15日递交的、申请号为61/979,827的美国临时申请的优先权,其全部内容通过引用的方式并入本申请。
技术领域
本发明系用于对酶的抑制剂耐药性进行检测的方法和装置。在酶抑制剂用作药物的情况下,该方法可被用于对其进行耐药性检测。本方法可用于检测通过功能改变方式而使酶针对任何酶抑制剂所产生耐药性。本方法也可以通过一种酶对不同的酶抑制剂的耐药性的变化来区分该酶的变型。本发明中还包括适用于本检测方法的检测装置。
政府资助
本文描述与声明中所涉及的发明使用部分由美国国家卫生研究院所授予的政府资助。
背景技术:
生物系统中的酶在该系统中发挥着重要的功能,因此也是药物干预的重要靶点。
目前,人们已经开发出多种酶抑制剂并将其用于对需要酶参与催化的生物进程进行干预。酶抑制剂是一种分子,这种分子能够粘合酶并降低酶的活性。酶抑制剂的粘合作用能够阻止底物进入酶的活性部位并且/或者阻止酶催化其参与的反应。酶的粘合作用分为可逆性和不可逆性两种,并会分别产生可逆性或不可逆性抑制作用。可逆性抑制又可分为竞争性抑制、非竞争性抑制以及同事包含上述两种作用的反竞争性抑制。通常,不可逆性酶抑制剂能够通过不可逆性共价键与酶相结合。
目前,人们已经开发出多种酶抑制剂并且成功地将其作为药物用于治疗多种疾病。作为药物GLEEVEC(商标名称)的活性成分,甲磺酸伊马替尼能够对蛋白质酪氨酸激酶(其过度表达可导致骨髓性白血病)产生抑制作用。由于这种酶抑制剂能够抑制蛋白质酪氨酸激酶的活性,因此能够对白血病进行有效治疗。而且,人们还成功地将特异性蛋白酶抑制剂用于治疗人类免疫缺陷病毒以及丙肝病毒相关感染的治疗。使用抗生素对各种细菌感染进行治疗已经挽救了不计其数的生命。β内酰胺是包括青霉素和头孢菌素在内的各种药物抗生素的主要成分。然而,多种菌种可生产β内酰胺酶。这种酶能够降低上述β内酰胺类抗生素的作用,从而使细菌对其产生耐药性。为了克服细菌对抗生素的耐药性,人们研制出了多种β内酰胺酶抑制剂,其中包括克拉维酸、舒巴坦和他唑巴坦。
同样地,目前被用作流感治疗干预的主要手段的是被称作神经氨酸酶抑制剂的一类新型药物。这种药物能够抑制流感病毒的神经氨酸酶。由于流感病毒神经氨酸酶是甲型和乙型流感病毒中的必需酶,因此上述药物对流感具有良好的治疗效果。目前,许多国家已经批准将奥司他韦和扎那米韦(神经氨酸酶抑制剂)用于治疗流感患者。奥司他韦和扎那米韦分别是TAMIFLU与RELENZA这两种抗流感药物的活性成分。
这类酶抑制剂在治疗中的使用会导致靶向酶产生遗传变异,从而导致该类抑制剂无法继续对酶产生有效的抑制作用,这种现象通常被称作耐药性。例如,使用HIV酶抑制剂可以很快导致蛋白酶基因产生突变选择,从而使HIV病毒对这类抑制剂产生耐药性。同样地,能够使病毒对奥司他韦(用于流感治疗的重要药物)产生耐药性的流感病毒突变体也已经出现。在2008/2009年的季节性流感中,美国流行的H1N1病毒分离株几乎全部都对奥司他韦具有耐药性。
因此,有必要对相关病毒是否已经对神经氨酸酶抑制剂产生了耐药性开发出快速且易于使用的检测方法。病毒对酶抑制剂的耐药性通常以IC50(半数酶的活性受到抑制时的抑制剂浓度)这一指标进行测定。通常,对某种抑制剂的IC50值的测定需要酶抑制检测法,其中含8-12项反应(待测抑制剂浓度依次升高)检测。IC50值可以对酶是否已经对某种抑制剂产生了耐药性或其敏感性程度(尤其是在与相关野毒或突变体酶进行对比时)予以提示。例如,奥司他韦羟酸盐对H1N1流感野毒的IC50值通常低于5nM,而神经氨酸酶基因发生H274Y突变的病毒突变体的这一IC50值通常超过50nM。
由于酶抑制检测通常需要对8-12项反应进行检测,因此测定出相关IC50值的工作量繁重,而且成本较高。因此,时至今日,酶抑制检测法仍然未在临床中得以广泛应用。作为本项发明的一项特色体现,检测两项反应(分别有药物参与和无药物参与)即足以确定出病毒是否具有耐药性,其所用指标也只有两种反应的信号比。两种反应检测法使药物耐药性检测得以大幅度简化。同时,采用具有双样本读数功能的检测装置还能够进一步简化检测程序。
发明概述
下文对本文所描述的本发明的多项特色体现进行了总结。下文相关段落具有自我指涉性。需要特别注意的是,相关段落中所使用的短语“根据前述或下述段落”系指其他段落。下文段落中所出现的这一短语指的是本文中所描述的发明特色,既包括单独解读单个段落时所出现的主题,也包括多个段落同时解读时所出现的主题。在这方面,发明申请人设置下列段落的目的显然是为了对其发明的各个方面与特色进行描述(尤其是在对多个段落进行同时解读时)。也就是说,各段落之间通过紧密结合的方式对各段落中以及彼此联合时所出现的全部特色予以设定和清晰呈现;因此,下列任何段落中所出现的主题(单独出现或与一个或多个其他段落中所描述的其他主题共同出现,包括单独设定的价值及其与其他设定价值的组合)均属于要求保护的主题。如果存在相关要求,本文中所描述的全部上述特色组合均可在本发明应用中或其后续应用(具有本项应用的优点)予以列举。
作为一种实际应用,酶检测(含两项反应)就是根据本项发明而开发的一项方法。这两种反应需要使用两种试剂混合物(本文中通常称为试剂混合物I和试剂混合物II)。这两种试剂混合物基本相同,但其中的一种试剂混合物(例如,试剂混合物II)中含有酶抑制剂或其适当浓度的活化型。两种试剂混合物中含有酶底物,因此在与酶反应时可导致信号的增强,从而表明样本中有酶的存在。试剂混合物中的酶可发色、显示荧光、产生化学发光或生成其他类型的可测定信号。由于化学发光反应的线性范围通常更广,因此在特定的实施方式中,可以将酶底物作为化学发光底物。
由于在涉及抑制剂(例如,试剂混合物II)的相关反应中酶的活性会全部或部分地受到抑制,因此该反应中的信号会有所减弱。该反应中酶抑制剂信号相对于无抑制剂参与的反应的减弱程度可表明酶对该抑制剂的敏感性或耐药性程度。信号减弱的程度可采用以多种形式表示的信号比予以表达。一种酶的信号比截断值可在试验中通过检测大量样本的方式予以确定。
用于酶抑制剂耐药性检测的适当样本包括(但不限于)纯化酶、部分纯化后的酶以及具有酶活性的样本。如果酶包含于细胞或病毒中,则需要将该细胞或病毒进行溶解以释放出酶或使反应试剂与酶相接触。
由于检测酶对抑制剂是否产生耐药性时需要测试两种反应(分别采用试剂混合物I和II),因此本发明还提供有可同时对两种反应的信号进行检测的信号检测装置。
在部分应用形式中,人们需要就酶对一种以上的抑制剂是否具有耐药性。此时,可制备多种抑制剂(含有试剂混合物);每种抑制剂(含有试剂混合物)中均含有一种独一无二的待测抑制剂。例如,有时人们需要对多种用于治疗流感的药物进行检测(例如,流感病毒神经氨酸酶抑制剂奥司他韦与扎那米韦)。为了在一次检测中检测出流感病毒是否对奥司他韦与扎那米韦两种药物具有耐药性,可制备出含有抑制剂的两种试剂混合物,其中分别含有奥司他韦和扎那米韦。因此,这种检测的必需材料包括不含有抑制剂的试剂混合物以及多份试剂混合物(每份混合物中均含有与众不同的酶抑制剂)。
在其他应用形式中,一种酶对其不同类型抑制剂的耐药性的不同表现也被用来作为对该酶变型的区分标准。例如,不同种类的β内酰胺酶抑制剂的耐药性可以用来作为众多带有β内酰胺酶的细菌的分类依据。例如,按照本发明的方法,能够设计和开发出检测和区分某特定的β内酰胺酶的实用检测方法,比如碳青霉烯酶,这种酶能够水解碳青霉烯类抗生素,而这一类抗生素通常作为“最后一招”的抗生素来使用。由于产生碳青霉烯酶的细菌(简称CPO)通常对大多数抗生素都产生耐药性,导致这类细菌的高发病率和高死亡率出现。因此,对于CPO的检测和确认对于临床诊断和公共健康的重要是不言而喻的。按照本发明的方法,检测方法包括两种试剂混合物,即试剂混合物I内含用于检测任何一种β内酰胺酶所必需的试剂,而试剂混合物II不仅内含试剂混合物I所包含的组成部分而且还包含碳青霉烯。当上述的试剂混合物I的信号值高于截断值时,表明某一样品中含有β内酰胺酶(包括碳青霉烯酶),而当试剂混合物II和试剂混合物I的比值高于截断值时,则可以确定该样品中的β内酰胺酶的种类属于碳青霉烯酶,由此可以检测和分类β内酰胺酶。
鉴于试剂混合物I和试剂混合物II的信噪号比值能够用来检测酶对其抑制剂的敏感性或耐药性程度或者区分酶的分型(比如碳青霉烯酶和普通β内酰胺酶),尤其重要的是在两个试剂混合物之间的信号值之差只是用来反映试剂混合物II含有的酶抑制剂对相关酶的抑制程度,而不是两种试剂混合物之间的信号变化。本发明的一种应用形式是由于试剂的不稳定的变动,为了将试剂的信号值比的变动降到最小,该应用需要使用两种试剂球,即一种主混合试剂球和酶抑制剂试剂球。主混合试剂球包含了所有能够产生反映酶存在的信号的反应组分,而酶抑制剂试剂球内含有抑菌浓度的酶抑制剂。作为实际应用形式,相同批次的主混合试剂球和酶抑制剂试剂球可以被组装在同时含有试剂混合物I和试剂混合物II的同一个试剂盒里。例如,来自同一批次的主混合试剂球被分别放入试剂混合物I和试剂混合物II的试管中,而酶抑制剂试剂球则只被放入试剂混合物II的试管中。如此组装的试剂混合物I和试剂混合物II被最终包装在一个试剂盒里用作样品的检测。个性化的设计技巧可以开发出对应于实际的试剂球的配方和生产工艺。
本发明的实用形式包括但不仅限于以下详述:
详述1:一种可以检测样品中的酶是否对于酶抑制剂产生耐药性的方法,这个方法包括:
a)多反应试验:该试验中包含2个或2个以上的反应,而且这些反应是有2个或2个以上试剂混合物产生的。其中一个试剂混合物不含酶抑制剂,而其他的试剂混合物中至少含有一种达到抑菌浓度的酶抑制剂,而且
b)采用信号比或信号比倍数作为参数;该信号比为有抑制剂参与的反应所得信号与没有抑制剂参与的反应所得信号之间的比值,该比值表示酶对相关抑制剂的耐药性与敏感性。
详述2:在详述1描述的方法中,其中所指定的试剂混合物的组分基本相同,除了一个不含酶抑制剂,而另一个含有达到抑菌浓度的酶抑制剂。
详述3:在详述1描述的方法中,所述的试剂混合物中包含有待检测的酶的底物。
详述4:在详述3描述的方法中,其中所指定的酶底物是一种能够产生显色信号、荧光信号、化学发光信号的酶底物。
详述5:在详述4描述的方法中,其中所指定的化学发光底物是一种金刚烷衍生物。
详述6:在详述4描述的方法中,其中所指定的荧光发光底物是一种荧光素衍生物。
详述7:在详述1描述的方法中,其中所指定的底物为用于检测样品中流感病毒神经氨酸酶活性的流感病毒神经氨酸酶底物;
详述8:在详述1描述的方法中,其中所指定的底物为用于检测样品中β内酰胺酶活性的β内酰胺酶底物;
详述9:在详述1描述的方法中,其中所指定的抑制剂在足够高的浓度条件下能够抑制敏感性流感病毒神经氨酸酶的活性;
详述10:在详述1描述的方法中,所描述的细菌β内酰胺酶抑制剂在达到其其抑菌浓度情况下,该抑制剂可以有效抑制对该种酶抑制剂敏感的细菌β内酰胺酶的活性。
详述11:在详述9描述的方法中,所描述的流感病毒神经氨酸酶抑制剂可以是下列任何一种抑制剂:奥司他韦羟酸盐、扎那米韦、帕拉米韦和那尼纳米韦;
详述12:在详述10描述的方法中,所描述的β内酰胺酶抑制剂可以是下列任何一种抑制剂:克拉维酸、舒巴坦、他唑巴坦、阿维巴坦、离子螯合剂以及β内酰胺类抗生素;
详述13:在详述12描述的方法中,所描述的β内酰胺抗生素可以是下列任何一种抗生素:超广谱头孢菌素类抗生素、碳青霉烯类抗生素以及苯唑青霉素或其衍生物;
详述14:用于检测样本中的酶是否具有抑制剂耐药性的方法,该方法包括:
a)该检测需要采用两种试剂混合物,其中一种不含抑制剂,而另一种含有一种酶抑制剂;
b)采用信号比或信号比倍数作为参数;该信号比为有抑制剂参与的反应所得信号与没有抑制剂参与的反应所得信号之间的比值,该比值表示酶对相关抑制剂的耐药性与敏感性。
c)一个包含两个检测样品仓的信号检测装置,这个信号装置将用来收集两个反应产生的信号。
详述15:在详述14描述的方法中,所述之装置能够检测双反应所产生的信号,同时能够计算出信号比并对检测结果进行解读;
详述16:在详述14描述的方法中,所述的两个检测样品仓中均装有一个信号传感器;
详述17:用于检测酶对于其抑制剂敏感性和耐药性的试剂盒,既可以组装在一个试剂盒里,也可以分别组装在不同的试剂盒中。在数个试剂组分中都有一个含有酶底物的成分,这个酶底物的成分能够被相对应的酶作用后产生可检测的信号,其中,第一个试剂混合物不含酶抑制剂,第二个试剂混合物含有达到抑菌浓度的所述的酶的抑制剂。再者,前述的第一种和第二种试剂混合物中都包含了一粒主反应混合试剂球,而这粒主反应试剂球能够产生用来表明所述酶存在的信号,前述的第二种试剂混合物还包含一粒额外的含有所述的酶的抑制剂试剂球。
详述18:在详述17描述的试剂盒中,进一步可以根据实际需要将显色信号、荧光信号、化学发光信号的底物随机地组合在一起。
图片简要说明
由于结合图片有助于深入本文所描述的相关应用形式的各种特色与优点,因此本文中特提供相关插图以供参考。
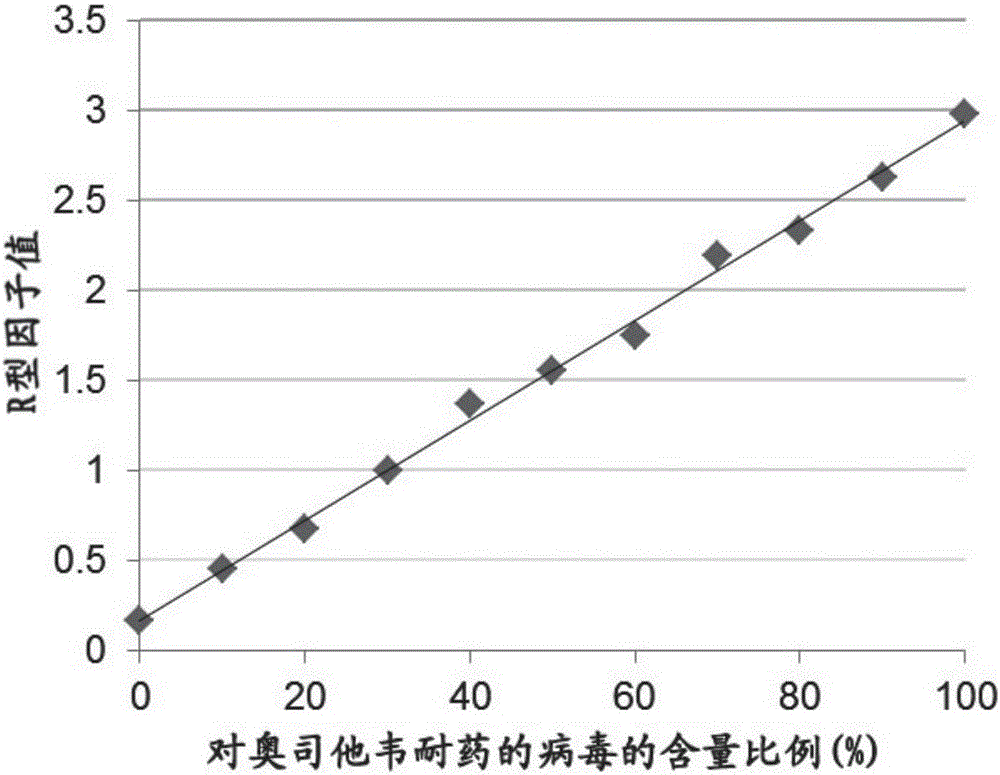
图1:R型因子值之间的关联性以及奥司他韦羟酸盐(OC)耐药性与敏感性混合物中的耐奥司他韦羟酸盐流感病毒比例图。将对奥司他韦敏感的流感病毒(A/H1N1p/CA/07/2009)和一系列数量递增的对奥司他韦耐药的流感病毒(A/H1N1p/CA/39/2009)进行混合,用本发明所述的方法中的试剂混合物I和试剂混合物II进行检测。除了试剂混合物II中包含有抑制剂奥司他韦羟酸盐以外,试剂混合物I和试剂混合物II的成分完全相同。R型因子值等于试剂混合物II的信号值除以试剂混合物I的信号值再乘以10倍而得。R型因子值和样品中的对奥司他韦耐药的病毒数比例可以构成二位函数图。
图2:R型因子值之间的关联性与含有OC耐药性与敏感性病毒的流感病毒分离株IC50值图。用本发明所述的两个反应的方法检测流感病毒中对奥司他韦敏感和耐药两种类型病毒。R型因子值和病毒的IC50值(nM)构成二位函数图。不同类型的流感病毒被分成两个截然不同的组别:一组是对奥司他韦敏感的病毒组,这一组表现出IC50值低,R型因子值也低,而另一组是对奥司他韦耐药的病毒组,该组则表现出IC50值高,R型因子值也高。
图3:用于测定抗菌素耐药性的β内酰胺酶检测的反应动力学。
图4:用于显示本发明中所述的试剂盒的组分,该试剂盒用于检测流感病毒耐药性。举例所示的试剂盒检测结果表明所有产生信号的试剂是极其相似的,而且试剂混合物II和试剂混合物I的信号比值已经被优化且非常适合于检测。图中显示的两种试剂球即主反应混合试剂球和抑制剂试剂球。在试剂盒中,试剂混合物I和试剂混合物II组合了同一生产批次的主反应混合试剂球,而试剂混合物II还包含了一粒额外的抑制剂试剂球,如图所示。
发明详述
本发明公开了一种用于对酶对抑制剂的耐药性进行测定的方法。本方法所采用的检测中包括两项可分别通过两种试剂混合物进行的反应。在一种应用形式中,本检测可在60分钟(最可能在30分钟)之内完成。两种试剂混合物能够用于对样本中的酶活性进行检测。这两种试剂混合物基本相同,但其中的一种试剂混合物中含有适当浓度的酶抑制剂或其活化型。如果酶对于某种抑制剂具有敏感性,则有酶抑制剂参与的反应的信号将大为减少。另一方面,如果酶对抑制剂具有耐药性,则有酶抑制剂参与的反应所产生的信号强度将保持不变。两种酶反应的信号强度可以表明酶是否对该抑制剂具有耐药性。在酶抑制剂用作药物的情况下,该检测法可被用于对其进行耐药性检测。
试剂混合物中所含的酶底物能够与酶产生较强的反应,从而导致信号强度(例如,化学发光信号强度)或信号分布曲线(例如,HPLC色谱图中保留时间的变化)的升高或改变。底物中通常(但并非总是)含有能够为酶所识别并因此使底物具备专属性的成分以及另一种可生成信号的成分。所产生的信号可以是显色信号、荧光信号、化学发光信号或其他可测量信号。在与酶反应时,底物通常会被酶所分解,从而导致其显色、荧光或化学发光信号发生变化,而这种变化可以为适当的仪器所检测到。试剂混合物中底物的适当浓度可通过试验进行优化。两种试剂混合物中均含有浓度不同的同一种酶抑制剂,但前提是两种混合物中该抑制剂的浓度必须有所不同,从而使检测人员可以通过信号比对抑制剂耐药性与敏感性酶加以区分。
在某些应用形式中,由于化学发光底物的线性范围通常更广,因此相关检测中会采用化学发光底物。适当的化学发光底物包括(但不限于)金刚烷衍生物与荧光素衍生物。
采用金刚烷作为化学发光底物时,底物与样本中的酶反应后会释放出金刚烷成分。将反应的pH值升高至碱性pH值范围(例如pH 11)之后,通常可以使释放出的金刚烷发光。如果待测样本中的酶所对应的最优pH值显著低于碱性pH值,则有必要通过两步法进行该项检测:首先在较低的pH值下进行酶反应以裂解底物,然后再升高至碱性pH值以促使金刚烷发光。
采用荧光素延伸无作为化学发光底物时,底物与样本中的酶反应后会释放出荧光素成分。由于可以将荧光素氧化为能够发光的氧化荧光素,因此荧光素酶可产生光。如果酶所对应的最优pH值接近于中性pH值,则由于荧光素酶在中性pH值条件下的作用效率较高,因此仅需要一步法即可完成检测。在采用一步法检测时,由于酶反应、信号生成与检测同时发生,因此检测程序得以简化,而检测的变异性通常也会得以降低。例1与例2系检测中所使用的试剂混合物成分举例。该检测中采用4,7-N-乙酰神经氨糖酸-O-荧光素作为检测流感病毒酶活性与奥司他韦羟酸盐抑制作用的底物。
底物并非总是会在其与特定的酶进行反应时使信号的强度产生变化。与此相反,底物可能会导致信号的其他参数(例如,信号类型)发生变化。例如,蛋白酶底物是一种可被蛋白酶裂解的肽或修饰肽。肽底物的裂解会产生两种较小的片段,其与未裂解的底物所产生的信号强度比较相近。然而,上述裂解产生的片段可以通过其他的检测装置(如高效液相色谱检测仪)进行检测。相关举例详见例4。
在特定应用形式中,一种试剂混合物不含酶抑制剂,而另一种试剂混合物则含有抑菌浓度的酶抑制剂。该抑制剂的浓度可通过对足量样本(部分样本含有对抑制剂具有耐药性的酶,而其他样本中则含有对抑制剂具有敏感性的酶)进行检测的试验方式予以测定。适当的抑制剂浓度可以使对抑制剂具有耐药性或敏感性的酶在两种反应中所产生的信号比具有显著性差异。据了解,不含酶抑制剂的试剂混合物中仍然可以含有一定量的酶抑制剂,但前提是两种混合物中该抑制剂的浓度必须有所不同,从而使检测人员可以通过信号比对抑制剂耐药性与敏感性酶加以区分。
试剂混合物可制成浓缩溶液(例如2倍浓缩溶液)。在使用2倍浓缩试剂混合物时,应将样本缓冲液中等量的样本与2倍浓缩实际混合物相混合以开始化学反应。试剂混合物中的试剂也可通过冻干方式除去水分,此时,可以将1倍溶液中的足量样本加入到试剂混合物中以开始化学反应。
应采用适当的仪器对两种反应所产生的信号强度予以测量:可采用光度仪器测定显色信号,采用荧光剂测定荧光信号,并采用光度计测定化学发光信号。可对两种反应所得出的信号比进行计算,并将计算结果用于显示酶对相关抑制剂的耐药性程度。信号比的表达可以采用多种形式。例如,可以采用反应I对反应II的信号比形式,或者采用反应II对反应I的信号比形式,还可以采用上述信号比的数倍形式(例如10倍;反应II信号÷反应I信号)。
酶对抑制剂的耐药性截断比测定方式可以通过对大量样本进行检测的方法进行;此类检测中应同时纳入对抑制剂具有耐药性和敏感性的样本,并应在测得的信号比与临床结局或金标准检测结果(例如IC50值和基于测序的突变检测)之间建立起关联性。
对于两种反应中所产生的信号,可以通过采用单管信号测量仪器按序测定。应对两种反应的信号予以记录并用其计算信号比(表示对抑制剂的耐药性程度)。这种仪器的使用在一定程度上有些繁琐。或者,上述两种反应可在微孔板上进行,这样,可通过微孔板读书器在反应进行的同时获得信号值。然而,微孔板读书器并非系针对该类检测(仅包括两种反应)而设计,而且通常也并不易于携带。
本发明中包括具有双信号测量功能的装置。该装置中设计有两个检测样品仓,而且,两个反应试管可以同时放入两个检测样品仓之内。该装置设计有1或2个检测传感器以进行信号检测。合格的信号检测传感器必须具备足够的敏感度。此类传感器包括(但不限于)用于光信号检测的光电倍增管和光电二极管。
在某些应用形式中,该装置设计有两个信号检测传感器,每一只传感器分别对应各自的检测样品仓。使用两个信号检测传感器(如光电二极管)有如下几项优点。首先,装置无需任何运动件,从而大大降低了生产成本并减小了仪器体积(因为每个检测样品仓均有对应的信号检测传感器)。其次,两个样品腔中两种反应所产生的信号可同时而非先后被检测到。第三,由于信号比可以通过计算得出,并且检测结果可通过装置进行自动解读,因此该检测程序得以简化。这样,采用带有两个检测样品仓的装置能够进一步简化酶对抑制剂所产生的耐药性的检测程序。而另外的应用形式中,该装置设计有数倍于两个样品仓的检测样品仓,比如4个样品仓等,用于同时收集超过1个样品以上的多样品检测。
目前,人们已经针对许多重要的治疗靶向酶开发出了两种或以上的抑制剂以进行药物干预。其中包括(但不限于)流感病毒神经氨酸酶、HIV蛋白酶与细菌β内酰胺酶。目前,β内酰胺酶抑制剂包括克拉维酸、舒巴坦与阿维巴坦,此外还包括多种内酰胺抗生素,如对β内酰胺酶降解具有耐降解性的碳青霉烯类抗生素。在某些应用形式中,应首先选择能够检测出对两种或两种以上的酶抑制剂具有耐药性的检测。这种检测材料由一种不含有抑制剂的试剂混合物以及多种试剂混合物(每种中均含有独特的酶抑制剂)所组成。样本检测可以通过将样本加入到不含抑制剂的试剂混合物中以及各种类型的试剂混合物(每种试剂混合物中均含有独特的抑制剂)中的方式进行。信号比可以通过对各种酶抑制剂相关参数进行计算的方式得出。
不含酶抑制剂的试剂混合物产生的信号值能用以判断一个样品中是否存在相应的酶。通过检测已知的一系列定量的样品来确定其截断值。比如,通过检查100例阳性样品和1000例阴性样品的方式,其截断值可以被设在其平均值上的3个标准方差的位置上。另外,通过检测符合比例的合适的样品,来确定每种酶和酶的抑制剂之间的对应关系,由此来确认试剂混合物II和试剂混合物I的信噪比的截断值。当然,众所周知,检测一个酶对其抑制剂的耐药性是需要知道其最低酶浓度,而这个酶浓度则可以通过对一系列已知的不同定量比的合适的阳性样品的检测来获得。
实施例
下列以插图形式给出的示例仅表示各种特别的应用形式,因此不构成限定性或排他性。
实施例1:流感病毒对奥司他韦羟酸盐的耐药性检测
本例旨在对如何将本发明中所描述方法用于区分出奥司他韦羟酸盐敏感性流感病毒和耐药性病毒进行说明。奥司他韦羟酸盐是TAMIFLU关键成分的活化型。
待测酶为流感病毒神经氨酸酶,该酶是包括奥司他韦羟酸盐在内的多种抑制剂的靶向酶。用于对流感病毒神经氨酸酶进行检测的化学发光底物为一种名为4,7-二甲基N-乙酰神经氨糖酸的荧光素衍生物。如果样本中存在流感病毒或其神经氨酸酶,则在酶的作用下,底物可释放出荧光素成分。如果样本中存在荧光素酶,则荧光素会被氧化为可产生光信号的氧化荧光素。由于流感病毒神经氨酸酶与荧光素酶均可在中性pH值的条件下发生作用,因此可将荧光素酶加入到酶反应混合物中以实施一步法检测。
试剂混合物I与II两种试剂混合物的制备方法如下:
试剂混合物I的组成:
试剂混合物II的成分与试剂混合物I基本相同,但前者中含有50nM的奥司他韦羟酸盐。据了解,其他浓度的抑制剂也可用于该检测中。将0.25ml的试剂混合物等份装入75x 12mm的玻璃瓶内。然后,将各小份试剂混合物进行冻干以除去其中的水分。
用pH值为7.4的10mM HEPES(羟乙基哌嗪乙磺酸)缓冲液将培养后的流感病毒稀释为1∶100和1∶1000两种浓度的溶液以用于检测。本例采用两种流感病毒株:A/Georgia/17/2006:对克流感有敏感性的野毒和A/Georgia/20/2006:对克流感具有耐药性的上述病毒突变体。将各病毒株的各种浓度的0.25ml样本加入到试剂混合物I和II中。将上述溶液在室温下培养5分钟后,用光度计对反应所得的光信号进行测量。光信号采用RLU(相对光单位)进行测量,然后将所得结果用于进行信号比计算。两种反应的信号比计算方式如下:
信号比(R因子)=10X(试剂混合物II的信号强度÷试剂混合物I的信号强度)
根据上式计算所得的信号比即为R因子。
如图1所示,根据对浓度分别为1∶100和1∶1000两种溶液的测量结果,对奥司他韦羟酸盐具有敏感性的流感病毒的R因子平均值分别为0.27和0.32。与此相对,根据对浓度分别为1∶100和1∶1000两种溶液的测量结果,对奥司他韦羟酸盐具有耐药性的流感病毒突变体的R因子平均值分别为7.14和5.26。对奥司他韦羟酸盐具有耐药性和敏感性的两种流感病毒的信号比之间显然有着明显区别。因此,本发明中所描述的双反应法可用于对奥司他韦羟酸盐具有耐药性和敏感性的两种流感病毒的区分。
表1使用双反应法对病毒的奥司他韦羟酸盐耐药状态进行测定
实施例2:信号比与抑制剂耐药性流感病毒含量之间的相互关系
本例旨在考察样本中流感病毒对流感病毒神经氨酸酶抑制剂奥司他韦羟酸盐(OC)所具有的耐药性程度以及相关信号比或R因子值。试剂混合物I与II系参照例1中所描述的配方而制定。为了制备具有不同程度OC耐药性的样本,我们将OC敏感性病毒(A/H1N1p/CA/07/2009)与数量递增的OC耐药性病毒(A/H1N1p/NC/39/2009)进行混合。然后,我们按照例1中所描述的方法用试剂混合物I与II对混合所得的样本进行检测。我们采用带有两个检测样品仓(每个检测样品仓中均装有光电二极管传感器)的检测装置对两次反应的信号强度进行测量。
信号比采用例1中所描述的R因子值的形式进行表达。R因子值与样本中OC耐药性病毒含量的升高而增加,其关联系数为0.9964(图1),从而表明R因子值对奥司他韦耐药性程度具有指示作用。
实施例3:采用信号比对神经氨酸酶抑制剂耐药性流感病毒进行检测
本例相关试验中所采用的试剂混合物I与II的成分与例1基本相同。
用于对流感病毒耐药性进行测定的当前所选方法为IC50测定法。然而,IC50测定法涉及到的样本检测需要进行8-12项反应。而本发明中所描述的方法仅需进行两项反应。本例表明,与IC50值类似,采用本发明所描述的方法和试剂所得出的R因子值能够对耐药性和敏感性流感病毒加以区分。
本例所示研究中共使用了202份流感病毒临床分离株。这些分离株由OC耐药性和敏感性病毒组成,其中包括从2008/2009流感季节所分离出的104种H1N1病毒(08/09H1N1季节性流感病毒)、从2007/2008流感季节所分离出的9种H1N1病毒(07/08H1N1季节性流感病毒)、从2008/2009流感季节所分离出的35种H3N2病毒(07/08H1N1季节性流感病毒)以及从今年流感病毒中所分离出的54中乙型流感病毒。所有上述病毒分离株的采集地均为美国。众所周知,美国流行的08/09季节性N1N1病毒的神经氨酸酶中存在H274Y基因变异,从而使病毒对奥司他韦羟酸盐具有耐药性。据估计,所有其他病毒分离株(包括07/08H1N1、08/09H3N2病毒以及乙型流感病毒分离株)均对OC具有敏感性。
对上述各种202中临床分离株的IC50测定基本上均以公开发表的相关文章为准(《抗菌药物与化学疗法》;第57卷,第5209-5215页)。关于上述病毒分离株的IC50曲线图可详见表2。不出所料,08/09H1N1分离株对OC表现出较高的耐药性,其IC50值范围为79.58-717.97nM。与此相对,07/08H1N1与08/09H3N2分离株的IC50值大幅度降低至0.40-7.10nM,从而表明这些病毒对OC具有高敏感性。目前已经知道,乙型流感病毒对OC的敏感性有所降低,这一结果与异性流感病毒组的IC50值相一致。乙型流感病毒的IC50平均值为18.69nM,其范围为5.46-36.24nM。通常可根据IC50值将病毒分为两组,一种是高IC50值组,另一组是第1C50值组;两组的IC50值分别为>79nM和<37nM。尽管如此,OC仍然可以有效治疗乙型流感病毒所导致的感染。
表2:奥司他韦羟酸盐的IC50曲线图
如果将表示OC耐药性的IC50截断值设为50nM,则100%的80/09H1N1病毒分离株对OC具有耐药性,而100%的07/08H1N1、08/09H3N2以及乙型流感病毒分离株均对OC具有敏感性。
对上述分离株的检测均采用双反应法和装有双检测样品仓的检测传感器进行。试剂混合物I与II基本上系根据例1中所描述的成分而制定。信号检测传感器中设计有双检测样品仓,每个检测样品仓内设计有一个光电二极管传感器,这样,反应试管中进行的两种反应可同时在检测传感器中进行,而所得出的信号也均可得到同时测量。
将稀释后的样品加入到试剂混合物I和II中以开始反应。将所得溶液在室温下培养约15分钟,然后对两种反应所得出的信号进行测量。R因子值的计算需采用Excel软件,其结果总结可详见表3。与IC50值的情况相同,R因子值也可分为两组,即高值组与低值组。正如此前的预期,R因子高值组中仅包括08/09H1N1病毒,而低值组则包括07/08H1N1病毒、08/09H3N2病毒和乙型流感病毒。
表3使用双反应法对病毒的奥司他韦羟酸盐耐药性进行测定
如果将R因子值截断值设为2.40,则全部08/09H1N1病毒分离株对OC具有耐药性,而全部的07/08H1N1、08/09H3N2以及乙型流感病毒分离株均对OC具有敏感性。在将IC50截断值设定为50nM时,采用本发明所描述的双反应法得出的检测结果与IC50值结果完全一致(表4)。因此,本发明所描述的双反应法可用于对流感病毒的OC耐药性进行测定。
表4:采用Qflu组合测试法测定奥司他韦的敏感性
如果以R因子值对IC50值作图,则可得出截然不同的关于两组流感病毒分离株的相关值曲线图:高IC50值与高R因子值组以及低IC50值与低R因子值组(图2)。上述结果表明,双反应法所得出的检测结果以及带有两个检测试管腔的检测传感器可用于进行流感病毒耐药性检测。
据了解,除了可对例1-3中所示的流感病毒神经氨酸酶进行检测之外,所属领域的技术人员可以对双反应法进行修改以用于检测任何酶对其抑制剂的耐药性。
实施例4:HIV蛋白酶对其抑制剂的耐药性检测
蛋白酶是对蛋白质具有裂解或溶解作用的酶。蛋白酶往往只能识别特定的氨基酸序列。HIV-1蛋白酶能够裂解酪氨酸-脯氨酸肽键。因此,HIV-1蛋白酶底物可能是含有酪氨酸-脯氨酸裂解位点的一种肽。合格的底物应是含有荧光素-谷氨酸-丝氨酸-甘氨酸-天冬酰胺-酪氨酸-脯氨酸-异亮氨酸-缬氨酸-谷氨酰胺-赖氨酸氨基酸序列(其中,荧光素是指荧光基团)的一种肽。底物被HIV-1蛋白酶裂解之后生成两种体积较小的肽,即荧光素-谷氨酸-丝氨酸-谷氨酰胺-天冬酰胺-酪氨酸和脯氨酸-异亮氨酸-缬氨酸-谷氨酰胺-赖氨酸,这两种肽可通过HPLC进行分离和检测。
用于进行HIV蛋白酶检测的2倍试剂混合物I溶液的制备方法如下:8微摩/L底物、0.6M醋酸钠、6.0M氯化钠、4.0nM乙二胺四乙酸(EDTA)、8.0mM二硫苏糖醇(DTT)、30%的二甲基亚砜(DMSO)、8mg/ml牛血清白蛋白(BSA),溶液的pH值为5.2倍试剂混合物II与试剂混合物I的制备方法大致相同,但后者中加入了HIV蛋白酶抑制剂(例如,100nM的奈非那韦)。反应的操作方法如下:在适当的样品缓冲液中将0.1ml的2倍试剂混合物与等量的样品相混合(例如,16mM pH值为6的醋酸盐、0.7%的BSA以及0.9%的曲拉通X-100)。在37℃环境中培养15分钟后,加入0.1ml浓度为10mM的氢氧化钠溶液以终止反应。然后,用C18色谱柱和荧光检测仪对所得的反应溶液进行HPLC分析。检测应得出2个荧光峰值,分别是反应产物以及未裂解底物(疏水性较低)的色谱峰。计算出两种反应溶液的产物峰面积(信号强度),然后用所得结果测定样品中HIV蛋白酶对抑制剂的耐药性。
对照试验应同时进行。例如,一份阳性对照品中应含有对抑制剂具有耐药性的HIV蛋白酶,而另一份对照品中则应含有HIV蛋白酶抑制剂以确定敏感性和耐药性HIV蛋白酶的信号比边界。可通过测试大量已知抑制剂耐药程度的样品的方式确定出信号比的截断值。
实施例5:流感病毒神经氨酸酶的奥司他韦羟酸盐和扎那米韦耐药性同步检测
本例旨在说明如何就神经氨酸酶对奥司他韦羟酸盐和扎那米韦的耐药性进行同步检测。该检测试剂包括试剂混合物I(不含抑制剂)、试剂混合物IIa(含50nM奥司他韦羟酸盐抑制剂)以及试剂混合物IIb(含50nM扎那米韦)。
可按照例1中所述方法制备试剂混合物I与II。试剂混合物IIb的成分构成与试剂混合物IIa相似,其不同之处在于前者中加入的是50nM的扎那米韦而不是50nM的奥司他韦羟酸盐。将样品与适当的溶液与样品缓冲液加入到试剂混合物I、IIa和IIb中以开始化学反应,从而对样品进行测试。分别测定反应I、IIa和IIb的反应信号。分别计算出扎那米韦和奥司他韦每份样品的信号比;信号比可采用例1所述的R因子值予以表达。扎那米韦与奥司他韦羟酸盐的R因子截断值可用与IC50的数据对比结果为依据。
实施例6:β-内酰胺酶活性检测
含有独特的β-内酰胺环的抗生素是细菌感染治疗药物的主要成分,其中包括青霉素和头孢菌素类抗生素。然而,由于许多种细菌已经具备了生成β-内酰胺酶的能力,而这种酶可以降解β-内酰胺类抗生素,因此这些细菌对β-内酰胺类抗生素具有耐药性。在本例中,仅适用1份试剂混合物对样品中的β-内酰胺酶活性进行检测。样品中存在β-内酰胺活性则表明该菌种已经对β-内酰胺类抗生素产生了耐药性。
将试剂混合物制备成2倍的浓溶液。2倍浓溶液混合物中含50mM HEPES(pH值7.0-7.2)、0.6mM ZnCl2、16mM ATP(三磷酸腺苷)、22mM DTT、0.8mM辅酶A、14mg/ml荧光素酶、0.4mM头孢菌素-O-荧光素、0.8mg/mL BSA、18mM CaCl2、14mM MgCl2以及6%的曲拉通X-100。采用头孢菌素-O-荧光素作为β内酰胺酶底物。该底物的合成与净化均以公开发表的科学文献中的规程为准(《德国应用化学》;2007年第46卷;第7031-7034页),但本文引用该文献仅旨在作为参考之用。
用47.5ml的去离子水对50ml的2倍浓缩试剂混合物进行稀释以开始检测流程。将2.5ml的大肠杆菌裂解物(经诱导以表达重组β内酰胺酶(HSV-2))加入到反应溶液中以开始反应。反应开始后2分钟内,可观测到反应的信噪比超过了10(图3)。该信噪比在反应大约进行10分钟之时达到峰值。10分钟后,信号强度有所降低,从而表明反应底物可能已经消耗殆尽。然而,在整个30分钟的反应期间内,信噪比始终大大高于1.0。(图3)。
实施例7:β内酰胺酶抑制剂与抗菌素耐药性检测
在本例中,根据本发明而设计的检测法能够就β内酰胺酶对β内酰胺抑制剂(克拉维酸)和亚胺培南(碳青霉烯类)的耐药性进行同步检测。本例中共检测了5种β内酰胺酶。这5种β内酰胺酶分别为为新德里金属β-内酰胺酶(NDM-2)、p99、SHV-2,KPC-2和TEM-2。上述β内酰胺酶的特性总结可详见表5。
表5:例7*所述研究中所采用的β内酰胺酶的特性
*节选自Bush与Jacob合著的《β内酰胺酶类抗生素最新功能分类》抗菌素与化学疗法54:969-976;2010年
对5种β内酰胺酶的基因编码进行合成之后将其克隆到大肠杆菌的表达载体中。然后,将含有β内酰胺酶基因编码的表达载体转化的大肠杆菌细胞进行诱导以表达β内酰胺酶。再将所得细胞制成团块并将其悬浮于样品缓冲液中(Fisher Scientific,分类编号:90084),然后超声溶解细胞。
制备出2倍的浓缩试剂混合物。不含β内酰胺酶抑制剂或抗生素的2倍试剂混合物(试剂混合物I)的制备以例6中所描述的成分构成为参考标准。含有β内酰胺酶抑制剂或亚胺培南的2倍浓缩试剂混合物(试剂混合物IIb)的制备方法为:向试剂混合物I中加入64mg/ml的克拉维酸(试剂混合物IIa)或64mg/ml的亚胺培南(试剂混合物IIb)。
将50ml的2倍试剂混合物加入到45ml的去离子水中以进行稀释,然后再向溶液中加入5ml的细胞裂解物。研究表明,不存在β内酰胺酶表达的大肠杆菌细胞裂解物所产生的信号与没有细胞裂解物参与的反应所产生的信号基本相同,因此,我们采用没有细胞裂解物参与的反应作为阴性对照品。将溶液在室温下培养15分钟之后用光度计对光信号进行测量。通过试剂混合物I的信号对样品内是否存在β内酰胺酶进行检测,具体方法是对反应所产生的信号与阴性对照品的反应信号进行对比;同时,通过信号比对β内酰胺酶的克拉维酸或亚胺培南耐药性进行测定。
在本例中,信号比通过R因子的形式予以表示,其计算方法如下:
R因子=10X(试剂混合物II的信号强度÷试剂混合物I的信号强度)
R因子值越高,则表示对试剂混合物II中的β内酰胺酶抑制剂或抗生素的耐药性越高。如表6所示,每种β内酰胺酶的测试结果与预期的耐药性状况均相一致。例如,克拉维酸的SHV-2与TEM-2酶R因子值分别为0.23和1.18,从而表明这两种β内酰胺酶均对克拉维酸具有敏感性。以β内酰胺抗生素和克拉维酸(如奥格门汀)构成成分的抗生素联合疗法甚至能够有效治疗由已经表达SHV-2和/或TEM-2类β内酰胺酶的菌种所引起的感染。
表6:例7中所描述实验的检测结果
相反地,对于由表达p99、KPC-2和/或NDM-2(对克拉维酸的R因子值较高)的菌种所导致的感染,奥格门汀无法实现有效治疗。同时,TEM-2、KPC-2与NDM-2对亚胺培南(一种碳青霉烯类抗生素)表现出较强的耐药性,而SHV-2和p99则对亚胺培南分别表现出轻度耐药性和无耐药性。这一信息在指导抗生素处方方面有着非常高的价值。
实施例8:产生碳青霉烯酶微生物检测
自19世纪40年代被发现和首次临床应用以来,β内酰胺类抗生素挽救了不计其数的生命。然而,随着这类抗菌素的广泛应用,导致了同样大量的耐药性菌种的产生,究其原因是β内酰胺酶的出现。β内酰胺类抗生素中一个大类就是碳青霉烯类,这类抗生素曾经被作为“最后一招”的抗生素来使用,因为它可以抵抗普通β内酰胺酶破坏作用。然而,可以水解碳青霉烯类抗生素的β内酰胺酶通常单独被称为碳青霉烯酶已经出现。携带有碳青霉烯酶(简称CPO)的细菌种类在近年来大幅地增加,在世界某些地区比如美国东海岸,带有CPO的细菌感染被认为是地方性特有的疾病。这就给人们一个警示,带有CPO的细菌的感染将带来高发病率和高死亡率。因此,人们期待能够设计开发出用来诊断和监测这种带有CPO的细菌的新型快速诊断方法和装置。
由于碳青霉烯类抗生素能够抑制除了碳青霉烯酶以外的所有β内酰胺酶,因此,根据本发明,一个能够检测CPO的方法和装置由此被设计开发。这个CPO检测方法包括两个试剂,如同实施例7中描述的设计方案。试剂混合物I包含一个主要的试剂混合结构,这个结构能够检测到β内酰胺酶的活性,而试剂混合物II中却是一个包含着碳青霉烯抗生素的主要的试剂混合结构。试剂混合物I的信号值用来确认在某个样品中是否存在β内酰胺酶的活性,而两个试剂混合物信号值的比值,比如在实施例7中描述的R型因子值,则能够确定这个β内酰胺酶是否是碳青霉烯酶。如果一个样品检测值超过了试剂混合物I的信号截断值和一个较高的R型因子值,那么这个样品就被确认为含有碳青霉烯酶,因此,随之能够确定这个样品中必然含有带有碳青霉烯酶的细菌。
可以采用临床及实验室标准学会(CLSI)推荐的方法(M100-S22)作为“金标准”,通过对含有固定比例的碳青霉烯酶和非碳青霉烯酶的β内酰胺酶混合的样品进行检测,由此来确定这个R型因子的截断值。
实施例9:使用培养皿中一个单一的细菌菌落检测β内酰胺酶耐药性
目前临床上采用的检测抗生素耐药性的方法通常包含两个序贯性的需要过夜的菌培养。
第一个菌培养用以确认在病人体内存在某种感染。当第一个菌培养在一个琼脂平皿中实现时,被培养细菌种类在琼脂平皿中以单一的菌落方式生长。在另一个琼脂平皿上放置含有抗生素的药敏片,然后将前述的单一的菌落取出并悬混在一种特别的溶液中,再将该特殊的溶液种植到放置抗生素药敏片的琼脂平皿中,以此来确认抗生素是否对相关细菌是否敏感。或者,当一个临床样品被放置在一个液体培养基中进行培养,比如血平皿,如果在第一个菌培养皿上表现为阳性结果,那么这个培养皿上培养出来的菌种也能够被第二个菌培养皿用来进行抗生素敏感性检测。这些检测方法因为需要耗费太长的时间去完成以至于严重地滞后了治疗方案的实施。
本发明所公开的检测方法能够用以确定一个细菌菌落是否产生β内酰胺酶,如果是,那么可以进一步确定这个β内酰胺酶是否是对β内酰胺酶抑制剂产生耐药性,比如克拉维酸和舒巴坦。克拉维酸被用于某些特定的抗生素的组合中,比如阿莫西林就是同时包括了克拉维酸和羟氨苄青霉素两种组分。正如实施例7中的描述,检测装置中包含两种试剂,试剂混合物I和试剂混合物II,试剂混合物I包含1粒不含有克拉维酸的主反应混合试剂球,试剂混合物II则包含1粒主反应混合试剂球和1粒克拉维酸试剂球。在这个实施例中,试剂混合物等同于检测试管内的0.25mL的试剂混合物冻干粉。
来自病人的样品被种植在一个琼脂平皿上经过过夜的温育后,将单一的菌落悬混在2.5mL如实例7中描述的样品缓冲液中,然后将0.25mL这样的样品缓冲液分别加入试剂混合物I和试剂混合物II的检测试管内。在室温下温育15分钟后,将试剂检测试管放入光度仪中进行信号检测。
如表7所示,在检测的23个病人的样品中,13例(占56.5%)清楚地表明β内酰胺酶(BL)活性的信噪比(S/CO)都大于1.0,这个高发率也反映了在这个地区β内酰胺类抗生素被广泛使用。在这13例β内酰胺酶阳性的样本中,8例(占61.5%)显示R型因子值低,这个低值表明在这8例样本中β内酰胺酶对其抑制剂克拉维酸是敏感的。而在另外5例β内酰胺酶阳性的样本中,其较高的R型因子值则表明在这些样本中的β内酰胺酶对其抑制剂克拉维酸却是耐药的。这一结果表明这个检查装置是灵敏性高而且能够被用于通过对单一的菌培养产生的菌落进行细菌β内酰胺酶耐药性的检测。
该实验结果能够被用来对临床抗生素处方的最终选择提供依据:对于
那些没有β内酰胺酶活性的细菌感染,治疗方案可以选择那些较早期的β内酰胺类的抗生素,比如羟氨苄青霉素,这类抗生素对这类感染将是有效的。对于另一类病人虽然感染了携带有β内酰胺酶的细菌,这类细菌的β内酰胺酶对克拉维酸却是敏感的,所以,其治疗方案能够采用复合性抗生素,即抗生素加克拉维酸,比如阿莫西林对这类感染治疗是有效的。而还有一类病人,不仅感染了携带有β内酰胺酶的细菌,而且这类细菌的β内酰胺酶对克拉维酸是耐药的,采用更新颖的抗生素,比如碳青霉烯抗生素或者非β内酰胺类的抗生素应该是有效的选择。
表7:使用单一的菌落进行克拉维酸(CA)耐药的检测
*BL(β内酰胺酶)阳性截断值(RLU):375
**CA(克拉维酸)耐药性R型因子的截断值:2.50
***N/A:由于试剂混合物I检测并没有发现样本中有β内酰胺酶的存在,因此R型因子值没有采用。
实施例10:使用液体培养基检测β内酰胺酶耐药性
在这个实施例中,一个液体培养基被用来检测β内酰胺酶的活性以及β内酰胺酶耐药性的检测。尽管含有来自临床样本有不止一种细菌被种植在液体培养基中,但是在特定的液体培养基中,比如血培养皿中,进行β内酰胺酶是否存在的检测和β内酰胺酶对其抑制剂是否耐药的检测仍然是十分有价值的。一个阳性液体细菌培养基用样本缓冲液按一定的比例进行稀释,然后进行试验性检测。稀释度可以采用下列举例但并不局限于此,1∶1,1∶2,1∶5和1∶10。上述提到的样本缓冲液等同于在实施例中描述的样本缓冲液,但实际使用时其应用浓度应该根据实际情况而定。例如,一个2倍浓缩的样本缓冲液应该被使用于准备1∶1样本稀释度。这样制备的样本溶液能够被用于β内酰胺酶活性检测和β内酰胺酶对其抑制剂是否耐药的检测,正如在实施例9中的描述。
据了解,相关领域技术人员能够识别根据本发明的具体应用形式与范例所得出的多种等效应用形式,并且也能够自行推演出应用形式。例如,两种试剂混合物中均含有浓度不同的同一种酶抑制剂,但前提是两种混合物中该抑制剂的浓度必须有所不同,从而使检测人员可以通过信号比对抑制剂耐药性与敏感性酶加以区分。其他范例包括由4种或4种以上反应所构成的检测法,其中一种检测法中不含任何酶抑制剂,而其他各种试剂混合物均含有独特的酶抑制剂。
在对前文中在本文所引用参考文献的基础上而做出的描述进行仔细思考之后,相关领域的技术人员能够确定出本发明的基本特色,并且能够在不背离本发明的精神与范围的基础上对其进行各种改动和修改以适应不同的应用目的和条件。
本专利中所提及之任何出版物、专利、专利应用以及其他引文均仅以参考为引述目的。
- 还没有人留言评论。精彩留言会获得点赞!