多特异性抗体的制作方法
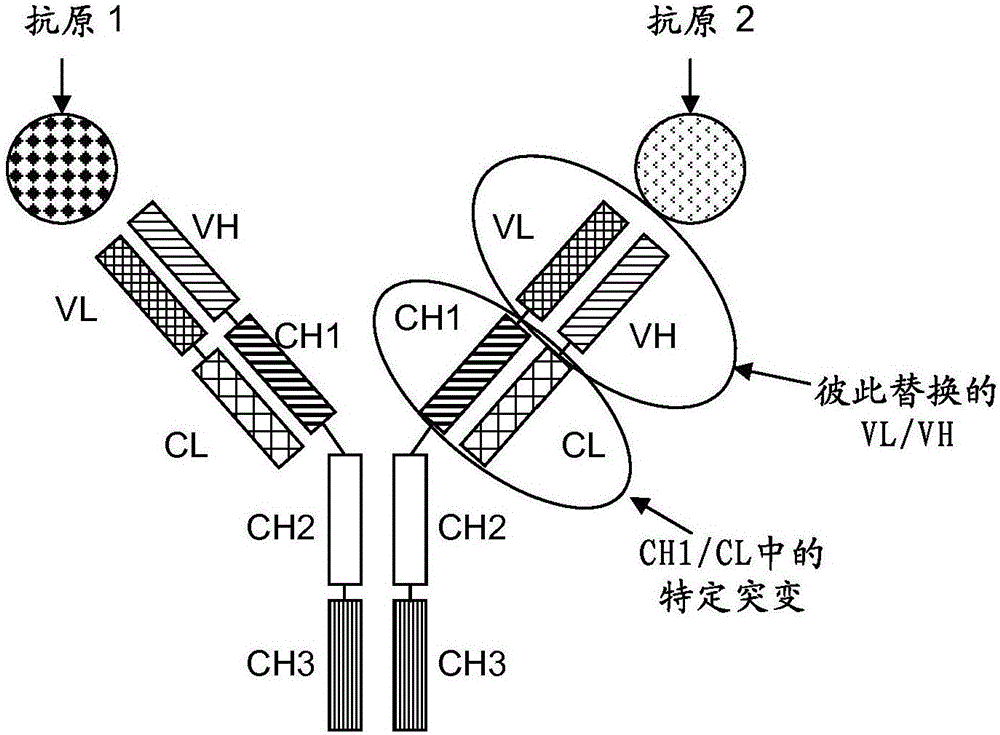
发明背景工程蛋白质,例如能够结合两种或更多种抗原的双或多特异性抗体是本领域中已知的。可以使用细胞融合、化学缀合或重组DNA技术来产生这样的多特异性结合蛋白。不久前通过使例如IgG抗体形式和单链结构域融合,已经发展了多种重组的多特异性抗体形式,例如四价的双特异性抗体(参见例如Coloma,M.J.等人,NatureBiotech.15(1997)159-163;WO2001/077342;和Morrison,S.L.,NatureBiotech.25(2007)1233-1234)。也已经发展了几种其它新的形式,其中所述的抗体核心结构(IgA、IgD、IgE、IgG或IgM)不再被保留,例如能够结合两种或更多种抗原的双、三或四抗体、小抗体、几种单链形式(scFv、Bis-scFv)(Holliger,P.等人,NatureBiotech.23(2005)1126-1136;Fischer,N.和Léger,O.,Pathobiology74(2007)3-14;Shen,J.等人,J.Immunol.Methods318(2007)65-74;Wu,C.等人,NatureBiotech.25(2007)1290-1297)。所有这样的形式利用接头要么使所述的抗体核心(IgA、IgD、IgE、IgG或IgM)与另外的结合蛋白(例如scFv)融合,要么使例如两个Fab片段或scFv融合(Fischer,N.和Léger,O.,Pathobiology74(2007)3-14)。虽然很明显接头用于所述的双特异性抗体的工程化具有优点,但是它们也可能在治疗设置中引起问题。实际上,这些外源肽可以引发抗所述的接头本身或所述的蛋白质和所述的接头之间的接合点的免疫应答。此外,这些肽的柔性使得它们更易于蛋白酶剪切,潜在地导致差的抗体稳定性、聚集和增大的免疫原性。另外,一个人可能想要保留效应子功能,例如补体依赖性细胞毒性(CDC)或抗体依赖性细胞毒性(ADCC),它们是通过保持与天然存在的抗体高度的相似性通过所述的Fc部分介导的。因此,理想地,应该瞄准发展具有最小的与人序列的偏差的、在一般结构方面与天然存在的抗体(像IgA、IgD、IgE、IgG或IgM)非常相似的双特异性抗体。在一种方法中,已经使用四体杂交瘤技术(参见Milstein,C.和Cuello,A.C.,Nature305(1983)537-540)产生了与天然抗体非常相似的双特异性抗体,所述的四体杂交瘤技术基于表达具有所要的所述的双特异性抗体的特异性的鼠单克隆抗体的两种不同的杂交瘤细胞系的体细胞融合。由于在所得的杂交-杂交瘤(或四体杂交瘤)细胞系之内两种不同抗体的重和轻链的随机配对,产生了至多十种不同的抗体种,其中只有一种是所想要的功能性双特异性抗体。由于错误配对的副产物的存在以及显著地减少的生产收率,需要复杂的纯化工序(参见例如Morrison,S.L.,NatureBiotech.25(2007)1233-1234)。一般而言,如果利用重组表达技术,仍然存在错误配对的副产物的相同问题。一种规避所述的错误配对的副产物问题的方法,它被称为‘旋钮入孔’(knobs-into-holes),目的在于通过在CH3结构域中引入突变以改进所述的接触界面,强迫两种不同抗体的重链配对。在一条链上,把体积大的氨基酸替换为具有短的侧链的氨基酸而产生一个‘孔’。相反地,把具有大的侧链的氨基酸引入其它CH3结构域中以产生一个‘旋钮’。通过共表达这两种重链(以及必须适合于这两种重链的两条相同的轻链),观察到高收率的异二聚体形成(‘旋钮-孔’)对同型二聚体形成(‘孔-孔’或‘旋钮-旋钮’)(Ridgway,J.B.等人,ProteinEng.9(1996)617-621;和WO96/027011)。通过使用噬菌体展示法重塑所述的两种CH3结构域的相互作用表面以及引入二硫桥来使所述的异二聚体稳定,可以进一步增加异二聚体的百分比(Merchant,A.M.等人,NatureBiotech.16(1998)677-681;Atwell,S.等人,J.Mol.Biol.270(1997)26–35)。在例如在EP1870459A1中描述了用于所述的旋钮入孔技术的新的方法。尽管这种形式似乎很有吸引力,但是目前没有可利用的描述关于所述的临床进展的数据。对这种策略的一个重要的限制是所述的两种亲本抗体的轻链必须是相同的以防止错配和非活性分子的形成。因此,这种技术不适合作为从抗所述的第一和所述的第二抗原的两种抗体出发,容易地发展重组的抗三个或四个抗原的三或四特异性抗体的基础,因为要么首先必须要优化这些抗体的重链和/要么必须要优化所述的相同的轻链,然后必须添加另外的抗所述的第三和第四抗原的抗原结合肽。WO2006/093794涉及异二聚体蛋白质结合组合物。WO99/37791描述了多用途抗体衍生物。Morrison,S.L.等人,J.Immunol.160(1998)2802-2808涉及可变区结构域交换对IgG的功能性质的影响。WO2013/02362涉及异二聚化多肽。WO2013/12733涉及包含异二聚体Fc区的多肽。WO2012/131555涉及工程的异二聚体免疫球蛋白。EP2647707涉及工程的异二聚体免疫球蛋白。WO2013/026835涉及具有结构域交换的双特异性的不含Fc的抗体。WO2009/080251、WO2009/080252、WO2009/080253、WO2009/080254和Schaefer,W.等人,PNAS,108(2011)11187-1191涉及具有结构域交换的二价的双特异性IgG抗体。在WO2009/080252中描述(也参见Schaefer,W.等人,PNAS,108(2011)11187-1191)的以一种结合方式来防止轻链错配(CrossMabVH-VL)的具有VH/VL替换/交换的多特异性抗体清楚地减少了由抗第一抗原的轻链与抗所述的第二抗原的错误的重链的错配所引起的副产物(与没有这样的结构域交换的方法相比)。然而,它们的制剂不完全不含副产物。所述的主要副产物基于本斯·琼斯型相互作用-也参见Schaefer,W.等人,PNAS,108(2011)11187-1191;在附录的图S1I中)。因此,仍然存在着对进一步减少这样的副产品、改善例如这样的双特异性抗体的收率的需要。发明概述本发明涉及多特异性抗体,其包含:a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,并且其中在所述的第二抗体的第二轻链和第二重链中的可变域VL和VH被彼此替换;并且其中i)在a)中所述的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)取代(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R)取代),并且其中在a)中所述的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)取代(根据KabatEU索引编号);或ii)在b)中所述的第二轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)取代(根据Kabat编号)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R)取代),并且其中在b)所述的第二重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。本发明的进一步实施方式是用于制备根据本发明的多特异性抗体的方法,其包括下列步骤:A)采用包含核酸分子的载体转化宿主细胞,该核酸分子编码:a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,其中在所述的第二抗体的第二轻链和第二重链中可变域VL和VH被彼此替换;并且其中i)在根据a)所述的第一重链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据a)所述的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代;或ii)在根据b)所述的第二轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据b)所述的第二重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代;B)在允许合成所述抗体分子的条件下培养所述的宿主细胞;和C)从所述培养物中回收所述抗体分子。本发明的另外的实施方式是编码根据本发明的多特异性抗体的氨基酸序列的核酸。本发明的另外的实施方式是包含根据本发明所述的核酸的表达载体,其能够在宿主细胞中表达所述核酸。本发明的另外的实施方式是包含根据本发明的载体的宿主细胞。本发明的另外的实施方式是根据本发明所述的抗体的组合物,例如药物或诊断组合物。本发明的另外的实施方式是包含根据本发明的抗体和至少一种药学上可接受的赋形剂的药物组合物。本发明的另外的实施方式是用于治疗需要治疗的患者的方法,其特征在于向所述的患者施用治疗有效量的根据本发明的抗体。根据本发明,通过在CH1和CL结构域中在特定的氨基酸位置引入用相反电荷替换带电荷的氨基酸,可以改善所要的多特异性抗体相比于不受欢迎的本斯·琼斯型主要副产物的比率。附图说明图1根据本发明的多特异性抗体的一些实例,在一个抗体结合臂中具有VH/VL结构域替换并且在一个CH1/CL结构域界面中具有特定的突变:至少处于CL结构域的第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)取代,和至少处于CH1结构域的第147位的氨基酸或处于CH1结构域的第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。图1A:在一个抗体结合臂中的VH/VL结构域替换和在另一抗体结合臂的CH1/CL结构域界面中的特定的突变。图1B:在一个抗体结合臂中的VH/VL结构域替换和在同一抗体结合臂的CH1/CL结构域界面中的特定的突变。图1C:在一个抗体结合臂中的VH/VL结构域替换和在另一抗体结合臂的CH1/CL结构域界面中的特定突变以及用于加强重链异二聚化的对CH3/CH3结构域界面的修饰(如例如旋钮入孔技术或备选的异二聚化技术如例如带电荷的氨基酸被它们相应的相反电荷替换)。图2A在一个抗体结合臂中具有VH/VL结构域替换并且在一个CH1/CL结构域界面(左侧)中没有突变的多特异性抗体的实例以及这种多特异性抗体的主要副产物(由于VL-VL本斯·琼斯型结构域相互作用)-直接地通过质谱没有检测到,在纤溶酶或LysC消化以后,通过质谱通过分析其Fab片段,也没有检测到其它可能的作为潜在的副产物的变体。图2B在一个抗体结合臂中具有VH/VL结构域替换并且在一个CH1/CL结构域界面中没有突变的多特异性抗体的主要副产物的来源(由于VL-VL本斯·琼斯型结构域相互作用)。图3图3A:CH1结构域(显示了两种IgG同种型)中的野生型(wt)氨基酸序列,第147位和第213位(根据KabatEU索引编号)氨基酸加下划线并突出显示。图3B:κ同种型的CL结构域中的野生型(wt)氨基酸序列,第124位和第123位(根据Kabat编号)氨基酸加下划线并突出显示。图3C:λ同种型的CL结构域中的野生型(wt)氨基酸序列,第124位和第123位氨基酸加下划线并突出显示(根据Kabat编号)。图4图4A:通过在CH1/CL界面中根据本发明的单一带电荷的氨基酸取代减少了主要的本斯·琼斯型副产物。根据本发明的具有VH/VL结构域交换/替换(CrossMAbVh-VL)的抗Ang2-VEGF多特异性抗体的实例。野生型(wt)和单一的带电荷的氨基酸取代的不同组合的比较1)在CH1/CL界面中没有特定的氨基酸取代的野生型(wt)抗Ang2-VEGFCrossMAbVh-VL多特异性抗体,2)根据本发明的抗Ang2-VEGF多特异性抗体:i)在CL结构域的第124位以及在CH1结构域的第147位(根据KabatEU索引编号)具有取代,或ii)在CL结构域的第124位以及在CH1结构域的第213位(根据KabatEU索引编号)具有取代,3)在不同的位置具有取代的其它抗Ang2-VEGFCrossMAbVh-VL多特异性抗体图4B:在图4A中显示了其结果的多特异性抗体的序列(SEQIDNO)。图5图5A:通过在CH1/CL界面中不同的带电荷的氨基酸取代减少主要的本斯·琼斯型副产物。根据本发明的具有VH/VL结构域交换/替换(CrossMAbVh-VL)的抗Ang2-VEGF多特异性抗体的实例。野生型(wt)和带电荷的氨基酸取代的不同组合的比较。图5B:在图5A中显示了其结果的多特异性抗体的序列(SEQIDNO)。图6图6A:通过在CH1/CL界面中不同的带电荷的氨基酸取代减少主要的本斯·琼斯型副产物。根据本发明的具有VH/VL结构域交换/替换(CrossMAbVh-VL)的抗IL-17/TWEAK多特异性抗体的实例。野生型(wt)和带电荷的氨基酸取代的不同组合的比较。图6B:在图6A中显示了其结果的多特异性抗体的序列(SEQIDNO)。图7根据本发明的二价多特异性抗体的一些实例,在一个抗体结合臂中具有VH/VL结构域替换并且在一个CH1/CL结构域界面中具有特定的突变,其中所述的多特异性抗体缺乏Fc片段(Fab-CrossFabVH-VL形式和CrossFabVH-VL-Fab):至少处于CL结构域的第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)取代,和至少处于CH1结构域的第147位的氨基酸或处于所述的CH1结构域的第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。图7A:在一个抗体结合臂中的VH/VL结构域替换和在另一个抗体结合臂的CH1/CL结构域界面中的特定突变。图7B:在一个抗体结合臂中的VH/VL结构域替换和在同一个抗体结合臂的CH1/CL结构域界面中的特定突变。图7C:在一个抗体结合臂中的VH/VL结构域替换,在同一个抗体结合臂的CH1/CL结构域界面具有特定突变;以及在另一抗体结合臂的CH1/CL结构域界面中的另外的特定突变。图7D:在一个抗体结合臂中的VH/VL结构域替换和在另一个抗体结合臂的CH1/CL结构域界面中的特定突变。图8根据本发明的三价的多特异性抗体的一些实例,在一个抗体结合臂中具有VH/VL结构域替换并且在一个CH1/CL结构域界面中具有特定突的,其中所述的多特异性抗体缺乏Fc片段(Fab-Fab-CrossFabVH-VL形式):至少处于所述的CL结构域的第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)取代(根据Kabat编号),和至少处于所述的CH1结构域的第147位的氨基酸或处于所述的CH1结构域的第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)取代(根据KabatEU索引编号)。图8A、B、C:在一个抗体结合臂中的VH/VL结构域替换和在另一个抗体结合臂的CH1/CL结构域界面中的特定突变。图8D:在一个抗体结合臂中的VH/VL结构域替换和在同一个抗体结合臂的CH1/CL结构域界面中的特定突变。图8E:在一个抗体结合臂中的VH/VL结构域替换与在同一个抗体结合臂的所述的CH1/CL结构域界面中的特定突变;以及在另一抗体结合臂的CH1/CL结构域界面中的另外的特定突变。图9根据本发明的四价多特异性抗体的一些实例,在一个抗体结合臂中具有VH/VL结构域替换并且在一个CH1/CL结构域界面中具有特定突变,其中所述的多特异性抗体缺乏Fc片段(Fab-Fab-CrossFabVH-VL形式):至少处于所述的CL结构域的第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)取代,和至少处于所述的CH1结构域的第147位的氨基酸或处于所述的CH1结构域的第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。图9A:在一个抗体结合臂中的VH/VL结构域替换和在另一个抗体结合臂的CH1/CL结构域界面中的特定突变。图9B:在一个抗体结合臂中的VH/VL结构域替换和在同一个抗体结合臂的CH1/CL结构域界面中的特定突变。发明详述在WO2009/080252和Schaefer,W.等人,PNAS,108(2011)11187-1191)(将其并入本文中作为参考)中描述了在一个结合臂(CrossFabVH–VL)中具有结构域替换/交换的多特异性抗体。它们清楚地减少了由抗第一抗原的轻链与抗第二抗原的错误重链的错配所引起的副产物(与没有这样的结构域交换的方法相比)。然而,它们的制剂不完全不含副产物。主要副产物基于本斯·琼斯型相互作用-也参见Schaefer,W.等人,PNAS,108(2011)11187-1191;在所述的附录的图S1I中)。因此,我们现在已经发现了通过在CH1和CL结构域中特定的氨基酸位置引入具有相反电荷的带电荷氨基酸取代,用于进一步减少这样的副产物以改善这样的多特异性抗体(即多特异性抗体,其仅仅在具有一种抗原特异性的结合臂中包含VH/VL结构域替换/交换,而另一种抗原特异性的结合臂不包含VH/VL结构域替换/交换,而是具有野生型抗体结构域排列,如图1中指示)的产率的方法。因此,本发明涉及多特异性抗体,其包含:a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,并且其中在所述的第二抗体的第二轻链和第二重链中可变域VL和VH被彼此替换;和其中i)在根据a)的第一轻链的恒定域CL中处于第124位的氨基酸(根据Kabat编号)被带正电荷的氨基酸取代,并且其中根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸(根据KabatEU索引编号)被带负电荷的氨基酸取代;或ii)在根据b)的第二轻链的所述的恒定域CL中,处于第124位的氨基酸(根据Kabat编号)被带正电荷的氨基酸取代,并且其中根据b)的第二重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸(根据KabatEU索引编号)被带负电荷的氨基酸取代。根据本发明所述的概念,根据本发明的抗体仅仅包含根据上面和下面i)和ii)所指示的修饰中的一种。因此,根据本发明所述的多特异性抗体包含下列中的任何一个:i)在根据a)所述的第一轻链的恒定域CL中,处于第124位的氨基酸(根据Kabat编号)被带正电荷的氨基酸取代,并且在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸(根据KabatEU索引编号)被带负电荷的氨基酸取代;或ii)在根据b)的第二轻链的恒定域CL中,处于第124位的氨基酸(根据Kabat编号)被带正电荷的氨基酸取代,并且在根据b)的第二重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸(根据KabatEU索引编号)被带负电荷的氨基酸取代,条件是所述的多特异性抗体不包含根据i)和ii)提到的两种修饰。因此,本发明涉及多特异性抗体,其包含:a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,并且其中在所述的第二抗体的第二轻链和第二重链中的可变域VL和VH被彼此替换;和其中i)在根据a)所述的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据a)的第一重链的恒定域CH1中,所述的处于第147位的氨基酸或所述的处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代;或ii)在根据b)所述的第二轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据b)所述的第二重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。本发明进一步涉及多特异性抗体,其包含:a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,并且其中在所述的第二抗体的第二轻链和第二重链中所述的可变域VL和VH被彼此替换;和其中i)在根据a)所述的第一轻链的恒定域CL中,处于第124位的氨基酸(根据Kabat编号)被带正电荷的氨基酸取代,并且其中在根据a)所述的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸(根据KabatEU索引编号)被带负电荷的氨基酸取代。本发明进一步涉及多特异性抗体,其包含:a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,并且其中在所述的第二抗体的第二轻链和第二重链中所述的可变域VL和VH被彼此替换;和其中i)在根据a)所述的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据a)所述的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。因此关于包含在根据本发明的多特异性抗体中的与第二抗原特异性地结合的所述第二抗体,下列适用:-在所述的轻链之内,所述的轻链可变结构域VL被所述抗体的重链可变结构域VH替换;和-在所述的重链之内,所述的重链可变结构域VH被所述抗体的所述的轻链可变结构域VL替换;和-在所述的第二抗体的第二轻链和第二重链中的恒定域CL和CH1没有被彼此替换(保持没有被交换)。因此关于包含在根据本发明的多特异性抗体中的与第一抗原特异性地结合的所述抗体,下列适用:-在来源于所述第一抗体的所述第一轻链之内,所述轻链的结构域的顺序排列(CL-VL)保持不变;和-在来源于所述第一抗体的所述第一重链之内,所述重链的结构域的顺序排列(例如CH1-VH或CH3-CH2-CH1-VH)保持不变(因此与所述的第一抗体特异性地结合的所述抗体不包含结构域交换,特别是没有VH/VL的交换)。换句话说,包含在根据本发明的多特异性抗体中的与第一抗原特异性地结合的所述抗体包含:-来源于所述第一抗体的第一轻链,其包括所述轻链的所述结构域的顺序排列VL-CL(从N端到C端方向);和-来源于所述第一抗体的第一重链,其包括所述重链的结构域的顺序排列CH1-VH(从N端到C端方向)(在一种实施方式中,所述的第一重链包括所述重链的所述结构域的顺序排列CH3-CH2-CH1-VH(从N端到C端方向)。如本文中所用的,“抗体的轻链”是多肽,其沿着N端到C端方向包含抗体轻链可变域(VL)和抗体轻链恒定域(CL),被缩写为VL-CL。如本文中所用的,“抗体的重链”是多肽,其沿着N端到C端方向包含抗体重链可变域(VL)和抗体重链恒定域1(CH1)。在本发明的一种实施方式中,所述的多特异性抗体的重链沿着N端到C端方向包含抗体重链可变域(VH)和抗体重链恒定域1(CH1)并且缺乏重链恒定域CH2和CH3,因此被缩写为VH-CH1。在一种实施方式中,根据本发明的多特异性抗体包含至少两个Fab片段,其中所述的第一Fab片段包含至少一个对于第一抗原有特异性的抗原结合位点;并且所述的第二Fab片段包含至少一个对于第二抗原有特异性的抗原结合位点,其中在所述的第二Fab片段中,在所述的第二轻链和第二重链中的可变域VL和VH被彼此替换;并且其中所述的多特异性抗体缺乏Fc结构域;并且其中i)在所述的第一Fab片段的轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在所述的第一Fab片段的重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代;或ii)在所述的第二Fab片段的轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在所述的第二Fab片段的所述重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。在进一步的实施方式中,根据本发明的多特异性抗体包含至少两个Fab片段,其中所述的第一Fab片段包含至少一个对于第一抗原特异的抗原结合位点;并且所述的第二Fab片段包含至少一个对于第二抗原特异的抗原结合位点,其中在所述的第二Fab片段中,在所述的第二轻链和第二重链中的可变域VL和VH被彼此替换;并且其中所述的多特异性抗体缺乏Fc结构域;并且其中i)在所述的第一Fab片段的轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在所述的第一Fab片段的重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。如本文中所用的,“Fab片段”是指抗体片段,其包括包含轻链(CL)的可变VL结构域和恒定域的轻链片段和重链的可变VH结构域和第一恒定域(CH1)。根据这种实施方式所述的多特异性抗体包含至少两个Fab片段,其中第二Fab片段的所述重和轻链的可变区被交换了。由于所述可变区的所述交换,所述第二Fab片段也被称为“交叉Fab片段”或“xFab片段”或“交换Fab片段”。在所述第二Fab片段中,其中所述的Fab重和轻链的可变区被交换了,所述的交换Fab分子包含由所述的轻链可变区(VL)和所述的重链恒定区(CH1)组成的经修饰的重链和由所述的重链可变区(VH)和所述的轻链恒定区(CL)组成的经修饰的轻链。这种交换Fab分子也被称为CrossFabVH/VL。在本文中使用术语“Fc结构域”来定义包含至少一部分恒定区的免疫球蛋白重链的C端区域。例如在天然抗体中,所述的Fc结构域由两个相同的蛋白质片段组成,该蛋白质片段来源于在IgG、IgA和IgD同种型中所述的抗体的两个重链的第二和第三恒定域;IgM和IgEFc结构域在每个多肽链中包含三个重链恒定域(CH域2–4)。如本文中所用的,“缺乏Fc结构域”意指本发明的双特异性抗体不包含CH2、CH3和CH4结构域;即所述的恒定重链仅仅由一个或更多个CH1结构域组成。在一种实施方式中,经由肽接头把所述的第一和第二Fab片段连接。如本文中所用的,术语“肽接头”表示具有氨基酸序列的肽,优选地它是合成来源的。在一种实施方式中,使用肽接头来使所述的Fab片段中的一种与另一种Fab片段的C-或N-端连接,以便形成根据本发明的多特异性抗体。在一种优选的实施方式中,所述肽接头是具有至少5个氨基酸长度的氨基酸序列的肽,在一种实施方式中具有5至100个氨基酸的长度,在进一步的实施方式中具有10至50个氨基酸的长度。在一种实施方式中,所述肽接头是(GxS)n或(GxS)nGm,其中G=甘氨酸,S=丝氨酸,并且(x=3,n=3、4、5或6,并且m=0、1、2或3)或(x=4,n=2、3、4或5并且m=0、1、2或3),在一种实施方式中,x=4并且n=2或3,在进一步的实施方式中,x=4并且n=2。在一种实施方式中,所述肽接头是(G4S)2。使用所述的肽接头来连接所述的第一Fab片段和所述的第二Fab片段。在一种实施方式中,使所述的第一Fab片段与所述的第二Fab片段的C-或N-端连接。在本发明的另一种优选的实施方案中,抗体的重链沿着N端到C端方向包含抗体重链可变域(VH)、抗体重链恒定域1(CH1)、抗体重链恒定域2(CH2)和抗体重链恒定域3(CH3),被缩写为VH-CH1-CH2-CH3。在所述的多特异性抗体在每个重链中包含结构域VH-CH1-CH2-CH3的情况下,本发明的另外一个方面是通过修饰所述所述多特异性抗体的所述第一和第二CH3域以增加包含这些第一和第二CH3结构域的两种重链的异二聚化,可以进一步改善所要的多特异性抗体相比于不想要的副产物的比率。存在几种用于CH3修饰以加强异二聚化的方法,它们被很好地描述在例如中。典型地,在所有这样的方法中,以互补的方式把所述的第一CH3结构域和所述的第二CH3结构域工程化,使得每个CH3结构域(或包含它的重链)不再能与它本身同二聚化,而是被迫与所述的互补的工程化的其它CH3结构域异二聚化(使得所述的第一和第二CH3结构域异二聚化并且在所述的两个第一或两个第二CH3结构域之间不形成同二聚体)。考虑把这些用于改善重链异二聚化的不同方法作为不同的备选方案,与在根据本发明所述的多特异性抗体中所述的重-轻链修饰(在一个结合臂中的VH和VL交换/替换和在所述的CH1/CL界面中引入带电荷的氨基酸被相反电荷取代)组合,其减少轻链错配和本斯·琼斯型副产物。在本发明的一种实施方式中(在所述的多特异性抗体在重链中包含CH3结构域的情况下),通过下列改变根据本发明所述多特异性抗体的CH3结构域以支持异二聚化:-取代所述的第一重链的CH3结构域的至少一个氨基酸,和-取代所述的第二重链的CH3结构域的至少一个氨基酸,其中所述氨基酸在所述的多特异性抗体的三级结构之内面对所述第一重链的CH3结构域的至少一个氨基酸,其中分别在所述的第一和第二重链的CH3结构域之内的相应氨基酸要么被-取代,使得具有相反的侧链电荷的氨基酸被引入相对重链中,要么被-取代,使得具有大的和小的侧链体积的氨基酸被引入相对重链中,由此通过在一个CH3结构域中具有大的侧链体积的氨基酸产生突起,它能够定位在位于另一CH3结构域之内的腔中,其中所述的腔是由具有小的侧链体积的氨基酸产生的。在本发明的一种优选的实施方式中(在所述的多特异性抗体在重链中包含CH3结构域的情况下),通过所述的“旋钮入孔”技术改变根据本发明所述多特异性抗体的CH3结构域,所述"旋钮入孔"技术以几个实例详细地描述在例如WO96/027011,Ridgway,J.B.等人,ProteinEng.9(1996)617-621;和Merchant,A.M.等人,Nat.Biotechnol.16(1998)677-681;和WO98/050431中。在这种方法中,改变所述的两个CH3结构域的相互作用表面以增大包含这两个CH3结构域的两个重链的异二聚化。(所述的两个重链的)两个CH3结构域中的每一个可以是“旋钮”,同时另一个是“孔”。二硫桥的引入进一步稳定化所述的异二聚体(Merchant,A.M.等人,NatureBiotech.16(1998)677-681;Atwell,S.等人,J.Mol.Biol.270(1997)26-35)并且增大产率。因此,在本发明的一种实施方式中,所述多特异性抗体(在每个重链中包含CH3结构域并且)的进一步特征在于:根据a)所述的抗体的第一重链的第一CH3结构域和根据b)所述的抗体的第二重链的第二CH3结构域各自在界面处相遇,该界面包含在所述的抗体CH3结构域之间的原始界面,其中改变所述界面以促进所述的多特异性抗体的形成,其中所述的改变的特征在于:i)改变一个重链的CH3结构域,使得在所述的多特异性抗体之内,在与另一重链的CH3结构域的原始界面相遇的一个重链的所述CH3结构域的原始界面之内,氨基酸残基被具有较大侧链体积的氨基酸残基替换,从而在所述的一个重链的所述CH3结构域的界面之内产生突起,该突起能够定位在另一重链的所述CH3结构域的所述界面之内的腔中和ii)改变另一重链的所述CH3结构域,使得在所述的多特异性抗体之内,在与所述的一个重链的所述CH3结构域的所述原始界面相遇的另一重链的所述CH3结构域的所述原始界面之内,氨基酸残基被具有较小侧链体积的氨基酸残基替换,从而在另一重链的所述CH3结构域的所述界面之内产生腔,在所述的一个重链的所述CH3结构域的所述界面之内的突起能够定位在该腔之内。在本发明的一种实施方式中,所述具有较大的侧链体积的氨基酸残基选自由精氨酸(R)、苯丙氨酸(F)、酪氨酸(Y)和色氨酸(W)组成的组。在本发明的一种实施方式中,所述具有较小侧链体积的氨基酸残基选自由丙氨酸(A)、丝氨酸(S)、苏氨酸(T)和缬氨酸(V)组成的组。在本发明的一个方面中,通过引入半胱氨酸(C)作为每个CH3结构域的相应位置中的氨基酸,来进一步改变这两个CH3结构域,使得可以在两个CH3结构域之间形成二硫桥。因此,根据本发明的这个方面,进一步改变所述的一个重链的所述CH3结构域,使得在所述的多特异性抗体之内,在与另一重链的CH3结构域的原始界面相遇的一个重链的CH3结构域的原始界面之内,一个氨基酸残基被半胱氨酸(C)残基替换,并且进一步改变另一重链的所述CH3结构域,使得在所述的多特异性抗体之内,在与所述的一个重链的所述CH3结构域的所述原始界面相遇的另一重链的所述CH3结构域的所述原始界面之内,一个氨基酸残基被半胱氨酸(C)残基替换,使得经由所述的引入的半胱氨酸残基可以在两个CH3结构域之间形成二硫桥。在一种优选的实施方式中,所述多特异性抗体在所述的“旋钮链”的一个CH3结构域中包含氨基酸T366W突变并且在所述的“孔链”的另一CH3结构域中包含氨基酸T366S、L368A、Y407V突变。还可以利用在所述的CH3结构域之间的另外的链间二硫桥(Merchant,A.M.等人,NatureBiotech.16(1998)677-681),例如通过把氨基酸Y349C突变引入所述的“孔链”的CH3结构域中;以及把氨基酸E356C突变或氨基酸S354C突变引入所述的“旋钮链”的CH3结构域中。在一种优选的实施方式中,所述多特异性抗体(它在每个重链中包含CH3结构域)在一个CH3结构域中包含氨基酸S354C和T366W突变并且在所述的两个CH3结构域中的另一个中包含氨基酸Y349C、T366S、L368A和Y407V突变(其中在一CH3结构域个中另外的氨基酸S354C突变和在另一CH3结构域中另外的氨基酸Y349C突变形成链间二硫桥)(根据KabatEU索引编号)。考虑用于CH3修饰以加强所述的异二聚化的其它技术作为本发明的备选方案,并且这些方法被描述在例如WO96/27011、WO98/050431、EP1870459、WO2007/110205、WO2007/147901、WO2009/089004、WO2010/129304、WO2011/90754、WO2011/143545、WO2012058768、WO2013157954、和WO2013096291中。在一种实施方式中,备选地利用在EP1870459A1中描述的异二聚化方法。这种方法基于在两个重链之间在所述的CH3/CH3结构域界面中的特定的氨基酸位置引入带电荷的氨基酸被相反电荷取代/带电荷的氨基酸突变为所述的相反电荷。关于所述多特异性抗体的一个优选的实施方案是在所述的多特异性抗体的一个重链的CH3结构域中的氨基酸R409D和K370E突变和在所述的多特异性抗体的另一重链的CH3结构域中的氨基酸D399K和E357K突变(根据KabatEU索引编号)。在另一种实施方式中,所述多特异性抗体在所述的“旋钮链”的CH3结构域中包含氨基酸T366W突变并且在所述的“孔链”的CH3结构域中包含氨基酸T366S、L368A和Y407V突变;并且另外在所述的“旋钮链”的CH3结构域中包含氨基酸R409D和K370E突变并且在所述的“孔链”的CH3结构域中包含氨基酸D399K和E357K突变。在另一种实施方式中,所述多特异性抗体在一个重链的CH3结构域中包含氨基酸S354C和T366W突变并且在另一重链的CH3结构域中包含氨基酸Y349C、T366S、L368A和Y407V突变;或所述多特异性抗体在一个重链的CH3结构域中包含氨基酸Y349C和T366W突变并且在另一重链的CH3结构域中包含氨基酸S354C、T366S、L368A和Y407V突变,以及另外在所述的“旋钮链”的CH3结构域中包含氨基酸R409D和K370E突变和在所述的“孔链”的CH3结构域中包含氨基酸D399K和E357K突变。在一种实施方式中,备选地利用在WO2013/157953中描述的异二聚化方法。在一种实施方式中,一个重链的CH3结构域包含氨基酸T366K突变并且另一重链的CH3结构域包含氨基酸L351D突变。在进一步的实施方式中,所述的一个重链的CH3结构域进一步包含氨基酸L351K突变。在进一步的实施方式中,另一重链的CH3结构域进一步包含选自Y349E、Y349D和L368E的氨基酸突变(在一种实施方式中,包含L368E)。在一种实施方式中,备选地利用在WO2012/058768中描述的异二聚化方法。在一种实施方式中,一个重链的CH3结构域包含氨基酸L351Y和Y407A突变并且另一重链的CH3结构域包含氨基酸T366A和K409F突变。在进一步的实施方式中,另一重链的CH3结构域进一步在第T411、D399、S400、F405、N390或K392位包含氨基酸突变。在一种实施方式中,所述氨基酸突变选自由下列组成的组:a)T411N、T411R、T411Q、T411K、T411D、T411E和T411W,b)D399R、D399W、D399Y和D399K,c)S400E、S400D、S400R和S400K,d)F405I、F405M、F405T、F405S、F405V和F405W,e)N390R、N390K和N390D,f)K392V、K392M、K392R、K392L、K392F和K392E。在进一步的实施方式中,一个重链的CH3结构域包含氨基酸L351Y和Y407A突变并且另一重链的CH3结构域包含氨基酸T366V和K409F突变。在进一步的实施方式中,一个重链的CH3结构域包含氨基酸Y407A突变并且另一重链的CH3结构域包含氨基酸T366A和K409F突变。在进一步的实施方式中,另一重链的CH3结构域进一步包含氨基酸K392E、T411E、D399R和S400R突变。在一种实施方式中,备选地利用在WO2011/143545中描述的异二聚化方法。在一种实施方式中,在所述重链的CH3结构域中在选自由368和409组成的组的位置处,引入根据WO2011/143545所述的氨基酸修饰。在一种实施方式中,备选地利用在WO2011/090762中描述的异二聚化方法,该文献也使用上面描述的旋钮入孔技术。在一种实施方式中,一个重链的CH3结构域包含氨基酸T366W突变并且另一重链的CH3结构域包含氨基酸Y407A突变。在一种实施方式中,一个重链的CH3结构域包含氨基酸T366YK突变并且另一重链的CH3结构域包含氨基酸Y407T突变。在一种实施方式中,所述的多特异性抗体是IgG2同种型的并且备选地利用在WO2010/129304中描述的异二聚化方法。在一种实施方式中,备选地利用在WO2009/089004中描述的异二聚化方法。在一种实施方式中,一个重链的CH3结构域包含K392或N392被带负电荷的氨基酸取代(在一种实施方式中,被谷氨酸(E)或天冬氨酸(D)取代;在进一步的实施方式中,包含K392D或N392D突变)并且另一重链的CH3结构域包含D399、E356、D356或E357被带正电荷的氨基酸取代(在一种实施方式中,被赖氨酸(K)或精氨酸(R)取代),在进一步的实施方式中,包含D399K、E356K、D356K或E357K取代;以及在更加进一步的实施方式中,包含D399K或E356K突变)。在进一步的实施方式中,所述的一个重链的CH3结构域进一步包含氨基酸K409或R409被带负电荷的氨基酸取代(在一种实施方式中,被谷氨酸(E)或天冬氨酸(D)取代;在进一步的实施方式中,包含K409D或R409D突变)。在进一步的实施方式中,所述的一个重链的CH3结构域进一步或备选地包含氨基酸K439和/或K370被带负电荷的氨基酸取代(在一种实施方式中,被谷氨酸(E)或天冬氨酸(D)取代)。在一种实施方式中,备选地利用在WO2007/147901中描述的异二聚化方法。在一种实施方式中,一个重链的CH3结构域包含氨基酸K253E、D282K和K322D突变并且另一重链的CH3结构域包含氨基酸D239K、E240K和K292D突变。在一种实施方式中,备选地利用在WO2007/110205中描述的异二聚化方法。如本文中所用的,术语“结合位点”或“抗原结合位点”表示实际上与配体(例如抗原或它的抗原片段)结合并且源自于抗体的抗体分子的区域。所述的抗原结合位点包括抗体重链可变域(VH)和/或抗体轻链可变域(VL)或VH/VL对。与所要的抗原特异性地结合的抗原结合位点可以来源于:a)抗所述抗原的已知抗体或b)新的抗体或抗体片段,其通过从头免疫方法,使用(尤其地)所述的抗原蛋白或核酸或其片段,或者通过噬菌体展示获得。本发明的抗体的抗原结合位点可以包含六个互补决定区(CDR),其在不同程度上对所述的抗原结合位点的亲和力有贡献。有三个重链可变域CDR(CDRH1、CDRH2和CDRH3)和三个轻链可变域CDR(CDRL1、CDRL2和CDRL3)。通过与氨基酸序列编译的数据库比较,确定所述的CDR和构架区(FR)的范围,在该数据库中,已经根据序列之中的可变性确定了那些区域。在本发明的保护范围内还包括由较少的几个CDR组成的功能性抗原结合位点(即其中结合特异性由三个、四个或五个CDR决定)。例如,少于整套6个的CDR对于结合来说可能足够了。在一些情形中,VH或VL结构域将会是足够的。抗体特异性是指所述的抗体对于抗原的特定表位的选择性识别。例如天然抗体是单特异性的。如本文中所用的,术语“单特异性”抗体表示具有一个或更多个结合位点并且每一个结合位点与相同抗原的相同表位结合的抗体。多特异性抗体例如是双特异性、三或四特异性抗体。双特异性抗体是具有两种不同的抗原结合特异性的抗体。相应地,三特异性抗体是具有三种不同的抗原结合特异性的抗体。四特异性抗体是具有四种不同的抗原结合特异性的抗体。在本发明的一种优选的实施方式中,所述的多特异性抗体是双特异性抗体。如果抗体具有一种以上的特异性,所识别的表位可能与单一抗原或一个以上抗原有关。正如在本申请中使用的,术语“价”表示在一个抗体分子中存在指定数目的结合位点。例如天然抗体具有两个结合位点,并且是二价的。同样地,术语“三价的”表示在一个抗体分子中存在三个结合位点。在本发明的一种优选的实施方式中,本发明所述的抗体包含一个或更多个免疫球蛋白种类的免疫球蛋白恒定区。免疫球蛋白种类包括IgG、IgM、IgA、IgD和IgE同种型以及在IgG和IgA的情形中它们的亚型。在一种优选的实施方式中,本发明的抗体具有IgG型抗体的恒定域结构。如本文中所用的,术语“单克隆抗体”或“单克隆抗体组合物”是指具有单一的氨基酸组成的抗体分子的制剂。术语“嵌合抗体”是指包含来自一种来源或物种的可变区(即结合区)和来源于不同来源或物种的恒定区的至少一部分的抗体,其通常通过重组DNA技术制备。优选包含鼠的可变区和人的恒定区的嵌合抗体。本发明所包括的其它优选形式的“嵌合抗体”是那些抗体,其与原始抗体的恒定区相比,恒定区已经被修饰或改变而产生根据本发明所述的性质,特别是关于C1q结合和/或Fc受体(FcR)结合。这样的嵌合抗体也被称为“类别转换的抗体”。嵌合抗体是表达的免疫球蛋白基因的产物,所述基因包含编码免疫球蛋白可变区的DNA区段和编码免疫球蛋白恒定区的DNA区段。用于产生嵌合抗体的方法涉及常规的重组DNA和基因转染技术,是本领域中熟知的。参见例如Morrison,S.L.等人,Proc.Natl.Acad.Sci.USA81(1984)6851-6855;US5,202,238和US5,204,244。术语“人源化抗体”是指抗体,其中构架或“互补决定区”(CDR)已经被修饰而包含与亲本免疫球蛋白的CDR相比具有不同特异性的免疫球蛋白的CDR。在优选的实施方案中,把鼠的CDR植入人抗体的构架区以制备“人源化抗体”。参见例如Riechmann,L.等人,Nature332(1988)323-327;和Neuberger,M.S.等人,Nature314(1985)268-270。本发明所包括的其它形式的“人源化抗体”是那些抗体,其中与原始抗体的恒定区相比,所述的恒定区已经被另外修饰或改变而产生根据本发明所述的性质,特别是在C1q结合和/或Fc受体(FcR)结合方面被改变。如本文中所用的,术语“人抗体”意图包括具有来源于人种系免疫球蛋白序列的可变区和恒定区的抗体。人抗体是现有技术中熟知的(vanDijk,M.A.和vandeWinkel,J.G.,Curr.Opin.Chem.Biol.5(2001)368-374)。还可以在转基因动物(例如小鼠)中产生人抗体,所述转基因动物在没有内源性免疫球蛋白生产的情况下,在免疫接种时,能够产生人抗体的全部组成成分或其部分。在这样的种系突变小鼠中,所述的人种系免疫球蛋白基因阵列的转移将会导致在抗原攻击时产生人抗体(参见例如Jakobovits,A.等人,Proc.Natl.Acad.Sci.USA90(1993)2551-2555;Jakobovits,A.等人,Nature362(1993)255-258;Bruggemann,M.等人,YearImmunol.7(1993)33-40)。还可以在噬菌体展示文库中产生人抗体(Hoogenboom,H.R.和Winter,G.,J.Mol.Biol.227(1992)381-388;Marks,J.D.等人,J.Mol.Biol.222(1991)581-597)。也可利用Cole等人和Boerner等人所述的技术来制备人单克隆抗体(Cole等人,MonoclonalAntibodiesandCancerTherapy,AlanR.Liss,p.77(1985);和Boerner,P.等人,J.Immunol.147(1991)86-95)。正如已经关于根据本发明的嵌合抗体和人源化抗体所提到的那样,本文中所用的术语“人抗体”也包括这样的抗体,它在恒定区中被修饰而产生根据本发明所述的性质,特别是关于C1q结合和/或FcR结合方面被修饰,例如通过“类别转换”,即Fc部件的改变或突变(例如从IgG1变为IgG4和/或IgG1/IgG4突变)。如本文中所用的,术语“重组的人抗体”意图包括通过重组手段制备、表达、产生或分离的所有的人抗体,例如从关于人免疫球蛋白基因的转基因的宿主细胞(例如NS0或CHO细胞)或动物(例如小鼠)中分离的抗体或使用转染到宿主细胞中的重组表达载体表达的抗体。这样的重组人抗体在重排形式中具有可变区和恒定区。已经使根据本发明所述的重组人抗体进行活体内体细胞高变。因此,所述的重组抗体的VH和VL区的氨基酸序列是这样的序列,其虽然来源于人种系VH和VL序列并且与人种系VH和VL序列相关,但是可以不必天然地在体内存在于所述的人抗体种系全部组成成分之内。如本文中所用的,“可变域”(轻链的可变域(VL)、重链的可变域(VH))表示直接地参与抗体与抗原的结合的一对轻链和重链中的每一个。可变的人轻链和重链的结构域具有相同的通用结构并且每个结构域包含四个构架(FR)区,该构架区的序列是广泛地保守的,通过三个“高变区”(或互补决定区CDR)连接。构架区采取β片层构象并且CDR可以形成连接β片层结构的环。通过构架区使每个链中CDR保持它们的三维结构,并且与来自另一个链的CDR一起形成抗原结合位点。抗体重和轻链的CDR3区在根据本发明抗体的结合特异性/亲和力中发挥特别重要的作用,因此提供了本发明的进一步目标。当在本文中使用时,术语“高变区”或“抗体的抗原结合部分”是指负责抗原结合的抗体的氨基酸残基。高变区包含来自“互补决定区”或“CDR”的氨基酸残基。“构架”或“FR”区是除如本文定义的高变区以外的那些可变域区域。因此,抗体的轻和重链包括从N-到C-端,结构域FR1、CDR1、FR2、CDR2、FR3、CDR3和FR4。在每个链上的CDR被这样的构架氨基酸分开。特别是,重链的CDR3是对抗原结合贡献最大的区域。根据Kabat等人,SequencesofProteinsofImmunologicalInterest,第五版,PublicHealthService,NationalInstitutesofHealth,BethesdaMD(1991)的标准定义确定CDR和FR区。如本文中所用的,术语“结合”、“其特异性地结合”和“特异性地结合”是指在采用纯化的野生型抗原的体外试验中,优选地在等离振子共振试验中,抗体与抗原表位的结合(GE-HealthcareUppsala,Sweden)。通过术语ka(关于来自抗体/抗原复合物的抗体缔合的速率常数)、kD(解离常数)和KD(kD/ka),来定义结合的亲和力。在一种实施方式中,“结合”或“其与...特异性地结合”意指10-8摩尔/升或更小,在一种实施方式中10-8M至10-13摩尔/升的结合亲和力(KD)。因此,根据本发明的多特异性抗体以10-8摩尔/升或更小的结合亲和力(KD),在一种实施方式中以10-8至10-13摩尔/升的结合亲和力(KD)与其特异的每个抗原特异性地结合。在一种实施方式中,多特异性抗体以10-9至10-13摩尔/升的结合亲和力(KD)与它的抗原特异性地结合。通过试验(GE-HealthcareUppsala,Sweden),可以研究抗体与FcγRIII的结合。通过术语ka(关于来自抗体/抗原复合物的抗体的缔合的速率常数)、kD(解离常数)和KD(kD/ka),来定义结合亲和力。术语“表位”包括能够与抗体特异性地结合的任何多肽决定簇。在某些实施方式中,表位决定簇包括分子的化学活性的表面基团,例如氨基酸、糖侧链、磷酰基或磺酰基,以及在某些实施方式中,表位决定簇可以具有特异的三维结构特征和或特异性的电荷特征。表位是被抗体结合的抗原的区域。在某些实施方式中,当抗体在蛋白质和/或大分子的复杂混合物中优先地识别它的靶抗原时,抗体被说成与抗原特异性地结合。在进一步的实施方式中,根据本发明的多特异性抗体的特征在于:所述抗体是人IgG1亚类的或人IgG1亚类的,具有突变L234A和L235A(根据KabatEU索引编号)。在进一步的实施方式中,根据本发明的多特异性抗体的特征在于:所述抗体是人IgG2亚类的。在进一步的实施方式中,根据本发明的多特异性抗体的特征在于:所述抗体是人IgG3亚类的。在进一步的实施方式中,根据本发明的多特异性抗体的特征在于:所述抗体是人IgG4亚类的或人IgG4亚类的,具有另外的突变S228P(根据KabatEU索引编号)。在进一步的实施方式中,根据本发明的多特异性抗体的特征在于:它是人IgG1或人IgG4亚类的。在进一步的实施方式中,根据本发明的多特异性抗体的特征在于:它是人IgG1亚类的,具有突变L234A和L235A(根据KabatEU索引编号)。在进一步的实施方式中,根据本发明的多特异性抗体的特征在于:它是人IgG1亚类的,具有突变L234A、L235A和P329G(根据KabatEU索引编号)。在进一步的实施方式中,根据本发明的多特异性抗体的特征在于:它是人IgG4亚类的,具有突变S228P和L235E(根据KabatEU索引编号)。在进一步的实施方式中,根据本发明的多特异性抗体的特征在于:它是人IgG4亚类的,具有突变S228P、L235E和P329G(根据KabatEU索引编号)。现在已经发现根据本发明的多特异性抗体具有改善的特征,例如生物学或药理学活性、药物动力学性质或毒性。可以使用它们例如用于治疗疾病,例如癌症。正如在本申请中使用的那样,术语“恒定区”表示除可变区以外的抗体的结构域的总和。恒定区不直接参与抗原的结合,但是展示各种效应子功能。根据抗体的重链的恒定区的氨基酸序列,把抗体分成下列类别:IgA、IgD、IgE、IgG和IgM,并且可以把这些中的几个进一步分成亚类,例如IgG1、IgG2、IgG3和IgG4、IgA1和IgA2。对应于不同的抗体类别的重链恒定区分别被称为α、β、ε、γ和μ。可以在所有的五个抗体类别中发现的轻链恒定区(CL)被称为κ(kappa)和λ(lambda)。如本文中所用的,“恒定域”来自于人源,其来自于亚类IgG1、IgG2、IgG3或IgG4的人抗体的恒定重链区和/或恒定轻链κ或λ区。这样的恒定域和区是现有技术中熟知的并且例如被Kabat等人,SequencesofProteinsofImmunologicalInterest,第五版,PublicHealthService,NationalInstitutesofHealth,Bethesda,MD(1991)描述。如本文中所用的,根据在Kabat等人,SequencesofProteinsofImmunologicalInterest,第五版,PublicHealthService,NationalInstitutesofHealth,Bethesda,MD(1991)中描述的Kabat编号系统,对重链和轻链的所有恒定区和结构域的氨基酸位置进行编号,并且在本文中将其称为“根据Kabat编号”。具体地,把Kabat等人,SequencesofProteinsofImmunologicalInterest,第五版,PublicHealthService,NationalInstitutesofHealth,Bethesda,MD(1991)的Kabat编号系统(参见第647-660页)用于κ和λ同种型的轻链恒定结构域CL,并且将KabatEU索引编号系统(见第661-723页)用于恒定重链结构域(CH1、铰链、CH2和CH3,在本文中在这种情况下,通过引用“根据KabatEU索引编号”进一步澄清它)。虽然IgG4亚类的抗体显示减小的Fc受体(FcγRIIIa)结合,但是其它IgG亚类的抗体显示强结合。然而,Pro238、Asp265、Asp270、Asn297(Fc碳水化合物的损失)、Pro329、Leu234、Leu235、Gly236、Gly237、Ile253、Ser254、Lys288、Thr307、Gln311、Asn434和His435(根据KabatEU索引编号)是这样的残基,如果改变它们,也提供减小的Fc受体结合(Shields,R.L.等人,J.Biol.Chem.276(2001)6591-6604;Lund,J.等人,FASEBJ.9(1995)115-119;Morgan,A.等人,Immunology86(1995)319-324;EP0307434)。在一种实施方式中,与IgG1抗体相比,根据本发明的抗体具有减小的FcR结合。因此,亲本抗体是关于IgG4亚类或在S228、L234、L235和/或D265中具有突变的IgG1或IgG2亚类的FcR结合,和/或包含PVA236突变(根据KabatEU索引编号)。在一种实施方式中,在亲本抗体中的突变是S228P、L234A、L235A、L235E和/或PVA236(根据KabatEU索引编号)。在另一种实施方式中,在亲本抗体中的突变在IgG4的S228P中以及在IgG1的L234A和L235A(根据KabatEU索引编号)中。抗体的恒定区直接地参与ADCC(依赖于抗体的细胞介导的细胞毒性)和CDC(补体依赖性细胞毒性)。通过补体因子C1q与大多数IgG抗体亚类的恒定区的结合来启动补体激活(CDC)。C1q与抗体的结合是由在所谓的结合位点处确定的蛋白质相互作用引起的。这样的恒定区结合位点是现有技术中已知的并且例如被Lukas,T.J.等人,J.Immunol.127(1981)2555-2560;Bunkhouse,R.和Cobra,J.J.,Mol.Immunol.16(1979)907-917;Burton,D.R.等人,Nature288(1980)338-344;Thomason,J.E.等人,Mol.Immunol.37(2000)995-1004;Idiocies,E.E.等人,J.Immunol.164(2000)4178-4184;Hearer,M.等人,J.Virol.75(2001)12161-12168;Morgan,A.等人,Immunology86(1995)319-324;和EP0307434描述。这样的恒定区结合位点例如特征在于氨基酸L234、L235、D270、N297、E318、K320、K322、P331和P329(根据KabatEU索引编号)。术语“抗体依赖性细胞毒性(ADCC)”是指在效应子细胞存在下,人靶细胞被根据本发明的抗体裂解。优选地通过在效应细胞(例如新鲜地分离的PBMC或从血沉棕黄层中纯化的效应细胞,如单核细胞或天然杀伤(NK)细胞或永久生长的NK细胞系)的存在下,采用根据本发明的抗体处理抗原表达细胞的制剂,来测定ADCC。术语“补体依赖性细胞毒性(CDC)”表示通过补体因子C1q与大多数IgG抗体亚类的Fc部分的结合而启动的过程。C1q与抗体的结合是由在所谓的结合位点处的确定的蛋白质相互作用所引起的。这样的Fc部分的结合位点是现有技术中已知的(参见上面)。这样的Fc部分的结合位点例如特征在于氨基酸L234、L235、D270、N297、E318、K320、K322、P331和P329(根据KabatEU索引编号)。亚类IgG1、IgG2和IgG3的抗体通常显示补体激活,包括C1q和C3结合,而IgG4不活化补体系统并且不与C1q和/或C3结合。通过使它们的寡糖组分工程化,可以增强单克隆抗体的细胞介导的效应子功能,正如Umana,P.等人,NatureBiotechnol.17(1999)176-180和US6,602,684中描述的那样。最通常使用的治疗性抗体IgG1型抗体是在每个CH2结构域中在Asn297处具有保守性N-糖基化位点的糖蛋白。与Asn297相连的两个复合的二触角寡糖被埋在CH2域之间,形成与多肽主链的广泛接触,并且它们的存在对抗体介导效应子功能(例如抗体依赖性细胞毒性(ADCC))是必不可少的(Lifely,M.,R.等人,Glycobiology5(1995)813-822;Jefferis,R.等人,Immunol.Rev.163(1998)59-76;Wright,A.和Morrison,S.L.,TrendsBiotechnol.15(1997)26-32)。Umana,P.等人,NatureBiotechnol.17(1999)176-180和WO99/54342显示在中国仓鼠卵巢(CHO)细胞中催化二等分寡糖形成的糖基转移酶——β(1,4)-N-乙酰葡糖胺基转移酶III(“GnTIII”)的过表达,显著地增加抗体的体外ADCC活性。Asn297碳水化合物的组成的改变或它的消除也影响与FcγR和C1q的结合(Umana,P.等人,NatureBiotechnol.17(1999)176-180;Davies,J.等人,Biotechnol.Bioeng.74(2001)288-294;Mimura,Y.等人,J.Biol.Chem.276(2001)45539-45547;Radaev,S.等人,J.Biol.Chem.276(2001)16478-16483;Shields,R.L.等人,J.Biol.Chem.276(2001)6591-6604;Shields,R.L.等人,J.Biol.Chem.277(2002)26733-26740;Simmons,L.C.等人,J.Immunol.Methods263(2002)133-147)。报道了用来增强单克隆抗体的细胞介导的效应子功能的方法,例如在WO2005/018572,WO2006/116260,WO2006/114700,WO2004/065540,WO2005/011735,WO2005/027966,WO1997/028267,US2006/0134709,US2005/0054048,US2005/0152894,WO2003/035835,WO2000/061739中。在本发明的一种优选的实施方式中,采用在Asn297处的糖链,使多特异性抗体糖基化(如果它包含IgG1、IgG2、IgG3或IgG4亚类的,优选地IgG1或IgG3亚类的Fc部分),由此在所述糖链之内岩藻糖的量是65%或更低(根据KabatEU索引编号)。在另一种实施方式中,在所述糖链之内岩藻糖的数量在5%和65%之间,优选地在20%和40%之间。根据本发明的“Asn297”意指位于Fc区中大约第297位的氨基酸天冬酰胺。基于抗体微小的序列变化,Asn297还可以位于第297位的上游或下游的一些氨基酸上(通常不超过±3个氨基酸),即在第294位和第300位之间。在一种实施方式中,IgG亚类的根据本发明糖基化抗体是人IgG1亚类的、具有突变L234A和L235A的人IgG1亚类的或IgG3亚类的。在进一步的实施方式中,在所述糖链之内,N-羟乙酰神经氨酸(NGNA)的数量是1%或更少和/或N端α-1,3-半乳糖的数量是1%或更少。糖链优选地展示与在CHO细胞中重组表达的抗体的Asn297相连的N连接的聚糖的特征。术语“糖链显示与在CHO细胞中重组表达的抗体的Asn297相连的N连接的聚糖的特征”表示除了岩藻糖残基以外,在根据本发明的亲本抗体的Asn297处的糖链具有与在未修饰的CHO细胞(例如在WO2006/103100中报告的那些)中表达的相同抗体的那些结构和糖残基序列相同的结构和糖残基序列。正如在本申请之内使用的那样,术语“NGNA”表示糖残基N-羟乙酰神经氨酸。人IgG1或IgG3的糖基化发生在Asn297,因为核心岩藻糖化的二触角复合寡糖糖基化以至多两个Gal残基结束。IgG1或IgG3亚类的人恒定重链区由Kabat,E.,A.等人,SequencesofProteinsofImmunologicalInterest,第五版,PublicHealthService,NationalInstitutesofHealth,Bethesda,MD.(1991)和Brüggemann,M.等人,J.Exp.Med.166(1987)1351-1361;Love,T.,W.等人,MethodsEnzymol.178(1989)515-527详细地报道。这些结构被定名为G0、G1(α-1,6-或α-1,3-)或G2聚糖残基,取决于末端Gal残基的数量(Raju,T.,S.,BioprocessInt.1(2003)44-53)。抗体Fc部分的CHO型糖基化例如被Routier,F.,H.,GlycoconjugateJ.14(1997)201-207描述。在非糖修饰的CHO宿主细胞中重组表达的抗体通常在Asn297处以至少85%的量被岩藻糖化。抗体的修饰的寡糖可以是杂合体或复合物。优选地,二等分的、减小的/没有岩藻糖化的寡糖是杂合体。在另一种实施方式中,二等分的、减小的/没有岩藻糖化的寡糖是复合物。根据本发明,“岩藻糖的数量”意指通过MALDI-TOF质谱测定的在在Asn297处糖链之内,与Asn297相连的所有糖结构的全部相关的,所述糖的数量(例如复合物、杂合体和高甘露糖结构),并且被计算成平均值。岩藻糖的相对量是通过MALDI-TOF在N-糖苷酶F处理的样品(例如分别为复合物、杂合体和寡-和高-甘露糖结构)中鉴定的与所有糖结构相关的包含岩藻糖的结构的百分比。根据本发明的抗体可以与多种抗原结合。在本发明的一种实施方式中,第一抗原和第二抗原均不是活化T细胞抗原。在本发明的一种实施方式中,第一抗原和第二抗原均不是CD3。在一种实施方式中,抗体不与活化T细胞抗原特异性地结合。在一种实施方式中,抗体不与CD3特异性地结合。在本发明的一种实施方式中,第一或第二抗原是人TWEAK。在本发明的一种实施方式中,第一或第二抗原是人IL17。在本发明的一种实施方式中,第一抗原是人TWEAK并且第二抗原是人IL17。在本发明的一种实施方式中,第一抗原是人IL17并且第二抗原是人TWEAK。人TWEAK(UniProtKBO43508,细胞程序死亡的TNF相关的弱诱导剂)是与细胞表面缔合的II型跨膜蛋白质。TWEAK被描述在Chicheportiche,Y.等人,J.Biol.Chem.272(1997)32401-32410;Marsters,S.A.等人,Curr.Biol.8(1998)525-528;Lynch,C.N.等人,J.Biol.Chem.274(1999)8455-8459中。TWEAK的活性形式是可溶性同源三聚体。人和鼠的TWEAK在受体结合结构域中显示93%序列同一性。TWEAK受体Fn14(成纤维细胞生长因子可诱导的14kDa蛋白)是由在配体结合结构域中富含单个半胱氨酸的结构域组成的129个氨基酸的I型跨膜蛋白。TWEAK的信号传导经由NF-KB途径活化发生。TWEAKmRNA在多种组织中表达,并且在大多数主要器官如心脏、脑、骨骼肌和胰腺、与免疫系统相关的组织如脾、淋巴结和胸腺中被发现。已经在心脏、脑、肺、胎盘、血管内皮细胞和平滑肌细胞中检测到Fn14mRNA。TWEAK无效的和Fnl4无效的敲除小鼠是能生存的、健康的和能生育的,并且具有更多的天然杀伤细胞和显示增强的先天的炎性应答。TWEAK参与细胞程序性死亡、增殖、血管生成、缺血半影区、脑水肿、多发性硬化症。人IL-17(也被称为IL17-A;CTLA-8,SwissProtQ16552,IL17)是由与MS的发病机理有牵连的辅助T细胞(被称为Th17)的亚组产生的促炎细胞因子。IL-17A在诱导其它炎性细胞因子、趋化因子和黏附分子中发挥作用。采用IL-17A中和抗体治疗动物减小了自身免疫性脑脊髓炎的发病率和严重度(Komiyama,Y.等人,J.Immunol.177(2006)566-573)。在MS患者的脑脊髓液中IL-17A被过度表达(Hellings,P.W.等人,Am.J.Resp.CellMol.Biol.28(2003)42-50;Matusevicius,D.等人,MultipleSclerosis5(1999)101-104;WO2005/051422)。另外,IL-17A中和抗体减小胶原诱导的关节炎的小鼠RA模型的严重度和发生率,并且可以在来自RA患者的发炎关节的滑液中检测到高水平的IL-17A(Ziolkowska,M.等人,J.Immunol.164(2000)2832-2838;Kotake,S.等人,J.Clin.Invest.103(1999)1345-1352;Hellings,P.W.等人,Am.J.Resp.CellMol.Biol.28(2003)42-50)。根据本发明的抗体是通过重组手段产生的。因此,本发明的一个方面是编码根据本发明抗体的核酸,以及进一步的方面是包含编码根据本发明的抗体的所述核酸的细胞。用于重组生产的方法是现有技术中广为人知的并且包括在原核和真核细胞中表达蛋白质与随后的分离抗体和通常纯化到药学上可接受的纯度。为了如上在宿主细胞中表达抗体,通过标准方法把编码各自修饰的轻链和重链的核酸插入表达载体中。在合适的原核生物或真核生物宿主细胞如CHO细胞、NS0细胞、SP2/0细胞、HEK293细胞、COS细胞、PER.C6细胞、酵母或大肠杆菌细胞中进行表达,并且从细胞(裂解以后的上清液或细胞)中回收抗体。用于抗体的重组生产的一般方法是现有技术中熟知的并且例如被描述在下列综述文章中:Makrides,S.C.ProteinExpr.Purif.17(1999)183-202;Geisse,S.等人,ProteinExpr.Purif.8(1996)271-282;Kaufman,R.J.,Mol.Biotechnol.16(2000)151-161;Werner,R.G.,DrugRes.48(1998)870-880。由宿主细胞产生的抗体可以经历从重链的C-端翻译后切除一个或更多个,特别是一个或两个氨基酸。因此,通过编码全长重链的特异性核酸分子的表达,由宿主细胞产生的抗体可以包括全长重链,或者它可以包括全长重链的切割变体(在本文中也被称为切割变体重链)。这可能是这样的情形:其中重链的最后两个C端氨基酸是甘氨酸(G446)和赖氨酸(K447,根据KabatEU索引编号)。因此,在本文中,如果不另外指出,包含CH3结构域的重链的氨基酸序列被表示成没有C端甘氨酸-赖氨酸二肽。在一种实施方式中,正如在本文中具体说明的那样,包含含有CH3结构域的重链的抗体包含另外的C端甘氨酸-赖氨酸二肽(G446和K447,根据Kabat的EU索引编号)。在一种实施方式中,正如在本文中具体说明的那样,包含含有CH3结构域的重链的抗体包含另外的C端甘氨酸残基(G446,根据Kabat的EU索引编号)。本发明的组合物,例如本文中描述的药物组合物,包含本发明的抗体群。抗体群可以包括具有全长重链的抗体和具有切割的变体重链的抗体。抗体群可以由具有全长重链的抗体和具有切割变异重链的抗体的混合物组成,其中至少50%、至少60%、至少70%、至少80%或至少90%的抗体具有切割变异重链。在一种实施方式中,正如在本文中具体说明的那样,包含本发明的抗体群的组合物包含抗体,该抗体包含含有CH3结构域的重链与另外的C端甘氨酸-赖氨酸二肽(G446和K447,根据KabatEU索引编号)。在一种实施方式中,正如在本文中具体说明的那样,包含本发明的抗体群的组合物包含抗体,该抗体包含含有CH3结构域的重链与另外的C端甘氨酸残基(G446,根据KabatEU索引编号)。在一种实施方式中,这样的组合物包含由下列抗体组成的抗体群:包含在本文中具体说明的含有CH3结构域的重链的抗体;包含在本文中具体说明的含有CH3结构域的重链与另外的C端甘氨酸残基(G446,根据KabatEU索引编号)的抗体;和包含在本文中具体说明的含有CH3结构域的重链与另外的C端甘氨酸-赖氨酸二肽(G446和K447,根据KabatEU索引编号)的抗体。通过常规的免疫球蛋白纯化步骤例如,A蛋白琼脂糖凝胶、羟基磷灰石层析、凝胶电泳、透析或亲和层析法,合适地从培养基中分离根据本发明的多特异性抗体。使用常规方法容易地分离编码单克隆抗体的DNA和RNA并且测序。杂交瘤细胞可以充当这样的DNA和RNA的来源。一旦分离,就可以把DNA插入表达载体中,然后把该表达载体转染到否则不产生免疫球蛋白的宿主细胞(例如HEK293细胞、CHO细胞或骨髓瘤细胞)中,以在宿主细胞中获得重组单克隆抗体的合成。通过把合适的核苷酸变化引入到抗体DNA中或通过核苷酸合成,制备了多特异性抗体的氨基酸序列变体(或突变体)。然而,可以仅仅在非常有限的范围内(例如如上述)进行这样的修饰。举例来说,修饰不改变上述的抗体特征,例如IgG同种型和抗原结合,但是可以进一步改善重组生产的产率、蛋白质稳定性或便于纯化。在某些实施方式中,提供了具有一个或更多个保守性氨基酸取代的抗体变体。可以根据常见的侧链性质把氨基酸分组:(1)疏水性的:正亮氨酸、Met、Ala、Val、Leu、Ile;(2)中性亲水的:Cys、Ser、Thr、Asn、Gln;(3)酸性的:Asp、Glu;(4)碱性的:His、Lys、Arg;(5)影响链取向的残基:Gly、Pro;(6)芳香族的:Trp、Tyr、Phe。表1–具有特异性性质的氨基酸正如本申请中使用的那样,术语“宿主细胞”表示可以被工程化而产生根据本发明抗体的任何种类的细胞系统。在一种实施方式中,使用HEK293细胞和CHO细胞作为宿主细胞。如本文中所用的,表述“细胞”、“细胞系”和“细胞培养物”可被互换地使用并且所有这样的名称包括后代。因此,词“转化体”和“转化细胞”包括原代受试者细胞和来源于其的培养物,不考虑转移的数目。也理解由于故意的或非故意的突变,所有的后代可以不必在DNA含量方面精确地相同。包括具有与在最初转化细胞中筛选的相同功能或生物学活性的变异后代。当意指不同的名称时,从上下文中清楚地得知。在NS0细胞中的表达例如被Barnes,L.M.等人,Cytotechnology32(2000)109-123;Barnes,L.M.等人,Biotech.Bioeng.73(2001)261-270描述。瞬时表达例如被Durocher,Y.等人,Nucl.Acids.Res.30(2002)E9描述。可变域的克隆被Orlandi,R.等人,Proc.Natl.Acad.Sci.USA86(1989)3833-3837;Carter,P.等人,Proc.Natl.Acad.Sci.USA89(1992)4285-4289;和Norderhaug,L.等人,J.Immunol.Methods204(1997)77-87描述。优选的瞬时表达系统(HEK293)被Schlaeger,E.-J.和Christensen,K.在Cytotechnology30(1999)71-83和被Schlaeger,E.-J.,J.Immunol.Methods194(1996)191-199描述。例如适用于原核生物的对照序列包含启动子、任选地操纵子序列和核糖体结合位点。已知真核细胞利用启动子、增强子和聚腺苷酸化信号。当把核酸置于与另一核酸序列的功能关系中时,核酸是“有效连接的”。例如,前序列或分泌前导序列的DNA如果被表达为参与多肽分泌的前蛋白质,那么所述DNA与所述多肽的DNA有效连接,如果启动子或增强子影响编码序列的转录,那么所述启动子或增强子与编码序列有效连接;或如果核糖体结合位点被置于促进翻译的位置,那么核糖体结合位点与编码序列有效连接。一般地,“有效连接的”意指连接的DNA序列是邻接的,以及在分泌前导序列的情形中,是邻接的并且在读框中。然而,增强子不必是邻接的。通过在方便的限制位点处的连接来完成连接。如果这样的位点不存在,根据通常的做法使用合成寡核苷酸衔接头或接头。通过标准技术进行抗体的纯化,以便除去细胞组分或其它污染物,例如其它细胞核酸或蛋白质,这些标准技术包括碱/SDS处理、CsCl显带、柱层析法、琼脂糖凝胶电泳和本领域中熟知的其它技术。参见Ausubel,F.等人主编,CurrentProtocolsinMolecularBiology,GreenePublishingandWileyInterscience,NewYork(1987)。不同的方法被很好地建立了并且被广泛地应用于蛋白质纯化,例如采用微生物蛋白质的亲和层析法(例如A蛋白或G蛋白亲和层析法)、离子交换层析法(例如阳离子交换(羧甲基树脂)、阴离子交换(氨基乙基树脂)和混合方式交换)、亲硫吸附(例如采用β-巯基乙醇和其它SH配体)、疏水性相互作用或芳香族吸附层析法(例如采用苯基-琼脂糖、亲氮杂芳基树脂或间氨基苯基硼酸)、金属螯合亲和层析(例如采用Ni(II)-和Cu(II)亲和性物质)、大小排阻层析和电泳方法(例如凝胶电泳、毛细管电泳)(Vijayalakshmi,M.A.,Appl.Biochem.Biotech.75(1998)93-102)。本发明的一个方面是包含根据本发明的抗体的药物组合物。本发明的另一个方面是根据本发明的抗体用于生产药物组合物的用途。本发明的进一步方面是用于生产包含根据本发明的抗体的药物组合物的方法。在一个方面中,本发明提供了包含与药用载体配制在一起的根据本发明的抗体的组合物,例如药物组合物。本发明的一种实施方式是根据本发明的多特异性抗体在治疗癌症中的用途。本发明的另一个方面是所述药物组合物在治疗癌症中的用途。本发明的另一个方面根据本发明的抗体用于生产用于治疗癌症的药物的用途。本发明的另一个方面是通过向需要这类治疗的患者施用根据本发明的抗体来治疗遭受癌症的患者的方法。本发明的一种实施方式是根据本发明的多特异性抗体在治疗炎性疾病、自身免疫性疾病、类风湿性关节炎、牛皮癣性关节炎、肌肉疾病(例如肌肉萎缩)、多发性硬化症、慢性肾脏疾病、骨疾病(例如在多发性骨髓瘤中的骨退化)、系统性红斑狼疮、狼疮肾炎和血管损伤中的用途。本发明的另一个方面是所述药物组合物在治疗炎性疾病、自身免疫性疾病、类风湿性关节炎、牛皮癣性关节炎、肌肉疾病(例如肌肉萎缩)、多发性硬化症、慢性肾脏疾病、骨疾病(例如在多发性骨髓瘤中的骨退化)、系统性红斑狼疮、狼疮肾炎和血管损伤中的用途。本发明的另一个方面是根据本发明的抗体用于生产用于治疗炎性疾病、自身免疫性疾病、类风湿性关节炎、牛皮癣性关节炎、肌肉疾病(例如肌肉萎缩)、多发性硬化症、慢性肾脏疾病、骨疾病(例如在多发性骨髓瘤中的骨退化)、系统性红斑狼疮、狼疮肾炎和血管损伤的药物的用途。本发明的另一个方面是通过向需要这样的治疗的患者施用根据本发明的抗体来治疗遭受炎性疾病、自身免疫性疾病、类风湿性关节炎、牛皮癣性关节炎、肌肉疾病(例如肌肉萎缩)、多发性硬化症、慢性肾脏疾病、骨疾病(例如在多发性骨髓瘤中的骨退化)、系统性红斑狼疮、狼疮肾炎和血管损伤的患者的方法。如本文中所用的,“药用载体”包括生理学上相容的任何和所有溶剂、分散介质、包衣、抗菌剂和抗真菌药、等渗剂和延迟吸收剂等等。优选地,载体适用于静脉内、肌肉内、皮下、肠胃外、脊椎或表皮施用(例如通过注射或输注)。可以通过本领域中已知的多种方法施用本发明的组合物。正如本领域技术人员将会理解的那样,施用途径和/或方式将会随所要的结果而变化。为了通过某种施用途径施用本发明的化合物,采用防止它灭活的物质包衣化合物或与防止它灭活的物质共同施用化合物可能是必要的。例如,可以向受试者施用在合适的载体(例如脂质体或稀释剂)中的化合物。药学上可接受的稀释剂包括盐水和水性缓冲溶液。药用载体包括无菌水溶液或分散体和用于临时配制无菌的注射溶液或分散体的无菌粉末。这样的介质和作用剂用于药学上的活性物质的用途是本领域中已知的。如本文中所用的,短语“肠胃外施用”和“以肠胃外方式施用”意指除了肠内和局部施用以外的施用方式,通常通过注射,并且非限定性地包括静脉内、肌肉内、动脉内、鞘内、囊内、眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外和胸骨内的注射和输注。如本文中所用的,术语癌症是指增生性疾病,例如淋巴瘤、淋巴细胞性白血病、肺癌、非小细胞肺(NSCL)癌、细支气管肺泡细胞肺癌、骨癌、胰腺癌、皮肤癌、头部或颈部癌症、皮肤或眼内黑素瘤、子宫癌、卵巢癌、直肠癌、肛区癌症、胃癌、胃癌、结肠癌、乳腺癌、子宫癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、霍奇金病、食管癌、小肠癌、内分泌系统癌症、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、膀胱癌、肾或输尿管癌、肾细胞癌、肾盂癌、间皮瘤、肝细胞性癌症、胆癌、中枢神经系统(CNS)瘤、脊椎轴肿瘤、脑干神经胶质瘤、多形性胶质母细胞瘤、星形细胞瘤、施万鞘瘤(schwanomas)、室管膜瘤、成神经管细胞瘤、脑膜瘤、鳞状细胞癌、垂体腺瘤和尤因氏肉瘤,包括上述癌症中任意一种或一种或更多种上述癌症的的组合的难治性形式。这些组合物也可以包含佐剂例如防腐剂、润湿剂、乳化剂和分散剂。通过上文的灭菌方法和通过包含各种抗菌剂和抗真菌药(例如对羟基苯甲酸酯、氯代丁醇、苯酚、山梨酸等等),可以确保防止微生物存在。把等渗剂(例如糖、氯化钠等等)包括到组合物中也可以是所希望的。另外,可以通过包含延迟吸收的作用剂,例如单硬脂酸铝和明胶,带来可注射的药物形式的延长吸收。与选择的施用途径无关,通过本领域技术人员已知的常规方法,把可以以合适的水合形式和/或在本发明药物组合物中使用的本发明化合物配制成药学上可接受的剂型。可以改变本发明药物组合物中活性成分的真实的剂量水平,以便在对患者无毒的情况下,获得有效地达到针对特定的患者、组合物和施用方式的相要的治疗应答的活性成分的量。所选择的剂量水平将会取决于多种药物动力学因素,包括使用的本发明特定的组合物的活性、施用途径、施用时间、所使用的特定的化合物的排泄速率、治疗的持续时间、与所使用的特定的组合物组合使用的其它药物、化合物和/或材料、被治疗的患者的年龄、性别、体重、状况、一般健康情况和医疗史等等医学领域中熟知的因素。组合物必须是无菌的和流动的达到这样的程度以至可通过注射器递送组合物。除了水之外,载体还优选地是等渗的缓冲盐水溶液。例如在分散体的情形中,通过利用包衣例如卵磷脂,通过保持需要的粒子大小和通过利用表面活性剂,可以保持适当的流动性。在很多情况下,优选在组合物中包含等渗剂,例如糖、多元醇(例如甘露糖醇或山梨糖醇)和氯化钠。如本文中所用的,术语“转化”是指载体核酸转移到宿主细胞中的过程。如果使用没有可怕的细胞壁屏障的细胞作为宿主细胞,例如通过由Graham和VanderEh,Virology52(1978)546ff描述的磷酸钙沉淀方法进行转染。然而,也可以使用用于把DNA引入到细胞中的其它方法,例如通过核注射或通过原生质体融合。如果使用原核细胞或包含实质性的细胞壁构造的细胞,例如一种转染方法是使用氯化钙的钙处理,如由Cohen,F.N等人,PNAS69(1972)7110及以下所描述的那样。如本文中所用的,“表达”是指借以把核酸转录成mRNA的过程和/或随后借以把转录的mRNA(也被称为转录物)翻译成肽、多肽或蛋白质的过程。转录物和编码多肽总体地被称为基因产物。如果多核苷酸源自于基因组DNA,在真核细胞中的表达可以包括剪接mRNA。“载体”是核酸分子,特别是自我复制的核酸分子,它把插入的核酸分子转移到宿主细胞中和/或之间。该术语包括主要地起把DNA或RNA插入到细胞中(例如染色体整合)作用的载体、主要地起复制DNA或RNA作用的载体和起转录和/或翻译DNA或RNA作用的表达载体的复制。也包括提供一种以上功能的载体。“表达载体”是多核苷酸,当它被引入合适的宿主细胞中时,可以被转录和翻译成多肽。“表达系统”通常是指由可以起产生所要的表达产物作用的表达载体组成的合适的宿主细胞。在下列本发明的具体实施方式中列举了:1.多特异性抗体,其包含:a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,并且其中在第二抗体的第二轻链和第二重链中可变域VL和VH被彼此替换;和其中i)在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代;或ii)在根据b)的第二轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据b)的第二重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。2.多特异性抗体,其包含:a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,并且其中在第二抗体的第二轻链和第二重链中可变域VL和VH被彼此替换;和其中i)在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。3.根据实施方式1或2的多特异性抗体,其中在根据a)第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。4.根据实施方式1或2的多特异性抗体,其中在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)取代,并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。5.根据实施方式4的多特异性抗体,其中在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R))取代,并且处于第123位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)取代;并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代并且处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。6.根据实施方式1或2的多特异性抗体,其中在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)或精氨酸(R)(根据Kabat编号)取代,并且其中在根据a)的第一重链的恒定域CH1中,处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。7.根据实施方式1或2的多特异性抗体,其中在根据b)的第二轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R))取代;并且其中在根据b)的第二重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。8.根据实施方式1或2的多特异性抗体,其中在根据b)的第二轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据b)的第二重链的恒定域CH1中,处于第147位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。9.根据实施方式8的多特异性抗体,其中在根据b)的第二轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R))取代,并且处于第123位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)取代,并且其中在根据b)的第二重链的恒定域CH1中,处于第147位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代并且处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。10.根据实施方式1或2的多特异性抗体,其中在根据b)的第二轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)取代,并且其中在根据b)的第二重链的恒定域CH1中,处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。11.根据实施方式5的多特异性抗体,其中在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸被赖氨酸(K)(根据Kabat编号)取代并且处于第123位的氨基酸被赖氨酸(K)(根据Kabat编号)取代,并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸被谷氨酸(E)(根据KabatEU索引编号)取代并且处于第213位的氨基酸被谷氨酸(E)(根据KabatEU索引编号)取代。12.根据实施方式9的多特异性抗体,其中在根据b)的第二轻链的恒定域CL中,处于第124位的氨基酸被赖氨酸(K)(根据Kabat编号)取代并且处于第123位的氨基酸被赖氨酸(K)(根据Kabat编号)取代,并且其中在根据b)的第二重链的恒定域CH1中,处于第147位的氨基酸被谷氨酸(E)(根据KabatEU索引编号)取代并且处于第213位的氨基酸被谷氨酸(E)(根据KabatEU索引编号)取代。13.根据前面的实施方式中任意一种的多特异性抗体,其中根据a)的第一轻链和根据b)的第二轻链的恒定域CL是kappa同种型的。14.根据实施方式1至12中任意一种的多特异性抗体,其中根据a)的第一轻链的恒定域CL是λ同种型的并且根据b)的第二轻链的恒定域CL是kappa同种型的。15.根据实施方式1至12中任意一种的多特异性抗体,其中根据a)的第一轻链和根据b)的第二轻链的恒定域CL是λ同种型的。16.根据前面的实施方式中任意一种的多特异性抗体,其中在根据a)的第一轻链或根据b)的第二轻链的恒定域CL中,其中处于第124位的氨基酸没有独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)取代并且它是kappa同种型的,处于第124位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(在一种优选的实施方式中被谷氨酸(E))(根据Kabat编号)取代。17.根据前面的实施方式中任意一种的抗体,其特征在于:根据a)的抗体的第一重链的第一CH3结构域和根据b)的抗体的第二重链的第二CH3结构域各自在界面处相遇,该界面包括在抗体的CH3结构域之间的原始界面,其中改变所述界面以促进多特异性抗体的形成,其中改变的特征在于:i)改变一个重链的CH3结构域,使得在多特异性抗体之内,在与另一重链的CH3结构域的原始界面相遇的一个重链的CH3结构域的原始界面之内,氨基酸残基被具有较大侧链体积的氨基酸替换,从而在一个重链的CH3结构域的界面之内产生突起,该突起能够定位在另一重链的CH3结构域的界面之内的腔中并且ii)改变另一重链的CH3结构域,使得在多特异性抗体之内,在与一个重链的CH3结构域的原始界面相遇的另一重链的CH3结构域的原始界面之内,氨基酸残基被具有较小侧链体积的氨基酸残基替换,从而在另一重链的CH3结构域的界面之内产生腔,在一个重链的CH3结构域的界面之内的突起能够定位在该腔之内。18.根据实施方式17的抗体,其特征在于:具有较大侧链体积的所述氨基酸残基选自由精氨酸(R)、苯丙氨酸(F)、酪氨酸(Y)和色氨酸(W)组成的组,并且所述具有较小侧链体积的氨基酸残基选自由丙氨酸(A)、丝氨酸(S)、苏氨酸(T)和缬氨酸(V)组成的组。19.根据实施方式17或18的抗体,其特征在于:通过引入半胱氨酸(C)作为每个CH3结构域的相应位置中的氨基酸来进一步改变这两种CH3结构域,使得可以在两个CH3结构域之间形成二硫桥。20.根据前面的实施方式中任意一种的多特异性抗体,其中所述抗体是双特异性的。21.根据前面的实施方式中任意一种的多特异性抗体,其与人TWEAK特异性地结合并且与人IL17特异性地结合,其中A)所述多特异性抗体包含SEQIDNO:24的重链可变结构域(VH)和SEQIDNO:25的轻链可变结构域(VL);和B)所述多特异性抗体包含SEQIDNO:26的重链可变结构域(VH)和SEQIDNO:27的轻链可变结构域(VL)。22.双特异性抗体,其包含:a)与人TWEAK特异性地结合的第一抗体的第一轻链和第一重链,它包括SEQIDNO:24的重链可变结构域(VH)和SEQIDNO:25的轻链可变结构域(VL);和b)与人IL-17特异性地结合的第二抗体的第二轻链和第二重链,它包括SEQIDNO:26的重链可变结构域(VH)和SEQIDNO:27的轻链可变结构域(VL);其中在第二抗体的第二轻链和第二重链中可变域VL和VH被彼此替换,并且其中i)在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)或精氨酸(R)取代,并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。23.根据实施方式21的双特异性抗体,其中在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)或精氨酸(R)(根据Kabat编号)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R))取代,并且处于第123位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)取代;并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代并且处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代。24.根据实施方式21至23中任意一种的抗体在治疗癌症或炎性疾病、自身免疫病、类风湿性关节炎、牛皮癣性关节炎、肌肉疾病(例如肌肉萎缩)、多发性硬化症、慢性肾脏疾病、骨疾病(例如在多发性骨髓瘤中的骨退化)、系统性红斑狼疮、狼疮肾炎和血管损伤中的用途。25.根据实施方式21至23中任意一种的抗体用于生产用于治疗癌症或炎性疾病、自身免疫病、类风湿性关节炎、牛皮癣性关节炎、肌肉疾病(例如肌肉萎缩)、多发性硬化症、慢性肾脏疾病、骨疾病(例如在多发性骨髓瘤中的骨退化)、系统性红斑狼疮、狼疮肾炎和血管损伤的药物的用途。26.根据实施方式1至23中任意一种的多特异性抗体,其特征在于:它是人IgG1或人IgG4亚类的。27.根据实施方式1至23和26中任意一种的多特异性抗体,其特征在于它是具有突变L234A和L235A(根据KabatEU索引编号)的人IgG1亚类的。28.根据实施方式1至23和26至27中任意一种的多特异性抗体,其特征在于它是具有突变L234A、L235A和P329G(根据KabatEU索引编号)的人IgG1亚类的。29.根据前面的实施方式1至23和26中任意一种的多特异性抗体,其特征在于它是具有突变S228P和L235E(根据KabatEU索引编号)的人IgG4亚类的。30.根据前面的实施方式1至23和26至29中任意一种的多特异性抗体,其特征在于它是具有突变S228P、L235E和P329G(根据KabatEU索引编号)的人IgG4亚类的。31.用于制备根据实施方式1至23和26至30中任意一种的多特异性抗体的方法,包括下列步骤:A)采用包含核酸分子的载体转化宿主细胞,该核酸分子编码:a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,并且其中在第二抗体的第二轻链和第二重链中可变域VL和VH被彼此替换;和其中i)在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代;或ii)在根据b)的第二轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据b)的第二重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代;B)在允许合成所述抗体分子的条件下培养宿主细胞;和C)从所述培养物中回收所述抗体分子。32.编码根据实施方式1至23和26至30中任意一种的多特异性抗体的氨基酸序列的核酸。33.包含根据实施方式32核酸的表达载体,它能够在宿主细胞中表达所述核酸。34.包含根据实施方式33的载体的宿主细胞。35.包含根据实施方式1至23和26至30中任意一种的抗体的组合物。36.包含根据实施方式1至23和26至30中任意一种的抗体和至少一种药学上可接受的赋形剂的药物组合物。37.用于治疗需要治疗的患者的方法,其特征在于向患者施用治疗有效量的根据实施方式1至23和26至30中任意一种的抗体。38.用于减少多特异性抗体的副产物的方法,包括下列步骤:A)采用包含核酸分子的载体转化宿主细胞,该核酸分子编码:a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,并且其中在第二抗体的第二轻链和第二重链中可变域VL和VH被彼此替换;和其中为了减少多特异性抗体的副产物,包括了下列取代:i)在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代;或ii)在根据b)的第二轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据b)的第二重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代;B)在允许合成所述抗体分子的条件下培养所述宿主细胞;和C)从所述培养物中回收所述抗体分子。39.用于减少多特异性抗体的副产物的方法,包括下列步骤:A)采用包含核酸分子的载体转化宿主细胞,该核酸分子编码:a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,并且其中在第二抗体的第二轻链和第二重链中可变域VL和VH被彼此替换;和其中包括了下列取代:i)在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)、组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)、精氨酸(R))取代,并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代;或ii)在根据b)的第二轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)、精氨酸(R))取代,并且其中在根据b)的第二重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代,B)在允许合成所述抗体分子的条件下培养所述宿主细胞;和C)从所述培养物中回收具有减少的副产物分布的所述抗体分子。40.用于减少多特异性抗体的副产物的方法,包括下列步骤:A)采用包含核酸分子的载体转化宿主细胞,该核酸分子编码:a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,并且其中在第二抗体的第二轻链和第二重链中可变域VL和VH被彼此替换;和其中包括了下列取代:i)在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)、精氨酸(R))取代,并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代,B)在允许合成所述抗体分子的条件下培养所述宿主细胞;和C)从所述培养物中回收具有减少的副产物分布的所述抗体分子。41.下列取代用于减少多特异性抗体的副产物形成(或用于减少副产物分布)的用途:i)在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代;或ii)在根据b)的第二轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方案中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据b)的第二重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代;其中所述多特异性抗体包含:a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,并且其中在第二抗体的第二轻链和第二重链中可变域VL和VH被彼此替换。42.下列取代用于减少多特异性抗体的副产物形成(或用于减少副产物分布)的用途:i)在根据a)的第一轻链的恒定域CL中,处于第124位的氨基酸独立地被赖氨酸(K)、精氨酸(R)或组氨酸(H)(根据Kabat编号)(在一种优选的实施方式中,独立地被赖氨酸(K)或精氨酸(R))取代,并且其中在根据a)的第一重链的恒定域CH1中,处于第147位的氨基酸或处于第213位的氨基酸独立地被谷氨酸(E)或天冬氨酸(D)(根据KabatEU索引编号)取代;其中所述多特异性抗体包含a)与第一抗原特异性地结合的第一抗体的第一轻链和第一重链;和b)与第二抗原特异性地结合的第二抗体的第二轻链和第二重链,并且其中在第二抗体的第二轻链和第二重链中可变域VL和VH被彼此替换。43.根据实施方式1至16和20至23中任意一种的多特异性抗体,其中所述抗体包含至少两个Fab片段,其中第一Fab片段包含至少一个对于第一抗原特异的抗原结合位点;并且第二Fab片段包含至少一个对于第二抗原特异的抗原结合位点,其中在第二Fab片段中,在第二轻链和第二重链中可变域VL和VH被彼此替换;并且其中所述多特异性抗体缺乏Fc结构域。44.根据实施方式43的多特异性抗体,其中所述抗体包含两个至四个Fab片段。45.根据实施方式43或44的多特异性抗体,其中所述抗体与人Ang-2和VEGF特异性地结合。46.生产抗体的方法,包括培养实施方式34的宿主细胞以致产生抗体。47.实施方式46的方法,进一步包括从所述的宿主细胞中回收所述的抗体。提供了下列实施例、序列表和附图以帮助理解本发明,在所附的权利要求书中给出了本发明的真正的保护范围。应该明白可以在不偏离本发明的精神的情况下,在所陈述的步骤中做多种修改。氨基酸序列的说明SEQIDNO:1轻链(LC)<Ang-2>野生型(wt)SEQIDNO:2重链(HC)<Ang-2>野生型(wt)SEQIDNO:3重链(HC)<VEGF>具有VH-VL交换野生型(wt)SEQIDNO:4轻链(LC)<VEGF>具有VH-VL交换野生型(wt)SEQIDNO:5轻链(LC)<Ang-2>具有Q124K取代SEQIDNO:6重链(HC)<Ang-2>具有K147E取代SEQIDNO:7重链(HC)<Ang-2>具有K213E取代SEQIDNO:8轻链(LC)<Ang-2>具有E123K取代SEQIDNO:9轻链(LC)<Ang-2>具有Q124K取代和E123K取代SEQIDNO:10重链(HC)<Ang-2>具有K147E取代和K213E取代SEQIDNO:11轻链(LC)<Ang-2>具有Q124R取代和E123K取代SEQIDNO:12轻链(LC)<VEGF>具有Q124E取代SEQIDNO:13轻链(LC)<Ang-2>具有E124K取代和E123K取代SEQIDNO:14重链(HC)<Ang-2>具有K147E取代和K213D取代SEQIDNO:15轻链(LC)<IL-17>野生型(wt)SEQIDNO:16重链(HC)<IL-17>野生型(wt)SEQIDNO:17重链(HC)<TWEAK>具有VH-VL交换野生型(wt)SEQIDNO:18轻链(LC)<TWEAK>具有VH-VL交换的野生型(wt)SEQIDNO:19轻链(LC)<IL-17>具有Q124K取代和E123R取代SEQIDNO:20重链(HC)<IL-17>具有K147E取代和K213E取代SEQIDNO:21轻链(LC)<TWEAK>具有Q124E取代SEQIDNO:22重链(HC)<IL-17>具有K147E取代和K213D取代SEQIDNO:23轻链(LC)<IL-17>具有Q124K取代和E123K取代SEQIDNO:24重链可变结构域VH<TWEAK>305-HC4SEQIDNO:25轻链可变结构域VL<TWEAK>305-LC2SEQIDNO:26重链可变结构域VH<IL-17>HC136SEQIDNO:27轻链可变结构域VL<IL-17>LC136SEQIDNO:28重链(HC)<TWEAK>具有VH-VL交换的野生型(wt)(包含末端GK二肽)SEQIDNO:29重链(HC)<IL-17>具有K147E取代和K213E取代(包含末端GK二肽)SEQIDNO:30重链(HC)<IL-17>具有K147E取代和K213D取代(包含末端GK二肽)SEQIDNO:31重链(HC)<Ang-2>野生型(wt)(包含末端GK二肽)SEQIDNO:32重链(HC)<VEGF>具有VH-VL交换的野生型(wt)(包含末端GK二肽)SEQIDNO:33重链(HC)<Ang-2>具有K147E取代(包含末端GK二肽)SEQIDNO:34重链(HC)<Ang-2>具有K213E取代(包含末端GK二肽)SEQIDNO:35重链(HC)<Ang-2>具有K147E取代和K213E取代(包含末端GK二肽)SEQIDNO:36重链(HC)<Ang-2>具有K147E取代和K213D取代(包含末端GK二肽)SEQIDNO:37重链(HC)<IL-17>野生型(wt)(包含末端GK二肽)SEQIDNO:38经由甘氨酸-丝氨酸-接头与具有VH-VL交换的野生型(wt)的一个重链(HC)偶联的野生型(wt)<VEGF>的Fab2-CrossFab重链(HC),其包含两个重链(HC)<Ang-2>SEQIDNO:39经由甘氨酸-丝氨酸-接头与具有VH-VL交换的野生型(wt)的一个重链(HC)<VEGF>偶联的具有K147E和K213E取代的Fab2-CrossFab重链(HC),其包含两个重链(HC)<Ang-2>SEQIDNO:40经由甘氨酸-丝氨酸-接头与具有K147E和K213E取代的一个重链(HC)<Ang-2>偶联的具有VH-VL交换的野生型(wt)的-CrossFab-Fab重链(HC),其包含一个重链(HC)<VEGF>SEQIDNO:41经由甘氨酸-丝氨酸-接头与具有K147E和K213E取代的一个重链(HC)<Ang-2>偶联的具有VH-VL交换的野生型(wt)的CrossFab-Fab重链(HC),其包含一个重链(HC)<VEGF>SEQIDNO:42经由甘氨酸-丝氨酸-接头与野生型(wt)的一个重链(HC)<Ang-2>偶联的具有VH-VL交换的野生型(wt)的CrossFab2-Fab重链(HC),其包含两个重链(HC)<VEGF>SEQIDNO:43经由甘氨酸-丝氨酸-接头与具有K147E和K231E取代的一个重链(HC)<Ang-2>偶联的具有VH-VL交换的野生型(wt)的CrossFab2-Fab重链(HC),其包含两个重链(HC)<VEGF>SEQIDNO:44重链(HC)<VEGF>具有VH-VL交换具有K147E取代SEQIDNO:45轻链(HC)<VEGF>具有VH-VL交换具有Q124K取代SEQIDNO:46重链(HC)<VEGF>具有VH-VL交换具有K147E和K213E取代SEQIDNO:47轻链(HC)<VEGF>具有VH-VL交换具有E123K和Q124K取代实施例材料与一般方法关于人免疫球蛋白的轻链和重链的核苷酸序列的一般信息在下文中提供:Kabat,E.A.等人,SequencesofProteinsofImmunologicalInterest,第五版,PublicHealthService,NationalInstitutesofHealth,Bethesda,MD(1991)。正如上面定义的那样,按照根据Kabat编号系统(Kabat,E.A.等人,SequencesofProteinsofImmunologicalInterest,第五版,PublicHealthService,NationalInstitutesofHealth,Bethesda,MD(1991)),把抗体链的氨基酸编号和命名。重组DNA技术正如Sambrook,J.等人,MolecularCloning:Alaboratorymanual;ColdSpringHarborLaboratoryPress,ColdSpringHarbor,NewYork,1989中描述的那样,使用标准方法来操作DNA。按照生产商的说明书使用分子生物学试剂。基因合成从通过化学合成制造的寡核苷酸制备所要的基因区段。通过退火和连接寡核苷酸,包括PCR扩增,来装配侧翼具有单一的限制性核酸内切酶切割位点的600-1800bp长基因区段并随后经由所指示的限制性位点(例如KpnI/SacI或AscI/PacI)克隆到基于pPCRScript(Stratagene)的pGA4克隆载体中。亚克隆基因片段的DNA序列通过DNA测序证实。按照在Geneart(Regensburg,Germany)提供的说明书把基因合成片段排序。DNA序列测定通过在MediGenomixGmbH(Martinsried,Germany)或SequiserveGmbH(Vaterstetten,Germany)进行的双链测序,来确定DNA序列。DNA和蛋白质序列分析以及序列数据管理使用GCG的(GeneticsComputerGroup,Madison,Wisconsin)软件包版本10.2和Infomax的VectorNT1Advance全套版本8.0进行序列创造、制图、分析、注解以及阐明。表达载体为了表达所述的抗体,应用基于有或没有CMV-A内含子启动子的cDNA组织或基于具有CMV启动子的基因组组织的用于瞬时表达(例如在HEK293EBNA或HEK293-F中)细胞的表达质粒的变体。除了抗体表达盒之外,载体还包含:-允许这个质粒在大肠杆菌中复制的复制起点,和-赋予在大肠杆菌中的氨苄青霉素抗性的β-内酰胺酶基因。抗体基因的转录单位由下列元件组成:-处于5’端的独特的限制性位点,-来自人巨细胞病毒的立即早期增强子和启动子,--人抗体基因的5’-非翻译区,-免疫球蛋白重链信号序列,-人抗体链(野生型或具有结构域交换),要么呈cDNA要么呈具有免疫球蛋白外显子-内含子组织的基因组组织,-具有聚腺苷酸化信号序列的3’非翻译区,和-3’末端的独特的限制性位点。如下包含抗体链的融合基因是通过PCR和/或基因合成,以及通过已知的重组方法和技术,通过例如使用在相应载体中独特的限制性位点把相符的核酸区段连接而装配来产生的。通过DNA测序证实了亚克隆的核酸序列。为了瞬时转染,通过来自转化的大肠杆菌培养物(NucleobondAX,Macherey-Nagel)的质粒制剂制备了较大量的质粒。细胞培养技术正如在CurrentProtocolsinCellBiology(2000),Bonifacino,J.S.,Dasso,M.,Harford,J.B.,Lippincott-Schwartz,J.和Yamada,K.M.(编辑),JohnWiley&Sons,Inc中描述的那样,使用标准的细胞培养技术。通过如下在贴壁生长的HEK293-EBNA中或在生长在悬浮液中的HEK29-F细胞中的各自表达质粒的瞬时共转染,来表达多特异性抗体。在HEK293-EBNA系统中的瞬时转染通过在补充有10%UltraLowIgGFCS(胎牛血清,)、2mML-谷氨酰胺和250μg/ml遗传霉素的DMEM(Dulbecco修饰的Eagle培养基,)中培养的贴壁生长的HEK293-EBNA细胞(表达Epstein-Barr病毒核抗原的人胚肾细胞系293;美国典型培养物保藏中心(Americantypeculturecollection)保藏号ATCC#CRL-10852,Lot.959218)中相应的表达质粒(例如编码重链和修饰的重链以及相应的轻链和修饰的轻链)的瞬时共转染,表达多特异性抗体。为了转染,以4:1(范围从3:1到6:1)的FuGENETM试剂(μl)与DNA(μg)的比率使用FuGENETM6TransfectionReagent(RocheMolecularBiochemicals)。分别使用范围从1:2到2:1的1:1的(等摩尔的)编码(修饰的和野生型)轻链和重链的质粒的摩尔比率,从相应的质粒表达了蛋白质。在第3天,采用4mM的L-谷氨酰胺、葡萄糖[Sigma]和NAA喂养细胞。在转染以后的第5天到第11天,通过离心作用收获包含多特异性抗体的细胞培养上清液并且储藏在-20℃。关于在例如HEK293细胞中人免疫球蛋白的重组表达的一般信息被提供在下文中:Meissner,P.等人,Biotechnol.Bioeng.75(2001)197-203。在HEK293-F系统中的瞬时转染按照生产商的说明书使用HEK293-F系统(Invitrogen),采用相应的质粒(例如编码重链和修饰的重链以及相应的轻链和修饰的轻链),通过瞬时转染产生多特异性抗体。简单来说,采用四种表达质粒和293fectinTM或fectin(Invitrogen)的混合物转染生长在摇瓶或搅拌的发酵罐中的不含血清的FreeStyleTM293表达培养基(Invitrogen)中的悬浮液中的HEK293-F细胞(Invitrogen)。对于2L摇瓶(Corning),在600mL中以1.0E*6个细胞/mL的密度,接种HEK293-F细胞并且以120转数/分钟、8%CO2下培育。第二天,以大约1.5E*6个细胞/mL的细胞密度,采用大约42mL的A)具有600g分别编码重链或修饰的重链和等摩尔比率的相应轻链的总质粒DNA(1g/mL)的20mLOpti-MEM(Invitrogen)和B)20ml的Opti-MEM+1.2mL293fectin或fectin(2l/mL)的混合物转染细胞。在发酵期间,根据葡萄糖消耗,添加葡萄糖溶液。在5-10天以后,收获包含分泌抗体的上清液,并且要么直接地从上清液中纯化抗体,要么把上清液冷冻和储藏。蛋白质测定按照Pace等人,ProteinScience,1995,4,2411-1423,通过测定在280nm处的光密度(OD),使用基于氨基酸序列计算的摩尔消光系数,确定了纯化的抗体和衍生物的蛋白质浓度。在上清液中的抗体浓度测定通过采用A蛋白琼脂糖珠子(Roche)的免疫沉淀反应估测了在细胞培养上清液中抗体和衍生物的浓度。在TBS-NP40(50mMTris,pH7.5,150mMNaCl,1%Nonidet-P40)中洗涤60μLA蛋白琼脂糖珠子三次。随后,把1-15mL细胞培养上清液施加到在TBS-NP40中预平衡过的A蛋白琼脂糖珠子中。在室温下温育1小时以后,在Ultrafree-MC过滤柱(Amicon)上采用0.5mLTBS-NP40洗涤珠子一次,采用0.5mL2x磷酸缓冲盐水(2xPBS,Roche)洗涤两次以及采用0.5mL100mMpH5.0的柠檬酸钠快速洗涤四次。通过添加35μlLDS样品缓冲液(Invitrogen)洗脱结合的抗体。将样品的一半分别与样品还原剂组合或留下不还原,并且在70℃加热10分钟。因此,把5-30μl施加到4-12%双TrisSDS-PAGE(Invitrogen)(对于非还原的SDS-PAGE,采用MOPS缓冲液,以及对于还原的SDS-PAGE,采用具有抗氧化剂运行缓冲液添加剂(Invitrogen)的MES缓冲液)并且采用考马斯蓝染色。通过亲和HPLC层析定量地测定在细胞培养上清液中抗体和衍生物的浓度。简单地,把包含与A蛋白结合的抗体和衍生物的细胞培养上清液应用到在pH7.4的200mMKH2PO4,100mM柠檬酸钠中的AppliedBiosystemsPorosA/20柱上,并且在AgilentHPLC1100系统上,采用pH2.5的200mMNaCl、100mM柠檬酸从基质中洗脱。通过紫外线吸光度和峰面积的积分,把洗脱的蛋白质定量化。纯化的标准IgG1抗体作为标准。备选地,通过夹心IgG-ELISA测定在细胞培养上清液中抗体和衍生物的浓度。简单地,在室温下以0.1μg/mL给StreptaWellHighBindStrepatavidinA-96孔微量滴定板(Roche)涂覆100μL/孔生物素化的抗人IgG捕获分子F(ab’)2<h-Fcγ>BI(Dianova)1小时或备选地在4℃过夜,并且随后采用200μL/孔PBS、0.05%Tween(PBST,Sigma)洗涤三次。向孔中添加100μL/孔含有各自的抗体的细胞培养上清液在PBS(Sigma)中的系列稀释液,并且在微量滴定板振荡器上在室温下温育1-2小时。采用200μL/孔PBST洗涤孔三次,并且在微量滴定板振荡器上在室温下,采用100μl0.1μg/mL的F(ab‘)2<hFcγ>POD(Dianova)作为检测抗体,来检测结合的抗体1-2小时。采用200μL/孔PBST洗掉未结合的检测抗体三次,并且通过添加100μLABTS/孔检测结合的检测抗体。在TecanFluor分光计上在405nm的测量波长(参考波长492nm)处进行吸光度的测定。蛋白质纯化参考标准实验规程,从过滤的细胞培养上清液中纯化蛋白质。简单说来,把抗体应用到A蛋白琼脂糖柱(GEhealthcare)上并且用PBS洗涤。在pH2.8下实现对抗体的洗脱,随后立即中和样品。通过在PBS中或在20mM组氨酸、150mMNaClpH6.0中的大小排阻层析(Superdex200,GEHealthcare),从单体抗体中分离聚集的蛋白质。汇集单体抗体流分,使用例如MILLIPOREAmiconUltra(30MWCO)离心浓缩机浓缩(如果需要的话),冷冻和在-20℃或-80℃储藏。提供部分样品用于随后的蛋白质分析和分析表征,例如通过SDS-PAGE、大小排阻层析(SEC)或质谱。SDS-PAGE按照生产商的说明书使用Pre-Cast凝胶系统(Invitrogen)。特别是,使用10%或4-12%Bis-TRISPre-Cast凝胶(pH6.4)和MES(还原的凝胶,采用抗氧化剂运行缓冲液添加剂)或MOPS(非还原的凝胶)运行缓冲液。分析性大小排阻层析通过HPLC层析进行大小排阻层析(SEC),用于测定抗体的聚集和寡聚状态。简单来说,把A蛋白纯化的抗体应用到在AgilentHPLC1100系统上的在300mMNaCl、50mMKH2PO4/K2HPO4、pH7.5中的TosohTSKgelG3000SW柱子上或在DionexHPLC系统上的在2xPBS中的Superdex200柱子(GEHealthcare)上。通过紫外线吸光度和峰面积的积分来把洗脱的蛋白质定量。BioRadGelFiltrationStandard151–1901作为标准。质谱本节描述具有VH/VL交换的多特异性抗体(VH/VLCrossMab)的表征,着重于它们的正确装配。通过去糖基化的完整CrossMab和去糖基化的/纤溶酶消化的或备选地去糖基化的/有限的LysC消化的CrossMab的电喷雾离子化质谱(ESI-MS)来分析预期的一级结构。在磷酸盐或Tris缓冲液中在37℃,采用N-糖苷酶F以1mg/ml的蛋白质浓度把VH/VLCrossMab去糖基化长达17小时。采用在Tris缓冲液pH8中的100μg去糖基化的VH/VLCrossMab进行纤溶酶或有限的LysC(Roche)消化,分别在室温下持续120小时和在37℃持续40分钟。在质谱之前,经由HPLC在SephadexG25柱子(GEHealthcare)上将样品脱盐。经由ESI-MS在装备有TriVersaNanoMate源(Advion)的maXis4GUHR-QTOFMS系统(BrukerDaltonik)上测定总质量。使用表面等离振子共振(SPR)(BIACORE)测定多特异性抗体与各自抗原的结合和结合亲和力使用BIACORE仪器(GEHealthcareBiosciencesAB,Uppsala,Sweden),通过表面等离振子共振研究了产生的抗体与各自抗原(例如ANG2和VEGF)的结合。简单来说,针对亲和力测定,经由胺偶联把山羊抗人IgG、JIR109-005-098抗体固定在CM5芯片上,用于呈递抗各自抗原的抗体。在25℃(或备选地在37℃)的HBS缓冲液(HBS-P(10mMHEPES、150mMNaCl、0.005%吐温20、ph7.4)中测定了结合。以在溶液中的不同浓度添加抗原(R&DSystems或内部纯化的)。通过80秒至3分钟的抗原注射测定缔合;通过采用HBS缓冲液洗涤芯片表面3-10分钟来测定解离,并且使用1:1朗缪尔结合模型估测KD值。从样品曲线中减去阴性对照数据(例如缓冲液曲线),用于校正系统固有的基线漂移和用于减少噪声信号。使用各自的BiacoreEvaluationSoftware对传感图进行分析并且计算亲和力数据。实施例1A在一个结合臂中具有VH/VL结构域交换/替换(CrossMAbVh-VL)并且在CH1/CL界面中具有单个带电荷的氨基酸取代的结合血管生成素-2(ANG2)和VEGF的多特异性抗体的生产和表达在第一个实施例中,正如一般方法部分中描述的那样,通过经典的分子生物学技术产生了与人血管生成素-2(ANG2)和人VEGF结合的多特异性抗体,并且如上述在HEK293细胞中瞬时表达。在图1A至C中提供了这些各自的多特异性抗体的一般方案。为了比较,也制备了在CH1/CL界面中没有取代的野生型(wt)VH/VL结构域交换/替换抗体。也使用在CH1CL界面(例如在EP2647707中提到的)中紧邻的其它备选的取代来进行比较。使用包含编码表2a中所描绘的氨基酸序列的核酸的表达质粒表达了多特异性抗体。表2a:具有VH/VL结构域交换/替换(CrossMAbVh-VL)的抗Ang2-VEGF多特异性抗体Ang2VEGF-0273、Ang2VEGF-0396、Ang2VEGF-0397、Ang2VEGF-0394、Ang2VEGF-0395的轻链(LC)和重链(HC)的氨基酸序列:野生型(wt)和单个带电荷的氨基酸取代的不同组合对于所有的构建体,把旋钮入孔异二聚化技术和在第一CH3结构域中典型的旋钮(T366W)取代和在第二CH3结构域中相应的孔取代(T366S、L368A和Y407V)(以及两个另外引入的半胱氨酸残基S354C/Y349’C)(包含在上面描绘的各自相应的重链(HC)序列中)一起使用。实施例1B在一个结合臂中具有VH/VL结构域交换/替换(CrossMAbVh-VL)并且在CH1/CL界面中具有单个带电荷的氨基酸取代的与血管生成素-2(ANG2)和VEGF结合的多特异性抗体的纯化和表征。通过A蛋白亲和层析和大小排阻层析的组合,从上清液中纯化了上面表达的多特异性抗体。所有的多特异性抗体能够以良好的产率生产并且是稳定的。对所获得的产物表征了身份(通过质谱)和分析性质如纯度(通过SDS-PAGE)、单体含量和稳定性。质谱通过去糖基化的完整CrossMab和去糖基化的/纤溶酶消化的或备选地去糖基化的/有限的LysC消化的CrossMab的电喷雾离子化质谱(ESI-MS),分析了预期的一级结构。在磷酸盐或Tris缓冲液中在37℃,采用N-糖苷酶F以1mg/ml的蛋白质浓度把VH/VLCrossMab去糖基化长达17小时。采用在Tris缓冲液pH8中的100μg去糖基化的VH/VLCrossMab进行纤溶酶或有限的LysC(Roche)消化,分别在室温下持续120小时和在37℃持续40分钟。在质谱之前,经由HPLC在SephadexG25柱子(GEHealthcare)上将样品脱盐。经由ESI-MS在装备有TriVersaNanoMate源(Advion)的maXis4GUHR-QTOFMS系统(BrukerDaltonik)上测定总质量。结果显示在表2b中和图4a中。表2b:通过在CH1/CL界面中根据本发明的单一带电荷的氨基酸取代减少主要的本斯·琼斯型副产物。表2b和图4a中的结果显示:根据本发明/正如关于本发明描述的那样,在CH1和CL结构域中具有单个带电荷的氨基酸被相反电荷取代(CL:Q124K和CH1:K147E对;或CL:Q124K和CH1:K213E对),当与没有这样的取代的野生型多特异性抗体相比时,主要副产物(本斯·琼斯型错配)被强有力地减少了(~减少17%)。在紧邻近处的其它取代(CL:Q123K和CH1:K147E对;或CL:Q123K和CH1:K213E对)与没有这样的取代的野生型多特异性抗体相比,仅仅轻微地减少了主要副产物(~减少5%)。实施例1C在一个结合臂中具有VH/VL结构域交换/替换(CrossMAbVh-VL)并且在CH1/CL界面中具有单个带电荷的氨基酸取代的与血管生成素-2(ANG2)和VEGF结合的多特异性抗体的抗原结合性质通过评定了前面的实施例1A和1Bd的多特异性抗体与它们各自的靶抗原(即ANG2和VEGF)的结合。按照下列方法评定了VEGF结合使用T200仪器(GEHealthcare),通过表面等离振子共振研究了所指示的抗体与人VEGFA-121的结合。在pH5.0,通过使用由GEHealthcare提供的胺偶联试剂盒,使10000(RU)左右的抗His抗体(1μg/ml抗His抗体;订单代码:28995056;GEHealthcareBio-SciencesAB,Sweden)偶联到SCM5系列芯片(GEHealthcareBR-1005-30)上。在固定程序期间,使用HBS-N(pH7.4的10mMHEPES、150mMNaCl,GEHealthcare)作为运行缓冲液。对于下列动力学表征,样品和运行缓冲液是pH7.4的PBS-T(包含0.05%Tween20的10mM磷酸缓冲盐水)。把流动池设定到25℃并且把样品阻断设定到12℃以及在动力学表征之前,采用运行缓冲液引发两次。通过以5μl/分钟的流速注射0.5μg/ml溶液30秒,捕获了VEFGA-121-His。通过以1:3的系列稀释度,从1000nM开始,以30μl/分钟的流速,以在溶液中的不同浓度注射所指示的抗体180秒,测定了缔合。通过从样品溶液转换到运行缓冲液来监测解离阶段长达600秒和触发解离阶段。通过以30μl/分钟的流速,用pH1.5的甘氨酸溶液洗涤60秒来再生表面。通过减去从抗His抗体表面获得的应答,校正了本体折射率差。也减去了空白注射(=双参考)。为了计算KD和其它动力学参数,使用了朗缪尔1:1模型。按照下列步骤评定了Ang-2结合:使用T200仪器(GEHealthcare),通过表面等离振子共振研究了所指示的抗体与人Ang-2-RBD-Fc的结合。在pH5.0,通过使用由GEHealthcare提供的胺偶联试剂盒,使8000(RU)左右的山羊抗人F(ab’)2(10μg/ml抗人F(ab)’2;订单代码:28958325;GEHealthcareBio-SciencesAB,Sweden)偶联到SCM5系列芯片(GEHealthcareBR-1005-30)上。在固定化程序期间,使用HBS-N(pH7.4的10mMHEPES、150mMNaCl,GEHealthcare)作为运行缓冲液。对于下列动力学表征,样品和运行缓冲液是处于pH7.4的PBS-T(包含0.05%Tween20的10mM磷酸缓冲盐水)。把流动池设定到25℃并且把样品区组设定到12℃以及在动力学表征之前,采用运行缓冲液引发两次。通过以5μl/分钟的流速注射5nM溶液25秒,捕获了双特异性抗体。通过以1:3的系列稀释度从100nM开始,以30μl/分钟的流速,以在溶液中的不同浓度注射人Ang2-RBD-Fc120秒,测定了缔合。通过从样品溶液转换到运行缓冲液来监测解离阶段长达180秒和触发解离阶段。通过以30μl/分钟的流速,用pH2.1的甘氨酸溶液洗涤60秒来再生表面。通过减去从山羊抗人F(ab’)2表面获得的应答,校正了本体折射率差。也减去了空白注射(=双参考)。为了计算表观KD,使用了朗缪尔1:1模型。像比较实施例那样,平行地评估了包含VH/VL结构域交换/替换但是缺乏带电荷的氨基酸取代(表2b的Ang2VEGF-0273抗体)的特异性结合Ang2和VEGF的参考抗体。在表2c和2d中指示了结果。表2c:所指示的抗体对于VEGF的亲和力表2d:所指示的抗体对于Ang2的亲和力所有测试的抗体都与靶Ang2和VEGF这两者特异性地结合,并且展示在纳摩尔范围中的抗原亲和力。实施例1D在一个结合臂中具有VH/VL结构域交换/替换(CrossMAbVh-VL)并且在CH1/CL界面中具有单个带电荷的氨基酸取代的与血管生成素-2(ANG2)和VEGF结合的多特异性抗体的稳定性为了评定抗体构建体的稳定性,按照下列方法评定了热稳定性以及聚集开始温度。制备了在pH6.0的20mM组氨酸/氯化组氨酸,140mMNaCl中的处于1mg/mL浓度的所指示的抗体的样品,将其转移到10μL微样品池阵列中,并且采用Optim1000仪器(AvactaInc.),当以0.1℃/分钟的速率把样品从25℃加热到90℃时,记录静态光散射数据以及在采用266nm激光激发时的荧光数据。把聚集开始温度(Tagg)定义为散射光强度开始增大时的温度。把熔解温度(Tm)定义为在荧光强度对波长图中的拐点。结果显示在表2e中。表2e:所指示的抗体的聚集开始温度(Tagg)和熔解温度(Tm)样品Tagg(℃)Tm(℃)Ang2VEGF-027356.061.3Ang2VEGF-039656.962.0Ang2VEGF-039756.061.7Ang2VEGF-039456.962.2Ang2VEGF-039556.862.1实施例1E在一个结合臂中具有VH/VL结构域交换/替换(CrossMAbVh-VL)并且在CH1/CL界面中具有单个带电荷的氨基酸取代的与血管生成素-2(ANG2)和VEGF结合的多特异性抗体的生产产率在A蛋白纯化(ProtA)以后,评定了所指示的多特异性抗体的生产产率。结果显示在表2f中。表2f:所指示的抗体的生产产率[mg/L上清液]样品A蛋白Ang2VEGF-027365Ang2VEGF-039680.8Ang2VEGF-039768.4Ang2VEGF-039479.2Ang2VEGF-039593.6实施例2A在一个结合臂中具有VH/VL结构域交换/替换(CrossMAbVh-VL)并且在CH1/CL界面中具有不同的带电荷的氨基酸取代的与血管生成素-2(ANG2)和VEGF结合的多特异性抗体的生产和表达在第一个实施例中,正如一般方法部分中描述的那样,通过经典的分子生物学技术产生了与人血管生成素-2(ANG2)和人VEGF结合的多特异性抗体,并且如上述在HEK293细胞中瞬时表达。在图1A至C中提供了这些各自的多特异性抗体的一般方案。为了比较,也制备了在CH1/CL界面中没有取代的野生型(wt)VH/VL结构域交换/替换抗体。使用包含编码表3a中所描绘的氨基酸序列的核酸的表达质粒表达了多特异性抗体。表3a:具有VH/VL结构域交换/替换(CrossMAbVh-VL)的抗Ang2-VEGF多特异性抗体Ang2VEGF-0273、Ang2VEGF-0274、Ang2VEGF-0282、Ang2VEGF-0283、Ang2VEGF-0284、Ang2VEGF-0285、Ang2VEGF-0286的轻链(LC)和重链(HC)的氨基酸序列:野生型(wt)和带电荷的氨基酸取代的不同组合对于所有的构建体,把旋钮入孔异二聚化技术和在第一CH3结构域中典型的旋钮(T366W)取代和在第二CH3结构域中相应的孔取代(T366S、L368A和Y407V)(以及两个另外引入的半胱氨酸残基S354C/Y349’C)(包含在上面描绘的各自相应的重链(HC)序列中)一起使用。实施例2B在一个结合臂中具有VH/VL结构域交换/替换(CrossMAbVh-VL)并且在CH1/CL界面中具有不同的带电荷的氨基酸取代的与血管生成素-2(ANG2)和VEGF结合的多特异性抗体的纯化和表征通过A蛋白亲和层析和大小排阻层析的组合,从上清液中纯化了上面表达的多特异性抗体。能够以良好的产率生产所有的多特异性抗体并且所有的多特异性抗体是稳定的。对所获得的产物表征了身份(通过质谱)和分析性质如纯度(通过SDS-PAGE)、单体含量和稳定性。质谱通过去糖基化的完整CrossMab和去糖基化的/纤溶酶消化的或备选地去糖基化的/有限的LysC消化的CrossMab的电喷雾离子化质谱(ESI-MS),分析了预期的一级结构。在磷酸盐或Tris缓冲液中在37℃,采用N-糖苷酶F以1mg/ml的蛋白质浓度把VH/VLCrossMab去糖基化长达17小时。采用在Tris缓冲液pH8中的100μg去糖基化的VH/VLCrossMab进行纤溶酶或有限的LysC(Roche)消化,分别在室温下持续120小时和在37℃持续40分钟。在质谱之前,经由HPLC在SephadexG25柱子(GEHealthcare)上将样品脱盐。经由ESI-MS在装备有TriVersaNanoMate源(Advion)的maXis4GUHR-QTOFMS系统(BrukerDaltonik)上测定总质量。结果显示在表中3b和图5a中。表3b:通过在CH1/CL界面中根据本发明的单一带电荷的氨基酸取代减少主要的本斯·琼斯型副产物表3b和图5a中的结果表明根据本发明/正如关于本发明所描述的那样,在CH1和CL结构域中具有带电荷的氨基酸被相反电荷取代的双取代(CL:Q124K/E123K和CH1:K147E/K213E;CL:Q124R/E123K和CH1:K147E/K213E;CL:Q124R/E123K和CH1:K147E/K213D),当与没有这样的取代的野生型多特异性抗体相比时,主要副产物(本斯·琼斯型错配)被完全除去了。这独立于在另一结合臂的CL结构域中进一步单取代Q124E,后者不影响表达也不影响副产物的分布。实施例2C在一个结合臂中具有VH/VL结构域交换/替换(CrossMAbVh-VL)并且在CH1/CL界面中具有不同的带电荷的氨基酸取代的与血管生成素-2(ANG2)和VEGF结合的多特异性抗体的抗原结合性质正如在实施例1C中描绘的那样,通过评定了前面的实施例2A和2B的多特异性抗体与它们各自的靶抗原(即ANG2和VEGF)的结合。像比较实施例那样,平行地评定了包含VH/VL结构域交换/替换但是缺乏带电荷的氨基酸取代(表2b的Ang2VEGF-0273抗体)的与Ang2和VEGF特异性地结合的参考抗体。在表3c和3d中给出了结果。表3c:所指示的抗体对于VEGF的亲和力表3d:所指示的抗体对于Ang2的亲和力样品KD(nM)Ang2VEGF-027315Ang2VEGF-027417Ang2VEGF-028214Ang2VEGF-028315Ang2VEGF-028413Ang2VEGF-028514Ang2VEGF-028612所有测试的抗体都与靶Ang2和VEGF这两者特异性地结合,并且展示在纳摩尔范围中的抗原亲和力。实施例2D在一个结合臂中具有VH/VL结构域交换/替换(CrossMAbVh-VL)并且在CH1/CL界面中具有单个带电荷的氨基酸取代的与血管生成素-2(ANG2)和VEGF结合的多特异性抗体的稳定性为了评定抗体构建体的稳定性,正如在实施例1D中描绘的那样,评定了热稳定性以及聚集开始温度。将结果显示在表3e中。表3e:所指示的抗体的聚集开始温度(Tagg)和熔解温度(Tm)样品Tagg(℃)Tm(℃)Ang2VEGF-027356.061.3Ang2VEGF-027453.558.9Ang2VEGF-028256.961.4Ang2VEGF-028356.361.0Ang2VEGF-028456.361.1Ang2VEGF-028556.361.1Ang2VEGF-028656.361.6实施例3A在一个结合臂中具有VH/VL结构域交换/替换(CrossMAbVh-VL)并且在CH1/CL界面中具有不同的带电荷的氨基酸取代的与IL-17和TWEAK结合的多特异性抗体的生产和表达在第一个实施例中,正如一般方法部分中描述的那样,通过经典的分子生物学技术产生了与人IL-17和人TWEAK结合的多特异性抗体,并且如上述在HEK293细胞中瞬时表达。在图1A至C中提供了这些各自的多特异性抗体的一般方案。为了比较,也制备了在CH1/CL界面中没有取代的野生型(wt)VH/VL结构域交换/替换抗体。使用包含编码表4a中所描绘的氨基酸序列的核酸的表达质粒表达了多特异性抗体。表4a:具有VH/VL结构域交换/替换(CrossMAbVh-VL)的抗TWEAK-IL17多特异性抗体TweakIL17-0096、TweakIL17-0097、TweakIL17-0098、TweakIL17-0099、TweakIL17-0100、TweakIL17-0101的轻链(LC)和重链(HC)的氨基酸序列:野生型(wt)和带电荷的氨基酸取代的不同组合对于所有的构建体,把旋钮入孔异二聚化技术和在第一CH3结构域中典型的旋钮(T366W)取代和在第二CH3结构域中相应的孔取代(T366S、L368A和Y407V)(以及两个另外引入的半胱氨酸残基S354C/Y349’C)(包含在上面描绘的各自相应的重链(HC)序列中)一起使用。实施例3B在一个结合臂中具有VH/VL结构域交换/替换(CrossMAbVh-VL)并且在CH1/CL界面中具有不同的带电荷的氨基酸取代的与IL-17和TWEAK结合的多特异性抗体的纯化和表征通过A蛋白亲和层析和大小排阻层析的组合,从上清液中纯化了上面表达的多特异性抗体。能够以良好的产率生产所有的多特异性抗体并且所有的多特异性抗体是稳定的。对所获得的产物表征了身份(通过质谱)和分析性质如纯度(通过SDS-PAGE)、单体含量和稳定性。质谱通过去糖基化的完整CrossMab和去糖基化的/纤溶酶消化的或备选地去糖基化的/有限的LysC消化的CrossMab的电喷雾离子化质谱(ESI-MS),分析了预期的一级结构。在磷酸盐或Tris缓冲液中在37℃,采用N-糖苷酶F以1mg/ml的蛋白质浓度把VH/VLCrossMab去糖基化长达17小时。采用在Tris缓冲液pH8中的100μg去糖基化的VH/VLCrossMab进行纤溶酶或有限的LysC(Roche)消化,分别在室温下持续120小时和在37℃持续40分钟。在质谱之前,经由HPLC在SephadexG25柱子(GEHealthcare)上将样品脱盐。经由ESI-MS在装备有TriVersaNanoMate源(Advion)的maXis4GUHR-QTOFMS系统(BrukerDaltonik)上测定总质量。将结果显示在表中4b和图6a中。表4b:通过在CH1/CL界面中根据本发明的单一带电荷的氨基酸取代减少主要的本斯·琼斯型副产物表2b和图6a中的结果表明根据本发明/正如关于本发明所描述的那样,在CH1和CL结构域中具有带电荷的氨基酸被相反电荷取代的双取代(CL:Q124K/E123R和CH1:K147E/K213E;CL:Q124K/E123R和CH1:K147E/K213D;CL:Q124K/E123K和CH1:K147E/K213E),当与没有这样的取代的野生型多特异性抗体相比时,主要副产物(本斯·琼斯型错配)被完全除去了。这独立于在另一结合臂的CL结构域中进一步单取代Q124E,后者不影响表达也不影响副产物的分布。实施例4A与Ang2和VEGF结合的二价和三价多特异性抗体的生产和表达,其中抗体缺乏Fc片段并且在一个结合臂中包含VH/VL结构域交换/替换并且在CH1/CL界面中包含一个或更多个带电荷的氨基酸取代在进一步的实施例中,正如一般方法部分中描述的那样,通过经典的分子生物学技术产生了与人Ang2和人VEGF结合的多特异性抗体并且如上述在HEK293细胞中瞬时表达。所产生的抗体在其结合臂中包含与VEGF特异性地结合的具有VH/VL结构域交换的Fab片段并且在其另一个结合臂中包含与Ang2特异性地结合的没有结构域交换的Fab片段,同时所述多特异性抗体缺乏Fc片段。相应地,第一轻链源自于与人Ang2特异性地结合的抗体并且从N端到C端方向包含结构域VL-CL。经由甘氨酸-丝氨酸肽接头,把第一(抗Ang2)和第二(抗VEGF)抗体的重链连接。在与VEGF特异性地结合的抗体的重链中,原始可变结构域VH被来源于抗VEGF抗体的可变域VL替换。因此,包含抗Ang2和抗VEGF抗体的重链的多肽从N端到C端方向包含结构域VH(Ang2)-CH1(Ang2)-接头-VL(VEGF)-CH1(VEGF)。在与人VEGF特异性地结合的轻链中,原始可变结构域VL被来源于抗VEGF抗体的可变域VH替换。因此,抗VEGF抗体的修饰的轻链从N端到C端方向包含结构域VH-CL。在图5b中指示了在CH1/CL界面中不同的氨基酸的取代。在这个实施例中,产生了三个通用结构的多特异性抗体:i)CrossFabVH-VL-(Fab)形式的二价多特异性的Ang2-VEGF双特异性抗体(图7D中指示的通用结构);ii)(CrossFabVH-VL)2-Fab形式的三价多特异性的Ang2-VEGF双特异性抗体(图8C(neu)中指示的通用结构);iii)(Fab)2-CrossFabVH-VL形式的三价多特异性的Ang2-VEGF双特异性抗体(图8D中指示的通用结构);为了比较,也制备了在CH1/CL界面中没有取代的野生型(wt)VH/VL结构域交换/替换抗体。使用包含编码表5a中描绘的氨基酸序列的核酸的表达质粒,来表达多特异性抗体。表5a:具有VH/VL结构域交换/替换的抗Ang2-VEGF多特异性抗体的轻链(LC)和重链(HC)的氨基酸序列:野生型(“不带电的”)和带电荷的氨基酸取代(“带电荷的”)的不同组合表5b:在表5a中提到的根据本发明的抗体中,在CH1/CL界面中的氨基酸取代实施例4B:与Ang2和VEGF结合的二价和三价多特异性抗体的生产和表达,其中所述抗体缺乏Fc片段并且在一个结合臂中包含VH/VL结构域交换/替换并且在CH1/CL界面中包含不同的带电荷的氨基酸取代使用亲和纯化,通过标准程序纯化分泌的蛋白质。在表5c中指示了通过分析性大小排阻层析测定的抗体分子的亲和纯化以后的生产产率和级分。表5c:在亲和纯化以后的生产产率和想要的抗体级分质谱:通过去糖基化的完整抗体和去糖基化的/纤溶酶消化的或备选地去糖基化的/有限的LysC消化的抗体的电喷雾离子化质谱(ESI-MS),分析了预期的一级结构。在磷酸盐或Tris缓冲液中在37℃,采用N-糖苷酶F以1mg/ml的蛋白质浓度把VH/VLFab-CrossFab构建体去糖基化长达17小时。采用在pH8的Tris缓冲液中的100μg去糖基化的VH/VLFab-CrossFab进行纤溶酶或有限的LysC(Roche)消化,分别在室温下持续120小时和在37℃持续40分钟。在质谱之前,经由HPLC在SephadexG25柱子(GEHealthcare)上将样品脱盐。经由ESI-MS在装备有TriVersaNanoMate源(Advion)的maXis4GUHR-QTOFMS系统(BrukerDaltonik)上测定总质量。由于在提供的物质和我们的MS方法之间重叠的质量范围,采用两种不同的方法取得了样品,以便在更大的质量范围中观察潜在的副产物。当在较大的质量范围(1000-4000m/z)中运行时,该方法包括CID电压(在这种情况下,90的cCID),在较低的质量范围(600-2000)中,测定不使用CID。由于应用CID,有更高的获得片段的机会,这些片段按照顺序出现在质谱仪中的源片段化中。将结果显示在表5d中。表5d:相对于想要的主要分子定量的通过MS分析的所指示的抗体的副产物实施例4C与ANG2和VEGF结合的二价和三价多特异性抗体的抗原结合性质,其中抗体缺乏Fc片段并且在一个结合臂中包含VH/VL结构域交换/替换并且在CH1/CL界面中包含不同的带电荷的氨基酸取代通过评定了前面的实施例4A和4B的多特异性抗体与它们各自的靶抗原(即ANG2和VEGF)的结合。按照下列方法评定了VEGF结合使用T200仪器(GEHealthcare),通过表面等离振子共振研究了所指示的抗体与人VEGFA-121的结合。在pH5.0,通过使用由GEHealthcare提供的胺偶联试剂盒,目的是使50RU的VEFGA-121-His偶联到SC1系列芯片(GEHealthcareBR-1005-35)上。在固定化程序期间,使用HBS-N(pH7.4的10mMHEPES、150mMNaCl,GEHealthcare)作为运行缓冲液。对于下列动力学表征,样品和运行缓冲液是pH7.4的PBS-T(包含0.05%Tween20的10mM磷酸缓冲盐水)。把流动池设定到25℃并且把样品区组设定到12℃以及在动力学表征之前,采用运行缓冲液引发两次。通过以30μl/分钟的流速,以1:3的系列稀释度,从100nM开始,以在溶液中的不同浓度注射所指示的抗体180秒,测定了缔合。通过样品溶液转换到运行缓冲液来监测解离阶段长达300秒并且触发解离阶段。通过以30μl/分钟的流速,用0.85%H3PO4(磷酸)溶液洗涤30秒来再生表面。通过减去从抗His抗体表面获得的应答,校正了本体折射率差。也减去了空白注射(=双参考)。为了计算KD和其它动力学参数,使用了朗缪尔1:1模型。按照下列步骤评定了Ang-2结合:使用T200仪器(GEHealthcare),通过表面等离振子共振研究了所指示的抗体与人Ang-2-RBD-Fc的结合。在pH5.0,通过使用由GEHealthcare提供的胺偶联试剂盒,使8000(RU)左右的山羊抗人F(ab’)2(10μg/ml抗人F(ab)’2;订单代码:28958325;GEHealthcareBio-SciencesAB,Sweden)偶联到SCM5系列芯片(GEHealthcareBR-1005-30)上。在固定化程序期间,使用HBS-N(pH7.4的10mMHEPES、150mMNaCl,GEHealthcare)作为运行缓冲液。对于下列动力学表征,样品和运行缓冲液是处于pH7.4的PBS-T(包含0.05%Tween20的10mM磷酸缓冲盐水)。把流动池设定到25℃并且把样品区组设定到12℃以及在动力学表征之前,采用运行缓冲液引发两次。通过以5μL/分钟的流速注射5nM溶液持续25秒,捕获了双特异性抗体。通过以30μl/分钟的流速,从100nM开始,以1:3的系列稀释度,以在溶液中的不同浓度注射人Ang2-RBD-Fc120秒,测定了缔合。通过从样品溶液转换到运行缓冲液来监测解离阶段长达180秒和触发解离阶段。通过以30μl/分钟的流速,用pH2.1的甘氨酸溶液洗涤60秒来再生表面。通过减去从山羊抗人F(ab’)2表面获得的应答,校正了本体折射率差。也减去了空白注射(=双参考)。为了计算表观KD和其它动力学参数,使用了朗缪尔1:1模型。在表5e和5f中指示了结果。表5e:所指示的抗体对于VEGF的亲和力抗体KD(nM)Ang2VEGF-04520.35Ang2VEGF-04470.36Ang2VEGF-04530.22Ang2VEGF-04480.18表5f:所指示的抗体对于Ang2的亲和力抗体KD(nM)Ang2VEGF-04523Ang2VEGF-04473Ang2VEGF-04535Ang2VEGF-04484抗原结合没有被在不含Fc的抗体的CH1/CL界面中引入的突变削弱。实施例5A:在VEGF结合臂中具有VH/VL结构域交换/替换(CrossMAbVh-VL)并且在VEGF结合臂的CH1/CL界面中具有不同的带电荷的氨基酸取代的与血管生成素-2(ANG2)和VEGF结合的多特异性抗体的生产和表达在进一步的实施例中,正如一般方法部分中描述的那样,通过经典的分子生物学技术产生了与人血管生成素-2(ANG2)和人VEGF结合的多特异性抗体,并且如上在HEK293细胞中瞬时表达。在图1B中提供了这些各自的多特异性抗体的一般方案,该图指示在包含VH/VL结构域交换/替换的结合臂的CH1/CL界面之内存在不同的带电荷的氨基酸取代。为了比较,也制备了在CH1/CL界面中没有取代的野生型(wt)VH/VL结构域交换/替换抗体。使用包含编码表6a中所描绘的氨基酸序列的核酸的表达质粒表达了多特异性抗体。表6a:具有VH/VL结构域交换/替换(CrossMAbVh-VL)的抗Ang2-VEGF多特异性抗体Ang2VEGF-0273、Ang2VEGF-0425和Ang2VEGF-0424的轻链(LC)和重链(HC)的氨基酸序列:野生型(wt)和带电荷的氨基酸取代的不同组合对于所有的构建体,把旋钮入孔异二聚化技术和在第一CH3结构域中典型的旋钮(T366W)取代和在第二CH3结构域中相应的孔取代(T366S、L368A和Y407V)(以及两个另外引入的半胱氨酸残基S354C/Y349’C)(包含在上面描绘的各自相应的重链(HC)序列中)一起使用。实施例5B在一个结合臂中具有VH/VL结构域交换/替换(CrossMAbVh-VL)并且在CH1/CL界面中具有不同的带电荷的氨基酸取代的与血管生成素-2(ANG2)和VEGF结合的多特异性抗体的纯化和表征通过A蛋白亲和层析和大小排阻层析的组合,从上清液中纯化了上面表达的多特异性抗体。能够以良好的产率生产所有的多特异性抗体并且所有的多特异性抗体是稳定的。对所获得的产物表征了身份(通过质谱)和分析性质如纯度(通过SDS-PAGE)、单体含量和稳定性。质谱通过去糖基化的完整CrossMab和去糖基化的/纤溶酶消化的或备选地去糖基化的/有限的LysC消化的CrossMab的电喷雾离子化质谱(ESI-MS),分析了预期的一级结构。在磷酸盐或Tris缓冲液中在37℃,采用N-糖苷酶F以1mg/ml的蛋白质浓度把VH/VLCrossMab去糖基化长达17小时。采用在Tris缓冲液pH8中的100μg去糖基化的VH/VLCrossMab进行纤溶酶或有限的LysC(Roche)消化,分别在室温下持续120小时和在37℃持续40分钟。在质谱之前,经由HPLC在SephadexG25柱子(GEHealthcare)上将样品脱盐。经由ESI-MS在装备有TriVersaNanoMate源(Advion)的maXis4GUHR-QTOFMS系统(BrukerDaltonik)上测定总质量。将结果显示在表6b中。表6b:由在包含VH/VL结构域交换/替换的结合臂之内的CH1/CL界面中单个的带电荷的氨基酸取代产生的副产物分布(主要的本斯·琼斯型副产物)表6b中的结果证明:在位于包含VH/VL结构域交换/替换的结合臂之内的CH1/CL界面中,在具有氨基酸取代的Ang2VEGF双特异性抗体中副产物的分布(包含本斯·琼斯型错配)不能被改善。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 与CD56分子特异性结合的多肽及其应用的制造方法与工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺