用于治疗PVNS的抗CSF1R抗体的制作方法
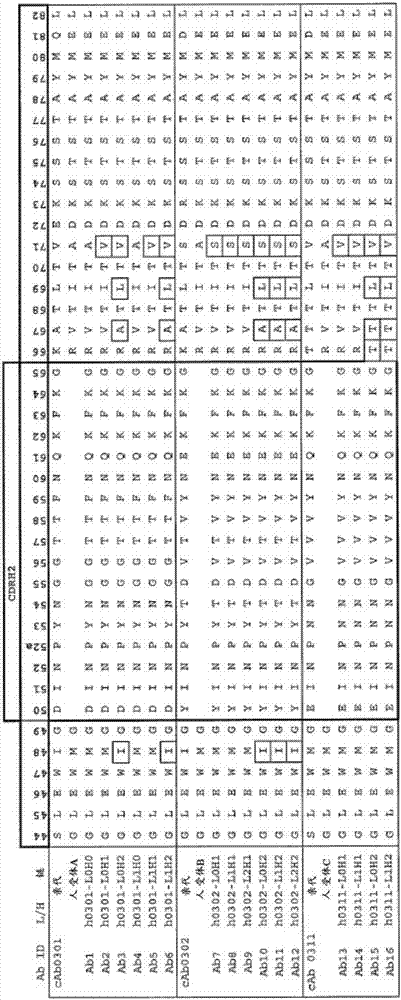
本发明提供使用结合集落刺激因子1受体(csf1r)的抗体治疗色素绒毛结节性滑膜炎(pigmentedvillonodularsynovitis;pvns)的方法。发明背景集落刺激因子1受体(在本文中称为csf1r;在本领域也称为fms、fim2、c-fms、m-csf受体及cd115)是具有n-末端胞外结构域(ecd)及c-末端胞内结构域的拥有酪氨酸激酶活性的单跨膜受体。csf1或白细胞介素34配体(在本文中称为il-34;lin等,science320:807-11(2008))与csf1r的配体结合导致受体二聚化、csf1r蛋白质酪氨酸激酶活性上调、csf1r酪氨酸残基磷酸化及下游信号传导事件。通过csf1或il-34引起的csf1r活化导致单核细胞及巨噬细胞以及其他单核细胞细胞谱系(如破骨细胞、树突细胞及小神经胶质细胞)的运输、存活、增殖及分化。色素绒毛结节性滑膜炎(pvns)是具有反应性炎症及克隆赘瘤性增殖的特征的滑膜实体肿瘤,其中集落刺激因子-1(csf1)是过表达的。csf1基因(1p13)至col6a3启动子(2q35)的常见转座存在于大约60%的pvns患者中。转座伴有滑膜中的csf1过表达。另外,大约40%的pvns患者在不存在鉴定的csf1转座的情况下具有csf1过表达。pvns及反应性滑膜炎的所有病例中csf1过表达的一致存在表明,csf1在滑膜病理学范畴中具有重要作用且具有在治疗上靶向csf1/csf1r相互作用的实用性。参见west等,2006,proc.natl.acad.sciusa,103:690-695。在pvns中,csf1过表达存在于少数滑膜细胞中,而大部分细胞浸润物表达csf1r而非csf1。将此现象表征为在肿瘤细胞中具有异常csf1表现的肿瘤美化效应(tumor-landscapingeffect),其导致非赘瘤性细胞的异常累积而形成团块。手术是患有局部性pvns的患者的治疗选择。复发发生于8-20%的患者中且通常通过再切除来管控。弥散性腱鞘滑膜巨细胞瘤(tgct/pvns或pvns/dttgct)往往更通常(33-50%)复发且具有更侵略性的临床过程。患者通常是有症状的且在其生命期间需要多个手术程序。对于患有不可切除的疾病或多次复发的患者而言,使用csf1r抑制剂的全身性疗法可帮助延迟或避免手术程序并改善功能结果。参见ravi等,2011,am.j.pathol.,179:240-247。在pvns患者中评估伊马替尼(imatinib)(csf1r的非特异性抑制剂)。纳入了29名来自欧洲、澳大利亚及美国的12个机构的患者。中值年龄为41岁且最常见疾病位点是膝盖(n=17;59%)。两名患者患有肺和/或骨的转移性疾病。根据recist针对19%的总体响应率,27名可评估患者中的5名具有完全(n=1)或部分(n=4)响应。27名患者中的20名(74%)具有稳定疾病。在可评估症状的22名患者中的16名(73%)中发现症状改善。尽管具有高症状改善率及总体有益安全性概貌,但10名患者因毒性或其他原因而中断治疗。或者,需要用于pvns的毒性较小的治疗。发明概述在一些实施方案中,提供了治疗受试者中涉及滑膜关节和/或腱鞘的增生性病症的方法,其包括向该受试者施用有效量的结合csf1r的抗体。在一些实施方案中,增生性病症选自色素绒毛结节性滑膜炎(pvns)、腱鞘的巨细胞瘤(giantcelltumorofthetendonsheath;gctts)及腱鞘滑膜巨细胞瘤(tenosynovialgiantcelltumor;tgct),如弥散性腱鞘滑膜巨细胞瘤(diffusetypetenosynovialgiantcelltumor;dttgct)。在一些实施方案中,所述病症是色素绒毛结节性滑膜炎/弥散性腱鞘滑膜巨细胞瘤(pvns/dttgct)。在一些实施方案中,提供了治疗受试者中色素绒毛结节性滑膜炎(pvns)的方法,其包括向该受试者施用有效量的结合csf1r的抗体。在一些实施方案中,抗体以每周一次、每两周一次、每三周一次或每个月一次施用。在一些实施方案中,抗体以至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少10、至少12、至少15、至少16、至少20、至少30、至少40、至少50或至少100mg/kg的剂量施用。在一些实施方案中,抗体以1、2、3或4mg/kg的剂量施用。在一些实施方案中,在施用至少两个、至少三个、至少四个、至少五个、至少六个、至少七个、至少八个、至少九个或至少十个剂量的结合csf1r的抗体之后,pvns肿瘤体积减小至少30%或至少40%或至少50%或至少60%或至少70%。在一些实施方案中,肿瘤体积是单一关节中的肿瘤体积。在一些实施方案中,单一关节选自髋关节及膝关节。在一些实施方案中,肿瘤体积是受pvns影响的所有关节中的总肿瘤体积。在一些实施方案中,在至少一个剂量的抗体后,受试者经历如下症状改善的一项或多于一项:(a)关节疼痛减小,(b)关节活动范围增加,及(c)关节功能能力增加。在一些实施方案中,在施用第一剂量的抗体之前,受试者接受选自如下的第一治疗:手术滑膜切除术、放射束治疗、放射性同位素滑膜切除术及关节置换。在一些实施方案中,pvns在第一治疗之后复发或进展。在一些实施方案中,抗体在选自如下的治疗之前施用:手术滑膜切除术、放射束治疗、放射性同位素滑膜切除术及关节置换。在一些实施方案中,肿瘤是不可切除的。在一些实施方案中,受试者未接受过使用伊马替尼或尼罗替尼(nilotinib)的先前治疗,而在其他实施方案中,受试者已接受过使用伊马替尼或尼罗替尼的先前治疗。在一些实施方案中,受试者未接受过使用csf1r抑制剂的先前治疗,而在其他实施方案中,受试者已接受过使用csf1r抑制剂的先前治疗。在本文所述的任一组合物或方法中,抗csf1r抗体的抗体重链和/或抗体轻链可具有下文所述的结构。在本文所述的任一组合物或方法中,抗csf1r抗体重链可包含与选自seqidno:9、11、13及39至45的序列至少90%、至少95%、至少97%、至少99%或100%相同的序列。在本文所述的任一方法中,抗csf1r抗体轻链可包含与选自seqidno:10、12、14及46至52的序列至少90%、至少95%、至少97%、至少99%或100%相同的序列。在本文所述的任一组合物或方法中,抗csf1r抗体重链可包含与选自seqidno:9、11、13及39至45的序列至少90%、至少95%、至少97%、至少99%或100%相同的序列,且抗csf1r抗体轻链可包含与选自seqidno:10、12、14及46至52的序列至少90%、至少95%、至少97%、至少99%或100%相同的序列。在本文所述的任一组合物或方法中,抗csf1r抗体hccdr1、hccdr2及hccdr3可包含选自如下的一组序列:(a)seqidno:15、16及17;(b)seqidno:21、22及23;和(c)seqidno:27、28及29。在本文所述的任一组合物或方法中,抗csf1r抗体lccdr1、lccdr2及lccdr3可包含选自如下的一组序列:(a)seqidno:18、19及20;(b)seqidno:24、25及26;和(c)seqidno:30、31及32。在本文所述的任一组合物或方法中,抗csf1r抗体重链可包含hccdr1、hccdr2及hccdr3,其中hccdr1、hccdr2及hccdr3包含选自如下的一组序列:(a)seqidno:15、16及17;(b)seqidno:21、22及23;及(c)seqidno:27、28及29;且轻链可包含lccdr1、lccdr2及lccdr3,其中lccdr1、lccdr2及lccdr3包含选自如下的一组序列:(a)seqidno:18、19及20;(b)seqidno:24、25及26;及(c)seqidno:30、31及32。在本文所述的任一组合物或方法中,抗csf1r抗体可含有:(a)包含与seqidno:9至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:10至少95%、至少97%、至少99%或100%相同的序列的轻链;(b)包含与seqidno:11至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:12至少95%、至少97%、至少99%或100%相同的序列的轻链;(c)包含与seqidno:13至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:14至少95%、至少97%、至少99%或100%相同的序列的轻链;(d)包含与seqidno:39至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:46至少95%、至少97%、至少99%或100%相同的序列的轻链;(e)包含与seqidno:40至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:46至少95%、至少97%、至少99%或100%相同的序列的轻链;(f)包含与seqidno:41至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:46至少95%、至少97%、至少99%或100%相同的序列的轻链;(g)包含与seqidno:39至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:47至少95%、至少97%、至少99%或100%相同的序列的轻链;(h)包含与seqidno:40至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:47至少95%、至少97%、至少99%或100%相同的序列的轻链;(i)包含与seqidno:41至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:47至少95%、至少97%、至少99%或100%相同的序列的轻链;及(j)包含与seqidno:42至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:48至少95%、至少97%、至少99%或100%相同的序列的轻链;(k)包含与seqidno:42至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:49至少95%、至少97%、至少99%或100%相同的序列的轻链;(1)包含与seqidno:42至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:50至少95%、至少97%、至少99%或100%相同的序列的轻链;(m)包含与seqidno:43至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:48至少95%、至少97%、至少99%或100%相同的序列的轻链;(n)包含与seqidno:43至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:49至少95%、至少97%、至少99%或100%相同的序列的轻链;(o)包含与seqidno:43至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:50至少95%、至少97%、至少99%或100%相同的序列的轻链;(p)包含与seqidno:44至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:51至少95%、至少97%、至少99%或100%相同的序列的轻链;(q)包含与seqidno:44至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:52至少95%、至少97%、至少99%或100%相同的序列的轻链;(r)包含与seqidno:45至少95%、至少97%、至少99%或100%相同的序列的重链及包含与链seqidno:51至少95%、至少97%、至少99%或100%相同的序列的轻;或(s)包含与seqidno:45至少95%、至少97%、至少99%或100%相同的序列的重链及包含与seqidno:52至少95%、至少97%、至少99%或100%相同的序列的轻链。在本文所述的任一组合物或方法中,抗csf1r抗体可包含:(a)重链,其包含具有seqidno:15序列的重链(hc)cdr1、具有seqidno:16序列的hccdr2及具有seqidno:17序列的hccdr3;及轻链,其包含具有seqidno:18序列的轻链(lc)cdr1、具有seqidno:19序列的lccdr2及具有seqidno:20序列的lccdr3;(b)重链,其包含具有seqidno:21序列的重链(hc)cdr1、具有seqidno:22序列的hccdr2及具有seqidno:23序列的hccdr3;及轻链,其包含具有seqidno:24序列的轻链(lc)cdr1、具有seqidno:25序列的lccdr2及具有seqidno:26序列的lccdr3;或(c)重链,其包含具有seqidno:27序列的重链(hc)cdr1、具有seqidno:28序列的hccdr2及具有seqidno:29序列的hccdr3;及轻链,其包含具有seqidno:30序列的轻链(lc)cdr1、具有seqidno:31序列的lccdr2及具有seqidno:32序列的lccdr3。在本文所述的任一组合物或方法中,抗csf1r抗体可含有:(a)包含seqidno:53序列的重链及包含seqidno:60序列的轻链;(b)包含seqidno:53序列的重链及包含seqidno:61序列的轻链;或(c)包含seqidno:58序列的重链及包含seqidno:65序列的轻链。在一些实施方案中,抗体包含重链及轻链,其中所述抗体包含:(a)由seqidno:53序列组成的重链及由seqidno:60序列组成的轻链;(b)由seqidno:53序列组成的重链及由seqidno:61序列组成的轻链;或(c)由seqidno:58序列组成的重链及由seqidno:65序列组成的轻链。在本文所述的任一组合物或方法中,抗csf1r抗体可以是人源化抗体。在本文所述的任一组合物或方法中,抗csf1r抗体可以是huab1、huab2、huab3、huab4、huab5、huab6、huab7、huab8、huab9、huab10、huab11、huab12、huab13、huab14、huab15或huab16的任一项。(参见图1-2)。在本文所述的任一组合物或方法中,抗csf1r抗体可选自fab、fv、scfv、fab’及(fab’)2。在本文所述的任一组合物或方法中,抗csf1r抗体可以是嵌合抗体。在本文所述的任一组合物或方法中,抗csf1r抗体可选自iga、igg及igd。在本文所述的任一组合物或方法中,抗csf1r抗体可以是igg。在本文所述的任一方法中,抗体可以是igg1或igg2。在本文所述的任一组合物或方法中,抗csf1r抗体可结合至人csf1r和/或结合至食蟹猴csf1r。在本文所述的任一组合物或方法中,抗csf1r抗体可阻断与csf1r结合的配体。在本文所述的任一组合物或方法中,抗csf1r抗体可阻断csf1和/或il-34与csf1r的结合。在本文所述的任一组合物或方法中,抗csf1r抗体可阻断csf1及il-34与csf1r的结合。在本文所述的任一组合物或方法中,抗csf1r抗体可抑制配体诱导的csf1r磷酸化。在本文所述的任一组合物或方法中,抗csf1r抗体可抑制csf1和/或il-34诱导的csf1r磷酸化。在本文所述的任一组合物或方法中,抗csf1r抗体可以小于1nm的亲和力(kd)结合至人csf1r。在本文所述的任一组合物或方法中,抗csf1r抗体可抑制在csf1或il-34存在下的单核细胞增殖和/或生存响应。附图简述图1a-c显示了人源化抗体huab1至huab16的每一个的人源化重链可变区的比对,如实施例1中所论述。加框的(boxed)残基是人受体序列中变回相应小鼠残基的氨基酸。图2a-c显示了人源化抗体huab1至huab16的每一个的人源化轻链可变区的比对,如实施例1中所论述。加框的残基是人受体序列中变回相应小鼠残基的氨基酸。图3显示了使用抗体huab1(也称为fpa008)的实施例4和5中所汇总的临床试验的示意图。发明详述本发明提供治疗受试者中的pvns的方法,包括对所述受试者施用抗csf1r抗体。本文所用的各章节标题仅出于组织性目的,而不应视为对所述的主题加以限制。本文所引用的所有参考文献(包含专利申请及公开)出于任何目的通过提述以其整体并入本文。定义除非另有定义,否则结合本发明使用的科学及技术术语应具有本领域普通技术人员通常所理解的含义。另外,除非上下文另有需要,否则单数术语应包括复数形式且复数术语应包含单数形式。与重组dna、寡核苷酸合成、组织培养及转化(例如电穿孔、脂质体转染)、酶促反应及纯化技术相关使用的示例性技术是本领域已知的。许多此类技术及程序阐述于例如sambrook等,molecularcloning:alaboratorymanual(第2版,coldspringharborlaboratorypress,coldspringharbor,n.y.(1989))中以及他处。另外,用于化学合成、化学分析、医药制备、配制和递送及患者治疗的示例性技术也是本领域已知的。在本申请中,除非另有说明,否则使用“或”意指“和/或”。在多项从属权利要求的情况下,使用“或”仅以择一形式引用多于一个的前述独立权利要求或从属权利要求。同样地,除非另有明确说明,否则诸如“元素”或“组分”等术语涵盖包括一个单元的元素及组分和包括一个以上亚单元的元素及组分两种情况。应理解,除非另有说明,否则本公开内容所用的下列术语具有如下含义:术语“核酸分子”及“多核苷酸”可互换使用,且是指核苷酸聚合物。此类核苷酸聚合物可含有天然和/或非天然核苷酸,且包括但不限于dna、rna及pna。“核酸序列”是指核苷酸的的线性序列,包括核酸分子或多核苷酸。术语“多肽”及“蛋白”可互换使用且是指氨基酸残基的聚合物,且不限于最小长度。此类氨基酸残基聚合物可含有天然或非天然氨基酸残基,且包括但不限于肽、寡肽、氨基酸残基的二聚体、三聚体及多聚体。该定义涵盖全长蛋白与其片段二者。该术语还包括多肽的表达后修饰,例如糖基化、唾液酸化、乙酰基化、磷酸化等等。此外,出于本发明目的,“多肽”是指包含对天然序列的修饰(例如缺失、添加及取代(通常为保守性质))的蛋白,只要该蛋白维持所需的活性。此类修饰可以是故意进行的,如经由定点诱变,或可以是偶然发生,例如经由宿主突变,其因pcr扩增而产生蛋白或误差。本文中的术语“csf1r”是指全长csf1r,其包含n-末端ecd、跨膜结构域及胞内酪氨酸激酶结构域,其具有或不具有n-末端前导序列。在一些实施方案中,csf1r是具有seqidno:1或seqidno:2的氨基酸序列的人csf1r。在提及抗csf1r抗体时,术语“阻断结合”配体(例如csf1和/或il-34)及其语法变化形式用于意指抑制csf1r与csf1r配体(例如csf1和/或il-34)之间的相互作用的能力。该抑制可经由任一机制发生,包括直接干扰配体结合(例如因与csf1r上重叠的结合位点)和/或通过改变配体亲和力的抗体诱导csf1r构象变化等。称为“功能性”的抗体及抗体片段的特征在于具有此类性质。本文所用的术语“抗体”是指包含至少重链的互补决定区(cdr)1、cdr2及cdr3和至少轻链的cdr1、cdr2及cdr3的分子,其中该分子能够结合至抗原。术语抗体包括但不限于能够结合抗原的片段(例如fv、单链fv(scfv)、fab、fab’及(fab’)2)。术语抗体还包括但不限于嵌合抗体、人源化抗体及各种物种(如小鼠、人、食蟹猴等)的抗体。在一些实施方案中,抗体包含重链可变区及轻链可变区。在一些实施方案中,抗体包含至少一条包含重链可变区及重链恒定区的至少一部分的重链及至少一条包含轻链可变区及轻链恒定区的至少一部分的轻链。在一些实施方案中,抗体包含两条重链,其中每一重链包含重链可变区及重链恒定区的至少一部分;及两条轻链,其中每一轻链包含轻链可变区及轻链恒定区的至少一部分。如本文中所使用的,单链fv(scfv)或任何包含例如单一多肽链(其包含全部六个cdr(三个重链cdr及三个轻链cdr))的其他抗体视为具有重链及轻链。在一些此类实施方案中,重链是抗体中包含三个重链cdr的区且轻链是抗体中包含三个轻链cdr的区。本文所用的术语“重链可变区”是指包含重链cdr1、框架(fr)2、cdr2、fr3及cdr3的区。在一些实施方案中,重链可变区还包含fr1的至少一部分和/或fr4的至少一部分。在一些实施方案中,重链cdr1对应于kabat残基26至35;重链cdr2对应于kabat残基50至65;且重链cdr3对应于kabat残基95至102。参见例如kabatsequencesofproteinsofimmunologicalinterest(1987和1991,nih,bethesda,md.);及图1。在一些实施方案中,重链cdr1对应于kabat残基31至35;重链cdr2对应于kabat残基50至65;且重链cdr3对应于kabat残基95至102。参见同上。本文所用的术语“重链恒定区”是指包括至少三个重链恒定域ch1、ch2及ch3的区。非限制性的示例性重链恒定区包括γ、δ及α。非限制性的示例性重链恒定区还包括ε及u。每一重链恒定区对应于抗体同种型。例如,包含γ恒定区的抗体是igg抗体,包含δ恒定区的抗体是igd抗体,且包含α恒定区的抗体是iga抗体。此外,包含μ恒定区的抗体是igm抗体,且包含ε恒定区的抗体是ige抗体。某些同种型可进一步再细分成亚类。例如,igg抗体包括但不限于igg1(包含γ1恒定区)、igg2(包含γ2恒定区)、igg3(包含γ3恒定区)及igg4(包含γ4恒定区)抗体;iga抗体包括但不限于iga1(包含α1恒定区)及iga2(包含α2恒定区)抗体;且igm抗体包括但不限于igm1及igm2。在一些实施方案中,重链恒定区包含一个或多个赋予抗体期望的特性的突变(或取代)、添加或缺失。非限制性的示例性突变是igg4铰链区(在恒定域ch1与ch2之间)中的s241p突变,其将igg4基序cpscp改变为cppcp,后者类似于igg1中的相应基序。在一些实施方案中,该突变产生更稳定的igg4抗体。参见例如angal等,mol.immunol.30:105-108(1993);bloom等,prot.sci.6:407-415(1997);schuurman等,mol.immunol.38:1-8(2001)。本文所用的术语“重链”是指至少包含重链可变区且具有或不具有前导序列的多肽。在一些实施方案中,重链包含重链恒定区的至少一部分。本文所用的术语“全长重链”是指包含重链可变区及重链恒定区且具有或不具有前导序列的多肽。本文所用的术语“轻链可变区”是指包含轻链cdr1、框架(fr)2、cdr2、fr3及cdr3的区。在一些实施方案中,轻链可变区还包含fr1和/或fr4。在一些实施方案中,轻链cdr1对应于kabat残基24至34;轻链cdr2对应于kabat残基50至56;且轻链cdr3对应于kabat残基89至97。参见例如kabatsequencesofproteinsofimmunologicalinterest(1987和1991,nih,bethesda,md.);及图1。本文所用的术语“轻链恒定区”是指包含轻链恒定域cl的区。非限制性示例性轻链恒定区包括λ及κ。本文所用的术语“轻链”是指包含至少轻链可变区且具有或不具有前导序列的多肽。在一些实施方案中,轻链包含轻链恒定区的至少一部分。本文所用的术语“全长轻链”是指包含轻链可变区及轻链恒定区且具有或不具有前导序列的多肽。本文所用的“嵌合抗体”是指包括至少一个来自第一物种(例如小鼠、大鼠、食蟹猴等)的可变区及至少一个来自第二物种(例如人、食蟹猴等)的恒定区的抗体。在一些实施方案中,嵌合抗体包含至少一个小鼠可变区及至少一个人恒定区。在一些实施方案中,嵌合抗体包含至少一个食蟹猴可变区及至少一个人恒定区。在一些实施方案中,嵌合抗体包括至少一个大鼠可变区及至少一个小鼠恒定区。在一些实施方案中,嵌合抗体的所有可变区来自第一物种且嵌合抗体的所有恒定区来自第二物种。本文所用的“人源化抗体”是指其中非人可变区的框架区中的至少一个氨基酸被来自人可变区的相应氨基酸替换的抗体。在一些实施方案中,人源化抗体包含至少一个人恒定区或其片段。在一些实施方案中,人源化抗体是fab、scfv、(fab’)2等。本文所用的“cdr移植抗体”是指将第一(非人)物种的互补决定区(cdr)移植于第二(人)物种的框架区(fr)上的人源化抗体。本文所用的“人抗体”是指在人中产生的抗体、在非人动物中产生的包含人免疫球蛋白基因的抗体(如)及选择用于体外方法(如噬菌体展示)的抗体,其中抗体谱(antibodyrepertoire)基于人免疫球蛋白序列。术语“前导序列”是指位于多肽n末端的促进来自哺乳动物细胞的多肽分泌的氨基酸残基序列。前导序列可在将多肽自哺乳动物细胞输出后被切割,形成成熟蛋白质。前导序列可以是天然或合成序列,且其可与其所附接的蛋白异源或同源。示例性的前导序列包括但不限于抗体前导序列,如seqidno:3及4的氨基酸序列,其分别对应于人轻链及重链前导序列。非限制性的示例性前导序列还包括来自异源蛋白的前导序列。在一些实施方案中,抗体缺乏前导序列。在一些实施方案中,抗体包含至少一个前导序列,其可选自天然抗体前导序列及异源前导序列。术语“载体”用于描述可经改造以含有可在宿主细胞中繁殖的一个或多个克隆的多核苷酸的多核苷酸。载体可包含下列组件中的一项或多项:复制起点、一个或多个调控目的多肽的表达的调控序列(例如启动子和/或增强子),和/或一种或多种可选标记物基因(例如抗生素抗性基因及可用于比色测定中的基因,例如β-半乳糖苷酶)。术语“表达载体”是指用于表达宿主细胞中的目的多肽的载体。“宿主细胞”是指可以是或已成为载体或分离的多核苷酸的接受者的细胞。宿主细胞可以是原核细胞或真核细胞。示例性的真核细胞包括哺乳动物细胞,例如灵长类动物或非灵长类动物动物细胞;真菌细胞,例如酵母;植物细胞;及昆虫细胞。非限制性的示例性哺乳动物细胞包括但不限于nso细胞、per.细胞(crucell)及293和cho细胞及其衍生物,如分别为293-6e及dg44细胞。本文所用的术语“分离的”是指自至少一些通常发现于自然界中的组分分离的分子。例如,在自至少一些产生其的细胞中的组分分离时,多肽称为“分离”的。在多肽是在表达之后由细胞分泌的情形下,以物理方式将含有多肽的上清液自产生其的细胞分离视为“分离”多肽。类似地,在多核苷酸并非通常见于自然界中的较大多核苷酸(例如在dna多核苷酸情形下的基因组dna或线粒体dna)中的一部分或是自至少一些产生其的细胞组分(例如在rna多核苷酸情形下)分离时,则其称为“分离的”。因此,含于宿主细胞内部的载体中的dna多核苷酸可称为“分离的”,只要该多核苷酸不是见于自然界中的载体中的。术语“升高的浓度”意指蛋白在受试者特定组织中的相对于对照中(例如一个或多个未患有pvns或本文所述的其他病状的受试者)同一组织的较高浓度。升高的浓度可源自任一机制,例如蛋白质的增加的表达、增加的稳定性、降低的降解、增加的分泌、降低的清除等。术语“减少/降低(reduce或reduces)”意指将受试者特定组织中的蛋白水平降低至少10%。在一些实施方案中,药剂(如结合csf1r的抗体)将受试者特定组织中的蛋白水平减少至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%或至少90%。在一些实施方案中,蛋白水平相对于与药剂(例如结合csf1r的抗体)接触之前的蛋白水平是减少的。在用于治疗剂抗性的上下文中时,术语“有抗性的”意指相对于受试者在过去对标准剂量的治疗剂的响应,或相对于患有类似病症的类似受试者对标准剂量的治疗剂的预期反应,对标准剂量的治疗剂具有降低的响应或没有响应。因此,在一些实施方案中,受试者可以是对治疗剂有抗性的,虽然受试者先前未被给予过治疗剂,或受试者可在一个或多个先前时刻在对药剂作出响应之后对治疗剂产生抗性。术语“受试者”及“患者”可在本文中互换使用且是指人。在一些实施方案中,还提供治疗其他哺乳动物(包括但不限于啮齿类动物、猿猴、猫、犬、马、牛、猪、绵羊、山羊、哺乳类实验室动物、哺乳类家畜、哺乳类竞技动物及哺乳类宠物)的方法。本文所用的术语“样品”是指自含有要表征、量化和/或鉴定(例如基于物理、生物化学、化学和/或生理学特性)的细胞和/或其他分子实体的受试者获得或衍生的组合物。示例性样品是组织样品。术语“组织样品”是指自受试者组织获得的相似细胞的集合。组织样品的来源可以是固体组织,如来自新鲜、冷冻和/或储藏的器官或组织样品或活检组织或抽吸物;血液或任何血液组分;体液,例如脑脊液、羊水、腹膜液、滑液或间隙液;来自受试者妊娠或发育的任何时间的细胞。在一些实施方案中,组织样品是滑膜活检组织样品和/或滑液样品。在一些实施方案中,组织样品是滑液样品。组织样品也可以是原代或经培养的细胞或细胞系。任选地,自疾病组织/器官获得组织样品。组织样品可含有不与自然界中的组织天然互混的化合物,如防腐剂、抗凝剂、缓冲剂、固定剂、营养物、抗生素等等。本文所用的“对照样品”或“对照组织”是指自已知或据信未罹患所述受试者所正在治疗的疾病的来源获得的样品、细胞或组织。出于本文目的,组织样品的“截面(section)”意指组织样品的一部分或片段,例如自固体组织样品切割的组织或细胞的薄切片。本文所用的术语“色素绒毛结节性滑膜炎”或“pvns”是指滑膜增厚且在一个或多个关节中过度生长的病状。局部化pvns通常涉及支撑关节的腱且/或发生于关节的一个区域中,而弥散性pvns更为广泛且可涉及整个关节。弥散性pvns通常影响大关节(例如髋和/或膝关节),而局部化(或结节性)pvns通常发生于较小关节(例如手及脚)中。可产生良性生长(有时称为良性肿瘤),从而对毗邻骨造成损伤和/或造成关节炎。本申请中所公开的治疗pvns的方法也可用于治疗涉及滑膜关节及腱鞘的其他增生性病症,例如腱鞘的巨细胞瘤(gctts)及腱鞘滑膜巨细胞瘤(tgct)(例如弥散性腱鞘滑膜巨细胞瘤(dttgct))。在药剂中和、阻断、抑制、消除、减少和/或干扰因子活性(包括在因子是配体时其与一种或多种受体的结合)时,药剂“拮抗”因子活性。本文所用的“治疗”是指治疗性处理及预防性(prophylactic或preventative)措施,其中目标是预防或减缓(减轻)靶病理学病状或病症。在一些实施方案中,术语“治疗”涵盖任何施用或施加用于哺乳动物(包括人)疾病的治疗剂,且包括抑制或减缓疾病或疾病进展;部分地或完全减轻疾病,例如通过引起消退或恢复或修复损失的、缺少的或缺陷的功能;刺激无效过程;或引起疾病平台期以具有降低的严重程度。术语“治疗”还包括降低任一表型特征的严重程度和/或降低该特征的发病率、程度或可能性。需要治疗的那些包含已患有病症的那些以及易于患上病症的那些或要预防病症的那些。术语“有效量”或“治疗有效量”是指有效治疗受试者中疾病或病症的药物量。在一些实施方案中,有效量是指在所需时间段内以所需剂量有效达成期望治疗或预防效应的量。本发明的抗csf1r抗体的治疗有效量可根据诸如以下等因素而有所变化:个体的疾病状态、年龄、性别及体重以及一种或多种抗体在该个体内诱发期望响应的能力。治疗有效量涵盖一种或多种抗体的治疗有益效应胜过其任何毒性或有害效应的量。在一些实施方案中,表述“有效量”是指有效治疗pvns的抗体量。“预防有效量”是指以所需时间段和剂量有效达到期望的预防结果的量。通常但非必须地,因预防剂量是在患病之前或患病早期用于受试者的,故预防有效量会低于治疗有效量。与一种或多种其他治疗剂“组合”施用包括以任何顺序同时(并行)及连续(顺序)施用。“药学上可接受的载剂”是指本领域通常与治疗剂一起使用(其一起包含用于施用于受试者的“药物组合物”)的无毒固体、半固体或液体填充剂、稀释剂、囊封材料、配制物助剂或载剂。药学上可接受的载剂在所用剂量及浓度处对接受者是无毒的且与配制物的其他成份兼容。药学上可接受的载剂适用于所采用的配制物。例如,若治疗剂要经口施用,则载剂可以是凝胶胶囊。若治疗剂要皮下施用,则载剂理想地对皮肤无刺激性且并不引起注射部位反应。抗csf1r抗体抗csf1r抗体包括但不限于人源化抗体、嵌合抗体、小鼠抗体、人抗体及包含本文所述的重链和/或轻链cdr的抗体。示例性人源化抗体在一些实施方案中,提供结合csf1r的人源化抗体。人源化抗体可用作治疗分子,这是由于人源化抗体减少或消除对非人抗体的人免疫响应(例如人抗小鼠抗体(hama)响应),该响应可对抗体治疗剂产生免疫响应,且降低治疗有效性。非限制性的示例性人源化抗体包括本文所述的huab1至huab16。非限制性的示例性人源化抗体还包括含有选自huab1至huab16的抗体的重链可变区和/或选自huab1至huab16的抗体的轻链可变区的抗体。非限制性的示例性人源化抗体包括含有选自seqidno:39至45的重链可变区和/或选自seqidno:46至52的轻链可变区的抗体。示例性人源化抗体还包括但不限于包含选自0301、0302及0311的抗体的重链cdr1、cdr2及cdr3和/或轻链cdr1、cdr2及cdr3的人源化抗体。在一些实施方案中,人源化抗csf1r抗体包含选自0301、0302及0311的抗体的重链cdr1、cdr2及cdr3和/或轻链cdr1、cdr2及cdr3。非限制性的示例性人源化抗csf1r抗体包括含有选自如下一组的重链cdr1、cdr2及cdr3的抗体:seqidno:15、16及17;seqidno:21、22及23;和seqidno:27、28及29。非限制性的示例性人源化抗csf1r抗体还包括含有选自如下的一组轻链cdr1、cdr2及cdr3的抗体:seqidno:18、19及20;seqidno:24、25及26;和seqidno:30、31及32。非限制性的示例性人源化抗csf1r抗体包括含有表1中的重链cdr1、cdr2及cdr3及轻链cdr1、cdr2及cdr3的组的抗体(所显示的seqidno;序列可参见表8)。表1的每一行显示了示例性抗体的重链cdr1、cdr2及cdr3及轻链cdr1、cdr2及cdr3。表1:重链和轻链的cdr其他示例性人源化抗体在一些实施方案中,人源化抗csf1r抗体包含重链,所述重链包含与选自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列,且其中该抗体结合csf1r。在一些实施方案中,人源化抗csf1r抗体包含轻链,所述轻链包含与选自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列,其中该抗体结合csf1r。在一些实施方案中,人源化抗csf1r抗体包含重链,所述重链包含与选自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列;及包含轻链,所述轻链包含与选自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列;其中该抗体结合csf1r。如本文中所使用,可使用例如计算机程序来测定具体多肽(例如)是否与氨基酸序列至少95%相同。在测定具体序列是否与参考序列例如95%相同时,相对于参考氨基酸序列的全长来计算同一性百分比。在一些实施方案中,人源化抗csf1r抗体包括本文所论述的至少一种cdr。换言之,在一些实施方案中,人源化抗csf1r抗体包含至少一个选自本文所论述的重链cdr1、本文所论述的重链cdr2、本文所论述的重链cdr3、本文所论述的轻链cdr1、本文所论述的轻链cdr2及本文所论述的轻链cdr3的cdr。此外,在一些实施方案中,人源化抗csf1r抗体包含至少一个基于本文所论述的cdr的突变cdr,其中突变cdr相对于本文所论述的cdr包括1、2、3或4个氨基酸取代。在一些实施方案中,氨基酸取代的一项或多项是保守氨基酸取代。本领域技术人员能选择一种或多种用于特定cdr序列的适合的保守氨基酸取代,其中适合的保守氨基酸取代预计并不显著改变包括突变cdr的抗体的结合性质。示例性的人源化抗csf1r抗体还包括与本文所述的抗体竞争与csf1r的结合的抗体。因此,在一些实施方案中,提供了与选自fab0301、0302及0311的抗体及那些fab的二价(即具有两条重链及两条轻链)抗体形式竞争与csf1r的结合的人源化抗csf1r抗体。示例性人源化抗体恒定区在一些实施方案中,本文所述的人源化抗体包含一个或多个人恒定区。在一些实施方案中,人重链恒定区是选自iga、igg及igd的同种型的。在一些实施方案中,人轻链恒定区是选自κ及λ的同种型的。在一些实施方案中,本文所述的人源化抗体包含人igg恒定区。在一些实施方案中,本文所述的人源化抗体包含人igg4重链恒定区。在一些此类实施方案中,本文所述的人源化抗体包含人igg4恒定区中的s241p突变。在一些实施方案中,本文所述的人源化抗体包含人igg4恒定区及人κ轻链。重链恒定区的选择可决定抗体是否具有体内效应功能。在一些实施方案中该效应功能包括抗体依赖性细胞介导的细胞毒性作用(adcc)和/或补体依赖性细胞毒性作用(cdc),且可使得杀伤抗体所结合的细胞。在一些治疗方法(包括治疗一些肿瘤的方法)中,例如,在抗体结合至支持肿瘤的维持或生长的细胞时,细胞杀伤可以是期望的。可支持肿瘤的维持或生长的示例性细胞包括但不限于肿瘤细胞本身、有助于将血管募集至肿瘤中的细胞及提供配体、生长因子或支持或促进肿瘤生长或肿瘤存活的反受体的细胞。在一些实施方案中,在期望效应功能时,选择包括人igg1重链或人igg3重链的抗csf1r抗体。在一些治疗方法中,效应功能可能是不期望的。例如,在一些实施方案中,可能期望用于治疗pvns的抗体不具有效应功能。因此,在一些实施方案中,使用缺乏显著效应功能的抗csf1r抗体来治疗pvns。在一些实施方案中,用于治疗pvns的抗csf1r抗体包含人igg4或igg2重链恒定区。在一些实施方案中,igg4恒定区包含s241p突变。抗体可以通过任一方法人源化。人源化的非限制性的示例性方法包括阐述于(例如)以下文献中的方法:美国专利第5,530,101号;第5,585,089号;第5,693,761号;第5,693,762号;第6,180,370号;jones等,nature321:522-525(1986);riechmann等,nature332:323-27(1988);verhoeyen等,science239:1534-36(1988);及美国公开第us2009/0136500号。如上所述,人源化抗体是这样的抗体,所述抗体中非人可变区的框架区中的至少一个氨基酸由来自人框架区中相应位置的氨基酸代替。在一些实施方案中,非人可变区的框架区中的至少两个、至少三个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少15个或至少20个氨基酸由来自一个或多个人框架区中一个或多个相应位置的氨基酸代替。在一些实施方案中,用于取代的一些相应的人氨基酸来自不同的人免疫球蛋白基因的框架区。即,在一些此类实施方案中,非人氨基酸的一个或多个可由来自第一人抗体的人框架区的相应氨基酸代替或由第一人免疫球蛋白基因编码,非人氨基酸的一个或多个可由来自第二人抗体的人框架区的相应氨基酸代替或由第二人免疫球蛋白基因编码,非人氨基酸的一个或多个可由来自第三人抗体的人框架区的相应氨基酸代替或由第三人免疫球蛋白基因编码,等等。此外,在一些实施方案中,所有用于单一框架区(例如fr2)中的取代的相应人氨基酸无需来自同一人框架。然而,在一些实施方案中,所有用于取代的相应人氨基酸都来自同一人抗体或由同一人免疫球蛋白基因编码。在一些实施方案中,通过使用相应的人框架区代替一个或多个整个框架区来将抗体人源化。在一些实施方案中,选择与所代替的非人框架区具有最高同源性水平的人框架区。在一些实施方案中,该人源化抗体是cdr移植抗体。在一些实施方案中,在cdr移植后,一个或多个框架氨基酸变回小鼠框架区中的相应氨基酸。在一些实施方案中,进行此类“回复突变”以保留一种或多种看起来有助于一个或多个cdr的结构和/或可涉及抗原接触和/或似乎涉及抗体的总体结构完整性的小鼠框架氨基酸。在一些实施方案中,在cdr接枝后,对抗体的框架区进行10个或更少、9个或更少、8个或更少、7个或更少、6个或更少、5个或更少、4个或更少、三个或更少、两个或更少、一个或零个回复突变。在一些实施方案中,人源化抗体也包含人重链恒定区和/或人轻链恒定区。示例性嵌合抗体在一些实施方案中,抗csf1r抗体是嵌合抗体。在一些实施方案中,抗csf1r抗体包含至少一个非人可变区及至少一个人恒定区。在一些此类实施方案中,抗csf1r抗体的所有可变区是非人可变区,且抗csf1r抗体的所有恒定区是人恒定区。在一些实施方案中,嵌合抗体的一个或多个可变区是小鼠可变区。嵌合抗体的人恒定区无需与其所代替的非人恒定区(若存在)是同一同种型。嵌合抗体论述于例如美国专利no.4,816,567号;及morrison等,proc.natl.acad.sci.usa81:6851-55(1984)中。非限制性的示例性嵌合抗体包括含有选自0301、0302及0311的抗体的重链和/或轻链可变区的嵌合抗体。其他非限制性的示例性嵌合抗体包括含有选自0301、0302及0311的抗体的重链cdr1、cdr2及cdr3和/或轻链cdr1、cdr2及cdr3的嵌合抗体。非限制性的示例性嵌合抗csf1r抗体包括含有如下重链及轻链可变区对的抗体:seqidno:9及10;seqidno:11及12;及seqidno:13及14。非限制性的示例性抗csf1r抗体包括含有上表1中所示的重链cdr1、cdr2及cdr3和轻链cdr1、cdr2及cdr3的组的抗体。其他示例性嵌合抗体在一些实施方案中,嵌合抗csf1r抗体包括含有与选自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列的重链,其中该抗体结合csf1r。在一些实施方案中,嵌合抗csf1r抗体包括含有与选自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列的轻链,其中该抗体结合csf1r。在一些实施方案中,嵌合抗csf1r抗体包括含有与选自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列的重链;及含有与选自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列的轻链;其中该抗体结合csf1r。在一些实施方案中,嵌合抗csf1r抗体包含至少一个本文所论述的cdr。即,在一些实施方案中,嵌合抗csf1r抗体包含至少一个选自本文所论述的重链cdr1、本文所论述的重链cdr2、本文所论述的重链cdr3、本文所论述的轻链cdr1、本文所论述的轻链cdr2及本文所论述的轻链cdr3的cdr。此外,在一些实施方案中,嵌合抗csf1r抗体包含至少一个基于本文所论述的cdr的突变cdr,其中所述突变cdr相对于本文所论述的cdr包含1、2、3或4个氨基酸取代。在一些实施方案中,氨基酸取代的一个或多个是保守氨基酸取代。本领域技术人员可选择一个或多个用于具体cdr序列的适合的保守氨基酸取代,其中预期适合的保守氨基酸取代并不显著改变包括突变cdr的抗体的结合特性。示例性的嵌合抗csf1r抗体还包括与本文所述的抗体竞争与csf1r的结合的嵌合抗体。因此,在一些实施方案中,提供了与选自fab0301、0302及0311的抗体及那些fab的二价(即具有两条重链及两条轻链)抗体形式竞争与csf1r的结合的嵌合抗csf1r抗体。示例性的嵌合抗体恒定区在一些实施方案中,本文所述的嵌合抗体包含一个或多个人恒定区。在一些实施方案中,人重链恒定区是选自iga、igg及igd的同种型的。在一些实施方案中,人轻链恒定区是选自κ及λ的同种型的。在一些实施方案中,本文所述的嵌合抗体包含人igg恒定区。在一些实施方案中,本文所述的嵌合抗体包含人igg4重链恒定区。在一些此类实施方案中,本文所述的嵌合抗体包含人igg4恒定区中的s241p突变。在一些实施方案中,本文所述的嵌合抗体包含人igg4恒定区及人κ轻链。如上所述,效应功能是否是期望的可取决于意欲针对抗体的具体治疗方法。因此,在一些实施方案中,在期望效应功能时,选择包含人igg1重链恒定区或人igg3重链恒定区的嵌合抗csf1r抗体。在一些实施方案中,在不期望效应功能时,选择包含人igg4或igg2重链恒定区的嵌合抗csf1r抗体。示例性的人抗体人抗体可通过任一合适方法制得。非限制性的示例性方法包括在包含人免疫球蛋白基因座的转基因小鼠中制备人抗体。参见例如jakobovits等,proc.natl.acad.sci.usa90:2551-55(1993);jakobovits等,nature362:255-8(1993);lonberg等,nature368:856-9(1994);及美国专利第5,545,807号;第6,713,610号;第6,673,986号;第6,162,963号;第5,545,807号;第6,300,129号;第6,255,458号;第5,877,397号;第5,874,299号;及第5,545,806号。非限制性的示例性方法还包括使用噬菌体展示文库来制备人抗体。参见例如hoogenboom等,j.mol.biol.227:381-8(1992);marks等,j.mol.biol.222:581-97(1991);及pct公开wo99/10494。在一些实施方案中,人抗csf1r抗体结合至具有seqidno:1的序列的多肽。示例性人抗csf1r抗体还包括与本文所述的抗体竞争与csf1r的结合的抗体。因此,在一些实施方案中,提供与选自fab0301、0302及0311的抗体和那些fab的二价(即具有两条重链及两条轻链)抗体形式竞争与csf1r的结合的人抗csf1r抗体。在一些实施方案中,人抗csf1r抗体包含一个或多个人恒定区。在一些实施方案中,人重链恒定区是选自iga、igg及igd的同种型的。在一些实施方案中,人轻链恒定区是选自κ及λ的同种型的。在一些实施方案中,本文所述的人抗体包含人igg恒定区。在一些实施方案中,本文所述的人抗体包含人igg4重链恒定区。在一些此类实施方案中,本文所述的人抗体包含人igg4恒定区中的s241p突变。在一些实施方案中,本文所述的人抗体包含人igg4恒定区及人κ轻链。在一些实施方案中,在期望效应功能时,选择包含人igg1重链恒定区或人igg3重链恒定区的人抗csf1r抗体。在一些实施方案中,在不期望效应功能时,选择包含人igg4或igg2重链恒定区的人抗csf1r抗体。其他示例性抗csf1r抗体示例性的抗csf1r抗体还包括但不限于包含例如本文所述的一个或多个cdr序列的小鼠抗体、人源化抗体、人抗体、嵌合抗体及工程化抗体。在一些实施方案中,抗csf1r抗体包含本文所述的重链可变区。在一些实施方案中,抗csf1r抗体包含本文所述的轻链可变区。在一些实施方案中,抗csf1r抗体包含本文所述的重链可变区及本文所述的轻链可变区。在一些实施方案中,抗csf1r抗体包含本文所述的重链cdr1、cdr2及cdr3。在一些实施方案中,抗csf1r抗体包含本文所述的轻链cdr1、cdr2及cdr3。在一些实施方案中,抗csf1r抗体包含本文所述的重链cdr1、cdr2及cdr3及本文所述的轻链cdr1、cdr2及cdr3。在一些实施方案中,抗csf1r抗体包含选自fab0301、0302及0311的抗体的重链可变区。非限制性的示例性抗csf1r抗体还包括含有选自人源化抗体huab1至huab16的抗体重链可变区的抗体。非限制性的示例性抗csf1r抗体包括含有重链可变区的抗体,所述重链可变区包含选自seqidno:9、11、13及39至45的序列。在一些实施方案中,抗csf1r抗体包含选自fab0301、0302及0311的抗体的轻链可变区。非限制性的示例性抗csf1r抗体还包括含有选自人源化抗体huab1至huab16的抗体的轻链可变区的抗体。非限制性的示例性抗csf1r抗体包括含有轻链可变区的抗体,所述轻链可变区包含选自seqidno:10、12、14及46至52的序列。在一些实施方案中,抗csf1r抗体包含选自fab0301、0302及0311的抗体的重链可变区及轻链可变区。非限制性的示例性抗csf1r抗体还包括含有选自人源化抗体huab1至huab16的抗体的重链可变区及轻链可变区的抗体。非限制性的示例性抗csf1r抗体包括含有如下重链及轻链可变区对的抗体:seqidno:9及10;seqidno:11及12;及seqidno:13及14;seqidno:39及40;seqidno:41及42;seqidno:43及44;seqidno:45及46;seqidno:47及48;seqidno:49及50;及seqidno:51及52。非限制性的示例性抗csf1r抗体还包括含有如下的重链及轻链对的抗体:seqidno:33及34;seqidno:35及36;及seqidno:37及38。在一些实施方案中,抗csf1r抗体包含选自fab0301、0302及0311的抗体的重链cdr1、cdr2及cdr3。非限制性的示例性抗csf1r抗体包括含有选自如下的重链cdr1、cdr2及cdr3的组的抗体:seqidno:15、16及17;seqidno:21、22及23;及seqidno:27、28及29。在一些实施方案中,抗csf1r抗体包含选自fab0301、0302及0311的抗体的轻链cdr1、cdr2及cdr3。非限制性的示例性抗csf1r抗体包括含有选自如下的轻链cdr1、cdr2及cdr3的组的抗体:seqidno:18、19及20;seqidno:24、25及26;及seqidno:30、31及32。在一些实施方案中,抗csf1r抗体包含选自fab0301、0302及0311的抗体的重链cdr1、cdr2及cdr3及轻链cdr1、cdr2及cdr3。非限制性的示例性抗csf1r抗体包括含有上表1中所示的重链cdr1、cdr2及cdr3及轻链cdr1、cdr2及cdr3的组的抗体。其他示例性抗体在一些实施方案中,抗csf1r抗体包含含有与选自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列的重链,其中该抗体结合csf1r。在一些实施方案中,抗csf1r抗体包含含有与选自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列的轻链,其中该抗体结合csf1r。在一些实施方案中,抗csf1r抗体包含含有与选自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列的重链;及含有与选自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列的轻链;其中该抗体结合csf1r。在一些实施方案中,抗csf1r抗体包含本文所论述的至少一个cdr。即,在一些实施方案中,抗csf1r抗体包含至少一个选自本文所论述的重链cdr1、本文所论述的重链cdr2、本文所论述的重链cdr3、本文所论述的轻链cdr1、本文所论述的轻链cdr2及本文所论述的轻链cdr3的cdr。此外,在一些实施方案中,抗csf1r抗体包含至少一个基于本文所论述cdr的突变cdr,其中突变cdr相对于本文所论述的cdr具有1、2、3或4个氨基酸取代。在一些实施方案中,氨基酸取代的一个或多个是保守氨基酸取代。本领域技术人员可选择一种或多种用于具体cdr序列的适合的保守氨基酸取代,其中预期适合的保守氨基酸取代不显著改变包括突变cdr的抗体的结合性质。示例性抗csf1r抗体也包含与本文所述的抗体竞争结合至csf1r的抗体。因此,在一些实施方案中,提供与选自fab0301、0302及0311的抗体及彼等fab的二价(即具有两条重链及两条轻链)抗体形式竞争结合至csf1r的抗csf1r抗体。示例性抗体恒定区在一些实施方案中,本文所述的抗体包含一个或多个人恒定区。在一些实施方案中,人重链恒定区是选自iga、igg及igd的同种型的。在一些实施方案中,人轻链恒定区是选自κ及λ的同种型的。在一些实施方案中,本文所述的抗体包含人igg恒定区。在一些实施方案中,本文所述的抗体包含人igg4重链恒定区。在一些此类实施方案中,本文所述的抗体包含人igg4恒定区中的s241p突变。在一些实施方案中,本文所述的抗体包含人igg4恒定区及人κ轻链。如上所述,效应功能是否是期望的可取决于意欲针对抗体的具体治疗方法。因此,在一些实施方案中,在期望效应功能时,选择包含人igg1重链恒定区或人igg3重链恒定区的抗csf1r抗体。在一些实施方案中,在不期望效应功能时,选择包含人igg4或igg2重链恒定区的抗csf1r抗体。示例性抗-csf1r重链可变区在一些实施方案中,提供抗csf1r抗体重链可变区。在一些实施方案中,抗csf1r抗体重链可变区是小鼠可变区、人可变区或人源化可变区。抗csf1r抗体重链可变区包含重链cdr1、fr2、cdr2、fr3及cdr3。在一些实施方案中,抗csf1r抗体重链可变区进一步包含重链fr1和/或fr4。非限制性的示例性重链可变区包括但不限于具有选自seq1dno:9、11、13及39至45的氨基酸序列的重链可变区。在一些实施方案中,抗csf1r抗体重链可变区包含含有选自seqidno:15、21及27的序列的cdr1。在一些实施方案中,抗csf1r抗体重链可变区包含含有选自seqidno:16、22及28的序列的cdr2。在一些实施方案中,抗csf1r抗体重链可变区包含含有选自seqidno:17、23及29的序列的cdr3。非限制性的示例性重链可变区包括但不限于包含选自如下的cdr1、cdr2及cdr3的组的重链可变区:seqidno:15、16及17;seqidno:21、22及23;及seqidno:27、28及29。在一些实施方案中,抗csf1r抗体重链包含与选自seqidno:9、11、13及39至45的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列,其中所述重链与轻链一起能够形成结合csf1r的抗体。在一些实施方案中,抗csf1r抗体重链包含本文所论述的至少一个cdr。即,在一些实施方案中,抗csf1r抗体重链包含至少一个选自本文所论述的重链cdr1、本文所论述的重链cdr2及本文所论述的重链cdr3的cdr。此外,在一些实施方案中,抗csf1r抗体重链包含至少一个基于本文所论述cdr的突变cdr,其中突变cdr相对于本文所论述的cdr具有1、2、3或4个氨基酸取代。在一些实施方案中,氨基酸取代的一个或多个是保守氨基酸取代。本领域技术人员可选择一种或多种用于具体cdr序列的适合的保守氨基酸取代,其中预期适合的保守氨基酸取代不显著改变包括突变cdr的重链的结合特性。在一些实施方案中,重链包含重链恒定区。在一些实施方案中,重链包含人重链恒定区。在一些实施方案中,人重链恒定区是选自iga、igg及igd的同种型的。在一些实施方案中,人重链恒定区是igg恒定区。在一些实施方案中,重链包含人igg4重链恒定区。在一些此类实施方案中,人igg4重链恒定区包含s241p突变。在一些实施方案中,在期望效应功能时,重链包含人igg1或igg3重链恒定区。在一些实施方案中,在较不期望效应功能时,重链包含人igg4或igg2重链恒定区。示例性抗-csf1r轻链可变区在一些实施方案中,提供抗csf1r抗体轻链可变区。在一些实施方案中,抗csf1r抗体轻链可变区是小鼠可变区、人可变区或人源化可变区。抗csf1r抗体轻链可变区包含轻链cdr1、fr2、cdr2、fr3及cdr3。在一些实施方案中,抗csf1r抗体轻链可变区进一步包含轻链fr1和/或fr4。非限制性的示例性轻链可变区包括具有选自seqidno:10、12、14及46至52的氨基酸序列的轻链可变区。在一些实施方案中,抗csf1r抗体轻链可变区包含含有选自seqidno:18、24及30的序列的cdr1。在一些实施方案中,抗csf1r抗体轻链可变区包含含有选自seqidno:19、25及31的序列的cdr2。在一些实施方案中,抗csf1r抗体轻链可变区包含含有选自seqidno:20、26及32的序列的cdr3。非限制性的示例性轻链可变区包括但不限于包含选自如下的cdr1、cdr2及cdr3的组的轻链可变区:seqidno:18、19及20;seqidno:24、25及26;及seqidno:30、31及32。在一些实施方案中,抗csf1r抗体轻链包含与选自seqidno:10、12、14及46至52的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的可变区序列,其中所述轻链与重链一起能够形成结合csf1r的抗体。在一些实施方案中,抗csf1r抗体轻链包含至少一个本文所论述的cdr。即,在一些实施方案中,抗csf1r抗体轻链包含至少一个选自本文所论述的轻链cdr1、本文所论述的轻链cdr2及本文所论述的轻链cdr3的cdr。此外,在一些实施方案中,抗csf1r抗体轻链包含至少一个基于本文所论述cdr的突变cdr,其中突变cdr相对于本文所论述的cdr具有1、2、3或4个氨基酸取代。在一些实施方案中,氨基酸取代的一个或多个是保守氨基酸取代。本领域技术人员可选择一种或多种用于具体cdr序列的适合的保守氨基酸取代,其中预期适合的保守氨基酸取代不显著改变包括突变cdr的轻链的结合特性。在一些实施方案中,轻链包含人轻链恒定区。在一些实施方案中,人轻链恒定区选自人κ及人λ轻链恒定区。示例性其他csf1r结合分子在一些实施方案中,提供其他结合csf1r的分子。此类分子包括但不限于非经典支架,例如抗运载蛋白(anti-calin)、阿德奈汀(adnectin)、锚蛋白重复序列(ankyrinrepeats)等。参见例如hosse等,prot.sci.15:14(2006);fiedler,m.和skerra,a.,“non-antibodyscaffolds”,第467-499页,handbookoftherapeuticantibodies,dubel,s.编,wiley-vch,weinheim,germany,2007。抗csf1r抗体的示例性特性在一些实施方案中,具有上述结构的抗体以小于1nm的结合亲和力(kd)结合至csf1r,阻断csf1和/或il-34与csf1r的结合,并抑制由csf1和/或il-34诱导的csf1r磷酸化。在一些实施方案中,抗csf1r抗体结合至csf1r的胞外结构域(csf1r-ecd)。在一些实施方案中,抗csf1r抗体对csf1r具有小于1nm、小于0.5nm、小于0.1nm或小于0.05nm的结合亲和力(kd)。在一些实施方案中,抗csf1r抗体具有0.01nm至1nm、0.01nm至0.5nm、0.01nm至0.1nm、0.01nm至0.05nm或0.02nm至0.05nm的kd。在一些实施方案中,抗csf1r抗体阻断配体与csf1r的结合。在一些实施方案中,抗csf1r抗体阻断csf1与csf1r的结合。在一些实施方案中,抗csf1r抗体阻断il-34与csf1r的结合。在一些实施方案中,抗csf1r抗体阻断csf1及il-34与csf1r的结合。在一些实施方案中,阻断配体结合的抗体结合至csf1r的胞外结构域。在一些实施方案中,使用所述分析(例如美国专利no.8,206,715b2的实施例7,其通过提述并入本文用于任何目的),在抗体将配体与csf1r的可检测结合量降低至少50%时,该抗体阻断配体与csf1r的结合。在一些实施方案中,抗体将配体与csf1r的可检测结合量降低至少60%、至少70%、至少80%或至少90%。在一些此类实施方案中,据述抗体将配体结合阻断至少50%、至少60%、至少70%等。在一些实施方案中,抗csf1r抗体抑制配体诱导的csf1r磷酸化。在一些实施方案中,抗csf1r抗体抑制csf1诱导的csf1r磷酸化。在一些实施方案中,抗csf1r抗体抑制il-34诱导的csf1r磷酸化。在一些实施方案中,抗csf1r抗体抑制csf1诱导及il-34诱导的csf1r磷酸化二者。在一些实施方案中,使用所述分析(例如美国专利no.8,206,715b2,实施例6,其通过提述并入本文用于任何目的),在抗体将可检测配体诱导的csf1r磷酸化的量降低至少50%时,将该抗体视为“抑制配体诱导的csf1r磷酸化”。在一些实施方案中,抗体将可检测配体诱导的csf1r磷酸化的量降低至少60%、至少70%、至少80%或至少90%。在一些此类实施方案中,据述抗体将配体诱导的csf1r磷酸化抑制至少50%、至少60%、至少70%等。在一些实施方案中,抗体抑制csf1和/或il-34存在下的单核细胞增殖和/或生存响应。在一些实施方案中,使用所述分析(例如美国专利no.8,206,715b2,实施例10,其通过提述并入本文用于任何目的),在抗体将csf1和/或il-34存在下的单核细胞增殖和/或生存响应的量降低至少50%时,将该抗体视为“抑制单核细胞增殖和/或生存响应”。在一些实施方案中,抗体将csf1和/或il-34存在下的单核细胞增殖和/或生存响应的量降低至少60%、至少70%、至少80%或至少90%。在一些此类实施方案中,据述抗体将单核细胞增殖和/或生存响应抑制至少50%、至少60%、至少70%等。示例性抗体缀合物在一些实施方案中,抗体缀合至标记和/或细胞毒性剂。如本文中所使用,标记是有助于抗体检测和/或有助于抗体所结合分子的检测的部分。非限制性的示例性标记包括但不限于放射性同位素、荧光基团、酶基团、化学发光基团、生物素、表位标签、金属结合标签等。本领域技术人员可根据预期应用来选择合适的标记。如本文中所使用,细胞毒性剂是降低一种或多种细胞的增殖能力的部分。在细胞变得不太能够增殖(例如由于细胞经经历凋亡或以其他方式死亡,细胞不能继续进行细胞周期和/或不能分裂,细胞分化等等)时,细胞具有降低的增殖能力。非限制性的示例性细胞毒性剂包括但不限于放射性同位素、毒素及化疗剂。本领域技术人员可根据预期应用来选择合适的细胞毒性剂。在一些实施方案中,使用体外化学方法将标记和/或细胞毒性剂缀合至抗体。缀合的非限制性的示例性化学方法是本领域已知的,且包含可购自例如thermoscientificlifescienceresearchproduces(曾经为pierce;rockford,il)、prozyme(hayward,ca)、sacriantibodyservices(calgary,canada)、abdserotec(raleigh,nc)等的服务、方法和/或试剂。在一些实施方案中,在标记和/或细胞毒性剂为多肽时,标记和/或细胞毒性剂可自具有至少一条抗体链的相同表达载体表达以产生包含融合至抗体链的标记和/或细胞毒性剂的多肽。本领域技术人员可根据预期应用来选择将标记和/或细胞毒性剂缀合至抗体的合适方法。示例性的前导序列为大量表达及分泌一些分泌蛋白,可能需要来自异源蛋白的前导序列。在一些实施方案中,前导序列选自seqidno:3及4,其分别为轻链及重链前导序列。在一些实施方案中,采用异源前导序列可能是有利的,其中所得成熟多肽可以保持无变化,因为在分泌过程期间在er中前导序列被去除。可能需要添加异源前导序列以表达及分泌一些蛋白。一些示例性的前导序列描述于例如由新加坡国立大学生物化学系(departmentofbiochemistry,nationaluniversityofsingapore)维护的在线前导序列数据库中。参见choo等,bmcbioinformatics,6:249(2005);及pct公开no.wo2006/081430。编码抗体的核酸分子提供了包含编码抗体的一条或多条链的多核苷酸的核酸分子。在一些实施方案中,核酸分子包含编码抗体的重链或轻链的多核苷酸。在一些实施方案中,核酸分子包含编码抗体重链的多核苷酸及编码抗体轻链的多核苷酸。在一些实施方案中,第一核酸分子包含编码重链的第一多核苷酸且第二核酸分子包含编码轻链的第二多核苷酸。在一些此类实施方案中,重链及轻链自一个核酸分子或自两个单独核酸分子(作为两个单独多肽)表达。在一些实施方案中,例如在抗体为scfv时,单一多核苷酸编码包含连接在一起的重链及轻链的单一多肽。在一些实施方案中,编码抗体的重链或轻链的多核苷酸包含编码前导序列(其在翻译时位于重链或轻链中n末端处)的核苷酸序列。如上文所论述,前导序列可以是天然重链或轻链前导序列,或可以是另一异源前导序列。可使用本领域常规的重组dna技术来构建核酸分子。在一些实施方案中,核酸分子是适于在所选宿主细胞中表达的表达载体。抗体表达及生产载体提供了包含编码抗体重链和/或轻链的多核苷酸的载体。还提供了包含编码抗体重链和/或轻链的多核苷酸的载体。此类载体包括但不限于dna载体、噬菌体载体、病毒载体、逆转录病毒载体等。在一些实施方案中,载体包含编码重链的第一多核苷酸序列编码轻链的第二多核苷酸序列。在一些实施方案中,重链及轻链自载体以两条单独多肽表达。在一些实施方案中,重链及轻链作为单一多肽的一部分而表达,例如在抗体为scfv时。在一些实施方案中,第一载体包含编码重链的多核苷酸且第二载体包含编码轻链的多核苷酸。在一些实施方案中,以类似量(例如类似摩尔量或类似质量的量)将第一载体及第二载体转染至宿主细胞中。在一些实施方案中,将摩尔-或质量比率为5∶1至1∶5的第一载体及第二载体转染至宿主细胞在。在一些实施方案中,对于编码重链的载体与编码轻链的载体使用1∶1至1∶5的质量比率。在一些实施方案中,对于编码重链的载体与编码轻链的载体使用1∶2的质量比率。在一些实施方案中,选择经优化以用于在cho或cho源细胞或nso细胞中表达多肽的载体。示例性的此类载体阐述于例如runningdeer等,biotechnol.prog.20:880-889(2004)中。在一些实施方案中,选择载体以用于在动物(包括人)中体内表达抗体重链和/或抗体轻链。在一些此类实施方案中,多肽表现处于以组织特异性方式发挥作用的启动子的控制下。例如,肝特异性启动子阐述于例如pct公开no.wo2006/076288中。宿主细胞在多种实施方案中,可在原核细胞(例如细菌细胞)或真核细胞(例如真菌细胞(例如酵母)、植物细胞、昆虫细胞及哺乳动物细胞)中表达抗体重链和/或轻链。例如,可根据本领域已知的程序实施该表达。可用于表达多肽的示例性真核细胞包括但不限于cos细胞,包括cos7细胞;293细胞,包括293-6e细胞;cho细胞,包括cho-s及dg44细胞;per.细胞(crucell);及nso细胞。在一些实施方案中,可在酵母中表达抗体重链和/或轻链。参见例如美国公开no.us2006/0270045al。在一些实施方案中,基于对抗体重链和/或轻链作出期望的翻译后修饰的能力来选择具体的真核宿主细胞。例如,在一些实施方案中,cho细胞产生唾液酸化水平比293细胞中所产生的相同多肽更高的多肽。可通过任一方法将一种或多种核酸引入期望的宿主细胞中,包括但不限于磷酸钙转染、deae-右旋糖酐介导的转染、阳离子脂质介导的转染、电穿孔、转导、感染等。非限制性的示例性方法阐述于例如sambrook等,molecularcloning,alaboratorymanual,第3版,coldspringharborlaboratorypress(2001)中。可根据任何合适方法在期望的宿主细胞中瞬时或稳定转染核酸。在一些实施方案中,可根据任何合适方法在动物中在体内产生一种或多种多肽,所述多肽由一种或多种编码多肽的核酸分子工程化或转染。抗体纯化可通过任何合适方法纯化抗体。此类方法包括但不限于使用亲和力基质或疏水相互作用色谱。合适的亲和力配体包括抗原及结合抗体恒定区的配体。例如,可使用蛋白a、蛋白g、蛋白a/g或抗体亲和力柱来结合恒定区及纯化抗体。疏水相互作用色谱(例如丁基或苯基柱)也可适于纯化一些多肽。纯化多肽的许多方法是本领域已知的。抗体的无细胞生产在一些实施方案中,在无细胞系统中产生抗体。非限制性的示例性无细胞系统阐述于(例如)sitaraman等,methodsmol.biol.498:229-44(2009);spirin,trendsbiotechnol.22:538-45(2004);endo等,biotechnol.adv.21:695-713(2003)中。治疗组合物及方法治疗色素绒毛结节性滑膜炎(pvns)及其他病状的方法在一些实施方案中,提供治疗pvns的方法,其包括施用有效量的抗csf1r抗体。在一些实施方案中,pvns是弥散性pvns。在一些此类实施方案中,pvns在髋和/或膝关节中。在一些此类实施方案中,pvns在手或脚关节中。在一些实施方案中,提供治疗其他涉及滑膜关节及腱鞘的增生性病症(例如腱鞘的巨细胞瘤(gctts)及腱鞘滑膜巨细胞瘤(tgct))的方法,其包括施用有效量的抗csf1r抗体。在一些实施方案中,抗体以本文所述的剂量施用,及例如以如下剂量施用:至少1、至少2、至少4、至少8、至少10、至少12、至少16、至少20、至少30、至少40、至少50或至少100mg/kg。在一些实施方案中,抗体以本文所述的剂量施用,及例如以1mg/kg、2mg/kg或4mg/kg的剂量施用。在一些实施方案中,抗体以本文所述的频率施用,及例如以如下频率施用:每两周一次、每三周一次、每4周一次、每5周一次、每6周一次、每8周一次或每10周一次。在一些实施方案中,可在抗体治疗过程期间施用至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个或至少12个剂量。在一些实施方案中,在至少两个或至少三个或至少4个剂量的抗体之后,用结合csf1r的抗体治疗pvns使得肿瘤体积评分降低至少30%或至少40%或至少50%或至少60%或至少70%。可以例如使用mri测量肿瘤体积评分以评估受影响关节中的肿瘤体积。在一些实施方案中,在一个受影响关节中测量肿瘤体积评分。在一些实施方案中,以一个或多个受影响关节中的总肿瘤体积来测量肿瘤体积评分。抗csf1r抗体可在至少一种其他疗法之前、同时和/或之后施用。非限制性的示例性的其他疗法包括手术滑膜切除术、放射束治疗、放射性同位素滑膜切除术及关节置换。在一些实施方案中,抗csf1r抗体阻断csf1和/或il-34与csf1r的结合和/或抑制由csf1和/或il-34诱导的csf1r磷酸化。在一些实施方案中,抗csf1r抗体阻断csf1及il-34与csf1r的结合和/或抑制由csf1和/或il-34诱导的csf1r磷酸化。在一些实施方案中,抗csf1r抗体包含本文所述的选自huab1至huab16的抗体的cdr或可变区。在一些实施方案中,抗csf1r抗体包含huab1的cdr或可变区。施用途径及载剂在多种实施方案中,可在体内通过多种途径施用抗体,包括但不限于经口、动脉内、胃肠外、鼻内、肌内、心内、心室内、气管内、经颊(buccal)、直肠、腹膜内、真皮内、局部、经皮及鞘内或另外通过植入或吸入。可将标题组合物配制为固体、半固体、液体或气态形式的制备物;包括但不限于片剂、胶囊、粉剂、颗粒剂、软膏剂、溶液、栓剂、灌肠剂、注射剂、吸入剂及气雾剂。可将编码抗体的核酸分子包覆于金微粒上并通过粒子轰击装置或“基因枪”进行皮内递送,如文献中所述(参见例如tang等,nature356:152-154(1992))。可根据预期应用来选择适当的配制物及施用途径。在多种实施方案中,将包含抗体的组合物与各种药学上可接受的载剂一起提供于配制物中(参见例如gennaro,remington:thescienceandpracticeofpharmacywithfactsandcomparisons:drugfactsplus,第20版(2003);ansel等,pharmaceuticaldosageformsanddrugdeliverysystems,第7版,lippencottwilliamsandwilkins(2004);kibbe等,handbookofpharmaceuticalexcipients,第3版,pharmaceuticalpress(2000))。各种药学上可接受的载剂(包括介质、佐剂及稀释剂)都是可获得的。此外,各种药学上可接受的辅助物质(如ph调节剂及缓冲剂、张力调节剂、稳定剂、润湿剂等等)也是可获得的。非限制性的示例性载剂包括盐水、缓冲盐水、右旋糖、水、甘油、乙醇,及其组合。在多种实施方案中,可通过如下方式来配制包括抗体的组合物以用于注射(bk皮下施用):将其(若需要的话)与常规添加剂(例如增溶剂、等张剂、悬浮剂、乳化剂、稳定剂及防腐剂),溶解、悬浮或乳化于水性或非水性溶剂(例如植物油或其他油、合成的脂肪酸甘油酯、高级脂肪酸的酯或丙二醇)中。在多种实施方案中,例如可使用可接受加压的推进剂(例如二氯二氟甲烷、丙烷、氮等等)配制组合物以供吸入。在多种实施方案中,例如,也可使用生物可降解或生物不可降解聚合物将组合物配制成持续释放微胶囊。非限制性的示例性生物可降解配制物包括聚乳酸-乙醇酸聚合物。非限制性的示例性生物不可降解配制物包括聚甘油脂肪酸酯。制备此类配制物的一些方法阐述于例如ep1125584a1中。本发明也提供包含一个或多个容器的药物包和试剂盒,每一容器含有一个或多个剂量的抗体或抗体组合。在一些实施方案中,提供单位剂量,其中所述单位剂量含有预定量的组合物,所述组合物包含抗体或抗体组合且具有或不具有一种或多种其他药剂。在一些实施方案中,以注射用一次性预填充的注射器形式供应所述单位剂量。在多种实施方案中,含于单位剂量中的组合物可包含盐水、蔗糖等等;缓冲剂,如磷酸盐等等;和/或配制在稳定且有效的ph范围内。或者,在一些实施方案中,组合物可作为冻干粉末提供,其可在添加适当液体(例如无菌水)后重建。在一些实施方案中,组合物包含一种或多种抑制蛋白质聚集的物质,包括但不限于蔗糖及精氨酸。在一些实施方案中,本发明组合物包含肝素和/或蛋白聚糖。以有效治疗或预防具体适应症的量施用药物组合物。治疗有效量通常取决于所治疗受试者的体重、其身体或健康状况、要治疗的病状的扩展性(extensiveness)或所治疗受试者的年龄。一般而言,可以约10μg/kg体重/剂量至约100mg/kg体重/剂的范围的量施用抗体。在一些实施方案中,可以约50μg/kg体重/剂至约5mg/kg体重/剂的范围的量施用抗体。在一些实施方案中,可以约100μg/kg体重/剂至约10mg/kg体重/剂的范围的量施用抗体。在一些实施方案中,可以约100μg/kg体重/剂至约20mg/kg体重/剂的范围的量施用抗体。在一些实施方案中,可以约0.5mg/kg体重/剂量至约20mg/kg体重/剂量范围的量施用抗体。在一些实施方案中,可以至少1、至少2、至少4、至少8、至少10、至少12、至少16、至少20、至少30、至少40、至少50或至少100mg/kg的剂量施用抗体。在一些实施方案中,可以1mg/kg、2mg/kg或4mg/kg的剂量施用抗体。可视需要向受试者施用抗体组合物。施用频率可由本领域技术人员(例如主治医师)基于如下考虑来确定:所治疗的病状、所治疗受试者的年龄、所治疗病状的严重程度、所治疗受试者的一般健康状态等等。在一些实施方案中,向受试者施用有效剂量的抗体一次或多次。在多种实施方案中,每月一次、每月小于一次(例如每两个月一次或每三个月一次)向受试者施用有效剂量的抗体。在其他实施方案中,每月一次以上(例如每三周一次、每两周一次或每周一次)施用有效剂量的抗体。在一些实施方案中,每1、2、3、4或5周一次施用有效剂量的抗体。在一些实施方案中,每周两次或三次施用有效剂量的抗体。向受试者施用有效剂量的抗体至少一次。在一些实施方案中,可施用有效剂量的抗体多次,包含施用至少一个月、至少6个月或至少一年的时段。组合治疗抗体可单独或与其他治疗模式一起施用。其可在其他治疗模式(例如手术、放射治疗、关节置换和/或另一治疗剂)之前、基本上同时或之后提供。在一些实施方案中,pvns在选自手术、放射治疗、关节置换、施用另一治疗剂或其组合的治疗后复发或进展。在一些实施方案中,在至少一种选自手术滑膜切除术、放射束治疗、放射性同位素滑膜切除术及关节置换的治疗之前、同时或之后施用抗csf1r抗体。实施例下文所论述的实施例仅意欲例示本发明而不应视为以如何方式限制本发明。此类实施例不意欲表示,下文实验是所实施的所有或仅有的实验。已努力确保所用数值(例如量、温度等)的精确性,但应考虑到一些误差及偏差。除非另有说明,否则份数是重量份数,分子量是重量平均分子量(weightaveragemolecularweight),温度是摄氏度,且压力是大气压或接近大气压。实施例1:人源化抗csf1r抗体先前研发了各种人源化抗csf1r抗体。参见例如pct公开no.wo2011/140249。人源化重链可变区及人源化轻链可变区的每一个的序列,其与亲代嵌合抗体可变区的序列及人受体可变框架区的序列比对,示于图1(重链)及2(轻链)中。人源化可变区序列相对于人受体可变框架区序列的变化以加框显示。每一可变区的每一cdr显示于加框区域中,且在加框序列上方标记为“cdr”。下表8显示了抗体huab1至huab16的人源化重链及人源化轻链的完整序列。这些抗体的每一个的人源化重链及人源化轻链的名称及seqidno显示于表3中。表3:huab1至huab16的人源化重链和轻链人源化抗体人源化hcseqidno人源化lcseqidnohuab1h0301-h053h0301-l060huab2h0301-h154h0301-l060huab3h0301-h255h0301-l060huab4h0301-h053h0301-l161huab5h0301-h154h0301-l161huab6h0301-h255h0301-l161huab7h0302-h156h0302-l062huab8h0302-h156h0302-l163huab9h0302-h156h0302-l264huab10h0302-h257h0302-l062huab11h0302-h257h0302-l163huab12h0302-h257h0302-l264huab13h0311-h158h0311-l065huab14h0311-h158h0311-l166huab15h0311-h259h0311-l065huab16h0311-h259h0311-l166如先前所阐述,测试了16种人源化抗体与人、食蟹猴及小鼠csf1recd的结合。参见例如pct公开no.wo2011/140249。发现抗体结合人及食蟹猴csf1recd,但不结合小鼠csf1recd。还发现人源化抗体阻断csf1和il-34与人和食蟹猴csf1r的结合且抑制cho细胞中表达的人csf1r的csf1诱导和il-34诱导的磷酸化。参见例如pct公开案no.wo2011/140249。先前已测定了与人csf1recd的结合的ka、kd及kd且显示于表4中。参见例如pct公开no.wo2011/140249。表4:针对人csf1r的人源化抗体结合亲和力huabka(m-1s-1)kd(s-1)kd(nm)huab0301-l0h03.22x1061.11x10-030.35huab0301-l0h13.56x1061.22x10-030.34huab0301-l0h22.32x1066.60x10-040.28huab0301-l1h03.29x1061.15x10-030.35huab0301-l1h12.87x1069.21x10-040.32huab0301-l1h22.95x1067.42x10-040.25huab0302-l0h13.54x1063.69x10-031.04huab0302-l1h13.47x1064.04x10-031.17huab0302-l2h11.60x1069.14x10-040.57huab0302-l0h23.40x1061.79x10-030.53huab0302-l1h22.71x1061.53x10-030.56huab0302-l2h21.84x1068.40x10-040.46huab0311-l0h11.22x1065.40x10-040.44huab0311-l1h11.32x1066.64x10-040.50huab0311-l0h21.34x1064.73x10-040.35huab0311-l1h21.51x1066.09x10-040.40实施例2:抗csf1r抗体的药代动力学及药效学在3个静脉内(iv)研究中于食蟹猴中研究了huab1的药代动力学(pk)及毒物动力学(tk)。所研究的剂量范围为在单一剂量后的3-150mg/kg及重复剂量后的3-150mg/kg。输注持续时间为30分钟。重复剂量研究中的给药间隔为每周一次且每个动物接受总共4个剂量。在scid小鼠中研究了嵌合替代(surrogate)抗体的单一及重复剂量pk以帮助阐释huab1清除的机制,且更好地理解相对于单一剂量pk研究中的猴在glp毒理学研究的恢复组中的猴中所观察到的延长暴露的机制。食蟹猴中在huab1的单一30分钟iv输注后的pk特征的特征在于快速分布,然后是止于huab1自血浆的加速消耗(与靶介导的清除一致)的较缓慢末期。除靶介导的清除之外,快速降低可部分地由huab1抗体导致。然而,嵌合替代抗体在缺乏产生ada响应的能力的scid小鼠中的单一剂量施用显示出类似特征并证实尤其在低剂量处靶介导的清除有助于huab1的总体清除。观察到的最大血浆浓度(cmax)与所测试所有剂量水平处的剂量成比例增加,而自时间零外推至无限的血浆浓度-时间曲线下面积(auc∞)增加自3mg/kg至10mg/kg大于剂量成比例,且自10mg/kg至150mg/kg是剂量成比例的。在加速终末下降之前的半衰期(t1/2)范围为1-12天且总体清除范围为0.14-1.25ml/h/kg。总而言之,huab1在食蟹猴中具有饱和非线性清除。在3个食蟹猴研究中检验了huab1对已知在体内由csf1r抑制调节的各种药效学(pd)标志物的效应。此类标志物包括csf1、cd16+单核细胞及骨吸收标志物。csf1水平:csf1的血浆或血清浓度是huab1靶接合(engagement)的测量。csf1在正常生理学条件下通过巨噬细胞(主要是脾脏巨噬细胞及肝kupffer细胞)经由csf1r介导的胞吞作用及细胞内降解自循环清除。csf1在正常受试者中的稳态水平<1μg/ml。huab1结合csf1且预防csf1从csf1r被清除,从而使得循环csf1浓度发生较大、快速增加,然后csf1水平达到大约10μg/ml的新稳态。在中试毒理学研究中,在食蟹猴中经4周每周一次给药后在谷底处(给药后7天)获得血浆csf1及血浆huab1样品。数据显示,最小生物效应出现于5μg/mlhuab1处,且半最大响应(ec50)为8μg/mlhuab1。cd16+单核细胞:在glp毒理学研究中,cd16+单核细胞在接受50mg/kg或150mg/kghuab1的4周静脉内输注的猴中有所减少,这与支持此单核细胞亚群体的体内生长及维持的csf1r通路一致。cd16+单核细胞减少发生于给药1周内且在整个给药及暴露时段中持续下去。cd16+单核细胞在huab1清除之后恢复至正常基线浓度。通过施用huab1来使cd16-单核细胞亚群体保持不受影响。骨吸收标志物:在重复给药huab1后于猴中评估骨吸收的血浆及尿液标志物。尿液ntx、血浆ctx及trap5b均是降低的。此类效应在清除huab1后是可逆的。实施例3:使用抗csf1r抗体治疗pvns将huab1抗体(分别包含seqidno:53及60的重链及轻链可变区的抗体)以1mg/kg至4mg/kg的增加剂量施用pvns患者。每2周一次施用huab1。以28天循环治疗患者,其中每一循环由第1天及第15天的2个剂量组成。在完成一个循环之后,可在下一循环中向患者施用增加的剂量。监测患者的症状改善及肿瘤体积评分(tvs)。可在开始huab1治疗之前及之后自患者获得基线及治疗后肿瘤组织切片及滑液。另外,监测患者的总体响应、免疫相关响应及总体生存。在第一剂量的huab1之前28天内且然后在第一剂量后的某些时间间隔处(例如4、8、16及24周,且然后每12-16周)进行mri肿瘤评估。还在第一剂量之后每4周一次进行健康结果(例如功能及症状)的临床评估。使用recist评估可测量疾病的huab1响应。可根据最佳总体肿瘤响应(完全响应[cr]、部分响应[pr]、疾病稳定[sd]或疾病进展[pd])来将患者分类。计算(在适当时)按照最佳总体肿瘤响应分级的患者的频率、比例及精确95%ci。将具有cr或pr的最佳总体肿瘤响应且持续时间为至少4周(28天)的患者进一步分类为具有客观肿瘤响应。通过recist及肿瘤体积评分对患者响应进行分类。肿瘤体积评分根据如下定义来分类响应:完全响应[(cr)病灶在治疗循环之后完全消失]、部分响应[(pr)体积评分相对于基线降低≥50%]、疾病进展[(pd)相对于治疗期间(不论在基线处或在某些其他访视时)的最低评分的体积增加≥30%]或疾病稳定[(sd)不满足基于评分的任一先前标准]。响应持续时间计算为自总体响应(cr或pr)的第一记载至疾病进展的第一记载的天数。实施例4:色素绒毛结节性滑膜炎(pvns)/弥散性腱鞘的巨细胞瘤(dt-tgct)患者中的i/ii期临床试验的总结在患有色素绒毛结节性滑膜炎(pvns)及弥散性腱鞘的巨细胞瘤(dt-tgct)的一者或两者的患者中使用huab1(也称为fpa008)进行i/ii期临床试验。i期的目标在于测定患者中huab1的推荐剂量,而实施ii期以估计huab1在患者中的客观响应率(orr)。orr=完全响应(cr)+部分响应(pr)。该研究还表征huab1在患者中的安全性及耐受性并确定有响应的患者的响应持续时间并评估huab1在患者中的药代动力学。另外,该研究评估huab1的药效学,如通过csf1、il34、trap5b、ctx及全血cd14+/cd16+单核细胞子集的血清浓度变化所测量的;通过免疫组织化学(ihc)针对csf1、csf1r及cd68评估滑膜活检组织;针对huab1浓度及细胞构成变化评估滑液;及评估功能结果,如通过特定针对pvns研发的ogilvie-harris评分(ogilvie-harris,1992;rhee,2010)及通过eq-5d-5l评分(rabin,2001;herdmann,2011)所测量的。i/ii期研究是开放标记的且将患者招募至任一期而非二者中。在28天循环中每2周一次用huab1治疗患者。可在一个28天循环之后继续治疗。例如,第一剂量循环可用于安全性及药代动力学评估,但患者可参与例如1、2或3个额外的28天循环的延长治疗期或直至疾病进展(若在24周之前的话)、不可接受毒性、患者或医师决定中断或研究终止为止。在i期中,将3名患者招募至3个群组的每一个中,向所述群组分别施用1mg/kghuab1、2mg/kghuab1或4mg/kghuab1。可增加其他群组且可增加中间的3mg/kghuab1群组。若剂量继续递增至高于4mg/kg,则ii期的推荐剂量(rd)可为或可不为最大耐受剂量(mtd)(假设mtd是在i期中鉴定),但不高于mtd。ii期研究是基于选自i期结果的剂量或预计小于或等于4mg/kg的剂量。基于总体安全性、耐受性、客观响应、pk、pd及自非临床数据外推的有效暴露的估计来鉴定ii期剂量。ii期研究持续时间为24周且涉及名30患者。所治疗患者为18岁或更大年龄且在组织学上确诊有会引起不可接受的功能损失或发病率的不宜手术的pvns/dt-tgct或潜在可切除的肿瘤,如通过有资格的外科医师或多学科肿瘤委员会所确定。患者可患有通过recist1.1在mri上可测量的pvns/dt-tgct。所治疗患者未接受过使用抗csf1r抗体或使用plx3397的先前治疗,除非因耐受不良而中断。然而,患者可以接受过使用伊马替尼或尼罗替尼的先前治疗。患者在第一研究剂量施用之前12周内未进行所涉及关节的任何手术程序。在患者中评估药代动力学参数。在适当且适用时,自fpa008的浓度-时间数据衍生出下列pk参数(也可计算其他参数(例如累积比率及半衰期)):血清浓度-时间曲线下面积(auc);最大血清浓度(cmax);最小血清浓度(cmin);清除率(cl);稳态分布体积(vss)。还评估了药效学(pd)参数:血清-csf1及il34配体浓度、ctx及trap5b骨吸收标志物浓度;全血-cd14+/cd16+单核细胞子集;滑膜(任选的)-评估滑膜活检组织的csf1基因转座(若先前未进行)、基线及治疗中的滑膜活检、csf1及csf1r和/或cd68的ihc;滑液(任选的)-huab1浓度;上述标志物的细胞组分(通过ihc)。例如,通过收集血样且针对huab1的抗药物抗体分析样品来评估免疫原性。例如,通过如下方式评估响应性:在筛选时、开始治疗后4、8及16周(或直至治疗中断为止)进行受影响关节的mri。使用recist1.1及tvs基于独立中心放射性评审评估mri响应。另外,若存在良好肿瘤响应率,可基于总体器官mri评分(worms)及类风湿性关节炎mri评分(ramris)评估周围骨及其他关节组织的变化。在筛选时、c1d15(给药前)、c2d1(给药前)且然后在24周中的所有后续循环的第1天(给药前)或直至治疗中断为止进行健康结果(功能、症状)的临床评估。每14(±2)周追踪在治疗完成/早期终止时尚未进展且同意继续参与研究的患者(健康结果的mri及评估)直至进展为止,在c1d1后,患者经受局部疗法(例如切除术、放射)或开始新全身性疗法最长52周。通过监测不良事件及体检变化、生命体征、12导联ecg及临床实验室测量来评估安全性。所有分析都是描述性且酌情按剂量组和总体呈现。将来自2期在患者数据汇总为单独的组。还汇总所有以rd给药的患者。因为可以在较低剂量水平处招募的患者数量较低,故可组合一些剂量水平以用于汇总。功效数据中的丢失值处理为丢失;不估算功效数据使用汇总表及患者数据列表呈现此研究中所收集的数据。使用描述性统计学(具体而言为平均值、中值、标准偏差(sd)、最小值及最大值)来汇总连续变量。通过频率及百分比来汇总类别变量。在适当时,呈现95%置信区间。使用响应率及相应置信区间(ci)来评估功效。预计总共有大约33至36名在rd下治疗的患者。表6显示相应95%置信区间及各个样本量及所观察响应率的精确度。使用非分室分析方法计算pk参数,但可在适当时采用分室分析方法。实施例5:色素绒毛结节性滑膜炎(pvns)/弥散性腱鞘的巨细胞瘤(dt-tgct)患者中的i/ii期临床试验1.前言1.1.pvns背景色素绒毛结节性滑膜炎(pvns)是具有响应性炎症及克隆赘瘤性增殖的特征的滑膜良性赘瘤,其中集落刺激因子-1(csf1)过表达。csf1基因(1p13)至col6a3启动子(2q35)的常见转座存在于大约60%的pvns患者中。转座伴有滑膜中的csf1过表达。另外,大约40%的pvns患者在不存在鉴定的csf1转座情况下具有csf1过表达。pvns及响应性滑膜炎的所有病例中csf1过表达的一致存在表明,csf1在滑膜病况范围中具有重要作用且靶向csf1/csf1r相互作用在治疗上有实用性(west,2006)。在pvns中,csf1过表达存在于少数滑膜细胞中,而大部分细胞浸润物表达csf1r而非csf1。将此现象描述为在赘瘤性细胞中具有异常csf1表达的肿瘤美化效应,其引起非赘瘤性细胞的异常累积而形成团块。选择手术来治疗患有局部pvns的患者。复发发生于8-20%的患者中且容易地通过再切除来管控。pvns/dt-tgct往往更通常(33-50%)复发且具有更具侵略性的临床过程。患者通常具有症状性且在其生命期间需要多个手术程序。对于患有不可切除疾病或多次复发的患者而言,使用csf1r抑制剂的全身性疗法可帮助延迟或避免手术程序并改善功能结果(ravi,2011)。在29名pvns患者中评估伊马替尼,一种csf1r的非特异性抑制剂。中值年龄为41岁且最常见疾病位点为膝盖(n=17;59%)。根据recist,27名可评估患者中的5名具有完全(n=1)或部分(n=4)响应,总体响应率为19%。27名患者中的20名(74%)具有稳定疾病。在可评估症状的22名患者中的16名(73%)中发现症状改善。尽管具有高症状改善率及总体良好的安全性特征,但10名患者因毒性或其他原因而中断治疗(cassier,2012)。csf1信号传导的强力抑制剂的最近两项研究已显示了在pvns患者中的初步但显著的临床活性。已在pvns患者中评估了plx3397(csf1r激酶抑制剂)及rg7155(靶向csf1r的单克隆抗体)(cassier,2014;tap,2014)。在两项研究中,基于recist、fdg-pet和/或总体积评分(其是通过mri对疾病体积的测量),大部分pvns患者对治疗具有响应。在pvns中,少数细胞的csf1过表达导致募集构成大部分肿瘤质量的表达csf1r的细胞。fpa008拮抗csf1r活化且应导致肿瘤中的表达csf1r的细胞的减少,由此提供临床益处。1.2.fpa008:分子描述huab1(也称为fpa008)是在铰链区中具有单一氨基酸取代以防止半-二聚体交换的人源化igg4单克隆抗体。fpa008对人集落刺激因子1受体(csf1r)(受体酪氨酸激酶)具有高亲和力结合。1.2.1.使用fpa008的非临床研究1.2.1.1.csf1r信号传导的fpa008抑制fpa008抑制经改造以过表达csf1r的细胞系(cho-csf1r)中的csf1及il34诱导的csf1r磷酸化,从而证实fpa008阻断经配体诱导的csf1r信号传导通路的活化。fpa008还在体外抑制周边血单核细胞的csf1及il34诱导的增殖/存活,从而证实fpa008不仅抑制csf1及il34信号传导通路的起始,且也抑制原代人单核细胞对此类配体的后续生理响应(关于进一步细节,参见fpa008研究者手册(investigator’sbrochure)[ib])。1.2.2.非临床药代动力学及药效学1.2.2.1.药物代谢动力学在4个静脉内(iv)研究中于食蟹猴中研究fpa008的药代动力学(pk)及毒物动力学(tk)。所研究剂量范围为在单一静脉内浓注剂量之后的3-150mg/kg及在重复静脉内输注剂量之后的3-150mg/kg。输注持续时间为30分钟。重复剂量研究中的给药间隔为每周一次且每一动物在两个研究中接受总共4个剂量且在一个研究中接受总共13个剂量。食蟹猴中在fpa008的单一iv推注给药后的pk特征的特征在于快速分布,随后是止于fpa008自血浆的加速消耗(与靶介导的清除一致)的较缓慢末期。除靶介导的清除外,快速降低可部分地由抗fpa008抗体所致。然而,cmfpa008在缺乏产生ada响应的能力的scid小鼠中的单一剂量施用显示类似特征且证实尤其在低剂量处的靶介导的清除有助于pa008的总体清除。所观察最大血浆浓度(cmax)与所测试所有剂量水平下的剂量成比例增加,而自时间零外推至无限的血浆浓度-时间曲线下面积(auc。。)增加自3mg/kg至10mg/kg大于剂量成比例,且自10mg/kg至150mg/kg是剂量成比例的。在加速终末下降之前的半衰期(t1/2)范围为1-12天且总体清除范围为0.14-1.25ml/h/kg。总而言之,fpa008在食蟹猴中具有饱和的靶介导的清除。1.2.2.2.药效学在3个食蟹猴研究中检验了fpa008对已知在体内由csf1r抑制调节的各种药效学(pd)标志物的效应(细节提供于本文的5.1.1.7部分中)。此类标记物包括csf1、cd16+单核细胞及骨吸收标志物。未在猴中测量il34,这是由于缺乏适当的测定。csf1水平:csf1的血浆或血清水平是fpa008靶接合的测量。csf1在正常生理学条件下通过巨噬细胞(主要是脾脏巨噬细胞及肝kupffer细胞)经由csf1r介导的胞吞作用及细胞内降解自循环清除(bartocci,1987)。csf1在正常受试者中的稳态浓度为<lng/ml。fpa008结合csf1且防止其被csf1r清除,从而使得循环csf1浓度发生大而快速的增加,然后csf1浓度达到大约10μg/ml的新稳态。在中试毒理学研究中,在食蟹猴中经4周每周一次给药后在谷底处(给药后7天)获得血浆csf1及血浆fpa008样品。数据显示,最小生物效应出现于5μg/mlfpa008处,且半最大响应(ec50)为8μg/mlfpa008。尽管fpa008升高csf1,但fiveprime相信,此类升高不重要,这是因为:●csf1r是csf1信号传导的唯一鉴定的受体且其受到fpa008拮抗。●csfl水平随着fpa008的清除而下降。●在fpa008存在下,在csf1升高时,在fpa008细胞效力测定中评估极高浓度的csf1使fpa008自csf1r受体转座的可能。数据显示,高达10μg/mlcsf1的浓度对fpa008效力或csf1r信号传导的最大抑制没有影响。●在临床前体内研究中清除fpa008后,未观察到cd16+单核细胞的反弹增加。cd16+单核细胞:在glp毒理学研究中,cd16+单核细胞在接受50mg/kg或150mg/kgfpa008的4周静脉内输注的猴中有所减少,这与支持此单核细胞亚群体的体内生长及维持所需的csf1r通路一致。cd16+单核细胞减少发生在给药1周内且在整个给药及暴露时段中持续。cd16+单核细胞在fpa008清除之后恢复至正常基线水平。通过施用fpa008使cd16-单核细胞亚群体保持不受影响。骨吸收标志物:在重复给药fpa008后在猴中评估骨吸收的血浆及尿液标志物。尿液ntx、血浆ctx及trap5b都是降低的。该效应在清除fpa008后是可逆的。1.2.3.非临床毒理学研究及发现非临床毒理学研究的全部细节提供于本文的第5.3部分中。所有毒性研究均在食蟹猴中实施,这是由于fpa008与啮齿类动物没有交叉反应性,但对食蟹猴及人csf1r显示出相似的体外结合亲和力且在比较人及食蟹猴组织的组的组织交叉反应性研究中具有相似组织结合特征。使用fpa008实施以下4个非临床体内毒理学研究:单剂量药代动力学(pk)/耐受性研究,使用3、10、30及150mg/kg的剂量;剂量范围发现重复剂量毒性研究,使用3、10及150mg/kg的4周iv剂量;重复剂量glp毒性研究,使用50mg/kg及150mg/kg的4周iv剂量及30周恢复期;及亚慢性重复剂量glp毒性研究,使用20、50及100mg/kg的13周iv剂量及29周恢复期。在食蟹猴中的体内毒理学研究中,fpa008通常是耐受良好的。测试物品相关发现包含临床观察、血液学及临床化学变化及组织学变化。这些观察中的大部分可视为非不良的。1.2.3.1.眶周水肿最突出的身体发现是在延长的fpa008暴露之后看到的可逆眶周水肿。水肿的发作未显示与暴露程度的清晰关系,然而,水肿在全身性清除药物之后得以消退。眶周水肿是使用影响csf1通路的药物的已知副作用(ries,2014)。1.2.3.2.单核细胞消耗主要血液学变化是循环cd16+单核细胞的减少,这被视为药效学(pd)效应。随着fpa008自循环的清除,降低的细胞数得以正常化。1.2.3.3.酶升高fpa008相关临床化学效应包含可逆增加的丙氨酸转氨酶(alt)、天门冬氨酸盐转氨酶(ast)及肌酸激酶(ck)血清浓度。此类实验室异常不与终末或恢复性尸检时的肝、心脏或肌肉组织损伤的任何组织病理学有关。还在研究的生命中部分期间测量了心脏肌钙蛋白、骨骼肌钙蛋白、肌红蛋白及醛缩酶,且检测到此类参数中的任一项均无变化,这进一步证实没有任何肝或肌肉损害。增加的血清水平归因于alt、ast及ck分子因减少的肝kupffer细胞数量而自血清的清除减弱(radi,2011)。因此,alt、ast及ck升高可视为无毒的且是fpa008暴露的间接pd效应。1.2.3.4.细胞外基质的累积在终末尸检时两个主要研究中的最值得关注的组织病理学发现是观察到黏膜下胶原纤维通过干净空间(clearspace)及不同量的蓝色、颗粒状胞外基质(ecm)发生可逆扩张。此发现存在于大量组织中且通常为最小至轻度严重程度。其最常见于食管中。此变化不与炎症性细胞或胶原纤维、纤维母细胞或扩展区域内的平滑肌细胞的退化或其他改变的任何体征有关。在缺乏功能csf1的op/op小鼠中也得到了类似观察(radi,2009)。在本公开中,作者假设减少的组织巨噬细胞很可能引起观察到ecm的累积,这是由于巨噬细胞对葡糖氨基聚糖的清除降低。葡糖氨基聚糖,尤其玻尿酸在结缔组织中较为突出且通常由巨噬细胞分解代谢(radi,2009)。此变化被视为fpa008的间接pd效应。尚无证据表明蓝色颗粒状ecm的累积是不良的;尚无与组织病理学观察相关的有关临床观察或器官重量变化。另外,ecm的此类变化在无药物恢复期期间可逆,且因此可视为非不良的。1.2.3.5.其他发现4周glp研究的独特的处在于给药150mg/kg的单一雌性中的发现。在终末处死时,观察到心外膜轻度炎症及心脏肌细胞空泡形成的显微学证据。此发现的重要性尚未知晓,但不能排除与fpa008的关联。慢性、轻度心外膜炎症可以是非人灵长类动物中的背景病灶。然而,细胞空泡形成可以是对有害刺激的非特异性细胞响应的早期体征。肌细胞空泡形成并未发现于任一其他给药动物中。重要的是应注意,此空泡形成不引起退化或坏死,且不引起所记录ecg的变化。在恢复时或在13周毒性研究中于任一动物中并未检测到心脏变化。此事件被视为4周毒性研究中的不良发现。另外,4周研究的独特的处在于,在雌性动物中具有增加的脾器官重量且具有最小至轻度滤泡增生的相应组织病理学发现。该发现可视为低毒物学重要性的且非不良的,且在13周毒性研究中并未观察到脾增生。因为巨噬细胞吞没病原体以破坏它们(dale,2008),故fpa008治疗可与细胞内病原体(例如结核分枝杆菌(mycobacteriumtuberculosis)、单核增生李斯特氏菌(listeriamonocytogenes)、利什曼原虫(leishmania)及其他细胞内病原体)的易感性的增加的风险有关。尽管迄今为止尚未在fpa008动物研究中发现自发感染,但临床研究方案含有用于处于最大风险的那些患者的排除标准。在研究的同时,定期监测患者的不良事件及感染。1.2.3.6.总结在以13个每周剂量施用于食蟹猴时,fpa008的无可观察不良效应水平(noael)经测定为100mg/kg。1.3.使用fpa008的临床经历当前在经设计在3个部分中研究安全性、药代动力学(pk)及pd生物标志物的双盲、随机化、安慰剂对照、首次应用于人的试验中评估fpa008。在第1部分中,使8名健康志愿者随机(3∶1)接受单一静脉内输注的fpa008或安慰剂(0.2、1、3或10mg/kg/剂量群组)。在第2部分中,使8名健康志愿者随机(3∶1)接受2个剂量的fpa008或安慰剂(间隔14天以1mg/kg或3mg/kg施用)。剂量递增决定是基于发生剂量限制毒性(dlt)以及超过dlt时段的所得不良事件。第3部分包括开放标记评估ra患者中的3个剂量水平,这些ra患者的疾病对疾病修饰抗炎症药(dmard)并无响应且使用稳定剂量的氨甲蝶呤。每一剂量水平处的三个受试者接受2个剂量的fpa008且间隔14天在开放标记部分中经静脉内施用。然后,使30个新受试者分别随机(2∶2∶1)接受fpa008或安慰剂的两个剂量水平中的一个,且接受3个剂量(经静脉内每14天施用)。尚无临床安全性数据可用于第3部分患者中。48个健康志愿者完成该研究的第1及2部分;这些受试者中的36个接受fpa008且12个接受安慰剂。fpa008在健康志愿者中于3mg/kg双重剂量处耐受良好。最常见fpa008治疗相关毒性是搔痒症、眼睑水肿以及面部肿胀、疲劳及头痛。所述事件是1级或2级及自限性的。在10mg/kg处,所有6个活动性受试者经历中等(2级)眼睑水肿或面部肿胀,一些伴有手脚肿胀、视力模糊及增重。所述事件持续长达3个月且同时在此剂量水平处具有延长pk暴露。没有不良事件满足剂量限制性毒性的方案定义。在1mg/kg及更高剂量处发现ck(最高6.8倍于正常值上限)及乳酸去氢酶(ldh)(最高2.2倍于正常值上限)的剂量依赖性升高;最高2.1倍于正常值上限的ast升高发生于3mg/kg及更高剂量处且发生于较大百分比的具有增加的剂量的志愿者中;且最高1.2倍于正常值上限的轻度alt升高发生于1个受试者中的10mg/kg处。峰值出现于在药物施用后2-8周,通常在12周时回归正常。这些升高不与总胆红素、ck同功酶或肌钙蛋白的临床体征/症状或异常有关。其是可逆的且预计由负责它们的清除的kupffer细胞的fpa008介导的抑制所致(radi,2011),且可视为抑制csf1r而非代表组织损害的药理学效应。此研究中观察到的不良事件特征相对类似于在其他靶向csf1r通路的化合物中所报导的那些(cassier,2014;tap,2014)。fpa008在所测试剂量范围中展现出饱和靶介导的清除。健康志愿者中所观察到的pk特征证实每2周一次或以更低频率给药fpa008会维持期望药物暴露。观察到cd16+单核细胞减少、骨更新生物标志物(ctx、trap5b)减少且血清csf1及il34浓度的剂量依赖性增加。1.4.风险-益处评估通常基于fpa008的非临床毒理学研究来预测fpa008在健康志愿者中的安全性、pk及pd。关于毒理学研究的更多细节提供于本文中。在非临床毒理学研究中,fpa008在多至100mg/kg的高剂量处经最多13个每周剂量在动物中是耐受良好的。pd效应(csf1及cd16+单核细胞)出现于远低在那些与不良事件或异常实验室发现有关的药物暴露水平处。来自用以评估与csf1及il34信号传导干扰有关的药理学介导毒性的潜在风险的小鼠模型的证据显示,csf1、il34或csf1r的缺失是非致死性的。缺少csf1的小鼠显示出骨破骨细胞的损失且显示在出生时一些骨髓细胞具有缺陷(yoshida,1990);缺少il34的小鼠在表皮中缺乏langerhans细胞且在一些脑区域中缺乏小神经胶质细胞(wang,2012;greter,2012);且缺少csf1r的小鼠显示出骨质疏松症及langerhans细胞及小神经胶质细胞二者的缺乏(hamilton,2013)。fpa008结合至csf1r不产生激动剂效应,如通过在fiveprime处实施的实验(细节提供于ib中)所证明的。另外,fpa008是igg4抗体,且体外测试证实,其没有特异性的抗体依赖性细胞介导的细胞毒性(adcc)或补体依赖性细胞毒性(cdc)活性。尽管pvns在大部分患者中通过局部介入管控,但一些患者呈现或患有不通过手术或其他可用疗法充分管控的慢性或复发性疾病。伊马替尼在少数患者中有效,但具有一些限制其应用的中靶及脱靶毒性。特异性csf1r抑制剂的初步报告表明,fpa008可有益地治疗非手术pvns(其可以是衰弱疾病)。2.研究及终点2.1.主要目标1期:确定fpa008在pvns/dt-tgct患者中的推荐剂量(rd)2期:估计fpa008在pvns/dt-tgct患者中的客观响应率(orr=cr+pr)2.2.次要目标表征fpa008在pvns/dt-tgct患者中的安全性及耐受性测定有响应的患者中的响应的持续时间评估fpa008在pvns/dt-tgct患者中的药代动力学2.3.探索性目标评估fpa008的药效学,如通过csf1、il34、trap5b、ctx及全血cd14+/cd16+单核细胞子集的血清水平变化所测量的通过免疫组织化学(ihc)评估所选患者中的滑膜活检组织的csf1、csf1r及cd68标志物评估所选患者中的滑液的fpa008浓度及细胞构成变化评估功能结果,如通过针对pvns特定研发的ogilvie-harris评分及通过eq-5d-5l评分所测量2.4.主要研究终点1期:3级及4级不良事件(ae)及定义为剂量限制毒性(dlt)的临床实验室异常的发病率2期:根据recist1.1所证实的客观响应的发病率2.5.次要终点pk参数ae、临床实验室异常及ecg异常的发病率根据recist1.1的响应持续时间2.6.探索性终点pd参数症状及功能结果,如通过针对pvns特定研发的ogilvie-harris评分及通过eq-5d-5l评分所测量的3.研究的总体设计及计划3.1.概述这是一项1期/2期研究。1期是fpa008的剂量递增、开放标记、安全性、耐受性、pk及pd研究。将患者招募至1期或2期任一的研究中,而非招募至二者中。所招募患者将在28天循环中接受治疗。每一循环由在第1天及第15天的2个剂量组成。3.1.1.筛选时段必须完成所有筛选评估且由研究者及医学监测器予以评审以证实患者在fpa008的第一输注之前满足所有合格性标准(附录1)。在实施任一研究具体筛选测试或程序之前,必须获得用于参与研究的书面知情同意书。除非另外规定,否则在第一剂量的fpa008之前28天内实施筛选评估。在此时段期间收集在签署知情同意书之后且在施用第一fpa008剂量之前发生的研究程序相关的ae。3.1.2.1期(剂量递增)继续剂量递增直至达到mtd或最大可行剂量为止,其中每一群组招募最少3名患者。预期剂量水平及计划表如下:剂量水平1:1mg/kgq2w;剂量水平2:2mg/kgq2w;剂量水平3:4mg/kgq2w。所有剂量递增决定均基于dlt、总体安全性及耐受性的评估并会在招募至每一群组中的最后患者已完成第一治疗循环之后作出。研究者与发起人之间将就剂量递增决定达成一致。在开始每一新剂量水平或扩大现有剂量水平之前,举行安全性电话会议,其中研究者及发起人评审患者数据(包括但不限于人口统计数据、fpa008给药、同步药剂、血液学及血清化学及ae);且剂量递增或扩大现有剂量水平的协议及文件同意书可视为适当。若发起人及研究者一致同意在安全性及药代动力学数据的评审后,应使用与所概述那些不同的剂量递增方案,则允许该方案。安全性、pk及pd参数的评审可告知决定增加使用替代剂量水平或剂量方案(例如较小频率给药或使用负荷剂量)的群组以达到最佳靶暴露。使用如下算法以用于剂量递增决定:表1:剂量递增考量mtd定义为在小于33%的接受fpa008(在28天循环的第1及15天施用)的患者中与dlt有关的最高剂量。此通常为推荐用于另一研究的剂量(rd);然而,基于安全性及pk数据的评审,rd可低于mtd。若未达到mtd,且最高评估fpa008剂量充分耐受,则评审数据以评估进一步的剂量递增是否得以保证。若其他剂量递增视为适当,则可修改该方案。若在1期期间未达到mtd,或1期中的后续治疗循环提供了关于安全性特征的其他见解,可基于总体耐受性、安全性及pk来选择rd。若患者出于毒性外的原因(例如疾病进展或撤回同意书)不接受2个剂量且不完成循环1中的安全性及pk评估,则将另一患者招募至该群组中,从而该群组具有至少三名可在整个循环1中评估耐受性的患者。所有此类讨论和决定会记载为剂量递增决策过程的一部分。不允许用于每一患者的高于起始剂量的患者内剂量递增。若出于不良事件降低患者剂量,则可在ae解决之后且在与发起人讨论并由其批准之后将剂量递增至最初分配剂量。ae复发至大于2级将使得持续减少剂量且不再递增。在完成循环1(安全性及pk评估时段)后,1期患者可参与始于循环2的第1天的延长治疗期。经多至24周以4周循环每2周施用fpa008或直至疾病进展(若在24周之前的话)、不可接受毒性、患者或医师决定中断、死亡或发起人终止研究为止,其中假设对供应药物的可用性没有限制或没有可阻止发起人提供fpa008的其他问题。3.1.3.2期在crc基于总体安全性、耐受性、目标响应、pk、pd及自非临床数据外推的有效暴露的估计鉴定rd时,开始2期中的招募。预计rd≤4mg/kg。然而,pvns/dt-tgct患者可具有不同于健康志愿者的药物暴露。若继续递增剂量至高于4mg/kg且若在1期中鉴定mtd,则rd可或可不为mtd。例如,若未达到mtd,或若mtd下的暴露远高于功效所需的认可程度,或若后续治疗循环提供了关于安全性特征的其他见解,则rd可以不同但不高于mtd的剂量。计划每2周经多至24周的继续治疗(不高于12个剂量)或直至疾病进展为止。若患者表现为具有稳定或改善的症状且具有稳定可测量疾病或更佳状况(通过mri),但具有不可耐受或3级或更大的不良事件,则经发起人同意可容许剂量减少25-50%。3.2.程序对患者实施安全性评估(dlt及其他ae、生命体征、ecg、临床实验室测试)、ecog体能状态(ps)测定及体检(附录1)。另外,收集所有患者的血样以用于pk及pd分析(附录2)。在筛选时、开始治疗后4、8及16周实施受影响关节的mri。除非已在前6周内实施或先前已确定肿瘤进展,否则也应在30天(±7天)及90天(±7天)治疗结束时随访访视中实施mri。尚未进展且进入长期随访的患者应每14(±2)周一次进行mri直至进展为止,在c1d1后,患者经受局部疗法(例如切除术、放射)或开始新全身性疗法最长52周。使用recist1.1及tvs基于独立中心放射性评审评估mri响应。在研究药物的第一次施用之后每4周一次进行健康结果(功能、症状)的临床评估。通过监测ae及体检、体重、生命体征、12导联ecg及实验室测量的变化来评估安全性。遵循国家癌症研究所(nationalcancerinstitute,nci)-常见不良事件术语标准(commonterminologycriteriaforadverseevents,ctcae)4.03版中所提供的指南来评估ae。也在研究期间的排定时间点(附录2)抽取血样以用于确定药物血清浓度及抗药物抗体(ada)(即对fpa008的抗体响应)。在具有可用存档肿瘤组织且已签署可选研究样品知情同意书的患者中,评估组织的csf1基因转座(若先前未进行)(附录1)。另外,测定csf1及csf1r及cd68标志物。对于签署适用的可选研究样品知情同意书的患者而言,在开始fpa008治疗之前且在已满足合格性标准之后自患者获得基线肿瘤组织切片(≥0.5cm至≤2cm)及滑液(若适用的话)。由病理学家评审基线组织样品以测定组织是否可评估。若筛选组织样品可评估,则在循环2施用fpa008第1天之前实施后续活检(附录1)。招募至研究的1期或2期的患者可继续以28天循环使用fpa008治疗多至24周或直至疾病进展、不可耐受毒性、患者或医师决定中断或发起人终止研究为止。除非开始其他疗法以用于治疗pvns/dt-tgct或撤回同意书,否则中断治疗同时仍具有响应(cr、pr或sd)的有响应的患者应在长期随访期期间以14(±2)周间隔获得随访细查以确定响应持续时间。所有患者都应返回诊疗所进行三个治疗结束时随访访视,不论患者是否退出或在计划访视时或中期退出。自施用fpa008的第一剂量时至在fpa008的最后剂量之后90天(±7天)(参见6.2.1.1部分)评估ae。在签署知情同意书之后于最后剂量之后经90天(±7天)收集所有严重不良事件(sae)(参见6.2.1.1部分)。3.3.研究设计的原理此研究的1期组成部分是剂量递增、开放标记研究,其用以评估fpa008在pvns/dt-tgct患者中的安全性、pk、pd及初步功效。3+3剂量递增设计是用于新型抗癌治疗的早期阶段试验的标准。2期组成部分是经设计以大约20%的精确度估计目标响应率的单阶段试验,其中假设响应率与针对plx3397及rg.7155(csf1r信号传导通路的其他强力抑制剂)所报导的那些相似。2期组成部分还容许更充分地研究fpa008在用于未来试验的靶群体中的安全性、pk及生物效应。4.研究合格性及退出标准4.1.患者及研究中心的计划数量1期:招募大约12-15名pvns/dt-tgct患者。1期中的招募将持续直至已达到mtd或直至已定义2期的rd。2期:招募大约30名pvns/dt-tgct患者。在北美、欧洲及亚洲的大约12个研究中心进行研究。4.2.参与研究的纳入标准招募至1期或2中的患者必须满足所有如下纳入标准:1.在任一研究性评估之前,理解并签署机构评审委员会/独立伦理委员会(institutionalreviewboard/independentethicscommittee)批准的知情同意书2.年龄≥18岁3.在组织学上证实诊断有将引起不可接受功能损失或发病率的不宜手术pvns/dt-tgct或潜在可切除肿瘤,如通过有资格外科医师或多学科肿瘤委员会所确定的(必须记载于在筛选期间的crf中)4.通过recist1.1根据mri的可测量的pvns/dt-tgct。5.ecog体能状态≤16.愿意且能够遵守所有研究程序7.在性活跃患者(即可能分娩、经受绝经(如通过连续12个月无月经所定义)或进行永久性绝育程序的女性及尚未进行永久性绝育程序的男性)中,愿意使用2种有效避孕方法(其中之一必须是物理屏障方法(避孕套、隔膜或子宫颈/子宫帽))直至fpa008的最后剂量之后6个月为止。其他有效避孕形式是在筛选之前至少6个月进行永久性绝育(子宫切除术和/或双侧卵巢切除术或使用手术的双侧输卵管结扎或输精管切除术)。<55岁的女性应具有>40的fsh。育龄女性患者必须在研究之前使用稳定口服避孕疗法或子宫内或移植装置至少90天,或禁绝性交作为一种生活方式。这些纳入标准不允许放弃。4.3.用于研究参与的排除标准若适用任一下列标准,则排除招募至1期或2中的患者:1.使用抗csf1r抗体的先前治疗2.使用plx3397的先前治疗,除非因耐受不良(即对于先前激酶抑制剂为非进展性)而中断;容许使用伊马替尼或尼罗替尼的先前治疗3.在筛选时的ck及肝功能测试(包含alt、ast及总胆红素)在地方实验室正常范围之外4.不适当器官或骨髓功能,其定义如下:血红素<10g/dl,绝对嗜中性粒细胞计数<1.5×09/l,血小板计数<100×09/l,血清肌酸酐>1.5×uln或计算的肌酸酐清除<30ml/min5.所涉及关节在在第一研究剂量施用之前12周内进行任何手术程序(除基线滑膜活检外(若实施的话))6.临床显著的当前或历史肌肉病症(例如肌炎)、最近未消退肌肉损害或任何已知升高血清ck浓度的病状7.在第一研究剂量施用之前<1年具有充血性心力衰竭或心肌梗塞的历史8.nyha>2级的降低的心脏功能9.不受控或显著心脏病症,例如不稳定性心绞痛10.在筛选时ecg具有显著异常。在筛选时,男性的qtcf>450msec或女性的qtcf>470msec11.禁忌mri及使用基于钆的静脉内造影剂12.对先前生物药剂具有严重过敏的(allergic)、过敏性(anaphylactic)或其他输注相关反应的历史13.在fpa008的第一剂量之前≤28天使用任何抗癌疗法进行治疗或参与使用研究药物在另一治疗性临床研究14.针对先前生物药剂的ada的已知历史15.对tween20(聚山梨醇酯20)敏感的已知历史16.以规则方式消耗非消毒牛奶,或具有对暴露于机会性细胞内感染(例如李斯特氏菌(listeria))或其他感染(例如病原体)的已知重大风险。17.在治疗第一天之前28天内接受任何疫苗。fpa008对确立免疫学疫苗响应的效应未知。可在研究的同时施用流感疫苗或其他疫苗,但fpa008对接种疫苗的安全性及功效的影响是未知的。18.当前具有未消退的感染或慢性活动性临床显著感染(病毒[例如hbv、hcv]、细菌、真菌或其他感染)的历史,其在研究者看来会将患者置于暴露于csf1r抑制剂的风险下19.关于人免疫缺失病毒(hiv)的已知阳性测试20.活动性tb21.在筛选时关于潜伏性tb的阳性测试(quantiferon测试)22.先前恶性肿瘤史,以下情形除外:●治愈性治疗的非黑色素瘤皮肤恶性肿瘤●原位子宫颈癌●先前治愈性治疗2年以上且并无复发证据的实体肿瘤23.缺乏周边静脉通路或任何干扰药物施用或研究样品收集的病状24.任何在研究者看来对患者安全性施加风险或干扰研究参与或受试者患者结果的诠释的不受控医学病况或精神病学病症25.不能实施和/或遵守研究及随访程序。这些排除标准不允许放弃。4.4.患者退出及替换患者有权停止治疗或在任何时间自研究退出。患者可继续fpa008治疗的重复循环(最多6个循环)直至适用下列标准中的至少一项为止:●在患者请求下或在其法定代表请求下撤回同意书●患者潜在疾病发生进展●任何向患者施加不可接受的安全性风险的事件●在很大程度上影响临床状态评估且需要中断疗法的间发性病况●在研究期间的任何时间处的阳性怀孕测试●在发起人或其全权代表的特定请求下(例如,若出于患者安全性原因而终止研究)。记录中止fpa008的日期及原因,且研究者必须尽力实施治疗结束时随访访视。出于安全性原因,在fpa008的最后剂量之后追踪患者90天(±7天);追踪患有进行中的sae的那些直至消退或稳定为止。来自过早中断的患者的数据将保留为研究数据库的一部分。4.5.患者鉴定及招募患者必须能够提供书面知情同意书且满足所有纳入标准,且不满足排除标准。对于在研究中所招募的任何患者,研究者及发起人或其指派者不准许纳入或排除标准出现放弃。在招募患者之前,所有合格性标准必须得到满足。将符合研究条件的1期的患者招募至第一可用群组中。在2期中,招募大约30名患者的群组。在研究中总共招募大约42-45名患者。若非合格发现被视为错误或急性发现可能满足重复测试中的合格性标准,则研究者可在招募之前重复合格实验室测试及重要器官测试/ecg。5.研究药物5.1.fpa008药物产物此研究中的研究药物产物是fpa008。fpa008的研究供应将由发起人(或指派者)提供至研究中心并在临床研究中由受训医护专业人员施用于患者。fpa008药物产物的简单描述提供于如下:●配制物:fpa008药物质(drugsubstance)由如下组成:ph6.3缓冲液(含有20mml-组氨酸、142mml-精氨酸及0.01%聚山梨醇酯20)中的20mg/mlfpa008。●如何供应:以存于配备有丁基橡胶塞及翻转铝密封件的5mliso6r类型1玻璃小瓶中的无菌、水性、无色、无致热原溶液形式供应fpa008药物产物以用于静脉内施用。每一小瓶含有最少5ml的20mg/mlfpa008溶液(大约100mg/小瓶)。●储存条件:2-8℃(36-46°f)。●根据地方法规来标记fpa008小瓶及纸板箱。5.2.施用基于此研究中的患者的体重来施用fpa008剂量。研究药师(或其他负责人员)将制备用于施用的溶液。在基于患者体重计算小瓶数量之后,在大约100ml0.9%氯化钠溶液中稀释研究药物产物。所制得fpa008应在制备之后≤6小时施用(环境温度)。用于fpa008输注的静脉内施用组必须含有0.22μm在线过滤器或0.22μm注射器过滤器。在医学监督下将大约30分钟静脉内输注经由周边静脉或中央静脉导管施用fpa008。若患者在完成输注之前经历输注反应,则必须停止输注,且应迅速根据体征及症状及当地临床方案来管控患者。若所有迹象及症状均已消退,则可以较缓慢速率重新开始输注。若体征及症状不消退,则不应重新开始输注。患者应在研究药物输注结束之后密切观察至少1小时。所有小瓶均仅使用一次。研究药物制备及施用的说明提供于医药手册(pharmacymanual)中。5.3.起始剂量及剂量修改各群组之间在1期中的fpa008起始剂量水平及后续剂量递增描述于3.1.2部分中。通过评估来自研究的1期的数据来确定2期中的fpa008剂量。5.3.1.群组之间fpa008的剂量递增剂量递增至下一群组仅始于在前一剂量群组已完成dlt时段之后。在由crc根据crc纲领作出潜在剂量递增决定之前,28天(dlt时段)的安全性数据必须可用于至少3名安全性可评估患者。若群组中的患者缺乏适当安全性数据(例如,因在早期自研究退出或与方案的依从性较差),则将其他患者招募至群组中。以逐步方式进行每一连续剂量群组中的剂量递增。由crc评审第一群组或前一剂量群组的所有相关安全性信息。计划继续剂量递增直至剂量限制毒性出现于群组中的2名或更多名患者中为止。中断剂量递增的决定将由发起人及研究者基于达到mtd或显示适当药效学效应的剂量水平共同作出。在第1群组中,最初在1mg/kgfpa008的起始剂量(通过输注给予)处招募3名患者。dlt发生(5.3.3部分)将决定是否在后续群组中递增剂量。剂量递增决定规则汇总于表2中。表2:递增的决定标准5.3.1.1.最大耐受剂量rd的选择基于临床响应数据以及pk及pd特征。发起人及研究者可在达到4mg/kg的最高计划剂量之前决定中断剂量递增,或可在安全性、pk及pd数据支持评估不同剂量水平时评估较高(>4mg/kg)或中间(3mg/kg)剂量。不意欲递增至mtd,但其是可发生的。因此,将mtd定义为在小于33%的接受fpa008(在计划28天循环的第1天及第15天施用)的患者中与循环1中的dlt有关的最高剂量。若在1期期间未达到mtd或1期中之后续治疗循环提供关于安全性特征的其他见解,则可根据总体耐受性、pk及自进行中的临床评估外推的有效暴露的估计来选择rd。5.3.1.2.最低剂量水平处的毒性若意外发现1mg/kg的第一剂量水平超过mtd,则关于进行方式的决定将基于安全性、耐受性及pk数据;且在研究者与发起人之间达成一致。可选择较低剂量水平用于下一群组。5.3.2.群组内的剂量递增不允许高于起始剂量的患者内剂量递增。若出于ae降低患者剂量,则可在ae消退之后且在与发起人讨论且由其批准之后剂量递增至最初指定的剂量。ae复发至大于2级将使得持续减少剂量且不会再递增。5.3.3.剂量限制性毒性dlt定义为发生于治疗的循环1期间的下列事件中的任一项且由研究者以及涉及fpa008的crc进行评估。在适用时,根据ncictcae(4.03版)来对事件进行分类。●任何等级≥3相关事件,下列事件除外:-对于并无相关临床或实验室异常的alt、ast或ck升高而言,应用下列dlt定义:■ck相关dlt:ck>10×正常值上限(uln)■alt或ast相关dlt:◆alt或ast>8×uln◆alt或ast>3×uln且相关总胆红素>2×uln自研究治疗去除在dlt评估时段(循环1)期间经历dlt的1期患者。在循环1之后的循环中经历在dlt评估时段期间视为剂量限制性毒性的患者无需在研究中中断研究参与。5.3.4.剂量修改标准对于超过1期中dlt时段的延长治疗中的患者或2期中的任一患者而言,可根据下列指南允许剂量减少。若研究者考虑不符合此类指南的剂量减少或中断,则此类剂量减少或中断需要与发起人进行讨论且由其批准。患者可出于不良事件或其他事件删除最多2个连续剂量(在剂量之间最长6周)且可在治疗中断6周内事件返回基线或≤1级时重新开始研究药物。出于不良事件删除长于6周的其他给药使得患者需要自研究中断,除非发起人容许。患者可在参与研究的过程中删除剂量,包含出于排定空闲或其他个人原因视需要删除剂量,但不能删除连续2个以上剂量。fpa008的循环2第1天输注仅可在完成28天dlt窗之后施用。所有后续输注皆可使用±3天窗口施用。患者不应在7天内接受2个fpa008剂量。每一循环的第一剂量可视为每一循环的第1天,除非存在治疗延迟,否则每28天一次重复循环。患者可在后续循环的第1天具有治疗延迟,只要第1天治疗在最后治疗的6周内。若患者的ck升高>5×uln但<10×uln,则基于伴随体征、症状及其他实验室发现的研究者评估(表3),下一排定研究治疗可自最后施用治疗剂量延迟最长28天。在alt或ast升高的情形下:●在任一时间下,若alt或ast升高>3×uln且伴有总胆红素升高>2×uln,则应维持fpa008,且患者应退出安全性随访。●若alt或ast升高>3×uln但<5×uln且胆红素不>2×uln,则应在下一排定访视时重复测试,且若alt或ast持续较高但仍<5×uln,则剂量可延迟最多28天。2个连续剂量之间的最小间隔不能小于7天。●若患者的alt或ast升高>5×uln但<8×uln,则基于伴随体征、症状及其他实验室发现的研究者评估,下一排定研究治疗可自最后施用治疗剂量延迟最长28天。●若患者经历归因于研究治疗的3级或更高alt或ast不良事件或alt或ast升高>8×uln(不论何种原因),则应中断研究药物且患者应退出研究治疗。对于alt或ast升高>3×uln且伴有总胆红素升高>2×uln的患者而言,也应自治疗退出。在ck升高的情形下:●因ck升高>10×uln,应中断治疗表3:除alt、ast和ck外的研究药物相关事件的剂量延迟及修改指南注意:表3适用于除上述alt、ast及ck规则外的不良事件。若出于不良事件降低患者剂量,则可在ae消退之后且在与发起人讨论且由其批准之后剂量递增至最初指定的剂量。ae复发至大于2级将使得持续减少剂量且不会再递增。5.3.5.研究药物输注期间的剂量中断若在输注期间发生任何≥3级的ae,则必须停止fpa008输注。若在输注期间患者发生支气管痉挛或呼吸困难,则应停止输注。另外,在研究者的判断下,若在输注期间发生较不严重ae(1级或2),则可减少输注速率或停止输注。若3级或更小严重程度的ae在6小时内消退,则可以先前速率的一半重新开始输注。若相同ae以相同严重程度在重新开始的输注期间于任何时间再次出现,则应中断输注,且未经发起人(或指派者)商讨即不能进一步给药研究药物。若患者经历输注反应,则应在输注期间监测患者的生命体征(温度、血压、脉搏及呼吸速率),且在输注之后经最少1小时的每30分钟一次进行监测且直至输注反应消退为止。应在医师的直接监督下且根据有效治疗方案在研究场所处管控全身性过敏性响应。然而,在不存在此种方案的情况下,应使用附录6中所提供的标准化治疗方案。5.4.盲化及破盲盲化及破盲是不适用的,这是由于这是开放标记研究。5.5.药物责任研究者或适当合格人员负责维持整个研究中的精确研究药物责任记录。研究者负责将所有未使用研究药物返回发起人(或指派者),且必须确认研究者不拥有所剩余的供应用品。在发起人(或指派者)已批准记载破坏程序后,允许研究场所根据站点政策破坏已使用或部分使用的研究药物小瓶。应在研究期间及在完成研究时通过使用药物库存日志核查及记录在研究场所接收、自研究场所分配、返回研究场所及由研究场所处理的所有研究药物的精确记录。5.6.研究产品依从性仅合格受训位点人员可施用fpa008。在研究需求中受训的医药人员将监测与治疗分配的依从性。经大约30分钟经由周边静脉或中央静脉导管由受训医护专业人员输注fpa008。在患者的电子病例报告表(ecrf)中记录所施用研究药剂的记录(日期、开始及停止时间及相对于制备时间施用的剂量)。5.7.伴随药物及治疗在ecrf上获得所有伴随药物(包含草本及其他非传统治疗剂)。收集下列参数:通用名、施用途径、开始日期、停止日期、剂量、频率及适应症。伴随药物的剂量或方案的任何变化也必须记录于ecrf中。在筛选时,询问患者其在前28天期间服用何种药剂。在每一后续研究访视时,询问患者伴随药物自先前访视的任何变化。在整个研究中,研究者可开出视为提供适当支持性护理所需的任何伴随药物或治疗的处方,下列情形除外:●其他实验药物或装置●其他用于治疗pvns的全身性药剂,例如伊马替尼或尼罗替尼●慢性每日皮质类固醇≥10mg/kg普赖松(或等效物)若患者使用禁止药剂或经历肿瘤切除术,则发起人应商讨决定患者是否应退出研究。患者可根据标准临床实践指示开始或继续疼痛药剂。视需要允许转输。对于初始fpa008剂量而言,不施用常规术前用药。若患者发生恶心、呕吐或其他输注相关ae,则患者可在随后输注fpa008之前在研究者判断下预先考虑止吐药、类固醇或抗组织胺。根据机构标准方法施用治疗,且应提供于患者ecrf上。6.评估参数及方法通过监测ae及体检(包括体重)、生命体征、12导联ecg、疾病相关体征及症状及临床实验室测量的变化来评估fpa008的安全性。评估血样的免疫原性。6.1.肿瘤响应参数在筛选时(在第一剂量之前28天内)、在开始治疗后4、8及16周实施mri(附录1)。在计划再成像时,mri应在剂量施用1周内完成。除非已在前6周内实施肿瘤评估或先前已测得肿瘤进展,否则所有患者均应在30天(±7天)及90天(±7天)治疗结束时随访访视中进行肿瘤响应参数评估。在筛选时、c1d15(给药前)、c2d1(给药前)且然后在24周中的所有后续循环的第1天(给药前)或直至治疗中断为止进行健康结果(功能、症状)的临床评估。每14(±2)周追踪在治疗结束时随访期之后尚未进展的患者(参见7.2.10部分)直至进展为止,在c1d1后,患者经受局部疗法(例如切除术、放射)或开始新全身性疗法最长52周。使用recist1.1(eisenhauer,2009)及总体积评分(tap,2014)评估放射学可测量疾病的响应。使用mri进行肿瘤的放射学测量。弥散性pvns的线性测量并发有诸多因素。因肿瘤在特征上是非晶形且其形状可有所变化,故连续线性测量与肿瘤体积变化的关联取决于实施测量的位置。然而,在某些位置中肿瘤与毗邻组织之间的较差对比性限制了可精确进行此类测量的位置。另外,线性测量对于连续获取影像上的区段平面变化高度敏感。然而,考虑到recist在肿瘤学临床试验中的长久惯例,根据recist1.1指南,在此研究中使用每一关节或腱鞘中最多两个可测量肿瘤位置的线性测量作为参考。也通过tvs评估放射学响应。tvs已用于显示csf1r酪氨酸激酶抑制剂的治疗效应的最新pvns研究中。据信,pvns的临床影响主要源自由受限关节及关节周间隙内的肿瘤生长引起的质量效应及局部结构损害。肿瘤生长干扰关节弯曲且也可破坏关节的结构及功能完整性,这是由于肿瘤会侵袭局部骨及软组织。pvns临床试验中的成像目标由此在于监测肿瘤体积变化且监测对局部组织的任何相关损害。弥散性pvns的体积量化并发有肿瘤的不规则形状、肿瘤与其周围结构之间的异质性对比及通过基于钆的静脉内造影剂所观察到的可变增强。肿瘤因此难以在某些位置中描绘,从而使得自动化分段不可靠且人工分段较为主观。血铁黄素沉积通常不显著改进对比性,这是由于血铁黄素的分布可变、异质且不总是局限于肿瘤。另外,可能难以辨别活肿瘤与惰性瘢痕组织或病灶内及病灶周的流体收集物。在此类情况下,使用半定量顺序量表的目测评分通常比体积量化更为可靠,如曾经在关节炎临床试验中使用滑膜增厚评估的经验所述。采用mri来评估关节炎的抗炎症性疗法的试验基于半定量评分。tvs量表是基于最大膨胀滑膜腔(其在关节之间有所变化)或最大膨胀腱鞘(假设为所涉及腱的直径的三倍)的估计体积的10%增量。因此,等于最大膨胀滑膜腔或腱鞘的体积的肿瘤评分为10,而为该体积的70%的肿瘤评分为7,且两倍于该体积的肿瘤评分为20。根据下列标准来分类tvs的个体患者结果:●完全响应(cr):病灶完全消失●部分响应(pr):体积评分相对于基线降低≥50%●疾病进展(pd):体积相对于研究期间(不论在基线时或在某一其他访视时)的最低评分的增加≥30%●疾病稳定(sd):不满足基于研究期间的评分的任一先前标准。注意:在筛选期间无需重复实施为fpa008的第一剂量28天(4周)内的患者标准护理的一部分的肿瘤评估。6.2.安全性参数6.2.1.实验室参数在每一研究场所实验室借助其确立方法来局部实施实验室评估。在开始研究之前,研究者向发起人(和/或指派者)提供测量的正常范围及单位的列表。应使用标准静脉穿刺技术获取血样。根据评估计划表(附录1)来测定下列实验室参数(表5):表5:实验室评估引起患者治疗管控变化(例如剂量延迟、需要其他药剂或监测)的异常实验室结果出于此研究的目的可视为临床显著且记录于ecrf的ae页中。满足sae标准的值必须报告为sae。记载研究者对于ae与药物疗法的关系的确定及所采取的对策并描述于ecrf中。6.2.2.生命体征生命体征包含坐位血压、脉搏、呼吸速率及温度。在患者已休息至少5分钟之后获得所有生命体征。根据评估计划表(附录1)来分析生命体征。6.2.3.心电图根据评估计划表(附录1)来实施12导联ecg。研究者必须评审ecg,在源文件中记载此评审,且将在研究期间发生的任何临床显著变化作为ae记录于ecrf中。6.2.4.怀孕怀孕是排除标准且育龄女性必须不能考虑在研究期间怀孕。在使用fpa008治疗的第一给药之前小于5天必须具有阴性血清孕检。在研究期间及在最后治疗之后6个月,可能生殖的患者(男性及女性)必须实施2种有效避孕方法(4.2部分)。。6.2.5.体检根据评估计划表(附录1)来实施体检。在筛选时实施包含身高及体重的完全体检。应根据事件计划表(附录1)来实施完整体检。6.2.6.免疫原性通过测量来自所有患者的总抗fpa008抗体来评估免疫原性(定义为对fpa008的免疫响应)。免疫原性测试包括筛选、证实及滴定。在附录2中所设计的时间点处自每一患者抽取用于免疫原性评估的样品。根据实验室手册中所提供的说明收集用于免疫原性测试的样品且进行处理。6.2.7.ecog体能状态在筛选时、在给药之前72小时内及在整个治疗结束时随访期中评估ecog体能状态(附录1)。6.3.药代动力学参数在此研究中,如附录2中概述收集用于测定血清fpa008的样品。取样将容许测定暴露(auc)、cmax、cmin(谷值浓度)、cl及vss。在数据容许时,也可计算其他pk参数(例如累积比率及半衰期)。根据单独实验室手册中所提供的说明收集此类样品且进行处理。6.4.药效学参数评估下列探索性终点(附录2):●血清:csf1及il34配体浓度、ctx及trap5b骨吸收标志物浓度●全血-cd14+/cd16+单核细胞子集浓度下列程序(参见附录1)仅适用于签署适用可选研究知情同意书的患者;此类程序的目的在于理解fpa008对于炎症(滑膜及滑液)中局部生物标志物的变化及fpa008在所涉及关节滑液)中的分布的影响:●滑膜(可选)-在预处理时,评估滑膜活检组织的csf1基因转座(若先前未进行)-针对以下的基线及治疗滑膜活检ihc:■csf1及csf1r■cd68●滑液(可选)-fpa008浓度;上述标记物的细胞组分(通过ihc)。6.5.患者及临床医师报告结果测量在筛选时、c1d15(给药前)、c2d1(给药前)且然后在24周中的所有后续循环的第1天(给药前)或直至治疗中断为止且在整个治疗结束时随访期中进行健康结果(功能、症状)的临床评估。尚未进展且进入长期随访的患者拟每14周(±2)周一次进行追踪直至进展为止,在c1d1后,患者经受局部疗法(例如切除术、放射)或开始新全身性疗法最长52周。使用下列工具收集关于症状及功能结果在探索性终点数据:●ogilvie-harris(oh)量表(附录4):此工具是针对pvns患者特定研发的(ogilvie-harris,1992)且已用于其他pvns公开案(deponti,2003;rhee,2010)中。此工具的特征包括如下:-其是临床医师报告的结果(cro)测量-其是基于用于4个区域的每一个的0-3间隔量表:■疼痛■滑膜炎/渗出■活动范围■功能能力-其使用指示严重失能、疼痛及功能损失在量表下限(评分min=0)及指示无失能的较高值(评分max=12)。可将评分求和并分类如下:■较差病状(0-3点)■普通病状(4-6点)■良好病状(7-9点)■优良病状(10-12点)-相对于其他位置特异性结果测量(例如womac、koos等)而选择用于此研究,这是由于:■其可用于受pvns影响的任何关节中■其是通过解决pvns的症状(疼痛及滑膜炎/渗出)而对pvns疾病具有特异性■其具有低响应性负担-4个“问题”-然而,其仅公开于膝pvns患者中且尚未针对金标准结果测量(例如sf-36或eq-5d-5l量表)进行验证。因此,eq-5d-5l量表(患者报告结果)也用于此研究中。●eq-5d-5l(附录5):这是健康状态的熟知的一般测量,其最初公开于2001年(rabin)且包括如下特征:-已用于多个国家的许多疾病及慢性病状中-是患者报告结果(pro)测量-用作活动性pvns临床试验中的功能评估(mcs110,novartis)-是基于用于5个范围的每一个的0-5间隔量表,其中量表下限(评分min=0)指示死亡(或较死亡更糟)健康状态且较高值(评分max=100)指示完美健康状态:■(1)运动性■(2)自我护理■(3)惯常活动■(4)疼痛/不适■(5)焦虑/抑郁症-其也使用vas以20-cm垂直线来测量响应者当前健康,其中0=“最差可能的健康”且100=“最佳靠想象健康”-其已在多个国家进行验证且可用于119种语言。其具有仅有6个问题的低响应性负担且可用于若干媒介(纸、网络及小传单)中。7.研究实施7.1.患者评估的概述在最长28天(4周)的初始筛选时段之后,使用fpa008以28天循环每2周(±3天)一次治疗患者,且经大约30分钟施用fpa008。评估的所有时间点都应在所陈述的时间范围中完成。在患者签署知情同意书之前实施的评估仅在证实是标准护理情况下方可接受。详述患者评估的计划表显示于附录1及附录2中。关于pk、pd及免疫原性数据的取样及处理的说明描述于单独方案特异性实验室手册中。7.2.通过访视进行的研究评估及程序7.2.1.筛选时段(第-28天至第0天)完全同意参与研究的患者将在施用fpa008的第一输注之前28天(4周)内经受筛选评估(除非另有说明)。为测定患者是否满足所有纳入标准且不违背排除标准,实施下列程序(附录1):●必须在任何研究特异性程序之前收集所签署书面知情同意书●完整医学及疾病历史●人口统计学及基线特性●生命体征(在休息5分钟之后的坐位血压、脉搏、呼吸速率及温度[℃])●完总体检,包含身高及体重●ecog体能状态评估●12导联ecg(在筛选时需要,且若在研究期间临床指示)●若适用,则报告ae●先前及并行药剂的文件●quantiferon测试(用于潜伏性tb)●临床安全性实验室分析,如表5中所概述(包含ana)●ogilvie-harris及eq-5d-5l评估●任选的存档组织●任选的滑膜活检组织●任选的滑液抽吸液●育龄女性在循环1第1天之前≤5天的血清孕检(β-人绒毛膜促性腺激素[β-hcg])●放射学成像:在fpa008的第一输注之前28天内实施所涉及关节的mri。若在第一研究输注28天内将mri实施是患者标准护理的一部分,则在提供结果记载且适于评估时,其无需重复。注意:在开始研究治疗之前,必须将方案特异性患者登记表呈递至发起人(或指派者)以证实患者合格性。7.2.2.治疗配置(给药分配)这是一项开放标记研究。将招募数量传真或电邮至研究者(或指派者)。发起人(或指派者)会保留特定群组内治疗的患者数的记录且将决定向哪一治疗群组分配新招募的患者。7.2.3.1及2期:循环1,第1天实施下列程序:●在fpa008输注之前(≤72小时内,除非另有说明):-验证合格性-更新医学及疾病历史以获取来自筛选的任一变化-若适用,则报告ae-评审伴随药物-记录体重-生命体征(在休息5分钟之后的坐位血压、脉搏、呼吸速率及温度[℃])-ecog体能状态评估-临床安全性实验室分析(除尿分析及ana外),如表5中所概述-仅对于育龄女性而言,在fpa008的第一剂量之前≤5天实施血清β-hcg(通过地方实验室评估)-pk、ada、血清生物标志物及cd14+/cd16+单核细胞样品收集(在≤4小时内),如附录2中所概述。●研究药物施用:通过静脉内输注经大约30分钟施用fpa008●在施用fpa008后:-pk、血清生物标志物及cd14+/cd16+单核细胞样品收集(±5min),如附录2中所概述。-在完成静脉内输注之后的下列时间点的给药后生命体征(在休息5分钟之后的坐位心率、血压、呼吸速率及温度[℃]):○5分钟、15分钟、30分钟及1小时-若适用,则报告ae-评审伴随药物7.2.4.1及2期:循环1,第2天pk、血清生物标志物及cd14+/cd16+单核细胞样品收集,如附录2中所概述。若适用,则报告ae评审伴随药物7.2.5.1及2期:循环1,第8天研究患者将在第8天(±2天)返回研究中心。不施用治疗。完成下列评估:●生命体征(在休息5分钟之后的坐位血压、脉搏、呼吸速率及温度[℃])●临床安全性实验室分析(除ana外),如表5中所概述●pk、血清生物标志物、cd14+/cd16+单核细胞样品收集,如附录2中所概述。●若适用,则报告ae●评审伴随药物7.2.6.1及2期:循环1,第15天研究患者将在第15天返回研究中心,且完成下列评估。●在fpa008输注之前(≤72小时内,除非另有说明):-记录体重-生命体征(在休息5分钟之后的坐位血压、心率、呼吸速率及温度[℃])-临床安全性实验室分析(除尿分析及ana外),如表5中所概述-ogilvie-harris及eq-5d-5l评估-pk、ada、血清生物标志物及cd14+/cd16+单核细胞样品收集(在≤4小时内),如附录2中所概述-更新医学及疾病历史-若适用,则报告ae-评审伴随药物●研究药物施用:通过静脉内输注经30分钟施用fpa008●在施用fpa008后:-在输注结束之后15分钟(±5min)收集pk样品(如附录2中所概述)-在完成静脉内输注之后的下列时间点的给药后生命体征(在休息5分钟之后的坐位心率、血压、呼吸速率及温度[℃]):○5分钟、15分钟、30分钟及1小时-12导联ecg(在pk/pd样品收集之后于给药后大约30分钟内)-若适用,则报告ae-评审伴随药物7.2.7.1期:循环1的结束对于1期患者而言,若在循环1结束时研究者测得患者可受益于继续给药fpa008,则可进入延长治疗期。若患者继续进行延长治疗期(循环2及更多循环),则进行7.2.8部分中所概述的程序。若患者没有资格接受fpa008的其他剂量,则患者返回诊疗所进行治疗结束时随访访视。7.2.8.1期延长治疗/2期循环2及后续循环1期延长治疗可开始于循环2第1天。若患者经历疾病进展或不可接受毒性,则中断给药。在每一输注访视时,患者在每次施用fpa008之后逗留于研究场所处直至完成用于安全性监测的所有给药后评估为止。除非另有说明,否则在每一访视时实施下列评估((附录1):7.2.8.1.1及2期:循环2及后续循环,第1天在研究药物的每一输注之前(≤72小时内,除非另有说明):-生命体征(在休息5分钟之后的坐位心率、血压、呼吸速率及温度[℃])-完总体检,包含循环2、4及6中的重量-ecog体能状态评估-ogilvie-harris及eq-5d-5l评估-临床安全性实验室分析(除尿分析及ana外),如表5中所概述-在循环2、3及5的第1天的pk、ada、血清生物标志物及cd14+/cd16+单核细胞样品收集(在≤4小时内),如附录2中所概述。-在c2d1、c3d1及c5d1的1周内使用用于用于评估基线肿瘤测量的相同物理或放射学参数对所涉及关节实施mri-在剂量施用之前最多-2天的任选的滑膜活检(仅循环2),如附录1中所概述-在剂量施用之前最多-2天的任选的滑液抽吸液(仅循环2),如附录1中所概述-若适用,则报告ae-评审伴随药物研究药物施用:通过静脉内输注经大约30分钟施用fpa008在研究药物施用后:-在完成静脉内输注之后的下列时间点的给药后生命体征(在休息5分钟之后的坐位心率、血压、呼吸速率及温度[℃]):-5分钟、15分钟、30分钟及1小时-在循环3及5第1天于输注结束之后15分钟(±5min)收集pk样品(附录1)。-若适用,则报告ae-评审伴随药物7.2.8.2.1及2期:循环2及后续循环,第15天在研究药物的每一输注之前(≤72小时内,除非另有说明):-生命体征(在休息5分钟之后的坐位心率、血压、呼吸速率及温度[℃])-临床安全性实验室分析(除尿分析及ana外),如表5中所概述-若适用,则报告ae-评审伴随药物研究药物施用:-通过静脉内输注经大约30分钟施用fpa008在研究药物施用后:-在完成静脉内输注之后的下列时间点的给药后生命体征(在休息5分钟之后的坐位心率、血压、呼吸速率及温度[℃]):○5分钟、15分钟、30分钟及1小时-12导联ecg(在pk/pd样品收集之后于给药后大约30分钟内)-若适用,则报告ae-评审伴随药物7.2.9.治疗结束时随访期在fpa008的最后输注之后大约30天(±7天)、60天(±7天)及90天(±7天),患者将返回研究中心三次以完成治疗结束时随访期。实施下列评估:●生命体征(在休息5分钟之后的坐位脉搏、血压、呼吸速率及温度[℃])●仅在30天(±7天)治疗结束时随访访视中的12导联ecg●仅在30天(±7天)治疗结束时随访访视中进行完总体检。在所有访视下均记录体重●ecog体能状态评估●临床安全性实验室分析,如表5中所概述(包含仅在30天(±7天)治疗结束时随访访视中的ana)●pk、ada、血清生物标志物及cd14+/cd16+单核细胞样品收集,如附录2中所概述●育龄女性中的血清β-hcg(通过地方实验室评估)●在30天(±7天)及90天(±7天)治疗结束时随访访视中的所涉及关节的mri、ogilvie-harris及eq-5d-5l评估。若在前6周内实施或若先前已测得肿瘤进展,则可删除这些。)每14(±2)周追踪在治疗中断时尚未进展且同意继续参与研究的患者直至进展为止,在c1d1后,患者经受局部疗法(例如切除术、放射)或开始新全身性疗法最长52周。●若适用,则报告ae●评审伴随药物7.2.10.长期随访期尚未进展的患者应在完成治疗结束时随访期之后继续进行长期随访。每14周(±2)周一次追踪患者直至进展为止,在c1d1后,患者经受局部疗法(例如切除术、放射)或开始新全身性疗法最长52周。实施下列评估:●临床安全性实验室分析,除尿分析及ana外●pk、ada、血清生物标志物及cd14+/cd16+单核细胞样品收集,如附录2中所概述●所涉及关节的mri、ogilvie-harris及eq-5d-5l评估●若适用,则进行用于视为与研究治疗相关的进行性不良事件的ae报告●报告伴随药物(局部疗法(例如切除术、放射)或仅新全身性疗法)8.统计学方法在数据库锁定之前,完成单独统计学分析计划(sap),从而提供用于下文时概述分析的详细方法。描述与计划分析的任何偏离且在最终总体研究报告中加以证实。8.1.研究患者8.1.1.患者概况呈现可评估dlt、安全性、功效、pk及pd的患者的数量及百分比。还汇总了退出原因。8.1.2.方案偏差提供具有方案偏差的患者的数量及百分比的汇总(根据偏差类型)。在数据库锁定之前,在sap中定义偏差。8.1.3.分析群体定义下列分析群体以用于研究:●安全性群体-所有已接受fpa008的至少一个剂量中的任一部分的患者。●dlt可评估群体-所有招募至研究的1期中且接受至少2个fpa008剂量并完成治疗的循环1的患者,或在循环1中经历dlt的那些。●pk可评估群体-所有接受至少一个fpa008剂量且具有适用于测定pk特征的pk评估的患者。●功效可评估群体-所有满足合格性标准、接受至少1个fpa008剂量、在基线下具有可测量肿瘤病灶且具有至少1个基线后疾病评估的患者。●治疗意向群体(itt)-所有招募的患者。无基线后疾病评估的患者将视为非响应者。8.2.一般考虑所有分析都是描述性的且在适当时按剂量组及总体呈现。将来自2期的患者数据汇总为单独组。还汇总了所有以rd给药的患者。使用汇总表及患者数据列表呈现此研究中所收集的数据。使用描述性统计学(具体而言有效例数、算术平均值、中值、标准偏差(sd)、最小值及最大值)来汇总连续变量。按照频率及百分比来汇总类别变量。方案中所描述数据分析方法的变化仅在改变方案主要特征时需要修正方案。在数据库锁定之前完成sap。描述最终sap中所描述方法的任何变化且在临床研究报告中予以证实。8.3.人口统计学、基线特性及伴随药物按照群组及总体汇总人口统计学数据、病历、其他基线特性、伴随疾病及伴随药物。为测定是否满足研究实施标准,提供相应表格及列表。此类表格及列表包含方案偏差评估、研究药物责任及其他可影响研究的一般实施的数据。8.4.治疗依从性按群组汇总治疗施用,包含剂量施用、剂量修改或延迟、累积剂量、平均剂量、输注数量及疗法持续时间。8.5.肿瘤响应分析根据最佳总体肿瘤响应(完全响应[cr]、部分响应[pr]、疾病稳定[sd]或疾病进展[pd])来对患者进行分类。计算(在适当时)按照最佳总体肿瘤响应分级的患者的频率、比例及精确95%ci。将具有cr或pr的最佳总体肿瘤响应且持续时间为至少4周(28天)的患者进一步分类为具有客观肿瘤响应。呈现具有目标肿瘤响应的患者的列表。通过recist1.1及总体体积评分对患者响应进行分类。肿瘤体积评分根据下列定义来分类响应:完全响应[(cr)病灶在研究结束时完全失去]、部分响应[(pr)体积评分相对于基线的降低≥50%]、疾病进展[(pd)体积相对于研究期间(不论在基线时或在某一其他访视时)的最低评分的增加≥30%]或疾病稳定[(sd)不满足基于研究期间的评分的任一先前标准]。除局部评审外,总体评审所有mri扫描,且测定肿瘤响应的局部评估及总体评估之间的同一性。响应持续时间计算为自总体响应(cr或pr)的第一记载至疾病进展或死亡(以先出现者为准)的第一记载的天数。在最后肿瘤响应评估时检查在数据分析时存活且无进展的患者。在适当响应以便决定切除剩余疾病的患者中,在手术程序时检查响应持续时间。8.6.安全性分析在研究的两个阶段内并针对所组合的所有患者单独实施安全性分析。在安全性分析中包含来自所有接受至少1个fpa008剂量的任一部分的患者的数据。将ae、临床实验室信息、生命体征、ecog体能状态、体重、ecg及伴随药物/程序制表并汇总。总体汇总ae且单独汇总严重ae、引起中断的ae、引起死亡的ae及ncictcae4.03版3级或更高级ae。描述性地汇总了体重及生命体征(n、平均值、标准偏差、中值、最小值及最大值)。以分类方式及描述方式汇总了ecog体能状态。对于群组及总体的实验室数据,提供显示按照治疗的基线等级及最大等级分类的患者计数及百分比的转换表。显著实验室变化定义为在治疗中自基线0级转移至3级(非血液学)或4级(血液学)或在治疗中自基线1级转移至4级。按照群组及总体对具有显著实验室变化的患者的数量及百分比进行制表。8.7.功效分析功效分析是描述性的。使用频率及百分比汇总总体响应率。使用描述性统计学(n、算术平均值、标准偏差、中值、最小值及最大值)以及以范畴方式汇总cr及pr患者的响应持续时间。使用recist1.1测定响应及响应持续时间。使用kaplan-meier方法汇总响应及pfs的持续时间。8.8.药代动力学分析将个别及平均(±sd)血清fpa008浓度-时间数据制表且按照剂量水平绘图。自血清药物浓度-时间数据使用非分室分析(nca)方法利用phoenixwinnonlin(certaralp,st.louis,mo)中的静脉内输注输入来计算fpa008pk参数。可考虑替代方法。对估计的个别及平均(±sd)pk参数进行制表且按照剂量水平汇总。可针对血清fpa008浓度-时间数据及估计pk参数报告其他描述性统计。在可能时,评估剂量均衡、药物累积及稳态达成。评估免疫原性对fpa008暴露的影响。8.9.中期分析未计划正式的中期分析。以常规方式由发起人及cro评审安全性数据。在1期中,发起人(和/或指派者)及研究者在剂量递增或递减之前评审来自每一剂量群组的安全性数据。在可用时,将来自延长治疗期的不良事件数据呈现至医学监测器。8.10.样本量的测定通常接受每个剂量样本量组三名患者且在dlt情形下将样本量增加至6作为适于测定递增剂量的新颖肿瘤学药物的安全性。若在3名患者中的1名中观察到dlt,则在相同剂量水平下再招募3名患者。剂量递增持续至在一定剂量水平下治疗的3-6名患者中的2名经历dlt。mtd定义为<33%的患者在循环1期间经历dlt的最大剂量。在测得mtd之后,可在该剂量水平下募集其他患者以进一步表征fpa008的安全性、pk、pd及初步功效。预计可在1期中招募12-15名患者。出于估计pvns/dt-tgct患者中的fpa008的orr的目标,估计在2期中招募大约30名患者。另外,总共在rd下招募大约33至36名患者。下表6显示相应95%ci及各个样本量及所观察响应率的精确度(agresti,1998)。表6:响应者的概率参考文献agrestia,coullb.approximateisbetterthan“exact”forintervalestimationofbinomialproportions.jamstatassoc,1998;52:119-26.bartoccia,mastrogiannisd,miglioratig,stockertr,wolkoffa,stanleye.macrophagesspecificallyregulatetheconcentrationoftheirowngrowthfactorinthecirculation.procnatlacadsci,1987;84:6179-6183.cassierp,gelderblomh,stacchiottis,thomasd,makir,kroepj,等efficacyofimatinibmesylateforthetreatmentoflocallyadvancedand/ormetastatictenosynovialgiantcelltumor/pigmentedvillonodularsynovitis.cancer,2012;118;1649-55.cassierp,gomez-rocac,italianoa,cannarilem,riesc,brilloueta,等phase1studyofrg7155,anovelanti-csf1rantibody,inpatientswithlocallyadvancedpigmentedvillonodularsynovitis(pvns).jclinoncolsuppl,2014;32:5摘要10504.daled,boxerl,lilesw.thephagocytes:neutrophilsandmonocytes.blood,2008;112(4):935-45.depontia,sansonev,malcherèm.resultofarthroscopictreatmentofpigmentedvillonodularsynovitisoftheknee.arthroscopy,2003;6:602-7.eisenhauere,therassep,bogaertsj,schwartzl,sargentd,fordr,等newresponseevaluationcriteriainsolidtumours:revisedrecistguideline(1.1版).eurjcancer,2009;45:228-247.greterm,leliosi,pelczarp,hoeffelg,pricej,leboeufm,等stroma-derivedinterleukin34controlsthedevelopmentandmaintenanceoflangerhanscellsandthemaintenanceofmicroglia.immunity,2012;37:1050-1060.hamiltonj,achuthana.colonystimulatingfactorsandmyeloidcellbiologyinhealthanddisease.trendsinimmunology,2013;34:81-89.herdmanm,gudexc,lloyda,janssenm,kindp,parkind,等developmentandpreliminarytestingofthenewfive-levelversionofeq-5d(eq-5d-5l).qualliferes,2011;20:1727-36.ogilvie-harrisd,mcleanj,zarnettm.pigmentedvillonodularsynovitisoftheknee.theresultsoftotalarthroscopicsynovectomy,partialarthroscopicsynovectomy,andarthroscopiclocalexcision.jbonejointsurgam,1992;74:119-123.rabinr,decharrof.eq-5d:ameasureofhealthstatusoftheeuroqolgroup.annmed,2001;33:337-343.radiz,guzmanr,bellr.increasedconnectivetissueextracellularmatrixintheop/opmodelofosteopetrosis.pathobiology,2009;76:199-203radiz,koza-taylorp,bellr,obertl,runnelsh,beebej,等increasedserumenzymelevelsassociatedwithkupffercellreductionwithnosignsofhepaticorskeletalmuscleinjury.amjpathol,2011;179:240-47.raviv,wangw-l,lewis,v.treatmentoftenosynovialgiantcelltumorandpigmentedvillonodularsynovitis.curropinoncol,2011;23:361-6.rheepc,sassoonaa,sayeedsa,stuartms,dahmdl.arthroscopictreatmentoflocalizedpigmentedvillonodularsynovitis:long-termfunctionalresults.amjorthop2010sep;39(9):e90-4.riesc,cannarilem,hovess,benzj,warthak,runzav,等targetingtumor-associatedmacrophageswithanti-csf-1rantibodyrevealsastrategyforcancertherapy.cancercell,2014;25:846-59.tapwd,anthonysp,chmielowskib等apilotstudyofplx3397,aselectivecolony-stimulatingfactor1receptor(csf1r)kinaseinhibitor,inpigmentedvillonodularsynovitis(pvns).jclinoncol2014;32:5s(suppl;abstr10503).wangy,szretterk,vermiw,gilfillans,rossinic,cellam,等il-34isatissue-restrictedligandofcsf1rrequiredforthedevelopmentoflangerhanscellsandmicroglia.natimmunol,2012;13:753-762.westr,rubinb,millerm,subramanians,kaygusuzg,montgomeryk,等alandscapeeffectintenosynovialgiant-celltumorfromactivationofcsf1expressionbyatranslocationinaminorityoftumorcells.procnatlacadsciusa,2006;103:690-5.yoshidah,hayashis,kunisadat,ogawam,nishikawas,okamurah,等themurinemutationosteopetrosisisinthecodingregionofthemacrophagecolonystimulatingfactorgene.nature,1990;345:442-444.缩写及定义表ada抗药物抗体adcc抗体依赖性细胞介导的细胞毒性作用ae不良事件alt丙氨酸转氨酶anc绝对嗜中性粒细胞计数anova方差分析ast天冬氨酸转氨酶auc血清浓度-时间曲线下面积β-hcgβ-人绒毛膜促性腺激素bun血尿素氮cbc完全血计数ck肌酐激酶cmax最大血清浓度cmin最小血清浓度cl清除率co2二氧化碳(碳酸氢盐)cr完全响应crc群组评审委员会cro临床医师报告的结果cro合同研究组织csf1集落刺激因子-1ct计算机断层扫描ctxi型胶原c-末端端肽ctcae常见不良事件术语标准dlt剂量限制性毒性dt-tgct弥散性腱鞘的巨细胞瘤ecrf电子病历报告表ecg心电图ecog美国东部肿瘤协作组(easterncooperativeoncologygroup)fda美国食品与药物管理局(foodanddrugadministration)fna细针抽吸gcp优质临床规范glp优质实验室规范hiv人类免疫缺陷病毒ib研究者的手册icf知情同意书ich国际协调会议(intemationalconferenceonharmonization)iec独立伦理委员会ihc免疫组织化学ind试验性新药(申请)inr国际标准化比率irb机构审查委员会iv静脉内ldh乳酸脱氢酶lvef左心室射血分数mch平均红细胞血红蛋白mchc平均红细胞血红蛋白浓度mcv平均红细胞体积mri磁共振成像mtd最大耐受剂量nci国家癌症研究所(nationalcancerinstitute)noael未观察到的不良作用水平ntxn-末端端肽nyha纽约心脏协会(newyorkheartassociation)orr客观响应率pd疾病进展pd药效学pet正电子放射成像术pfs无进展生存率pk药代动力学pr部分响应pro患者报告的结果ps体能状态pt凝血酶原时间ptt部分促凝血酶原激酶时间pvns色素绒毛结节性滑膜炎qtc校正的qt间隔rbc红细胞rd推荐剂量recist实体瘤响应评估标准sae严重不良事件sap统计学分析计划sd疾病稳定t1/2半衰期tb结核病trap5b抗酒石酸酸性磷酸酶5btvs肿瘤体积评分uln正常上限vss稳态分布体积wbc白细胞附录2:用于药代动力学、免疫原性及药效学血样收集的研究流程表*如果未施用fpa008,则不需要在输注后15分钟进行pk血液抽取。附录3:ecog体能状态附录4:pvns的ogilvie-harris评分●疼痛□严重(0点)□中等(1点)□轻度(2点)□无(3点)●滑膜炎/渗出□严重(0点)□中等(1点)□轻度(2点)□无(3点)●活动范围(*正常=150°)□>20%损失(0点)□10%-20%损失(1点)□0%-10%损失(2点)□无损失(3点)*实例:损失15°弯曲或伸展=损失10%(150-(150-15)/150)=10%●功能能力□最小活动(0点)□一些活动(1点)□大部分活动(2点)□所有活动(3点)附录5:eq-5d-5l在每一标题处,请将最佳描述当前健康的一个框打钩运动性我走路没问题我走路有轻微问题我走路有中度问题我走路有严重问题我不能走路自我护理我洗澡和穿衣没问题我洗澡和穿衣有轻微问题我洗澡和穿衣有中度问题我洗澡和穿衣有严重问题我不能洗澡和穿衣惯常活动(例如工作、研究、家庭工作、家庭或闲暇活动)我惯常活动没问题我惯常活动有轻微问题我惯常活动有中度问题我惯常活动有严重问题我不能进行惯常活动疼痛/不适我没有疼痛或不适我有轻度疼痛或不适我有中度疼痛或不适我有严重疼痛或不适我有极度疼痛或不适焦虑/抑郁我没有焦虑或抑郁我有轻度焦虑或抑郁我有中度焦虑或抑郁我有严重焦虑或抑郁我有极度焦虑或抑郁●我们愿意知晓今日您健康状况有多良好或较差。●此量表编号0至100。●100意指您认为可能的最佳健康状况。0意指您认为可能的最差健康状况。●在量表上标记x以表示您今日健康状况。●现在,请在下框中写下在量表上所标记的数字。附录6:全身性过敏性响应的管控施用研究药物的人员需要在输注之后前180分钟中密切监测所有患者的可能全身性过敏性响应(例如全身性皮疹、荨麻疹、感觉异常、支气管缩小、心悸),尤其需要关注那些具有气喘或对过敏原注射具有全身性响应的历史的患者。将所有全身性过敏性表现提供于适当ecrf页上且鉴定为是由过敏性响应所致。根据研究场所的实际治疗方案来管控全身性过敏性响应。在不存在该方案的情况下,使用下列标准化治疗方案:●尽快使用25mg至50mg(苯海拉明盐酸盐(diphenhydraminehydrochloride))经口或经静脉内在研究者判断下治疗临床轻度响应(例如全身性疹或搔痒、荨麻疹)。观察时段视需要延长至超过3小时,直至症状及体征已消退或稳定为止。经历临床轻度响应的患者可继续施用研究药物。●立即治疗临床中等响应(例如低血压、呼吸短促、面部水肿)且如医学上所指示开始支持性护理措施(例如iv流体、皮质类固醇、血管加压药、氧、支气管扩张剂、苯海拉明(diphenhydramine)及对乙酰氨基酚(acetaminophen))。以10分钟间隔监测生命体征直至其正规化为止。观察时段视需要延长至超过3小时,直至症状及体征已消退为止。在临床中等响应的情形下,患者不应接受使用研究药物的其他治疗。●在研究者的直接监督下立即治疗临床严重响应(例如显著低血压、晕厥、严重支气管缩小、舌或喉咙肿胀、显著血管性水肿),且如医学上所指示开始支持性护理措施(例如iv流体、皮质类固醇、血管加压药、氧、支气管扩张剂、苯海拉明及对乙酰氨基酚)。以最小10分钟间隔监测生命体征及系统,只要研究者认识其为确保患者安全性所需。在临床严重响应的情形下,患者不应接受使用研究药物的其他治疗。此类临床分类是出于向经历全身性过敏性响应的患者推荐治疗的目的。此类分类不用于对ecrf内全身性过敏性事件的严重程度进行分级。根据ncictcaev4.03中所呈现的分级系统来记载此类事件的严重程度。来自此试验的初步数据显示,使用低至1mg/kg的剂量治疗的患者在根据pvns的ogilive-harris评分的一些参数中显示临床改善,包括:1)减少疼痛,例如自严重(0点)至无(3点),2)增强活动范围,例如自损失20%以上至无损失,及3)增加功能能力,例如自能够进行一些活动至能够进行所有活动。使用eq-5d-5l评估也观察到了改善治疗效应,这是由于至少一些接受治疗的患者在洗澡及穿衣及其他自我护理活动方面具有具有改善的能力。序列表表5提供本文所论述的一些序列。除非另有说明,否则显示的所有多肽及抗体序列均不含前导序列。表5:序列及描述序列表<110>戊瑞治疗有限公司(fiveprimetherapeutics,inc.)<120>用于治疗pvns的抗csf1r抗体<130>01134-0037-00pct<150>us62/095,297<151>2014-12-22<150>us62/163,251<151>2015-05-18<160>95<170>patentin版本3.5<210>1<211>953<212>prt<213>人工序列<220><223>hcsf1r(全长,无前导序列)<400>1ileprovalilegluproservalprogluleuvalvallysprogly151015alathrvalthrleuargcysvalglyasnglyservalglutrpasp202530glyproproserprohistrpthrleutyrseraspglyserserser354045ileleuserthrasnasnalathrpheglnasnthrglythrtyrarg505560cysthrgluproglyaspproleuglyglyseralaalailehisleu65707580tyrvallysaspproalaargprotrpasnvalleualaglngluval859095valvalphegluaspglnaspalaleuleuprocysleuleuthrasp100105110provalleuglualaglyvalserleuvalargvalargglyargpro115120125leumetarghisthrasntyrserpheserprotrphisglyphethr130135140ilehisargalalyspheileglnserglnasptyrglncysserala145150155160leumetglyglyarglysvalmetserileserileargleulysval165170175glnlysvalileproglyproproalaleuthrleuvalproalaglu180185190leuvalargileargglyglualaalaglnilevalcysseralaser195200205servalaspvalasnpheaspvalpheleuglnhisasnasnthrlys210215220leualaileproglnglnseraspphehisasnasnargtyrglnlys225230235240valleuthrleuasnleuaspglnvalasppheglnhisalaglyasn245250255tyrsercysvalalaserasnvalglnglylyshisserthrsermet260265270phepheargvalvalgluseralatyrleuasnleuserserglugln275280285asnleuileglngluvalthrvalglygluglyleuasnleulysval290295300metvalglualatyrproglyleuglnglypheasntrpthrtyrleu305310315320glypropheserasphisglnprogluprolysleualaasnalathr325330335thrlysaspthrtyrarghisthrphethrleuserleuproargleu340345350lysproserglualaglyargtyrserpheleualaargasnprogly355360365glytrpargalaleuthrphegluleuthrleuargtyrproproglu370375380valservaliletrpthrpheileasnglyserglythrleuleucys385390395400alaalaserglytyrproglnproasnvalthrtrpleuglncysser405410415glyhisthraspargcysaspglualaglnvalleuglnvaltrpasp420425430aspprotyrprogluvalleuserglngluprophehislysvalthr435440445valglnserleuleuthrvalgluthrleugluhisasnglnthrtyr450455460glucysargalahisasnservalglyserglysertrpalapheile465470475480proileseralaglyalahisthrhisproproaspglupheleuphe485490495thrprovalvalvalalacysmetserilemetalaleuleuleuleu500505510leuleuleuleuleuleutyrlystyrlysglnlysprolystyrgln515520525valargtrplysileileglusertyrgluglyasnsertyrthrphe530535540ileaspprothrglnleuprotyrasnglulystrpglupheproarg545550555560asnasnleuglnpheglylysthrleuglyalaglyalapheglylys565570575valvalglualathralapheglyleuglylysgluaspalavalleu580585590lysvalalavallysmetleulysserthralahisalaaspglulys595600605glualaleumetsergluleulysilemetserhisleuglyglnhis610615620gluasnilevalasnleuleuglyalacysthrhisglyglyproval625630635640leuvalilethrglutyrcyscystyrglyaspleuleuasnpheleu645650655argarglysalaglualametleuglyproserleuserproglygln660665670aspprogluglyglyvalasptyrlysasnilehisleuglulyslys675680685tyrvalargargaspserglypheserserglnglyvalaspthrtyr690695700valglumetargprovalserthrserserasnaspserpheserglu705710715720glnaspleuasplysgluaspglyargproleugluleuargaspleu725730735leuhispheserserglnvalalaglnglymetalapheleualaser740745750lysasncysilehisargaspvalalaalaargasnvalleuleuthr755760765asnglyhisvalalalysileglyasppheglyleualaargaspile770775780metasnaspserasntyrilevallysglyasnalaargleuproval785790795800lystrpmetalaprogluserilepheaspcysvaltyrthrvalgln805810815seraspvaltrpsertyrglyileleuleutrpgluilepheserleu820825830glyleuasnprotyrproglyileleuvalasnserlysphetyrlys835840845leuvallysaspglytyrglnmetalaglnproalaphealaprolys850855860asniletyrserilemetglnalacystrpalaleugluprothrhis865870875880argprothrpheglnglnilecysserpheleuglngluglnalagln885890895gluaspargarggluargasptyrthrasnleuproserserserarg900905910serglyglyserglysersersersergluleugluglugluserser915920925sergluhisleuthrcyscysgluglnglyaspilealaglnproleu930935940leuglnproasnasntyrglnphecys945950<210>2<211>972<212>prt<213>人<220><221>misc_feature<222>(1)..(972)<223>hcsf1r(全长,+前导序列)<400>2metglyproglyvalleuleuleuleuleuvalalathralatrphis151015glyglnglyileprovalilegluproservalprogluleuvalval202530lysproglyalathrvalthrleuargcysvalglyasnglyserval354045glutrpaspglyproproserprohistrpthrleutyrseraspgly505560serserserileleuserthrasnasnalathrpheglnasnthrgly65707580thrtyrargcysthrgluproglyaspproleuglyglyseralaala859095ilehisleutyrvallysaspproalaargprotrpasnvalleuala100105110glngluvalvalvalphegluaspglnaspalaleuleuprocysleu115120125leuthraspprovalleuglualaglyvalserleuvalargvalarg130135140glyargproleumetarghisthrasntyrserpheserprotrphis145150155160glyphethrilehisargalalyspheileglnserglnasptyrgln165170175cysseralaleumetglyglyarglysvalmetserileserilearg180185190leulysvalglnlysvalileproglyproproalaleuthrleuval195200205proalagluleuvalargileargglyglualaalaglnilevalcys210215220seralaserservalaspvalasnpheaspvalpheleuglnhisasn225230235240asnthrlysleualaileproglnglnseraspphehisasnasnarg245250255tyrglnlysvalleuthrleuasnleuaspglnvalasppheglnhis260265270alaglyasntyrsercysvalalaserasnvalglnglylyshisser275280285thrsermetphepheargvalvalgluseralatyrleuasnleuser290295300sergluglnasnleuileglngluvalthrvalglygluglyleuasn305310315320leulysvalmetvalglualatyrproglyleuglnglypheasntrp325330335thrtyrleuglypropheserasphisglnprogluprolysleuala340345350asnalathrthrlysaspthrtyrarghisthrphethrleuserleu355360365proargleulysproserglualaglyargtyrserpheleualaarg370375380asnproglyglytrpargalaleuthrphegluleuthrleuargtyr385390395400proprogluvalservaliletrpthrpheileasnglyserglythr405410415leuleucysalaalaserglytyrproglnproasnvalthrtrpleu420425430glncysserglyhisthraspargcysaspglualaglnvalleugln435440445valtrpaspaspprotyrprogluvalleuserglngluprophehis450455460lysvalthrvalglnserleuleuthrvalgluthrleugluhisasn465470475480glnthrtyrglucysargalahisasnservalglyserglysertrp485490495alapheileproileseralaglyalahisthrhisproproaspglu500505510pheleuphethrprovalvalvalalacysmetserilemetalaleu515520525leuleuleuleuleuleuleuleuleutyrlystyrlysglnlyspro530535540lystyrglnvalargtrplysileileglusertyrgluglyasnser545550555560tyrthrpheileaspprothrglnleuprotyrasnglulystrpglu565570575pheproargasnasnleuglnpheglylysthrleuglyalaglyala580585590pheglylysvalvalglualathralapheglyleuglylysgluasp595600605alavalleulysvalalavallysmetleulysserthralahisala610615620aspglulysglualaleumetsergluleulysilemetserhisleu625630635640glyglnhisgluasnilevalasnleuleuglyalacysthrhisgly645650655glyprovalleuvalilethrglutyrcyscystyrglyaspleuleu660665670asnpheleuargarglysalaglualametleuglyproserleuser675680685proglyglnaspprogluglyglyvalasptyrlysasnilehisleu690695700glulyslystyrvalargargaspserglypheserserglnglyval705710715720aspthrtyrvalglumetargprovalserthrserserasnaspser725730735phesergluglnaspleuasplysgluaspglyargproleugluleu740745750argaspleuleuhispheserserglnvalalaglnglymetalaphe755760765leualaserlysasncysilehisargaspvalalaalaargasnval770775780leuleuthrasnglyhisvalalalysileglyasppheglyleuala785790795800argaspilemetasnaspserasntyrilevallysglyasnalaarg805810815leuprovallystrpmetalaprogluserilepheaspcysvaltyr820825830thrvalglnseraspvaltrpsertyrglyileleuleutrpgluile835840845pheserleuglyleuasnprotyrproglyileleuvalasnserlys850855860phetyrlysleuvallysaspglytyrglnmetalaglnproalaphe865870875880alaprolysasniletyrserilemetglnalacystrpalaleuglu885890895prothrhisargprothrpheglnglnilecysserpheleuglnglu900905910glnalaglngluaspargarggluargasptyrthrasnleuproser915920925serserargserglyglyserglysersersersergluleugluglu930935940glusersersergluhisleuthrcyscysgluglnglyaspileala945950955960glnproleuleuglnproasnasntyrglnphecys965970<210>3<211>20<212>prt<213>人工序列<220><223>轻链前导序列<400>3metgluthraspthrleuleuleutrpvalleuleuleutrpvalpro151015glyserthrgly20<210>4<211>19<212>prt<213>人工序列<220><223>重链前导序列<400>4metalavalleuglyleuleuleucysleuvalthrpheprosercys151015valleuser<210>5<211>487<212>prt<213>人工序列<220><223>hcsf1recd.506<400>5ileprovalilegluproservalprogluleuvalvallysprogly151015alathrvalthrleuargcysvalglyasnglyservalglutrpasp202530glyproproserprohistrpthrleutyrseraspglyserserser354045ileleuserthrasnasnalathrpheglnasnthrglythrtyrarg505560cysthrgluproglyaspproleuglyglyseralaalailehisleu65707580tyrvallysaspproalaargprotrpasnvalleualaglngluval859095valvalphegluaspglnaspalaleuleuprocysleuleuthrasp100105110provalleuglualaglyvalserleuvalargvalargglyargpro115120125leumetarghisthrasntyrserpheserprotrphisglyphethr130135140ilehisargalalyspheileglnserglnasptyrglncysserala145150155160leumetglyglyarglysvalmetserileserileargleulysval165170175glnlysvalileproglyproproalaleuthrleuvalproalaglu180185190leuvalargileargglyglualaalaglnilevalcysseralaser195200205servalaspvalasnpheaspvalpheleuglnhisasnasnthrlys210215220leualaileproglnglnseraspphehisasnasnargtyrglnlys225230235240valleuthrleuasnleuaspglnvalasppheglnhisalaglyasn245250255tyrsercysvalalaserasnvalglnglylyshisserthrsermet260265270phepheargvalvalgluseralatyrleuasnleuserserglugln275280285asnleuileglngluvalthrvalglygluglyleuasnleulysval290295300metvalglualatyrproglyleuglnglypheasntrpthrtyrleu305310315320glypropheserasphisglnprogluprolysleualaasnalathr325330335thrlysaspthrtyrarghisthrphethrleuserleuproargleu340345350lysproserglualaglyargtyrserpheleualaargasnprogly355360365glytrpargalaleuthrphegluleuthrleuargtyrproproglu370375380valservaliletrpthrpheileasnglyserglythrleuleucys385390395400alaalaserglytyrproglnproasnvalthrtrpleuglncysser405410415glyhisthraspargcysaspglualaglnvalleuglnvaltrpasp420425430aspprotyrprogluvalleuserglngluprophehislysvalthr435440445valglnserleuleuthrvalgluthrleugluhisasnglnthrtyr450455460glucysargalahisasnservalglyserglysertrpalapheile465470475480proileseralaglyalahis485<210>6<211>719<212>prt<213>人工序列<220><223>hcsf1recd.506-fc<400>6ileprovalilegluproservalprogluleuvalvallysprogly151015alathrvalthrleuargcysvalglyasnglyservalglutrpasp202530glyproproserprohistrpthrleutyrseraspglyserserser354045ileleuserthrasnasnalathrpheglnasnthrglythrtyrarg505560cysthrgluproglyaspproleuglyglyseralaalailehisleu65707580tyrvallysaspproalaargprotrpasnvalleualaglngluval859095valvalphegluaspglnaspalaleuleuprocysleuleuthrasp100105110provalleuglualaglyvalserleuvalargvalargglyargpro115120125leumetarghisthrasntyrserpheserprotrphisglyphethr130135140ilehisargalalyspheileglnserglnasptyrglncysserala145150155160leumetglyglyarglysvalmetserileserileargleulysval165170175glnlysvalileproglyproproalaleuthrleuvalproalaglu180185190leuvalargileargglyglualaalaglnilevalcysseralaser195200205servalaspvalasnpheaspvalpheleuglnhisasnasnthrlys210215220leualaileproglnglnseraspphehisasnasnargtyrglnlys225230235240valleuthrleuasnleuaspglnvalasppheglnhisalaglyasn245250255tyrsercysvalalaserasnvalglnglylyshisserthrsermet260265270phepheargvalvalgluseralatyrleuasnleuserserglugln275280285asnleuileglngluvalthrvalglygluglyleuasnleulysval290295300metvalglualatyrproglyleuglnglypheasntrpthrtyrleu305310315320glypropheserasphisglnprogluprolysleualaasnalathr325330335thrlysaspthrtyrarghisthrphethrleuserleuproargleu340345350lysproserglualaglyargtyrserpheleualaargasnprogly355360365glytrpargalaleuthrphegluleuthrleuargtyrproproglu370375380valservaliletrpthrpheileasnglyserglythrleuleucys385390395400alaalaserglytyrproglnproasnvalthrtrpleuglncysser405410415glyhisthraspargcysaspglualaglnvalleuglnvaltrpasp420425430aspprotyrprogluvalleuserglngluprophehislysvalthr435440445valglnserleuleuthrvalgluthrleugluhisasnglnthrtyr450455460glucysargalahisasnservalglyserglysertrpalapheile465470475480proileseralaglyalahisgluprolysserserasplysthrhis485490495thrcysproprocysproalaprogluleuleuglyglyproserval500505510pheleupheproprolysprolysaspthrleumetileserargthr515520525progluvalthrcysvalvalvalaspvalserhisgluaspproglu530535540vallyspheasntrptyrvalaspglyvalgluvalhisasnalalys545550555560thrlysproargglugluglntyrasnserthrtyrargvalvalser565570575valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys580585590cyslysvalserasnlysalaleuproalaproileglulysthrile595600605serlysalalysglyglnproarggluproglnvaltyrthrleupro610615620proserargaspgluleuthrlysasnglnvalserleuthrcysleu625630635640vallysglyphetyrproseraspilealavalglutrpgluserasn645650655glyglnprogluasnasntyrlysthrthrproprovalleuaspser660665670aspglyserphepheleutyrserlysleuthrvalasplysserarg675680685trpglnglnglyasnvalphesercysservalmethisglualaleu690695700hisasnhistyrthrglnlysserleuserleuserproglylys705710715<210>7<211>506<212>prt<213>人工序列<220><223>cynocsf1recd(有前导序列)<400>7metglyproglyvalleuleuleuleuleuvalvalthralatrphis151015glyglnglyileprovalilegluproserglyprogluleuvalval202530lysproglygluthrvalthrleuargcysvalglyasnglyserval354045glutrpaspglyproileserprohistrpthrleutyrseraspgly505560proserservalleuthrthrthrasnalathrpheglnasnthrarg65707580thrtyrargcysthrgluproglyaspproleuglyglyseralaala859095ilehisleutyrvallysaspproalaargprotrpasnvalleuala100105110lysgluvalvalvalphegluaspglnaspalaleuleuprocysleu115120125leuthraspprovalleuglualaglyvalserleuvalargleuarg130135140glyargproleuleuarghisthrasntyrserpheserprotrphis145150155160glyphethrilehisargalalyspheileglnglyglnasptyrgln165170175cysseralaleumetglyserarglysvalmetserileserilearg180185190leulysvalglnlysvalileproglyproproalaleuthrleuval195200205proalagluleuvalargileargglyglualaalaglnilevalcys210215220seralaserasnileaspvalasppheaspvalpheleuglnhisasn225230235240thrthrlysleualaileproglnargseraspphehisaspasnarg245250255tyrglnlysvalleuthrleuserleuglyglnvalasppheglnhis260265270alaglyasntyrsercysvalalaserasnvalglnglylyshisser275280285thrsermetphepheargvalvalgluseralatyrleuaspleuser290295300sergluglnasnleuileglngluvalthrvalglygluglyleuasn305310315320leulysvalmetvalglualatyrproglyleuglnglypheasntrp325330335thrtyrleuglypropheserasphisglnprogluprolysleuala340345350asnalathrthrlysaspthrtyrarghisthrphethrleuserleu355360365proargleulysproserglualaglyargtyrserpheleualaarg370375380asnproglyglytrpargalaleuthrphegluleuthrleuargtyr385390395400proprogluvalservaliletrpthrserileasnglyserglythr405410415leuleucysalaalaserglytyrproglnproasnvalthrtrpleu420425430glncysalaglyhisthraspargcysaspglualaglnvalleugln435440445valtrpvalaspprohisprogluvalleuserglngluprophegln450455460lysvalthrvalglnserleuleuthralagluthrleugluhisasn465470475480glnthrtyrglucysargalahisasnservalglyserglysertrp485490495alapheileproileseralaglyalaarg500505<210>8<211>740<212>prt<213>人工序列<220><223>cynocsf1recd-fc(有前导序列)<400>8metglyproglyvalleuleuleuleuleuvalvalthralatrphis151015glyglnglyileprovalilegluproserglyprogluleuvalval202530lysproglygluthrvalthrleuargcysvalglyasnglyserval354045glutrpaspglyproileserprohistrpthrleutyrseraspgly505560proserservalleuthrthrthrasnalathrpheglnasnthrarg65707580thrtyrargcysthrgluproglyaspproleuglyglyseralaala859095ilehisleutyrvallysaspproalaargprotrpasnvalleuala100105110lysgluvalvalvalphegluaspglnaspalaleuleuprocysleu115120125leuthraspprovalleuglualaglyvalserleuvalargleuarg130135140glyargproleuleuarghisthrasntyrserpheserprotrphis145150155160glyphethrilehisargalalyspheileglnglyglnasptyrgln165170175cysseralaleumetglyserarglysvalmetserileserilearg180185190leulysvalglnlysvalileproglyproproalaleuthrleuval195200205proalagluleuvalargileargglyglualaalaglnilevalcys210215220seralaserasnileaspvalasppheaspvalpheleuglnhisasn225230235240thrthrlysleualaileproglnargseraspphehisaspasnarg245250255tyrglnlysvalleuthrleuserleuglyglnvalasppheglnhis260265270alaglyasntyrsercysvalalaserasnvalglnglylyshisser275280285thrsermetphepheargvalvalgluseralatyrleuaspleuser290295300sergluglnasnleuileglngluvalthrvalglygluglyleuasn305310315320leulysvalmetvalglualatyrproglyleuglnglypheasntrp325330335thrtyrleuglypropheserasphisglnprogluprolysleuala340345350asnalathrthrlysaspthrtyrarghisthrphethrleuserleu355360365proargleulysproserglualaglyargtyrserpheleualaarg370375380asnproglyglytrpargalaleuthrphegluleuthrleuargtyr385390395400proprogluvalservaliletrpthrserileasnglyserglythr405410415leuleucysalaalaserglytyrproglnproasnvalthrtrpleu420425430glncysalaglyhisthraspargcysaspglualaglnvalleugln435440445valtrpvalaspprohisprogluvalleuserglngluprophegln450455460lysvalthrvalglnserleuleuthralagluthrleugluhisasn465470475480glnthrtyrglucysargalahisasnservalglyserglysertrp485490495alapheileproileseralaglyalaargglysergluprolysser500505510serasplysthrhisthrcysproprocysproalaprogluleuleu515520525glyglyproservalpheleupheproprolysprolysaspthrleu530535540metileserargthrprogluvalthrcysvalvalvalaspvalser545550555560hisgluaspprogluvallyspheasntrptyrvalaspglyvalglu565570575valhisasnalalysthrlysproargglugluglntyrasnserthr580585590tyrargvalvalservalleuthrvalleuhisglnasptrpleuasn595600605glylysglutyrlyscyslysvalserasnlysalaleuproalapro610615620ileglulysthrileserlysalalysglyglnproarggluprogln625630635640valtyrthrleuproproserargaspgluleuthrlysasnglnval645650655serleuthrcysleuvallysglyphetyrproseraspilealaval660665670glutrpgluserasnglyglnprogluasnasntyrlysthrthrpro675680685provalleuaspseraspglyserphepheleutyrserlysleuthr690695700valasplysserargtrpglnglnglyasnvalphesercysserval705710715720methisglualaleuhisasnhistyrthrglnlysserleuserleu725730735serproglylys740<210>9<211>122<212>prt<213>人工序列<220><223>fab0301重链可变区<400>9gluvalglnleuglnglnserglyprogluleuvalargproglyala151015servallysmetsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvallysglnserhisglylysserleuglutrpile354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglylysalathrleuthrvalglulysserserserthralatyr65707580metglnleuasnserleuthrsergluaspseralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrservalthrvalserser115120<210>10<211>111<212>prt<213>人工序列<220><223>fab0301轻链可变区<400>10asnilevalleuthrglnserproalaserleualavalserleugly151015glnargalathrilesercyslysalaserglnservalasptyrasp202530glyaspasntyrmetasntrptyrglnglnlysproglyglnpropro354045lysleuleuiletyralaalaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuasnilehis65707580provalgluglugluaspalaalathrtyrtyrcyshisleuserasn859095gluaspleuserthrpheglyglyglythrlysleugluilelys100105110<210>11<211>121<212>prt<213>人工序列<220><223>fab0302重链可变区<400>11gluileglnleuglnglnserglyprogluleuvallysproglyala151015servallysmetsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvallysglnlysproglyglnglyleuglutrpile354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglylysalathrleuthrseraspargserserserthralatyr65707580metaspleuserserleuthrsergluaspseralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrserilethrvalserser115120<210>12<211>111<212>prt<213>人工序列<220><223>fab0302轻链可变区<400>12aspvalvalvalthrglnthrproalaserleualavalserleugly151015glnargalathrilesercysargalasergluservalaspasntyr202530glyleuserphemetasntrppheglnglnlysproglyglnpropro354045lysleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyglyglyserargthraspphethrleuthrileasp65707580provalglualaaspaspalaalathrtyrphecysglnglnserlys859095gluleuprotrpthrpheglyglyglythrargleugluilelys100105110<210>13<211>122<212>prt<213>人工序列<220><223>fab0311重链可变区<400>13gluileglnleuglnglnserglyproaspleumetlysproglyala151015servallysmetsercyslysalaserglytyrilephethrasptyr202530asnmethistrpvallysglnasnglnglylysserleuglutrpmet354045glygluileasnproasnasnglyvalvalvaltyrasnglnlysphe505560lysglythrthrthrleuthrvalasplysserserserthralatyr65707580metaspleuhisserleuthrsergluaspseralavaltyrtyrcys859095thrargalaleutyrhisserasnpheglytrptyrpheaspsertrp100105110glylysglythrthrleuthrvalserser115120<210>14<211>111<212>prt<213>人工序列<220><223>fab0311轻链可变区<400>14aspilevalleuthrglnserproalaserleualavalserleugly151015glnargalathrilesercyslysalaserglnservalasptyrasp202530glyaspserhismetasntrptyrglnglnlysproglyglnpropro354045lysleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglyalaaspphethrleuthrilehis65707580provalgluglugluaspalaalathrtyrtyrcysglnglnglyasn859095gluaspprotrpthrpheglyglyglythrargleugluilelys100105110<210>15<211>10<212>prt<213>人工序列<220><223>0301重链cdr1<400>15glytyrthrphethraspasntyrmetile1510<210>16<211>17<212>prt<213>人工序列<220><223>0301重链cdr<400>16aspileasnprotyrasnglyglythrthrpheasnglnlysphelys151015gly<210>17<211>13<212>prt<213>人工序列<220><223>0301重链cdr3<400>17gluserprotyrpheserasnleutyrvalmetasptyr1510<210>18<211>15<212>prt<213>人工序列<220><223>0301轻链cdr1<400>18lysalaserglnservalasptyraspglyaspasntyrmetasn151015<210>19<211>7<212>prt<213>人工序列<220><223>0301轻链cdr2<400>19alaalaserasnleugluser15<210>20<211>9<212>prt<213>人工序列<220><223>0301轻链cdr3<400>20hisleuserasngluaspleuserthr15<210>21<211>10<212>prt<213>人工序列<220><223>0302重链cdr1<400>21glytyrthrpheserasppheasnilehis1510<210>22<211>17<212>prt<213>人工序列<220><223>0302重链cdr2<400>22tyrileasnprotyrthraspvalthrvaltyrasnglulysphelys151015gly<210>23<211>12<212>prt<213>人工序列<220><223>0302重链cdr3<400>23tyrpheaspglythrpheasptyralaleuasptyr1510<210>24<211>15<212>prt<213>人工序列<220><223>0302轻链cdr1<400>24argalasergluservalaspasntyrglyleuserphemetasn151015<210>25<211>7<212>prt<213>人工序列<220><223>0302轻链cdr2<400>25thralaserasnleugluser15<210>26<211>9<212>prt<213>人工序列<220><223>0302轻链cdr3<400>26glnglnserlysgluleuprotrpthr15<210>27<211>10<212>prt<213>人工序列<220><223>0311重链cdr1<400>27glytyrilephethrasptyrasnmethis1510<210>28<211>17<212>prt<213>人工序列<220><223>0311重链cdr2<400>28gluileasnproasnasnglyvalvalvaltyrasnglnlysphelys151015gly<210>29<211>13<212>prt<213>人工序列<220><223>0311重链cdr3<400>29alaleutyrhisserasnpheglytrptyrpheaspser1510<210>30<211>15<212>prt<213>人工序列<220><223>0311轻链cdr1<400>30lysalaserglnservalasptyraspglyaspserhismetasn151015<210>31<211>7<212>prt<213>人工序列<220><223>0311轻链cdr2<400>31thralaserasnleugluser15<210>32<211>9<212>prt<213>人工序列<220><223>0311轻链cdr3<400>32glnglnglyasngluaspprotrpthr15<210>33<211>449<212>prt<213>人工序列<220><223>cab0301重链<400>33gluvalglnleuglnglnserglyprogluleuvalargproglyala151015servallysmetsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvallysglnserhisglylysserleuglutrpile354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglylysalathrleuthrvalglulysserserserthralatyr65707580metglnleuasnserleuthrsergluaspseralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrservalthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys<210>34<211>448<212>prt<213>人工序列<220><223>cab0301轻链<400>34gluileglnleuglnglnserglyprogluleuvallysproglyala151015servallysmetsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvallysglnlysproglyglnglyleuglutrpile354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglylysalathrleuthrseraspargserserserthralatyr65707580metaspleuserserleuthrsergluaspseralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrserilethrvalserseralaserthrlysglyproser115120125valpheproleualaprocysserargserthrsergluserthrala130135140alaleuglycysleuvallysasptyrpheprogluprovalthrval145150155160sertrpasnserglyalaleuthrserglyvalhisthrpheproala165170175valleuglnserserglyleutyrserleuserservalvalthrval180185190proserserserleuglythrlysthrtyrthrcysasnvalasphis195200205lysproserasnthrlysvalasplysargvalgluserlystyrgly210215220proprocysproprocysproalaproglupheleuglyglyproser225230235240valpheleupheproprolysprolysaspthrleumetileserarg245250255thrprogluvalthrcysvalvalvalaspvalserglngluasppro260265270gluvalglnpheasntrptyrvalaspglyvalgluvalhisasnala275280285lysthrlysproargglugluglnpheasnserthrtyrargvalval290295300servalleuthrvalleuhisglnasptrpleuasnglylysglutyr305310315320lyscyslysvalserasnlysglyleuproserserileglulysthr325330335ileserlysalalysglyglnproarggluproglnvaltyrthrleu340345350proproserglngluglumetthrlysasnglnvalserleuthrcys355360365leuvallysglyphetyrproseraspilealavalglutrpgluser370375380asnglyglnprogluasnasntyrlysthrthrproprovalleuasp385390395400seraspglyserphepheleutyrserargleuthrvalasplysser405410415argtrpglngluglyasnvalphesercysservalmethisgluala420425430leuhisasnhistyrthrglnlysserleuserleuserleuglylys435440445<210>35<211>448<212>prt<213>人工序列<220><223>cab0302重链<400>35gluileglnleuglnglnserglyprogluleuvallysproglyala151015servallysmetsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvallysglnlysproglyglnglyleuglutrpile354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglylysalathrleuthrseraspargserserserthralatyr65707580metaspleuserserleuthrsergluaspseralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrserilethrvalserseralaserthrlysglyproser115120125valpheproleualaprocysserargserthrsergluserthrala130135140alaleuglycysleuvallysasptyrpheprogluprovalthrval145150155160sertrpasnserglyalaleuthrserglyvalhisthrpheproala165170175valleuglnserserglyleutyrserleuserservalvalthrval180185190proserserserleuglythrlysthrtyrthrcysasnvalasphis195200205lysproserasnthrlysvalasplysargvalgluserlystyrgly210215220proprocysproprocysproalaproglupheleuglyglyproser225230235240valpheleupheproprolysprolysaspthrleumetileserarg245250255thrprogluvalthrcysvalvalvalaspvalserglngluasppro260265270gluvalglnpheasntrptyrvalaspglyvalgluvalhisasnala275280285lysthrlysproargglugluglnpheasnserthrtyrargvalval290295300servalleuthrvalleuhisglnasptrpleuasnglylysglutyr305310315320lyscyslysvalserasnlysglyleuproserserileglulysthr325330335ileserlysalalysglyglnproarggluproglnvaltyrthrleu340345350proproserglngluglumetthrlysasnglnvalserleuthrcys355360365leuvallysglyphetyrproseraspilealavalglutrpgluser370375380asnglyglnprogluasnasntyrlysthrthrproprovalleuasp385390395400seraspglyserphepheleutyrserargleuthrvalasplysser405410415argtrpglngluglyasnvalphesercysservalmethisgluala420425430leuhisasnhistyrthrglnlysserleuserleuserleuglylys435440445<210>36<211>218<212>prt<213>人工序列<220><223>cab0302轻链<400>36aspvalvalvalthrglnthrproalaserleualavalserleugly151015glnargalathrilesercysargalasergluservalaspasntyr202530glyleuserphemetasntrppheglnglnlysproglyglnpropro354045lysleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyglyglyserargthraspphethrleuthrileasp65707580provalglualaaspaspalaalathrtyrphecysglnglnserlys859095gluleuprotrpthrpheglyglyglythrargleugluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys210215<210>37<211>449<212>prt<213>人工序列<220><223>cab0311重链<400>37gluileglnleuglnglnserglyproaspleumetlysproglyala151015servallysmetsercyslysalaserglytyrilephethrasptyr202530asnmethistrpvallysglnasnglnglylysserleuglutrpmet354045glygluileasnproasnasnglyvalvalvaltyrasnglnlysphe505560lysglythrthrthrleuthrvalasplysserserserthralatyr65707580metaspleuhisserleuthrsergluaspseralavaltyrtyrcys859095thrargalaleutyrhisserasnpheglytrptyrpheaspsertrp100105110glylysglythrthrleuthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys<210>38<211>218<212>prt<213>人工序列<220><223>cab0311轻链<400>38aspilevalleuthrglnserproalaserleualavalserleugly151015glnargalathrilesercyslysalaserglnservalasptyrasp202530glyaspserhismetasntrptyrglnglnlysproglyglnpropro354045lysleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglyalaaspphethrleuthrilehis65707580provalgluglugluaspalaalathrtyrtyrcysglnglnglyasn859095gluaspprotrpthrpheglyglyglythrargleugluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys210215<210>39<211>122<212>prt<213>人工序列<220><223>h0301-h0重链可变区<400>39glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvalargglnalaproglyglnglyleuglutrpmet354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglyargvalthrilethralaasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrleuvalthrvalserser115120<210>40<211>122<212>prt<213>人工序列<220><223>h0301-h1重链可变区<400>40glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvalargglnalaproglyglnglyleuglutrpmet354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglyargvalthrilethrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrleuvalthrvalserser115120<210>41<211>122<212>prt<213>人工序列<220><223>h0301-h2重链可变区<400>41glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvalargglnalaproglyglnglyleuglutrpile354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglyargalathrleuthrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrleuvalthrvalserser115120<210>42<211>121<212>prt<213>人工序列<220><223>h0302-h1重链可变区<400>42glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvalargglnalaproglyglnglyleuglutrpmet354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglyargvalthrilethrserasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrleuvalthrvalserser115120<210>43<211>121<212>prt<213>人工序列<220><223>h0302-h2重链可变区<400>43glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvalargglnalaproglyglnglyleuglutrpile354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglyargalathrleuthrserasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrleuvalthrvalserser115120<210>44<211>122<212>prt<213>人工序列<220><223>h0311-h1重链可变区<400>44glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrilephethrasptyr202530asnmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glygluileasnproasnasnglyvalvalvaltyrasnglnlysphe505560lysglyargvalthrilethrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095thrargalaleutyrhisserasnpheglytrptyrpheaspsertrp100105110glyglnglythrleuvalthrvalserser115120<210>45<211>122<212>prt<213>人工序列<220><223>h0311-h2重链可变区<400>45glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrilephethrasptyr202530asnmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glygluileasnproasnasnglyvalvalvaltyrasnglnlysphe505560lysglythrthrthrleuthrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095thrargalaleutyrhisserasnpheglytrptyrpheaspsertrp100105110glyglnglythrleuvalthrvalserser115120<210>46<211>111<212>prt<213>人工序列<220><223>h0301-l0轻链可变区<400>46gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspasntyrmetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyralaalaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcyshisleuserasn859095gluaspleuserthrpheglyglyglythrlysvalgluilelys100105110<210>47<211>111<212>prt<213>人工序列<220><223>h0301-l1轻链可变区<400>47asnilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspasntyrmetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyralaalaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcyshisleuserasn859095gluaspleuserthrpheglyglyglythrlysvalgluilelys100105110<210>48<211>111<212>prt<213>人工序列<220><223>h0302-l0轻链可变区<400>48gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalasergluservalaspasntyr202530glyleuserphemetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnserlys859095gluleuprotrpthrpheglyglnglythrlysvalgluilelys100105110<210>49<211>111<212>prt<213>人工序列<220><223>h0302-l1轻链可变区<400>49gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalasergluservalaspasntyr202530glyleuserphemetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserargthraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnserlys859095gluleuprotrpthrpheglyglnglythrlysvalgluilelys100105110<210>50<211>111<212>prt<213>人工序列<220><223>h0302-l2轻链可变区<400>50gluilevalvalthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalasergluservalaspasntyr202530glyleuserphemetasntrppheglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserargthraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnserlys859095gluleuprotrpthrpheglyglnglythrlysvalgluilelys100105110<210>51<211>111<212>prt<213>人工序列<220><223>h0311-l0轻链可变区<400>51gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspserhismetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnglyasn859095gluaspprotrpthrpheglyglnglythrlysvalgluilelys100105110<210>52<211>111<212>prt<213>人工序列<220><223>h0311-l1轻链可变区<400>52aspilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspserhismetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglyalaaspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnglyasn859095gluaspprotrpthrpheglyglnglythrlysvalgluilelys100105110<210>53<211>449<212>prt<213>人工序列<220><223>h0301-h0重链<400>53glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvalargglnalaproglyglnglyleuglutrpmet354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglyargvalthrilethralaasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrleuvalthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys<210>54<211>449<212>prt<213>人工序列<220><223>h0301-h1重链<400>54glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvalargglnalaproglyglnglyleuglutrpmet354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglyargvalthrilethrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrleuvalthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys<210>55<211>449<212>prt<213>人工序列<220><223>h0301-h2重链<400>55glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrphethraspasn202530tyrmetiletrpvalargglnalaproglyglnglyleuglutrpile354045glyaspileasnprotyrasnglyglythrthrpheasnglnlysphe505560lysglyargalathrleuthrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alaarggluserprotyrpheserasnleutyrvalmetasptyrtrp100105110glyglnglythrleuvalthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys<210>56<211>448<212>prt<213>人工序列<220><223>h0302-h1重链<400>56glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvalargglnalaproglyglnglyleuglutrpmet354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglyargvalthrilethrserasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrleuvalthrvalserseralaserthrlysglyproser115120125valpheproleualaprocysserargserthrsergluserthrala130135140alaleuglycysleuvallysasptyrpheprogluprovalthrval145150155160sertrpasnserglyalaleuthrserglyvalhisthrpheproala165170175valleuglnserserglyleutyrserleuserservalvalthrval180185190proserserserleuglythrlysthrtyrthrcysasnvalasphis195200205lysproserasnthrlysvalasplysargvalgluserlystyrgly210215220proprocysproprocysproalaproglupheleuglyglyproser225230235240valpheleupheproprolysprolysaspthrleumetileserarg245250255thrprogluvalthrcysvalvalvalaspvalserglngluasppro260265270gluvalglnpheasntrptyrvalaspglyvalgluvalhisasnala275280285lysthrlysproargglugluglnpheasnserthrtyrargvalval290295300servalleuthrvalleuhisglnasptrpleuasnglylysglutyr305310315320lyscyslysvalserasnlysglyleuproserserileglulysthr325330335ileserlysalalysglyglnproarggluproglnvaltyrthrleu340345350proproserglngluglumetthrlysasnglnvalserleuthrcys355360365leuvallysglyphetyrproseraspilealavalglutrpgluser370375380asnglyglnprogluasnasntyrlysthrthrproprovalleuasp385390395400seraspglyserphepheleutyrserargleuthrvalasplysser405410415argtrpglngluglyasnvalphesercysservalmethisgluala420425430leuhisasnhistyrthrglnlysserleuserleuserleuglylys435440445<210>57<211>448<212>prt<213>人工序列<220><223>h0302-h2重链<400>57glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrthrpheseraspphe202530asnilehistrpvalargglnalaproglyglnglyleuglutrpile354045glytyrileasnprotyrthraspvalthrvaltyrasnglulysphe505560lysglyargalathrleuthrserasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095alasertyrpheaspglythrpheasptyralaleuasptyrtrpgly100105110glnglythrleuvalthrvalserseralaserthrlysglyproser115120125valpheproleualaprocysserargserthrsergluserthrala130135140alaleuglycysleuvallysasptyrpheprogluprovalthrval145150155160sertrpasnserglyalaleuthrserglyvalhisthrpheproala165170175valleuglnserserglyleutyrserleuserservalvalthrval180185190proserserserleuglythrlysthrtyrthrcysasnvalasphis195200205lysproserasnthrlysvalasplysargvalgluserlystyrgly210215220proprocysproprocysproalaproglupheleuglyglyproser225230235240valpheleupheproprolysprolysaspthrleumetileserarg245250255thrprogluvalthrcysvalvalvalaspvalserglngluasppro260265270gluvalglnpheasntrptyrvalaspglyvalgluvalhisasnala275280285lysthrlysproargglugluglnpheasnserthrtyrargvalval290295300servalleuthrvalleuhisglnasptrpleuasnglylysglutyr305310315320lyscyslysvalserasnlysglyleuproserserileglulysthr325330335ileserlysalalysglyglnproarggluproglnvaltyrthrleu340345350proproserglngluglumetthrlysasnglnvalserleuthrcys355360365leuvallysglyphetyrproseraspilealavalglutrpgluser370375380asnglyglnprogluasnasntyrlysthrthrproprovalleuasp385390395400seraspglyserphepheleutyrserargleuthrvalasplysser405410415argtrpglngluglyasnvalphesercysservalmethisgluala420425430leuhisasnhistyrthrglnlysserleuserleuserleuglylys435440445<210>58<211>449<212>prt<213>人工序列<220><223>h0311-h1重链<400>58glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrilephethrasptyr202530asnmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glygluileasnproasnasnglyvalvalvaltyrasnglnlysphe505560lysglyargvalthrilethrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095thrargalaleutyrhisserasnpheglytrptyrpheaspsertrp100105110glyglnglythrleuvalthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys<210>59<211>449<212>prt<213>人工序列<220><223>h0311-h2重链<400>59glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaserglytyrilephethrasptyr202530asnmethistrpvalargglnalaproglyglnglyleuglutrpmet354045glygluileasnproasnasnglyvalvalvaltyrasnglnlysphe505560lysglythrthrthrleuthrvalasplysserthrserthralatyr65707580metgluleuserserleuargsergluaspthralavaltyrtyrcys859095thrargalaleutyrhisserasnpheglytrptyrpheaspsertrp100105110glyglnglythrleuvalthrvalserseralaserthrlysglypro115120125servalpheproleualaprocysserargserthrsergluserthr130135140alaalaleuglycysleuvallysasptyrpheprogluprovalthr145150155160valsertrpasnserglyalaleuthrserglyvalhisthrphepro165170175alavalleuglnserserglyleutyrserleuserservalvalthr180185190valproserserserleuglythrlysthrtyrthrcysasnvalasp195200205hislysproserasnthrlysvalasplysargvalgluserlystyr210215220glyproprocysproprocysproalaproglupheleuglyglypro225230235240servalpheleupheproprolysprolysaspthrleumetileser245250255argthrprogluvalthrcysvalvalvalaspvalserglngluasp260265270progluvalglnpheasntrptyrvalaspglyvalgluvalhisasn275280285alalysthrlysproargglugluglnpheasnserthrtyrargval290295300valservalleuthrvalleuhisglnasptrpleuasnglylysglu305310315320tyrlyscyslysvalserasnlysglyleuproserserileglulys325330335thrileserlysalalysglyglnproarggluproglnvaltyrthr340345350leuproproserglngluglumetthrlysasnglnvalserleuthr355360365cysleuvallysglyphetyrproseraspilealavalglutrpglu370375380serasnglyglnprogluasnasntyrlysthrthrproprovalleu385390395400aspseraspglyserphepheleutyrserargleuthrvalasplys405410415serargtrpglngluglyasnvalphesercysservalmethisglu420425430alaleuhisasnhistyrthrglnlysserleuserleuserleugly435440445lys<210>60<211>218<212>prt<213>人工序列<220><223>h0301-l0轻链<400>60gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspasntyrmetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyralaalaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcyshisleuserasn859095gluaspleuserthrpheglyglyglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys210215<210>61<211>218<212>prt<213>人工序列<220><223>h0301-l1轻链<400>61asnilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspasntyrmetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyralaalaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcyshisleuserasn859095gluaspleuserthrpheglyglyglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys210215<210>62<211>218<212>prt<213>人工序列<220><223>h0302-l0轻链<400>62gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalasergluservalaspasntyr202530glyleuserphemetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnserlys859095gluleuprotrpthrpheglyglnglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys210215<210>63<211>218<212>prt<213>人工序列<220><223>h0302-l1轻链<400>63gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalasergluservalaspasntyr202530glyleuserphemetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserargthraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnserlys859095gluleuprotrpthrpheglyglnglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys210215<210>64<211>218<212>prt<213>人工序列<220><223>h0302-l2轻链<400>64gluilevalvalthrglnserproalathrleuserleuserprogly151015gluargalathrleusercysargalasergluservalaspasntyr202530glyleuserphemetasntrppheglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserargthraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnserlys859095gluleuprotrpthrpheglyglnglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys210215<210>65<211>218<212>prt<213>人工序列<220><223>h0311-l0轻链<400>65gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspserhismetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglythraspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnglyasn859095gluaspprotrpthrpheglyglnglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys210215<210>66<211>218<212>prt<213>人工序列<220><223>h0311-l1轻链<400>66aspilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercyslysalaserglnservalasptyrasp202530glyaspserhismetasntrptyrglnglnlysproglyglnalapro354045argleuleuiletyrthralaserasnleugluserglyileproala505560argpheserglyserglyserglyalaaspphethrleuthrileser65707580serleugluprogluaspphealavaltyrtyrcysglnglnglyasn859095gluaspprotrpthrpheglyglnglythrlysvalgluilelysarg100105110thrvalalaalaproservalpheilepheproproseraspglugln115120125leulysserglythralaservalvalcysleuleuasnasnphetyr130135140proargglualalysvalglntrplysvalaspasnalaleuglnser145150155160glyasnserglngluservalthrgluglnaspserlysaspserthr165170175tyrserleuserserthrleuthrleuserlysalaasptyrglulys180185190hislysvaltyralacysgluvalthrhisglnglyleuserserpro195200205valthrlysserpheasnargglyglucys210215<210>67<211>158<212>prt<213>人<220><221>misc_feature<222>(1)..(158)<223>人csf1<400>67glugluvalserglutyrcysserhismetileglyserglyhisleu151015glnserleuglnargleuileaspserglnmetgluthrsercysgln202530ilethrphegluphevalaspglngluglnleulysaspprovalcys354045tyrleulyslysalapheleuleuvalglnaspilemetgluaspthr505560metargpheargaspasnthrproasnalailealailevalglnleu65707580glngluleuserleuargleulyssercysphethrlysasptyrglu859095gluhisasplysalacysvalargthrphetyrgluthrproleugln100105110leuleuglulysvallysasnvalpheasngluthrlysasnleuleu115120125asplysasptrpasnilepheserlysasncysasnasnserpheala130135140glucysserserglnglyhisgluargglnsergluglyser145150155<210>68<211>222<212>prt<213>人<220><221>misc_feature<222>(1)..(222)<223>人il-34<400>68asngluproleuglumettrpproleuthrglnasngluglucysthr151015valthrglypheleuargasplysleuglntyrargserargleugln202530tyrmetlyshistyrpheproileasntyrlysileservalprotyr354045gluglyvalpheargilealaasnvalthrargleuglnargalagln505560valsergluarggluleuargtyrleutrpvalleuvalserleuser65707580alathrgluservalglnaspvalleuleugluglyhisprosertrp859095lystyrleuglngluvalglnthrleuleuleuasnvalglnglngly100105110leuthraspvalgluvalserprolysvalgluservalleuserleu115120125leuasnalaproglyproasnleulysleuvalargprolysalaleu130135140leuaspasncyspheargvalmetgluleuleutyrcyssercyscys145150155160lysglnserservalleuasntrpglnaspcysgluvalproserpro165170175glnsercysserprogluproserleuglntyralaalathrglnleu180185190tyrproproproprotrpserproserserproprohisserthrgly195200205servalargprovalargalaglnglygluglyleuleupro210215220<210>69<211>25<212>prt<213>人工序列<220><223>人受体afr1<400>69glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaser2025<210>70<211>14<212>prt<213>人工序列<220><223>人受体afr2<400>70trpvalargglnalaproglyglnglyleuglutrpmetgly1510<210>71<211>32<212>prt<213>人工序列<220><223>人受体afr3<400>71argvalthrilethralaasplysserthrserthralatyrmetglu151015leuserserleuargsergluaspthralavaltyrtyrcysalaarg202530<210>72<211>11<212>prt<213>人工序列<220><223>人受体afr4<400>72trpglyglnglythrleuvalthrvalserser1510<210>73<211>25<212>prt<213>人工序列<220><223>人受体bfr1<400>73glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaser2025<210>74<211>14<212>prt<213>人工序列<220><223>人受体bfr2<400>74trpvalargglnalaproglyglnglyleuglutrpmetgly1510<210>75<211>32<212>prt<213>人工序列<220><223>人受体bfr3<400>75argvalthrilethralaasplysserthrserthralatyrmetglu151015leuserserleuargsergluaspthralavaltyrtyrcysalaarg202530<210>76<211>11<212>prt<213>人工序列<220><223>人受体bfr4<400>76trpglyglnglythrleuvalthrvalserser1510<210>77<211>25<212>prt<213>人工序列<220><223>人受体cfr1<400>77glnvalglnleuvalglnserglyalagluvallyslysproglyser151015servallysvalsercyslysalaser2025<210>78<211>14<212>prt<213>人工序列<220><223>人受体cfr2<400>78trpvalargglnalaproglyglnglyleuglutrpmetgly1510<210>79<211>32<212>prt<213>人工序列<220><223>人受体cfr3<400>79argvalthrilethralaasplysserthrserthralatyrmetglu151015leuserserleuargsergluaspthralavaltyrtyrcysalaarg202530<210>80<211>11<212>prt<213>人工序列<220><223>人受体cfr4<400>80trpglyglnglythrleuvalthrvalserser1510<210>81<211>23<212>prt<213>人工序列<220><223>人受体dfr1<400>81gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercys20<210>82<211>15<212>prt<213>人工序列<220><223>人受体dfr2<400>82trptyrglnglnlysproglyglnalaproargleuleuiletyr151015<210>83<211>32<212>prt<213>人工序列<220><223>人受体dfr3<400>83glyileproalaargpheserglyserglyserglythraspphethr151015leuthrileserserleugluprogluaspphealavaltyrtyrcys202530<210>84<211>10<212>prt<213>人工序列<220><223>人受体dfr4<400>84pheglyglyglythrlysvalgluilelys1510<210>85<211>23<212>prt<213>人工序列<220><223>人受体efr1<400>85gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercys20<210>86<211>15<212>prt<213>人工序列<220><223>人受体efr2<400>86trptyrglnglnlysproglyglnalaproargleuleuiletyr151015<210>87<211>32<212>prt<213>人工序列<220><223>人受体efr3<400>87glyileproalaargpheserglyserglyserglythraspphethr151015leuthrileserserleugluprogluaspphealavaltyrtyrcys202530<210>88<211>10<212>prt<213>人工序列<220><223>人受体efr4<400>88pheglyglnglythrlysvalgluilelys1510<210>89<211>23<212>prt<213>人工序列<220><223>人受体ffr1<400>89gluilevalleuthrglnserproalathrleuserleuserprogly151015gluargalathrleusercys20<210>90<211>15<212>prt<213>人工序列<220><223>人受体ffr2<400>90trptyrglnglnlysproglyglnalaproargleuleuiletyr151015<210>91<211>32<212>prt<213>人工序列<220><223>人受体ffr3<400>91glyileproalaargpheserglyserglyserglythraspphethr151015leuthrileserserleugluprogluaspphealavaltyrtyrcys202530<210>92<211>10<212>prt<213>人工序列<220><223>人受体ffr4<400>92pheglyglnglythrlysvalgluilelys1510<210>93<211>719<212>prt<213>人工序列<220><223>mcsf1recd-fc<400>93alaprovalilegluproserglyprogluleuvalvalgluprogly151015gluthrvalthrleuargcysvalserasnglyservalglutrpasp202530glyproileserprotyrtrpthrleuaspprogluserproglyser354045thrleuthrthrargasnalathrphelysasnthrglythrtyrarg505560cysthrgluleugluaspprometalaglyserthrthrilehisleu65707580tyrvallysaspproalahissertrpasnleuleualaglngluval859095thrvalvalgluglyglnglualavalleuprocysleuilethrasp100105110proalaleulysaspservalserleumetarggluglyglyarggln115120125valleuarglysthrvaltyrphepheserprotrpargglypheile130135140ilearglysalalysvalleuaspserasnthrtyrvalcyslysthr145150155160metvalasnglyarggluserthrserthrglyiletrpleulysval165170175asnargvalhisprogluproproglnilelysleugluproserlys180185190leuvalargileargglyglualaalaglnilevalcysseralathr195200205asnalagluvalglypheasnvalileleulysargglyaspthrlys210215220leugluileproleuasnserasppheglnaspasntyrtyrlyslys225230235240valargalaleuserleuasnalavalasppheglnaspalaglyile245250255tyrsercysvalalaserasnaspvalglythrargthralathrmet260265270asnpheglnvalvalgluseralatyrleuasnleuthrserglugln275280285serleuleuglngluvalservalglyaspserleuileleuthrval290295300hisalaaspalatyrproserileglnhistyrasntrpthrtyrleu305310315320glyprophephegluaspglnarglysleuglupheilethrglnarg325330335alailetyrargtyrthrphelysleupheleuasnargvallysala340345350serglualaglyglntyrpheleumetalaglnasnlysalaglytrp355360365asnasnleuthrphegluleuthrleuargtyrproprogluvalser370375380valthrtrpmetprovalasnglyseraspvalleuphecysaspval385390395400serglytyrproglnproservalthrtrpmetglucysargglyhis405410415thraspargcysaspglualaglnalaleuglnvaltrpasnaspthr420425430hisprogluvalleuserglnlyspropheasplysvalileilegln435440445serglnleuproileglythrleulyshisasnmetthrtyrphecys450455460lysthrhisasnservalglyasnserserglntyrpheargalaval465470475480serleuglyglnserlysglngluprolysserserasplysthrhis485490495thrcysproprocysproalaprogluleuleuglyglyproserval500505510pheleupheproprolysprolysaspthrleumetileserargthr515520525progluvalthrcysvalvalvalaspvalserhisgluaspproglu530535540vallyspheasntrptyrvalaspglyvalgluvalhisasnalalys545550555560thrlysproargglugluglntyrasnserthrtyrargvalvalser565570575valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys580585590cyslysvalserasnlysalaleuproalaproileglulysthrile595600605serlysalalysglyglnproarggluproglnvaltyrthrleupro610615620proserargaspgluleuthrlysasnglnvalserleuthrcysleu625630635640vallysglyphetyrproseraspilealavalglutrpgluserasn645650655glyglnprogluasnasntyrlysthrthrproprovalleuaspser660665670aspglyserphepheleutyrserlysleuthrvalasplysserarg675680685trpglnglnglyasnvalphesercysservalmethisglualaleu690695700hisasnhistyrthrglnlysserleuserleuserproglylys705710715<210>94<211>327<212>prt<213>人工序列<220><223>人igg4s241p<400>94alaserthrlysglyproservalpheproleualaprocysserarg151015serthrsergluserthralaalaleuglycysleuvallysasptyr202530pheprogluprovalthrvalsertrpasnserglyalaleuthrser354045glyvalhisthrpheproalavalleuglnserserglyleutyrser505560leuserservalvalthrvalproserserserleuglythrlysthr65707580tyrthrcysasnvalasphislysproserasnthrlysvalasplys859095argvalgluserlystyrglyproprocysproprocysproalapro100105110glupheleuglyglyproservalpheleupheproprolysprolys115120125aspthrleumetileserargthrprogluvalthrcysvalvalval130135140aspvalserglngluaspprogluvalglnpheasntrptyrvalasp145150155160glyvalgluvalhisasnalalysthrlysproargglugluglnphe165170175asnserthrtyrargvalvalservalleuthrvalleuhisglnasp180185190trpleuasnglylysglutyrlyscyslysvalserasnlysglyleu195200205proserserileglulysthrileserlysalalysglyglnproarg210215220gluproglnvaltyrthrleuproproserglngluglumetthrlys225230235240asnglnvalserleuthrcysleuvallysglyphetyrproserasp245250255ilealavalglutrpgluserasnglyglnprogluasnasntyrlys260265270thrthrproprovalleuaspseraspglyserphepheleutyrser275280285argleuthrvalasplysserargtrpglngluglyasnvalpheser290295300cysservalmethisglualaleuhisasnhistyrthrglnlysser305310315320leuserleuserleuglylys325<210>95<211>107<212>prt<213>人<220><221>misc_feature<222>(1)..(107)<223>人ig-κ<400>95argthrvalalaalaproservalpheilepheproproseraspglu151015glnleulysserglythralaservalvalcysleuleuasnasnphe202530tyrproargglualalysvalglntrplysvalaspasnalaleugln354045serglyasnserglngluservalthrgluglnaspserlysaspser505560thrtyrserleuserserthrleuthrleuserlysalaasptyrglu65707580lyshislysvaltyralacysgluvalthrhisglnglyleuserser859095provalthrlysserpheasnargglyglucys100105当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1