水稻核苷酸片段HAL及含该片段的表达载体与应用的制作方法
本发明涉及一个对水稻的株型、穗型、产量等性状有影响的核苷酸片段——hal,以及含有该片段的重组表达载体,以及其在改良水稻株型、产量等性状中的应用,属于基因工程技术领域。
背景技术:
水稻是世界上重要的粮食作物之一,全世界有约2/3的人口以水稻为主食。为了满足日益增长的人口对粮食的需求,提高水稻生产力具有重要意义。产量性状是描述水稻生产力的重要农艺性状,主要由有效穗数、每穗谷粒数和千粒重几部分组成。这些产量性状都属于数量性状(qtl),由许多效应不同的基因所控制。
目前国内外利用转基因改良农作物经济性状的技术主要是根据已知的功能基因与表型性状的关系,采用组成型表达载体或组织专一性表达载体将目的基因导入目标植物,以期获得作物特定经济性状或抗逆性性状的改良。
叶片是水稻最重要的器官,有研究表明水稻抽穗后灌浆所需营养物质的60%~80%来自叶片的光合作用。水稻叶片在结实期间衰老的快慢直接影响水稻的产量,有研究则表明叶片每推迟衰老一天,产量可提高1%左右。这就是“源-库-流”平衡问题,叶片是“源”,种子是“库”,“库”再大,“流”再畅通,而总的“源”有限,产量终究上不去。所以在提高生物量的基础上,实现产量多基因聚合,改善产量性状,才能达到高产。也就是说要提高水稻产量必须改良水稻株型,增加生物量,进而提高水稻植株产量。
除了增加水稻生物量改良株型可以提高产量外,延长水稻营养生长期,延缓叶片衰老,增加植株光合作用产物量,也是增加水稻产量的一个途径。叶片衰老最明显的表现就是叶绿素逐渐消失,并出现黄化脱落现象,叶片的衰老程度越严重,叶绿素的含量就越低。然而,植物中存在着一种“持绿”现象,持绿是指叶片在植物生长后期的较长时间内仍保持绿色的一种表型特征。水稻转基因研究表明将抗衰老基因导入水稻能够延缓叶片衰老从而使产量得以提高。叶片衰老过程中有一些基因受到抑制而低水平表达,甚至完全不表达;而另一些基因则被激活,从而增强表达。前一类基因被称为衰老下调基因(senescencedown-regulationgenes,sdgs),如编码与光合过程有关的蛋白质的转录本丰度随叶片的衰老而急剧下降;后一类则被称为衰老相关基因(senescence-associatedgenes,sags)。sags又可分为两类:一类仅在衰老阶段才表达,被称为衰老特定基因(senescence-specificgenes,ssgs),如 sag12、sag13;另一类在叶片生长初期就可检测到有低水平表达,在衰老开始后表达量迅速上升。
本发明尝试采用衰老叶片中高表达的一个est,构建反义表达载体,通过rna干扰抑制该高表达基因表达,进而延缓植株衰老,增长水稻营养生长期,扩大水稻植株的“源”,为植株产量提高奠定基础。
技术实现要素:
针对上述现有技术,本发明在衰老叶片mrna中发现了一个高表达的est,并将其命名为hal(highlyexpressinginapoptosisleaves),对其进行克隆,构建反义表达载体,并将该表达载体转化到水稻中,通过rna干扰抑制靶基因在水稻植株中的表达,结果表明该est在水稻株型和产量改良中具有一定的应用潜力。
本发明是通过以下技术方案实现的:
一个水稻核苷酸片段,是在水稻衰老叶片转录组芯片结果中发现的一段高表达的est,设计引物将其从金23b反转录cdna序列中分离和克隆到,将其命名为hal(highlyexpressinginapoptosisleaves),该段est长445bp,核苷酸序列如seqidno.1所示。
一种含有上述核苷酸片段hal的重组表达载体,由核苷酸片段hal反向插入到空白表达载体而成。
优选的,所述含有核苷酸片段hal的重组表达载体所用空白表达载体为pcambia1304,hal序列反向插入的位点为pcambia1304载体35s组成型启动子下游(由此构建的重组表达载体命名为anti-hal表达载体)。
所述anti-hal表达载体的构建方法为:大多数基因工程都是将基因的核苷酸编码序列正向插入载体,而本发明是将hal反向插入载体;所述hal反向序列如seqidno.2所示;构建重组表达载体时,采用pcambia1304(centerfortheapplicationofmolecularbiologyofinternationalagriculture,canberra,act,australia)为表达载体,利用酶切位点bglii和spei将hal反向序列插入到pcambia1304载体35s组成型启动子下游,得到反义表达hal的表达载体,其结构图如图1所示。
本发明构建的含有核苷酸片段hal的重组表达载体(anti-hal表达载体),转入水稻后,经实验证明,可干扰抑制hal在水稻植株(水稻品种包括籼稻金23b和炳1b)中的表达,可增加水稻植株的有效穗数、枝梗数和穗粒数,增加产量,具体表现为:转基因水稻的株高大于转化水稻品种;转基因水稻的穗长大于转化水稻品种;转基因水稻的千粒重大于转化水稻品种。
本发明在衰老叶片mrna中发现了一个高表达的est,并将其命名为hal(highlyexpressinginapoptosisleaves),对其进行克隆,首次将组成型表达调控的花椰菜病毒35s启动子与hal反义互补序列进行融合,并将该融合表达载体转化到水稻中,通过rna干扰抑制靶基因在水稻植株中表达,改变了水稻的株型、穗型、产量等性状。本发明的est在水稻株型和产量改良中具有一定的应用潜力。
附图说明
图1为水稻anti-hal基因的表达载体结构图。
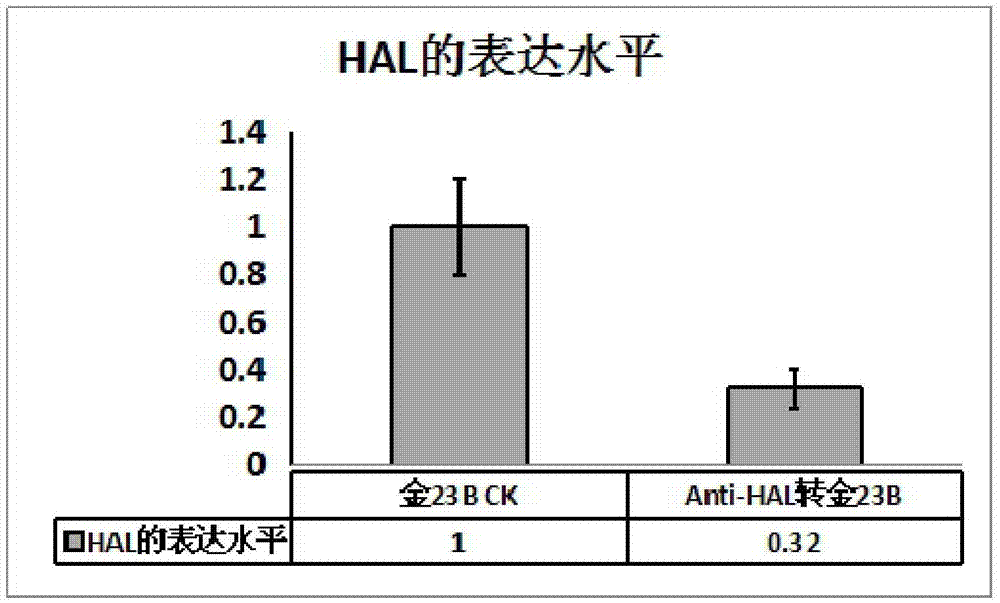
图2为hal基因在野生型植株金23b和anti-hal转基因植株中表达量的对比。
图3为anti-hal转基因植株株高变化。
图4为anti-hal转基因植株产量性状变化。
图5为anti-hal转基因植株千粒重和总重变化。
图6为anti-hal转基因植株结实率变化。
图7为anti-hal转基因植株和金23b对照的14天幼苗对比。
图8为anti-hal转基因植株和金23b对照的苗期叶片衰老对比。
图9为anti-hal转基因植株和金23b对照的株型对比。
图10为anti-hal转基因植株和金23b对照的稻穗对比。
图11为anti-hal转基因植株和金23b对照的粒型对比。
图12为anti-hal转基因植株和金23b对照的根横切面对比,其中,a为金23b;b为anti-hal转基因。
图13为anti-hal转基因植株和金23b对照的茎横切面对比,其中,a为金23b;b为anti-hal转基因。
图14为anti-hal转基因植株和金23b对照的茎纵切面对比,其中,a为金23b;b为anti-hal转基因。
图15为anti-hal转基因植株和金23b对照的叶横切面对比。
图16为anti-hal转基因植株和金23b对照的颖壳横切面对比,其中,a为金23b;b为anti-hal转基因。
图17为anti-hal转基因植株转育炳1b和三个对照株的抽穗期株型对比。
图18为anti-hal转基因植株转育炳1b和三个对照株的抽穗期穗型对比。
图19为anti-hal转基因植株转育炳1b和三个对照株的抽穗期粒型对比。
具体实施方式
下面结合实施例对本发明作进一步的说明。
下述实施例中所涉及的仪器、试剂、材料等,若无特别说明,均为现有技术中已有的常规仪器、试剂、材料等,可通过正规商业途径获得。下述实施例中所涉及的实验方法,检测方法等,若无特别说明,均为现有技术中已有的常规实验方法,检测方法等。
实施例1hal序列的获得、重组表达载体的构建及应用
1.hal序列的获得
在水稻衰老叶片转录组芯片结果中,发现一段高表达的est,设计扩增引物hal-s:gatacttctgaaagcaccaa;hal-a:gtgagattaacggtatgact(如seqidno.3、4所示),从金23bcdna中扩增获选序列并进行测序分析,得到一段长度为445bp的核苷酸序列,命名为hal(highlyexpressinginapoptosisleaves),序列如seqidno.1所示。
2.干扰载体的构建
选取hal全长445bp序列作为特异干扰区,使用金23bcdna作为扩增模板,连入载体所使用的引物为:hal-bglii-s:gga/gatctgtgagattaacggtatgact;hal-spei-a:gga/ctagtgatacttctgaaagcaccaa(如seqidno.5、6所示;带下划线的字母表示bglii和spei的酶切位点,左斜线表示限制性内切酶切割位点)。使用凝胶回收试剂盒将含有目的pcr产物的琼脂糖凝胶进行dna片段回收,纯化后的pcr产物连接到pmd19-t载体中,将连接质粒体系使用冻融法转化大肠杆菌,涂板,通过蓝白板筛选以及单克隆菌液测序,选定含有正确hal序列的大肠杆菌抽提质粒,以及pcambia1304空载体,同时进行bglii和spei双酶切,回收酶切片段进行连接,这样hal就反向插入到了35spromoter的下游。干扰载体pcambia1304/antisense-hal构建完成,如图1所示。
3.anti-hal干扰载体的遗传转化
(1)将anti-hal载体转化eha105农杆菌(agrobacteriumtumefaciens)(wuzmet,.2007),得到转化子。将转化子提取质粒送样测序,结果表明质粒为anti-hal,因此将含有anti-hal的转化子命名为eha105/anti-hal。
(2)金23b成熟种子愈伤的诱导与培养
本实验用培养基如表1所示。
表1
(注:1.以上培养基均含30g/l蔗糖+2.5g/lagar)
取金23b成熟种子去壳,在无菌条件下,先用70%乙醇浸洗10min,转入0.1%升汞浸泡20min,无菌水清洗3次,接种于诱导培养基中。26℃黑暗条件下培养,20天后选取愈伤组织继代培养。
3)农杆菌侵染
28℃培养eha105/anti-hal农杆菌16小时,收集菌液,并稀释到含有100μmol/l的yep液体培养基中至浓度为od600≈0.5,浸泡时间分为10min、20min、30min三组,以希望能够比较得出最佳的浸泡时间,浸泡期间不时摇匀。浸泡完成后,取出愈伤块,铺在灭菌的滤纸上吸干多余菌液后,转移到共培养培养基上,培养基表面铺一层无菌滤纸,愈伤在滤纸上与培养基不直接接触。26℃,共培养6天。
4)转化愈伤的筛选
共培养完成后,取出愈伤块,用无菌水清洗3~5次,再用含利福平(50mg/l)与卡那霉素(50mg/l)抗性的无菌水清洗2~3次,无菌滤纸吸干净多余水分后,将愈伤转移至初级筛选培养基(添加30ppm潮霉素的ms培养基)中(转化愈伤进行初级、次级两轮筛选,约3周),然后将筛选的细胞系转移到分化培养基诱导长芽和生根。
4.转化处理试管苗移栽及转化植株后代的分子检测
上述筛选完成后,将筛选的细胞系转移至分化培养基中再生植株,在26℃、16h光照/每天的条件下,继续培养30天。至分化出绿苗后,把小苗转移到生根培养基中培养,当小植株长到约10cm高时,将其从生根培养基中移出,洗净残留培养基,炼苗一段时间后,移栽到温室,于2012年夏获得阳性t0代植株。2012年冬,在海南岛加代繁殖,获得转基因t1代,采用pcr扩增检测候选的转化植株,所使用的扩增引物为:hal-jc-s:cactatccttcgcaagaccc,hal-jc-a:gtgagattaacggtatgact(如seqidno.7、4所示),获得12个含anti-hal的转化阳性植株(共计12个株系)。
5.hal反向序列转金23b植株的实时定量pcr(realtimepcr)检测
结果如图2所示,esthal在金23b转基因植株中的表达量比野生型植株降低。
6.hal反向序列转基因t2代群体产量性状的调查与统计
将hal反向序列转基因t2代于2013年春播种,四叶期将2个转基因t2代株系,种植在复旦大学试验田,每个株系各种植20株,行株距为6寸×6寸,重复三次,同时设立籼稻金23b亲本对照。在成熟期分别统计各株系20个单株的株高,穗长,有效穗数,一次枝梗数,二次枝梗数,单穗总粒数,千粒重,总重,结实率,计算平均值,统计结果如表2所示。
表2
水稻anti-hal转基因植株的穗长、有效穗数、枝梗数和穗粒数变化见图3~7所示。根据上述田间调查及考种数据,与对照相比,anti-hal转基因籼稻金23b的产量性状优于对照:有效穗数增加11.90%;主穗穗粒数增加35.65%;千粒重增加13.3%,图8~10列举了anti-hal转基因植株和金23b对照植株抽穗期的株型,穗型和粒型的差别(从图中可以看到,转基因植株的株高明显高于金23b对照植株;转基因植株的穗长明显长于金23b对照植株;转基因植株的粒明显大于金23b对照植株)。根据考种统计数据和植株表型可知,水稻anti-hal转基因增加产量的主要原因是增加有效穗数、枝梗数和穗粒数。
7.hal反向序列转基因植株的叶片衰老延缓
将水稻hal反向序列转基因植株和对照金23b的种子同时催芽发苗,生长至30天时,对照金23b植株的第二叶已完全黄化枯萎,hal反向序列转基因植株的第二叶则仍为绿色,如图7所示。抽穗期时,转基因植株的叶片衰老明显晚于对照,如图7所示。由于反义表达hal在转基因植株中引起持绿和抽穗期推迟,延长了光合作用的时间,因此大大增加了干物质的积累,最终导致了产量的显著提高。
8.hal反向序列转基因植株生物量增加是由细胞数目增多引起
取灌浆期前水稻植株的根,茎,叶和颖壳进行组织学切片分析,如图11~15中所示,金23b和anti-hal转基因植株的根,茎,叶和颖壳的大小差异是由细胞数目改变引起的,在anti-hal转基因植株中各器官增大,通过增加植株的生物量,合成更多的光合作用产物,最终引起水稻产量的提高。
9.转基因金23b中的anti-hal序列杂交导入籼稻品种炳1b中,产量性状得到改良
将转anti-hal序列的金23b与籼稻品种炳1b杂交,并连续与炳1b回交3次,通过anti-hal序列的分子标记辅助选择,把anti-hal序列导入籼稻品种炳1b中,结果表明,导入anti-hal序列后,产量得到了大幅度的提高,如图16~18所示(图中可见,导入anti-hal序列后,水稻植株的株高、穗长得到了明显的增长,有效穗数、主穗穗粒数得到了明显的增加,且粒型明显增大,粒大饱满,产量得到了明显的增加)。
上述虽然结合实施例对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
sequencelisting
<110>复旦大学
<120>水稻核苷酸片段hal及含该片段的表达载体与应用
<130>
<160>7
<170>patentinversion3.5
<210>1
<211>445
<212>dna
<213>水稻
<400>1
gatacttctgaaagcaccaaagtgattgattgagataatttaccaatgtggctatctgca60
acttgaagttagggatcatccttattctcttaggaaccattttatttgtttccttgtttt120
caatgatgataacaaattaggaaaaatattgggatttaatccagatagaagtgtgaatgc180
tgtttgtgctgacttggggttgccagatggtttgcaatgttgaattacagggaaatctgt240
gaacctccccctcgaaatagtatatgcagtaaactaacaaaattatacatcttgaattgt300
atttttgttgagtattggtactgtggcagtaggctggaccaaactggcaaacaattgcat360
ggatatataatgtatagtttgcttatcagaatcaaatgttctgaataaggatgattctat420
gaaaaagtcataccgttaatctcac445
<210>2
<211>445
<212>dna
<213>水稻
<400>2
gtgagattaacggtatgactttttcatagaatcatccttattcagaacatttgattctga60
taagcaaactatacattatatatccatgcaattgtttgccagtttggtccagcctactgc120
cacagtaccaatactcaacaaaaatacaattcaagatgtataattttgttagtttactgc180
atatactatttcgagggggaggttcacagatttccctgtaattcaacattgcaaaccatc240
tggcaaccccaagtcagcacaaacagcattcacacttctatctggattaaatcccaatat300
ttttcctaatttgttatcatcattgaaaacaaggaaacaaataaaatggttcctaagaga360
ataaggatgatccctaacttcaagttgcagatagccacattggtaaattatctcaatcaa420
tcactttggtgctttcagaagtatc445
<210>3
<211>20
<212>dna
<213>人工序列
<400>3
gatacttctgaaagcaccaa20
<210>4
<211>20
<212>dna
<213>人工序列
<400>4
gtgagattaacggtatgact20
<210>5
<211>28
<212>dna
<213>人工序列
<400>5
ggagatctgtgagattaacggtatgact28
<210>6
<211>28
<212>dna
<213>人工序列
<400>6
ggactagtgatacttctgaaagcaccaa28
<210>7
<211>20
<212>dna
<213>人工序列
<400>7
cactatccttcgcaagaccc20
- 还没有人留言评论。精彩留言会获得点赞!