一种在血浆和血清中检测miRNA的方法与流程
本发明涉及生物技术领域,具体地,涉及一种在血浆和血清中检测mirna的方法。
背景技术:
2008年mitchellps等发现血浆中mirna能以稳定的形式存在,避免内源性rna酶的降解。同年shlomitg等证实mirna可以在血浆和其他体液中稳定存在,并且表达谱随不同病理生理状态而改变。由于外周静脉血获取简单且病人容易接受,克服了样本量不足等困难,使得循环mirna在疾病诊断中的应用研究成为研究的热点。
最常用且有效的mirna表达检测技术是荧光定量pcr法。目前通用步骤为:抽提样本rna,逆转为mirnacdna,荧光定量检测mirna表达水平。第一步抽提样本rna较困难。由于血浆mirna含量较低,若样本量较少时提取的rna量不足后续试验。最常用的血浆循环rna抽提法沿用传统trizol抽提法:trizol裂解,氯仿萃取,异丙醇沉淀,75%乙醇洗涤,depc水溶解。此方法提取效率低,对样本量要求大,而且有机试剂的残留会抑制后续pcr反应,造成mirna检测效率下降。市场上的试剂盒抽提法为:裂解,萃取,磁珠或吸附柱吸附,洗涤,溶解。该方法通常会使用磁珠或吸附柱,会造成rna的损失、破坏rna的完整性,对样本需求量大而且费用较高。
并且,传统的血浆mirna检测方法复杂,耗时间,成本高,重复性低,不利于临床推广和应用。
因此,本领域迫切需要开发一种简化检测方法、降低成本、提高重复性的在血浆和血清中检测mirna的方法。
技术实现要素:
本发明的目的是提供了一种简化检测方法、降低成本、提高重复性的在血浆和血清中检测mirna的方法。
本发明第一方面提供了一种非诊断性的免抽提的对测试样品进行mirna检测的方法,所述方法包括步骤:
(i)提供一测试样品,所述测试样品为血浆和血清样品,将所述测试样品和预处理缓冲液混合,形成第一混合物,其中所述预处理缓冲液包括非离子型表面活性剂;
(ii)将所述第一混合物进行加热处理,得到经处理的第二混合物;和
(iii)将所述第二混合物直接用作模板,检测所述测试样品中的mirna的种类和/或含量。
在另一优选例中,在步骤(i)中,所述预处理缓冲液包括一种或多种选自下组的非离子型表面活性剂:吐温20(tween-20)、吐温21(tween-21)、吐温40(tween-40)、吐温60(tween-60)、吐温61(tween-61)、吐温80(tween-80)、吐温81(tween-81)、吐温85(tween-85)、tritonx-100、np-40、或其组合。
在另一优选例中,所述非离子型表面活性剂包括吐温20(tween-20)。
在另一优选例中,所述非离子型表面活性剂的浓度(v/v)为0.5-10%,较佳地,1-5%,更佳地,2-4%。
在另一优选例中,所用溶剂为水。
在另一优选例中,所述非离子型表面活性剂的浓度为0.5-10wt%,较佳地,1-5wt%,更佳地,2-4wt%。
在另一优选例中,在步骤(i)中,所述预处理缓冲液的ph为6-9,较佳地,7-9,更佳地,7-8。
在另一优选例中,所述预处理缓冲液还包括tris-hcl缓冲液。
在另一优选例中,所述tris-hcl缓冲液的浓度为25-150mm,较佳地,30-100mm,更佳地,30-80mm。
在另一优选例中,所述预处理缓冲液还包括金属螯合剂。
在另一优选例中,所述金属螯合剂选自下组:edta、egta、或其组合。
在另一优选例中,所述金属螯合剂包括edta。
在另一优选例中,所述金属螯合剂的浓度为0.5-2.0mm,较佳地,0.5-1.5mm,更佳地,0.8-1.2mm。
在另一优选例中,在步骤(ii)中,所述加热温度为60-80℃,较佳地,70-75 ℃。
在另一优选例中,在步骤(iii)中,用荧光定量pcr的方法检测测试样品中的mirna的含量。
在另一优选例中,所述mirna来自于哺乳动物,优选人。
在另一优选例中,所述方法不包括抽提rna的步骤。
在另一优选例中,所述方法为非治疗非诊断性的。
在另一优选例中,所述方法检测所述测试样品中选自下组(a)的一个或多个mirna的种类和/或数量:mir-20b、mir-106a、mir-16。
在另一优选例中,所述方法检测所述测试样品中选自下组(b)的一个或多个mirna的种类和/或数量:mir-671、mir-151、mir-433、mir-409。
本发明第二方面提供了一种mirna组合物,所述组合物包括如下mirna或由如下mirna构成:mir-20b、mir-106a、mir-16、mir-671、mir-151、mir-433、和mir-409。
在另一优选例中,所述组合物包括选自下组(a)的至少一种或全部的mirna:mir-20b、mir-106a、mir-16。
在另一优选例中,所述组合物包括选自下组(b)的至少一种或全部的mirna:mir-671、mir-151、mir-433、mir-409。
本发明第三方面提供了一种本发明第二方面所述组合物的用途,用于制备检测乳腺癌转移的诊断试剂或试剂盒。
在另一优选例中,所述组合物还被用作血浆中检测乳腺癌发生及转移的生物标志物。
在另一优选例中,所述试剂盒包括:(i)本发明第二方面所述的mirna组合物作为对照品;和(ii)标签或说明书,其中,所述标签或说明书注明所述试剂盒用于检测或诊断乳腺癌转移。
在另一优选例中,所述诊断试剂是单克隆抗体。
在另一优选例中,所述的检测乳腺癌转移是血浆检测。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
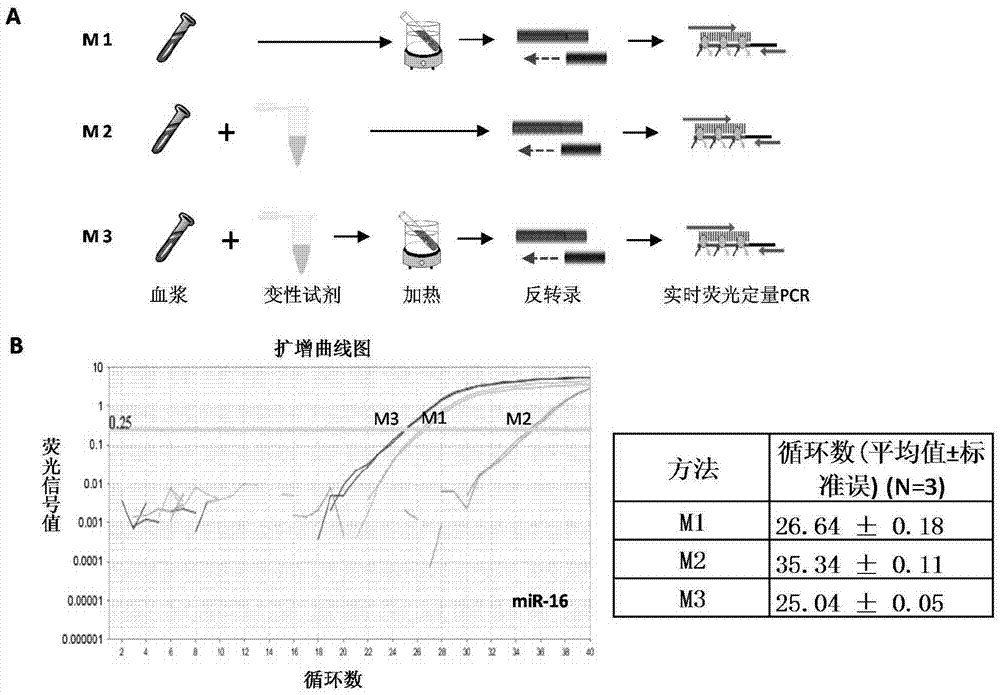
图1显示了本发明的方法与传统方法的比较。
图2显示了最佳方法的优选。其中,2a:三种不同处理样本方法的比较;2b:三种方法分别检测mir-16,显示m3(化学变性和加热变性相结合)的检测效率最高。
图3显示了该检测方法的准确性。取不同体积的血浆样本,定量检测mir-16,其含量与样本体积呈正比例关系,其中,3a:利用m3(化学变性和加热变性相结合),定量检测血浆mir-16;3b:mir-16扩增循环数;3c:将上述扩增循环数换算为mirna相对表达量,和样本体积成线性正比关系。
图4显示了该检测方法的特异性。同一血浆样本中加入不同体积的外源性小rnaunisp6,利用该方法成功检测到unisp6,并且其检测到的含量与加入的量相符。mir-16作为内对照,其含量不随外源性unisp6的加入而改变。其中,4a:定量检测血浆中unisp6的丰度;4b:检测和unisp6无关的mir-16。
图5通过检测mir-92a和let-7b,比较了传统的检测方法及本方案申请的检测方法。其中,5a显示血浆直接测定法(p)检测效率优于传统的rna提取检测方法(r);5b显示两种方法分别检测let-7b在不同样本中的差异,结果是一致的;5c显示两种方法分别检测mir-92a在不同样本中的差异,结果是一致的。
图6显示了血浆中mir-106a和mir-671可以作为乳腺癌转移的生物标志物。其中,6a显示4例正常人和6例乳腺癌患者(包括3例癌细胞非转移患者和3例癌细胞转移患者)血浆mirna筛查,发现7个异常表达的mirna;6b通过更多样本的验证,证实mir-106a在转移性乳腺癌血浆中显著性上调;6c通过更多样本的验证,证实mir-671在转移性乳腺癌血浆中显著性下调。
图7显示加热处理的样本,利用血浆直接测定法,能够检测到mir-16,而sds处理的样本,利用血浆直接测定法未能检测到mir-16。
图8显示加热处理的样本,利用血浆直接测定法,能够检测到mir-21,而sds处理的样本,利用血浆直接测定法未能检测到mir-21。
图9显示加热处理的样本,利用血浆直接测定法,能够检测到5srrna,而sds处理的样本,利用血浆直接测定法未能检测到5srrna。
具体实施方式
本发明人经过广泛而深入的研究,首次开发了一种新型的检测mirna的方法,该方法将血浆和血清样品进行加热和非离子表面活性剂处理,所得到的混 合物不经rna提取直接用作模板,用于检测血浆和血清中mirna的含量。该检测方法的检测结果具有高准确性、高灵敏度、高特异性、高检测效率的特点。此外,本发明人还发现一系列mirna分子,可作为诊断乳腺癌转移的标记物。在此基础上,发明人完成了本发明。
如本文所用,术语“预处理缓冲液”、“变性缓冲液”可互换使用,均指一种含有吐温20(0.5-10%v/v)、edta(0.8-1.2mm)和tris-hcl(30-80mm)的溶液。
检测方法
本发明提供了一种可用于检测微小rna(mirna)的新方法。
本发明检测方法采用了对血浆和血清进行加热和变性缓冲液(包括非离子型表面活性剂)共处理,所得到的混合物不经rna提取步骤,直接用于mirna的检测。
本发明的方法与传统方法的比较如图1所示。在本发明中,一个典型的mirna检测方法包括如下基本步骤:
(i)提供一测试样品,所述测试样品为血浆和血清样品,将所述测试样品和预处理缓冲液混合,形成第一混合物,其中所述预处理缓冲液包括非离子型表面活性剂;
(ii)将所述第一混合物进行加热处理,得到经处理的第二混合物;和
(iii)将所述第二混合物直接用作模板,检测所述测试样品中的mirna的种类和/或含量。
在本发明中,一种优选的检测方法的步骤包括:
(1)准备变性缓冲液:2.5%(v/v)tween20,50mmol/ltris-hcl,1mmol/ledta
(2)5ul血浆加5ul等体积变性缓冲液,反应10分钟,75℃水浴5min,入冰冷却,离心。
(3)利用常规市售mirna逆转录试剂盒,将mirna反转录为cdna,稀释10-100倍备用。
(4)荧光定量pcr反应,扩增mirna,检测mirna在血浆样本的表达丰度。
16ul反应体系:1ulcdna,1ul待测mirna前引物(2.5pmol/ul),1ul通用 后引物(2.5pmol/ul),8ulsybr荧光试剂,5ulh2o。
反应条件:50℃、2min;95℃、10min;40个循环:95℃、15s,60℃、1min。
本发明的检测方法不仅省略了rna的提取步骤,还具有检测结果高准确性、高特异性、高灵敏度、高检测效率的特点。
检测乳腺癌发生及转移的生物标志物
本发明还提供了mirna组合物,可被用作检测血浆中乳腺癌发生及转移的生物标志物。
在本发明中,本发明的mirna组合物选自下组:mir-20b、mir-106a、mir-16、mir-671、mir-151、mir-433、mir-409、或其组合。
其中,mir-20b、mir-106a和mir-16在转移性乳腺癌患者的血浆中能够特异性高表达;mir-671、mir-151、mir-433和mir-409在转移性乳腺癌患者的血浆中能够特异性低表达。
本发明的优点主要包括:
(1)该检测方法省略了rna的提取步骤,方法简单,成本更低。
(2)该检测方法的检测结果具有高准确性、高特异性、高检测效率的特点。
(3)该检测方法灵敏度更高,避免了血浆rna制备过程中的mirna损失。
(4)该检测方法快捷便利,和传统方法相比,检测时间缩短了一半。
(5)该检测方法避免使用trizol等有机溶剂,排除了传统方法残存有机溶剂对后续检测的影响。
(6)基于上述优点,该检测方法更适于临床检验和检测。
(7)首次发现,本发明的mirna组合物可以被用作检测血浆中乳腺癌发生及转移的生物标志物。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂 商所建议的条件。除非另外说明,否则百分比和份数是重量或体积百分比和重量份数。
1.方法
(1)准备变性缓冲液:2.5%(v/v)tween20,50mmol/ltris-hcl,1mmol/ledta
(2)5ul血浆加5ul等体积变性缓冲液,反应10分钟,75℃水浴5min,入冰冷却,离心。
(3)利用常规市售mirna逆转录试剂盒,将mirna反转录为cdna,稀释10-100倍备用。
(4)荧光定量pcr反应,扩增mirna,检测mirna在血浆样本的表达丰度。
16ul反应体系:1ulcdna,1ul待测mirna前引物(2.5pmol/ul),1ul通用后引物(2.5pmol/ul),8ulsybr荧光试剂,5ulh2o。
反应条件:50℃、2min;95℃、10min;40个循环:95℃、15second,60℃、1min。
2.优化的方法
首先比较了三种不同的蛋白变性方法,m1是加热变性,m2是变性缓冲液化学变性,m3是把化学变性和加热变性结合一起,比较不同方法对mirna在血浆中的释放和定量检测的影响。
利用上述三种不同的方法,定量检测了同一个血浆样本中mir-16的表达丰度,结果如图2a和2b所示。结果显示,m3检测效率最高(循环数最小),m1次之,m2效率最低(循环数最大)。
结果表明,利用血浆蛋白变性直接检测mirna方法可行,并且m3方法(化学变性和加热变性结合)对于血浆mirna检测效率最高。
3.方法准确性的验证
分别取1、4、8ul血浆,利用m3所述方法,定量检测血浆mir-16,以验证 不同体积血浆中mir-16量的不同。
结果如图3a、3b、3c所示。结果显示,1、4、8ul血浆分别对应的mir-16扩增循环数为31.8、29.6、28.5。血浆体积越大,循环数越小,符合预期。将上述扩增循环数换算为mirna相对表达量,和样本体积成线性正比关系,r2达到0.999,结果表明,本发明的检测方法对血浆mirna的检测具有高准确性。
4.方法特异性的验证
在一个血浆样本中,加入一种外源性的rna(unisp6)。此rna在血浆中本身不存在。设定三组实验,等量血浆中分别给予0、1、4ul的unisp6,再利用m3所述方法,定量检测血浆中unisp6的丰度,以验证该方法对某个特定mirna检测的特异性。结果如图4a所示。结果显示,unisp6在0ul的实验组中检测不到;而在1ul和4ul的实验组中能够检测到,并且其丰度相对比值≈4,和unisp6加入量匹配,结果证明了该方法对rna定量分析具有高特异性。
在上述体系中,检测和unisp6无关的mir-16,结果如图4b所示。结果表明,三组体系中mir-16的表达丰度一致,进一步验证了该方法对rna定量分析具有高特异性。
5.检测效率的验证
设计一组实验,比较传统提取rna的方法和本发明的方法,用于同一个血浆样本mirna检测,通过cdna不同稀释倍数,取相当于源自0.02ul血浆的两种方法的cdna,分别检测mirnalet-7b和mir-92a。结果如图5a所示。结果显示,与传统的分析方法相比,本发明的方法具有更高的检测效率,δct值相差0.7~1.1,相当于检测效率高一倍左右。
设计另外一组实验,比较传统提取rna的方法和本发明的方法,用于检测两种不同血浆中某mirna的表达差异性。发明人用两种方法,分别检测了样本s4和s5中let-7b和mir-92a的表达。结果如图5b和5c所示。结果显示,两种方法均检测到样本s4和s5的let-7b,δct≈3,相当于s4的let-7b比s5高8倍,并且两种方法均检测到样本s4和s5的mir-92a,δct≈2,相当于s4的let-7b比s5高4倍。该实验进一步证明了本发明的方法的检测效率非常高。
6.血清中检测mirna
收集外周血到未加抗凝剂的采血管中,室温静置30分钟,1500rpm离心5分钟,收集上清,得到待测血清样本。
用上述方法(1和2)分别对血清样本中的mirna(如mir-16)进行检测。
结果显示,m3方法(化学变性和加热变性结合)能够成功检测到血清mirna,但对于同一血液样本,血浆mirna含量高于血清mirna含量(c1:c2>130%),可能归因于血清制备过程中部分mirna随结合蛋白一起沉淀损失。
结果表明,可直接检测血清的mirna,并且m3方法(化学变性和加热变性结合)对于血浆mirna检测效率最高。
7.临床应用
之前通过mirna基因芯片技术,分析了六例乳腺癌患者血浆样本及四例年龄匹配的健康女性血浆样本,其中患者三例为非转移乳腺癌、另三例为发生转移的乳腺癌,找到了三个在转移性乳腺癌患者血浆特异高表达的mirna(mir-20b,mir-106a,mir-16),及四个在转移性乳腺癌患者血浆特异低表达的mirna(mir-671,mir-151,mir-433,mir-409)。如图6a、6b和6c所示。
利用本发明的血浆直接测定法m3(化学变性和加热变性相结合),重新收集了三例非转移乳腺癌患者血浆、三例发生转移的乳腺癌患者血浆、三例健康女性的血浆,对上述mirna分别进行了验证,发现mir-106a在转移性乳腺癌患者血浆特异高表达,mir-671在转移性乳腺癌患者血浆特异低表达。这两个结果与之前的基因芯片检测结果一致,说明通过不同样本,不同方法的分析,确认了这两个mirna可以作为转移性乳腺癌患者血浆生物标志物,具有临床应用价值和潜力,可用于乳腺癌转移的早期诊断。
对比例1
方法同1,区别在于,用sds替代变性缓冲液,取5ul血浆,分别用加热处理或者等体积10%sds处理,然后利用本发明的mirna直接检测法,对三个微小rna(如mir-16、mir-21、5srrna)进行检测,结果如图7-9所示。
结果如图7-9所示。结果显示,加热变性处理的样本,扩增良好,利用血浆直接测定法,能够检测到mir-16、mir-21和5srrna,而sds变性处理的样本,没有扩增曲线,利用血浆直接测定法均未能检测到上述mirna。
结果表明,用sds处理,无法对三个微小rna(如mir-16、mir-21、5srrna)进行检测。
对比例2
方法同1,区别在于,用sds替代变性缓冲液,对血浆进行加热和等体积10%sds处理,然后利用本发明的mirna直接检测法,对三个微小rna(如mir-16、mir-21、5srrna)进行检测,结果显示,用加热和sds同时处理,没有扩增曲线。
结果表明,对血浆同时进行加热和sds处理,无法对三个微小rna(如mir-16、mir-21、5srrna)进行检测。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!