改进的重组人促卵泡激素的制作方法
技术领域:
本发明涉及促性腺激素领域。特别地,提供了改进的重组人促卵泡激素(rhFSH)。这种改进的rhFSH可用于不育症的治疗,特别是用于人类患者。
背景技术:
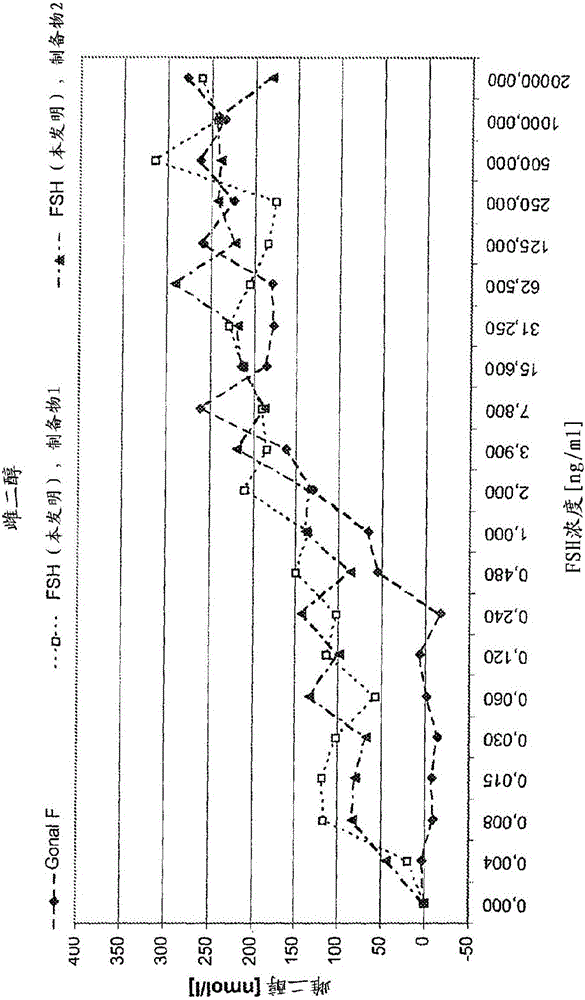
:促性腺激素是一组蛋白质激素,其调控雄性和雌性的性腺功能,因此在人类能育中起到重要作用。其是由脊椎动物脑垂体的促性腺细胞在受到促性腺激素释放激素(GnRH)刺激后分泌的。促性腺激素为异二聚体糖蛋白,包括促卵泡激素(FSH)、促黄体激素(LH)及绒毛促性腺激素(CG)。这些促性腺激素具有相同的α-亚基,但包含不同的β-亚基,后者能确保其的受体结合特异性。FSH包含一个92个氨基酸的α-亚基以及一个111个氨基酸的β-亚基,后者赋予其对FSH受体的特异性结合。所述天然蛋白质的两个亚基都受到糖基化修饰。α-亚基在Asn52和Asn78处而β-亚基在Asn7和Asn24处进行天然糖基化。在细胞中两种亚基都是以前体蛋白质产生然后加工并分泌的。FSH调控身体的发育、生长、青春期成熟及生殖过程。特别地,其刺激生殖细胞的成熟并因此参与精子发生及卵泡发生。卵泡发生是由FSH诱导的,例如通过FSH对粒层细胞表面上的FSH受体的结合。FSH受体为G蛋白偶联受体,其在FSH结合时激活偶联的G蛋白。然后所述G蛋白进而激活腺苷酸环化酶,导致cAMP——一种二级信使分子的产生。细胞中cAMP浓度的增加激活数种下游靶标,特别是cAMP依赖的蛋白质激酶,后者然后引起黄体酮和雌激素的合成。黄体酮和雌激素是由粒层细胞分泌的,诱导卵泡发生。在粒层细胞受到FSH刺激时,其还释放抑制素-B,这形成了一个负反馈环,从而抑制垂体中FSH的产生和分泌。已有显示抑制素B为很好替代标记物,提示有FSH造成的卵巢刺激。FSH在对不育症的治疗中有广泛使用,可以单独或与其他试剂(特别是LH)组合使用。在本领域中,通用已经使用了纯化自绝经期后人尿液的FSH(尿FSH)或由中国仓鼠卵巢(CHO)细胞重组产生的FSH用于人类治疗。然而,由于存在不同异构体,所以有极大的与不同FSH制备相关的异质性。个体FSH异构体显示相同的氨基酸序列,但在其糖基化程度和本质上有差异。具体的异构体的特征在于碳水化合物支链结构的异质性以及不同量的唾液酸(一种带负电的末端单糖单元),这二者都影响了异构体的特异生物活性。因此,FSH的糖基化形式对其生物学活性有显著的影响。然而,来自不同供体和不同制备物的尿液FSH在其碳水化合物结构上有显著的变化,形成高度的批-批变化。考虑到尿液制品中病毒的存在,还存在安全问题。进一步地,获自CHO细胞的FSH显示的糖基化形式特异于这些仓鼠细胞,这与人类糖基化形式不相同。这些差异导致所获得的FSH有变化的生物学活性及副作用,因此要施用于患者的药用制备物也具有这些性质。鉴于此,本发明的一个目标就是提供改进的FSH制备物。进一步地,本发明的一个目标是提供具有新型治疗或药用特征的FSH制备物。进一步地,本发明的一个目标是提供具有改进的糖基化形式的FSH制备物。技术实现要素:本发明人已经发现获自人类细胞的改进的FSH制备物(优选地,是以优化的糖基化水平选择的制备物)能够以比对应的获自人尿液或CHO细胞的FSH制备物更低的浓度诱导性类固醇如雌激素和黄体酮的分泌。因此,根据本发明的FSH制备物具有可用于治疗的惊人的特征。本发明在第一方面提供了重组的FSH制备物,其中制备物中的重组FSH具有的糖基化形式包含一种或多种以下特征:(i)携带平分型N-乙酰葡萄糖胺(bisGlcNAc)的聚糖的相对量为至少20%;(ii)携带果糖的聚糖的相对量为至少30%;和/或(iii)2,6-偶联唾液酸的相对量为至少30%;和/或(iv)其为多样的糖基化形式。在第二方面,本发明提供了重组FSH制备物,其可通过在人类细胞或人类细胞系中生产而获得,特别是细胞系GT-5s(DSMACC3078,保藏于2010年7月28日)。据发现在各细胞系中产生的FSH产生了改进的糖基化谱,如上文和下文所描述的。还提供了一种药用组合物,其包含根据本发明的重组FSH。进一步地,本发明涉及根据本发明的重组FSH制备物或药用组合物,用于治疗不育症。进一步地,本发明涉及根据本发明的重组FSH制备物或药用组合物,用于不依赖于cAMP而诱导和/或刺激性类固醇的分泌。一些实验显示根据本发明的FSH的低浓度效应在特定环境中不依赖于靶标细胞中的cAMP信号传导。因此,这些实验表明根据本发明的改进的FSH制备物可在一定浓度下诱导性类固醇如黄体酮的分泌而不增加cAMP的分泌。因此,认为根据本发明的改进的FSH制备物的特定实施方式能够诱导信号转导通路而导致性类固醇的分泌,所述通路不同于对通常使用的FSH制备物所描述的使用cAMP作为第二信使的已知信号转导通路。进一步地,本发明涉及根据本发明的重组FSH制备物或药用组合物用于通过不依赖于cAMP信号的生物学过程刺激或共刺激生殖细胞的成熟。进一步地,本发明涉及根据本发明的重组FSH制备物或药用组合物用于诱导和/或刺激性类固醇的分泌的用途,在这些FSH浓度下不会诱导显著的cAMP释放。本发明的其他目标、特征、优势及方面通过以下描述及附随的权利要求对本领域技术人员变得明显。然而,要理解的是以下描述、附随的权利要求及指出本应用优选的实施方式的特异实施例都只是以示例说明的方式给出。在阅读下文后,本领域技术人员会容易理解在所公开的发明的精神和范围内的多种变化和修饰。定义:如本文所使用的,以下词语通常优选地具有下文提出的意义,除非其使用的上下文中另有指出。如本文所使用的,词语“包含”除了其常规意义外还包括并特异性指代词语“基本上由……组成”及“由……组成”。因此,词语“包含”指的是这样的实施方式,其中“包含”特异性列出的元素的主题物质不包含其他元素,还包括这样的实施方式,其中“包含”特异性列出的元素的主体物质可能和/或确实包含其他元素。术语“FSH”指的是促卵泡激素,一种促性腺激素。FSH为一种糖蛋白,其包含两个亚基的糖蛋白,标记为α和β亚基。优选地,FSH为人类FSH,特别是由具有SEQIDNO:1的氨基酸序列的α亚基和具有SEQIDNO:2的氨基酸序列的β亚基组成的人类FSH。然而,在其中一个或两个亚基中可能存在一个或多个,如1个、1或2个、多至3个、多至5个、多至10个或多至20个氨基酸的置换、添加和/或删除。优选地,α亚基的氨基酸序列与根据SEQIDNO:1的氨基酸序列共有的整体同源性或同一性为至少80%、更优选地至少85%、至少90%、至少95%或至少98%。进一步地,β亚基的氨基酸序列与根据SEQIDNO:2的氨基酸序列共有的整体同源性或相同性优选为至少80%、更优选地至少85%、至少90%、至少95%或至少98%。所述FSH的亚基优选地为两条分离的多肽链,然而,如本文所使用的,术语“FSH”还包括这样的实施方式,其中这两个亚基共价地彼此相连,例如通过交联试剂或连接多肽链,还包括这样的实施方式,其中一个或两个亚基被进一步划分为数条多肽链。优选地,根据本发明的FSH能够结合及/或激活FSH受体,优选地为人类FSH受体。如本文所使用的,术语“FSH”具体指代制备物中的所有FSH蛋白质。因此,术语“FSH”具体指代FSH制备物或组合物中所有FSH蛋白质的全体。优选地,所述FSH蛋白质的两个亚基都包含一个或多个连接于多肽链的碳水化合物结构。更优选地,这些碳水化合物结构是连接于这些亚基的天冬氨酸残基上的。在尤其优选的实施方式中,α亚基包含两个碳水化合物结构,分别连接于Asn52和Asn78,而/或β亚基含两个碳水化合物结构,分别连接于Asn7和Asn24。携带这些碳水化合物结构的氨基酸残基以相对于根据SEQIDNO:1和2的相应α和β亚基的人类氨基酸序列的方式进行标注。人类FSH的糖部分优选地由果糖、半乳糖、甘露糖、半乳糖胺、葡萄糖胺和/或唾液酸构成。根据本发明使用的FSH优选地为重组FSH,更优选地为重组人类FSH。术语“重组FSH”指的是FSH并非由活的人类或动物体天然产生并因此获自来源于其的样品,如尿液、血液或其他体液、排泄物或人类或动物体的组织。优选地,重组FSH获自经过生物技术工程改造的细胞,特别是以编码FSH或者FSH的α或β亚基的核酸转化或转染的细胞。根据优选的实施方式,重组FSH获自包含编码FSH的外源核酸的人类细胞。相应的外源核酸可例如通过使用一种或多种表达载体而引入,其可例如经由转染而引入宿主细胞。用于重组产生蛋白质和FSH的相应方法在在先技术中已熟知,无需其他描述。根据本发明的FSH优选地为FSH,更优选地为人类FSH,可通过在人类细胞,优选地为人类细胞系中产生而获得。所述人类细胞系优选地来源于人类血细胞,特别是髓细胞系,优选地为髓性白血病细胞系。所述细胞系优选地是永生化的。在一个优选的实施方式中,用于产生根据本发明的FSH的细胞系为细胞系GT-5s(其根据布达佩斯协议于2010年7月28日以登记号DSMACC3078保藏于德意志微生物保藏中心(DeutscheSammlungvonMikroorganismenundZellkulturen(DSMZ),因霍芬大街7B,38124布伦瑞克(德国)),保藏人为GlycotopeGmbH,Robert--Str.10,13125Berlin(DE))或来源于此的细胞系,或同源细胞系。GT-5s为一种永生化人类髓性白血病细胞系,能够提供如本文所描述的特异糖基化形式。根据本发明,术语“GT-5s”和“GT-5s细胞系”还包括来源于GT-5s的细胞或细胞系。来源于GT-5s的细胞系可例如通过随机或特异性地从GT-5s培养物中选择单一克隆或一组细胞而获得,任选地在之前已经对GT-5s细胞进行了增强突变率的处理,或通过遗传改变GT-5s细胞系而获得。所选择的克隆或一组细胞可进一步如上文所述的方法进行处理和/或可进行其他的筛选轮。同源于GT-5s的细胞系特别是永生化人类髓细胞系。优选地,来源于或同源于GT-5s的细胞系能够提供的FSH具有的糖基化形式类似于获自GT-5s的形式。优选地,由来源于或同源于GT-5s的细胞系产生的FSH具有一种或多种本文所描述的糖基化特征,特别是携带N-平分型乙酰葡萄糖胺(bisGlcNAc)的聚糖的相对量为至少20%;和/或携带果糖的聚糖的相对量为至少30%;和/或2,6-偶联唾液酸的相对量为至少30%;及/或多样的糖基化形式。根据一个实施方式,来源于或同源于GT-5s的细胞系能够表达具有如本文描述的优选糖基化形式的FSH,特别是选自表1的糖基化形式。由来源于或同源于GT-5s的细胞系产生的FSH的类似的糖基化形式优选地与获自GT-5s的FSH的糖基化形式在一种或多种,优选地为所有糖基化特性上的差异为20%或更少、更优选地为15%或更少、10%或更少或5%或更少,所述糖基化特性选自bisGlcNAc的相对量、唾液酸化聚糖的相对量、硫酸化聚糖的相对量、2,6-偶联唾液酸的相对量、果糖相对量、四天线型聚糖的相对量、携带半乳糖的聚糖支链相对量及Z数。进一步地,根据本发明的FSH优选地为FSH,更优选地为人类FSH,其具有一种或多种本文公开的特异性糖基化特征,优选地具有选自表1的糖基化形式。细胞系GT-5s以及由其来源的细胞系及与其同源的细胞系尤其有优势,因为其提供了非常稳定和均一的蛋白质生产,尤其是就FSH蛋白质而言。其具有很好的批次一致性,即,从不同生产运行中获得的或以不同规模和/或用不同培养步骤所产生的蛋白质及其糖基化形式是类似的。特别地,如本文所描述的多样的糖基化形式在使用这些细胞系表达FSH的不同生产运行中是高度可复制的。根据本发明的FSH是糖基化的,即,其是由一个或多个,优选地为四个连接于多肽链的寡糖修饰的。这些寡糖,即聚糖或碳水化合物可以为线性或分支的糖链,并且优选地为复合型N-连接寡糖链。根据寡糖的分支数,称为单-、二-、三-或四天线型(或甚至五天线型)。单天线型寡糖是不分支的,而二-、三-或四天线型寡糖分别具有一个、两个或三个分支。因此具有更多天线的糖蛋白具有更多的寡糖终点并可携带更多的功能性末端糖单元,如唾液酸。如本文所使用的,“至少三天线型”指的是具有至少3个天线的寡糖,包括三天线型、四天线型和五天线型寡糖。如本文所使用的,“至少四天线型”指的是具有至少4个天线的寡糖,包括四天线型和五天线型寡糖。对于复合型N-聚糖,优选地认为平分型GlcNAc残基不是分支或天线,因此不加到FSH的天线之内。本文所指代的FSH的糖基化形式特别指的是根据本发明的FSH制备物中所有FSH蛋白质的整体糖基化形式。特别地,在糖基化形式中考虑到并反映了FSH制备物中在FSH蛋白质中包含并由此连接于FSH多肽链的任何聚糖结构。术语“唾液酸”特别指代任何神经氨酸的N-或O-置换衍生物。其可指代5-N-乙酰神经氨酸或5-N-羟乙酰神经氨酸,但优选地仅仅指代5-N-乙酰神经氨酸。唾液酸,特别是5-N-乙酰神经氨酸,优选地通过2,3-或2,6-连接与碳水化合物链相连。优选地,本文描述的FSH制备物中存在有2,3-及2,6-偶联唾液酸二者。FSH的唾液酸化程度通常以Z数表示。Z数表示糖蛋白的聚糖结构上的相对负电荷。Z数是通过以下公式计算的:Z=A1%*1+A2%*2+A3%*3+A4%*4其中A1%为带-1电荷的聚糖的百分比,A2%为带-2电荷的聚糖的百分比,A3%为带-3电荷的聚糖的百分比,而A4%为带-4电荷的聚糖的百分比。这些百分比是相对连接于FSH的所有聚糖计算的,包括带电及不带电的聚糖。聚糖的的电荷可由聚糖中包含的任何带电的单糖单元或置换物提供,尤其是由唾液酸残基和/或硫酸基团和/或磷酸基团提供。由于FSH的聚糖的电荷通常只是通过其的唾液酸残基确定而FSH通常具有四个聚糖结构,所以Z数指示了FSH上的唾液酸的量或FSH的酸性。然而,当FSH还包括显著量的硫酸聚糖时,Z数指示了唾液酸和硫酸基团的组合量。根据本发明,“聚糖的相对量”指代连接于FSH制备物或包含FSH的组合物中FSH糖蛋白的聚糖的特定百分比或百分比范围。特别地,聚糖的相对量指的是FSH蛋白质中包含并因此连接于FSH制备物或包含FSH的组合物的FSH多肽链的所有聚糖的特定百分比或百分比范围。100%的聚糖指的是分别连接于FSH制备物或包含FSH的组合物中的FSH糖蛋白的所有聚糖。例如,携带平分型GlcNAc的聚糖的相对量为60%指的是这样的FSH制备物,其中FSH蛋白质中包含并因此连接于所述FSH制备物中FSH多肽链的所有聚糖中的60%包含平分型GlcNAc残基,而FSH蛋白质中包含并因此连接于所述FSH制备物中FSH多肽链的所有聚糖中的40%不包含平分型GlcNAc残基。本文给出的数值,特别是特异糖基化特性的相对量优选地理解为近似数值。特别地,这些数值优选地可高出或低于多至10%,特别是高出或低于多至9%、8%、7%、6%、5%、4%、3%、2%或1%。“FSH制备物”可为任何包含或由FSH构成的组合物或物质。其可为固态或液态形式,可包含FSH之外的其他成分。特别地,FSH制备物可为溶液,包含FSH及合适溶剂如水和/或乙醇,或为例如含有FSH的溶液冻干后获得的粉末。FSH制备物的合适实例为在细胞中表达FSH后获得的组合物,特别是在FSH的纯化之后,或包含FSH的药用组合物。FSH制备物可在FSH之外含有例如溶剂、稀释剂、辅料、稳定剂、防腐剂、盐、佐剂和/或表面活性剂。术语“FSH制备物”在本文使用的意义特别是“包含FSH的组合物”。这些术语优选地在本文以同义词使用。“2,6-偶联唾液酸的相对量”指代为2,6-偶联唾液酸的唾液酸的总量的特定百分比或百分比范围。因此2,6-偶联唾液酸的相对量为100%意味着所有唾液酸为2,6-偶联唾液酸。例如,2,6-偶联唾液酸的相对量为60%指的是这样的FSH制备物,其中FSH蛋白质中包含并因此连接于所述FSH制备物中FSH蛋白质的寡糖链的所有唾液酸中的60%是以2,6-连接而连接,而FSH蛋白质中包含并因此连接于所述FSH制备物中FSH蛋白质的寡糖链的所有唾液酸中的40%不是以2,6-连接而连接,而是经由2,3-连接或2,8-连接而连接.术语“多样糖基化形式”特别指的是制备物或组合物中FSH蛋白质的糖基化形式,这些糖基化形式包含多种不同的聚糖结构。不同的聚糖结构为寡糖结构在至少一个寡糖单元的存在/不存在、量和/或位置及/或至少一种化学修饰例如硫酸残基、乙酰残基等等上有差异。特定的“不同聚糖结构”优选地在其相对量为糖基化形式中聚糖结构总量的至少0.02%、更优选地至少0.03%、至少0.05%、至少0.07%、至少0.1%、至少0.15%、至少0.2%、至少0.25%、至少0.3%或者至少0.5%时只以这方面考虑。多样糖基化形式特别是包含至少5种不同聚糖结构的糖基化形式。优选地,多样糖基化形式包含至少7、更优选地至少10、至少15、至少20、至少25、至少30、至少35、至少40、至少45、至少50、至少55且最优选地至少60种不同的聚糖结构。多样糖基化形式特别还指代制备物或组合物中FSH的糖基化形式,所述糖基化形式包含比在相应制备物或组合物中获自CHO细胞的的FSH更多的不同聚糖结构。特别地,糖基化形式比获自CHO细胞的FSH包含的不同聚糖结构多至少10%、优选地至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%且最优选地至少100%。术语“核酸”包括单链和双链核酸及核糖核酸,以及脱氧核糖核酸。其可包含天然发生的及合成的核苷酸,也可天然或人工修饰,例如有甲基化、5'-和/或3'-帽化。术语“载体”在本文使用的是其最通用的意义,包含核酸的任何中间媒介物,其能使得所述核酸例如引入原核及/或真核宿主细胞,并在恰当的时候整合入宿主细胞的基因组中。此种类型的载体优选地在宿主细胞中复制和/或表达。载体优选地包含一种或多种选择标记物以选择包含所述载体的宿主细胞。合适的选择标记物为抗性基因,其为宿主细胞提供例如针对特异抗生素的抗性。其他合适的选择标记物为例如酶类基因如DHFR或GS。使得重组蛋白质(包括FSH)能够表达的载体以及能够使得重组蛋白质在宿主中以高产量表达的合适的表达盒及表达元件在在线技术中已熟知,也是商业可得的,因此无需在本文进行详细描述。术语“细胞”和“多个细胞”以及“细胞系”可交换使用,优选地指代一种或多种哺乳动物细胞,特别是人类细胞。该术语包括细胞的子代或细胞群体。本领域技术人员会认识到“多个细胞”包括单一细胞的子代,而由于天然、偶然、或认为突变和/或改变的原因,子代不必(在形态或总DNA互补物上)完全相同于起始亲本细胞。“细胞”优选地指代分离的细胞核/或培养的细胞,其没有并入活的人类或动物体。术语“患者”根据本发明指的是人类、非人灵长动物或其他动物,特别是哺乳动物如奶牛、马、猪、绵羊、山羊、狗、猫或啮齿动物如小鼠和大鼠。在一个具体优选的实施方式中,患者为人类。在人类患者的情况下,FSH优选地为人类FSH。患者可以为雄性或雌性,优选地为雌性。术语“药用组合物”特别指代适合施用于人类或动物的组合物,即含有药用可接受组分的组合物。优选地,药用组合物包含活性化合物或盐或其原药,以及载体、稀释剂或药用辅料如缓冲液、防腐剂及张力调节剂。FSH的国际单位(IU)指的是人尿液FSH和LH的第四套国际标准(thefourthInternationalStandardforHumanUrinaryFSHandLH)(Storring,P.L.&GainesDas,R.E.(2001)JournalofEndocrinology171,119-129),是根据增广卵巢增重法(aaugmentedovarianweightgainmethod)确定的(Steelman,S.L.&Pohley,F.M.(1953)Endocrinology53,604-616)。根据本发明,术语“不育症治疗”指的是对人类或动物受试者生殖或能育性相关的功能不良或疾病的治疗。特别地,不育症治疗包括辅助生殖技术、排卵诱导、体外受精、宫腔内人工受精以及生殖细胞成熟如卵泡发生或精子发生的实现或改进。根据本发明,术语“其中未释放显著量的cAMP”或类似的词语特别指的是细胞或组织释放的cAMP的量占由以导致最大cAMP释放的浓度的FSH刺激后的细胞或组织获得的cAMP释放量的少于25%、优选地为少于20%、更优选地为少于15%、少于10%、少于7.5%、少于5%或少于2.5%。这些细胞或组织易感或敏感于FSH的刺激,如粒层细胞或睾丸支持细胞(Sertolicell)。不依赖于FSH的cAMP释放,即在FSH不存在时也会发生的cAMP释放不应当在这一方面考虑。优选地,“释放显著量的cAMP”或“cAMP的显著释放”是高于FSH不存在时cAMP释放的任何cAMP释放,特别是在测量的不精确度之上的任何可检测的cAMP释放。用于测量cAMP释放的标准步骤在实施例中有所描述,可用于确定显著或不显著的cAMP释放。“cAMP的释放”指的是cAMP的细胞内释放及/或cAMP的细胞外释放或分泌,优选地只指代cAMP的分泌。cAMP指代环磷酸腺苷,其在细胞信号转导中起第二信使分子的作用。cAMP是由腺苷环化酶从ATP合成的。“不依赖cAMP信号传导”的生物学过程或信号转导途径优选地不涉及腺苷环化酶的活化。“性类固醇”,也称为性腺类固醇或性激素,特别指代与脊椎动物的雄激素和雌激素受体相互作用的类固醇激素。术语“性类固醇”包括雄性激素如合成代谢类固醇、雄烯二酮、脱氢表雄酮、二氢睾丸酮和睾丸酮;雌激素如雌二醇、雌三醇和雌素酮;以及黄体酮。优选地,性类固醇指代天然发生的性类固醇,更优选地指代天然人类性类固醇。根据本发明的优选的性类固醇为雌二醇和黄体酮,尤其是黄体酮。本发明根据一个方面基于的是一项发现,具有优化糖基化形式的改进的重组FSH制备物能够在低的不诱导显著cAMP释放的FSH浓度下诱导性类固醇如黄体酮的分泌。特别地,在此特定方面,根据本发明的改进的FSH在比通常所用的尿液FSH或获自CHO细胞的重组FSH低很多的浓度下诱导性类固醇分泌。因此,改进的FSH可以低很多的剂量施用,这减少了副作用的风险,并进一步降低了生产成本。进一步地,如果以可比的剂量施用,在此实施方式中改进的FSH比通常使用的FSH在患者体内提供更长久的活性,因为在施用一段很长的时间后只有很低浓度的FSH留存在循环系统中,但是根据本发明的这个实施方式的FSH仍然发挥其生物学活性并优选地刺激或共刺激生殖细胞成熟和/或释放性类固醇。此外,在高浓度下,根据本发明的改进的FSH以及通常使用的尿液或来源于CHO的FSH显示出可比的效应。因此,相比于通常使用的FSH,剂量过大没有其他风险。进一步地,本发明者已经在猕猴中证明根据本发明的改进FSH与通常使用的尿液或来源于CHO的FSH相比具有类似甚至较高的药学效应。这一点尤其意外,因为根据本发明的FSH在大鼠和猴中显示了比获自尿液或CHO细胞的常用FSH制备物更低的最大血清浓度(Cmax)及循环半衰期。虽然改进的FSH的生物可及性较低,但却具有类似或更高的药学效应,因此可以推论根据本发明的改进的FSH具有比尿液或CHO来源的FSH更高的特异性治疗活性。根据所获得的临床数据,根据本发明的改进的FSH在人类中比常用FSH制备物有显著更高的Cmax;然而,改进的FSH的循环半衰期稍低却也是可比的。最意外的是,根据本发明的改进FSH制备物甚至在只施用了单次剂量之后都在人类中显示出治疗效应,特别是卵泡生长的效应。相反,以单次剂量施用常用FSH制备物后未观察到任何效应。因此,预期的是以所述改进的FSH可对患者进行更精确的治疗。特别地,有可能使用确切定时、定量的剂量治疗并改进患者的不育症,也可能不需要长期的连续治疗。因此,也减少了多胎妊娠的风险。总之,根据本发明的改进的FSH制备物更加有效。因此,可对患者施用较小的剂量,这引起更少的副作用,对患者更加方便也花费更少。进一步地,用改进的FSH可设计更特异和详细的剂量方案。进一步地,减少的半衰期可减少不期望的副作用并进一步使得治疗终止后FSH能更快从人体移除。不受此理论的约束,本发明的发明人推论根据本发明的FSH制备物的更高的特异性治疗活性是基于改进的糖基化形式。特别地,高量的平分型GlcNAc残基和/或高量的2,6-偶联唾液酸以及高量的硫酸化聚糖可产生高的活性。进一步地,根据本发明的FSH制备物还显示了更多样复杂的糖基化形式,意味着相比于例如来源于CHO细胞的常规FSH制备物,所述制备物中存在更多不同的聚糖结构。据相信,CHO来源的FSH只能在靶标细胞中激活单一的通路,而根据本发明的改进的FSH由于其由独特的糖基化形式,显然是经由多种不同通路发挥其生物学活性,产生增加的生物学应答。如本文实验数据所示,这些途径中有一些涉及cAMP信号传导,而其他的新型通路是不依赖于cAMP的。鉴于这些发现,本发明在第一个方面提供了FSH制备物,其中制备物中的FSH具有的糖基化形式包含一种或多种以下特征:(i)携带平分型N-乙酰葡萄糖胺(bisGlcNAc)的聚糖的相对量为至少20%;(ii)携带果糖的聚糖的相对量为至少30%;和/或(iii)2,6-偶联唾液酸的相对量为至少30%;和/或(iv)其为多样的糖基化形式。在特定实施方式中,本发明提供了FSH制备物,其中制备物中的FSH具有的糖基化形式包含一种或多种以下特征:(i)携带平分型N-乙酰葡萄糖胺(bisGlcNAc)的聚糖的相对量为至少35%;(ii)携带果糖的聚糖的相对量为至少60%;和/或(iii)2,6-偶联唾液酸的相对量为至少30%;优选地,所述FSH为重组FSH,因此其可通过宿主细胞中的重组生产而获得,后者优选地为人类宿主细胞。合适的提供相应糖基化形式的人宿主细胞随后有描述。优选地,所述糖基化形式包含特征(i)、(ii)和(iii)的至少两种(特别是特征(i)和(ii)、(i)和(iii)、或(ii)和(iii)),更优选地包含全部特征(i)、(ii)和(iii)。进一步地,所述糖基化形式可进一步包含至少四天线型的聚糖,其相对量为至少15%,和/或携带一个或多个唾液酸残基的聚糖,其相对量为至少80%,和/或携带半乳糖的聚糖,其相对量为至少95%,和/或携带末端半乳糖单元的聚糖分支,其相对量为至少60%,和/或携带硫酸基团聚糖,其相对量为至少1%,优选地为至少2.5%。所述末端半乳糖单元任选地进一步携带唾液酸残基。所述组合物中的重组FSH优选地具有Z数为至少200。携带bisGlcNAc的聚糖的相对量优选地为至少25%、至少27%、至少30%、至少35%、至少38%或至少40%。更优选地,其的范围为大约25%-大约60%,特别是大约35%-大约60%的范围或大约38%-大约50%的范围,或大约40%-大约45%的范围。根据一个实施方式,为大约42%。携带一个或多个唾液酸残基的聚糖的相对量优选地为至少83%、至少85%或至少88%,更优选地为大约85%-大约98%的范围或大约88%-大约95%的范围,最优选地为大约90%。Z数优选地为至少210、更优选地至少215、至少220、至少230或至少240。较高的Z数可例如通过在FSH制备物中富集酸性和/或负电FSH蛋白质而获得。优选地,至少四天线型聚糖的相对量为至少16%、至少17%、至少18%或至少19%、更优选地至少20%或至少21%。至少三天线型聚糖,特别是三-和四天线型聚糖的相对量优选地为至少25%、至少30%、至少35%或至少40%、更优选地至少45%、至少50%或至少55%。优选地,携带果糖的聚糖的相对量为至少35%、至少40%、至少50%、至少60%或至少70%、更优选地至少75%或至少78%。其可为大约70%-大约90%的范围,特别是大约75%-大约85%的范围。优选地,2,6-偶联的唾液酸的相对量为至少40%、至少45%、至少50%、至少53%、至少55%、至少60%或至少65%,特别是大约40%-大约99%的范围,优选地为大约40%-大约80%、大约50%-大约60%或大约53%-大约70%的范围。优选地,2,3-偶联唾液酸对2,6-偶联唾液酸的比率范围为大约1:10-大约7:3,更优选地为大约1:5-大约3:2或大约1:2-大约1:1,最优选地为大约2:3-大约1:1。在优选的实施方式中,2,6-偶联唾液酸的相对量超过2,3-偶联唾液酸的量。携带半乳糖的聚糖的相对量优选地为至少97%,最优选地为大约98%。优选地,携带半乳糖单元(任选地由唾液酸残基修饰)的聚糖分支的相对量为至少65%、更优选地至少70%或至少73%。其优选地范围为大约60%-大约95%,更优选地范围为大约70%-大约80%。优选地,携带硫酸基团的聚糖(硫酸聚糖)的相对量为至少1%、至少1.5%、至少2%、至少2.5%、至少3%或至少5%、更优选地至少7%、至少10%或至少12%。根据一个实施方式,携带硫酸基团的聚糖的相对量不超过50%,优选地不超过40%、35%、30%、25%或20%。在优选的实施方式中,制备物中的FSH具有多样糖基化形式,其中制备物中FSH包含至少45或优选地至少50种不同的聚糖结构,其中每种不同的聚糖结构具有制备物中FSH的聚糖结构总量的相对量为至少0.05%。根据一个实施方式,制备物中FSH包含至少35或优选地至少40种不同的聚糖结构,其中每种不同的聚糖结构具有制备物中FSH的聚糖结构总量的相对量为至少0.1%;和/或制备物中FSH包含至少20或优选地至少25中不同的聚糖结构,其中每种不同的聚糖结构具有制备物中FSH的聚糖结构总量的相对量为至少0.5%。在一个进一步的实施方式中,制备物中的FSH比相应制备物中获自CHO细胞的FSH包含的不同聚糖结构多至少40%,优选地至少50%,其中每种不同的聚糖结构具有相应制备物中FSH的聚糖结构总量的相对量为至少0.05%、0.1%或0.5%。在优选的实施方式中,根据本发明的重组FSH制备物不包含N-羟乙酰神经氨酸(NeuGc)或可检测量的NeuGc。进一步地,根据本发明的重组FSH制备物优选地还不含有Galili表位(Galα1,3-Gal结构)或可检测量的Galili表位。本发明特别提供了具有人类糖基化形式的FSH。由于这些糖基化特性,不存在诱导副作用的外源免疫原性非人结构,这意味着避免了已知由特定外源糖结构如免疫原性非人唾液酸(NeuGc)或Galili表位(Gal-Gal结构)(所述二者对于啮齿动物生产系统也是已知的)或其他结构如已知来自酵母系统的免疫原性高甘露糖结构引起的不期望的副作用或不利之处。在特定实施方式中,根据本发明的制备物中重组FSH的糖基化形式包含一种或多种,优选地包括全部的以下特征:(i)携带平分型N-乙酰葡萄糖胺(bisGlcNAc)的聚糖的相对量范围为大约25%-大约50%;(ii)携带果糖的聚糖的相对量为至少35%;(iii)2,6-偶联唾液酸的相对量为至少53%;(iv)携带一个或多个唾液酸的聚糖的相对量为至少88%;以及(v)至少四天线型聚糖的相对量为至少16%.在特定的优选实施方式中,根据本发明的重组FSH制备物具有下文表1中列出的糖基化形式之一:表1:特异糖基化参数所显示是的是具有以下特性的聚糖的相对量:B:平分型GlcNAc;2,6-S:2,6-偶联唾液酸;硫酸化:硫酸聚糖;S>0:至少一个唾液酸;Z:Z数;四天线型:至少四天线型的聚糖在表1中列出的实施方式1-12中,优选地,平分型GlcNAc的相对量为至少25%而不是至少20%;和/或2,6-偶联唾液酸的相对量优选地为至少55%、更优选地至少60%,而不是至少53%;和/或硫酸聚糖的相对量为至少3%、更优选地至少10%,而不是至少2.5%。表1中列出的糖基化形式优选地为人类糖基化形式和/或不好喊NeuGc和Galili表位。进一步地,本发明提供重组的FSH制备物,其可通过在人类宿主细胞或人类细胞系中生产而获得。优选地,所述重组FSH可获自人髓细胞系,优选地为永生化人髓性白血病细胞系,特别是细胞系GT-5s或来源于其的细胞系或同源于GT-5s的细胞系。据发现,在所述细胞系中产生的FSH显示有如上文所描述的糖基化形式,特别显示了本文描述的有利的治疗和药学效应。因此,本发明还涉及通过在合适的细胞系中重组表达FSH生产重组FSH制备物的方法,特别是如上文描述的细胞系,特别是细胞系GT-5s、来源于GT-5s的细胞系或同源于GT-5s的细胞系。相应产生的重组FSH可进行分离及任选地进行纯化。因此,重组FSH制备物优选地可通过包括以下步骤的方法获得:(i)在适合表达FSH的条件下培养人类宿主细胞,优选地是来源于细胞系GT-5s的细胞系或同源细胞系,其包含编码FSHα和β亚基的核酸;以及(ii)分离FSH。用于表达的人类宿主细胞优选地为髓细胞,特别是永生化的髓性白血病细胞,优选地为或来源于细胞系GT-5s或是与其同源的细胞系。培养这些人类宿主细胞以便其表达FSH。合适的培养条件对技术人员是已知的。对FSH的分离优选地包括以下进一步的步骤:(a)在人类细胞分泌FSH时获得培养物上清,或在FSH不分泌时裂解人类细胞;(b)使用色谱步骤如反相色谱、体积排阻色谱和/或疏水作用色谱从培养物上清或细胞裂解物中分离FSH;以及(c)任选地通过移除碱性FSH异构体获得FSH的酸性级分,优选地通过使用阴离子交换色谱,包括移除碱性FSH异构体的洗涤步骤,如在大约pH5.0或大约pH4.5或大约pH4.0下的洗涤步骤。优选地,编码FSHα亚基的核酸及编码FSHβ亚基的核酸包含在表达盒中的,后者包含在能在人类宿主细胞中表达的合适的表达载体。编码FSHα亚基的核酸及编码FSHβ亚基的核酸可包含在相同的载体中,但优选地是包含在分离的载体中的。进一步地,使用恰当的元件如IRES元件可将其在一个表达盒中表达。优选地,FSH是由人类细胞分泌的。在优选的实施方式中,对人类细胞的培养是在发酵罐和/或在无血清条件下进行的。用于重组FSH的合适的纯化方法在美国专利申请号US61/263,931、欧洲专利申请号EP09014585.5及PCT专利申请号WO2011/063943中有所描述。可通过在人类宿主细胞或人类细胞系中生产而获得的重组FSH制备物优选地显示出本文描述的、根据本发明的重组FSH制备物相关的特征。特别是,其糖基化形式包含一种或多种上文描述的特征,优选地为至少一种如表1和/或权利要求1-6中描述的糖基化形式。在本发明的方面的优选的实施方式中,根据本发明的重组FSH为重组人FSH(rhFSH),优选地可通过在人类细胞系如细胞系GT-5s中生产而获得,所述细胞系包含一种或多种编码人FSH亚基的核酸及用于在宿主细胞中表达所述一种或多种核酸的元件。优选地,rhFSH的α亚基具有根据SEQIDNO:1的氨基酸序列或在其整个长度上与SEQIDNO:1具有同源性或优选地同一性为至少80%、优选地至少85%、至少90%、至少95%或至少98%的氨基酸序列。在优选的实施方式中,rhFSH的α亚基包含52和78号位的天冬氨酸残基,并在氨基酸Asn52和Asn78处被糖基化。优选地,rhFSH的β亚基具有根据SEQIDNO:2的氨基酸序列或与SEQIDNO:2在其整个长度上具有同源性或优选地同一性为至少80%、优选地至少85%、至少90%、至少95%或至少98%的氨基酸序列。在优选的实施方式中,rhFSH的β亚基包含7和24号位的天冬氨酸残基,并在氨基酸Asn7和Asn24处被糖基化。根据一个实施方式,根据本发明的重组FSH制备物能够(a)在不释放显著量的cAMP的浓度下;及/或(b)通过诱导不依赖于cAMP信号传导的信号转导通路刺激粒层细胞中的黄体酮释放。根据一个实施方式,根据本发明的重组FSH制备物能够通过不依赖于cAMP信号传导的生物学过程刺激或共刺激生殖细胞成熟。惊人地,在实验中发现上文描述的糖基化形式导致重组FSH的相应的新型药学谱,其显示了本文描述的药学和治疗优势。根据本发明的重组FSH制备物可能具有一种或多种随后描述的特征,可在粒层细胞测定中确定(例如在实施例2中描述的)。如这些实施例表明的,具有上文描述的糖基化形式的重组FSH,特别是可通过在细胞系GT-5s中生产而获得的重组FSH显示出随后描述的特征,而引起本文描述的药学和治疗性优势。所述FSH制备物根据一个实施方式能够以低于诱导粒层细胞释放cAMP所需的最小浓度的浓度刺激粒层细胞释放黄体酮。下文提到的黄体酮、雌二醇和/或cAMP的释放指代在大约1*104-大约1*106粒层细胞/ml,优选地在大约5*104-大约1*105粒层细胞/ml中的体外释放,特别是在下文实施例2中描述的条件下的释放。优选地,根据本发明的重组FSH制备物能够以不诱导cAMP释放或诱导cAMP释放少于20pmol/ml、少于15pmol/ml、少于10pmol/ml、少于5pmol/ml的浓度释放至少100ng/ml、至少150ng/ml、至少200ng/ml、优选地至少250ng/ml、至少300ng/ml或至少400ng/ml黄体酮。进一步地,根据本发明的重组FSH制备物优选地能够以低于人尿液FSH或产生于CHO细胞(GonalF)的重组FSH所需浓度的FSH浓度释放至少100ng/ml、至少200ng/ml、优选地至少300ng/ml或至少400ng/ml的黄体酮。其优选地能够以特定浓度释放至少100ng/ml、至少200ng/ml、优选地至少300ng/ml或至少400ng/ml的黄体酮,在此浓度下人尿液FSH或产生于CHO细胞(GonalF)的重组FSH不会引起黄体酮的对应等同的高释放。如实施例所表明的,根据本发明的重组FSH比人尿液FSH或产生于CHO细胞(GonalF)的重组FSH更强地诱导并刺激黄体酮的产生。进一步地,根据本发明的重组FSH制备物优选地能够以不诱导cAMP释放或诱导cAMP释放少于20pmol/ml、少于15pmol/ml、少于10pmol/ml、少于5pmol/ml的FSH浓度释放至少50nmol/l、至少75nmol/l、至少100nmol/l、至少125nmol/l或至少150nmol/l的雌二醇。进一步地,根据本发明的重组FSH制备物优选地能够以低于人尿液FSH或产生于CHO细胞(GonalF)的重组FSH所需浓度的FSH浓度释放至少50nmol/l、至少75nmol/l、至少100nmol/l、至少125nmol/l、至少150nmol/l、至少200nmol/l、至少250nmol/l、至少300nmol/l或至少350nmol/l的雌二醇。因此,其优选地能够以特定浓度释放至少50nmol/l、至少75nmol/l、至少100nmol/l、至少125nmol/l、至少150nmol/l、至少200nmol/l、至少250nmol/l、300nmol/l或至少350nmol/l的雌二醇,在此浓度下人尿液FSH或产生于CHO细胞(GonalF)的重组FSH不会引起雌二醇的对应等同的高释放。如实施例所证明的,根据本发明的重组FSH制备物比人尿液FSH或产生于CHO细胞(GonalF)的重组FSH更强地诱导并刺激雌二醇的产生。本文描述的cAMP释放和性类固醇表达的相应特征可使用粒层细胞测定进行分析和确定,例如如实施例2中所描述的。根据本发明的重组FSH制备物优选地存在于药用组合物中。因此,本发明的另一方面为包含根据本发明的重组FSH制备物的药用组合物,其用于治疗如本文限定的不育症。所述药用组合物可包括其他的药用活性试剂,特别是可用于不育症的治疗的其他试剂如其他促性腺激素,特别是LH和/或CG,优选地为重组的和/或人类LH或CG。备选地,包含重组FSH的药用组合物可设计为与这样的其他药用活性试剂组合使用。进一步地,本发明提供了根据本发明的重组FSH制备物或根据本发明的药用组合物,其用于不育症的治疗,以及用于治疗不育症的方法,包括对患者施用根据本发明的重组FSH制备物根据本发明的药用组合物。如上文所讨论的,在特定实施方式中,根据本发明的重组FSH制备物在不释放显著量的cAMP的浓度下已经能够刺激或共刺激性类固醇如黄体酮的释放,特别是粒层细胞中黄体酮的释放。特别是,根据本发明的重组FSH能够在低于诱导粒层细胞释放cAMP所需的最小浓度的浓度下刺激粒层细胞中性类固醇如黄体酮的释放。进一步地,在特定实施方式中,根据本发明的重组FSH制备物能够通过诱导不依赖cAMP信号传导的信号转导通路刺激黄体酮的释放,特别是粒层细胞中黄体酮的释放。优选地,不育症的治疗包括用根据本发明的重组FSH制备物能够诱导不依赖cAMP信号传导的信号转导通路,导致黄体酮的释放的刺激。然而,其他包括cAMP信号传导的信号转导通路还可由所述重组FSH激活。在其他实施方式中,不育症的治疗不涉及根据本发明的重组FSH制备物对cAMP显著释放的诱导。在其他实施方式中,如上文所述,根据本发明的重组FSH制备物能够通过不依赖cAMP信号传导的生物学过程刺激或共刺激生殖细胞的成熟。因此,本发明还涉及上文描述的重组FSH制备物或药用组合物,用于诱导和/或刺激也不依赖于cAMP对的性类固醇的分泌。进一步地,本发明还涉及上文描述的重组FSH制备物或药用组合物,用于通过不依赖cAMP信号传导的生物学过程刺激或共刺激生殖细胞的成熟。此外,本发明还涉及上文描述的重组FSH制备物或药用组合物,用于以不诱导显著cAMP释放的FSH浓度诱导和/或刺激性类固醇的分泌。进一步地,本发明还涉及上文描述的重组FSH制备物或药用组合物,用于以比通常使用的尿液FSH或获自CHO细胞的重组FSH低得多的FSH浓度诱导性类固醇的分泌。相应用途,特别是用于治疗不育症的用途的药学和治疗性优势在上文有详细讨论。特别地,不育症的治疗可包括通过不依赖cAMP信号传导的生物学过程刺激或共刺激生殖细胞的成熟。然而,不育症的治疗可另外包含通过一种或多种涉及cAMP信号的其他生物学过程刺激生殖细胞成熟。在其他实施方式中,不育症的治疗不涉及通过这样的其他生物学过程刺激生殖细胞成熟。生殖细胞的成熟优选地包括卵泡生长和/或精子发生。进一步地,FSH刺激生殖细胞成熟的生物学过程可包括性类固醇,特别是黄体酮的分泌,优选地是由粒层细胞分泌的。优选地,不依赖于cAMP信号传导的生物学过程指代性类固醇特别是黄体酮的分泌,优选地是由粒层细胞分泌的,这是由不涉及cAMP作为信使分子的信号转导通路诱导的。在优选的实施方式中,根据本发明的重组FSH制备物能够甚至在只施用单次剂量后发挥生物学效应。特别地,在只施用单次剂量的所述FSH制备物或药用组合物后,根据本发明的FSH制备物或根据本发明的药用组合物能够在患者,特别在人患者中诱导卵泡生长和/或卵子成熟。优选的,与获自人尿液和/或表达于CHO细胞中的FSH制备物相比,在只施用单次剂量后达到的生物学效应更高,特别是卵泡生长和/或卵子成熟更显著及/或在更高比率的经治疗的患者中达到。所述单次剂量特别包括至少10IUFSH、优选地至少15IUFSH、至少20IUFSH或至少25IUFSH,及/或1000IUFSH或更少、优选地为750IUFSH或更少、500IUFSH或更少、300IUFSH或更少、200IUFSH或更少、150IUFSH或更少、100IUFSH或更少或50IUFSH或更少。优选地,所述单次剂量包含大约10IU-大约500IUFSH,更优选地大约20IU-大约300IUFSH,或例如大约25IUFSH、大约75IUFSH或大约100IUFSH。在进一步的实施方式中,根据本发明的重组FSH比获自人尿液和/或表达于CHO细胞中的FSH制备物具有较短的循环半衰期。特别地,其在人、食蟹猴、大鼠和/或小鼠中的一种或多种中有更短的循环半衰期。优选地,循环半衰期比获自人尿液和/或表达于CHO细胞中的FSH制备物低至少5%、更优选地至少10%、至少15%或低至少20%。在特定实施方式中,根据本发明的重组FSH制备物比获自人尿液和/或表达于CHO细胞中的FSH制备物具有更低的生物利用率,特别地,是在人、食蟹猴、大鼠和/或小鼠中的一种或多种中。优选地,生物利用率比获自人尿液和/或表达于CHO细胞中的FSH制备物低至少5%、更优选地至少10%、至少15%或低至少20%。在此方面的生物利用率优选地指代在药效动力学研究中获得的曲线下面积(AUC)值,其中在施用限定量的FSH后不同时间点测定血清FSH浓度。优选地,循环半衰期和生物利用率是在通过皮下注射施用FSH后确定的,特别是在单次剂量施用后确定,其中所述的单次剂量优选地包含大约10-大约1000IUFSH、更优选地为25IU-大约500IUFSH或大约50IU-大约300IUFSH,特别是100IUFSH。特别地,循环半衰期和生物利用率是如下文实施例6中公开的方式确定的。在优选的实施方式中,根据本发明的重组FSH制备物具有与获自人尿液和/或表达于CHO细胞中的FSH制备物类似或甚至更高的治疗效力,特别是在是在人、食蟹猴、大鼠和/或小鼠中的一种或多种中。术语“治疗效力”优选地指代在施用于患者时刺激雌二醇和/或抑制素B的释放的能力。治疗效力优选地是在通过皮下注射施用FSH后测量一个或多个患者血液或血清中的雌二醇和/或抑制素B的浓度确定的,特别是在单次剂量施用后,其中单次剂量优选地包含大约10-大约1000IUFSH、优选地大约25IU-大约500IUFSH或大约50IU-大约300IUFSH,特别是大约100IUFSH。特别地,治疗效力是如下文实施例5中公开的方式确定的。类似的治疗效力特别指的是相应的FSH制备物对雌二醇和/或抑制素B释放的刺激,这样产生的雌二醇和/或抑制素B的血清浓度相互之间差异不超过25%、优选地不超过20%、不超过15%或不超过10%。获自人尿液的FSH制备物特别获自绝经期后女性的尿液。表达于CHO细胞中的FSH制备物为例如表达于CHO细胞系CHOdhfr-[ATCC号CRL-9096]。获自人尿液的FSH制备物及表达于CHO细胞中的FSH制备物优选地为商业可得并得到许可的药用制备物,特别分别为Bravelle和Gonal-f。在比较不同FSH制备物的效应特别在比较其循环半衰期、生物利用率及治疗效力时,通过以相同的剂量方案使用相同的施用途径并使用类似或相同的其他条件将FSH制备物施用于类似的患者组而分析所述制备物。在特定实施方式中,以导致患者循环系统中的FSH浓度低于5IU/L的剂量将根据本发明的重组FSH制备物施用于患者。在特定实施方式中,要施用于患者的剂量导致患者循环系统中的FSH浓度为低于大约4IU/L、特别是低于3IU/L、低于大约2IU/L、低于大约1IU/L或低于大约0.5IU/L。患者循环系统中的FSH浓度例如在大约.0.01-大约5IU/L的范围,特别是大约0.05-大约2IU/L、大约0.1-大约1.5IU/L或大约0.2-大约1IU/L。特别地,FSH是以不诱导cAMP显著释放的剂量施用于患者的。如实施例中所表明的,根据本发明的重组FSH制备物在特定实施方式中在这些浓度下发挥治疗效应。然而,根据本发明的重组FSH制备物也可以在患者循环系统中产生更高FSH浓度的剂量施用。在优选的实施方式中,不育症的治疗包括辅助生殖技术、诱导排卵、体外受精例如通过胞质内精子注射进行的体外受精、配子输卵管内转移、子宫内受精、女性的无卵障碍的治疗、女性卵子成熟的严重激素缺陷的治疗、男性的精子产生缺陷的治疗及/或生殖细胞成熟如卵泡发生和精子发生的实现或改进,尤其是例如在体外受精刺激操作流程中和/或进行无卵障碍治疗时实现或改进女性卵泡成熟。优选地,根据本发明的重组FSH制备物用于对患者的肠道外施用。特别地,重组FSH是通过例如静脉内、肌内或皮下进行注射或灌注施用的。在本发明的特定实施方式中,重组FSH存在于药用组合物中。合适的剂量方案可由本领域技术人员确定,也可来源于本领域的一般知识。根据本发明的药用组合物可为单剂量单位或多剂量单位形式。优选地,所述药用组合物为包含根据本发明的重组FSH的无菌溶液,其进一步包含一种或多种选自以下的成分:溶剂如水、缓冲物质、稳定剂、防腐剂、辅料、表面活性剂和盐类。单次剂量单位优选地包含大约10IU-大约750IUFSH、更优选地为大约25IU-大约500IUFSH、大约50IU-大约400IUFSH或大约100IU-大约300IUFSH。多剂量单位包含足以提供多次单次剂量的FSH,特别是5、至少10、至少20或至少50次的单次剂量。所述药用组合物可为例如注射笔的形式。附图说明图1显示了以不同浓度的改进的重组人FSH(FSH(本发明);制备物1:空心方块、制备物2:实心三角)或获自CHO细胞的FSH(GonalF;实心菱形)刺激的分离的粒层细胞的cAMP释放。图2显示了以不同浓度的改进的重组人FSH(FSH(本发明);制备物1:空心方块、制备物2:实心三角)或获自CHO细胞的FSH(GonalF;实心菱形)刺激的分离的粒层细胞的雌二醇合成情况。图3显示了以不同浓度的改进的重组人FSH(FSH(本发明);制备物1:空心方块、制备物2:实心三角)或获自CHO细胞的FSH(GonalF;实心菱形)刺激的分离的粒层细胞的黄体酮合成情况。图4显示了以不同浓度的改进的重组人FSH(FSH(本发明);空心方块)或尿液FSH(Fostimon;实心菱形)刺激的分离的粒层细胞的cAMP释放。图5显示了以不同浓度的改进的重组人FSH(FSH(本发明);空心方块)或尿液FSH(Fostimon;实心菱形)刺激的分离的粒层细胞的雌二醇合成情况。图6显示了以不同浓度的改进的重组人FSH(FSH(本发明);空心方块)或尿液FSH(Fostimon;实心菱形)刺激的分离的粒层细胞的黄体酮合成情况。图7显示了使用改进的重组人FSH对比表中尿液FSH及获自CHO细胞的标准重组FSH进行的Steelman-Pohley测定结果。将不成熟的雌性大鼠在进行三天的每日施用后的卵巢增重对所使用的FSH浓度作图。图8显示了单次(A)及重复(B)皮下注射FSH(本发明)、尿液FSHBravelle或表达于CHO细胞中的重组FSHGonal-f后,食蟹猴中观察到的雌二醇(E2)和抑制素B的血清浓度。每条棒代表4只动物的平均值和标准偏差。图9显示了单次静脉内或皮下注射后,雌性食蟹猴中的血清FSH浓度。每种符号代表一组4只动物的平均值。图10显示了可连接于FSH糖基化位点的复杂型聚糖结构的示意图。显示了(a)双天线型、(b)三天线型和(c)四天线型结构。这些结构中还可不存在唾液酸及半乳糖残基,且所述结构可进一步包含例如平分型GlcNAc残基、果糖残基及/或硫酸基团。Sia:唾液酸;Gal:半乳糖,本文也称之为末端半乳糖;GlcNAc:N-乙酰葡萄糖胺;Man:甘露糖。具体实施方式实施例1:FSH(本发明)的制备通过培养GT-5s细胞生产FSH,所述细胞稳定转染有两种表达构建体,具有人FSH的α和β链(α链登记号NT_007299.13;β链登记号NT_009237.18)。用于表达FSHα链的质粒携带有突变形式的小鼠二氢叶酸还原酶(dhfr)的基因,该突变形式对该酶的抑制剂甲氨蝶呤比原生形式有更高的抗性;用于表达FSHα链的第二种质粒携带嘌呤霉素抗性基因。用于FSH(本发明)表达的细胞系转染是通过使用上文描述的两种表达质粒进行细胞核转染而进行。为选择及扩增稳定产生抗体的细胞克隆,以逐渐增加的浓度添加嘌呤霉素和甲氨蝶呤。将扩增的细胞群接种到半固体基质上用于使用ClonePixFL技术进行单细胞克隆或通过有限稀释法进行单细胞克隆。筛选能够高度分泌完整的FSH分子的克隆。FSH是在无血清条件下以分批、补料分批或灌注过程发酵生产FSH的GT-5s克隆而生产。发酵通常进行2-3周。在发酵后,将上清滤过2μm滤膜以清除细胞及细胞碎片,随后使用0.2μm滤膜进行灭菌过滤步骤。该纯化过程使用了反相色谱(RPC)进行捕获步骤,随后进行浓缩步骤及其后的尺寸排阻色谱(SEC)。任选地,然后将洗脱物加至阴离子交换色谱(AEC)以清除酸性较低的FSH内容物。这是通过用pH5.0("在pH5.0下富集")或pH4.5("在pH4.5下富集")的洗涤缓冲液洗涤结合的FSH而完成的,以在洗脱所需的FSH部分前洗脱酸性较低的FSH异构体。使用疏水相互作用色谱(HIC)作为精纯步骤获得高纯度的FSH。实施例2:粒层细胞测定为进行粒层细胞测定,在收集卵细胞的过程中从IVF患者的卵泡液中分离原代细胞。使用Ficoll梯度离心法清除了其他细胞类型如血红细胞后,将粒层细胞接种于24-96孔板在含有雄烯二酮或睾丸酮的培养基中培养5-7天。在此阶段后,用1pg/ml-2μg/ml范围内的FSH在图中所示步骤(400μl/孔)中刺激细胞(2-4*104细胞/孔)。在孵育后三至四小时后,收集一半上清进行cAMP测定。再过24h后将细胞于剩余的上清中进行冻融而裂解。将裂解物用于黄体酮和雌二醇测定。FSH(本发明)与GonalF的比较在第一组实验中,将FSH(本发明)与GonalF(MerckSeronoSA)进行比较。GonalF是重组产生于CHO细胞的FSH。结果显示于图1-3。尽管在可比FSH浓度的GonalF和FSH(本发明)产品下产生的第二信使cAMP的量也是可比的,但是在FSH(本发明)产品的情况下相比于重组产生于CHO细胞的FSH(GonalF)在低很多的FSH浓度下就释放出类固醇黄体酮和雌二醇。FSH(本发明)与Fostimon的比较在另一组实验中,将FSH(本发明)对Fostimon(IBSAInstitutBiochimiqueSA,分离自人尿液的FSH产品)进行比较。结果显示于图4-6。虽然在两种制品FSH剂量范围可比时的cAMP水平升高情况类似,但是相比于Fostimon,在显著较低浓度的FSH(本发明)下就能产生性类固醇。注意:由于这些测定是使用不同供体进行的,因此刺激形式的差异可能归因于每个测定中使用的供体。实施例3:Steelman-Pohley测定FSH的活性还通过Steelman-Pohley测定法而确定。该测定是根据药典进行的。特别地,在施用三种不同FSH浓度,每种每日施用,施用三天后,测量不成熟雌性大鼠的卵巢增重。使用平行线评估计算效力。结果显示于图7。表2:与尿液FSH比较后计算的FSH(本发明)的活性样品计算所得活性未富集的FSH(本发明)6,271IU/mg在pH4.5下富集的FSH(本发明)7,663IU/mg尿液标准品的活性:7,135IU/mg如Steelman-Pohley测定所表明的,FSH(本发明)及尿液和重组的标准品FSH的体内活性在大鼠中是类似的。实施例4:糖化谱不同FSH制备物的糖化谱是由糖基化的结构分析确定的。糖化谱生成了关于糖基化位点的复杂聚糖结构的信息。为测定糖化谱,使用PNG酶F从蛋白质核心释放出完整的N-聚糖。消化是在凝胶或凝胶块中对明确的组别进行的。游离的N-聚糖由荧光标记物2-氨基苯甲酰胺标记。纯化的N-聚糖样品是通过疏水相互作用色谱(HILIC)结合荧光光度计检测的方式分离的。该分析给出以下结果:表3:不同糖基化特性的相对量样品FSGBFSH(本发明)80%90%98%42%Fostimon48%83%91%28%Puregon129%91%91%0%F:果糖;S:唾液酸;G:半乳糖;B:平分型N-乙酰半乳糖胺1:文献值(K.等人(1990)EuropeanJournalofBiochemistry193,263-271)显示的是携带所示单元的FSH上的N-聚糖的相对量。Puregon为另一种产生于CHO细胞的重组人FSH。进一步地,通过比较唾液酸酶A(裂解2,3-及2,6-偶联唾液酸)及唾液酸酶S(只裂解2,3-偶联唾液酸)释放的唾液酸的量分析FSH的聚糖中2,3-偶联及2,6-偶联唾液酸的比率。表4:唾液酸连接的相对量样品2,3-连接唾液酸2,6-连接唾液酸FSH(本发明)43%57%Bravelle75%25%GonalF/Puregon100%0%在FSH(本发明)中,唾液酸残基通过2,3-及2,6-键以大约1:1的比率偶联于聚糖上,甚至包含的2,6-偶联唾液酸比2,3-偶联唾液酸更多,而在尿液FSHBravelle(FerringPharmaceuticalsInc.)中,比率为大约3:1,2,3-连接唾液酸更多。由于Puregon(Organon/EssexPharma)和GonalF(MerckSerono)是在CHO细胞中重组产生的,所以其不具有任何平分型N-乙酰半乳糖胺,只包含2,3-偶联唾液酸。从以上的测定并通过确定聚糖从FSH上释放后的电荷分布而计算天线型、末端半乳糖单位及Z数。表5:不同FSH的糖基化天线型样品二型三型四型FSH(本发明)42%35%22%Fostimon39%45%16%GonalF1~65%~25%~10%Puregon253%26%12%二型:双天线型N-聚糖;三型:三天线型N-聚糖;四型:四天线型N-聚糖1:文献值(Gervais,A.等人(2003)Glycobiology13(3),179-189)2:文献值(K.等人(1990)EuropeanJournalofBiochemistry193,263-271)显示的是FSH上双-、三、及四天线型N-聚糖的相对量。表6:末端半乳糖单位的相对量样品末端半乳糖FSH(本发明)75%Fostimon43%显示的是末端具有半乳糖的FSH上N-聚糖分支的相对量。表7:不同FSH的Z数样品Z数未富集的FSH(本发明)220富集了酸性异构体的FSH(本发明)245GonalF(rFSH)218Puregon(rFSH)204Fostimon(uFSH)212Bravelle(uFSH)244显示的是FSH制备物的Z数即相对酸度。较高的Z数表示FSH制备酸性更高。总之,根据本发明的FSH(FSH(本发明))具有高度的平分型N-乙酰葡萄糖胺、高天线型及高度的唾液酸化(尤其是在富集了酸性异构体后)以及高的硫酸度。我们认为由于FSH(本发明)具有这三种糖基化参数中的一种或多种,其相比于常用的重组或尿液FSH制备物有更优越的活性。进一步地,FSH(本发明)还是高度果糖基化的,具有大约1:1的2,3-对2,6-唾液酸化比或甚至更高量的2,6-唾液酸化。进一步地,还通过对所释放的聚糖进行质谱以分析FSH制备物的聚糖结构。获得了以下结果:表8:不同糖基化特性的相对量样品FS0S1S2S3S4S>0G0G1G2G3G4G>0BGonalF551164528998015530141000Bravelle431114534999073939149914FSH(本发明)43118353115990745302010228显示的是具有以下特性的聚糖的相对量:F:果糖;S0:无唾液酸;S1:一个唾液酸;S2:两个唾液酸;S3:三个唾液酸;S4:四个唾液酸;S>0:至少一个唾液酸;G0:无半乳糖;G1:一个半乳糖;G2:两个半乳糖;G3:三个半乳糖;G4:四个半乳糖;G>0:至少一个半乳糖;B:平分型GlcNAc。表9:不同FSH的糖基化的天线型样品二型三型四型FSH(本发明)48%31%21%Bravelle45%43%12%Gonal-f56%30%14%二型:双天线型N-聚糖;三型:三天线型N-聚糖;四型:四天线型N-聚糖表10:硫酸化聚糖的相对量样品硫酸化FSH(本发明)15%Bravelle2%GonalF0%显示的是携带硫酸基团的FSH上的N-聚糖的相对量。实施例5:药学效应在雌性大鼠和猴中进行不同的体内药学和毒理学研究并进行体内生物测定以研究FSH(本发明)的药学谱。雌二醇和抑制素B被用作分子标记物。这些标记物是由卵巢在以FSH刺激时释放的。雌二醇负责卵泡生长成熟而抑制素B是天然负反馈机制的一部分。进一步地,先前显示抑制素B为FSH造成的卵巢刺激的良好的替代标记物。5.1对成熟大鼠的FSH处理在以单一皮下剂量为100IUFSH(本发明)/kg体重处理成熟雌性大鼠时,血清抑制素B水平在施用2-3天后升高并再次下降到基线水平。根据排卵周期以100IUFSH(本发明)对大鼠进行重复给药,造成血清黄体酮和抑制素B的极大增加,这反映了黄体细胞中激素产生后的多次排卵。类似的发现也在剂量范围寻找的研究中观察到,其中1200IUFSH(本发明)/kg的剂量重复施用7-d。相比于相同研究中所研究的含有FSH的参考产品(Gonal-f,Bravelle),未观察到FSH(本发明)的药效动力学活性有差异。在雌性大鼠中进行的28天的重复剂量毒性研究中,在所有剂量组(30、100、300IU/kg体重)中都观察到有剂量相关的卵巢增大和格拉夫卵泡数量增加。与这些发现相关的是在处理阶段抑制素B水平比对照升高。经处理的动物的抑制素B水平从30IUFSH(本发明)/kg体重/天的低剂量水平开始以剂量相关方式增加。所有发现都是完全可逆的。5.2对成熟猴的FSH处理在以单一及重复剂量施用FSH(本发明)后,在食蟹猴中评估药学形式。由于其与人的紧密相似性,食蟹猴被认为是最相关的动物模型。本研究包括对性成熟并表现出规则的月经周期的雌性动物施用单次剂量的FSH。基于其排卵周期将这些动物随机分配至测试组。测试物品对动物的施用开始于月经起始的1-3天。该研究包括4组,每组包含4只动物,以单一皮下团注100IU/kg体重的FSH(本发明)、尿液FSHBravelle或表达于CHO细胞中的重组FSHGonal-f的方式处理这些动物。在给药前及施用后所指出的时间点进行血液取样以分析雌二醇和抑制素B水平。选择的施用后的时间点反映了排卵周期的不同时期。结果显示于图8A。对所有测试的FSH物质,在施用测试物质后经处理动物的雌二醇和抑制素B水平连续5天增加,并再次降低至基线水平。对几乎所有动物在14-22测试日观察到正常的中周期雌二醇激增。FSH(本发明)显示了雌二醇水平的最高增加。此实验表明FSH(本发明)在较低AUC水平(见实施例6)下至少有可比的药学效力,这表示其在受体刺激上有较高活性。此外,进行了类似的研究,其中猴接收重复的FSH剂量。重复剂量研究包括3组,每组包含4只动物,以连续7天每天重复皮下团注100IU/kg体重的FSH(本发明)、Bravelle或Gonal-f的方式处理这些动物。血液取样如单剂量研究中所描述。重复皮下注射100IUFSH(本发明)/kg体重、100IUBravelle/kg体重或100IUGonal-f/kg体重处理的动物的雌二醇和抑制素B水平在7天的整个处理阶段中都有增加(见图8B)。在处理末期,激素水平缓慢降低并在5-7天后达到正常水平。在重复施用FSH(本发明)后观察到的最大雌二醇和抑制素B浓度比单次剂量施用也比正常排卵周期的水平高得多。在重复皮下施用FSH(本发明)后观察到的药效动力学效应与对此产品类别的预期相同,也比得上相同研究中对参考产品观察到的效应。卵泡生长的诱导在食蟹猴中进行了一项为期4周的亚慢性毒性研究,包括对药效动力学参数的分析。通过以每天一次重复皮下注射FSH(本发明)对4组动物进行28天的处理,每组动物包含4只雌性性成熟食蟹猴。对低、中、高剂量组的剂量水平分别为30、100和300IU/kg体重/天。除了这项主要研究,对对照和高剂量组安排每组的2只雌性动物进行6周恢复期。在处理阶段前及末期(给药前、第1和28天)、第17天施用后6小时及恢复末期(第70天)取学样品分析雌二醇和抑制素B。以30、100或300IUFSH(本发明)/kg体重/天重复处理4周导致在最后的处死时绝对及相对卵巢重量增加以及且导致格拉夫卵泡数的增加。此外,所有剂量组有一些动物显示了黄体数的轻微降低。与此项发现相关的是在所有剂量组中都观察到增加的血清雌二醇及抑制素B水平。5.3不利作用分析为分析FSH(本发明)的任何预期外的副作用风险,在大鼠和食蟹猴中进行的为期4周的关键毒性研究中包括了主要的安全药学参数(ECG、心率、血压、呼吸率)。这些研究未提供任何FSH(本发明)对主要系统的起一般作用的证据,因此可认为FSH(本发明)是安全的,不显示不利的副作用。实施例6:药代动力学本研究的目的为研究在皮下或静脉内施用于食蟹猴时FSH(本发明)相比于Bravelle和Gonal-f的生物利用率和药学效应。本研究是对性成熟并显示有规则月经周期的雌性动物进行的。基于其排卵周期将这些动物随机分配至测试组。测试物品对动物的施用开始于月经起始的1-3天。该研究包括4组,每组包含4只动物,以单一静脉内团注100IU/kg体重的FSH(本发明)或单一皮下团注100IU/kg体重的FSH(本发明)、或的方式处理这些动物。在施用后反映排卵周期不同时期的不同时间点进行血液取样以分析FSH水平。没有任何动物在研究过程中提早死亡或显示系统毒性的临床表现。未注意到任何测试或参考物品相关的影响或局部不耐受。186.13mIUFSH/mL的Cmax水平是在以100IUFSH(本发明)/kg体重进行单一皮下处理施用后8小时记录到的。FSH(本发明)的计算平均血清清除半衰期为16.85小时。血清水平显示于图9。单一接触后猴血清中毒性动力学参数的平均值在表11中给出。表11:在向雌性食蟹猴单一皮下团注FSH后计算的毒性动力学参数。#:获自FSH血清分析的值n.a.:不适用F:FSH(本发明)的相对生物利用率[(AUC0-t终点皮下x静脉内剂量)/(AUC0-t终点静脉内x皮下剂量)]x100%##:AUC0-t终点值的比较,组1=1.00皮下施用后的FSH(本发明)相比静脉内施用的FSH(本发明)计算的相对生物利用率(F)为72.77%。单一接触后记录的FSH接触比率如下:FSH(本发明)(s.c.)<FSH(本发明)(i.v.)<Bravelle<Gonal-f。从食蟹猴的多次剂量研究及大鼠和裸鼠中的研究中都获得了类似数据:食蟹猴中的重复剂量研究的进行与单次剂量研究类似。该研究包括3组,每组包括4只动物,连续7天每天皮下团注100IU/kg体重FSH(本发明)、Bravelle或Gonal-f以重复处理动物。参考猴中的药代动力学和毒理学研究选择剂量,使用了剂量为10-1000IU/kg体重的Gonal-f。没有任何动物在研究过程中提早死亡或显示系统毒性的临床表现。未注意到任何测试或参考物品相关的影响或局部不耐受。这些结果显示猴中FSH(本发明)的Cmax-和AUC值比含有FSH的参考产品(Gonal-f,Bravelle)是减少的,使得FSH(本发明)处理的细胞有较低的药物接触。然而,在相同研究中获得的药学数据显示这些FSH产品之间其作为FSH受体的效应子刺激雌二醇和抑制素B产生的能力没有差异(见实施例5)。以皮下注射对雌性裸鼠施用5μgFSH,并监视血液中的FSH浓度。FSH(本发明)及Gonal-f和Bravelle的药代动力学谱在Cmax和AUC0–t终点值上很大程度是可比的。在单一皮下注射FSH(本发明)、Bravelle和Gonal-f后观察到的Cmax水平分别为5.1±1.9%ID、6.7±0.4%ID和5.5±0.4%ID。对FSH(本发明)、Bravelle和Gonal-f观察到的AUC0–tlast值分别为71.6±25.4%ID、99.1±12.9%ID和79.7±9.7%ID。对所有所研究的物质其从血液中的清除情况及相对药物暴露量基本上上是可比的;未测得统计学相关的差异。在研究所施用的FSH的生物分布时,观察到卵巢和子宫中的FSH积累(此外还有在肾中的高积累,因为其起到从体内清除FSH的作用)。通过皮下注射对雌性大鼠使用单一或多次剂量的100IU/kg体重FSH(本发明)、Bravelle或Gonal-f,并监视血清FSH浓度。结果显示在大鼠中,FSH(本发明)的血清半衰期和AUC值相比含有FSH的参考产品(Gonal-f、Bravelle)有所下降,使得FSH(本发明)处理的动物具有较低的药物暴露量。尽管如此,在相同的研究中获得的药学数据显示FSH产品之间在其作为FSH受体的效应子刺激雌二醇和抑制素B产生的能力上没有差异(见实施例5)。实施例7:人中的药代动力学和药效动力学在一项临床研究中,将FSH(本发明)施用于志愿者并确定药代动力学和药效动力学参数。健康的雌性志愿者以单一皮下剂量接收25IU、75IU或150IUFSH(本发明),并监视循环系统中的FSH浓度。此外,在给药前后都分析卵泡的数量和大小。初步结果是,观察到的FSH(本发明)的最大血清浓度(Cmax)相比于不同实验室测量的尿液和重组FSH的已发表数据,几乎增加一倍。皮下施用后FSH(本发明)(~33h±3h)、重组CHO细胞来源FSH(Gonal-f:37h±28h(leCotonnec等人(1994)FertilityandSterility61,679-686)及尿液FSH(MetrodinHP:45h±21h(leCotonnec等人(1993)HumanReproduction8,1604-1611)的循环半衰期(t1/2)是相当的。药效动力学数据显示在单次剂量25IUFSH(本发明)下已经在有些患者中可见卵泡生长。这在对比物Bravelle和Gonal-f的情况下是不能观察到的。在75和150IUFSH(本发明)的情况下,所有受试者都显示了卵泡增大,其中一名患者的卵泡大小增加一倍。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1