miRNA标志物在制备筛查叶酸缺乏群体的宫颈上皮内瘤变试剂中的应用的制作方法
本发明涉及一种基因工程及临床医学领域,具体为一种mirna标志物在制备筛查叶酸缺乏群体的宫颈上皮内瘤变试剂中的应用。
背景技术:
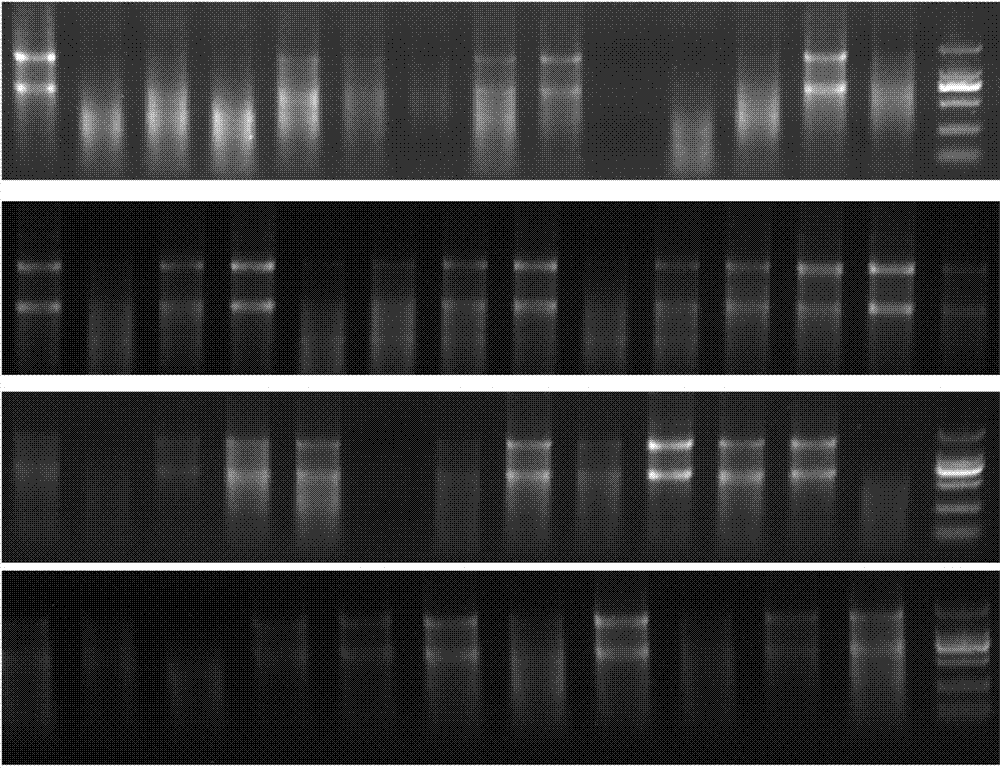
:宫颈癌(cervicalcancer,cc)发病率位居发展中国家女性恶性肿瘤第二位,据统计,全球每年新发病例50万,我国占25%,病死率达11.30%,远高于发达国家。山西省为宫颈癌的高发区,其中我省阳城县仍为我国子宫颈癌发病率(78.23/10万)和死亡率(25.07/10万)最高的地区,远高于同期我国宫颈癌平均发病率(9.62/10万)和死亡率(2.54/10万)[2,3]。故山西省已经成为该病的重灾区,严重威胁着妇女的健康和生命。所以在我们国家(尤其山西)研究该病的发生机制、阻断其发生仍然是迫切需要解决的问题。宫颈上皮内瘤变(cervicalintraepithelialneoplasia,cin)作为癌前病变,是阻断宫颈癌发生的关键阶段。由于筛查的广泛推进,cin呈发病增加及年轻化趋势。cin可分为两个级别即:低级别鳞状上皮内病变(low-gradecervicalsquamousintraepitheliallesions,lsil)和高级别鳞状上皮内病变(high-gradecervicalsquamousintraepitheliallesions,hsil)。其中,前者多自然消退,而后者则高度可能进展为浸润癌。随着预防关口的前移,阻断cin进展为宫颈癌已成为目前广泛关注和亟待解决的问题。持续性的人乳头瘤病毒(humanpapillomavirus,hpv)(尤其是hpv16、18等)的感染是宫颈癌发生的重要因素,hpv16和hpv18感染存在于70%以上的宫颈癌中。然而超过80%妇女曾有hpv感染,只有不到1%宫颈癌变。可见在宫颈癌的发生过程中必然存在hpv外的协同因素的辅助。所以深入探讨山西宫颈癌高发的区域因素,及其在疾病进展中的分子机制,对进一步完善宫颈癌发病机制,寻求新的防治策略具有重要意义。目前已经明确1.叶酸缺乏引可能是协同hr-hpv感染致cin进展、宫颈癌发生的重要辅助因素已发现营养素(叶酸,vita,vite等)摄入量或体内水平较低可增加患宫颈癌的风险。与叶酸缺乏有关的新生儿神经管畸形发生率在山西省居全国首位,高发区沿太行山脉走形,与宫颈癌的高发区域基本一致。这两者间是否存在内在某种联系呢?以医院为基础的人群研究发现,无论是膳食叶酸摄入量抑或血清叶酸水平,在宫颈癌组均低于对照组,宫颈癌的患病风险与血清叶酸间存在剂量反应关系。且血清水平低与hpv16感染间存在交互作用,两者同时存在时患宫颈癌的危险高达17.45倍。叶酸作为体内甲基提供者s-腺苷蛋氨酸(s-adenosylmethionine,sam)合成的极为重要、必要的组成成分,可参与dna合成、dna甲基化,与肿瘤的发生密切相关。sam是体内100多个(dna、rna和膜磷脂甲基化反应)通用的甲基供体。在所有细胞内,通过dna甲基转移酶(dnamethytrasferase,dnmt)的作用,sam脱去一个甲基,变成s-腺苷高半胱氨酸(s-adenosylhomocystein,sah),sah转化成高半胱氨酸,提供下一个蛋氨酸循环之用。叶酸缺乏时,sam易耗竭,高半胱氨酸堆积,sah含量升高,sam/sah比例下降,对dnmt的抑制功能下降,导致dnmt活性升高,使得抑癌基因(启动子区)发生过度甲基化,发生转录沉默,表达降低或不表达,是促进肿瘤细胞形成的关键环节(见图1)。随着宫颈病变(cin至宫颈癌的进程)的加重,血清叶酸含量降低,p16基因cpg岛甲基化率逐渐升高,且叶酸水平低和p16、fhit基因(cpg岛)甲基化过度在宫颈癌的发生中有交互作用。提示叶酸缺乏引发、dna甲基化紊乱可能是导致hr-hpv感染致宫颈病变(cin至宫颈癌)进展的重要辅助机制。2.mirna在叶酸辅助hr-hpv感染导致cin进展、宫颈癌发生中的作用不容忽视《mirna与宫颈上皮内瘤变及宫颈癌关系的研究进展》首都医科大学附属北京妇产医院妇科微创中心,医学综述2012.11.18卷22期,梁学爱,代荫梅。公开了以下内容,研究证实,mir-143,mir-145抑制宫颈细胞的增殖,mir-146促进细胞的增殖。hr-hpve6,p53,mir-,34a,p181nk4c,与宫颈癌的发生有一定关系,p181nk4c很可能是宫颈癌的分子标志物。mir-21可促进宫颈细胞的增生、降低宫颈癌细胞中程序性细胞死亡基因的表达。在hpv感染细胞中,hpv-dna的含量与mir-125的表达水平呈反比,外源性的mir-125b可以显著地抑制宫颈细胞中hpv-dna的合成。mir-886-5p通过抑制程序性细胞死亡可引起宫颈癌的发生。运用反转录聚合酶链反应的方法检测cin的mir-218表达水平,发现hpv-dna阳性患者的mir-218表达下调,认为mir-218缺乏与宫颈癌的发生有关。mir-29抑制细胞周期,通过yy1转录因子和细胞周期依赖性激酶源减少细胞凋亡。现已明确,肿瘤的发生与表观遗传调控密切相关,后者包括dna甲基化、微小核糖核酸(microrna,mirna)、组蛋白修饰和染色质重塑等。其中,mirna与肿瘤发生关系从表观遗传学角度进行研究受到很多学者的关注。mirna通过与目标mrna(5’和3’端非编码区域)互补配对,抑制mrna翻译、转录后调控,使相应的蛋白表达下调。mirna通过影响(原癌、抑癌)基因的表达,发挥着原癌、抑癌的作用。目前认为,约1/3的蛋白编码基因受mirna的调控,且一个mirna可调控百余种靶基因。其中,超出1/2的mirna位于染色体的脆性位点、hpv整合区域等癌症相关的基因组不稳定区域。patricia等研究发现,68种mirna在宫颈癌中表达上调(mir-199s,mir-9,mir-199a,mir-199a,mir-199b,mir-145,mir-133a,mir-133b,mir-214和mir-127等),8种mirna(mir-26a,mir-143,mir-145,mir-99a,mir-203,mir-513,mir-29a和mir-199a)在cin、宫颈癌组织中下调,其下调程度与宫颈病变级别的升高相关。在宫颈癌组织或细胞系中,mir-15b,mir-16,mir-17-5p,mir-20a,mir-20b,mir-21,mir-93,mir-106a,mir-155,mir-182,mir-185和mir-224等也表达上调,mir-29a,mir-34a,mir-126,mir-127,mir-145,mir-218,mir-424,mir-450,mir-455等表达明显下调。由此可见,mirna异常表达是宫颈癌表观遗传机制的关键内容。研究表明,超出一半的mirna(编码基因启动子区)富含cpg岛,该部位过度甲基化可引起mirna表达下调,影响其靶基因的表达、功能,参与信号转导通路异常所致的癌症。在hct-116细胞中,han等[19]将dnmt敲除,发现基因甲基化广泛下调(95%),低甲基化导致细胞内7种mirna过表达,包括mir-10a(2.85倍),mir-200a(2.35倍),mir-125b(1.72倍),mir-221(1.34倍)和mir-222(1.34倍);此外,6种mirna低表达,包括mir-17(0.71倍),mir-20a(0.77倍)和mir-106a(0.57倍)。wilting等发现mirna(启动子区)甲基化发生于癌前病变早期阶段,与hpv恶性转化密切相关,添加去甲基化试剂可以使宫颈癌细胞株mirna表达恢复。鉴于叶酸与cpg岛甲基化、cpg岛甲基化与mirna表达间存在不可分割、极其重要的联系,推测叶酸可诱发cpg岛甲基化、mirna异常表达,在cin进展、宫颈癌发生中发挥一定的作用。associationbetweenfolatestatusandcervicalintraepithelialneoplasia.eurjclinnutr.2016.[epubaheadofprint]zhaow,haom,wangy,fengn,wangz,wangw,wangj,dingl.证实了血清叶酸水平低可增加cin发生发展的风险,且与hr-hpv感染存在正相加交互作用。叶酸缺乏可能通过影响dna的甲基化和dna合成及修复功能,使宫颈癌发病风险上升;补充叶酸可改善cin情况,抑制癌细胞增殖,可能会降低宫颈癌发生风险。现已明确,肿瘤的发生与表观遗传调控密切相关,后者包括dna甲基化、mirna、组蛋白修饰和染色质重塑等。其中,mirna与肿瘤发生关系从表观遗传学角度进行研究受到很多学者的关注。mirna通过转录后对基因表达调控,降调节其体内约1/3的蛋白编码基因,广泛参与病毒感染、肿瘤发生发展的每一个阶段。研究已证实,mirna异常表达是宫颈癌表观遗传机制的重要内容。超过一半mirna位于癌症相关的基因组不稳定区域(染色体基因的脆性位点、hpv整合区域)。patricia等研究发现,68种mirna在宫颈癌中表达上调,8种mirna在cin、宫颈癌组织中下调,其程度与宫颈病变级别的升高相关。研究发现,叶酸参与调控mirna表达在疾病的发生、发展中发挥一定作用。有学者对雄性fisher鼠在单独采用叶酸缺乏饮食饲养而无其他致癌物接触的第54周发生了肝细胞癌,同时与接受叶酸充足饮食饲养的鼠肝组织相比,发生肝癌的鼠体内肝组织中let-7a,mir-21,mir-23,mir-130,mir-190,mir-17-92的转录水平上调,而mir-122的转录水平下调;当重新给予叶酸饲养36周后,mir-122转录水平增加且肝癌生长受抑。叶酸可通过调控mirna异常表达产生化学预防肿瘤作用。marist等使用叶酸缺乏培养基培养人的类淋巴母细胞(tk-6)后发现,mir-125b,-221,-222,-22,-34b表达水平分别增加2.89,2.50,2.09,1.93和2.08倍。随后通过与血清叶酸水平正常的头颈部鳞状细胞癌患者相比,血清叶酸缺乏者mir-222表达水平明显增高。liang等对鼠胚胎干细胞采用叶酸缺乏培养基培养后发现其凋亡率增加,g0/g1期停滞,且增殖速度减慢。同时12种mirna转录异常。wang等[42]对胚胎鼠早期暴露酒精后发现,脑组织内mir-10a,mir-10b,mir-9,mir-145,mir-30a-3p和mir-152表达上调(>1.5倍),而mir-200a,mir-496,mir-296,mir-30e-5p,mir-362,mir-339,mir-29c和mir-154表达下调(<0.67倍),给予叶酸干预后,上调的mir-10a表达下调,且其下游靶基因同源异型盒a1表达恢复,该研究证实叶酸干预可影响体内mirna的异常表达。然而,叶酸缺乏是否通过调控mirna异常表达,参与cin进展至宫颈癌?目前国内外未见文献报道。因此,我们研究叶酸缺乏条件下调控mirna异常表达,以确定某些mirna参与cin,以更好地判断cin。技术实现要素:本发明的目的是提供一种在身体内叶酸缺乏条件下筛查宫颈上皮内瘤变试剂mirna标志物及其应用。本发明的技术方案是,一种mirna标志物在制备筛查叶酸缺乏群体的宫颈上皮内瘤变试剂中的应用,所述的叶酸缺乏标准为不大于10nmol/l,所述的mirna标志物包括:mirna为14个;mir-10a,mir-375,mir-23a,mir-18a,mir-6774,mir-21,mir-3613,mir-4730,mir-1247,mir-3607,mir-224,mir-30a,mir-30c,mir-196b。所述的试剂或试剂盒可以用来检查叶酸缺乏患者宫颈组织内14个mirna表达情况。以便于分析此类群体患cin乃至宫颈癌的风险性。本发明为国家卫计委2014年度公益性卫生行业科研专项项目“宫颈上皮内瘤变进展的预警模式及治疗策略优化的多中心研究(编号:2014020)”。本发明研究的目的:应用mirna芯片技术筛选血清叶酸充足/缺乏的不同程度宫颈组织中mirna表达谱的差异,结合生物信息学分析发现与血清叶酸缺乏、宫颈病变进展均相关的mirnas,同时对差异最为显著的特定mirna扩大样本量进行验证,为以后进一步研究叶酸缺乏在cin进展为宫颈癌中的协同作用机制奠定基础。采取的方法:经严格流行病学资料匹配后,选择血清叶酸含量充足的单纯hpv16阳性正常宫颈组织作为对照组,血清叶酸含量充足和缺乏的单纯hpv16阳性hsil、单纯hpv16阳性早期宫颈鳞癌组织作为研究组,每组各选择5例进行affymetrixgenechipmirna4.0array芯片技术检测各组宫颈组织mirna的表达谱,应用生物信息学分析手段twoclassdif、go-analysis、pathway-analysis选择显著性差异mirnas,进一步利用差异mirnas与靶基因及其功能的从属关系构建网络mirna-gene-network、mirna-go-network;同时对差异最为显著的特定mirna扩大样本量进行qrt-pcr验证。实验结果:(1)mirna芯片结果显示,与血清叶酸缺乏、宫颈病变进展均相关的特异性差异表达的mirnas为14个,mir-10a,375在hsil中上调,但在scc中下调;mir-23a,18a在hsil中下调,但在scc中上调;mir-6774,21,3613,4730随着宫颈病变的进展呈一致性上调表达趋势;mir-1247,3607,224,30a,30c,196b随着宫颈病变的进展呈一致性下调表达趋势,其中mir-375在scc组织中下调最为显著。(2)生物信息学分析显示,差异mirnas主要参与调节细胞大分子生物合成、细胞组分形态发生、大分子代谢、细胞内氮化合物生物合成、干细胞分化、细胞内成分结构及表观遗传修饰等分子生物过程;且可参与肿瘤发生、雌激素信号通路、黑色素生成、轴突导向、干细胞多能性信号通路、泛素化蛋白水解等信号通路异常。(3)qrt-pcr验证结果显示,mir-375在lsil、hsil和scc组的表达水平低于nc组,尤以hsil和scc组下调最为显著,且与血清叶酸水平呈正相关。最终结论:叶酸差异相关宫颈病变组织中存在mirna表达谱的差异,与血清叶酸缺乏、宫颈病变进展均相关的特异性差异表达mirna有14个,其中,以mir-375在scc组织中下调最为显著,并经扩大样本量验证。生物信息学分析显示差异mirna主要参与肿瘤发生等信号通路调控细胞大分子生物合成等一系列分子生物过程。我们可以将上述研究应用于筛查体内叶酸缺乏的群体患宫颈上皮内瘤变的风险,进一步判断宫颈癌发生的风险。附图说明图1叶酸代谢参与基因表达调控示意图图2-1部分样本rna电泳图图2-2芯片扫描图图2-33端杂交质控图图2-4芯片平均信号值与背景信号值图2-5hpv16感染的正常宫颈组织、叶酸缺乏的hpv16感染的hsil组织、叶酸缺乏的hpv16感染的早期scc组织3组的mirna表达谱(p<0.05)。颜色从绿到红表示mirna的表达量从低到高。图2-6hpv16感染的正常宫颈组织、叶酸充足的hpv16感染的hsil组织、叶酸充足的hpv16感染的早期scc组织3组的mirna表达谱(p<0.05)。颜色从绿到红表示mirna的表达量从低到高。图2-7芯片筛选叶酸充足的正常宫颈组织、叶酸充足和叶酸缺乏的hsil组织、叶酸充足和叶酸缺乏的早期scc组织5组中差异表达mirna的动态表达特征(p<0.05),y轴为mirna差异倍数的相对表达量(log2值),x轴为不同程度宫颈组织。图2-8差异mirna靶基因显著性go的log柱状图图2-9差异mirna靶基因显著性pathway的log柱状图图2-10差异mirna与其靶向基因建立mirna-gene作用网络图2-11差异mirna与基因功能的调控网络(mirna-pathway-network)图2-12mir-375在nc、lsil,hsil和scc组织中的相对表达量,*p<0.05。具体实施方式一种mirna标志物在制备筛查叶酸缺乏群体的宫颈上皮内瘤变试剂中的应用,所述的叶酸缺乏标准为血清叶酸不大于10nmol/l,所述的mirna标志物包括:mirna为14个;mir-10a,mir-375,mir-23a,mir-18a,mir-6774,mir-21,mir-3613,mir-4730,mir-1247,mir-3607,mir-224,mir-30a,mir-30c,mir-196b。1对象与方法1.1研究对象1.1.1研究对象入选标准选择2013年1月~12月于我院就诊的妇科疾病患者,采用tct检测宫颈脱落细胞,排除宫颈腺细胞异常者,对tct结果结果为ascus及以上者进一步行阴道镜下活检和组织病理学检查。同时使用导流杂交芯片技术(hybrimax)进行hpv型别检测。将病理诊断证实为hsil、宫颈鳞癌(ⅰa-ⅱa)且单纯hpv16感染的患者作为研究组,同期选择病理诊断证实为正常宫颈组织且单纯hpv16阳性者作为对照组。每组50例以上。研究对象必须符合下列所有标准:①已婚至65岁女性;②本地区居住一年以上;③签署知情同意书。本研究为国家卫生公益性行业科研专项(201402010)基金项目;所有研究方案、知情同意书于2013年7月经山西医科大学第二医院伦理委员会批准;经中国临床试验中心注册(注册号:chictr-roc-15006479)。1.1.2研究对象排除标准凡具备下列任一情况者不得入选:①妊娠期妇女。②有子宫切除术史者。③有宫颈及阴道病变治疗史者。④其他恶性肿瘤患者。⑤血液系统、消化系统疾病患者。⑥近期(三个月内)b族维生素使用者。1.1.3研究对象分组(1)采集基线信息:由流行病学专家设计统一的、结构式问卷,由培训合格、固定的调查员,面对面地对研究对象进行询问、填写。调查内容有人口学特征(年龄、职业、文化程度、年收入),婚育信息(月经史、婚姻史、孕产史、性行为史、避孕史),既往病史和肿瘤家族史等。(2)血清叶酸检测:方法同第一部分。世界卫生组织叶酸和维生素b12缺乏技术顾问组确定将叶酸缺乏标准定为叶酸浓度小于4ng/ml(10mol/l)[9]。(3)研究对象分组:根据宫颈组织病理学、hpv分型检测结果,选择正常宫颈组织(normalcervix,nc)、lsil、hsil和宫颈鳞癌(squamouscervicalcancer,scc)(ⅰa-ⅱa期)者每组30例以上,根据血清叶酸水平又分为叶酸含量充足者和叶酸含量缺乏者(血清叶酸<10nmol/l),经严格匹配流行病学资料后筛选出各组5例用于mirna芯片筛查。分组编号如下:1=血清叶酸充足的单纯hpv16阳性nc(45.00±1.58岁),2=血清叶酸充足的单纯hpv16阳性hsil(46.60±3.44岁),3=血清叶酸缺乏的单纯hpv16阳性hsil(44.20±2.77岁),4=血清叶酸充足的单纯hpv16阳性scc(47.40±2.41岁),5=血清叶酸缺乏的单纯hpv16阳性scc(48.40±1.82岁)。五组间年龄差异无统计学意义(=2.373,=0.087)。25例mirna芯片实验标本的临床病理资料(如表2-1所示)。然后扩大样本量,选择经病理学确诊的nc、lsil、hsil和scc组四组共计120例标本对筛选的差异mirna进行qrt-pcr验证,120例标本的临床病理资料(如表2-2所示),其中30例scc标本的临床病理资料(如表2-3所示)。表2-1mirna芯片检测标本的临床病理资料groupsampleno.pathologyagehpvtypetctserumfolate10000134nc5616nilm23.8612100365nc4416nilm40.6312100071nc3716nilm18.2612100371nc4316nilm26.8912100222nc2716nilm17.9220000219cinⅲ3516asc28.7922100218cinⅲ5216hsil17.3722100209cinⅲ5616asc-h21.7820000043cinⅲ3716asc18.1722100399cinⅲ累腺5216asc-h35.0232100046cinⅲ累腺3316nilm9.2530000126cinⅲ3116lsil9.9132100005cinⅲ4116asc7.9230000179cinⅲ4116asc8.4032100068cinⅲ4316nilm8.9042100279sccg2-g35316scc21.8442100387sccg25916hsil20.2242100418sccg25616asc22.5940000266sccg24016asc17.3340000172sccg2416scc26.7652100125sccg15616asc9.9152100385sccg26616hsil9.5750000048sccg25716nilm9.6550000104sccg26716asc7.3652100290sccg25916scc6.67表2-2mirnaqrt-pcr实验标本的临床病理资料表2-3mirnaqrt-pcr验证实验中所用scc标本的临床病理资料1.2主要仪器与试剂1.2.1主要仪器及设备沉降式、全自动液基细胞学制片、染色系统(dc-12型)达诚,广州,中国核酸扩增分析仪(tc-96/g/h(6)型)、医用核酸分子快速杂交仪(hmm-2型)凯普,广东,中国全自动、微粒子化学发光免疫分析系统(beckmancoulteraccess2型)beckmancoulter,美国-80°c冰箱sanyo,日本mettlertoledo*ab204-s电子天平fisherscientific,美国分光光度计(sma3000)meriton,北京,中国凝胶成像仪(js-380a)培清,上海,中国geneamppcrsystem9700abi,美国电泳仪biorad,美国涡旋器(evtx05)碧云天,北京,中国磁力架invitrgen,美国离心管、pcr管axygen,美国杂交炉(genechip2hybridizationoven640)affymetrix,美国洗涤工作站(genechip2fluidicsstation450)affymetrix,美国扫描仪(genechip2scanner30007g)affymetrix,美国移液器(1000ul,200μl,20μl,2.5μl)eppendorf,德国振荡器(9600)agilent,美国nanodrop2000thermo,美国eppendorf5418离心机eppendorf,德国振荡器(gl-88b)其林贝尔,海门,中国金属浴(hb-100,chb-100)博日科技,杭州,中国恒温培养箱(xmtd-8222)精宏实验设备,上海,中国1.2.2主要试剂及耗材液基细胞制片耗材、染色剂达诚,广州,中国hpv分型试剂盒(20143402188)凯普,广州,中国叶酸检测试剂盒beckmancoulter,美国accesssubstratebeckmancoulter,美国accesswashbufferⅱbeckmancoulter,美国叶酸校准品beckmancoulter,美国测试杯拱东,杭州,中国trizol试剂invitrogen,美国flashtagbiotinhsrrnalabelingkitaffymetrix,美国genechip®hybridization,wash,andstainkitaffymetrix,美国chipaffymetrix,美国real-timepcrmastermix(2×)吉码,上海,中国mirnahairpin-primerset(5μm)吉码,上海,中国mirnartprimer(10μm)吉码,上海,中国taqdnapolymerase(5u/μl)吉码,上海,中国syntheticmir-16standard吉码,上海,中国1xrnadilutionbuffer1ml吉码,上海,中国1.3宫颈组织标本收集(1)取出预冷(4度冰箱)低温冻存管(1ml)。(2)由具有阴道镜检查经验2年以上者实施阴道镜检查,对病变部位进行观察,初步考虑为cin或宫颈癌病变(研究组):在不影响常规病理诊断的前提下,另钳取2块组织(大小各约5mm);对照组:宫颈3、6、9、12点各钳取2块组织(大小各约5mm);(3)新鲜宫颈组织标本离体后,予生理盐水清洗血迹,置于预冷好的低温冻存管中,及时(<10min)放入装好液氮的保温桶内。放置新鲜宫颈组织时应用的无菌棉签或镊子不得接触其他液体、组织或物品,以防污染。(4)待标本在液氮桶内放置1h后,旋紧冻存管的盖子,按要求放入冻存盒,按预设的存储位置放入-80℃冰箱,并记录进入信息系统。1.4mirna芯片检测1.4.1宫颈组织总rna提取(1)在加入液氮的研钵中,将宫颈组织剪成小块、磨成粉末,取其50mg加入ep管(盛有1ml的trizol液),混匀。(2)室温放置5min,加入氯仿(200μl),盖紧ep管、剧烈摇荡15s。(3)12000rpm离心(10min),取上层水相置于另一ep管,加入异丙醇(500μl),温和混匀。室温放置10min,12000rpm离心(10min)。(4)弃去上清,加入75%乙醇(1ml),涡旋混匀,4℃下12000rpm离心(5min)。重复操作一次。(5)弃去上清,室温或真空干燥(5~10min)。depc水将rna溶解,必要时温水浴10min。吸取上清到离心管,加入氯仿(1/5体积)混匀,放置3min,4℃12000rpm离心(15min);重复操作一次。(6)吸取上清到离心管中,加入无水乙醇(1.5倍体积),混匀。(7)上述溶液转移至吸附柱,8000rpm离心1min,倒掉废液,将其放回收集管。(8)rwt(350μl)加入吸附柱中,8000rpm离心(1min),倒掉废液,然后将其放回收集管中。(9)dnasei(80μl)加入吸附柱中,25℃消化dna15min,轻柔混合;后重复步骤(8)。(10)rpe洗涤液(500μl)洗涤1次,8000rpm离心1min。(11)弃掉收集管废液,然后12000rpm离心(2min)。(12)把吸附柱移到收集管,加入预热(50℃)过的rnase-freewater(15~20μl),室温放2min,12000rpm离心2min,得rna溶液。1.4.2mirna芯片检测步骤(1)poly(a)tailing①在无rnase的rna样品pcr管中加入1μg总rna,补充nuclease-freewater至8μl,冰上静置。②加入2ulrnaspikecontrololigos混匀。③用1mmtris稀释atpmix,稀释倍数如下:totalrna:atpmix稀释倍数=1:500。④加入5μlmastermix混合液至pcr管,混匀离心5s,mastermix组分如下:⑤在pcr仪37℃孵浴15min,然后离心5s,放在冰上。(2)flashtagbiotinhsrligation①加4μl5×flashtagbiotinhsr连接混合液,加入2μlt4连接酶,轻轻混匀、离心5s,25℃孵浴30min;②离心5s。加入2.5μlhsrstopsolution混匀后离心5s,然后吸取2μl做elosaqcassay检测,其余-20℃保存。(3)芯片杂交①把芯片从冰箱中取出后放在室温;②在无rnasepcr管中加入5ul20×eukaryotichybridizationcontrols在pcr仪上65℃孵育5min;③配制杂交液:④离心5s,pcr仪上孵育。⑤将上述液体离心5s,然后取100μl注入芯片中,贴纸封住加样口。⑥置于杂交炉,48℃,60rpm,16h。(4)芯片洗涤和扫描①结束杂交后,吸掉杂交液,加入100μlarrayholdingbuffer;②在affymetrixgenechipcommandconsole(agcc)中,扫描芯片条形码,注册样品信息,生成样品对应芯片arr文件;③将芯片洗涤液置于相应位置,运行agccflutionscontrol软件;④初始化结束后,3个无rnase离心管(1.5ml)中分别加入600mlstaincocktail1、600mlstain在cocktail2和800mlarrayholdingbuffer,将其置于洗脱站的相应位置(1、2、3)上,然后把芯片插入洗脱站的槽中;⑤在洗脱站中扫描芯片条形码、选择芯片类型,点击运行,洗涤1h;⑥将芯片置于affymetrix扫描仪中,点击agccscancontrol,生成芯片扫描数据。1.5mirna生物信息学分析1.5.1两分类的差异基因筛选(twoclassdif)对于小样本,通常使用随机方差模型(t检验、f检验)筛选差异基因。t检验通常适合于二类的差异基因。设,为二类型的样本平均值,为方差,为样本量,计算公式为:,其中,t服从自由度为的t分布。估计t检验中的方差时,选择反伽玛分布作为随机方差模型。首先,选择线性模型中,设为来自i样本的基因j的标准化表达值,为标志不同特性的向量,为系数向量,为未知残差(均值为0,方差未知)。对每一个基因j,且方差的样本估计值服从反伽玛分布。对的假设检验基于给定的基因表达数据。根据线形模型要检验的假设为为线性子空间表示的维数,表示受子空间约束的线性向量的维数。在空间上,对的最大似然估计为,以及在子空间上,对的最大似然估计为,其中代表在子空间上的满秩矩阵。要假设的检验为,我们要先考虑各偏差平方和,然后用下面给出的统计量去检验假设:。在零假设为真时,f服从自由度为r与n-k的f分布。我们再在随机方差模型的假设检验下,对进行估计,就会在最大似然估计中有一些改变。在统计量f中,分母的残差平方和替换为,而其自由度也由n-k变为n-k+2a。所以,调整后的统计量为,在假设为真时,服从自由度为r与n-k+2a的f分布。在线性模型下,采用最大似然估计对方差进行估计,得到:,,再运用随机方差模型,经过运算之后,得到:通过随机方差模型的建造,我们得到对t检验的方差估计,也就是说对传统t检验中的方差进行修正,得到:,其中,,使得统计量的自由度由n-2变为。1.5.2基因功能的显著性分析(go-analysis)筛选得到差异表达的mirna,利用数据库预测差异mirna调控的靶基因,对其进行显著性的功能分析,得到显著性的功能。基因本体论(geneontology,go)是对基因进行显著性go的分析,利用如下的四格表:nf:表示go中差异基因的数目;nf:表示差异基因的数目;n:表示go中含有基因的总数目;n:表示基因的总数目(注释系统)。在给定的边际频率(即go中基因数目确定)时,四格表中元素服从超几何分布,从而得到fisher精确检验的p值,即通过求解双尾的累积超几何分布值得到fisher精确检验的p值,对于2nf≤n,p值计算公式如下:为了控制多重比较检验中犯第一类错误的整体概率,我们采用benjamini-hochberg的方法来控制错误发现率(falsediscoveryrate,fdr)(判断为显著性的go中假阳性go比例的期望),从而得到具有显著统计学意义的功能[15]。另外,我们通过富集得分(enrichmentscore,e)来评估单个功能中基因的富集程度,计算方法如下[16]:。1.5.3信号转导通路的显著性分析(pathway-analysis)目前,京都基因与基因组百科全书(kyotoencyclopediaofgenesandgenome,kegg)是有关pathway的主要公共数据库,pathwayanalysis是对mirna调控的靶基因按照kegg进行pathway分类,并对靶基因进行基于离散分布的显著性分析。利用如下四格表::表示pathway中差异基因的数目;:表示差异基因的数目;:表示pathway中含有基因的总数目;:表示芯片上检测出来基因的总数目;:表示差异基因落在pathway中的概率;:表示非差异基因不落在pathway中的概率。假设:,在此假设下分别利用fisher精确检验、检验,得到值、值,进一步经多重比较,确定pathway的fdr。最后得出显著性pathway,完成pathway-analysis。enrichment计算公式为:1.5.4mirna与基因的调控网络(mirna-gene-network)生物网络体现了基因之间或者基因与其他功能或通路之间的相互联系,通过网络分析可以发现基因影响生物体的协助脉络,并能在复杂的作用链条中,系统地挖掘基因发挥作用的真实线索。利用差异mirna、靶基因二者间的属性关系建立mirna-gene相互作用网络。其中,圆圈表示gene,圆角矩形表示mirna,一条边表示相互作用。中心度表示mirna对周围gene的贡献程度,或gene对周围mirna的贡献程度。degree最高表明该mirna、gene在网络中处于最核心的位置。1.5.5mirna与信号转导通路的调控网络(mirna-pathway-network)通过pathwayenrichmentanalysis,可以得到mirna调控的靶基因参与的显著性的pathway与gene的关系,联合mirna与gene的靶向关系,就可以建立mirna与显著性pathway之间的相互作用关系。其中,圆圈表示pathway,圆角矩形表示mirna,一条边表示相互作用。degree最高表明该mirna、pathway在网络中处于最核心的位置。1.6qrt-pcr验证mir-375的表达(1)总rna提取和质检:同1.4。(2)逆转录反应体系:程序:42ºc,30min;85ºc,10min;产物4℃保存。(3)引物的设计与合成mir-375基因的引物序列来自参考文献。正义引物:5-cttactatccgtttgttcgttcg-3反义引物:5-tatggttgttctcgtctctgtgtc-3(4)荧光定量反应体系:程序:95ºc3min;95ºc12s;62ºc40s;40循环。根据2-δδct计算相对表达量。1.7统计学方法采用affymetrixexpressionconsoletm对芯片检测结果进行数据标准化解析、质控。应用rqmanagerversion1.2软件分析qrt-pcr结果,以均数±标准差表示相对表达量。采用spss18.0windows统计软件包进行分析,采用均数±标准差描述正态分布资料;采用两独立样本的t检验进行两组资料比较,采用anova和lsd-t检验进行多组资料比较;以p<0.05为差异有统计学意义。2结果2.1质量控制rna样品加于1%琼脂糖凝胶孔,经120v电压5min,紫外光下观察,可见28s、18s核糖体rna条带浓、亮,且前者密度约是后者的2倍;二者间弥散一片溴化乙啶染色物质,由mrna和其它异型rna组成。再下方还有可能观察到一个稍微扩散的、更小的带,其由低分子量rna(如trna、5s核糖体rna等)组成。当dna污染时,更高分子量的弥散迁移物质、会在28s核糖体带的上面出现,提示需要进行纯化。当rna降解时,核糖体rna带发生弥散。本组入选研究对象的组织标本中总rna经琼脂糖凝胶电泳检测在28s、18s、5s条带出完整且清晰(如图2-1所示)。芯片质量控制参照核心质控标准、参考质控标准。其中,从所有芯片扫描图上都可以看到芯片阵列名以及角落的黑白棋盘状图案,表示b2oligo强阳性杂交质控合格(如图2-2所示)。参考质控标准有两方面:(1)杂交控制:图显示杂交探针结果为biob<bioc<biod<cre,表示杂交质控合格(如图2-3所示)。(2)芯片平均信号值与背景信号值:芯片的平均信号值(meanintensity)高于芯片的背景信号值(meanbackgroundintensity),表示芯片检测结果好(如图2-4所示)。2.2mirna芯片筛选叶酸差异的不同宫颈组织mirna表达谱通过选择血清叶酸水平充足的单纯hpv16阳性的正常宫颈作为对照组,分别选择叶酸含量充足/缺乏的单纯hpv16阳性的hsil及早期scc组织作为实验组,严格匹配流行病学资料后,每组各5例患者采用affymetrixgenechipmirna4.0array芯片技术检测各组宫颈组织mirna的表达谱,首先对单纯hpv16感染的正常宫颈组织、叶酸缺乏的单纯hpv16感染的hsil组织、叶酸缺乏的单纯hpv16感染的早期scc组织(a组)3组进行单因素方差分析,差异表达的mirna为34个(p<0.05)(如图2-5所示);其次对单纯hpv16感染的正常宫颈组织、叶酸正常的单纯hpv16感染的hsil组织、叶酸正常的单纯hpv16感染的早期scc组织(b组)3组进行单因素方差分析,差异表达的mirna为57个(p<0.05)(如图2-6所示);将a组与b组取交集,得到与单纯与宫颈病变进展相关的差异表达的mirna为20个,最后从a组除去a组与b组的交集mirna,得出与血清叶酸缺乏、宫颈病变进展均相关的特异性差异表达的mirna为14个,mir-10a,375在hsil组织中上调,但在scc组织中下调;mir-23a,18a在hsil组织中下调,但在scc组织中上调;mir-6774,21,3613,4730随着宫颈病变的进展呈一致性上调表达趋势;mir-1247,3607,224,30a,30c,196b随着宫颈病变的进展呈一致性下调表达趋势;其中,以mir-375在scc组中下调最为显著(如表2-1,图2-7所示)。表2-1不同宫颈组织中差异mirna在基因芯片中的表达量注:先将所有差异显著的mirna进行数据标准化,即每个mirna的hsil、scc的表达量分别除以正常宫颈的表达量以后,再进行log2标准化,将正常宫颈组织的每个mirna都归一化为0。2.3差异mirna功能的生物信息学分析2.3.1mirna调控的靶基因预测取血清叶酸充足、单纯hpv16感染的正常宫颈组织作为对照,取叶酸充足/缺乏的单纯hpv16感染的hsil组织、叶酸充足/缺乏的单纯hpv16感染的早期scc组织5组差异表达的14个mirna,分别搜索数据库(targetscan、miranda)预测靶基因,取交集部分,得到差异mirna(显著性趋势)调控的所有靶基因作为基础进行后续研究。本研究中,14个差异表达mirna共预测到1263个交集靶基因。2.3.2靶基因功能的显著性分析(go-analysis)go-analysis对靶基因按go分类,基于显著性、误判率和富集度分析,得到联系显著、低误判率、靶向性的基因功能分类。本研究通过对14个差异mirna预测到的交集靶基因进行go分析,显示其靶向性的基因功能共195类(如图2-8所示)。2.3.3信号转导通路的显著性分析(pathway-analysis)本研究中按照kegg,对mirna调控的靶基因进行pathway分类,基于离散分布的显著性分析,得到显著性的pathway分类42条(如图2-9所示)。2.3.4mirna与基因的调控网络(mirna-gene-network)将显著性go与显著性pathway包含的靶基因交集并与mirna构建调控网络,根据位置函数计算出mirna在网络中的关系强度,即网络特征值。特征值最高代表该mirna处于网络的枢纽性地位,其调控能力最强,同时亦可得到mirna调控的关键靶基因。本研究中,根据mirna与gene的属性关系建立二者间的相互作用关系网络,其中mir-30a-5p和mir-18a-3p具有最高的degree,表明该mirna在网络中处于最核心的调控位置(如表2-2和图2-10所示)。2.3.5mirna与信号转导通路的调控网络(mirna-pathway-network)根据呈显著性趋势的mirna和靶基因的显著性功能,利用二者间的联系,建立mirna-pathway-network,来反映mirna对基因功能的作用。同样,根据位置函数计算出mirna在网络中的关系强度,即网络特征值,数值最高代表该mirna处于网络的枢纽性地位,其调控能力最强,同时亦可得到mirna调控的关键pathway。本研究中,根据mirna与pathway的属性关系建立二者间的相互作用关系网络,其中mir-18a-3p和mir-30c-2-3p具有最高的degree,表明该mirna在网络中处于最核心的调控位置(如表2-3a,b和图2-11所示)。2.4不同宫颈组织中mir-375的表达及其与血清叶酸的相关性选择在叶酸缺乏宫颈癌组织中下调最为显著的mir-375作为研究目标,分别选择nc30例,lsil30例,hsil30例,scc30例,检测各组宫颈组织中mir-375的表达,结果发现nc、lsil、hsil和scc组宫颈组织中mir-375的相对表达量分别为:1.04±0.13;0.87±0.10;0.04±0.02和0.08±0.02,组间差异有统计学意义(f=1236.62,p<0.001)。其中,除hsil组、scc组两组间差异无统计学意义(p=0.06),其余任两组间差异均有统计学意义(p<0.001)(如图2-12所示)。可见,mir-375在lsil、hsil和scc组的表达水平低于nc组。随后,进一步将宫颈组织中mir-375的表达水平与血清叶酸水平进行相关性检验,结果显示,mir-375的表达水平、血清叶酸水平间呈正相关(r=0.695,p=0.03)。提示,mir-375表达下调在宫颈病变的进展中发挥一定的作用,且可能与血清叶酸水平低相关。本研究中使用affymetrixgenechipmirna4.0array芯片,总探针数30,424,具有以下优势:①可以全面覆盖sangermirbasev20.0数据库,同时检测206个物种的mirna。②同时检测成熟mirna、mirna前体,能检测人snorna和scarna。③增加mirna和mrna之间的关联分析。④可全面解决mirna芯片分析方案(包括归一化、差异基因筛选、mirna靶基因预测、mirna-target-network、mirna-gonetwork、mirna-pathway-network的联合分析)。本研究中,通过选择血清叶酸水平正常、单纯hpv16阳性的正常宫颈组织作为对照组,分别选择叶酸含量缺乏/充足的单纯hpv16阳性的hsil及早期scc组织作为实验组,严格匹配流行病学资料后,每组各5例患者采用affymetrixgenechipmirna4.0array芯片技术检测各组宫颈组织mirna的表达谱,得出与叶酸缺乏(<10nmol/l)、宫颈病变进展均相关的特异性差异表达的mirna为14个,mir-10a,375在hsil组织中上调,但在scc组织中下调;mir-23a,18a在hsil组织中下调,但在scc组织中上调;mir-6774,21,3613,4730随着宫颈病变的进展呈一致性上调表达趋势;mir-1247,3607,224,30a,30c,196b随着宫颈病变的进展呈一致性下调表达趋势;其中,mir-375在scc组织中下调最为显著。然而,芯片分析结果有一定局限性,获得的叶酸差异相关mirna特征性表达谱仍存在假阳性的可能,故我们对mir-375在不同宫颈组织中的表达情况进行了qrt-pcr验证,结果发现mir-375在lsil、hsil和scc组的表达水平低于nc组,而hsil和scc组间差异不具有统计学意义。提示,mir-375表达下调与cin进展为宫颈癌密切相关。近期研究发现,mir-375过表达可通过抑制e6和e7转录,导致p53、rb降解受抑和htert转录激活,使得细胞周期停滞、细胞增殖受抑,提示mir-375表达下调对hpv阳性宫颈癌的发生起关键的调控作用[44]。然而,有关mir-375下调的机制尚不明确。bierkensm等[45]采用高分辨率微阵列比较基因组杂交的方法检测hsil病变组织中的微小染色体突变(<3mb),结果显示染色体突变眼睛发育缺失蛋白(drosophilaeyesabsenthomologue-2,eya2)(20q13)和mir-375(2q35)导致的表达缺失与hsil相关,进一步在宫颈癌细胞株内外源性导入mir-375可降低细胞活性。wilting等[46]发现与mir-149,-203,-375,-638启动子区高甲基化相关的转录抑制是宫颈癌发生的重要机制,后两者发生于癌前病变早期阶段,与hpv感染细胞恶性转化密切相关,且对添加去甲基化试剂可以使siha细胞mir-149,-203,-375表达恢复。本研究同时对mir-375的表达水平、血清叶酸水平分析相关性,结果显示二者间呈正相关(r=0.695,p=0.03)。提示,叶酸缺乏引发的mir-375下调是cin进展、宫颈癌发生的关键分子事件。此外,本研究同时利用生物信息学技术对本研究中差异表达的14个mirnas分别通过搜索数据库(targetscan、miranda)进行靶基因预测,取交集部分,得到显著性趋势包含的差异mirna调控的所有靶基因共1263个。对这些靶基因进行go分析,发现这些差异mirna主要参与调节细胞大分子生物合成、细胞组分形态发生、大分子代谢、细胞内氮化合物生物合成、干细胞分化、细胞内成分结构、发育过程调控及表观遗传修饰等重要的分子生物过程;kegg分析发现这些差异mirna主要参与肿瘤发生、雌激素信号通路、黑色素生成、轴突导向、调节干细胞多能性信号通路、泛素化蛋白质水解等信号通路。提示,这些分子生物过程及信号通路可能是叶酸缺乏协同hr-hpv感染致宫颈癌变过程中的关键调控步骤。通过建立mirna-target-network、microrna-pathway-network,发现mir-18a-5p在2个网络中处于最核心的位置,表明其调控能力最强。mir-18a是mir-17-92基因簇的重要成员,对维持肿瘤细胞的正常增殖、分化至关重要。大多研究显示mir-18a在乳腺癌、神经胶质瘤、胰腺癌、肝癌、鼻咽癌、胃癌和前列腺癌中均为高表达,发挥癌基因的作用。然而,也有少许研究显示,过表达mir-18a可以抑制肿瘤细胞的增殖,诱导肿瘤细胞的凋亡。目前有关mir-18a在宫颈癌组织中的研究甚少。近期,lius等发现对宫颈癌组织中mir-18a的表达与放疗敏感性有关,过表达mir-18a可以抑制共济失调-毛细血管扩张突变基因的突变率、减弱dna双链断裂修复能力,提高放疗敏感性。本研究mirna芯片结果显示,与nc相比,mir-18a在hsil组织中表达下调,但在scc组织中表达上调。有待进一步通过大样本组织标本对mir-18a在不同宫颈组织中的表达进行验证。4结论4.1叶酸差异的不同宫颈组织中差异mirna的筛选及验证mirna芯片结果显示,与叶酸缺乏和宫颈病变进展均相关的特异性差异表达的mirna为14个,mir-10a,375在hsil中上调,但在scc中下调;mir-23a,18a在hsil中下调,但在scc中上调;mir-6774,21,3613,4730随着宫颈病变的进展呈一致性上调表达趋势;mir-1247,3607,224,30a,30c,196b随着宫颈病变的进展呈一致性下调表达趋势;其中,mir-375在scc组织中下调最为显著。qrt-pcr验证结果显示,mir-375在lsil、hsil和scc组的表达水平低于nc组,且与血清叶酸水平间呈正相关。14个mirna;mir-10a,mir-375,mir-23a,mir-18a,mir-6774,mir-21,mir-3613,mir-4730,mir-1247,mir-3607,mir-224,mir-30a,mir-30c,mir-196b。基因序列表。micrornanameidseq>hsa-mir-10a-5pmimat0000253uacccuguagauccgaauuugug>hsa-mir-10a-3pmimat0004555caaauucguaucuaggggaaua>hsa-mir-1247-5pmimat0005899acccgucccguucguccccgga>hsa-mir-1247-3pmimat0022721ccccgggaacgucgagacuggagc>hsa-mir-18a-5pmimat0000072uaaggugcaucuagugcagauag>hsa-mir-18a-3pmimat0002891acugcccuaagugcuccuucugg>hsa-mir-196b-5pmimat0001080uagguaguuuccuguuguuggg>hsa-mir-196b-3pmimat0009201ucgacagcacgacacugccuuc>hsa-mir-21-5pmimat0000076uagcuuaucagacugauguuga>hsa-mir-21-3pmimat0004494caacaccagucgaugggcugu>hsa-mir-6774-5pmimat0027448acuugggcaggagggacccuguaug>hsa-mir-6774-3pmimat0027449ucgugucccucuuguccacag>hsa-mir-23a-5pmimat0004496gggguuccuggggaugggauuu>hsa-mir-23a-3pmimat0000078aucacauugccagggauuucc>hsa-mir-3613-5pmimat0017990uguuguacuuuuuuuuuuguuc>hsa-mir-3613-3pmimat0017991acaaaaaaaaaagcccaacccuuc>hsa-mir-4730mimat0019852cuggcggagcccauuccaugcca>hsa-mir-3607-5pmimat0017984gcaugugaugaagcaaaucagu>hsa-mir-3607-3pmimat0017985acuguaaacgcuuucugaug>hsa-mir-224-5pmimat0000281caagucacuagugguuccguu>hsa-mir-224-3pmimat0009198aaaauggugcccuagugacuaca>hsa-mir-30a-5pmimat0000087uguaaacauccucgacuggaag>hsa-mir-30a-3pmimat0000088cuuucagucggauguuugcagc>hsa-mir-30c-5pmimat0000244uguaaacauccuacacucucagc>hsa-mir-30c-2-3pmimat0004550cugggagaaggcuguuuacucu>hsa-mir-30c-1-3pmimat0004674cugggagaggguuguuuacucc>hsa-mir-375mimat0000728uuuguucguucggcucgcguga当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1