一种测定核糖体失活蛋白活性的方法与流程
本发明属于生物化学分析检测技术领域,具体涉及一种测定核糖体失活蛋白活性的方法。
背景技术:
核糖体失活蛋白(ribosome-inactivating protein,RIP)是一类可使真核细胞核糖体失活而抑制蛋白质合成的植物毒蛋白,广泛存在于被子植物、细菌、真菌和藻类中。RIP具有广谱抗肿瘤、抗病毒、免疫调节等多种生物活性,而且对正常细胞毒性很小,近二十年来在全世界受到广泛的关注和研究。
但现阶段对RIP的开发有一个明显的问题——尚没有一种简单方便并且可靠的方法来测定RIP的活性。现有的方法大致有以下几种:第一,通过测定RIP体外抑制肿瘤细胞增殖来标定其活性,这种方法需要繁杂的细胞培养过程,测定时间长。第二,有研究者用同位素标记的方法测定RIP抑制体外无细胞系统合成蛋白质的效果。这种方法同样操作复杂,而且需要检测放射性同位素并保证无RNA酶污染,对实验室条件要求较高。第三,将rRNA与RIP反应后,用酸性苯胺处理,进行变性RNA电泳检测。但这种方法也需要保证无RNA酶干扰,而且只能定性的测定,难以定量。第四,将RIP与RNA反应后,使用RP-HPLC法检测游离腺嘌呤的释放量。这种方法可以准确的定量测定,但是同样要排除RNA酶的干扰,而且RP-HPLC一次只能测定一个样品,若有大量样品需要测定时就显得不方便。
公开号为104498494A的专利公开了一种利用质粒检测RIP活性的方法,但该方法需要通过琼脂糖凝胶电泳检测RIP的活性,定量效果不佳。亟待寻找一种能够定量测定RIP活性的有效且简便方法。
技术实现要素:
本发明的目的在于提供一种测定核糖体失活蛋白活性的显色液和方法。
本发明提供了一种用于核糖体失活蛋白活性测定的显色液,所述显色液是以浓度为0.05~0.2M、pH为6.5~7.3的HEPES-NaOH缓冲液或MES-NaOH缓冲液为基础溶液,且添加了终浓度为5~9U/mL的腺苷脱氨酶、4~6g/L的4-氨基安替比林、30~50mM的N-乙基-N-(2-羟基-3-磺丙基)-3-甲基苯胺钠盐、9~14U/mL的过氧化物酶和5~10U/mL黄嘌呤氧化酶。
0.05~0.2M:单位M即mol/L。
4-羟乙基哌嗪乙磺酸:HEPES;
2-(N-吗啡啉)乙磺酸:MES;
2-(N-吗啡啉)乙磺酸-NaOH缓冲液:MES-NaOH缓冲液;
N-乙基-N-(2-羟基-3-磺丙基)-3-甲基苯胺钠盐:TOOS。
其中,所述显色液是以浓度为0.1M、pH为7.0的MES-NaOH缓冲液为基础溶液,且添加了终浓度为6U/mL的腺苷脱氨酶、5g/L的4-氨基安替比林、40mM的N-乙基-N-(2-羟基-3-磺丙基)-3-甲基苯胺钠盐、9U/mL的过氧化物酶和6U/mL黄嘌呤氧化酶;
或,所述显色液是以浓度为0.1M、pH为7.0的MES-NaOH缓冲液为基础溶液,且添加了终浓度为5U/mL的腺苷脱氨酶、4g/L的4-氨基安替比林、35mM的N-乙基-N-(2-羟基-3-磺丙基)-3-甲基苯胺钠盐、10U/mL的过氧化物酶和8U/mL黄嘌呤氧化酶;
或,所述显色液是以浓度为0.1M、pH为7.0的MES-NaOH缓冲液为基础溶液,且添加了终浓度为8U/mL的腺苷脱氨酶、5g/L的4-氨基安替比林、50mM的N-乙基-N-(2-羟基-3-磺丙基)-3-甲基苯胺钠盐、12U/mL的过氧化物酶和10U/mL黄嘌呤氧化酶;
或,所述显色液是以浓度为0.2M、pH为7.3的HEPES-NaOH缓冲液为基础溶液,且添加了终浓度为9U/mL的腺苷脱氨酶、6g/L的4-氨基安替比林、40mM的N-乙基-N-(2-羟基-3-磺丙基)-3-甲基苯胺钠盐、13U/mL的过氧化物酶、8U/mL黄嘌呤氧化酶。
其中,所述显色液中还包括终浓度为0.3~0.5g/L的NaN3和1~2mL/L的Triton X-100;
进一步地,所述显色液中还包括终浓度为0.3g/L的NaN3和2mL/L的Triton X-100。
本发明还提供了上述显色液在核糖体失活蛋白活性测定中的用途。
本发明还提供了一种测定核糖体失活蛋白活性的方法,它包括如下步骤:
a.取核糖体失活蛋白或包含核糖体失活蛋白的溶液,作为待测样品;
b.取核糖体失活蛋白或包含核糖体失活蛋白的溶液,煮沸2~3min,作为空白对照;
c.将待测样品、空白对照分别加入等体积浓度为40~80mM的底物溶液,混匀,在50~55℃条件下孵育20~35min,然后煮沸3min,5000~10000g离心1~2min,取上清液;
其中,所述底物溶液的配制如下:称取rRNA类似物,用浓度为0.01~0.05M、pH为2.0~3.0的缓冲液溶解并稀释,所述缓冲液为磷酸氢二钠-柠檬酸缓冲液、氢氧化钠-柠檬酸-盐酸缓冲液、甘氨酸-盐酸缓冲液或乙酸-乙酸钠缓冲液;
所述rRNA类似物为能被核糖体失活蛋白催化释放出腺嘌呤的化合物;
d.取步骤c的上清液,加入3倍体积的上述显色液,混匀,35~45℃孵育25~40min;
e.以空白对照调零点,分光光度计法测定待测样品在500~600nm波长条件下的光吸收值;
f.根据光吸收值,计算酶活,即可。
包含核糖体失活蛋白的溶液:比如可以是核糖体失活蛋白粗酶液。
测定光吸收值用可见或紫外可见分光光度计,普通比色皿或微量比色皿,以空白管调零点,测定光吸收值。
其中,步骤a和/或b中,核糖体失活蛋白为α-苦瓜素、MAP30、天花粉蛋白。
其中,步骤a中,对核糖体失活蛋白或粗酶液进行稀释,使待测样品按照步骤a-e反应后,在500~600nm波长条件下的光吸收值控制在0.1~0.4;
进一步地,稀释溶剂为浓度为0.01~0.05M、pH为2.0~3.0的磷酸氢二钠-柠檬酸缓冲液、氢氧化钠-柠檬酸-盐酸缓冲液或乙酸-乙酸钠缓冲液。
其中,步骤c中,待测样品或空白对照与底物溶液混合前,待测样品、空白对照、底物溶液均分别在50~55℃,下孵育2~5min;
和/或,步骤c中,待测样品、空白对照分别加入底物溶液,混匀,孵育时间为25~35min;然后煮沸3min,离心条件为8000g/min离心1min;
和/或,步骤c中,所述rRNA类似物为AMP、NAD+或NADH。
其中,步骤d中,孵育温度为40℃,孵育时间为25~30min;
步骤e中,所述波长为555nm。
核糖体失活蛋白活性单位定义为:在本实验条件下,每分钟催化底物释放1μmol腺嘌呤的酶量为1U。
其中,步骤f中,计算酶活的方法如下:
按照以下公式计算得出待测样品液(核糖体失活蛋白)的相对酶活性:
ΔA:样品吸光度值变化量;0.2142:在555nm波长下,1A对应的腺嘌呤浓度(mM);Vt:反应总体积(mL);103:1mM=103μM;df:酶液稀释倍数;t:酶和底物的准确反应时间(min);Ve:酶液体积(mL);D:比色皿光径(1cm);Vr:与偶联酶显色液起反应的体积(mL);C:蛋白质浓度(mg/mL)。
本发明所涉及的各缓冲液制备方法如下:
1、0.05~0.2M、pH为6.5~7.3的MES-NaOH缓冲液
配制0.3M的MES溶液,然后用氢氧化钠调节pH至7.0-7.3,用ddH2O稀释成相应的浓度。
2、0.05~0.2M、pH为6.5~7.3的HEPES-NaOH缓冲液
配制浓度为0.3M的HEPES溶液,然后用氢氧化钠调节pH至6.5-7.3,用ddH2O稀释成相应的浓度。。
3、浓度为0.01~0.05M、pH为2.0~3.0的磷酸氢二钠-柠檬酸缓冲液
分别配制0.01~0.05M的磷酸二氢钠和柠檬酸溶液,以一定比例混合后测pH达2.0~3.0。
4、浓度为0.01~0.05M、pH为2.0~3.0的氢氧化钠-柠檬酸-盐酸缓冲液柠檬酸21g,NaOH8.4g和浓盐酸16mL混合后加ddH2O溶解至1000ml。
5、浓度为0.01~0.05M、pH为2.0~3.0的乙酸-乙酸钠缓冲液
分别配制0.01M~0.05M的乙酸和乙酸钠溶液,取适量乙酸溶液,逐步加入乙酸钠溶液,用pH计测量并控制混合液pH值,当pH=2时停止加入乙酸钠溶液,止时为0.01~0.05mol/L、pH 2.0的乙酸-乙酸钠缓冲液。
本发明提供的显色液可以用于核糖体失活蛋白的活性检测,本发明方法可以有效测定核糖体失活蛋白的活性,反应灵敏、准确可靠,而且可避免传统RNA酶对反应的干扰;另外本发明操作简单、成本低廉,只需分光光度计就能完成定量测定过程。
使用本发明方法可以用来分析比较不同来源RIP活性的大小;在RIP分离和纯化过程中,检测或跟踪不同阶段目的蛋白的去向或活性回收情况;检测植物、微生物等中核糖体失活蛋白基因的表达状况;评价RIP结构改造(如聚乙二醇化学修饰、定点突变等)前后的活性变化等,在RIP的研究和开发领域,具有广泛的实际应用前景。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
图1为三种核糖体失活蛋白与五种rRNA类似底物反应产生腺嘌呤的硅胶薄板层析图谱图;
a为标准品,各道底物分别为1.AMP;2.ATP;3.NAD+;4.NADH;5.NADP+;6.腺嘌呤;b为对照组,即先将MAP30煮沸失活,然后与各底物反应。各道底物分别为1.AMP;2.ATP;3.NAD+;4.NADH;5.NADP+;c为反应组,将MAP30分别与各种底物,在55℃反应2h。各道底物分别为1.AMP;2.ATP;3.NAD+;4.NADH;5.NADP+;6为释放的腺嘌呤。
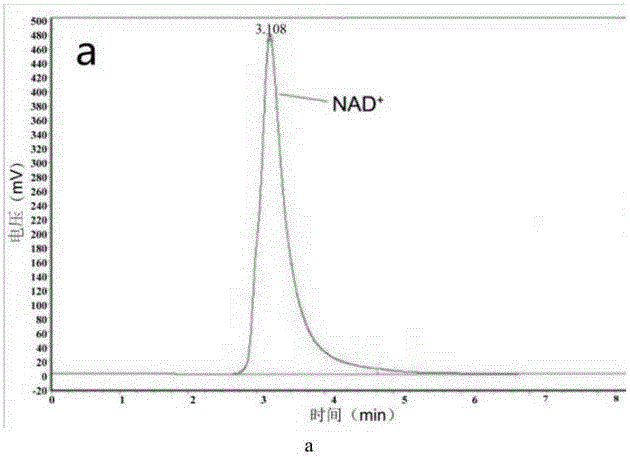
图2为标准品NAD+和标准品腺嘌呤在RP-HPLC上的层析图谱;
a为NAD+标准品;b为腺嘌呤标准品。
图3在pH2.0、4.0和6.0条件下,MAP30与NAD+反应产物的RP-HPLC检测结果图;
a:pH2.0;b:pH 4.0;c:pH 6.0。
图4在pH2.0、4.0和6.0条件下,α-MMC与NAD+反应产物的RP-HPLC检测结果图;
a:pH2.0;b:pH 4.0;c:pH 6.0。
图5为高浓度腺嘌呤与偶联酶显色液反应的工作曲线图。
图6为低浓度腺嘌呤与偶联酶显色液反应的工作曲线图。
图7为pH对核糖体失活蛋白活性的影响图;
a:α-MMC;b:MAP30;c:TCS。
图8为核糖体失活蛋白浓度对催化水解NAD+释放腺嘌呤影响图;
a:α-MMC;b:MAP30;c:TCS。
图9为反应时间对RIP催化NAD+释放腺嘌呤的影响图。
图10为NAD+浓度对核糖体失活蛋白活性的影响图。
图11为温度对RIP催化NAD+释放腺嘌呤的影响图;
a:α-MMC;b:MAP30;c:TCS。
具体实施方式
下面以实施例作进一步说明,但本发明不局限于这些实施例。
本发明所用的主要实验试剂和仪器如下:
试剂:2-(N-吗啡啉)乙磺酸或4-羟乙基哌嗪乙磺酸、N-乙基-N-(2-羟基-3-磺丙基)-3-甲基苯胺钠盐(TOOS)、AMP、ATP、NAD+、NADH、NADP+为Sigma试剂,4-氨基安替比林为麦克林试剂;黄嘌呤氧化酶、腺苷脱氨酶或腺嘌呤脱氨酶、过氧化物酶为上海蓝园生物工程有限公司产品;其它试剂均为国产A.R级(分析纯)。
仪器:UV-2102C/PC/PCS型分光光度计为尤尼柯(上海)仪器有限公司产品。
实施例1本发明显色液的制备
本发明所使用的显色液为检测腺嘌呤含量的偶联酶试剂,显色液在使用前新鲜超纯水配制,呈无色透明溶液,4℃保存,若含有稳定剂有效期至少3个月。若在测定时发现空白管的光吸收值大于0.01时,则应重新配制。
偶联酶显色液配制如下:
取0.1M、pH7.0的MES-NaOH缓冲液,依次加入TOOS、4-氨基安替比林、过氧化物酶、腺苷脱氨酶、黄嘌呤氧化酶,最后加入MES-NaOH缓冲液定容,使得显色液中含有终浓度为40mM的TOOS、5g/L的4-氨基安替比林、9U/mL的过氧化物酶、6U/mL的腺苷脱氨酶、6U/mL黄嘌呤氧化酶。即为本发明的显色液,将其置于棕色瓶中,于4℃保存备用。
实施例2本发明显色液的制备
取0.1M、pH7.0的MES-NaOH缓冲液,依次加入TOOS、4-氨基安替比林、过氧化物酶、腺苷脱氨酶、黄嘌呤氧化酶,最后加入MES-NaOH缓冲液定容,使得显色液中含有终浓度为35mM的TOOS、4g/L的4-氨基安替比林、10U/mL的过氧化物酶、5U/mL的腺苷脱氨酶、8U/mL黄嘌呤氧化酶。即为本发明的显色液,将其置于棕色瓶中,于4℃保存备用。
实施例3本发明显色液的制备
取0.2M、pH7.3的HEPES-NaOH缓冲液,依次加入TOOS、4-氨基安替比林、过氧化物酶、腺苷脱氨酶、黄嘌呤氧化酶,最后加入HEPES-NaOH缓冲液定容,使得显色液中含有终浓度为40mM的TOOS、6g/L的4-氨基安替比林、13U/mL的过氧化物酶、9U/mL的腺苷脱氨酶、8U/mL黄嘌呤氧化酶。即为本发明的显色液,将其置于棕色瓶中,于4℃保存备用。
实施例4本发明显色液的制备
取0.1M、pH7.0的MES-NaOH缓冲液,依次加入TOOS、4-氨基安替比林、过氧化物酶、腺苷脱氨酶、黄嘌呤氧化酶、NaN3和Triton X-100,最后加入MES-NaOH缓冲液定容,使得显色液中含有终浓度为40mM的TOOS、5g/L的4-氨基安替比林、9U/mL的过氧化物酶、6U/mL的腺苷脱氨酶、6U/mL黄嘌呤氧化酶、0.3g/L的NaN3、2mL/L的Triton X-100。即为本发明的显色液,将其置于棕色瓶中,于4℃保存备用。
实施例5核糖体失活蛋白活性测定-α-苦瓜素(α-MMC)
本发明方法(偶联酶显色法测定核糖体失活蛋白活性的方法)的工作原理为:根据核糖体失活蛋白(RIP)催化AMP、NAD+和NADH中N-糖苷键断裂而释放出产物-腺嘌呤的特点,再经腺苷脱氨酶、黄嘌呤氧化酶和过氧化物酶以及辅助试剂:N-乙基-N-(2-羟基-3-磺丙基)-3-甲基苯胺钠盐(TOOS)、4-氨基安替比林(4-AA)等构成的显色剂显色,测定显色产物的光吸收值,即可间接反映出核糖体失活蛋白的生物活性。其原理如下所示:
操作方法如下:
a.底物的配制:称取适量的NAD+粉末,用浓度为0.04M、pH2.5的乙酸-乙酸钠缓冲液溶解并使浓度达到40mM。
b.待测样品的稀释:取待测蛋白样品α-苦瓜素(α-MMC),以牛血清白蛋白为对照,测定蛋白含量为0.5mg/mL。
c.测试样品:将待测样品与底物溶液,在55℃水浴中分别预热2min,然后各取100μL混合,立即置于55℃准确反应30min,立即煮沸3min终止反应。将反应液8000g离心1min,收集上清液。
空白管:先将酶于100℃处理2min失活,再加底物。其它过程同样品管。
d.显色过程:取上清液100μL与300μL显色液(显色液配制:0.1M、pH7.0的MES-NaOH缓冲液、腺苷脱氨酶5U/mL、4-氨基安替比林4g/L、TOOS35mM、过氧化物酶10U/mL和黄嘌呤氧化酶8U/mL)。于37℃水浴保温30min。
e.测定过程:
光径为1cm比色皿,以空白管调零点,测定样品管在555nm波长下的吸收值为0.24。
按照以下公式计算得出待测样品液的酶活性:U/mL=34U,U/mg=70U
ΔA:样品吸光度值变化量;0.2142:在555nm波长下,1A对应的腺嘌呤浓度(mM);Vt:反应总体积(mL);103:1mM=103μM;df:酶液稀释倍数;t:酶和底物的准确反应时间(min);Ve:酶液体积(mL);D:比色皿光径(1cm);Vr:与偶联酶显色液起反应的体积(mL);C:蛋白质浓度(mg/mL)。
本实施例所用的核糖体失活蛋白α-MMC(α-苦瓜素)可通过购买市售产品获得,也可采用现在文献报道方法制备,本发明采用如下方法制备:
α-MMC从蓝山长白苦瓜种子中提取,方法为:将苦瓜种子剥壳取出苦瓜籽,经过粉碎、抽提、酸化、中和、硫酸铵分级沉淀、透析、阳离子交换层析、分子筛层析或结合Blue-Sepharose亲合层析获得。得到的α-MMC借用SDS-PAGE、Acid PAGE、IEF-PAGE和MALDI-TOF-TOF以及N-末端测序进行鉴定。蛋白含量以牛血清白蛋白为标准,采用Lowry法测定。
实施例6核糖体失活蛋白活性测定-MAP30
操作方法如下:
a.底物的配制:称取适量NAD+粉末,用浓度为0.05M、pH3.0的磷酸氢二钠-柠檬酸缓冲液溶解并使NAD+浓度达50mM。
b.待测样品的稀释:取待测蛋白样品MAP30,用双蒸水稀释到浓度为0.1mg/mL。
c.反应过程:将100μL待测样品和100μL底物分别于52℃孵育预热3min。然后各取100μL混合,立即置于52℃准确反应30min,立即煮沸3min终止反应。空白管:将酶于100℃处理2min失活,再加底物。其它过程同样品管。
d.显色过程:将上一步的反应液5000g离心1min,取上清液50μL与150μL显色液混合,35℃水浴保温35min;
所述偶联酶显色液由下述浓度的组分组成:0.1MpH7.0的MES-NaOH缓冲液、4-氨基安替比林5g/L、过氧化物酶12U/mL、腺苷脱氨酶8U/mL、黄嘌呤氧化酶10U/mL和TOOS 0.05M。
e.测定过程:光径为1cm比色皿,以空白管调零点,测定样品管在550nm波长下的吸收值为0.21。
按照以下公式计算得出待测样品液的酶活性:U/mL=30U,U/mg=310U
ΔA:样品吸光度值变化量;0.2142:在555nm波长下,1A对应的腺嘌呤浓度(mM);Vt:反应总体积(mL);103:1mM=103μM;df:酶液稀释倍数;t:酶和底物的准确反应时间(min);Ve:酶液体积(mL);D:比色皿光径(1cm);Vr:与偶联酶显色液起反应的体积(mL);C:蛋白质浓度(mg/mL)。
本实施例所用的核糖体失活蛋白MAP30(Momordica Antiviral Protein30kD,苦瓜抗艾滋病毒蛋白)可通过购买市售产品获得,也可采用现在文献报道方法制备,本发明采用如下方法制备:
MAP30从市售苦瓜种子中提取,方法为:将苦瓜种子剥壳取出苦瓜籽,经过粉碎、抽提、酸化、中和、硫酸铵分级沉淀、透析、阳离子交换层析、分子筛层析、阳离子层析最后脱盐并分装除菌,得到的MAP30经过SDS-PAGE、Acid PAGE、IEF-PAGE、MALDI-TOF-TOF等方法鉴定。用Lowry法测定蛋白含量,以牛血清白蛋白为标准,制作标准蛋白质曲线。
实施例7核糖体失活蛋白活性测定-天花粉蛋白(TCS)
操作方法如下:
a.底物的配制:称取适量的NAD+粉末,用浓度为0.02M、pH3.0的乙酸-乙酸钠缓冲液溶解并使浓度达到45mM。
b.待测样品的稀释:取待测天花粉蛋白(TCS),用双蒸水稀释至0.5mg/mL。
c.反应过程:将100μL待测样品和100μL底物分别于55℃孵育预热3min。然后各取100μL混合,立即置于55℃准确反应30min,立即煮沸3min终止反应。空白管:将酶于100℃处理2min失活,再加底物。其它过程同样品管。
d.显色过程:将上一步的反应液6000g离心1min,取上清液100μL与300μL的显色液37℃水浴保温35min;
所述偶联酶显色液由下述浓度的组分组成:0.2M、pH7.3的HEPES-NaOH缓冲液、腺苷脱氨酶9U/mL、4-氨基安替比林6g/L、TOOS 40mM、过氧化物酶13U/mL、黄嘌呤氧化酶8U/mL、NaN30.3g/L和Triton X-100 2mL/L。
e.测定过程:光径为1cm比色皿,以空白管调零点,测定样品管在550nm波长下的吸收值为0.22。
按照以下公式计算得出待测样品液的酶活性为U/mL=34U,U/mg=65U。
ΔA:样品吸光度值变化量;0.2142:在555nm波长下,1A对应的腺嘌呤浓度(mM);Vt:反应总体积(mL);103:1mM=103μM;df:酶液稀释倍数;t:酶和底物的准确反应时间(min);Ve:酶液体积(mL);D:比色皿光径(1cm);Vr:与偶联酶显色液起反应的体积(mL);C:蛋白质浓度(mg/mL)。
本实施例所用的核糖体失活蛋白天花粉蛋白(TCS)可通过购买市售产品获得,也可采用现在文献报道方法制备,本发明采用如下方法制备:
TCS是从瓜蒌块茎中分离纯化而来,纯化经过以下步骤:
(1)粉碎:先用研钵将晒干的瓜蒌块茎研成小块,随后用打粉机将其打成粉末,过80目钢筛,收集粉末。
(2)抽提:加入相当于粉末质量5~6倍体积的磷酸缓冲液(含有0.15MNaCl、浓度为50mM、pH6.0的磷酸缓冲液),搅拌过夜,尼纶布过滤。
(3)硫酸铵分级分离:12000g离心10min,收集上清。4℃下磁力搅拌缓慢加入硫酸铵粉末于上清液中,使硫酸铵饱和度达80%,静置2h后,12000g离心20min,弃去上清并回收沉淀。
(4)透析:将沉淀用最小体积的浓度为10mM、pH6.0磷酸缓冲液充分溶解,装入截留分子量10000的透析袋中,对浓度为10mM、pH6.0的磷酸缓冲液透析除去硫酸铵。
(5)离子交换层析:将透析样品12000g离心5min去除不溶解的杂质,然后将样品上SP-Sepharose F.F.层析柱,用同样缓冲液充分洗涤柱,换用0.1MNaCl的同样缓冲液洗脱,收集蛋白峰。
(6)亲和层析:将上步样品上Blue-sepharose F.F.层析柱,用pH6.0 30mM磷酸缓冲液充分洗涤柱,然后换用含0.5M NaCl、浓度为50mM、pH6.0磷酸缓冲液洗脱,收集蛋白峰。
得到的TCS经过SDS-PAGE、Acid PAGE和MALDI-TOF-TOF鉴定并用Lowry法测定蛋白含量。
以下用试验例的方式说明本发明的有益效果:
试验例1核糖体失活蛋白对rRNA类似物底物的筛选试验
一、试验材料
分别取实施例5-7中使用的待测蛋白样品α-MMC、MAP30和TCS。
二、硅胶薄板层析分析法筛选rRNA类似物底物
1.硅胶薄板的活化
将长20cm硅胶板置于烘烤箱中110℃烘烤2h,待其冷却后放入干燥器中待用。
2.核糖体失活蛋白与rRNA类似物反应产物的制备
分别称取NAD+、NADH、NADP+、AMP、ATP的粉末,用0.1M、pH3.0的磷酸氢二钠-柠檬酸缓冲液溶解使得每种底物的浓度均为40mM。
将制备的α-MMC、MAP30和TCS溶液分别用蒸馏水稀释至2mg/mL、0.4mg/mL和2mg/mL。取50μL RIP溶液与50μL底物溶液混合,置于55℃水浴中保温反应2h。
同时空白对照组为取相应的RIP溶液50μL,100℃处理3min,再加入50μL底物,55℃保温2h。
3.硅胶薄板层析
用微量进样器取标准品、空白对照和反应混合溶液各10μL,分别点在离硅胶薄层板下边缘0.6cm处,点样点间隔距离为1.0cm。将硅胶板倾斜放入层析缸中,点样的一端边缘浸入展开剂中上行展开。展开剂的组成为正丁醇:水:乙酸=5:2:3(v/v)。展开剂上行展开至距离硅胶板上边缘0.5cm时将硅胶板从层析缸中拿出,并用吹风机冷风吹干,在紫外分析仪下观察,记录下斑点位置,做出示意图。结果如图1和表1所示。
表1:薄板层析检测三种核糖体失活蛋白催化五种rRNA类似底物产生腺嘌呤能力
注:“+”表示有腺嘌呤产生;“—”表示没有腺嘌呤产生。“+”的多少表示观察到腺嘌呤斑点的强弱。
由表1和图1可知,与五种rRNA类似的小分子底物反应后,三种核糖体失活蛋白均能与NAD+、NADH和AMP反应并水解底物中的N-糖苷键而释放出腺嘌呤,定性的观察到三种酶蛋白与NAD+反应时能释放出最大量的腺嘌呤,NADH次之,AMP最少;而三种核糖体失活蛋白与ATP和NADP+反应产物中未检测到腺嘌呤的产生,
说明NAD+、NADH和AMP均可以作为核糖体失活蛋白酶学反应的rRNA类似物底物,其中,尤其NAD+为底物时的催化效果最好。
三、RP-HPLC(反相高效液相色谱)法检测
1.核糖体失活蛋白与rRNA类似底物反应产物的制备
称取NAD+粉末,用不同pH0.1M缓冲液溶解粉末使其浓度为40mM。不同pH缓冲液分别为:pH2.0甘氨酸-盐酸缓冲液;pH4.0乙酸-乙酸钠缓冲液;pH6.0磷酸氢二钠-磷酸二氢钠缓冲液。
用双蒸水稀释α-MMC和MAP30样品,分别为1mg/mL和0.2mg/mL。取0.1mL两种蛋白溶液分别与0.1mL不同pH缓冲体系的NAD+溶液混合,立即于55℃孵育,准确反应1h后,煮沸3min终止反应,随后8000g离心1min。在反应液中加入0.5ml冷无水乙醇,充分混匀,置于4℃冰箱中静置30min,12000g离心5min,吸出上清液备用。
2.RP-HPLC检测
流动相为含有32%(v/v)甲醇的pH7.5 40mM硼砂-磷酸二氢钠缓冲液,并用0.45μm膜过滤和超声波脱气。反相色谱柱为Grace Smart C18柱(150mm×46mm)。进样前先用流动相冲洗色谱柱直到基线平稳,流速为0.5mL/min,进样体积为20μL,在线检测器检测波长设定为260nm。标准品为10mM NAD+和10mM腺嘌呤溶液(溶剂:pH2.0、0.1M的乙酸-乙酸钠缓冲液),其它处理同上。层析结果如图2、图3、图4所示。
由图2可知,NAD+标准品的保留时间为3.2min,腺嘌呤标准品的保留时间为5.7min。图3和图4中分别反映了MAP30和α-MMC在不同pH条件下催化NAD+释放腺嘌呤的检测结果。可以看出,α-MMC和MAP30均能催化NAD+释放出腺嘌呤,释放腺嘌呤的保留时间与腺嘌呤标准品一致;随着反应pH值升高,催化释放出的腺嘌呤活性逐渐减少。
综上,核糖体失活蛋白能够催化NAD+、NADH和AMP的N-糖苷酶水解并释放出游离的腺嘌呤,NAD+、NADH和AMP均可以作为核糖体失活蛋白酶学反应的rRNA类似物底物,其中,尤其NAD+为底物时的催化效果最好。
试验例2本发明显色液的灵敏度检测
(1)偶联酶显色液
10mL 0.2M、pH7.0的MES-NaOH缓冲液
160μL TOOS
160μL 4-氨基安替比林160μL过氧化物酶(1U/μL)
100μL腺苷脱氨酶(1U/μL)
100μL黄嘌呤氧化酶(1U/μL)
按上述顺序依次加入,用MES-NaOH缓冲液定容至15mL。显色液中TOOS终浓度为40mM,4-氨基安替比林终浓度为5g/L。
将显色液置于棕色瓶中,4℃保存。
(2)标准腺嘌呤
先称取适量的腺嘌呤粉末,用双蒸水溶解并使之浓度达到0.5mM,然后按照表2进行稀释得到不同浓度的腺嘌呤水溶液。
表2 不同浓度腺嘌呤水溶液的配制过程
(3)反应过程和检测
取50μL不同浓度的腺嘌呤与150μL偶联酶显色液混合,37℃水浴保温20min。用分光光度计测定其在550nm处的光吸收值。以腺嘌呤浓度对A550nm作图,即为腺嘌呤工作曲线。
结果见图5(低浓度)、图6所示(高浓度),可以看出:无论腺嘌呤在低浓度,还是在高浓度,R2值能够达到>0.99。表明均显示良好的线性关系;腺嘌呤在低浓度时,最小检测浓度为0.025mM,在高浓度时,最大检测浓度为0.2mM。说明本发明的显色液能完全转化RIP催化水解rRNA底物类似物释放的腺嘌呤,本发明显色液的灵敏度高。
试验例3本发明方法的准确性验证
1、pH对核糖体失活蛋白活性的影响
(1)称取NAD+粉末,用适量的不同pH的缓冲液溶解粉末使其浓度为40mM。不同pH,0.01M的缓冲液分别为:pH2.0至pH7.0磷酸氢二钠-柠檬酸缓冲液;pH8.0~pH9.0为巴比妥-盐酸缓冲液。
(2)取适量的α-MMC、MAP30和TCS的母液,分别用双蒸水稀释,使最终反应后测定的OD555nm达到0.1-0.5。将50μL蛋白溶液加入50μL不同底物的不同pH溶液中,并马上置于55℃水浴中保温,准确反应30min,立刻煮沸3min终止反应。
空白对照组为先将蛋白溶液煮沸2min使之失活,其它操作过程同上。
(3)将煮沸终止的反应液6000g离心1min,吸取50μL反应液与150μL实施例1的偶联酶显色液混合,于37℃水浴中保温25min。将反应液转移到光径为1cm微量石英比色皿中,用紫外可见光分光光度计测定其在555nm处的光吸收值,以不同pH下的相对活性作图。
结果如图7所示。
由图7可见,三种核糖体失活蛋白与NAD+在不同pH条件下进行反应,它们均能催化NAD+释放腺嘌呤,其活性随着pH值的升高而降低。因此,本发明方法中选择了pH为2-3的缓冲液,此时核糖体失活蛋白活性最佳。
2、核糖体失活蛋白浓度对催化NAD+释放腺嘌呤的影响
A.试剂配制
不同浓度RIP:将α-MMC和TCS母液用双蒸水分别稀释至0.05mg/mL、0.1mg/mL、0.2mg/mL、0.5mg/mL、0.7mg/mL和1mg/mL;将MAP30母液稀释至0.01mg/mL、0.03mg/mL、0.05mg/mL、0.1mg/mL、0.15mg/mL和0.2mg/mL。
底物的配制:0.01M、pH3.0的磷酸氢二钠-柠檬酸缓冲液为溶剂,使NAD+为40mM。
B.反应过程
取100μL不同浓度的RIP溶液与100μL底物溶液混合,立即于55℃准确反应30min,立即煮沸3min终止反应,将反应液8000g离心1min,收集上清液。
C.显色过程
取100μL上清液与300μL实施例1的显色液混合,37℃水浴保温25min。
D.测定过程
用分光光度计,光径为1cm微量石英比色皿,测定在500nm波长下的吸收值。以A500对不同浓度RIP作图,结果见图8所示。
根据酶促反应动力学原理,酶浓度是影响酶促反应速度的主要因素之一,也是酶促反应动力学的显著特征之一。即在特定条件下,随着酶浓度增加反应速度增加,也就是说,酶浓度与反应速度呈正比关系。
由图8可见,不同浓度的核糖体失活蛋白催化水解NAD+释放出的腺嘌呤量呈现线性的正比关系,其结果符合酶促反应动学力学的特征。
因此,本发明方法可以测定不同浓度核糖体失活蛋白的活性,结果准确可靠。
3、反应时间对RIP催化NAD+释放腺嘌呤的影响
用双蒸水分别稀释α-MMC、MAP30和TCS至1mg/mL、0.2mg/mL和1mg/mL,其它操作过程同上述2。
三种核糖体失活蛋白与NAD+进行反应,并于不同反应时间取样,再与偶联酶试剂反应后,检测腺嘌呤的释放量。结果见图9所示。
由图9可见,在相同浓度的RIP下,随着反应时间的增长,释放出的游离腺嘌呤量也在增加。当反应到一定时间后,反应速度处于稳定的状态。反应时间在60min内的速度,即代表三种核糖体失活蛋白的反应初速度。
因此,反应时间对RIP催化NAD+释放腺嘌呤的影响结果,它遵循和符合酶促反应动力学的规律。
4、底物浓度对酶促反应速度的影响
反应总体积为0.3mL,由0.15mL的终浓度为1mM~30mM的NAD+(溶剂为pH3.0 0.02M磷酸氢二钠-柠檬酸缓冲液)和0.15mL水稀释的MAP30组成。
于55℃准确反应50min,然后煮沸3min终止反应,10000g离心2min,取上清液0.1mL与偶联酶试剂0.3mL,37℃反应保温0.5h。测定555nm光吸收值,以555nm光吸收值对底物浓度作图。结果见图10。
在生化反应中,若酶的浓度为定值,底物的起始浓度较低时,酶促反应速度与底物浓度成正比,即随底物浓度的增加而增加。当所有的酶与底物结合生成中间产物后,即使在增加底物浓度,中间产物浓度也不会增加,酶促反应速度也不增加。由图10可见,MAP30催化释放腺嘌呤的反应中,当浓度较低时,随着NAD+浓度的增加,释放出的腺嘌呤量与NAD+浓度成正比。当NAD+浓度达到较高时,释放出的腺嘌呤量也不再增加。
因此,MAP30催化NAD+释放腺嘌呤的反应,遵循酶促反应动力学-底物浓度对反应速度影响的双曲线特征。
α-MMC和TCS也可获得与MAP30类似的结果。
5、温度对酶促反应速度的影响
取100μL不同浓度的RIP(α-MMC 1mg/mL,MAP30 0.2mg/mL和TCS1.5mg/mL,水为溶剂)分别与100μL 40mM NAD+(溶剂为0.1M、pH3.0的磷酸氢二钠-柠檬酸缓冲液),在40~80℃准确反应30min,100℃加热3min终止反应。将反应液在10000g离心3min,取上清液0.1mL与0.3mL偶联酶试剂混合,置于37℃孵育30min。然后测定555nm光吸收值,以555nm光吸收值对不同温度作图,结果见图11。
由图11可见,α-MMC、MAP30和TCS的最适温度均为50~55℃,低于此温度时,其活性随温度的升高而升高;高于此温度时,它们的活性随温度的升高逐渐降低,表现出快速失活的特征。因此,本发明选择反应温度为50~55℃。
本试验例通过验证pH对核糖体失活蛋白活性的影响,核糖体失活蛋白浓度、反应时间对催化NAD+释放腺嘌呤的影响,底物浓度、温度对酶促反应速度的影响,确定了本发明酶促反应与理论是一致的,说明用本发明方法本发明方法检测核糖体失活蛋白的活性的准确性。
综上,本发明的显色液可以用于核糖体失活蛋白的活性检测,本发明的核糖体失活蛋白测定方法准确性高,反应灵敏,操作简单,而且可避免传统RNA酶对反应的干扰,应用前景良好。
- 还没有人留言评论。精彩留言会获得点赞!