一种重组赖氨酸特异性酶的制备方法与流程
本发明涉及基因工程技术领域。具体地,本发明提供了一种重组赖氨酸特异性酶(Lysine-specific endoprotease,Lys-C)的高效制备方法,包括工程菌的构建、重组赖氨酸特异性酶的表达与纯化。
背景技术:
赖氨酸特异性酶(Lysine-specific endoprotease)是一种碱性蛋白酶,分子量约为26kD,属于丝氨酸蛋白酶家族成员之一。作为一种高纯度蛋白酶,它能特异水解Lys的羧基端(与精氨酸相连时除外),可以产生比Trypsin多的酶解肽段,可用于通过肽质谱指纹印迹或MS/MS光谱匹配进行蛋白鉴定,因此在蛋白质组学分析中有着很好的应用前景。另外,因其高度的专一性和高酶切活性,Lys-C也可用于重组蛋白工业生产中的前体切割(如胰岛素前体),因此Lys-C目前在基因工程制药领域成为蛋白表达下游纯化的重要工具酶,尤其适用于生物工程制药业及基因工程、生物化学、分子生物学研究。
目前市场上的赖氨酸特异性酶大多为天然菌种的表达产物,已知有三种微生物可合成Lys-C:产酶溶杆菌,水解无色杆菌,铜绿假单胞菌。赖氨酸特异性酶主要由产酶溶杆菌表达生产,其次为水解无色杆菌培养液中分离得到。天然提取的Lys-C价格极为昂贵,如Promega的Lys-C市价约为370元/μg。同时产酶溶杆菌作为Lys-C的主要产生菌,生产效率不高,发酵周期较长,且提取工艺比较复杂,这些大大限制了Lys-C的广泛应用。
目前天然提取的赖氨酸特异性酶不仅有限,而且成本高、得率低,也容易被其它杂质污染,从而导致目的蛋白降解。同时国内目前还未有赖氨酸特异性酶重组生产的企业,而进口rLys-c的价格较昂贵,大量购买进口rLys-c将会大大提高药物生产成本,因此,建立一种快速、简便、稳定、活性高rLys-C的生产方法,对于基因工程药物的开发以及生物学研究具有重要的应用与研究价值。
技术实现要素:
本发明为了克服上述现有技术的缺陷和不足,提供了一种重组赖氨酸特异性酶制备方法,涉及重组赖氨酸特异性酶基因序列的设计、含有该基因的重组表达载体和基因工程菌的构建及重组赖氨酸特异性酶的制备方法。为重组赖氨酸特异性酶的工业生产提供了有效途径。
本发明一方面提供了一种高效表达重组赖氨酸特异性酶,该酶的DNA序列为SEQ ID NO:1。
上述重组赖氨酸特异性酶的氨基酸,其序列为SEQ ID NO:2。
一种重组载体,含有序列SEQ ID NO:1的pPIC9k-PIV。
本发明的技术方案另一方面提供了一种高效表达重组赖氨酸特异性酶的工程菌,所述工程菌为含序列SEQ ID NO:1的毕赤酵母菌。
在本发明的一些实施方式中,所述的工程菌为GS115/pPIC9k-PIV。
本发明的技术方案同时提供了一种高效表达重组赖氨酸特异性酶工程菌的构建方法,包括以下步骤:
1)获得优化的DNA序列SEQ ID NO:1,在其C端添加6×His标签,并在基因序列5’端和3’端分别添加合适酶切位点与相Kex2位点,最终进行全基因合成,获得PIV;
2)将连接有前导肽α因子的PIV插入质粒pPIC9k中,得重组质粒pPIC9k-PIV;
3)将上述所得质粒pPIC9k-PIV进行Sac线性化,并电转至毕赤酵母GS115菌株中,经培养与酶活检测,筛选得高产菌株GS115/pPIC9k-PIV。
一种利用上述基因工程菌生产重组赖氨酸特异性酶的方法,包括以下步骤,培养基因工程菌,并获得重组表达的重组赖氨酸特异性酶。
一种利用上述基因工程菌生产重组赖氨酸特异性酶的方法,其特征在于,包括以下步骤:
a)赖氨酸特异性酶高产菌株的筛选:将菌株接种至一级培养基中,在28-30℃培养至OD600为15-20时,转接至二级培养基中,28-30℃下震荡培养,每8-12h补加甲醇进行诱导表达,发酵12-120h后停止,离心培养液取上清;
b)发酵生产:将复筛后的菌株接种至发酵培养基中,在28-30℃下培养至溶氧量达70-80%时,以2-4ml/min加入甘油9~12小时,加入含1%~1.2%PTM1的甲醇溶液进行诱导,60-72h后每隔4-12h取发酵液进行酶活检测;
c)将上述培养液经分离、纯化后得到赖氨酸特异性酶蛋白的蛋白冻干粉。
在本发明的一些实施方式中,步骤b)发酵培养基中菌株的接种量为1-5%。
在本发明的一些实施方式中步骤a)中甲醇诱导时的pH值为4.0-8.0;步骤b)中甲醇诱导时培养基的pH值为5.5-6.0。
在本发明的一些实施方式中,纯化选自交换层析、超滤或冻干。
除非明确地说明与此相反,否则,本发明引用的所有范围包括端值。例如,“步骤a)中甲醇诱导时的pH值为4.0-8.0”,表示步骤a中甲醇诱导时的pH值为4.0≤pH≤8.0。
本发明中的数字均为近似值,无论有否使用“大约”或“约”等字眼。数字的数值有可能会出现1%、2%、5%、7%、8%、10%等差异。每当公开一个具有N值的数字时,任何具有N+/-1%,N+/-2%,N+/-3%,N+/-5%,N+/-7%,N+/-8%或N+/-10%值的数字会被明确地公开,其中“+/-”是指加或减。
本发明在对重组赖氨酸特异性酶的基因进行改进后,并采用毕赤酵母菌表达产物,为重组赖氨酸特异性酶的工业生产提供了有效途径。与目前常用的产酶溶杆菌,水解无色杆菌,铜绿假单胞菌表达产物相比,克服了生产效率不高,发酵周期较长,且提取工艺比较复杂等缺点,在降低生产成本的同时还具有快速、简便、稳定等特点,且生产的rLys-C活性高,对于基因工程药物的开发以及生物学研究具有重要的应用与研究价值。
附图说明
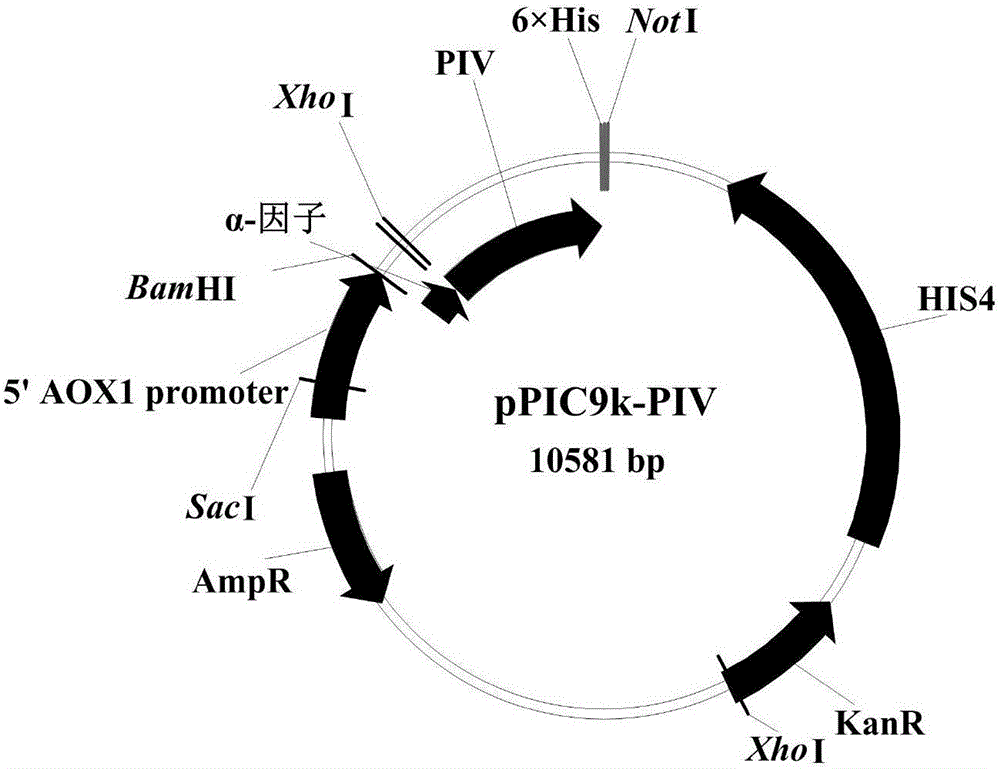
图1为重组表达质粒pPIC9k-PIV的示意图;
图2为PIV不同诱导时间发酵液上清酶活测定结果示意图;
具体实施方式
下面结合具体实施例对本发明作进一步具体详细描述,但本发明的实施方式不限于此,对于未特别注明的工艺参数,可参照常规技术进行。
实施例1重组表达质粒pPIC9k-PIV的构建
1.重组赖氨酸特异性酶基因(PIV)的全合成
根据GenBank公布的赖氨酸特异性酶基因序列(AY062882)和氨基酸序列(AAL47683.1),按照酵母密码子优化策略,对赖氨酸特异性酶核酸序列进行优化,同时在其C端添加6×His标签,并在PIV基因序列5’端带有XhoI位点和Kex2蛋白酶酶切位点Lys-Arg对应的密码子AAAAGA,3’端添加TGA终止密码子和NotI位点,获得编码基因PIV,最终交给基因合成公司进行全基因合成(pUC57-PIV)。
2.重组表达质粒pPIC9k-PIV的构建
利用XhoI和NotI位点处理过的中间载体18T-α为载体片段,与pUC57-PIV经XhoI和NotI双酶切回收得到的片段进行连接,筛选得到阳性质粒18T-α-PIV。得到的阳性质粒18T-α-PIV经BamHI和NotI双酶切后,回收目的基因片段(α-PIV),与pPIC9k经BamHI和NotI双酶切后回收的载体片段进行连接,筛选得到最终重组表达质粒pPIC9k-PIV,结果见图1。利用5’AOX1和3’AOX1引物进行测序,测序结果显示克隆基因片段与理论一致。
实施例2毕赤酵母GS115生产赖氨酸特异性酶
1.pPIC9k-PIV电转化
利用SacI酶切位点对表达质粒pPIC9k-PIV进行线性化,按照Invitrogen公司EasySele Pichia Expression Kit中的方法制备酵母宿主菌感受态,并电转至毕赤酵母GS115菌株中,涂布于MD平板上,30℃下培养3-4天长出单菌落。
2.赖氨酸特异性酶高产菌株的筛选
挑选大小适中且较为饱满的单菌落接种至BMGY培养基(质量百分比,酵母粉1%、蛋白胨2%、YNB1.34%、Glycerol1%、生物素0.004%、100mM磷酸盐缓冲液),30℃过夜培养,OD600约为15-20,转接至含有50mL BMMY培养基(质量百分比,酵母粉1%、蛋白胨2%、YNB1.34%、生物素0.004%、100mM磷酸盐缓冲液)的500mL锥形瓶中,于220rpm摇床中30℃培养,每12h补加1%体积的甲醇进行诱导表达,共培养96h。发酵完后取培养液,离心(12000rpm,5min,4℃),取上清。测定不同单菌落的发酵液酶活,筛选酶活较高的菌株,再进行第二轮复筛。
3.赖氨酸特异性酶的发酵生产
具体方法为:以复筛得到的高产菌株(摇瓶发酵酶活0.817U/mL)进行50L发酵罐发酵。种子液接种量为5%,转接至装有20L基础培养基(甘油40g/L、K2SO4 17.5g/L、MgSO414g/L、KOH 3.2g/L、CaSO4 0.8g/L、PTM1 3ml/L,pH为6.0)的50L发酵罐中,培养16-18h,待溶氧从接近0%上升到70-80%,按2mL/min加入甘油10小时,开始诱导,优化诱导的pH为5.5-6.0,稳定诱导期内加入含1.2%PTM1的甲醇诱导60-72h,共发酵121h,每隔4h取发酵液进行酶活检测,结果见图2。
实施例3赖氨酸特异性酶的纯化与活性检测
1.赖氨酸特异性酶的纯化
发酵液上清经超滤系统置换缓冲液,置换溶液为30mMTris-HCl,膜包选择为5k分子量,面积为0.1m2,超滤后的溶液经pH5.0,0.1M NaAc缓冲液平衡过的阳离子层析填料,上样量根据小试穿透情况确定,上样的pH调为pH 5.0,电导7.0ms/cm。并用pH5.0,0.1M NaAc缓冲液进行冲洗,紧接着用0.1M NaAc和0.3MNaCl缓冲液(pH 6.0)进行洗脱,最后用0.5M NaOH溶液进行再生,最后进行冻干,测定酶活,见表1。
2.赖氨酸特异性酶的酶活测定
1)溶液配制:Tris-HCL缓冲液(100mM,pH8.5):称取Tris2.428g溶于200mg超纯水中,用HCl调pH至8.5。Lys-C底物溶液:取一支5mg装底物(N-p-Tosyl-Gly-Pro-Lys 4-硝基苯胺醋酸盐)直接用3.939mL超纯水溶解即得。
2)实验过程:取Tris-HCL缓冲液180μL,加入样品10μL,底物溶液10μL,混匀后用酶标仪,于405nm处,每隔20S读一次数,共30min,反应温度30℃,绘制动力学曲线,取反应初始阶段呈线性部分求酶活。
3)计算公式:
△A/t:动力学曲线斜率(取反应初始阶段呈线性的部分)
Tv:反应体系的体积
Sv:加入样品的体积
b:光径为1cm
N:样品稀释倍数
ξ:摩尔消光系数(硝基苯胺为9.620mL/μmol/cm)
4)酶活定义:每分钟催化1μmol底物水解所需的酶量定义为一个酶单位。
表1赖氨酸特异性酶纯化富集后酶活测定结果
- 还没有人留言评论。精彩留言会获得点赞!