一种提高酱香型窖底酒质量的方法与流程
技术领域:
本发明涉及一种白酒的制备方法,特别涉及一种酱香型窖底酒的制备方法。
背景技术:
:
白酒是中国传统的酒精饮料,又名烧酒、白干,系以曲类、酒母为糖化发酵剂,利用谷物类的淀粉质(糖质)原料,经蒸煮、糖化、发酵、蒸馏、陈酿和勾兑而酿造而成的蒸馏酒。其工艺独特,历史悠久,享誉中外。中国白酒与白兰地、威士忌、朗姆酒、伏特加、金酒并称世界六大蒸馏酒。
中国白酒目前按香型划分有十二种香型,其中最基本的香型是酱香、清香、浓香以及米香型。
勾兑酱香白酒需三种不同的香型原酒,即酱香型酒、醇甜型酒、窖底香型酒。酱香白酒就是以贮存三年以上的不同轮次、不同香型酒勾兑而成。优质的酱香白酒与这三种香型原酒的质量密不可分。其中,质量优良的窖底香型酒己酸乙酯含量高,可增加酒体的醇甜和放香,入口丰满,后味长,空杯留香好。窖底香型酒产量虽然较低,但在勾兑酱香白酒中却起着画龙点睛的作用。窖底酒的质量在很大程度上决定并影响酱香白酒的质量。另一方面,窖底香型酒的制作及其质量的优劣与窖底井黄水密切相关。
窖底井黄水是固态法生产白酒过程的副产物,是发酵过程中渗于窖池底部的一种棕黄色、微粘稠的混浊液体,具有窖香和酯香,有明显的涩味和酸味。黄水成分复杂,除了醇、醛、酸、酯外,还有丰富的糖类、蛋白等以及大量长期驯化的有益微生物。
迄今为止报道的文献几乎都是关于浓香型白酒生产过程中黄水的生成及其在浓香型白酒生产中的作用及地位。糟醅中的微生物利用营养物质生长繁殖,糟醅中的水分逐渐下沉形成黄水,黄水为窖泥中有益的厌氧微生物提供养分并形成适宜的生长环境,同时这些有益菌又通过黄水的媒介作用渗透到糟醅中代谢生酸并进行酯化,三者间相互依存,相互作用,从而形成了浓香型白酒中的复杂的香味成分。酱香型白酒生产过程中窖泥、糟醅、黄水之间也必然存在着如此的辩证关系。
浓香型白酒中黄水研究的较为透彻,酱香型黄水研究的一直寥寥无几。同时,生产出窖香浓郁、酒体醇厚、质量上等的窖底香型酒也是各个酱香酒生产企业亟需解决的问题。
技术实现要素:
:
为了解决上述技术问题,本发明采用的技术方案是:首先优化传统的窖底井黄水制作工艺,确定窖底井黄水制作工艺中所涉因素的用量范围,然后通过在每个轮次强化窖底井黄水中的优势微生物菌群的方式,最终达到改善窖底酒质量的目的。
为此,本发明提供一种酱香型窖底酒的制备方法,所述方法是将本发明的优化窖底井黄水、尾酒、大曲粉等混合,在烤取窖底酒之前的每个轮次,均匀泼洒至窖底糟醅上,翻拌均匀,烤取窖底酒。其中所述优化窖底井黄水中含有本发明的优势微生物菌群,所述优势微生物菌群,采用本发明方法获取并培养得到。
本发明一方面提供了一种酱香型白酒黄水发酵的优势微生物菌群。
本发明第二方面提供了一种酱香型白酒黄水。
本发明第三方面提供了一种酱香型白酒黄水的制备方法。
本发明第四方面提供了一种酱香型窖底酒的制备方法。
具体,本发明是通过下述技术方案实现的:
本发明的一种酱香型白酒黄水发酵的优势微生物菌群,其特征在于,包括厌氧细菌属,所述的的厌氧细菌属包括芽孢杆菌、乳杆菌。在数量为104至107的厌氧细菌属中,其中芽孢杆菌数量103与104、乳杆菌数量为103到105。
本发明的优势微生物菌种是采用传统分离与分子生物学相结合的方法来分析不同轮次窖底井黄水中的优势微生物,主要是采用了聚合酶链反应-变性梯度凝胶电泳(pcr-dgge)的现代分子分析手段,确定并分离出窖底井黄水中的优势微生物菌群,并逐级扩大培养至生产规模,具体包括微生物计数、分离纯化、pcr-dgge鉴定。
首先本发明经过细菌培养采用37℃下pca平板培养计数;真菌培养采用30℃下pda平板培养计数;芽孢杆菌采用80℃处理10min,然后涂布pca平板培养计数;厌氧微生物计数采用37℃下mrs平板计数。结果发现,细菌的数量在104左右,芽孢杆菌的数量在103与104间波动。真菌的数量很少,几乎没有。厌氧菌计数其数量范围在104至107,远大于好氧菌及兼性厌氧菌;可以判断,厌氧细菌为黄水中的主要菌群。第二,黄水中微生物的群落多样性分析采用pcr-dgge技术,首先提取窖底井黄水的总dna,分别选用细菌和真菌引物进行两次扩增,然后进行pcr-dgge电泳,切胶测序,确定本发明的优势微生物菌群。确定后提取并培养,所述培养方法如下:
(1)筛选出的窖底井优势微生物菌群,采用乙醇醋酸钠液体培养基培养,培养基配方为:无水乙醇2.0%(灭菌后使用前加入)、naac0.5%、酵母膏0.1%、mgso4·7h2o0.02%、k2hpo40.04%、(nh4)2so40.05%、caco31%(高温干灭后加入),ph自然;0.12mpa高压蒸汽灭菌30min。
(2)接种液体培养基:
在无菌条件下,用接种针从斜面培养物上挑一环分离培养好的本发明优势微生物菌群,接种到200ml乙醇醋酸钠液体培养基,30℃,厌氧培养7d。
(3)液体种子一级扩培:
将培养好的200ml种子液接种到2l乙醇醋酸钠液体培养基,进行一级扩大培养,30℃,厌氧培养7d。
(4)液体种子二级扩培:
将培养好的2l种子液接种到20l乙醇醋酸钠液体培养基,进行二级扩大培养,30℃,厌氧培养30d。
本发明进一步提供一种酱香型白酒优化窖底井黄水,是由下述重量份原料制备得到的:
优势微生物菌群3-20份、
大曲4-8份、
糟醅2-6份、
底锅水0-50份、
原始窖底井黄水0-15份、
尾酒为溶剂调至2-10vol%。
优选的,一种技术方案在室外进入强化培养的的酱香型白酒优化窖底井黄水,是由下述重量份原料制备得到的:
优势微生物菌群3-20份、
大曲4-8份、
糟醅2-6份、
底锅水0-50份、
原始窖底井黄水5-15份、
尾酒为溶剂调至2-10vol%。
优选的,是由下述重量份原料制备得到的:
优势微生物菌群5-15份、
大曲4-6份、
糟醅2-4份、
底锅水10-50份、
原始窖底井黄水8-12份、
尾酒为溶剂调至1-6vol%。
更优选的,是由下述重量份原料制备得到的:
优势微生物菌群8-12份、
大曲5-6份、
糟醅2-4份、
底锅水10-30份、
原始窖底井黄水8-10份、
尾酒为溶剂调至2-4%。
本发明的酱香型白酒优化窖底井黄水的制备方法:以尾酒作为溶剂,接入优势微生物菌群,并分别加入大曲、发酵糟醅,添加一定比例的底锅水,最后添加一定量的原始窖底井黄水,厌氧发酵30-40d,培养温度30-35℃即可。
具体为,(1)接入优势微生物菌群接种量为3-20份,并分别加入大曲4-8份、发酵糟醅2-6份,添加底锅水0-50份,添加原始窖底井黄水5-15份,最后以尾酒为溶剂调至最终酒精浓度为2-10vol%,(2)上述厌氧发酵30-40d,培养温度30-35℃即得优化窖底井黄水。
本发明另外一种技术方案适用于在窖底井内进行强化培养。由于室内窖底井内含有原始窖底井黄水,因此在强化培养时则不需要添加原始窖底井黄水,其它成分配料用量不变。具体如下:
优选,本发明另外一种技术方案适用于在窖底井内进行强化培养由于室内窖底井内含有原始窖底井黄水,因为在强化培养时则不需要添加原始窖底井黄水,其它成分配料用量不变。具体如下:
本发明适合窖底井内培养的酱香型白酒优化窖底井黄水,是由下述重量份原料制备得到的:
优势微生物菌群3-20份、
大曲4-8份、
糟醅2-6份、
底锅水0-50份、
尾酒为溶剂调至2-10vol%。
优选地,是由下述重量份原料制备得到的:
优势微生物菌群5-15份、
大曲4-6份、
糟醅2-4份、
底锅水10-50份、
尾酒为溶剂调至1-6vol%。
更优选的,是由下述重量份原料制备得到的:
优势微生物菌群8-12份、
大曲5-6份、
糟醅2-4份、
底锅水10-30份、
尾酒为溶剂调至2-4%。
具体制备过程:含有原始窖底井黄水的窖底井,接入优势微生物菌群3-20份,大曲4-8份、发酵糟醅2-6份,底锅水0-50份、用尾酒调配至酒度2-10vol%,培养温度自然,培养周期32d。
本发明在黄水制备过程中添加底锅水,不仅可以变废为宝,还可以减轻底锅水对环境污染的压力。本发明强化窖底井黄水中的优势微生物,可以提高窖底井黄水的质量,使窖底井黄水的窖底香更为丰满、浓厚,从而进一步提升窖底香型酒的质量。
本发明的酱香型窖底酒的制备方法是将优化窖底井黄水、尾酒、大曲粉,在烤取窖底酒之前的每个轮次,均匀泼洒至窖底糟醅上,翻拌均匀,烤取窖底酒。
具体地,本发明的酱香型窖底酒的制备方法,包括如下步骤:将优化窖底井黄水25-35份、8-15vol%尾酒20-25份、大曲粉10-15份,在烤取窖底酒之前的每个轮次,均匀泼洒至80-120份的窖底糟醅上,翻拌均匀,烤取窖底酒。
其中所述每个轮次,是指窖底酒制备过程中的各个轮次,包括下沙、糙沙、一轮次、二轮次、三轮次和/或四轮次。
以下通过实验数据进一步说明本方的有益效果:
有益效果
试验例一、优化窖底井黄水对窖底酒己酸乙酯含量的影响
1、样品
优化后的窖底酒:按照实施例1制备
优化前的窖底酒即传统工艺窖底糟的制作工艺:按传统窖底井黄水总量200l,加入大曲粉5-7.5%,糟醅3.5-5%,8-15%vol尾酒加入量为35-50%,在烤取窖底酒之前的每个轮次,均匀泼洒至100份的窖底糟醅上,翻拌均匀,烤取窖底酒。
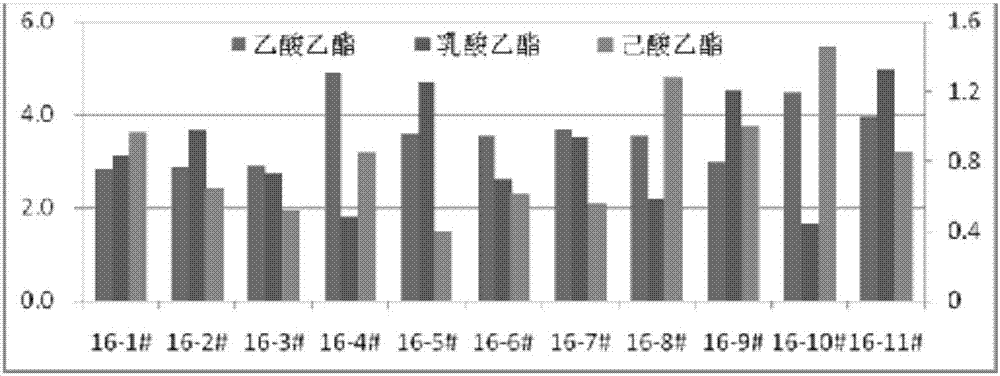
2、方法:对【7批次优化前的窖底酒(16-1#~16-7#)和4批次优化后的窖底酒(16-8#~16-11#)】的酸、酯含量以及酒的品级进行分析比较。
3、结果:
(1)总酸总酯含量:从总酸总酯的含量来看,优化后窖底酒总酸含量略高于优化前的平均水平,高出近9%;优化后窖底酒总酯含量高出优化前平均水平的14%。见表1、图1。
表1优化前和优化后窖底酒总酸总酯含量(g/l)
(2)酯类物质:从平均水平来看,优化后的窖底酒乙酸乙酯、乳酸乙酯与优化前窖底酒的水平基本相当,但己酸乙酯的含量要比优化前高出70%以上。
表2、图2
表2优化前和优化后窖底酒乙酸乙酯、乳酸乙酯、己酸乙酯含量(g/l)
(3)优化前后窖底酒品评分级
表3优化前后窖底酒品评打分表
从上表3可以看出,4个批次优化后的窖底酒评分平均值在83分,而7个批次优化前窖底酒打分平均为78分,而且优化后的窖底酒均为二等酒,因此,从品评结果可以看出,优化后的的窖底酒质量要优于优化前。
4、结论:
综上所述,采用本发明的方法筛选优势微生物菌群后对窖底井黄水进行强化培养并且烤取之后的窖底酒己酸乙酯含量在1.0-3.0g/l,优化后的窖底酒总酯含量要高出优化前1.0g/l,优化后窖底酒己酸乙酯含量为1.15g/l,而优化前己酸乙酯含量仅为0.65g/l,高出优化前75%以上。窖底酒合格率在95-100%之间。见图3
试验例二、本发明的优化窖底井黄水筛选过程
本研究通过正交实验的方法对人工黄水的制作工艺中的底锅水、大曲粉、糟醅、酒精度四个因素,进行三水平正交试验,正交因素试验表如下。
表4黄水制作优化工艺l9(34)正交因素试验表
对9组试验进行37℃厌氧培养30d,窖底酒中的窖底香是以己酸乙酯为主的复合香气,己酸乙酯的含量可在一定程度上反映窖底酒与窖底黄水的质量。检测实验组黄水样品中的己酸乙酯的含量,试验结果如下。
表5黄水制作优化正交试验设计及结果
由上表的极差分析结果可知,四个因素对黄水中己酸乙酯含量的影响大小依次为:大曲粉>酒精度>糟醅>底锅水。四因素中,大曲粉和酒精度的影响较为显著,其中,大曲粉的提取作用最为显著。在试验设计范围内,优化得到人工黄水制作的最佳条件为a1b2c2d1,考虑到实际生产中的成本及现场操作实施情况,优化后的黄水制作工艺为底锅水10-50%、大曲粉4-6%、糟醅2-4%、酒精度1-6%vol。
试验例三、优势微生物菌群的制备
1.总dna的提取
黄水采样后贮存于冰箱4℃,并尽快用于提取总dna。
黄水摇匀,移入50ml离心管,3000rpm离心,收集沉淀。然后使用土壤总dna提取试剂盒,根据说明书的指示,进行黄水微生物总dna的提取。具体操作步骤为:
(1)500mg玻璃珠加入1.5ml离心管中,加入0.2~0.5g土壤样品,加1mlbufferslxmlux,高速涡悬3~5min。
(2)加100μlbufferds,蜗悬混合。
(3)70℃水浴10min,期间快速混匀一次。
(4)3000rpm离心3min(室温离心),移800μl上清在新的1.5ml离心管,加入270μlbuffersp2彻底混匀。
(5)冰浴5min后,13000×g离心5min,4℃。
(6)将上清移至新的1.5ml离心管中,加入0.7倍体积的异丙醇。颠倒20~30次,充分混匀,-20℃置1h。
(7)13000×g离心10min,4℃,沉淀dna。
(8)收集沉淀,沥干。
(9)加入200μlelutionbuffer,吹吸混匀10秒,65℃水浴10~20min,溶解dna;此时可平衡吸附柱。
(10)加入100μlhtrreagent,混匀10秒(用前混匀htrreagent)。
(11)室温放置2min,13000×g离心2min。
(12)小心将上清液移入新的1.5ml离心管;若上清仍深色,重复(10)至(12)步骤。
(13)加等体积xp2buffer,混合。
(14)将样品移入吸附柱,10000×g室温离心1min,弃液体。
(15)将柱子放入原收集管中,加入300μlxp2buffer,10000×g离心1min,弃液体和收集管。
(16)将柱子放入新的收集管中,加入700μl(已加过无水乙醇的)spwwashbuffer。10000×g离心1min,弃液体,回收收集管,再利用。
(17)重复(16)步骤。
(18)弃液体,将柱子放置在新的收集管中,13000×g离心2min(室温)。避免乙醇影响下面的工序。
(19)将柱子放置在新的1.5ml离心管中,在柱子中央加入40μlelutionbuffer。
(20)13000×g离心1min,收集dna。
(21)重复(19)至(20)步骤。
(22)总dna样品保存于-20℃,以备pcr扩增反应。
平衡吸附柱的步骤为:
(1)柱子中加入200μlbuffergps平衡缓冲液。
(2)室温放置3~5min。
(3)室温,12000×g离心2min。
(4)弃滤液,柱子装入收集管。
(5)加700μl灭菌水。
(6)室温12000×g离心2min。
(7)弃滤液,装入收集管中。吸附柱平衡后,可在室温放置1~2周内使用。
2.pcr扩增
2.1细菌16srdnav3可变区的扩增
以总dna为模板,利用巢式pcr技术,扩增出16srdnav3可变区片段。扩增引物均为通用引物,引物序列分别为16s1(5′–agagtttgatcmtggctcag–3′);16s2(5′–tacggytaccttgttacgactt–3′);r518(5′–attaccgcggctgctgg–3′);338f(5′–actcctacgggaggcagcag–3′)。gc发夹(5′–cgcccgccgcgcgcggcgggcggggcgggggcacgggggg–3′)引入338f引物中,以便在dgge电泳中可以有效分离。在巢式pcr中,第一轮pcr选用16s1和16s2引物,在第二轮扩增选用r518和338f-gc引物。反应条件:94℃,4min;94℃,45s;50℃,45s;72℃,90s;30个循环;72℃,10min。pcr产物均用1%(m/v)琼脂糖凝胶电泳进行检测。
pcr反应体系为:
第一步pcr扩增反应
引物16s11μl
引物16s21μl
dntp4μl
rtag聚合酶1μl
buffer2.5μl
无菌水14.5μl
dna模板1μl
第二pcr扩增反应:
引物r5182μl
引物338f-gc2μl
dntp8μl
extaq聚合酶1μl
buffer5μl
无菌水31μl
dna模板1μl
2.2真菌fr1/ff390区的扩增
以总dna为模板,利用巢式pcr技术,扩增出fr1/ff390区片段。扩增引物均为通用引物,引物序列分别为geoa2(5′–ccagtagtcatatgcttgtctc–3′);geo11(5′–accttgttacgacttttacttcc–3′);fr1(5′–aiccattcaatcggtait–3′);ff390(5′–cgataacgaacgagacct–3′)。gc发夹(5′–cgcccgccgcgccccgcgcccggcccgccgcccccgccccc–3′)引入fr1引物中,以便在dgge电泳中可以有效分离。在巢式pcr中,第一轮pcr选用geoa2和geo11引物,在第二轮扩增选用fr1-gc和ff390引物。反应条件:94℃,4min;94℃,45s;50℃,45s;72℃,90s;30个循环;72℃,10min。pcr产物均用1%(m/v)琼脂糖凝胶电泳进行检测。
pcr反应体系为:
第一步pcr扩增反应:
引物geoa21μl
引物geo111μl
dntp4μl
extag聚合酶1μl
buffer2.5μl
无菌水14.5μl
dna模板1μl
第二pcr扩增反应:
引物fr1-gc2μl
引物ff3902μl
dntp8μl
extag聚合酶1μl
buffer5μl
无菌水31μl
dna模板1μl
3.dgge电泳
细菌16sv3可变区使用10%聚丙烯酰胺凝胶,30~60%变性梯度。电泳采用dcodetmμniversalmutationdetectionsystem。首先在20v电压下预电泳20min,随后调整至100v,电泳10h。电泳结束后,进行sybrgreeni染色液染色。
真菌fr1/ff390区使用8%聚丙烯酰胺凝胶,20~50%变性梯度。电泳采用dcodetmμniversalmutationdetectionsystem。首先在20v电压下预电泳20min,随后调整至100v,电泳10h。电泳结束后,进行sybrgreeni染色液染色。
4.序列分析
将dgge凝胶上呈现的各个样品的优势条带切下,溶于1×te缓冲液中,-20℃冻融过夜。用r518/338f引物(针对细菌)或fr1/ff390引物(针对真菌)进行再扩增。pcr产物经1%琼脂糖凝胶电泳检测后,送bgi公司进行序列测定。将所测得的序列在nationalcentreforbiotechnologyinformation(ncbi)(http://www.ncbi.nlm.nih.gov)网页,通过blastnetworkservice(blastn)进行比对,根据待分析序列与已注册序列的同源性,确定其细菌种属。
5、结论
窖底井黄水样品中微生物dgge电泳图谱见图4,从dgge电泳谱图上来看,窖底井黄水中的微生物较为复杂,经过微生物的分离和纯化共获得菌株243株,经过菌落形态对比,最后得到108株菌株,对样品全基因组采用高通量测序,结果发现,黄水中微生物种群以芽孢杆菌、乳杆菌等厌氧细菌属为主,真菌种类及数量极少,主要是某些酵母菌属。因此我们认为窖底井黄水中的优势微生物就是某些厌氧芽孢杆菌属,并对这些优势微生物进行了分离培养。
6、黄水优势微生物的分离选育
富集培养基,即乙醇醋酸钠培养基(eam):乙醇2.0%(灭菌后使用前加入)、naac0.5%、酵母膏0.1%、mgso4·7h2o0.02%、k2hpo40.04%、(nh4)2so40.05%、caco31%,ph自然;0.12mpa高压蒸汽灭菌30min。
分离和保藏培养基:在eam培养基的基础上,添加10ml0.1%溴百里酚蓝指示剂、15-20g琼脂,加水至1000ml,调ph值为7.0,121℃灭菌20min。
分离流程
1高温富集培养:取10ml优质黄水放入90ml液体富集培养基中,80℃水浴处理10min,加塞包扎,33℃培养5d,选取产气多的试管,得到己酸菌种子液,继续80℃水浴处理10min,再以10%的接种量接种到新鲜的培养基中,在同样条件下培养7d,根据培养液的己酸定性分析结果,选取经富集的产己酸较多的试样。
2吸取富集菌液1ml,将10-1-10-6梯度的稀释菌悬液分别涂布于筛选培养基(含有溴百里酚蓝指示剂)上,抽真空,倒置于37℃恒温培养3d,筛选出本发明黄色优势微生物菌落,根据其菌落形态及显微形态的不同将其简单归类,并进行纯化保藏。附己酸的定性分析方法
a:用移液管吸取1.5ml发酵液,缓慢沿壁滴加到含有5ml2%cuso4溶液的试管中,静置10min后观察cuso4溶液中是否有蓝色絮状沉淀产生。若有,则说明发酵液中有己酸生成,否则说明没有。或者吸取2ml的培养液加入到小试管中,再加入2ml2%的cuso4和1ml无水乙醚,摇匀后静置分层,如果乙醚层呈现蓝色则说明有己酸生成。
b:吸取4ml混合均匀的己酸菌培养液,加入2%乙酸铜溶液1ml,然后加1ml乙醚充分振荡,静置分层后观察乙醚层颜色。如果乙醚层呈现蓝绿色,则证明菌液中含有己酸,且颜色越深己酸含量越高。
附图说明:
图1优化前和优化后窖底酒总酸总酯含量(g/l)
图2优化前和优化后窖底酒乙酸乙酯、乳酸乙酯、己酸乙酯含量(g/l)
图3优化前与优化后窖底酒中酸酯含量对比
图4窖底井黄水样品中微生物dgge电泳图谱
具体实施方式:
以下通过实施例进一步说明本发明。
实施例1采用本发明的方法对窖底井黄水进行室外强化扩大培养
(2)优势微生物的逐级扩大培养。采用pcr-dgge技术对窖底井黄水中的微生物进行鉴定并分离,优势菌群为梭状芽孢杆菌,采用培养基具体成分为:乙醇2.0%(灭菌后使用前加入)、naac0.5%、酵母膏0.1%、mgso4·7h2o0.02%、k2hpo40.04%、(nh4)2so40.05%、caco31%,ph自然;0.12mpa高压蒸汽灭菌30min。采用三级扩大培养至200l,分装至三个不锈钢桶中,由于一、二轮次外界气温较低,不利于窖底黄水室外培养,因此将3桶黄水随入窖糟醅埋入窖池内,保温培养30d。
(2)优化窖底井黄水制作工艺:取梭状芽孢杆菌种子液20l、大曲12kg,发酵糟醅用量8kg,底锅水添加60l,原始窖底井黄水20l,用尾酒调配至酒度2vol%,培养温度30℃,培养周期30d。
(3)窖底糟培植。每个窖池需200l黄水进行窖底糟培植,黄水的用量约为窖底糟醅的30%。另外还需要75kg大曲粉、8vol%酒尾100kg,将黄水、大曲粉、酒尾、窖底糟醅翻拌均匀后撒上一层稻壳,即完成窖底糟醅的培植。在四轮次生产时烤取窖底酒,窖底酒己酸乙酯含量为1.8g/l,窖底酒合格率为100%。
表6窖底酒理化检测结果
实施例2采用本发明的方法对窖底井黄水进行室外强化扩大培养
(1)优势微生物的逐级扩大培养。采用pcr-dgge技术对窖底井黄水中的微生物进行鉴定并分离,优势菌群为乳杆菌,采用培养基具体成分为:乙醇2.0%(灭菌后使用前加入)、naac0.5%、酵母膏0.1%、mgso4·7h2o0.02%、k2hpo40.04%、(nh4)2so40.05%、caco31%,ph自然;0.12mpa高压蒸汽灭菌30min。采用三级扩大培养至200l,分装至三个不锈钢桶中,由于一、二轮次外界气温较低,不利于窖底黄水室外培养,因此将3桶黄水随入窖糟醅埋入窖池内,保温培养30d。
(2)优化窖底井黄水制作工艺:取乳杆菌种子液3l、大曲4kg,发酵糟醅用量2kg,原始窖底井黄水5l,用尾酒调配至酒度2vol%,培养温度30℃,培养周期30d。
(3)窖底糟培植。每个窖池需25l黄水进行窖底糟培植,黄水的用量约为窖底糟醅的30%。另外还需要10kg大曲粉、8vol%酒尾25kg,将黄水、大曲粉、酒尾、窖底糟醅翻拌均匀后撒上一层稻壳,即完成窖底糟醅的培植。在四轮次生产时烤取窖底酒.
实施例3采用本发明的方法对窖底井黄水进行室外强化扩大培养
(1)优势微生物的逐级扩大培养。采用pcr-dgge技术对窖底井黄水中的微生物进行鉴定并分离,优势菌群为梭状芽孢杆菌,采用培养基具体成分为:乙醇2.0%(灭菌后使用前加入)、naac0.5%、酵母膏0.1%、mgso4·7h2o0.02%、k2hpo40.04%、(nh4)2so40.05%、caco31%,ph自然;0.12mpa高压蒸汽灭菌30min。采用三级扩大培养至200l,分装至三个不锈钢桶中,由于一、二轮次外界气温较低,不利于窖底黄水室外培养,因此将3桶黄水随入窖糟醅埋入窖池内,保温培养30d。
(2)优化窖底井黄水制作工艺:取梭状芽孢杆菌种子液40l、大曲16kg,发酵糟醅用量12kg,底锅水添加100l,原始窖底井黄水20l,用尾酒调配至酒度10vol%,培养温度30℃,培养周期30d。
(3)窖底糟培植。每个窖池需350l黄水进行窖底糟培植,窖底糟醅1200kg,另外还需要150kg大曲粉、15vol%酒尾250kg,将黄水、大曲粉、酒尾、窖底糟醅翻拌均匀后撒上一层稻壳,即完成窖底糟醅的培植。在四轮次生产时烤取窖底酒。
实施例4采用本发明的方法对窖底井黄水进行室外强化扩大培养
(2)优势微生物的逐级扩大培养。采用pcr-dgge技术对窖底井黄水中的微生物进行鉴定并分离,优势菌群为梭状芽孢杆菌,采用培养基具体成分为:乙醇2.0%(灭菌后使用前加入)、naac0.5%、酵母膏0.1%、mgso4·7h2o0.02%、k2hpo40.04%、(nh4)2so40.05%、caco31%,ph自然;0.12mpa高压蒸汽灭菌30min。采用三级扩大培养至200l,分装至三个不锈钢桶中,由于一、二轮次外界气温较低,不利于窖底黄水室外培养,因此将3桶黄水随入窖糟醅埋入窖池内,保温培养30d。
(2)优化窖底井黄水制作工艺:取梭状芽孢杆菌种子液8l、大曲5kg,发酵糟醅用量4kg,底锅水添加10l,原始窖底井黄水8l,用尾酒调配至酒度2vol%,培养温度30℃,培养周期30d。
(3)窖底糟培植。每个窖池需200l黄水进行窖底糟培植,黄水的用量约为窖底糟醅的30%。另外还需要75kg大曲粉、8vol%酒尾100kg,将黄水、大曲粉、酒尾、窖底糟醅翻拌均匀后撒上一层稻壳,即完成窖底糟醅的培植。在四轮次生产时烤取窖底酒,窖底酒己酸乙酯含量为1.8g/l,窖底酒合格率为100%。
实施例5采用本发明的方法对窖底井黄水进行室外强化扩大培养
(2)优势微生物的逐级扩大培养。采用pcr-dgge技术对窖底井黄水中的微生物进行鉴定并分离,优势菌群为乳杆菌,采用培养基具体成分为:乙醇2.0%(灭菌后使用前加入)、naac0.5%、酵母膏0.1%、mgso4·7h2o0.02%、k2hpo40.04%、(nh4)2so40.05%、caco31%,ph自然;0.12mpa高压蒸汽灭菌30min。采用三级扩大培养至200l,分装至三个不锈钢桶中,由于一、二轮次外界气温较低,不利于窖底黄水室外培养,因此将3桶黄水随入窖糟醅埋入窖池内,保温培养30d。
(2)优化窖底井黄水制作工艺:取乳杆菌种子液12l、大曲6kg,发酵糟醅用量4kg,底锅水添加30l,原始窖底井黄水10l,用尾酒调配至酒度4vol%,培养温度30℃,培养周期30d。
(3)窖底糟培植。每个窖池需200l黄水进行窖底糟培植,黄水的用量约为窖底糟醅的30%。另外还需要75kg大曲粉、8vol%酒尾100kg,将黄水、大曲粉、酒尾、窖底糟醅翻拌均匀后撒上一层稻壳,即完成窖底糟醅的培植。在四轮次生产时烤取窖底酒,窖底酒己酸乙酯含量为1.8g/l,窖底酒合格率为100%。
实施例6采用本发明的方法对窖底井黄水进行室外强化扩大培养
(2)优势微生物的逐级扩大培养。采用pcr-dgge技术对窖底井黄水中的微生物进行鉴定并分离,优势菌群为乳杆菌,采用培养基具体成分为:乙醇2.0%(灭菌后使用前加入)、naac0.5%、酵母膏0.1%、mgso4·7h2o0.02%、k2hpo40.04%、(nh4)2so40.05%、caco31%,ph自然;0.12mpa高压蒸汽灭菌30min。采用三级扩大培养至200l,分装至三个不锈钢桶中,由于一、二轮次外界气温较低,不利于窖底黄水室外培养,因此将3桶黄水随入窖糟醅埋入窖池内,保温培养30d。
(2)优化窖底井黄水制作工艺:取乳杆菌菌种子液15l、大曲6kg,发酵糟醅用量4kg,底锅水添加50l,原始窖底井黄水12l,用尾酒调配至酒度6vol%,培养温度30℃,培养周期30d。
(3)窖底糟培植。每个窖池需200l黄水进行窖底糟培植,黄水的用量约为窖底糟醅的30%。另外还需要75kg大曲粉、8vol%酒尾100kg,将黄水、大曲粉、酒尾、窖底糟醅翻拌均匀后撒上一层稻壳,即完成窖底糟醅的培植。在四轮次生产时烤取窖底酒,窖底酒己酸乙酯含量为1.8g/l,窖底酒合格率为100%。
实施例7采用本发明对窖底井黄水进行井内强化培养
(1)优势微生物菌群的扩大培养。将窖底井黄水中的优势芽孢杆菌微生物进行扩大培养,采用eam培养基培养。按照窖底井体积0.34m3的60%来计算,需要20l优势微生物的种子液强化窖底井黄水。在七轮次生产结束之后,在下一个生产周期下沙开始之前一个月左右,将培养好的20l种子液加到窖底井中,封闭好窖底板,厌氧发酵30d。
(2)优化窖底井黄水的制作,含有适量原始窖底井黄水的窖底井的尺寸为70*70*70cm,20l优势微生物的种子液,大曲12kg,发酵糟醅用量8kg,底锅水60l,用尾酒调配至酒度2.5%vol,培养温度自然,培养周期32d。
(3)窖底糟培植。待下沙制作窖底糟醅时,将200kg优化窖底井黄水泼洒到650kg糟醅上,连同曲药75kg,尾酒120kg翻拌均匀此时,再将另一批培养好的20l优势微生物的种子液添加到窖底井中,盖好窖底井口,如此循环重复,直至烤取窖底酒。在四轮次生产时烤取窖底酒,窖底酒己酸乙酯含量为1.1g/l,窖底酒合格率为100%。
表7窖底酒理化检测结果
实施例8采用本发明对窖底井黄水进行井内强化培养
(1)优势微生物菌群的扩大培养。将窖底井黄水中的优势芽孢杆菌微生物进行扩大培养,采用eam培养基培养。按照窖底井体积0.34m3的60%来计算,需要20l优势微生物的种子液强化窖底井黄水。在七轮次生产结束之后,在下一个生产周期下沙开始之前一个月左右,将培养好的20l种子液加到窖底井中,封闭好窖底板,厌氧发酵30d。
(2)优化窖底井黄水的制作,含有适量原始窖底井黄水的窖底井的尺寸为70*70*70cm,40l优势微生物的种子液,大曲添加比例16kg,发酵糟醅用量12kg,底锅水添加比例100l,用尾酒调配至酒度10%vol,培养温度自然,培养周期32d。
(3)窖底糟培植。待下沙制作窖底糟醅时,将200kg优化窖底井黄水泼洒到1200kg糟醅上,连同曲药150kg,尾酒250kg翻拌均匀此时,再将另一批培养好的20l优势微生物的种子液添加到窖底井中,盖好窖底井口,如此循环重复,直至烤取窖底酒。在四轮次生产时烤取窖底酒
实施例9采用本发明对窖底井黄水进行井内强化培养
(1)优势微生物菌群的扩大培养。将窖底井黄水中的优势乳杆菌进行扩大培养,采用eam培养基培养。按照窖底井体积0.34m3的60%来计算,需要20l优势微生物的种子液强化窖底井黄水。在七轮次生产结束之后,在下一个生产周期下沙开始之前一个月左右,将培养好的20l种子液加到窖底井中,封闭好窖底板,厌氧发酵30d。
(2)优化窖底井黄水的制作,含有适量原始窖底井黄水的窖底井的尺寸为70*70*70cm,梭状芽孢杆菌种子液15l、大曲6kg,发酵糟醅用量4kg,底锅水添加50l,用尾酒调配至酒度6vol%,,培养温度自然,培养周期32d。
(3)窖底糟培植。待下沙制作窖底糟醅时,将200kg优化窖底井黄水泼洒到650kg糟醅上,连同曲药75kg,尾酒120kg翻拌均匀此时,再将另一批培养好的20l优势微生物的种子液添加到窖底井中,盖好窖底井口,如此循环重复,直至烤取窖底酒。在四轮次生产时烤取窖底酒
实施例10采用本发明对窖底井黄水进行井内强化培养
(1)优势微生物菌群的扩大培养。将窖底井黄水中的优势乳杆菌进行扩大培养,采用eam培养基培养。按照窖底井体积0.34m3的60%来计算,需要20l优势微生物的种子液强化窖底井黄水。在七轮次生产结束之后,在下一个生产周期下沙开始之前一个月左右,将培养好的20l种子液加到窖底井中,封闭好窖底板,厌氧发酵30d。
(2)优化窖底井黄水的制作,含有适量原始窖底井黄水的窖底井的尺寸为70*70*70cm,优势微生物的种子液12l、大曲6kg,发酵糟醅用量4kg,底锅水添加30l,用尾酒调配至酒度4vol%,培养温度自然,培养周期32d。
(3)窖底糟培植。待下沙制作窖底糟醅时,将200kg优化窖底井黄水泼洒到650kg糟醅上,连同曲药75kg,尾酒120kg翻拌均匀此时,再将另一批培养好的20l优势微生物的种子液添加到窖底井中,盖好窖底井口,如此循环重复,直至烤取窖底酒。在四轮次生产时烤取窖底酒。
- 还没有人留言评论。精彩留言会获得点赞!