酿酒酵母及其育种方式及工业化发酵生产乙醇的应用的制作方法
本发明涉及工业微生物发酵工程
技术领域:
,具体涉及一种通过模拟工业发酵条件快速半自动传代驯化而筛选的酿酒酵母及其工业发酵生产乙醇的应用。
背景技术:
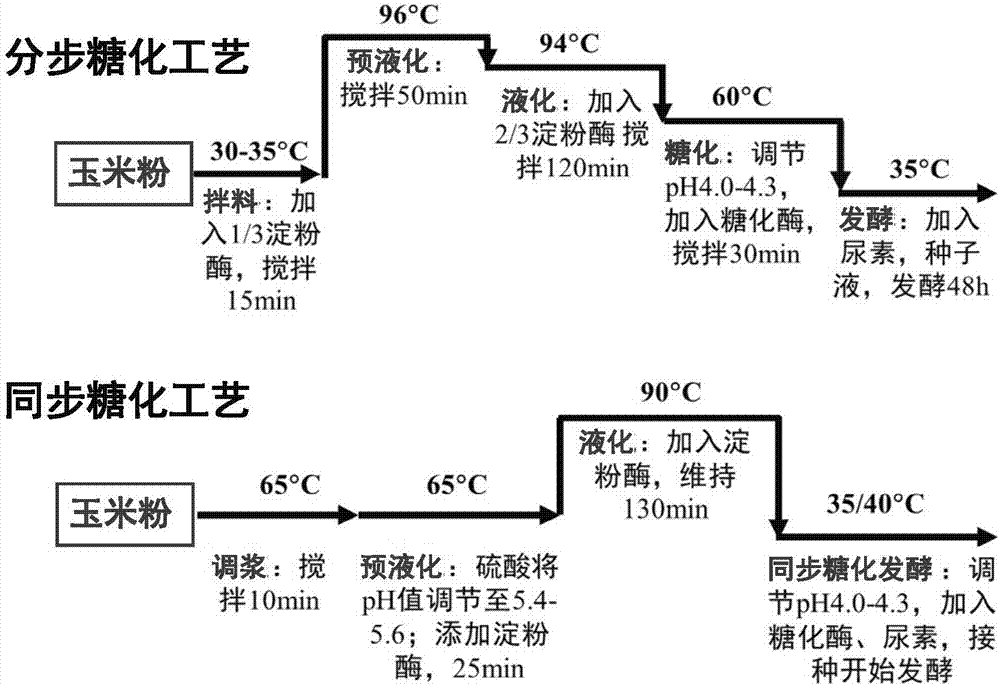
:乙醇是一种重要的工业原料,广泛应用于食品、化工、医药等领域,特别是作为燃料乙醇,用来替代化石能源,减少二氧化碳和污染物的排放。燃料乙醇具有安全、清洁、可再生等优点,不仅在碳减排方面扮演着重要角色,同时还能够缓解化石能源消耗的压力,降低我国原油对外的依存度。在十三五期间,乙醇将成为最具有发展潜力的可再生能源。利用酵母细胞高温浓醪发酵生产乙醇可以降低成本,节约能耗,缩短发酵周期,提高生产效率。然而在高温浓醪发酵中,酵母细胞会受到温度、底物渗透压、工业循环水中的抑制物以及发酵后期高浓度乙醇积累等多重胁迫,生长繁殖和发酵能力受到明显的抑制,因此选育能耐受多重胁迫的酵母菌株,可以更好地满足高温浓醪发酵的要求,从而为乙醇发酵工业带来显著的经济效益。由于酿酒酵母的胁迫耐受性是受多基因在不同层面上协同控制的复杂数量性状,因此通常采用能在全基因组水平上产生变异积累的育种方法,包括传统的物理化学诱变、基因组改组和驯化(适应性进化)等来提高菌株的抗逆性。例如,申请公布号为cn101845404a的中国发明专利,公开了一种酿酒酵母菌株,其选育方式是:从常见的农家自酿甜酒中分离并经原生质体紫外诱变得到的。首先将紫外照射后的菌液涂布ypd平板,放置在高温下培养,从高温培养下的ypd平板上筛选得到耐高温菌株,然后以同样方法经紫外线照射后,在高温培养下,从含有乙醇的ypd平板上筛选得到耐高温耐高乙醇菌株,并通过耐糖和耐温测试,获得应用于高温快速浓醪发酵淀粉生产燃料乙醇的优质菌株。申请公布号为cn103232948a的中国发明专利公开了一株耐高温酿酒酵母及其选育方法,其先将出发菌株进行传统紫外诱变,通过高温培养和玉米粉水解液发酵,筛选得到高温发酵性能有所提升的正向突变株文库,然后进行三轮基因组重排,在高温发酵条件下筛选获得乙醇产量最高的基因组重排最优菌。上述两专利公开的酿酒酵母的选育方法,均是首先诱导或构建菌株突变库,然后再在特定胁迫条件下筛选耐受该胁迫的抗性突变株。由此筛选出的抗性突变株只能耐受某一胁迫条件,对其他的胁迫条件仍然非常的敏感,无法适应工业化生产的发酵条件。目前,虽然淀粉发酵生产乙醇的生产工艺已经较为成熟,但其生产效能依然有较大的提升空间,其中最核心的解决方案是改善工业酿酒酵母的抗逆性,选育适合于高温浓醪工业化发酵生产乙醇的高性能菌株。技术实现要素:有鉴于此,本发明提供了一种酵母菌tibscy02或由其传代而产生的酵母菌,其中tibscy02的保藏编号为cgmccno.14248,分类命名为酿酒酵母saccharomycescerevisiae,于2017年06月15日藏保于中国微生物菌种保藏管理委员会普通微生物中心(保藏地址为北京市朝阳区北辰西路1号院3号)。示例性地,所述酵母菌tibscy02或由其传代而产生的酵母菌以酵母菌株(例如tibscy01)为出发菌株,通过驯化而得到的。示例性地,通过耐高温驯化和/或模拟工业发酵条件驯化而得到的。在本发明的一个具体实施方式中,酵母菌tibscy02以酵母菌tibscy01为出发菌株,通过模拟工业发酵条件驯化而得到的。示例性地,酵母菌tibscy01以scy为出发菌株,通过耐高温驯化和/或模拟工业发酵条件驯化而得到的。示例性地,酵母菌tibscy01以scy为出发菌株,通过耐高温驯化而得到的。在本发明的一个具体实施方式中,将酵母菌tibscy接种到含有高浓度葡萄糖的蛋白胨酵母膏(yp)液体培养基中进行耐高温适应性驯化。例如,采用半自动传代驯化方式,培养温度从37℃开始驯化,逐渐提高到39℃,最后至40℃,从而获得高温发酵性能优良的耐高温菌株tibscy01。在本发明的一个具体实施方式中,酵母菌tibscy02或由其传代而产生的酵母菌包括一个或多个非同义突变。示例性地,所述非同义突变包括纯合突变和杂合突变。示例性地,所述非同义突变包括影响酵母菌tibscy02信号转导蛋白(ira2p)和/或核膜核孔蛋白(pse1p)和/或fad转运蛋白(flc3p)。示例性地,信号转导蛋白(ira2p)和所述核膜核孔蛋白(pse1p)发生纯合突变,以及所述fad转运蛋白(flc3p)发生杂合突变。示例性地,所述信号转导蛋白(ira2p)的突变为ira2n1887d;所述核膜核孔蛋白(pse1p)的突变为pse1s1020l;和所述fad转运蛋白(flc3p)的突变为flc3w469l。在本发明的一个具体实施方式中,酵母菌tibscy02或由其传代而产生的酵母菌,其8号染色体上在6583bp至14000bp之间的约有5kb大片段缺失。示例性地,所述缺失导致参与细胞膜蛋白的周转的酵母细胞内体(endosome)蛋白(cos8p)和/或识别铁螯合物的特异转运蛋白(arn2p)的表达下降或者不表达。示例性地,酵母菌tibscy02不表达酵母细胞内体(endosome)蛋白(cos8p)和/或识别铁螯合物的特异转运蛋白(arn2p)。本发明还提供上述酵母菌tibscy02或由其传代而产生的酵母菌经过遗传修改而改造的酵母菌。本发明还提供了酵母菌tibscy02或由其传代而产生的酵母菌的制备方法,包括通过耐高温驯化和/或模拟工业发酵条件进行驯化。在本发明的一个具体实施方式中,以tibscy01为出发菌株,通过模拟工业发酵条件进行驯化。具体包括:将tibscy01细胞接种到淀粉中,在40℃条件下培养,采用半自动传代驯化的育种方法传代,直至得到性能稳定且发酵高产乙醇的酵母菌tibscy02。本发明还提供了包括或由上述酵母菌tibscy02或其传代而产生的酵母菌、上述酵母菌tibscy01或其传代而产生的酵母菌、酵母菌tibscy组成的组在制备乙醇中的应用。其中,酵母菌tibscy02或其传代而产生的酵母菌、酵母菌tibscy01或其传代而产生的酵母菌、酵母菌tibscy可以以任意比例进行组合。示例性地,上述酵母菌tibscy02或其传代而产生的酵母菌通过浓醪发酵的方式发酵生产乙醇。示例性地,上述酵母菌tibscy02或其传代而产生的酵母菌以淀粉质原料进行发酵。所述淀粉淀粉质原料可为玉米粉、小麦粉、木薯淀粉等。本发明还提供利用上述酵母菌tibscy02或其传代而产生的酵母菌发酵淀粉质原料生产乙醇的方法。在本发明的一个具体实施方式中,以玉米粉为原料,酵母菌tibscy02可通过分步糖化发酵工艺或同步糖化工艺进行发酵。分步糖化发酵工艺过程具体包括:1)拌料:加入淀粉酶搅拌;2)预液化:升高温度搅拌;3)液化:再加入淀粉酶,高温条件下搅拌;4)糖化:调节ph,加入糖化酶,搅拌;5)发酵:加入尿素,接种种子液,发酵。同步糖化发酵工艺过程具体包括:1)调浆:玉米粉加水搅拌;2)预液化:调节ph值,添加淀粉酶反应;3)液化:再次加入淀粉酶搅拌;4)同步糖化发酵:调节ph值,加入糖化酶和尿素,接种种子液,发酵。本发明还提供酵母菌tibscy02或由其传代而产生酵母菌的培养物或其加工物,例如发酵液,培养基或冻干粉等加工物,以及酵母菌tibscy02与其他菌株混合的发酵液,培养基或冻干粉等加工物。本发明筛选出了一种浓醪发酵生产乙醇的酵母菌tibscy01和酵母菌tibscy02,其均能够在高温下发酵生产乙醇。尤其是酵母菌tibscy02,其保藏编号为cgmccno.14248。相较于普通产乙醇工业酵母发酵生产乙醇,其乙醇产量均明显提高,能够耐受高温、高浓醪和抑制物等多重胁迫,解决高温浓醪发酵淀粉生产酒精中酵母细胞多重胁迫耐性不足的缺陷。酵母菌tibscy02在高温下发酵生产乙醇,可大幅度降低工业用水的用量,从而减少能量消耗,降低乙醇生产成本,而且该菌株能够利用工业用水进行大规模发酵生产乙醇,进一步降低了乙醇的生产成本,其在大规模工业生产中具有很大的潜力。附图说明图1为本发明实施例中耐高温及高温工业发酵条件下的适应性进化流程示意图;图2为本发明实施例中分步/同步糖化发酵乙醇的工艺过程图;图3为本发明实施例中酵母菌tibscy02的基因组约5kb大片段缺失区域测序深度(depth)图。具体实施方式下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1酿酒酵母tibscy02的获得本实施例中以酿酒酵母工业菌株tibscy(本实验室保藏,从自然界中分离所得)为出发菌株,以玉米粉为原料进行适应性驯化制备酿酒酵母tibscy02。其制备过程参见图1所示。细胞的转接采用程序化控制的驯化筛选培养设备(参见中国实用新型专利cn203373351u)。具体制备过程如下:参见图1,首先,将出发酵母菌株tibscy接种于驯化培养基(葡萄糖10%,蛋白胨2%,酵母膏1%,ph5.5),在30℃,200r/min条件下培养至对数生长期,以od600为0.5的起始接种量,接种到新鲜的驯化培养基中,每24小时转接一代,在37℃条件下转接15代,提高驯化温度至39℃,转接20代,然后提高驯化温度至40℃,转接39代,获得在高温条件下维持正常细胞生长的耐高温突变株tibscy01。将突变株tibscy01接种于模拟工业发酵条件的多重胁迫培养基继续进行适应性进化,该培养基为30%底物的玉米液化醪,其制备过程如下:1、调浆:玉米粉固形物(淀粉)浓度30%,含水量是12%,100ml的液化醪需要称取玉米粉34.1g,调浆后,在65℃水浴锅中搅匀,搅拌速度以能保持浆料均匀稳定为准,其中液化用水为利用玉米生产乙醇时的循环使用的工业用水(其中含有乙酸、甘油等杂质);2、液化:用硫酸将上述浆料的ph值调节至5.4-5.6;添加淀粉酶0.004g(0.12kg/吨玉米粉),加酶后开始计时,63℃-65℃维持25分钟(一直处于均匀稳定地搅拌中);将浆料转移至90℃水浴锅中,升温至90℃,二次添加淀粉酶0.004g(0.12kg/吨玉米粉),维持130分钟;降温至33℃,硫酸调节浆料的ph值至4.0-4.4(一直处于均匀稳定地搅拌中);添加糖化酶0.03g(0.88kg/吨玉米),添加尿素0.05g(1.5kg/吨玉米粉),获得玉米液化醪。将菌株tibscy01接种于装有20ml种子培养基(葡萄糖2%,蛋白胨2%,酵母膏1%,ph5.5)的50ml摇瓶中,35℃、200r/min的条件下恒温培养24小时后,转接到含有80ml玉米液化醪培养基的100ml蓝盖瓶中,接种量为每ml培养基接种1个od600的湿细胞,在40℃、200r/min条件下发酵72小时,然后弃掉一半即40ml发酵液,添加新鲜的玉米液化醪40ml(此时混合液中含有4-5%的乙醇),在40℃、200r/min条件下继续发酵72小时,重新更换新鲜的玉米液化醪,以相同的方法传代培养。以此类推,以获得能够适应高温、高浓醪、高酒精以及含有工业用水抑制物等多重胁迫的酿酒酵母菌株tibscy02,将其保存,备用。并于2017年06月15日将其藏保于中国微生物菌种保藏管理委员会普通微生物中心(保藏地址为北京市朝阳区北辰西路1号院3号),保藏编号为cgmccno.14248。实施例2酵母菌株tibscy02发酵葡萄糖测试将酵母菌株tibscy02、耐高温菌株tibscy01和出发菌株tibscy分别接种于盛有20ml种子培养基(葡萄糖2%,蛋白胨2%,酵母膏1%,ph5.5)的50ml摇瓶中,在35℃、200r/min条件下培养24小时,取5ml种子液转接到装有200ml发酵培养基(葡萄糖35%,蛋白胨2%,酵母膏1%,ph5.5)的500ml摇瓶中,在35℃、200r/min条件下发酵48小时,利用hplc检测发酵液中乙醇含量,具体实验结果如表1所示。hplc检测方法:检测柱:rezexrfq-fastacidh+(0.8%),lccolumn(100×7.8mm)检测条件:0.5mm硫酸、0.6ml/min,柱温55℃,示差检测器,温度35℃,时间为10min。表1酵母菌株tibscy02发酵葡萄糖测试实验结果乙醇产量(g/l)乙醇得率(g/g)tibscy02166.70.49tibscy01158.90.47tibscy148.70.44从表1中可以看出,酵母菌株tibscy02发酵生产乙醇的产量和得率均高于耐高温菌株tibscy01和出发菌株tibscy。与耐高温菌株tibscy01相比,酵母菌株tibscy02发酵生产乙醇的产量提高了4.9%,乙醇得率提高了4.3%;与tibscy相比,酵母菌株tibscy02发酵生产乙醇的产量提高了12.5%,乙醇得率提高了11.4%。实施例3酵母菌株tibscy02发酵玉米液化醪测试将酵母菌株tibscy02、耐高温菌株tibscy01和出发菌株tibscy分别接种于盛有20ml种子培养基(同实施例2)的50ml摇瓶中,取5ml种子液接种到装有200ml发酵培养基(实施例2中的发酵培养基中加入35%玉米液化醪,玉米液化醪的制备方法如实施例1所述)的500ml摇瓶中,在35℃、200r/min条件下发酵72小时,利用hplc检测发酵液中乙醇含量和葡萄糖残留量。hplc检测方法如实施例2所述。具体实验结果参见表2。表2酵母菌株tibscy02发酵玉米液化醪测试实验结果乙醇产量(g/l)葡萄糖残留量(g/l)淀粉转化率(g/g)tibscy02155.51.10.52tibscy01151.92.60.51tibscy134.23.20.45从表2中可以看出,酵母菌株tibscy02的乙醇产量、淀粉转化率均高于耐高温菌株tibscy01和出发菌株tibscy。与耐高温菌株tibscy01相比,酵母菌株tibscy02的乙醇产量提高了2.3%,葡萄糖残留量减少了一半以上,最终的淀粉转化率提高了0.01g/g。实施例4酵母菌株tibscy02扩大培养发酵生产乙醇将酵母菌株tibscy02接种到装有80ml一级种子培养基的250ml摇瓶中,该培养基的ph为5.5,含有下述质量百分比的组分:葡萄糖2%,蛋白胨2%,酵母膏1%。在35℃、200r/min条件下培养16小时,转接10ml培养液到含有200ml的二级种子培养基的1l摇瓶中,准备2个1l的摇瓶,共400ml的种子培养基,该培养基的ph为5.5,含有下述质量百分比的组分:葡萄糖10%,蛋白胨2%,酵母膏1%。在35℃、200r/min的摇床培养16小时,加入到发酵罐中进行同步糖化发酵。按照实例1所述方法制备4l的30%玉米液化醪,将液化醪添加到5l发酵罐中(发酵罐经过空消灭菌处理),接入400ml种子液,在温度35℃,自然ph值,转速100rpm,罐压0.005mpa,微通气条件下发酵72小时。利用hplc检测发酵液中乙醇含量和葡萄糖残留量。hplc检测方法如实施例2所述。测得乙醇产量为127g/l,葡萄糖残留为0.8g/l,淀粉转化率为0.53g/g。实施例5酵母菌株tibscy02适应性进化评价—分步/同步糖化发酵工艺比较在35℃条件下对35%玉米粉进行分步/同步糖化发酵,比较tibscy02、tibscy01、tibscy和普通产乙醇工业酵母的发酵性能,其实验结果如表3所示,具体工艺过程如图2所示。具体工艺条件如下:分步糖化发酵工艺:1)拌料:加入1/3淀粉酶,30~35℃条件下搅拌15min;2)预液化:96℃条件下搅拌50min;3)液化:加入2/3淀粉酶,94℃条件下搅拌120min;4)糖化:调节ph4.0-4.3,加入糖化酶,60℃条件下搅拌30min;5)发酵:加入尿素,接种种子液,发酵48h。同步糖化发酵工艺:1)调浆:玉米粉加水,65℃条件下搅拌10min;2)预液化:硫酸调节ph值至5.4-5.6,添加淀粉酶,65℃条件下反应25min;3)液化:加入淀粉酶,维持130min;4)同步糖化发酵:调节ph4.0-4.3,加入糖化酶和尿素,接种种子液,发酵48h。表3不同菌株分步/同步糖化工艺乙醇产量及转化率如表3所示,无论是分步还是同步糖化发酵,tibscy02都具有明显的性能优势,当进行同步糖化发酵时,最大乙醇积累可达172g/l(21.8%),分别是同等条件下tibscy01的1.03倍以及普通酵母的1.19倍。实施例6与酵母菌株tibscy02多重胁迫抗性性能关联的遗传变异通过对酵母菌株tibscy02(cgmccno.14248)进行全基因组重测序,利用比较基因组学分析手段,挖掘与出发菌株tibscy、耐高温突变株tibscy01相比,酵母菌株tibscy02中积累了非同义突变,其结果如表4所示。菌株tibscy02的基因组dna和测序文库由华大基因(中国北京)公司提取和构建,采用illuminahiseq4000高通量测序平台的150bp双端测序的方法测序。以酿酒酵母菌株s288c为参考基因组(refseqassemblyaccession:gcf_000146045.2),获得16.3百万cleanreads,测序深度为147x和97.8%的测序覆盖率。出发菌株tibscy和耐高温突变株tibscy01的基因组dna和测序文库由金唯智公司(中国苏州)提取和构建,采用illuminahiseq2000高通量测序平台的100bp双端测序的方法测序,平均获得16.6百万cleanreads,平均测序深度为145x和98%的测序覆盖率。采用mckenna等人报道的gatkv3.5基因组分析流程,检测各菌株中的单核苷酸多态性(singlenucleotidepolymorphism,snp)突变和插入/缺失(insertion/deletion,indels)突变(mckenna,a.,etal.,thegenomeanalysistoolkit:amapreduceframeworkforanalyzingnext-generationdnasequencingdata.genomeres,2010.20(9):p.1297-303.)。然后,对发生在蛋白编码区的非同义突变利用sift进行突变对蛋白功能影响的预测分析。(kumarp,henikoffs,ngpc.predictingtheeffectsofcodingnon-synonymousvariantsonproteinfunctionusingthesiftalgorithm.natprotoc.2009.4(7):1073-81.)表4tibscy02中积累的非同义突变gene注:wt:野生型;mt:突变;homo:纯合;het:杂合。siftscore越小,说明该突变对蛋白结构和功能的影响越大。基因组重测序分析锁定候选的非同义突变,分别以tibscy、tibscy01和tibscy02的基因组dna为模板,经pcr扩增突变所在的dna片段,并进行sanger测序,结果如表4所示。与tibscy相比,在tibscy01中未发现纯合的非同义突变,只发现了一个杂合突变——ira2n1887d;而与tibscy和tibscy01相比,tibscy02经过育种在基因组中积累了更多非同义突变,包括2个纯合突变——ira2n1887d和pse1s1020l,以及1个杂合突变——flc3w469l。这些突变所影响的生理功能包括:信号转导(ira2p)、核膜核孔蛋白(pse1p)以及fad转运(flc3p)。其中,ira2在tibscy中为纯合的野生型,在tibscy01中为杂合突变,而在tibscy02中为纯合的突变。同时,在tibscy02的8号染色体上6583bp至14000bp之间发现了一个约5kb大片段缺失(如图3所示),涉及cos8和arn2这两个基因功能受到破坏。cos8p是酵母细胞内体(endosome)蛋白,参与细胞膜蛋白的周转,对于多囊泡体分选途径内化质膜蛋白降解所需的,为非泛素化的载体蛋白提供泛素。arn2p是识别铁螯合物的特异转运蛋白,参与铁的吸收。本发明提供的酵母菌tibscy02是通过上述驯化方式得到的,其也可以通过基因重组获得。例如,以野生型酵母(例如tibscy)为出发菌株,通过定点非同义突变和大片段缺失突变获得。关于定点非同义突变的具体操作可参见非专利文献:atsushisatomura等,reconstructionofthermotolerantyeastbyone-pointmutationidentifiedthroughwhole-genomeanalysesofadaptively-evolvedstrains.scientificreports,2016,6,23157或者参考非专利文献:karinvoordeckers等,adaptationtohighethanolrevealscomplexevolutionarypathways,plosgenetics,11(11),2015,p.e1005635(具体原理可参见“quikchangesite-directedmutagenesiskit)。对于大片段缺失突变,可参见非专利文献matthewj.maurer,lawrencesutardja,dominicpinel,stefanbauer,amandal.muehlbauer,tylerd.ames,jeffreym.skerker,adamp.arkin,quantitativetraitloci(qtl)-guidedmetabolicengineeringofacomplextrait,acssyntheticbiology,2017,6,3,566。另外,也可以通过crispr/cas9基因组操作工具,对酵母菌tibscy基因组进行定点突变和大片段敲除进而获得酵母菌tibscy02(具体可参见非专利文献:vratislavstovicek等,crispr/cassystemforyeastgenomeengineeringadvancesandapplications,femsyeastresearch,2017,vol.17,no.5)。目前,现有的育种策略往往忽略了高温浓醪发酵时酵母细胞所面临的多重胁迫问题,会导致所得菌株实际工业应用中的局限性。本发明采用的是定向选育微生物的方法,该方法是微生物的适应性进化,微生物细胞随着培养条件的变化逐步适应某种特定条件,最后获得较高耐受力和代谢活性。本发明依据高温浓醪发酵存在的多重胁迫因素来设计育种策略,通过模拟工业发酵条件快速驯化的育种方法,有效地筛选到一株能够在40℃生长良好,残糖量低,具有多重胁迫抗性,且不影响乙醇积累水平的生产乙醇的酵母菌tibscy02,以解决高温浓醪发酵淀粉生产酒精中酵母细胞多重胁迫耐性不足的缺陷,其能够满足实际生产要求。该方法,操作简单方便,可以依据工业发酵条件的需要筛选出适合该条件的微生物菌株。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1