一种基于C‑N键的断裂来合成肟醚类化合物的方法与流程
本发明属于医药化工中间体及相关化学技术领域,具体涉及到多种肟醚类化合物的绿色合成方法。
背景技术:
肟醚类化合物广泛应用于化学领域,其化合物的骨架结构常可见于药物,天然活性产物,农用化学品等分子结构中,可见肟醚类化合物的骨架具有广阔的科研价值及市场前景。
常见的肟醚类化合物有着传统的合成方法,大致可以分为两种:一种方法是利用含有羰基或醛基官能团的化合物直接与烷氧基取代的伯胺盐酸盐进行反应,可以直接生成肟醚类化合物。另一种方法是利用含有羰基或醛基官能团的化合物直接与羟胺进行反应,然后利用卤代化合物与之进行反应,脱掉卤化氢后,得到相应的肟醚类化合物。传统的合成方法虽然一直沿用至今,但在许多底物运用上还会存在许多局限性。因此,如何通过更简单的起始原料,较少的反应步骤,温和的反应条件,以及使用廉价无污染的催化剂或氧化剂来制备肟醚类化合物的研究工作就十分必要。
技术实现要素:
本发明要解决的问题是提供一种高效的多种肟醚类化合物的合成方法。
为解决上述技术问题,本发明采用的技术方案是:
一种肟醚类化合物的合成方法,该方法包括将反应式(1)的化合物与反应式(2)的化合物在过氧化物、有机溶剂条件下反应,制得式(3)肟醚类化合物,其反应通式如下:
其中R1为C1-C6烷基(优选甲基、乙基)或苄基;R2为氢、异丁基、环己烷基、苯基、二甲基取代基、甲氧基、乙氧基、苄氧基、二甲氧基取代基、亚甲二氧基、硝基、卤素或甲砜基;R3为氢、C1-C6烷基(优选甲基、丙基)、取代C1-C6烷基、乙腈基、苄基或苯基。
优选的,所述的过氧化物为过硫酸氢钾复合盐、过硫酸钾、过硫酸钠或过硫酸铵中的一种;更优选地,所述的过氧化物为过硫酸钾。
优选地,所述的有机溶剂为乙醇,甲醇,乙二醇,乙二醇二甲醚或1,4-二氧六环的一种;更优选地,所述有机溶剂为乙醇或甲醇;最优选地,所述有机溶剂为甲醇。
优选地,所述式(1)化合物和式(2)化合物的摩尔比为1:1~1.5。
优选地,所述式(1)化合物和过氧化物的摩尔比为1:0.4~2.4。
优选地,所述有机溶剂的加入量是式(1)化合物重量的20倍。
优选地,所述反应温度为50~90℃,反应时间为12~25小时,更优选地,所述反应温度为80℃;反应时间为20小时。
本发明具有的优点和积极效果是:本发明方法的合成路线短、起始原料简单、反应条件温和、过氧化物价廉无污染,底物范围广,产物易分离,并且当扩大到克级的反应的时候,我们的反应也能得到很好的适用性。
附图说明
图1是实施例1-6化合物1a的1H核磁、13C核磁谱图。
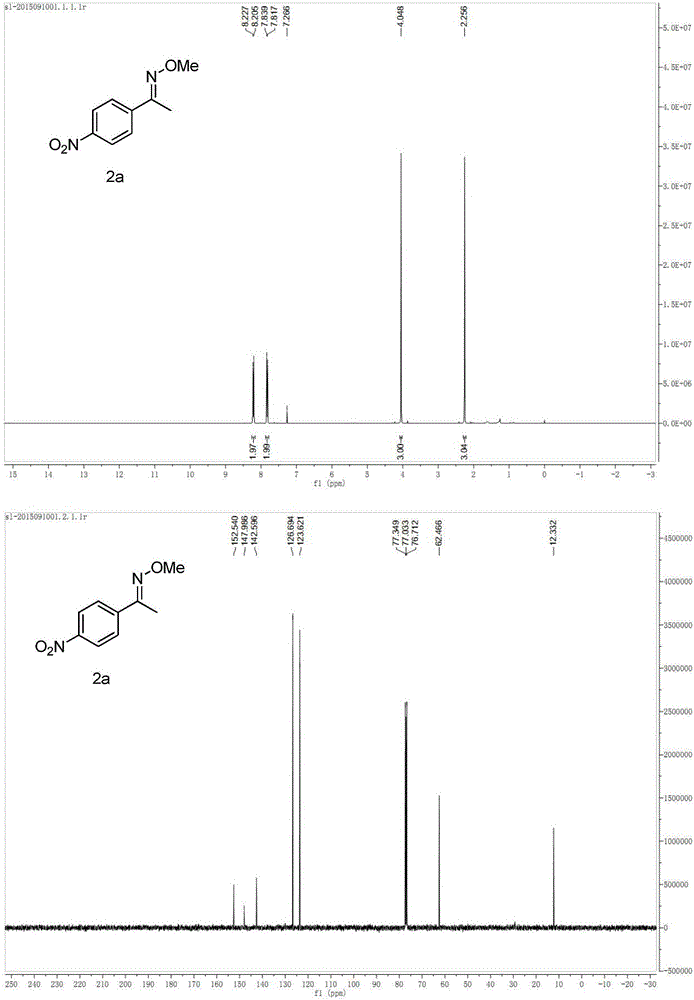
图2是实施例7化合物2a的1H核磁、13C核磁谱图。
图3是实施例8化合物3a的1H核磁、13C核磁谱图。
图4是实施例9化合物4a的1H核磁、13C核磁谱图。
图5是实施例10化合物5a的1H核磁、13C核磁谱图。
图6是实施例11化合物6a的1H核磁、13C核磁谱图。
图7是实施例12化合物7a的1H核磁、13C核磁谱图。
图8是实施例13化合物8a的1H核磁、13C核磁谱图。
图9是实施例14化合物9a的1H核磁、13C核磁谱图。
图10是实施例15化合物10a的1H核磁、13C核磁谱图。
图11是实施例16化合物11a的1H核磁、13C核磁谱图。
图12是实施例17化合物12a的1H核磁、13C核磁谱图。
图13是实施例18化合物13a的1H核磁、13C核磁谱图。
图14是实施例19化合物14a的1H核磁、13C核磁谱图。
图15是实施例20化合物15a的1H核磁、13C核磁谱图。
图16是实施例21化合物16a的1H核磁、13C核磁谱图。
具体实施方式
下面结合具体的实施例来进一步说明,但本发明的保护范围不局限于实施例表示的范围。
起初筛选反应是在N甲氧基苯甲酰胺投的0.5mmol的条件下进行的,当我们将原料N甲氧基苯甲酰胺投的量扩大到g级进行反应时,发现也取得了很高的产率。即在圆底烧瓶中加入对乙氧基苯乙酮(10.5mmol,1.8g)、N甲氧基苯甲酰胺(7.0mmol,1.1g)、过硫酸钾(14.0mmol,3.8g)、无水甲醇30mL,封口,在80度下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=600:1)得到1-(4-ethoxyphenyl)ethanone O-methyl oxime 1.3g,产率94%。
实施例1:1-(4-ethoxyphenyl)ethanone O-methyl oxime(1a)的合成
在反应器中加入对乙氧基苯乙酮(0.75mmol,127mg)、N-甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=600:1)得到1-(4-ethoxyphenyl)ethanone O-methyl oxime(1a)90.8mg,产率94%。
1H NMR(400MHz,CDCl3):δ7.58(d,J=8.5Hz,2H),6.87(d,J=8.5Hz,2H),4.04(q,J=7.0Hz,2H),3.97(s,3H),2.19(s,3H),1.41(t,J=7.0Hz,3H);13C NMR(100MHz,CDCl3):δ159.8,154.3,129.0,127.3,114.3,63.5,61.8,14.8,12.5.
实施例2:1-(4-ethoxyphenyl)ethanone O-methyl oxime(1a)的合成
在反应器中加入对乙氧基苯乙酮(0.75mmol,127mg)、N-甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钠(1.0mmol,238.1mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=600:1)得到1-(4-ethoxyphenyl)ethanone O-methyl oxime(1a)45.1mg,产率47%。
实施例3:1-(4-ethoxyphenyl)ethanone O-methyl oxime(1a)的合成
在反应器中加入对乙氧基苯乙酮(0.75mmol,127mg)、N-甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水乙醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=600:1)得到1-(4-ethoxyphenyl)ethanone O-methyl oxime(1a)26.1mg,产率27%。
实施例4:1-(4-ethoxyphenyl)ethanone O-methyl oxime(1a)的合成
在反应器中加入对乙氧基苯乙酮(0.75mmol,127mg)、N-甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在60℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=600:1)得到1-(4-ethoxyphenyl)ethanone O-methyl oxime(1a)38.6mg,产率40%。
实施例5:1-(4-ethoxyphenyl)ethanone O-methyl oxime(1a)的合成
在反应器中加入对乙氧基苯乙酮(0.75mmol,127mg)、N-甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应12小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=600:1)得到1-(4-ethoxyphenyl)ethanone O-methyl oxime(1a)59.9mg,产率62%。
实施例6:1-(4-ethoxyphenyl)ethanone O-methyl oxime(1a)的合成
在反应器中加入对乙氧基苯乙酮(0.5mmol,85mg)、N-甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=600:1)得到1-(4-ethoxyphenyl)ethanone O-methyl oxime(1a)83.1mg,产率86%。
实施例7:1-(4-nitrophenyl)ethanone O-methyl oxime(2a)的合成
在反应器中加入对硝基苯乙酮(0.75mmol,128mg)、N甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=600:1)得到1-(4-nitrophenyl)ethanone O-methyl oxime(2a)83.5mg,产率86%。
1H NMR(400MHz,CDCl3):δ8.22(d,J=8.9Hz,2H),7.83(d,J=8.9Hz,2H),4.05(s,3H),2.26(s,3H).13C NMR(100MHz,CDCl3):δ152.5,148.0,142.6,126.7,123.6,62.5,12.3.
实施例8:1-(4-(methylsulfonyl)phenyl)ethanone O-methyl oxime(3a)的合成
在反应器中加入对甲砜基苯乙酮(0.75mmol,152mg)、N甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=5:1)得到1-(4-(methylsulfonyl)phenyl)ethanone O-methyl oxime(3a)86.3mg,产率76%。
1H NMR(400MHz,CDCl3):δ7.93(d,J=8.3Hz,2H),7.85(d,J=8.3Hz,2H),4.04(s,3H),3.06(s,3H),2.25(s,3H).13C NMR(100MHz,CDCl3):δ152.8,141.8,140.5,127.5,126.8,62.4,44.5,12.4.
实施例9:1-(3,4-dimethoxyphenyl)ethanone O-methyl oxime(4a)的合成
在反应器中加入3,4-二甲氧基苯乙酮(0.75mmol,139mg)、N甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=10:1)得到1-(3,4-dimethoxyphenyl)ethanone O-methyl oxime(4a)101.3mg,产率97%。
1H NMR(400MHz,CDCl3):δ7.30(d,J=2.1Hz,1H),7.14(dd,J=8.3,2.1Hz,1H),6.84(d,J=8.4Hz,1H),3.99(s,3H),3.91(d,J=13.2Hz,6H),2.21(s,3H).13C NMR(100MHz,CDCl3):δ154.2,150.1,148.9,129.4,119.1,110.6,108.6,61.8,55.9,12.5.
实施例10:4-methylbenzaldehyde O-methyl oxime(5a)的合成
在反应器中加入对甲基苯甲醛(0.75mmol,92uL)、N甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚)得到4-methylbenzaldehyde O-methyl oxime(4a)55.1mg,产率74%。
1H NMR(400MHz,CDCl3):δ8.03(s,1H),7.47(d,J=8.1Hz,2H),7.17(d,J=7.9Hz,2H),3.96(s,3H),2.35(s,3H).13C NMR(100MHz,CDCl3):δ148.6,140.0,129.4,127.0,61.9,21.5.
实施例11:4-chlorobenzaldehyde O-methyl oxime(6a)的合成
在反应器中加入对氯苯甲醛(0.75mmol,109mg)、N甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚)得到4-chlorobenzaldehyde O-methyl oxime(6a)57.2mg,产率68%。
1H NMR(400MHz,CDCl3):δ8.01(s,1H),7.51(d,J=8.5Hz,2H),7.34(d,J=8.5Hz,2H),3.97(s,3H).13C NMR(100MHz,CDCl3):δ147.4,135.7,130.7,129.0,128.2,62.2.
实施例12:3,4-dimethylbenzaldehyde O-methyl oxime(7a)的合成
在反应器中加入3,4-二甲基苯甲醛(0.75mmol,102uL)、N甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=800:1)得到3,4-dimethylbenzaldehyde O-methyl oxime(7a)64.3mg,产率79%。
1H NMR(400MHz,CDCl3):δ8.01(s,1H),7.38(s,1H),7.28(d,J=7.7Hz,1H),7.12(d,J=7.7Hz,1H),3.96(s,3H),2.26(s,6H).13C NMR(100MHz,CDCl3):δ148.9,138.8,137.0,130.0,129.7,127.9,124.9,61.9,19.8,19.7.
实施例13:4-(benzyloxy)benzaldehyde O-methyl oxime(8a)的合成
在反应器中加入对苄氧基苯甲醛(0.75mmol,163mg)、N甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=600:1)得到4-(benzyloxy)benzaldehyde O-methyl oxime(8a)107.4mg,产率89%。
1H NMR(400MHz,CDCl3):δ8.01(s,1H),7.51(d,J=8.7Hz,2H),7.44–7.32(m,5H),6.96(d,J=8.7Hz,2H),5.07(s,2H),3.94(s,3H).13C NMR(100MHz,CDCl3):δ160.1,148.2,136.6,128.7,128.5,128.1,127.5,125.1,115.1,70.1,61.9.
实施例14:3-(methoxyimino)-3-phenylpropanenitrile(9a)的合成
在反应器中加入苯甲酰乙腈(0.75mmol,111mg)、N甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=400:1)得到3-(methoxyimino)-3-phenylpropanenitrile(9a)67.3mg,产率77%。
1H NMR(400MHz,CDCl3):δ7.64(s,2H),7.42(s,3H),4.08(s,3H),3.77(s,2H).13C NMR(100MHz,CDCl3):δ146.3,133.2,130.2,128.9,126.2,115.0,62.8,15.1.
实施例15:1,2-diphenylethanone O-methyl oxime(10a)的合成
在反应器中加入二苯乙酮(0.75mmol,152mg)、N甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚)得到1,2-diphenylethanone O-methyl oxime(10a)58.3mg,产率52%。
1H NMR(400MHz,CDCl3):δ7.66–7.60(m,2H),7.32–7.30(m,3H),7.27–7.14(m,5H),4.14(s,2H),4.02(s,3H).13C NMR(100MHz,CDCl3):δ156.1,136.7,135.7,129.1,128.6,128.5,128.5,126.5,126.3,62.1,32.7.
实施例16:1-phenylbutan-1-one O-methyl oxime(11a)的合成
在反应器中加入丁酰苯(0.75mmol,110uL)、N甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=1000:1)得到1-phenylbutan-1-one O-methyl oxime(11a)54.9mg,产率62%。
1H NMR(400MHz,CDCl3):δ7.65–7.59(m,2H),7.39–7.30(m,3H),3.97(s,3H),2.75–2.68(m,2H),1.60–1.51(m,2H),0.95(t,J=7.4Hz,3H).13C NMR(100MHz,CDCl3):δ158.7,136.0,129.0,128.4,126.3,61.8,28.6,20.0,14.3.
实施例17:2-bromo-1-phenylethanone O-methyl oxime(12a)的合成
在反应器中加入2,-溴苯乙酮(0.75mmol,151mg)、N甲氧基苯甲酰胺(0.5mmol,78.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚)得到2-bromo-1-phenylethanone O-methyl oxime(12a)56.3mg,产率98%。
NMR(400MHz,CDCl3):δ7.72–7.69(m,2H),7.43–7.37(m,3H),4.35(s,2H),4.09(s,3H).13C NMR(100MHz,CDCl3):δ152.6,133.5,129.7,128.7,126.0,62.8,18.1.
实施例18:1-(4-ethoxyphenyl)ethanone O-ethyl oxime(13a)的合成
在反应器中加入对乙氧基苯乙酮(0.75mmol,127mg)、N乙氧基苯甲酰胺(0.5mmol,85.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=600:1)得到1-(4-ethoxyphenyl)ethanone O-ethyl oxime(13a)100.4mg,产率97%。
1H NMR(400MHz,CDCl3):δ7.58(d,J=8.9Hz,2H),6.87(d,J=8.9Hz,2H),4.22(q,J=7.0Hz,2H),4.04(q,J=7.0Hz,2H),2.20(s,3H),1.41(t,J=7.0Hz,3H),1.32(t,J=7.0Hz,3H).13C NMR(100MHz,CDCl3):δ159.7,153.9,129.3,127.3,114.3,69.5,63.5,14.8,12.7.
实施例19:1-(4-nitrophenyl)ethanone O-ethyl oxime(14a)的合成
在反应器中加入对硝基苯乙酮(0.75mmol,128mg)、N乙氧基苯甲酰胺(0.5mmol,85.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=600:1)得到1-(4-nitrophenyl)ethanone O-ethyl oxime(14a)95.1mg,产率91%。
1H NMR(400MHz,CDCl3):δ8.21(d,J=9.0Hz,2H),7.83(d,J=9.0Hz,2H),4.30(q,J=7.1Hz,2H),2.26(s,3H),1.35(t,J=7.1Hz,3H).13C NMR(100MHz,CDCl3):δ152.1,147.9,142.9,123.6,70.4,14.8,12.4.
实施例20:1-(4-ethoxyphenyl)ethanone O-benzyl oxime(15a)的合成
在反应器中加入对乙氧基苯乙酮(0.75mmol,127mg)、N苄氧基苯甲酰胺(0.5mmol,117.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=600:1)得到1-(4-ethoxyphenyl)ethanone O-benzyl oxime(15a)115.4mg,产率86%。
1H NMR(400MHz,CDCl3):δ7.57(d,J=8.8Hz,2H),7.41(d,J=7.3Hz,2H),7.35(t,J=7.4Hz,2H),7.31-7.27(m,1H),6.86(d,J=8.8Hz,2H),5.22(s,2H),4.02(q,J=7.0Hz,2H),2.23(s,3H),1.40(t,J=7.0Hz,3H).13C NMR(100MHz,CDCl3):δ159.8,154.6,138.3,129.0,128.4,128.2,127.7,127.4,114.3,76.1,63.5,14.8,12.8.
实施例21:4-(benzyloxy)benzaldehyde O-benzyl oxime(16a)的合成
在反应器中加入对苄氧基苯甲醛(0.75mmol,163mg)、N苄氧基苯甲酰胺(0.5mmol,117.2mg)、过硫酸钾(1.0mmol,270.3mg)、无水甲醇2mL,封口,在80℃下搅拌反应20小时。冷却至室温,减压除去溶剂后,通过柱层析分离纯化(洗脱剂为石油醚/乙酸乙酯=500:1)得到4-(benzyloxy)benzaldehyde O-benzyl oxime(16a)140.7mg,产率89%。
1H NMR(400MHz,CDCl3):δ8.08(s,1H),7.51(d,J=8.7Hz,2H),7.43-7.30(m,10H),6.95(d,J=8.7Hz,2H),5.18(s,2H),5.07(s,2H).13C NMR(100MHz,CDCl3):δ160.1,148.7,137.7,136.6,128.7,128.6,128.4,128.4,128.1,127.9,127.5,125.1,115.1,76.3,70.1.
以上对本发明创造的实施例进行了详细说明,但所述内容仅为本发明创造的较佳实施例,不能被认为用于限定本发明的实施范围。凡依本发明创造范围所作的均等变化与改进等,均应仍归属于本专利涵盖范围之内。
- 还没有人留言评论。精彩留言会获得点赞!