一种从红茶中提取茶黄素的方法与流程
本发明属于植物提取技术领域。更具体地,涉及一种从红茶中提取茶黄素的方法。
背景技术:
茶黄素(theaflavins,TFs)是在红茶发酵过程中茶多酚物质氧化形成的主要色素物质,其中茶黄素、其中茶黄素(TF1)、茶黄素-3-没食子酸酯(TF2A)、茶黄素-3'-没食子酸酯(TF2B)和茶黄素-3,3'-双没食子酸酯(TF3)是4种最主要的茶黄素。茶黄素不仅是红茶滋味和汤色最重要的影响因子,而且具有治疗心血管系统疾病、抗炎、抗氧化、抗病毒、增强免疫力、降血糖、抗肿瘤等多种药理功效,是一类极具开发潜力的产物。
目前,从红茶中提取茶黄素粗提物的方法主要有:(1)Collier法,该方法主要步骤是:样品用热水浸提→过滤→浓缩→干燥→甲醇、水溶解→三氯甲烷萃取(除去杂质)→水相减压浓缩→乙酸乙酯反复萃取→硫酸镁脱水→蒸馏至干→茶黄素粗提物。该方法工艺技术比较简单,但有机溶剂用量多。(2)Ullah法,该方法的主要步骤是:样品用水浸提→过滤→滤液减压浓缩→三氯甲烷萃取(除去咖啡碱等杂质)→磷酸二氢钠和乙酸乙酯混合萃取→乙酸乙酯经减压浓缩干燥,得茶黄素粗提物。该方法工艺简单,只需一次萃取,分离效果较好,但使用了有毒有机溶剂。
4种主要的茶黄素单体TF1、TF2A、TF2B、TF3的分离纯化的方法主要包括纤维素柱层析、葡聚糖凝胶(Sephadex LH-20)柱层析、硅胶柱层析、聚酰胺柱层析和高速逆流色谱等。早在20世纪50年代,Takino等应用硅胶层析初步分离,纤维素柱层析精制的方法成功地分离得到TF3、TF1a、TFlb。Crispin等(1971年),竹尾忠一等(1973年),Collier等(1973年)用Sephadex LH-20柱层析或者Sephadex LH-20联合硅胶柱层析,分离得到TF3、TF2、TF1。硅胶柱层析法、纤维素柱层析法、Sephadex LH-20柱层析法均只能分离得到TF1单体和TF3单体,无法分离同分异构体的TF2A和TF2B。SephadexLH-20柱层析法成本高,分离量少,分离时间长,并且多次使用时会造成不可逆吸附污染,分离效果变差。江和源等(2000)首次利用高速逆流色谱分离茶黄素;杨子银等(2008)通过增加NaHCO3的前处理步骤以及优化洗脱溶剂系统等对高速逆流色谱方法进行了改进,较好地分离了茶黄素单体;王坤波等(2008)优化高速逆流色谱分离获得4种茶黄素单体。高速逆流色谱法虽然可以分离制备得到四种主要茶黄素单体,分离时间较柱层析法短,但是仍然存在制备量较小、仪器昂贵等缺点。另外,目前,聚酰胺柱层析法在茶黄素分离纯化中也有应用,具有分离效果好、填料价格低廉、制备量大和产品纯度高的特点,但是耗时量相对较长。
技术实现要素:
本发明要解决的技术问题是克服现有天然茶黄素提取的得率低和纯度低,大量使用有毒试剂等缺陷和不足,提供一种从红茶中提取天然茶黄素的方法。该方法以红茶为原料,经过醇提、萃取、脱色、除杂、提纯等步骤,对红茶中的总茶黄素进行提取,此提取方法步骤简单,所使用的试剂不涉及剧毒有机溶剂,红茶茶黄素的得率和纯度均较高。
本发明的目的是提供一种从红茶中提取茶黄素的方法。
本发明上述目的通过以下技术方案实现:
一种从红茶中提取茶黄素的方法,包括如下步骤:
S1.醇提:采用乙醇溶液对红茶进行提取,得到红茶提取液;
S2.乙酸乙酯萃取:采用乙酸乙酯对红茶提取液进行萃取,得到乙酸乙酯层提取物;
S3.脱色:利用MCl反相色谱柱将S2所得乙酸乙酯层提取物去除叶绿素,得到脱色茶黄素粗品;
S4.乙酸乙酯洗脱:S3所得脱色茶黄素粗品上硅胶柱,采用乙酸乙酯-乙酸溶液进行洗脱,收集茶黄素段的洗脱液,得到茶黄素粗品;
S5.除杂:S4所得的茶黄素粗品上MCl反相色谱柱,采用甲醇-乙酸溶液进行梯度洗脱,除去杂质并收集茶黄素段的洗脱液,得到纯化茶黄素;
S6.提纯:S5所得的茶黄素粗品上C18柱,采用不同浓度的甲醇-乙酸溶液进行梯度洗脱,除去杂质并收集茶黄素段的洗脱液,得到高纯度茶黄素。
更具体地,上述从红茶中提取茶黄素的方法包括如下步骤:
S1.醇提:采用乙醇溶液对红茶进行回流提取,所得提取液进行旋转浓缩除去乙醇,得到红茶浓缩提取液;
S2.乙酸乙酯萃取:采用乙酸乙酯对红茶浓缩提取液进行萃取,旋转浓缩除去乙酸乙酯,冷冻干燥得到乙酸乙酯层提取物;
S3.脱色:取乙酸乙酯层提取物用甲醇溶液溶解,通过MCl反相色谱填料短柱吸附脱除叶绿素,用甲醇溶液洗脱,收集洗脱液并浓缩干燥得到脱色茶黄素粗品;
S4.乙酸乙酯洗脱:取S3所得脱色茶黄素粗品用甲醇溶解后,采用干法拌硅胶,装硅胶柱后,采用乙酸乙酯-乙酸溶液进行洗脱,通过液相色谱检测收集茶黄素段的洗脱液,收集合并洗脱液并浓缩干燥,得到茶黄素粗品;
S5.除杂:取S4所得的茶黄素粗品用甲醇-乙酸溶液溶解样品后,采用MCl反相色谱柱,通过不同浓度的甲醇-乙酸溶液进行梯度洗脱,通过液相色谱检测除去杂质,再用甲醇-乙酸溶液洗脱收集茶黄素段的洗脱液,合并茶黄素段洗脱液并浓缩干燥,得到纯化茶黄素;
S6.提纯:取S5所得的茶黄素粗品用甲醇-乙酸溶液溶解样品后,采用C18反相色谱柱,通过不同浓度的甲醇-乙酸溶液进行梯度洗脱,通过液相色谱检测除去杂质,再用甲醇-乙酸溶液进行洗脱收集茶黄素段的洗脱液,合并茶黄素段洗脱液并浓缩干燥,得到高纯度茶黄素。
优选地,步骤S1所述乙醇为食品级乙醇,乙醇溶液浓度为45~55%,料液比(w/v)为1:8~1:10,回流提取次数为3~4次。
更优选地,步骤S1所述醇提的乙醇溶液浓度为50%。更优选地,所述料液比(w/v)为1:10。更优选地,所述回流提取次数为3次。
优选地,步骤S2所述乙酸乙酯萃取所使用的乙酸乙酯为分析纯,所述红茶浓缩提取液和乙酸乙酯的体积比为1:1~1:2,萃取次数为3~4次。
更优选地,红茶浓缩提取液和乙酸乙酯的体积比为1:1。更优选地,所述萃取次数为3次。
优选地,步骤S3所述甲醇溶液的浓度为75%~85%,甲醇溶液pH值为3.0~4.0。
更优选地,所述甲醇溶液浓度为80%。
更优选地,所述甲醇溶液pH值为3.5。
优选地,步骤S4中,乙酸和乙酸乙酯的体积比为1:40~1:60。
更优选地,所述乙酸和乙酸乙酯的体积比为1:50。
优选地,步骤S5中用以溶解茶黄素粗品的甲醇-乙酸溶液中,甲醇浓度是35%~45%,乙酸的浓度是0.05%~0.1%;用以洗脱样品杂质的甲醇-乙酸溶液中,甲醇浓度是35%~45%,乙酸的浓度是0.05%~0.1%;用以洗脱茶黄素段样品的甲醇-乙酸溶液中,甲醇浓度是55%~65%,乙酸的浓度是0.05%~0.1%。
更优选地,溶解茶黄素粗品所用甲醇-乙酸溶液的浓度为除杂洗脱的初始浓度。
更优选地,所述用以洗脱样品杂质的甲醇-乙酸溶液中,甲醇浓度为40%,乙酸的浓度范围是0.1%。
更优选地,所述用以洗脱茶黄素段样品的甲醇-乙酸溶液中,甲醇浓度为60%,乙酸的浓度范围是0.1%。
优选地,步骤S6中,用以溶解茶黄素粗品的甲醇-乙酸溶液中,甲醇浓度是30%~35%,乙酸浓度是0.05%~0.1%;用以洗脱样品杂质的甲醇-乙酸溶液中,甲醇浓度是30%~35%,乙酸浓度是0.05%~0.1%;用以洗脱茶黄素段样品的甲醇-乙酸溶液中,甲醇浓度是50%~55%,乙酸浓度是0.05%~0.1%。
更优选地,溶解茶黄素粗品所用甲醇-乙酸溶液的浓度为除杂洗脱的初始浓度。
更优选地,用以洗脱样品杂质的甲醇-乙酸溶液中,甲醇浓度为30%,乙酸浓度是0.1%。
更优选地,用以洗脱茶黄素段样品的甲醇-乙酸溶液中,甲醇浓度为50%,乙酸浓度是0.1%。
另外,上述方法的应用也应在本发明的保护范围之内。
另外,根据上述方法制备得到的茶黄素,也在本发明的保护范围之内。
本发明具有以下有益效果:
本发明提供一种从红茶中提取天然茶黄素的方法,该方法以红茶为原料,通过醇提、萃取、脱色、除杂、提纯等步骤,对红茶中的总茶黄素进行提取,步骤简单,不涉及剧毒试剂,所需试剂为常见化学试剂,且用量不大,可重复回收利用。
另外,此提取方法所得红茶总茶黄素的得率较高,杂质较少,茶黄素纯度可达90%以上,得率达到0.5%以上。此提取工艺克服现有天然茶黄素提取的得率低和纯度低的缺陷和不足。
附图说明
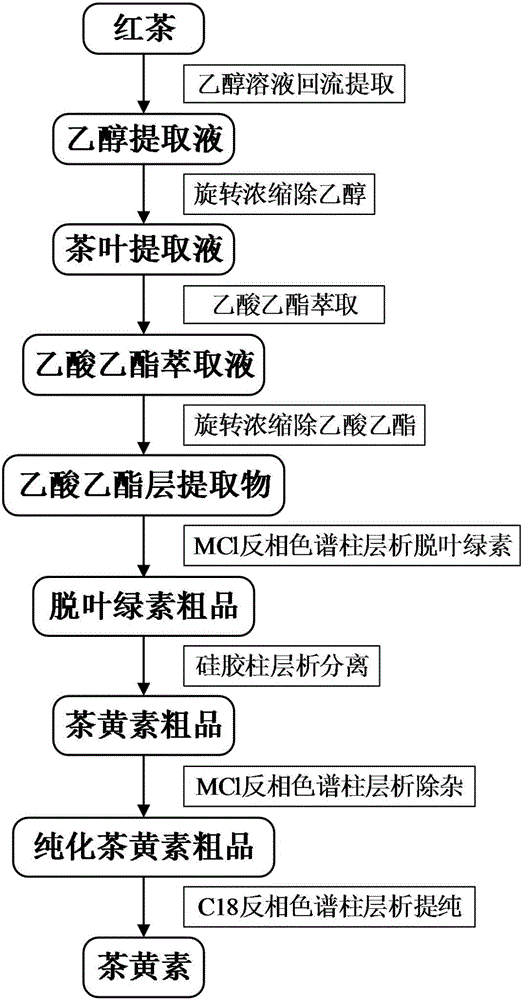
图1为红茶茶黄素提取的工艺流程图。
图2为4种茶黄素单体标准样品液相色谱图。
图3为茶黄素单体TF1的标准曲线图。
图4为茶黄素单体TF2A的标准曲线图。
图5为茶黄素单体TF2B的标准曲线图。
图6为茶黄素单体TF3的标准曲线图。
图7为茶黄素(英红九号红茶为原料)的4种茶黄素单体液相色谱图。
图8为茶黄素(金萱红茶为原料)的4种茶黄素单体液相色谱图。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1红茶茶黄素的提取方法
如图1所示,红茶茶黄素的提取方法,步骤如下:
(1)选用英红九号红茶为原料,粉碎后过60目筛,按固液比(w/v)为1:10加入50%的乙醇溶液,回流提取3次,合并提取液并旋转浓缩至无乙醇;
(2)采用乙酸乙酯对红茶浓缩提取液进行萃取,红茶浓缩提取液和乙酸乙酯的体积比为1:1,萃取次数为3次,合并乙酸乙酯萃取液并旋转浓缩除去乙酸乙酯,冷冻干燥得到乙酸乙酯层提取物;
(3)取乙酸乙酯层提取物用80%甲醇溶液(用乙酸调节pH值为3.5)溶解,通过MCl反相色谱填料短柱脱除叶绿素后用80%甲醇溶液(pH值为3.5)洗脱至无红色,收集洗脱液并浓缩干燥得到脱色茶黄素粗品;
(4)取脱色茶黄素粗品,甲醇溶解样品后,采用干法拌硅胶,装硅胶柱后,以乙酸乙酯(含2%乙酸)进行洗脱,通过液相色谱检测收集茶黄素段的洗脱液,收集合并洗脱液并浓缩干燥得到茶黄素粗品;
(5)取茶黄素粗品,用40%甲醇溶液(含0.1%乙酸)溶解样品后,采用MCl反相色谱柱以40%甲醇溶液(含0.1%乙酸)洗脱除去前杂,再用60%甲醇溶液(含0.1%乙酸)洗脱,收集茶黄素段的洗脱液,合并茶黄素段洗脱液并浓缩干燥得到纯化茶黄素;
(6)取纯化过的茶黄素样品用30%甲醇溶液(含0.1%乙酸)溶解样品后,采用C18反相色谱柱,以30%甲醇溶液(含0.1%乙酸)进行洗脱,除去前杂,再用50%甲醇溶液(含0.1%乙酸)进行洗脱,收集茶黄素段的洗脱液,合并茶黄素段洗脱液,合并茶黄素段洗脱液并浓缩干燥得到高纯度英红九号红茶茶黄素。
实施例2红茶茶黄素的提取方法
如图1所示,红茶茶黄素的提取方法,步骤如下:
(1)选用金萱红茶为原料,粉碎后过60目筛,按固液比(w/v)为1:8加入50%的乙醇溶液,回流提取4次,合并提取液并旋转浓缩至无乙醇;
(2)采用乙酸乙酯对红茶浓缩提取液进行萃取,红茶浓缩提取液和乙酸乙酯的体积比为1:2,萃取次数为2次,合并乙酸乙酯萃取液并旋转浓缩除去乙酸乙酯,冷冻干燥得到乙酸乙酯层提取物;
(3)取乙酸乙酯层提取物用85%甲醇溶液(用乙酸调节pH值为3.0)溶解,通过MCl反相色谱填料短柱脱除叶绿素后用85%甲醇溶液(pH值为3.0)洗脱至无红色,收集洗脱液并浓缩干燥得到脱色茶黄素粗品;
(4)取脱色茶黄素粗品,甲醇溶解样品后,采用干法拌硅胶,装硅胶柱后,以乙酸乙酯(含1.5%乙酸)进行洗脱,通过液相色谱检测收集茶黄素段的洗脱液,收集合并洗脱液并浓缩干燥得到茶黄素粗品;
(5)取茶黄素粗品,用45%甲醇溶液(含0.1%乙酸)溶解样品后,采用MCl反相色谱柱以45%甲醇溶液(含0.1%乙酸)洗脱除去前杂,再用65%甲醇溶液(含0.1%乙酸)洗脱,收集茶黄素段的洗脱液,合并茶黄素段洗脱液并浓缩干燥得到纯化茶黄素;
(6)取纯化过的茶黄素样品用35%甲醇溶液(含0.1%乙酸)溶解样品后,采用C18反相色谱柱,以35%甲醇溶液(含0.1%乙酸)进行洗脱,除去前杂,再用55%甲醇溶液(含0.1%乙酸)进行洗脱,收集茶黄素段的洗脱液,合并茶黄素段洗脱液,合并茶黄素段洗脱液并浓缩干燥得到高纯度金萱红茶茶黄素。
以下实施例对上述提取的茶黄素进行测定。
实施例3英红九号红茶茶黄素纯度测定
1实验方法
1.1仪器与试剂
仪器:高效液相色谱仪、超声波清洗仪、砂芯抽滤器、超纯水发生器、分析天平(感量0.0001g)、恒温水浴锅等。
试剂:乙腈色谱纯;乙酸乙酯、乙酸为优级纯;标准品:TF2A、TF2B、TF3、TF。
1.2色谱条件
流动相:A相:乙腈:乙酸乙酯=7:1(v:v)B相:2%乙酸
流速:0.8mL/min
柱温:35℃
波长:紫外280nm
柱子:C18色谱柱(粒径5μm,250mm×4.6mm)
进样量:10μL
洗脱:梯度洗脱,梯度洗脱程序见下表1:
表1
1.3流动相的配制
流动相A:用量筒量取700mL乙腈和100mL乙酸乙酯,混匀,过0.45μm膜,超声脱气30min以上,备用。
流动相B:用移液管吸取20mL乙酸于1000mL容量瓶中,加入超纯水定容,摇匀,超声脱气30min以上,备用。
1.4标准品溶液的配制
精密称取TF1、TF2A、TF2B、TF3标准品0.0100g,置于一个10mL容量瓶中,用超纯水溶解定容,摇匀,得到茶黄素混合标准溶液储备液(1.00mg/mL)。
分别精密吸取1mL、1.5mL、2mL、2.5mL的储备液于10mL的容量瓶中,用超纯水溶解定容,摇匀,得到浓度为100μg/mL、150μg/mL、200μg/mL、250μg/mL的标准曲线工作液。
配好的标样均置于4℃避光保存备用。
1.5样品处理
称取5.00mg茶黄素样品,用超纯水溶解后定容至10mL容量瓶,摇匀,然后用0.45μm的滤膜过滤,所得滤液直接用于HPLC分析茶黄素单体含量。
1.6准曲线的制作
将不同浓度的标准曲线工作液分别以10μL进样,以峰面积(Y,μV·S)对质量浓度(X,μg/mL)作图,绘制标准曲线,对结果进行回归分析。
得出回归方程:Y=a·X±b
1.7含量计算
X:所测样品茶黄素单体浓度(μg/mL)
V:所测样品溶液的体积,单位为毫升(mL)
m:样品称取量,单位为克(g)
M:样品的干物质含量,%。
2实验结果
表2英红九号红茶茶黄素4种单体的含量(mg/g)
通过液相色谱分析英红九号红茶茶黄素的结果表明,每克茶黄素中茶黄素单体TF1的含量为125.38mg/g,TF2A的含量为257.75mg/g,TF2B的含量为89.00mg/g,TF3的含量为452.96mg/g,每克英红九号红茶茶黄素中4种茶黄素单体总量达到925.09mg/g,即所提取的茶黄素纯度达到92.51%以上。
实施例4金萱红茶茶黄素纯度测定
1实验方法
实验方法同实施例3的实验方法。
2实验结果
表3金萱红茶茶黄素4种单体的含量(mg/g)
通过液相色谱分析英红九金萱红茶茶黄素的结果表明,每克茶黄素中茶黄素单体TF1的含量为128.23mg/g,TF2A的含量为28.49mg/g,TF2B的含量为253.43mg/g,TF3的含量为480.21mg/g,每克金萱红茶茶黄素中4种茶黄素单体总量达到890.29mg/g,即所提取的茶黄素纯度达到89.03%以上。
另外,图2为4种茶黄素单体标准样品液相色谱图。
图3为茶黄素单体TF1的标准曲线图。
图4为茶黄素单体TF2A的标准曲线图。
图5为茶黄素单体TF2B的标准曲线图。
图6为茶黄素单体TF3的标准曲线图。
图7为茶黄素(英红九号红茶为原料)的4种茶黄素单体液相色谱图。
图8为茶黄素(金萱红茶为原料)的4种茶黄素单体液相色谱图。
- 还没有人留言评论。精彩留言会获得点赞!