一种治疗脑损伤的合成肽的制作方法
本发明属于生物医药技术领域,具体涉及合成肽及其在制备治疗脑损伤药物中的用途。
背景技术:
甘氨酸是化学结构最简单的氨基酸,但具有复杂的功能。甘氨酸在中枢神经系统中是一种重要的抑制性神经递质,在控制神经元兴奋性方面发挥重要作用。动物实验发现甘氨酸具有明显的神经保护作用,并且在一些临床试验中也发现甘氨酸可明显改善认知功能障碍和痴呆,尤其是可以作为一个常规的精神安定剂治疗精神分裂症。除此之外,甘氨酸还可以治疗心脏损伤和脑卒中。
L-半胱氨酸是一种神经调节物质,也是一种具有神经保护作用的抗氧化剂。同时,它也是脑内谷胱甘肽的重要合成单位,合成的谷胱甘肽对于脑缺血再灌注损伤和帕金森病都有明显的治疗作用。
L-苯丙氨酸是人体必需氨基酸之一,属芳香族氨基酸。已有研究表明,L-苯丙氨酸可作为抗癌药物的载体将药物分子直接导入癌瘤区,其效果是其他氨基酸的3~5倍。
尽管甘氨酸和半胱氨酸都有明显的脑保护作用,但是外周给甘氨酸(800mg/kg)和半胱氨酸(500mg/kg)剂量过大,导致副反应严重,限制了它们的临床应用。
技术实现要素:
本发明针对现有技术存在的问题,提供了一类新的合成肽,它是由甘氨酸,半胱氨酸,丙氨酸和苯丙氨酸四种天然氨基酸为原料脱水缩合而成,在生物学上是有活性的,在诊断学上是有用的并具有治疗脑损伤的作用。这些肽类特别稳定并易透过血脑屏障,因此通过静脉途径给药仍是有效的。
本发明的第一方面,提供了一种合成肽,其结构特征,自N端至C端如下式I:
X1-X2-L-Ala-(L-Cys-Gly)n-X3(I),式中,
X1是无或L-Phe
X2是无或L-Cys
X3是无或L-Phe
X1、X3不能同时为无,n≤8,n为L-Cys-Gly的排列在序列中的重复次数,该类合成肽中存在三种蛋白水解酶切割位点,一个是L-Cys与Gly的连接点,一个是L-Cys与L-Ala的连接点,一个是肽两端L-Phe与式I中其它任意氨基酸的连接点,蛋白水解酶切割后产生游离Gly和L-Cys作为药物或药理活性基团,L-Ala是疏水性氨基酸,促进合成肽穿透细胞膜,L-Phe作为穿透细胞膜的载体,可携带合成肽分子穿过血脑屏障,进入大脑。
本发明中氨基酸缩写简称如下:
甘氨酸:Gly,G;L-半胱氨酸:L-Cys,C;L-苯丙氨酸:L-Phe,F;L-丙氨酸:L-Ala,A。
本发明中提到的Cys、Phe、Ala都是L型的。
在另一优选例中,合成肽可以选自以下任意一种:
(a)NH2-L-Phe-L-Ala-L-Cys-Gly-COOH;
(b)NH2-L-Phe-L-Cys-L-Ala-L-Cys-Gly-COOH;
(c)NH2-L-Cys-L-Ala-L-Cys-Gly-L-Phe-COOH;
(d)NH2-L-Phe-L-Ala-(L-Cys-Gly)4-COOH;
(e)NH2-L-Phe-L-Ala-(L-Cys-Gly)8-COOH;
(f)NH2-L-Ala-(L-Cys-Gly)4-Phe-COOH;
(g)NH2-L-Phe-L-Cys-L-Ala-L-Cys-Gly-L-Phe-COOH;
本发明的另一方面是提供该类合成肽在制备治疗神经系统疾病药物中的应用。
优选地,提供该类合成肽在制备治疗缺血性脑卒中,出血性脑卒中,脑创伤,阿尔茨海默病,帕金森病及其他神经退行性疾病药物中的应用。
所述药物为注射剂。
优选地,该类合成肽用于治疗神经系统疾病时采用静脉注射的方式给药。
本发明在具体实施例中提供通过固相合成制备本发明各类合成肽的方法。具体以L-Phe-L-Ala-L-Cys-Gly的实施例进行描述。
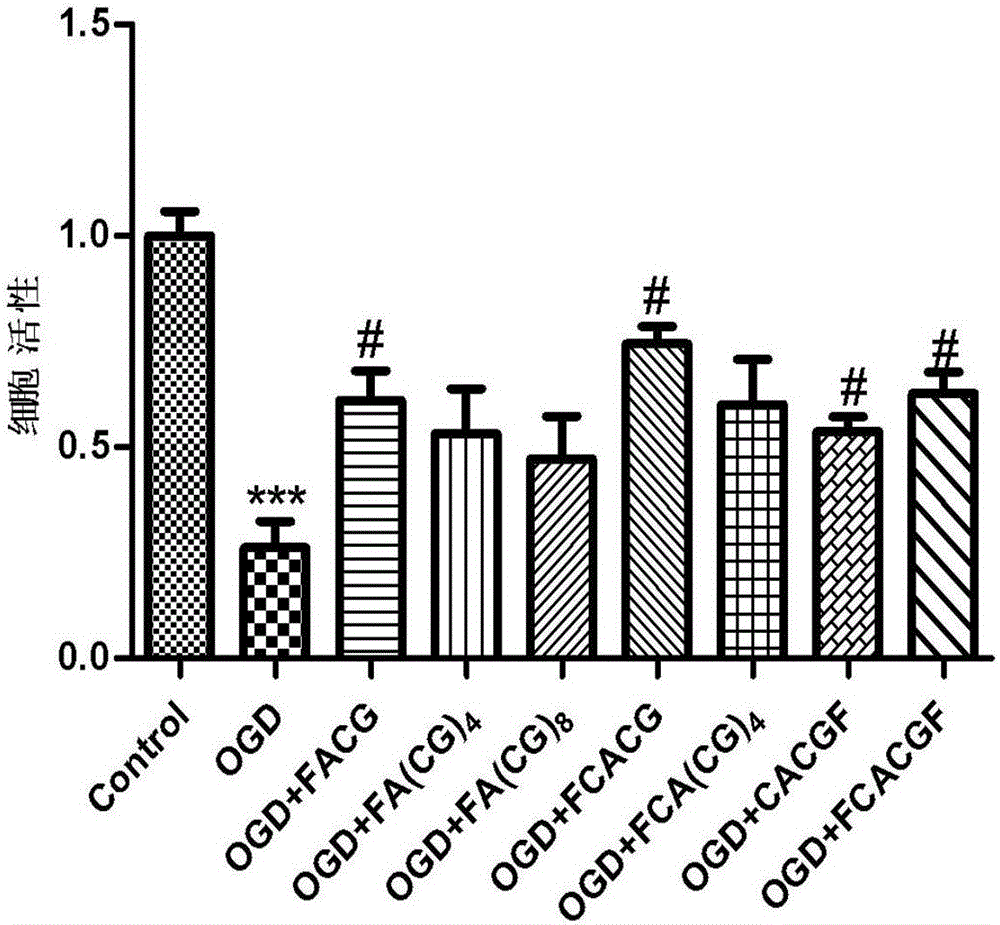
为了确定本专利其它合成肽是否也有脑保护作用,我们建立了皮层神经元离体糖氧剥夺(OGD)模型,神经元在OGD损伤情况下,用500μM的各合成肽处理神经元,用cck8去评价细胞的活力,从而判断各合成肽对神经元有无保护作用。由图2可见,各合成肽均有保护作用,其中FACG,FCACG,CACGF,FCACGF合成肽对损伤神经元具有明显保护作用。
本发明用SD大鼠作为实验对象,采用脑中动脉阻断法(MCAo)制备脑缺血大鼠模型,缺血3小时后静脉注射药物,1小时后取脑,脑组织冰冻切片,在荧光显微镜下观察脑片中荧光物质强度。
采用静脉注射FITC(异硫氰酸荧光素,紫外激发可发绿色荧光;8μmol/kg)标记大鼠脑神经细胞,结果可见未缺血大鼠脑组织中未见荧光标记的神经细胞;缺血大鼠脑组织中镜下可见极少量FITC标记的绿色荧光神经细胞;脑缺血后注射FITC-CG,镜下也只观察到极少量荧光细胞;脑缺血后注射FITC-FCG和FITC-FACG(8μmol/kg),镜下可见大量荧光标记的神经细胞,并且后者比前者镜下观察到的荧光细胞数量更多,荧光信号更强(见附图3),表明Phe作为穿透细胞膜的载体,可携带CG穿透血脑屏障,进入大脑,并且Ala作为疏水性氨基酸,在大鼠缺血情况下,通过静脉注射方式,进一步增加FCG透过血脑屏障的能力,使FACG更高效的进入大脑。
为了说明FACG通过静脉注射方式透过血脑屏障进入大脑后,被蛋白水解酶水解为Gly和L-Cys,,使脑内的Gly和L-Cys的水平上升,我们建立大鼠脑缺血模型,后随即分为两组,一组为对照组,缺血5h后静脉注射生理盐水;另一组为实验组,静脉注射12mg/kg FACG,24h后取脑,用HPLC测定大鼠脑缺血损伤区Gly和L-Cys的含量。结果表明大鼠脑缺血后,静脉给FACG组,大鼠脑缺血区Gly和Cys的含量均高于缺血后给生理盐水组,说明静脉给缺血大鼠FACG后,FACG透过血脑屏障,进入大脑,水解生成Gly和L-Cys。(见附图4)
本发明用SD大鼠作为实验对象,静脉注射给予FACG(12mg/kg)、依达拉奉(临床脑卒中治疗药物;6mg/kg),采用MCAo脑缺血大鼠模型,缺血后5h,静脉一次性注射上述药物。24h后,处死动物,取脑,后TTC染色,梗死体积用([(VC-VL)/V C]表示,VC是对照半球体积,,VL是损伤半球非梗死体积)。
结果可见,注射生理盐水的脑缺血大鼠,梗死体积0.359±0.041;给予12mg/kg FACG,梗死体积0.021±0.008;注射6mg/kg依达拉奉,梗死体积为0.141±0.015;相对于静脉给生理盐水和依达拉奉组,给GCAF四肽药组有更低的梗死体积,并且有统计学意义(p<0.05)(见表2,附图5)。
总之,本发明有如下优点:
(1)本发明提供的合成肽可以通过静脉注射,以L-Phe为穿透细胞膜的载体,L-Ala是疏水性氨基酸,促进合成肽穿透细胞膜,透过血脑屏障,进入大脑,在脑内蛋白水解酶的作用下水解生成游离的甘氨酸和半胱氨酸发挥神经保护作用,减少脑的缺血灌注损伤,起到治疗脑卒中的目的。此外,甘氨酸除可用于脑卒中治疗外,还可明显改善认知功能障碍和痴呆,尤其是可以作为一个常规的精神安定剂治疗精神分裂症。而L-半胱氨酸以及以它为基础合成的谷胱甘肽作为一种强抗氧化剂,能明显改善帕金森病患者的氧化应激损伤和脑缺血再灌注损伤。
(2)副作用小:本发明只需要12mg/kg的FACG静脉注射剂量,即可达到显著的治疗效果。
(3)安全:该合成肽的氨基酸残基取自20种组成人体蛋白质的氨基酸,安全无毒。
(4)经济:该合成肽由固相合成而得,成本较低且便于质量管理。
附图说明
图1为本专利肽FACG和FCACGF的HPLC图谱以及质谱图;
图2为合成肽对皮层神经元存活的影响图;
图3为FITC标记的合成肽在大鼠脑缺血情况下,透过血脑屏障,进入大脑的示意图;
图4为HPLC色谱图
A为空白的DNFB,B为Gly和L-Cys标准品,C为大鼠脑缺血侧损伤区Gly和L-Cys的含量;峰1表示Gly的流出峰,峰2表示L-Cys的流出峰。
图5为缺血大鼠注射各药物后对大鼠脑梗死体积改变的示意图;
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
【实施例1】本专利以L-苯丙氨酸-L-丙氨酸-L-半胱氨酸-甘氨酸四肽(FACG)为例说明固相合成肽的制备过程如下:
一、复合物I Fmoc-Gly-树脂的合成:
本专利三肽用固相合成的方法,称取取代度为0.4mmol/g的2-氯三苯甲基氯树脂(2-Chlorotrityl Chloride Resin)10.7g,将树脂放入多肽反应管中,加入二氯甲烷(DCM)160.5ml,震荡30分钟;通过沙芯抽滤掉DCM溶剂,加入12mmol的Fmoc-Gly-OH氨基酸,再加入40mmol的N,N-二异丙基乙胺(DIEA),最后加入少量二甲基甲酰胺(DMF)溶解,振荡1h。用DMF和DCM交替清洗6遍。加160.5ml20%哌啶(哌啶溶解在DMF溶液中),5分钟后抽掉哌啶,再次加入160.5ml20%哌啶,等15分钟后抽掉哌啶溶液,从管中取反应后的树脂十几粒,用乙醇洗三次,加入茚三酮,氰化钾溶液,苯酚溶液各一滴,105℃-110℃加热5min,变深蓝色为阳性反应,说明Fmoc-Gly-OH与树脂联接成功,形成复合物I Fmoc-Gly-树脂。
二、复合物II Fmoc-Cys(Trt)-Gly-树脂的合成:
多肽反应管分别用160.5ml DMF洗两次,160.5ml甲醇洗两次,160.5ml DMF再洗两次;后在Fmoc-Gly-树脂复合物上联接第二个氨基酸,在反应管中加入少量用DMF溶解的12mmolFmoc-Cys(Trt)-OH和12mmol苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(HBTU),后立即加入N-甲基吗啉(NMM)40mmol,反应30min,反应管分别用160.5ml DMF洗一次,160.5ml甲醇洗两次,160.5ml DMF再洗两次。加160.5ml20%哌啶(哌啶溶解在DMF溶液中),5分钟后抽掉哌啶,再次加入160.5ml20%哌啶,等15分钟后抽掉哌啶溶液,从管中取反应后的树脂十几粒,用乙醇洗三次,加入茚三酮,氰化钾溶液,苯酚溶液各一滴,105℃-110℃加热5min,变深蓝色为阳性反应,说明Fmoc-Cys(Trt)-OH与Fmoc-Gly-树脂联接成功,形成新的复合物II Fmoc-Cys(Trt)-Gly-树脂。
三、复合物III Fmoc-L-Ala-Cys(Trt)-Gly-树脂的合成:
多肽反应管分别用160.5ml DMF洗两次,160.5ml甲醇洗两次,160.5ml DMF再洗两次;后在Fmoc-Cys(Trt)-Gly-树脂上联接第三个氨基酸,在反应管中加入少量用DMF溶解的12mmolFmoc-L-Ala-OH和12mmolHBTU,后立即加入N-甲基吗啉(NMM)40mmol,反应30min,反应管分别用160.5ml DMF洗一次,160.5ml甲醇洗两次,160.5ml DMF再洗两次。加160.5ml20%哌啶(哌啶溶解在DMF溶液中),5分钟后抽掉哌啶,再次加入160.5ml20%哌啶,等15分钟后抽掉哌啶溶液,从管中取反应后的树脂十几粒,用乙醇洗三次,加入茚三酮,氰化钾溶液,苯酚溶液各一滴,105℃-110℃加热5min,变深蓝色为阳性反应,说明Fmoc-L-Ala-OH与复合物II联接成功,形成新的复合物IIIFmoc-L-Ala-Cys(Trt)-Gly-树脂。
四、复合物IV Fmoc-L-Phe-L-Ala-Cys(Trt)-Gly-树脂的合成:
多肽反应管分别用160.5ml DMF洗两次,160.5ml甲醇洗两次,160.5ml DMF再洗两次;后在Fmoc-L-Ala-Cys(Trt)-Gly-树脂上联接第四个氨基酸,在反应管中加入少量用DMF溶解的12mmolFmoc-L-Phe-OH和12mmolHBTU,后立即加入N-甲基吗啉(NMM)40mmol,反应30min,反应管分别用160.5ml DMF洗一次,160.5ml甲醇洗两次,160.5ml DMF再洗两次。加160.5ml20%哌啶(哌啶溶解在DMF溶液中),5分钟后抽掉哌啶,再次加入160.5ml20%哌啶,等15分钟后抽掉哌啶溶液,从管中取反应后的树脂十几粒,用乙醇洗三次,加入茚三酮,氰化钾溶液,苯酚溶液各一滴,105℃-110℃加热5min,变深蓝色为阳性反应,说明Fmoc-L-Phe-OH与复合物III Fmoc-L-Ala-Cys(Trt)-Gly-树脂联接成功,形成新的复合物IV Fmoc-L-Phe-L-Ala-Cys(Trt)-Gly-树脂。
五、得到粗品肽:
多肽反应管分别用160.5ml DMF洗两次,160.5ml甲醇洗两次,160.5ml DMF再洗两次,抽干10min,配制切割液107ml,配方分别是TFA(三氟乙酸)94.5%;水2.5%;EDT(1,2-乙二硫醇)2.5%;TIS(三异丙基硅烷)1%,将树脂装入烧瓶或者离心管中,倒入切割液,恒温震荡2h,将切割液用氮气尽量吹干,乙醚层析,再用乙醚洗6次,然后常温挥干,得到1.2g粗品肽Phe-Ala-Cys-Gly。
五、纯化粗品肽Phe-Ala-Cys-Gly
仪器:LC3000型高效液相色谱仪
柱子:Gemini-NX C18 10um 120A 4.6*250mm
流动相A:0.1%TFA in 100%Acetonitrile
流动相B:0.1%TFA in 100%Water
根据上述纯化条件,将粗品肽(1.2g),进入到HPLC内(每次进样100mg),进行分离纯化,收集主峰馏分,放冻干机上冻干(48h),最后得到99%以上的纯品600mg。
图1A L-苯丙氨酸-L-丙氨酸-L-半胱氨酸-甘氨酸四肽(FACG)四肽的HPLC图谱以及质谱图,HPLC图中可见该四肽纯度为99.5%;质谱图结果可见,[M+H]+397.00,因此该物质分子量为396,与L-苯丙氨酸-L-丙氨酸-L-半胱氨酸-甘氨酸四肽理论分子量相符。
图1B L-苯丙氨酸-L-半胱氨酸-L-丙氨酸-L-半胱氨酸-甘氨酸-L-苯丙氨酸六肽(FCACGF)六肽的HPLC图谱以及质谱图,HPLC图中可见该四肽纯度为98.72%;质谱图结果可见,[M+H]+647.10,因此该物质分子量为646.10,与L-苯丙氨酸-L-半胱氨酸-L-丙氨酸-L-半胱氨酸-甘氨酸-L-苯丙氨酸六肽理论分子量相符。
采用同样的固相合成的方法,本实验室合成了本专利实施例中其它合成肽。
【实施例2】本专利合成肽对原代皮层神经元的细胞毒性试验
本实施例用培养10天的原代皮层神经元作为实验对象,建立了皮层神经元离体糖氧剥夺(OGD)模型,神经元在OGD损伤情况下,用500μM的各合成肽处理神经元,用cck8去评价细胞的活力,从而判断各合成肽对神经元有无保护作用。本实施例所用合成肽如下:
表1本实施例涉及的合成肽
一、主要实验试剂和仪器
实验中各合成肽均由本实验室自主合成;Neurobasal,由Gibco公司提供;B27,Gibco公司提供;FBS,由invitrogen公司提供;glutamax,invitrogen公司提供;Glutamic acid,由sigma公司提供;多聚赖氨酸,由sigma公司提供。培养箱,来自于SANYO公司,培养条件是37℃,5%CO2;酶标仪,美国Bio-Tek公司;CCK8试剂盒,日本同仁化学;其余部分试剂全为国药集团化学试剂有限公司提供的分析纯试剂。
二、主要溶液的配制
1、HBSS:Hank,S平衡液:NaCl 8.0g,KCl 0.4g,Glucose 1.0g,KH2PO40.06g,Na2HPO4 0.06g,加双蒸水溶解,用NaHCO3调PH至7.3,定容到1000ml.
2、分离液:HBSS 500ml,Hepes 1.78g,Sucrose 2.5g,Glucose 10.0g,PH调至7.4,最后加入200ml双蒸水,4度保存。
3、ECS溶液:NaCl 8.01g,CaCl2 0.222g,KCl 0.4g,MgCl2 0.095g,HEPES2.98g,Glucose 3.27g,加双蒸水溶解,PH7.4,定容至1000ml,用0.22um的滤膜过滤除菌。
无糖ECS溶液:NaCl 8.01g,CaCl2 0.222g,KCl 0.4g,MgCl2 0.095g,HEPES2.98g,加双蒸水溶解,PH7.4,定容至1000ml,用0.22um的滤膜过滤除菌。
4、Glutamic acid储备液(11.8mM):称0.1736g的谷氨酸用双蒸水溶解,NaOH调PH至7.0,定量到100ml,分装1060μl/tube,贮存在4度。
5、0.5%FBS培养基:B27取1ml,FBS 250ul,glutamax 500ul,glutamic acid106μl,用neurobasal定量到50ml,4度保存。
6、无FBS培养基:B27取1ml,glutamax 500μl,用neurobasal定量到50ml,4度保存。
7、0.15M硼酸盐缓冲液:称取28.6g的硼砂,用双蒸水溶解,搅拌3-5min,用HCl调PH至8.4,定容到500ml。
8、多聚赖氨酸:把5mg的多聚赖氨酸固体溶解到500ml的硼酸盐缓冲液中,过滤除菌,-20℃保存。
三、实验动物
动物SPF级ICR雌性小鼠,体重25-30g。武汉大学动物实验中心提供,动物合格证号为No.42000500006525,生产许可证号:SCXK(鄂)2014-0004。
四、实验原理
cck8的原理:该试剂中含有WST-8(化学名:2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐),它在电子耦合试剂存在的情况下,可以被线粒体内的脱氢酶还原生成高度水溶性的橙黄色的甲臜产物(Formazan)。颜色的深浅与细胞的增殖成正比,与细胞毒性成反比。
五、实验方法
神经元的原代培养:培养前一天晚上用多聚赖氨酸包被培养皿,过夜;第二天早上取出已包被的多聚赖氨酸,接种前用PBS洗2-3遍。取怀孕17-18d的ICR雌性小鼠,颈椎脱臼处死后,取胎鼠大脑,置于分离液中,打开颅腔后取出全脑置于另一盛有分离液的玻璃培养皿中,在解剖镜下分离剥离脑膜,取大脑皮层置另一盛有分离液的玻璃小皿中;用眼科镊夹碎皮层组织成1mm3大小,吸管吸取组织置一15ml的离心管中,静置几秒,让组织沉淀下来,弃去分离液,加入1-2ml的0.5%FBS培养基,用吸管吹打20-30次,液体变浑浊停止,然后再静置10-20秒,使大的组织块下沉,取上清用滤网过滤,过滤后的液体先数细胞,以4*105/ml的细胞密度把细胞接种到已包被的皿中。第二天从各皿中弃一半体积的培养基,换成无FBS的培养基,之后,每三天换一次全培养基,换的都是无FBS的培养基。
细胞处理过程:取培养10天的96孔板的原代神经元,简单分为三组,分别是Control,OGD,OGD+各合成肽组,合成肽浓度都为500μM,每组重复5个复孔,每个孔先用PBS洗2-3遍,control组加入ECS,放入含5%CO2的培养箱内37°C继续培养1h,OGD组加入无糖ECS,放入95%N2/5%CO2的培养箱内37℃培养1h,后control组换新的ECS继续培养12h,而OGD组换新的ECS后转入含5%CO2的培养箱内37℃继续培养12h,其他OGD+合成肽组加入各合成肽药物(肽溶解在ECS中)也转入含5%CO2的培养箱内37℃继续培养12h,每孔加入CCK8 10μl,2h后在450nm处测吸光值。
六、实验结果
结果见图2,神经元在OGD损伤情况下,用500μM的各合成肽处理神经元,发现各合成肽均有保护作用,其中FACG,FCACG,CACGF,FCACGF合成肽对损伤神经元具有明显保护作用。
【实施例3】建立大鼠脑缺血模型,静脉注射荧光标记的合成肽,从整体上观察合成肽透过血脑屏障的能力
一、实验主要试剂及仪器
FITC,武汉明皓生物科技股份有限公司;FITC-CG,FITC-FCG,FITC-FACG,武汉明皓生物科技股份有限公司;OCT胶,北京中杉金桥生物技术有限公司;病理组织切片机,德国Leitz,1512型;荧光显微镜,宁波舜宇仪器有限公司;多聚甲醛,国药集团化学试剂有限公司。
二、实验原理
FITC(异硫氰酸荧光素):为黄色或橙黄色结晶粉末,分子量为389.4,最大吸收光波长为490~495nm,最大发射光波长为520~530nm,呈现明亮的黄绿色荧光,是目前应用最广泛的荧光素。
FITC-FACG:就是FACG进行荧光标记,FITC与FACG四肽结合,结合后不影响FACG四肽的结构和功能,通过在荧光显微镜下观察,具有强烈的黄绿色荧光,可用于FACG的定位或定量的检测。
血脑屏障(Blood Brain Barrier):指脑毛细血管壁与神经胶质细胞形成的血浆与脑细胞之间的屏障和由脉络丛形成的血浆和脑脊液之间的屏障,这些屏障能够阻止某些物质(多半是有害的)由血液进入脑组织,维持中枢神经系统正常的生理状态。但是,由于许多治疗中枢神经系统疾病的药物难以透过血脑屏障,限制了它们在临床上的应用。
三、实验结果
结果可见图3,Control为正常动物静脉注射生理盐水组,切片后镜下观察,无荧光标记的神经细胞;缺血后静脉注射FITC 8μmol/kg组,镜下可观察到有极少量荧光标记的神经细胞;脑缺血后注射FITC-CG,镜下也只观察到极少量荧光细胞;脑缺血后注射FITC-FCG和FITC-FACG(8μmol/kg),镜下可见大量荧光标记的神经细胞,并且后者比前者镜下观察到的荧光细胞数量更多,荧光信号更强(见附图3),表明Phe作为穿透细胞膜的载体,可携带CG穿透血脑屏障,进入大脑,并且Ala作为疏水性氨基酸,在大鼠缺血情况下,通过静脉注射方式,进一步增加FCG透过血脑屏障的能力,使FACG更高效的进入大脑。
【实施例4】建立大鼠脑缺血模型,静脉注射FACG后检测脑内甘氨酸和半胱氨酸的水平
一、实验仪器及试剂
美国Agilent1100高效液相色谱仪,UV检测器及色谱数据处理系统;Gly,Cys标准品(美国sigma公司);2,4-二硝基氟苯(成都西亚试剂有限公司);乙腈,甲醇(色谱级,国药集团化学试剂有限公司);超纯水;其余试剂均为分析纯。
二、实验方法
氨基酸标准品储备液的配制 精密称取Gly,Cys标准品各10mg,置于10ml容量瓶中,用甲醇/水(1:1)溶解并稀释至刻度,使配成浓度为1mg/ml的储备液。
衍生化试剂的配制 DNFB用乙腈配成0.5%的溶液,避光保存。
样品预处理和衍生化 建立大鼠脑缺血模型,后随即分为两组,一组为对照组,缺血5h后静脉注射生理盐水;另一组为实验组,静脉注射13mg/kgCGPF,24h后取脑,在冰上分离大鼠缺血脑损伤区,用生理盐水制备组织匀浆,15000rpm,4度离心20min,取上清,一部分测BCA,另一部分再加入两倍体积甲醇,15000rpm,4度离心10min,除去蛋白,所得上清液即用来测定甘氨酸和半胱氨酸的含量。
色谱条件 色谱柱:大连依利特Hypersil BDS C18(4.6×200mm,5μm);流动相:A为0.05mol/L的醋酸钠缓冲液(pH=6.5),B为乙腈-水(1:1,V/V),梯度洗脱程序B由初始时的16%经10min增至45%,25min至85%,30min至16%;流速:1mL/min;检测波长:360nm;柱温:30℃,取30μL进样分析。该色谱条件下,甘氨酸和半胱氨酸在30min内得到有效分离,保留时间为:Gly(10.21min),L-Cys(23.71min)所得色谱图见图4。
线性关系 精密量取Gly和Cys混合标准储备液,用甲醇/水(1:1)将储备液分别稀释成0.1,1,4,10,40,200ug/ml的对照液。衍生后各取30ul进样,以上述色谱条件进行测定,以峰面积(Y)与标准品浓度(X)进行线性回归。结果表明,Gly和Cys在0.1~200ug/ml范围内线性关系良好,相关系数Gly为0.9991,Cys为0.9997。
三、实验结果
样品测定 大鼠脑缺血损伤区Gly和Cys的含量测定结果见表1。
表1大鼠脑缺血损伤区Gly和Cys的含量
与模型组相比,**P<0.01,#P<0.05
大鼠脑缺血后,静脉给FACG组,大鼠脑缺血损伤区Gly和Cys的含量均高于缺血后给生理盐水组,说明静脉给缺血大鼠FACG后,FACG透过血脑屏障,进入大脑,水解生成Gly和Cys。
【实施例5】建立大鼠脑缺血模型,确定FACG对脑缺血后的保护作用
一、实验药品及试剂
FACG,由本实验自主合成;水合氯醛,国药集团化学试剂有限公司;TTC,武汉科瑞生物技术有限公司提供;无菌生理盐水,武汉滨湖双鹤药业有限责任公司;肝素钠注射液,南京新百药业有限公司提供;依达拉奉注射液,国药集团国瑞药业有限公司,30mg/一支。
二、实验动物
动物SPF级SD雄性大鼠,体重240-260g。武汉大学动物实验中心提供,动物合格证号为NO.42000500006247,生产许可证号:SCXK(鄂)2014-0004。鼠饲料,购于武汉大学实验动物中心。
三、实验方法
240-260g的大鼠随机分组:假手术组,缺血组,缺血加药组,假手术组和缺血组静脉都给400μl的生理盐水,缺血加药组的药物浓度分别是FACG组12mg/kg,依达拉奉组6mg/kg,药物均溶解在400μl生理盐水中,缺血5h后静脉一次性给予。
动物给药方式的选择:动物的外周给药方式主要有三种,分别是口服,腹腔注射和静脉注射。传统口服药物和腹腔注射药物,药物都需要先由肠道吸收后进入血液,药物在吸收过程中需要一定的时间并且会有一定程度的损耗,进入血液中的药物就少了。而静脉注射药物相对于传统给药方式,药物是直接进入血液,血液中药物浓度100%,并且直接发挥作用。在药物的有效浓度范围内,选择静脉给药所需的药物浓度更低,作用时间更短,副作用小,因此本实验选择静脉给药。
大脑中动脉栓塞(MCAO)模型的制备:首先采用10%的水合氯醛根据动物体重(0.035ml/kg)进行腹腔注射麻醉,麻醉成功后用改良的线栓法制备大脑中动脉缺血模型。选择与SD大鼠体重匹配的线栓,术前先侵泡在盛有肝素的EP管中。在颈外动脉远心端剪一小口后,将前端有圆头的线栓从小口处,调整方向后插入颈内动脉,线栓插入深度为线栓头端到黑色标记处,长约17-19mm。栓塞90min后,再小心将线栓拨出。缝好皮肤,涂抹络合碘,术后放置在电热毯上,对SD大鼠进行保温处理。
假手术建模:进行缺血手术操作,线栓从颈外动脉插入颈内动脉后迅速拔出不留置线栓。
检测指标采用Zea Longa方法进行神经功能缺失评分:
0分,没有任何神经功能缺失;
1分,明显可见SD大鼠左前肢内收,前爪不能外展;
2分,明显可见SD大鼠向左侧未缺血侧成追尾状地转圈;
3分,明显可见SD大鼠向左侧未缺血侧成倾倒状;
4分,明显可见SD大鼠的意识障碍,无自主行走。
该检测指标用于评价SD大鼠MCAO缺血模型是否成功,缺血动物选择1-2分作为实验动物。
另一指标为TTC染色:TTC染料参与正常组织中的琥珀酸脱氢反应呈红色。缺血组织内蛋白变性坏死,脱氢酶活性显著下降,无法发生琥珀酸脱氢反应,因此不呈现红色而呈白色。TTC染色可以检测哺乳动物组织的缺血梗死程度。
染色步骤如下:
1.冰上快速提取完整的脑组织放入一次性细胞培养皿中。
2.将组织放入-20℃冰箱中20min。
3.将组织放在室温中数秒,等待脑组织的硬度稍微变软
4.用刀片在冠状面截取8等分的脑片,每片2mm。
5.将TTC染料倒入培养皿中,使脑片悬浮在液体中,脑片上表面和下表面都需接触TTC液体。
6.放入37℃恒温箱中15min-20min(避光)。
7.取出后倾倒染料,用生理盐水漂洗后换上4%PFA 4℃固定过夜。
8.第二天取出用扫瞄仪进行数据图像采集并采用ImageJ软件分析梗死体积(梗死体积=[(VC-VL)/V C],VC是对照半球体积,,VL是损伤半球非梗死体积)。
四、实验结果
结果可见图5,未给药的脑缺血组,梗死体积为0.359±0.041;静脉注射FACG 12mg/kg的缺血大鼠,梗死体积是0.021±0.008;静脉注射6mg/kg依达拉奉,梗死体积为0.141±0.015;相对于静脉给生理盐水,依达拉奉组,给FACG四肽药组有更低的梗死体积,并且有统计学意义(p<0.05)。结果表明FACG四肽可改善脑卒中,且作用明显优于临床用药依达拉奉(见表2,附图5)。
表2合成肽对缺血大鼠的保护作用及与依达拉奉的比较
与模型组相比,**P<0.01,*P<0.05。
【实施例5】L-苯丙氨酸-L-丙氨酸-L-半胱氨酸-甘氨酸四肽注射液制备
L-苯丙氨酸-L-丙氨酸-L-半胱氨酸-甘氨酸四肽注射液,100g L-苯丙氨酸-L-丙氨酸-L-半胱氨酸-甘氨酸四肽冻干粉分装到1000个已灭菌的管制冻干瓶中,真空封瓶,储存于-20或-80℃,每瓶含L-苯丙氨酸-L-丙氨酸-L-半胱氨酸-甘氨酸四肽100mg,用氯化钠注射液或5%葡萄糖溶解,静脉缓慢滴注。
- 还没有人留言评论。精彩留言会获得点赞!