一种植物杂交体系及其应用的制作方法
本发明涉及一种植物杂交体系的创建及其在植物育种中的应用。
(二)
背景技术:
杂种优势是指2个遗传组成不同的亲本杂交产生的F1代在生活力、生长势、抗逆性、适应性以及产量、品质等方面超过双亲的现象。杂种优势在许多农作物和园艺作物上得到广泛的应用,并获得巨大成功,对推动农业生产做出了重大贡献。
人们对杂种优势的利用从200多年前就开始了。法国Koireutier在1761-1766年育成了早熟优良的烟草品种间杂种,并提出了种植烟草杂交种的建议。以后,Merdel、Darwin、Beal、Pichey等分别做了大量研究,Shull(Shull G H,Gowen J W.Beginnings of the heterosis concept[J].Heterosis.,1952:14-48.)在1905~1909年进行玉米自交系选育与杂种优势的研究中,首次提出了“杂种优势”这一术语和选育单交种的基本程序,从理论上和育种模式上为玉米自交系间的杂种优势利用奠定了基础。到20世纪30年代。人们已经利用杂交玉米在生产上取得高产,自此杂种优势在农作物生产上的大规模应用便开始了,到1956年,全美已经普及了玉米杂交种。玉米杂交种广泛成功应用,推动了作物杂种优势利用的探索和研究。随着雄性不育系的选育成功,创造了自花授粉作物和常异花授粉作物杂种优势利用的条件,扩大了杂种优势利用的领域,到20世纪50年代后期,美国已基本普及高粱杂交种。我国对玉米杂种优势的研究利用较晚,20世纪50年代才推广品种间杂交种,60年代推广双交种,70年代推广单交种。杂交高粱始于20世纪50年代后期,育成并推广了一批高粱杂交种,现在高梁杂交种全世界已普及。我国有杂交水稻方面的研究并于20世纪70年代前期完成籼型和粳型三系配套.开创了自花授粉作物杂种优势利用的先例,处于国际领先地位。
目前利用杂交优势的途径包括人工去雄杂交制种、化学去雄杂交制种、利用自交不亲合性杂交制种、利用雄性不育系。雄性不育系在现代杂交制种应用中极为普遍,一般采用三系两田法,即不育系、恢复系、保持系、亲本繁殖田、杂交制种田。而且制种手续简化,制种产量较高,从而降低了种子生产成本。目前应用的三系制种中的不育系主要是核质互作雄性不育,这种类型的不育性比较容易获得三系。现已在玉米、高梁、小麦、水稻等大田作物的杂交制种中广泛应用。然而,要获得具有应用价值的不育系、保持系及恢复系是一项极其繁琐、艰巨的工作。通过基因工程手段获得雄性不育系、恢复系不仅较传统的多代选育省时、省力,而且易于保持亲本的优良性状,有着巨大的应用前景。1990年,Mariani(Mariani,Debeuckeleer et al.1990)等利用TA29-Barnase嵌合基因的转化,首次在世界上获得了转基因的不育烟草和油菜;1992年,他们又通过TA29-Barstar基因的转化获得了上述不育烟草和油菜的恢复系(Mariani C,Gossele V,De Beuckeleer M,et al.1992.)。此后,Reynaerts(Reynaerts A,Van de Wiele H,De Sutter G,et al.Scientia Horticulturae,1993,55(1):125-139.)等又相继获得了转基因的不育椰菜、莴苣等。
上述基因工程手段获得雄性不育系的方法给不育系的获得打开了前所未有的空间。然而,基于Barnase-Barstar的杂交体系获得的杂交种中同时存在两个外源基因,需要进行大量的基因安全评价工作,限制了该方法的使用前景。
Ms45是玉米花序特异性表达基因,ms45突变体的纯和植株不能产生花粉,从而导致雄性不育(Cigan A M,Unger E,Xu R J,et al.Sexual Plant Reproduction,2001,14(3):135-142.)。杜邦公司研制了一个基于颜色筛选的ms45突变体的保持系。在ms45突变体不育系能保持的情况下,则可以构建一套非常方便的杂交体系。但是,该方法是基于颜色筛选,需要建设一套专门的厂房和生产线用于种子的筛选,同时还需要消耗大量人力和能源来维持该生产线的运行。因此,更为简便、高效和环保的杂交系统亟待构建。
除草剂(herbicide)是指可使杂草彻底地或选择地发生枯死的药剂,又称除莠剂,用以消灭或抑制植物生长的一类物质。根据作用方式分类可以分为:选择性除草剂和灭生性除草剂。选择性除草剂是指不同种类的植物对其具有不同程度的抗性,可以杀死部分植物,而对其它植物无害。如苯达松、烟嘧磺隆、乙草胺、莠去津、氟磺胺草醚、灭草松、苯磺隆等。非选择性除草剂(又称灭生性除草剂)是指对所有植物都有毒性,都会受害或被杀死。如草甘膦、草铵膦、百草枯等。随着生物技术的发展,人们可以通过基因工程的方法,赋予作物非选择性除草剂的抗性。
(三)
技术实现要素:
本发明目的是提供一种简单高效的植物杂交体系及其应用,通过该方法,可以通过田间喷施除草剂的方法筛选不育系和保持系,而不需要建设一套专门的厂房和生产线用于种子的筛选,从而节省人力和能源成本,提高生产效率。
本发明采用的技术方案是:
本发明提供一种植物杂交体系,所述杂交体系由不育系植株、保持系植株和恢复系植株组成;所述不育系植株为生殖组织特异性表达基因功能缺失的植株;所述保持系植株为插入TWS表达框构建的植株,所述TWS表达框由非选择性除草剂抗性基因表达框、植物内源抗除草剂基因的沉默或敲除表达框、不育系育性恢复表达框和花粉不育表达框组成;所述恢复系植株是任意与所述不育系植株具有良好杂交优势的植株。
进一步,所述生殖组织特异性表达基因包括玉米Ms45基因(Unger E,Cigan A M,Trimnell M,et al.,2002,Transgenic Research,11(5):455-465)、Zm13(Hamilton D A,Roy M,Rueda J,et al.,1992,Plant molecular biology,18(2):211-218)、水稻的RTS(Luo H,Lee J Y,Hu Q,et al.,2006,Plant Molecular Biology,62(3):397-408)、PS1(Zou J T,Zhan X Y,Wu H M,et al.,1994,American journal of botany,552-561)以及具有类似功能的基因。
进一步,所述不育系植株为通过把cas9载体导入植株中进行基因敲除而获得的-。具体的,所述玉米cas9载体由Cas9基因表达框,sgRNA基因表达框和G10基因表达框组成。所述T-DNA外源基因表达框中,Cas9基因的核苷酸序列为SEQ ID NO.1中11111bp-15456bp的碱基所示,所述sgRNA基因核苷酸序列为SEQ ID NO.2所示,所述G10基因是在从细菌中克隆到的抗草甘膦基因的基础上特变后人工合成的高效抗草甘膦基因(中国专利:2011100093290),所述G10基因核苷酸序列为SEQ ID No.4中18371bp-19694bp的碱基所示。所述的水稻cas9载体和玉米中所用的cas9载体类似,但是其中的sgRNA基因核苷酸序列为SEQ ID NO.3所示。
本发明所述保持系为具有非选择性除草剂抗性、被选择性除草剂杀灭、恢复不育系育性和导致花粉不育的特性。同时具有赋予非选择性除草剂抗性、被选择性除草剂抗性杀灭、恢复不育系育性和导致花粉不育的表达框构建在同一个被命名为TWS(Two-way selection,双向选择)的外源插入的T-DNA片段上。
进一步,所述非选择除草剂抗性基因表达框由“组成型启动子-抗除草剂基因-终止子”构成;所述组成型启动子为花椰菜花叶病毒(CaMV)35S启动子p35Sp35S(Odell,Joan T.,Ferenc Nagy,and Nam-Hai Chua,1985,Nature,810-812)、水稻的Actin1启动子pAct1(McElroy D,Zhang W,Cao J,et al.,1990,The Plant Cell,2(2):163-171.)、玉米Ubiquitin启动子pUBI(Christensen A H,Sharrock R A,Quail P H,1992,Plant molecular biology,18(4):675-689)及其具有类似表达模式的启动子;所述抗除草剂基因为抗草甘膦基因CP4-EPSPS(孟山都公司)、G10(中国专利:2011100093290),抗草丁膦基因Bar(Thompson C J,Movva N R,Tizard R,et al,1987,The EMBO journal,6(9):2519.)及其具有类似功能的基因。
进一步,所述植物内源抗除草剂基因沉默或敲除表达框为RNA干扰表达框或者基于基因编辑技术的DNA敲除表达框;基于基因编辑技术的DNA敲除表达框包括基于ZFN(zinc-finger nucleases)、TALEN(transcription activator-like effector nucleases)、CRISPR/Cas9和Argonaute/Gdna(Gao F,Shen X Z,Jiang F,et al.,2016,Nature biotechnology)等基因组定点突变技术的基因敲除表达框。所述不育系育性恢复表达框由“启动子-生殖组织特异性表达基因-终止子”构成,发生突变后导致不育的基因包括玉米的Ms45、Zm13、水稻的PS1以及具有类似功能的基因;所述花粉不育的表达框由“花粉特异性启动子-花粉不育基因-终止子”构成,所述花粉特异性启动子包括玉米5126启动子(美国专利:US8257930B2)、Zm13启动子(Hamilton D A,Roy M,Rueda J,et al.,1992,Plant molecular biology,18(2):211-218),水稻的PS1启动子(Zou J T,Zhan X Y,Wu H M,et al.,1994,American journal of botany,552-561),烟草的TA29启动子(Koltunow A M,Truettner J,Cox K H,et al.,1990,The Plant Cell,1990,2(12):1201-1224)、NTP303启动子(Weterings K,Schrauwen J,Wullems G,et al.,1995,The Plant Journal,8(1):55-63)等花粉不育基因包括任何阻止或破坏花粉发育从而致使花粉发育受阻、发育不良或发生歧化,进而使花粉不具有育性的基因。这些基因包括淀粉酶基因、蛋白酶基因、RNA酶基因等。
进一步,在玉米杂交体系中,所述保持系植株为插入TWS外源基因表达框(ZmTWS)构建而成,所述TWS外源基因表达框由CYP81A9基因RNAi表达框,G10基因表达框,Ms45花药特异性基因表达框和玉米淀粉酶花粉特异性基因表达框组成。其中玉米杂交体系中,TWS外源插入片段包括的4个表达框分别为耐草甘膦表达框、抗烟嘧磺隆基因RNAi表达框、Ms45基因花药特异性表达框和α-淀粉酶基因花粉特异性表达框(图3、5);耐草甘膦表达框的结构为“组成型启动子-G10evo-ter”;抗烟嘧磺隆基因RNAi表达框的结构为“组成型启动子-CPY81A9(RNAi)-ter”。Ms45基因花药特异性表达框的结构为“花药特异性启动子p5126-Ms45-ter”;花粉不育表达框的结构为“花粉特异性启动子pPg47-α-淀粉酶基-ter”结构。水稻杂交体系中,保持系中的TWS外源插入片段(OsTWS)包括的4个表达框分别为耐草甘膦表达框、抗苯达松基因RNAi表达框、RTS基因花药特异性表达框和α-淀粉酶基因花粉特异性表达框(图4、6);耐草甘膦表达框的结构为“组成型启动子-G10evo-ter”;抗苯达松基因RNAi表达框的结构为“组成型启动子-CPY81A6(RNAi)-ter”;RTS基因花药特异性表达框的结构为“花药特异性启动子pRTS-RTS-ter”;花粉不育表达框的结构为“花粉特异性启动子pPs1-α-淀粉酶基-ter”结构。
进一步,在玉米杂交体系中,所述TWS外源基因表达框(ZmTWS)中CYP81A9基因RNAi核苷酸序列为SEQ ID NO.6所示,所述Ms45花药特异性基因为已发现的玉米产生可育花粉所必须的基因(Cigan A M,Unger E,Xu R J,et al.Sexual Plant Reproduction,2001,14(3):135-142.),所述G10基因是在从细菌中克隆到的抗草甘膦基因的基础上特变后人工合成的高效抗草甘膦基因(中国专利:2011100093290),所述Ms45花药特异性基因核苷酸序列为SEQ ID No.4中9563bp-11522bp的碱基所示,所述玉米淀粉酶花粉特异性基因核苷酸序列为SEQ ID No.4中14259bp-15745bp的碱基所示,所述G10基因核苷酸序列为SEQ ID No.4中18371bp-19694bp的碱基所示。在水稻杂交体系中,所述TWS外源基因表达框(OsTWS)中CYP81A6基因RNAi核苷酸序列为来源于现有表达框(Lin C,Fang J,Xu X,et al.,2008,PLoS One,3(3):e1818.),所述RTS花药特异性基因为已发现的水稻产生可育花粉所必须的基因(Luo H,Lee J Y,Hu Q,et al.,2006,Plant Molecular Biology,62(3):397-408)。所述淀粉酶基因和G10基因是与玉米TWS外源基因表达框中一致。
进一步,所述玉米不育系获得过程中使用的cas9载体中的T-DNA外源基因表达框核苷酸序列为SEQ ID NO.1所示。水稻不育系获得过程中使用的cas9载体中的T-DNA外源基因表达框核苷酸序列类似SEQ ID NO.1,但是其中SEQ ID No.1中15790bp-15809bp的碱基被置换为SEQ ID NO.3所示的序列。
进一步,所述玉米保持系获得过程中使用的TWS外源基因表达框核苷酸序列为SEQ ID NO.4所示。水稻保持系获得过程中使用的TWS外源基因表达框核苷酸序列类似SEQ ID NO.4,但是其中的CYP81A9基因RNAi表达框被置换为CYP81A6基因RNAi表达框;Ms45花药特异性表达框被置换为RTS花药特异性表达框;玉米淀粉酶花粉特异性表达框中的特异性启动子玉米Pg47基因启动子被置换为水稻的PS1基因启动子(PS1基因启动子序列如SEQ ID No.5)(具体序列如实施例9所述)。
此外,本发明还提供一种所述植物杂交体系在培育杂交种子中的应用,所述应用为利用所述杂交体系生产杂交种子,具体为:(1)播种保持系种子并对4-5叶期或2叶1心期的植株喷施草甘膦,杀灭其中的非转基因植株,剩下的转基因植株产生的种子中含50%的转基因种子(即保持系种子)和50%的非转基因种子(即不育系种子)(图7和图8);(2)将步骤(1)保持系种子和不育系种子间隔种植,对4-5叶期或2叶1心期的的保持系植株喷施草甘膦,杀灭其中的非转基因植株,剩下的转基因植株给不育系植株提供非转基因花粉,获得不育系非转基因种子;(3)步骤(2)的不育系非转基因种子与恢复系植株种子间隔种植,恢复系植株给不育系提供花粉获得杂交种子。
由于TWS片段中含有导致花粉不育的表达框,因此保持系产生的50%含有TWS片段的花粉是不育的,另外50%为不含TWS片段的可育花粉,即保持系只能产生50%不含TWS片段的可育花粉,另外50%含有TWS片段的花粉是不育的。保持系自交产生的后代(M1)中50%是转基因保持系种子,50%是非转基因不育系种子。为了扩繁保持系种子,单独播种M1,喷施非选择性除草剂杀死其中的不育系植株,剩下的保持系植株自交,收获的种子中有50%是转基因保持系种子;为了扩繁不育系种子,把M1和不育系间隔种植,并对M1喷施非选择性除草剂,杀灭其中的不育系植株,剩下的保持系给不育系植株授粉,这些不育系植株产生的种子全部为不育系(图7、8)。最后,把该不育系和任意作为恢复系的优良自交系杂交,生产的种子即为可以销售的杂交种。在喷施非选择性除草剂防止杂草的同时可以把可能存在的极少数含有TWS片段的植株杀灭,确保杂交种的高纯度。
本发明中的植物杂交体系可以用于单子叶植物,包括玉米、水稻、小麦、大麦和高粱等和双子叶植物,包括大豆、油菜、棉花和烟草等。
与现有技术相比,本发明的有益效果主要体现在:与目前已有的杂交体系相比,本体系具有以下三个方面的优势,第一,不受作物品系的限制,可以通过回交选育利用到任意作物品系上;第二,生产的杂交种子可以不引入任何外源基因;第三,不需要建设一套专门的厂房和生产线用于种子的筛选,节省人力和能源成本,提高生产效率。
(四)附图说明
图1:CRISPR/Cas9基因敲除载体结构示意图。p35S为花椰菜花叶病毒CaMV启动子。NLS为核定位序列。OsCas9-NLS为3’连接有NLS的根据水稻密码子偏好优化后的来源于Streptococcus pyogenes的Cas9基因。pOsU6为水稻U6启动子,gRNA为靶向目的基因的向导序列,sgRNA scaffold为sgRNA的支架序列,U6Ter为水稻U6终止子。pUBI为玉米泛素(ubiquitin)启动子,AHAS为叶绿体信号肽,G10为耐草甘膦基因。RB为右边界,LB为左边界。LB到RB之间为T-DNA,T-DNA以外为pCambia1300载体骨架。
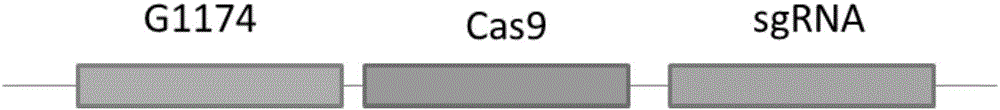
图2:CRISPR/Cas9基因敲除载体T-DNA结构示意图。G10为抗草甘膦表达框,Cas9为Cas9基因表达框,sgRNA为单链向导RNA表达框。
图3:ZmTWS载体结构示意图。p5126为花药特异性表达启动子,Ms45gene为包括编码序列和终止子的Ms45基因。pPg47为花粉特异性启动子,Zm aa1为玉米的淀粉酶基因。pUBI为玉米泛素(ubiquitin)启动子,G10为耐草甘膦基因。p35S为花椰菜花叶病毒CaMV启动子,RNAi为玉米CYP81A9基因发夹RAN表达框。RB为右边界,LB为左边界。LB到RB之间为T-DNA,T-DNA以外为pCambia1300载体骨架。
图4:OsTWS载体结构示意图。RTS为RTS基因表达框。pPs1为水稻花粉特异性启动子,Zm aa1为玉米的淀粉酶基因。pUBI为玉米泛素(ubiquitin)启动子,G10为耐草甘膦基因。p35S为花椰菜花叶病毒CaMV启动子,CYP81A6RNAi为水稻CYP81A6基因发夹RAN表达框。RB为右边界,LB为左边界。LB到RB之间为T-DNA,T-DNA以外为pCambia1300载体骨架。
图5:ZmTWS载体的T-DNA结构示意图。Ms45为Ms45基因花药特异性表达框,Zm-aa1为玉米淀粉酶花粉特异性表达框,G10为草甘膦抗性基因G10表达框,CYP81A9RNAi为CYP81A9干扰表达框。
图6:OsTWS载体的T-DNA结构示意图。RTS为RTS基因花药特异性表达框,Zm-aa1为玉米淀粉酶花粉特异性表达框,G10为草甘膦抗性基因G10表达框,CYP81A6RNAi为CYP81A6干扰表达框。
图7:玉米保持系扩繁示意图。
图8:水稻保持系扩繁示意图。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1、玉米不育系的获得
不育系的获得有多种方法,比如从自然界中选育,用物理方法选育,用基因操作方法获取。本实施例中所使用的是基因操作方法获取转基因玉米。
载体构建:用于获得玉米不育系的转化载体的T-DNA中包涵3个表达框(图1和图2),分别为Cas9基因表达框,sgRNA表达框,G10表达框。Cas9基因表达框用于表达Cas9蛋白;sgRNA 表达框用于产生sgRNA靶向特异位点;G10基因用于赋予转基因玉米草甘膦抗性。
Cas9基因表达框的构建。人工合成Cas9基因(生工生物),在Cas9的5’端依次设置有33bp的编码核定位序列(NLS)的碱基对和终止子(CaMV 3'UTR)。上述序列构成“Cas9-NLS-Ter”片段,片段的5’端和3’端分别设置有BamHI和KpnI酶切位点,该片段的序列如SEQ ID No.1中11111bp-15456bp的碱基所示。用于驱动Cas9的基因为花椰菜花叶病毒的CaMV35S启动子p35S。该启动子通过人工合成,5’端和3’端分别设置有HindIII和BamHI,序列如SEQ ID No.1中10324bp-11116bp的碱基所示。为了获得完整的p35S驱动Cas9基因表达的表达框,用HindIII和BamHI对包含人工合成的p35S启动子的质粒进行双酶切,用BamHI和KpnI对包含人工合成的“Cas9-NLS-Ter”片段的质粒进行双酶切,用KpnI和HindIII对双元载体pCambia1300进行双酶切,并回收上述酶切后的两个片段和pCambia1300载体,将上述片段通过三段连接的方式连接,获得载体pCambia1300-p35S-Cas9-NLS-Ter。
sgRNA表达框的构建。通过人工合成sgRNA的表达框(pOsU6-sgRNA)。靶向玉米Ms45基因的sgRNA为一个包含20个碱基对的核苷酸片段,序列如SEQ ID No.2所示。sgRNA的5’端是用于驱动sgRNA表达的启动子pOsU6,5’端是sgRNA的支架片段,上述元件构成“pOsU6-sgRNA靶标序列-sgRNA支架-ter”片段,片段的5’端和3’端各设置有一个KpnI酶切位点,该片段的序列如SEQ ID No.1中15451bp-16131bp的碱基所示。
G10表达框的构建。G10基因是在从细菌中克隆到的抗草甘膦基因的基础上特变后人工合成的高效抗草甘膦基因(中国专利:2011100093290)。启动G10的是玉米的ubiquitin-1启动子pUBI。G10的终止子CaMV35S的3’UTR。用引物pUBI-F1(5’TCTCGAGGCAGCTCCTCTCCGCGCACC3’)和pUBI-R1(5’CTGAGATCTACAGACTATGTCAACATAAAGCAC3’),以玉米(B73)基因组(中国专利:2011100093290)为模板,PCR获得pUBI的5’端约1.4kb的DNA片段,pUBI-F1上设置有KpnI酶切位点,pUBI-R1上设置有EcoRI酶切位点。用引物pUBI-F2(5’TCTCGAGGCAGCTCCTCTCCGCGCACC3’)和pUBI-R2(5’CTGAGATCTACAGACTATGTCAACATAAAGCAC3’),以玉米(B73)基因组为模板,PCR获得pUBI的3’端约0.5kb的DNA片段,然后用引物G10-F(5’TCTCGAGGCAGCTCCTCTCCGCGCACC3’)和G10-R(5’CTGAGATCTACAGACTATGTCAACATAAAGCAC3’)以合成的G10质粒为模板,PCR获得约1.6kb的G10,最后,用引物pUBI-F2和引物G10-R,以上面获得的两种PCR产物pUBI的3’端约0.5kb的DNA片段和约1.6kb的G10为模板,克隆出大小为约2.1kb的pUBI的3’端和G10的融合片段,该片段的5’和3’分别设置有EcoRI和XhoI酶切位点。PCR反应体系中,两种模板各加0.5μl。为了获得完整的pUBI驱动G10基因表达的表达框,用EcoRI和XhoI对PCR获得的小为约2.1kb的pUBI的3’端和G10的融合片段进行双酶切,用KpnI和EcoRI对PCR获得的pUBI的5’端约1.4kb的DNA片段进行双酶切,用KpnI和XhoI对双元载体pCambia1300进行双酶切,并回收上述酶切后的两个片段和pCambia1300载体,将上述片段通过三段连接的方式连接,获得载体pCambia1300-pUBI-G10,所述G10基因核苷酸序列为SEQ ID No.4中18371bp-19694bp的碱基所示。
上述PCR试验过程中PCR反应中,如无特殊注释,模板都为玉米(B73)基因组。PCR的反应体系为:5x PrimeSTARTM Buffer(Mg2+plus)(购自TaKaRa公司),10μl;dNTP Mixture(各2.5mM),4μl;正向引物(10μM),1μl;反向引物(10μM),1μl;模板DNA100ng;PrimeSTARTMHS DNA Polymerase(2.5U/μl),0.5μl;灭菌蒸馏水,加至最终体积为50μl。PCR的条件为:95℃预变性2min;94℃变性30sec,58℃退火30sec,72℃延伸1kb/1min,32个循环;72℃延伸10min。
农杆菌T-DNA载体的构建:
以双元载体pCambia1300-pUBI-G10为基础,用KpnI和HindIII对pCambia1300-p35S-Cas9-NLS-Ter,进行双酶切,回收“p35S-Cas9-NLS-Ter”片段,然后将该片段连入经过相同酶切的pCambia1300-pUBI-G10载体中,获得pCambia1300-pUBI-G10-p35S-Cas9载体。再用KpnI对包含人工合成的pOsU6-sgRNA表达框的质粒进行酶切,回收pOsU6-sgRNA表达框片段,将该片段连入经KpnI单酶切,并且去磷酸化处理的pCambia1300-pUBI-G10-p35S-Cas9载体中,获得终载体pCambia1300-pUBI-G117-p35S-Cas9-pOsU6-sgRNA载体。这个载体命名为:Cas9-Ms45(序列如SEQ ID No.1所示)。该载体结构如图1所示。T-DNA片段结构如图2所示。最后,通过电转的方法把这个T-DNA质粒转入农杆菌LB4404中,通过含有15μg/ml四环素和50μg/mL的卡那霉素的YEP固体培养基筛选出阳性克隆,并保菌,用于接下来的植物转化。
玉米转化:
玉米的转化方法已经比较成熟,例如Frame等描述了利用农杆菌转化玉米的方法(Frame et al.,(2002)Plant Physiol,129:13-22)。取含载体Cas9-Ms45的农杆菌(即含T-DNA载体的农杆菌)划板,挑单菌落接种,准备转化用农杆菌。取授粉后8-10天的Hi-II玉米穗。收集所有的未成熟胚(大小为1.0-1.5mm)。将含有T-DNA载体的农杆菌与未成熟胚共培养2-3天(22℃)。转移未成熟胚到愈伤诱导培养基上(培养基中含有200mg/L的Timentin,用于杀灭农杆菌,参照(Frame et al.,(2002)Plant Physiol,129:13-22)),28℃暗培养10-14天。将所有的愈伤转到带有终浓度2mM草甘膦的筛选培养基上(Frame et al.,(2002)Plant Physiol,129:13-22),28℃暗培养2-3周。
转移所有的组织到新鲜含终浓度2mM草甘膦的筛选培养基上,28℃暗培养2-3周。然后,转移所有筛选后成活的胚性组织到再生培养基上(Frame et al.,(2002)Plant Physiol,129:13-22),28℃暗培养10-14天,每皿一个株系。转移胚性组织到新鲜的再生培养基上,26℃光照培养10-14天。转移所有发育完全的植株到生根培养基上(Frame et al.,(2002)Plant Physiol,129:13-22),26℃光照培养直到根发育完全,然后移植到温室中单株培养,检测转基因玉米的抗除草剂能力。用稀释300倍的孟山都的41%的草甘膦水剂喷洒,7天后叶片发黄,枯死的为阴性;和喷清水对照长势一样的为阳性植株。
转基因品系的筛选:
通过上述方法,获得含转化载体Cas9-Ms45的T-DNA片段的转基因玉米植株。将获得的150个Cas9-Ms45转基因T0代植株移栽到温室中,用商业化品种“郑丹958”的母本,“郑58”(Z58)的花粉进行授粉,收获种子。然后通过连续的回交转育,获得Z58的近等位基因系。最终,从这150个品系中获得5个ZmMs45基因被敲除的雄性不育品系,用于后面的产业化研究和应用。
实施例2、玉米保持系的获得
载体构建:玉米保持系的转化载体包涵一个TWS插入片段,序列如SEQ ID No.4所示。TWS片段中包括四个表达框,分别为CYP81A9基因RNAi表达框,G10表达框,Ms45花药特异性表达框,玉米淀粉酶花粉特异性表达框。CYP81A9基因RNAi表达框赋予保持系能被玉米田中最常用的选择性除草剂烟嘧磺隆杀灭的特性;G10表达框赋予保持系对非选择性除草剂草甘膦的高耐受性;Ms45花药特异性表达框可以恢复ms45突变体的育性;玉米淀粉酶花粉特异性表达框可以使得含有TWS的花粉不育。
CYP81A9基因RNAi表达框的构建。用引物CYP81A9-F(5’TCTCGAGGCAGCTCCTCTCCGCGCACC3’)分别和CYP81A9-R1(5’CTGAGATCTACAGACTATGTCAACATAAAGCAC3’),CYP81A9-R2(5’ACTCGAGGCAGCTCCTCTCCGCGCAC3’),引物中分别设计了XhoI和BglII酶切位点,以玉米(B73)基因组为模板,PCR分别获得的大约0.5kb和0.7kb的DNA片段后克隆到pMD-18-T-Vector载体(TaKaRa)中,测定序列,最终把测序正确的上述两个序列通过三段连接的方法连入用XhoI单酶切并去磷酸化的双元载体pCambia1300中。即把pCambia1300载体中的抗潮霉素基因hptII置换为CYP81A9基因RNAi片段。载体中的35S启动子用来原来驱动CYP81A9基因RNAi表达。CYP81A9基因RNAi片段的序列如SEQ ID No.4中1032bp-2272bp的碱基所示。CYP81A9基因RNAi结构的终止子为pCambia1300载体中的CaMV 3'UTR序列。
G10表达框的构建。G10基因是从细菌中克隆到的抗草甘膦基因的基础上特变后人工合成的高效抗草甘膦基因(中国专利:2011100093290)。启动G10的是玉米的ubiquitin-1启动子pUBI。G10的终止子为人工合成终止子Ter(中国专利:2011100093290)。人工合成pUBI-G10-ter的序列,两端分别设置KpnI和EcoRI酶切位点,用于克隆到双元载体pCambia1300中,所述G10基因核苷酸序列为SEQ ID No.4中18371bp-19694bp的碱基所示。
Ms45花药特异性表达框的构建。
用于驱动Ms45表达的花药特异性启动子为玉米5126基因启动子。为了获得抹去KpnI位点的启动子,首先用引物p5126-F(5’GCCAGTGCCAAGCTTTATGATTTAGAATAATATAC3’)和p5126-MR(5’TGGTTGGTACGGAGCAGATGAGCAATTGGTAG3’),p5126-MF(5’TCATCTGCTCCGTACCAACCAGCCTTTCCTATT3’)和p5126-R(5’TCTCCATGGCAAAGCAACTTTGATTTGTGGT3’),以玉米(B73)基因组为模板,分别克隆出启动子的前后两部分,再以上述两种PCR产物为模板,用引物p5126-F(5’GCCAGTGCCAAGCTTTATGATTTAGAATAATATAC3’)和p5126-R(5’TCTCCATGGCAAAGCAACTTTGATTTGTGGT3’)克隆出大小为约0.5kb的完整的p5126启动子。p5126启动子5’端和和3’分别设置有HindIII和NcoI位点。p5126启动子序列如SEQ ID No.4中9056bp-9568bp的碱基所示。
包括Ms45基因的编码区和终止子的基因组序列中含有一个BamHI位点。为了获得抹去该位点的Ms45基因序列,首先用引物Ms45-F(5’TGCCATGGAGAAGAGGAACCTGCAGTGGCG3’)和Ms45-MR(5’AATACGGAACCATTCCTGTGCACATCGAGGTC3’),Ms45-MF(5’GAATGGTTCCGTATTCTTCACTGACACGAGCATG3’)和Ms45-R(5’AGGATCCTCATGGCGGCGTCCGCTCGGTTT3’),以玉米(B73)基因组为模板,分别克隆出启动子的前后两部分,再以上述两种PCR产物为模板,用引物Ms45-F(5’TGCCATGGAGAAGAGGAACCTGCAGTGGCG3’)和Ms45-R(5’AGGATCCTCATGGCGGCGTCCGCTCGGTTT3’)克隆出大小为约2.0kb的完整的包括Ms45 基因编码区和终止子的基因组序列(Unger E,Cigan A M,Trimnell M,et al.,2002,Transgenic Research,11(5):455-465)。Ms45基因的5’端和和3’分别设置有NcoI和BamHI位点。Ms45基因序列如SEQ ID No.4中9563bp-11522bp的碱基所示。
Ms45花药特异性表达框的构建。
用于驱动玉米淀粉酶Zm-aa1基因表达的花粉特异性启动子为玉米Pg47基因启动子。该启动子中含有BamHI、KpnI和NcoI位点。为了获得抹去这三个位点的启动子,首先用引物pPg47-F(5’TGGATCCTGCACCGGACACTGTCTGGTGGCATACC3’)和pPg47-MR(5’GTAGCCCAAGCGATCCACCTTTGATTTAATAGGATATTC3’),pPg47-MF(5’GGATCGCTTGGGCTACCAAAGACCAAATTTAGGAGT3’)和pPg47-R(5’GCCATGGTGTCGTGATCGATGCTTTATTCGTGTCTC3’),以玉米(B73)基因组为模板,分别克隆出启动子的前后两部分,再以上述两种PCR产物为模板,用引物pPg47-F(5’TGGATCCTGCACCGGACACTGTCTGGTGGCATACC3’)和pPg47-R(5’GCCATGGTGTCGTGATCGATGCTTTATTCGTGTCTC3’)克隆出抹除BamHI、KpnI位点的大小为约2.7kb的完整的pPg47启动子。再用引物pPg47-F(5’TGGATCCTGCACCGGACACTGTCTGGTGGCATACC3’)和pPg47-NR(5’CCCATCAGGACACCGATGGGAACTAATGGGCATCTC3’),pPg47-NF(5’CCATTAGTTCCCATCGGTGTCCTGATGGGCTTGGC3’)和pPg47-R(5’GCCATGGTGTCGTGATCGATGCTTTATTCGTGTCTC3’),以PCR产物约2.7kb的完整的pPg47启动子为模板,克隆出大小分别约为1.7kb和1kb的片段,再以上述两种PCR产物为模板,用引物pPg47-F(5’TGGATCCTGCACCGGACACTGTCTGGTGGCATACC3’)和pPg47-R(5’GCCATGGTGTCGTGATCGATGCTTTATTCGTGTCTC3’)克隆出抹除NcoI位点的大小为约2.7kb的完整的pPg47启动子。pPg47启动子5’端和和3’分别设置有BamHI和NcoI位点。pPg47启动子序列如SEQ ID No.4中11517bp-14264bp的碱基所示。
玉米淀粉酶Zm-aa1基因通过人工合成获得(序列如SEQ ID No.4中14259bp-16191bp的碱基所示),5’端连接有玉米brittle-1基因中编码淀粉质体靶向转运肽的序列,3’端连接有玉米In2-1基因的终止子。两端分别设置有NcoI和KpnI位点。
上述PCR试验过程中,如无特殊注释,模板都为玉米(B73)基因组。PCR的反应体系为:5x PrimeSTARTM Buffer(Mg2+plus)(购自TaKaRa公司),10μl;dNTP Mixture(各2.5mM),4μl;正向引物(10μM),1μl;反向引物(10μM),1μl;模板DNA100ng;PrimeSTARTM HS DNA Polymerase(2.5U/μl),0.5μl;灭菌蒸馏水,加至最终体积为50μl。PCR的条件为:95℃预变性2min;94℃变性30sec,58℃退火30sec,72℃延伸1kb/1min,32个循环;72℃延伸10min。
农杆菌T-DNA载体的构建:
以双元载体pCambia1300为基础,如上所述,把其中的抗潮霉素基因hptII置换为CYP81A9基因RNAi片段。获得pCambia1300-p35S-CYP81A9RNAi的载体。然后利用酶切位点KpnI和EcoRI把pUBI-G10-ter克隆到pCambia1300-p35S-CYP81A9RNAi中,获得载体pCambia1300-p35S-CYP81A9RNAi-pUBI-G10。再利用酶切位点HindIII和BamHI把用HindIII和NcoI酶切后的p5126以及用NcoI和BamHI酶切后的Ms45基因和终止子片段连入载体pCambia1300-p35S-CYP81A9RNAi-pUBI-G10中,获得载体pCambia1300-p35S-CYP81A9RNAi-pUBI-G10-p5126-Ms45。最后,利用BamHI和KpnI,把用BamHI和NcoI酶切后的pPg47以及用NcoI和KpnI酶切后的Zm-aa1基因及其终止子片段通过三段连接的方法连入载体pCambia1300-p35S-CYP81A9RNAi-pUBI-G10-p5126-Ms45中,获得载体pCambia1300-p35S-CYP81A9RNAi-pUBI-G10-p5126-Ms45-pPg47-Zm-aa1载体。这个载体命名为:ZmTWS(序列如SEQ ID No.4所示)。该载体结构如图3所示,载体中的T-DNA序列中的TWS片段结构如图5所示。最后,通过电转的方法把这个T-DNA质粒转入农杆菌LB4404中,通过含有15μg/ml四环素和50μg/mL的卡那霉素的YEP固体培养基筛选出阳性克隆,并保菌,用于接下来的植物转化。
玉米转化:
转化时使用的菌株为ZmTWS的农杆菌(即含T-DNA载体的农杆菌),使用的材料为授粉后8-10天的Hi-II玉米ms45基因突变株系玉米穗。其它都跟实施例1一致。
转基因品系的筛选:
通过上述方法,获得含转化载体ZmTWS的转基因玉米植株(命名为ZmTWS)。将获得的459个ZmTWS转基因T0代植株移栽到温室中,用商业化品种“郑丹958”的母本,“郑58”(Z58)的花粉进行授粉,收获T0代种子。然后,播种T0代种子,从中筛选出128个大约50%的花粉可育,50%的花粉不育的单拷贝、插入位点稳定,清晰、目的蛋白表达量合适的品系。然后将这些品系与商业化品种“郑丹958”的母本,“郑58”(Z58)进行回交转育,获得Z58近等位基因系。再对这些近等位基因系的草甘膦抗性和烟嘧磺隆抗性进行比较分析,我们从上述128个ZmTWS植株中筛选到82个草甘膦抗性良好且对烟嘧磺隆敏感的植株。最后,根据对株高、生长势、产量、生育期、生长周期,结实率等性状的统计分析结果,筛选出5个品系用于产业化研究。
实施例3、玉米不育系的转育
把实施例1获得的Ms45基因被敲除的不育系和优良母本自交系进行杂交,然后再经过连续回交,获得优良母本自交系的近等位基因系,即完成了不育系的转育。具体的,将Z58背景的不育系和另一个优良自交系母本隆平702(LP702)杂交,再经过6轮回交,筛选出LP702的近等位基因不育系,即完成了该不育系的转育。
实施例4、玉米保持系的转育
为了把TWS片段转育到其它不育系中,需要把保持系和不育系进行连续的回交,然后再通过连续自交获得稳定的保持系。把实施例2筛选的Z58背景的保持系和LP702背景的不育系杂交,然后经过6轮回交,再经过3轮自交后筛选到稳定的LP702近等位基因不育系,即完成了该保持系的转育。
实施例5、玉米保持系的扩繁
播种实施例2中获得的Z58背景的保持系种子,每孔播种3-4粒种子,然后对5叶期的保持系植株喷施1:200稀释的农达(孟山都公司),杀灭不含有TWS片段的非转基因植株,再让保持系植株自交,收获保持系种子。收获的这些保持系种子中有50%的转基因种子和50%的非转基因种子,可用于保持系和不育系的扩繁(图7)。
实施例6、玉米不育系的扩繁
把实施例2中获得的Z58背景的保持系种子和实施例1中获得的Z58背景的不育系种子以2:5的比例间隔种植。然后对5叶期的保持系植株喷施1:200稀释的农达(孟山都公司),杀灭不含有TWS片段的非转基因植株,再让保持系植株产生花粉给不育系植株授粉。收获不育系植株的种子,这些种子都是不育系种子,可用于杂交种的制备和不育系的扩繁。
实施例7、玉米杂交体系的及其应用
把实施例1中获得的Z58背景的不育系种子和Z58的父本-昌72以5:2的比例间隔种植。然后,在5叶期喷施田间正常使用浓度的选择性除草剂烟嘧磺隆用于除草,同时还可以起到除杂的作用,杀灭可能存在的极个别含有TWS片段的转基因植株。让昌72植株产生花粉给不育系植株授粉。收获不育系植株的种子,这些种子都是杂交种子,这些杂交种子可以用于销售和大田生产。
实施例8、水稻不育系的获得
不育系的获得有多种方法,比如从自然界中选育,用物理方法选育,用基因操作方法获取。本实施例中所使用的是基因操作方法获取转基因玉米。
载体构建:用于获得水稻不育系的转化载体的T-DNA中包含3个表达框(图1和2),分别为Cas9基因表达框,sgRNA表达框,G10表达框。Cas9基因表达框用于表达Cas9蛋白;sgRNA表达框用于产生sgRNA靶向特异位点;G10基因用于赋予转基因玉米草甘膦抗性。
Cas9基因表达框的构建。与实施例1中的方法一致。
sgRNA表达框的构建。通过人工合成sgRNA的表达框(pOsU6-sgRNA)。靶向水稻RTS基因的sgRNA为一个包含20个碱基对的核苷酸片段,序列如SEQ ID No.3所示。sgRNA的5’端是用于驱动sgRNA表达的启动子pOsU6,5’端是sgRNA的支架片段,上述元件构成“pOsU6-sgRNA靶标序列-sgRNA支架-ter”片段,片段的5’端和3’端各设置有一个KpnI酶切位点,该片段的序列如SEQ ID No.1中15451bp-16131bp的碱基所示,但是,其中SEQ ID No.1中15790bp-15809bp的碱基被置换为SEQ ID NO.3所示的序列。G10表达框的构建。与实施例1中的方法一致。
农杆菌T-DNA载体的构建:
构建方法与实施例1中的方法一致。这个载体命名为:Cas9-RTS(该载体中的T-DNA外源基因表达框核苷酸序列类似SEQ ID NO.1,但是其中SEQ ID No.1中15790bp-15809bp的碱基被置换为SEQ ID NO.3所示的序列。)。该载体结构如图1所示,载体T-DNA片段结构如图2所示。最后,通过电转的方法把这个T-DNA质粒转入农杆菌LB4404中,通过含有15μg/ml四环素和50μg/mL的卡那霉素的YEP固体培养基筛选出阳性克隆,并保菌,用于接下来的植物转化。
水稻转化:
转基因水稻的获得方法是采用现有技术(卢雄斌,龚祖埙(1998)生命科学10:125-131;刘凡等(2003)分子植物育种1:108-115)。选取成熟饱满的“秀水-134”种子去壳,诱导产生愈伤组织作为转化材料。取Cas9-RTS农杆菌划板。挑单菌落接种,准备转化用农杆菌。将待转化的愈伤组织放入OD为0.6左右的农杆菌菌液中(农杆菌菌液的制备:将农杆菌接种至培养基,培养至OD为0.6左右;培养基组成:3g/L K2HPO4、1g/LNaH2PO4、1g/LNH4Cl、0.3g/L MgSO4·7H2O、0.15g/L KCl、0.01g/L CaCl2、0.0025g/L FeSO4·7H2O、5g/L蔗糖、20mg/L乙酰丁香酮,溶剂为水,pH=5.8),让农杆菌结合到愈伤组织表面,然后把愈伤组织转移到共培养培养基(MS+2mg/L 2,4-D+30g/L葡萄糖+30g/L蔗糖+3g/L琼脂(sigma 7921)+20mg/L乙酰丁香酮)中,共培养2-3天。用无菌水冲洗转化后的愈伤,转移到筛选培养基(MS+2mg/L 2,4-D+30 g/L蔗糖+3g/L琼脂(sigma 7921)+20mg/L乙酰丁香酮+2mM草甘膦(Sigma))上,筛选培养两个月(中间继代一次)。把筛选后,生长活力良好的愈伤转移到预分化培养基(MS+0.1g/L肌醇+5mg/L ABA+1mg/L NAA+5mg/L 6-BA+20g/L山梨醇+30g/L蔗糖+2.5g/L gelrite)上培养20天左右,然后将预分化好的愈伤组织移到分化培养基上,每天14小时光照分化发芽。2-3周后,把抗性再生植株转移到生根培养基(1/2MS+0.2mg/L NAA+20g/L蔗糖+2.5g/L gelrite)上壮苗生根,最后将再生植株洗去琼脂移植于温室,选择产量高、种子大或者生物量高等能够提高水稻产量的转基因株系,培育新品种。分别获得含上述转化载体和只含有筛选标记基因EPSPS的空载体的转基因水稻植株。
转基因品系的筛选:
通过上述方法,获得含转化载体Cas9-RTS的T-DNA片段的转基因玉米植株。将获得的205个Cas9-RTS转基因T0代植株移栽到转基因试验田中,其中17个品系的不可育,通过与非转基因品系杂交收获转基因T0代种子。同时收获另外188个可育品系的T0代种子,用于进一步种植,筛选雄性不育植株。然后通过筛选获得5个RTS基因被敲除、雄性不育且Cas9-RTS的T-DNA片段分离了的品系用于后面的产业化研究和应用。
实施例9、水稻保持系的获得
载体构建:水稻保持系的转化载体包涵一个TWS插入片段。TWS片段中包括四个表达框,分别为CYP81A6基因RNAi表达框,G10表达框,RTS基因花药特异性表达框,玉米淀粉酶花粉特异性表达框。CYP81A6基因RNAi表达框赋予保持系能被水稻田中最常用的选择性除草剂苯达松杀灭的特性;G10表达框赋予保持系对非选择性除草剂草甘膦的高耐受性;RTS花药特异性表达框可以恢复rts突变体的育性;玉米淀粉酶花粉特异性表达框可以使得含有TWS的花粉不育。
CYP81A6基因RNAi表达框的构建。CYP81A6的表达框为现有表达框(Lin C,Fang J,Xu X,et al.,2008,PLoS One,3(3):e1818.)。即把pCambia1300载体中的抗潮霉素基因hptII置换为CYP81A6基因RNAi片段。载体中的35S启动子用来原来驱动CYP81A6基因RNAi表达。CYP81A6基因RNAi结构的终止子为pCambia1300载体中的CaMV 3'UTR序列。
G10表达框的构建。与实施例2中的方法一致。
RTS花药特异性表达框的构建。
设计PCR引物RTS-F(5’GAAGCTTGAGCTCACCGGCGAGGCGGTGC)和RTS–R(5’GCTTGCGGATCCTTCTGAAAAACTACATAAGTAC),以商业水稻品种秀水134基因组为模板,通过PCR扩增获得包涵RTS启动子、编码序列和终止子的DNA片段,大小为约2.1kb的。在该片段的5’端和3’端分别设置有HindIII和BamHI位点。该DNA片段的序列见NCBI(ACCESSION:U12171)。
玉米淀粉酶花粉特异性表达框的构建。人工合成水稻的PS1基因启动子pPS1,5’端和3’端分别设置有BamHI和NcoI位点,核苷酸序列如SEQ ID No.5所示。玉米淀粉酶Zm-aa1基因与实施例2一致。
农杆菌T-DNA载体的构建:
以双元载体pCambia1300为基础,如上所述,把其中的抗潮霉素基因hptII置换为CYP81A6基因RNAi片段。获得pCambia1300-p35S-CYP81A6RNAi的载体。然后利用酶切位点KpnI和EcoRI把pUBI-G10-ter克隆到pCambia1300-p35S-CYP81A6RNAi中,获得载体pCambia1300-p35S-CYP81A6RNAi-pUBI-G10。再利用酶切位点HindIII和BamHI把用HindIII和NcoI酶切后的p5126以及用NcoI和BamHI酶切后的RTS基因和终止子片段连入载体pCambia1300-p35S-CYP81A6RNAi-pUBI-G10中,获得载体pCambia1300-p35S-CYP81A6RNAi-pUBI-G10-pRTS-RTS。最后,利用BamHI和KpnI,把用BamHI和NcoI酶切后的pPg47以及用NcoI和KpnI酶切后的Zm-aa1基因及其终止子片段通过三段连接的方法连入载体pCambia1300-p35S-CYP81A6RNAi-pUBI-G10-pRTS-RTS中,获得载体pCambia1300-p35S-CYP81A6RNAi-pUBI-G10-pRTS-RTS-pPg47-Zm-aa1载体。这个载体命名为:OsTWS。该载体结构如图4所示,载体中的T-DNA序列中的TWS片段结构如图6所示。OsTWS载体的T-DNA序列与ZmTWS类似,但是其中的CYP81A9基因RNAi表达框被置换为CYP81A6基因RNAi表达框;Ms45花药特异性表达框被置换为RTS花药特异性表达框;玉米淀粉酶花粉特异性表达框中的特异性启动子玉米Pg47基因启动子被置换为水稻的PS1基因启动子(具体序列如实施例9所述)。
最后,通过电转的方法把这个T-DNA质粒转入农杆菌LB4404中,通过含有15μg/ml四环素和50μg/mL的卡那霉素的YEP固体培养基筛选出阳性克隆,并保菌,用于接下来的植物转化。
水稻转化:
转化时使用的菌株为OsTWS的农杆菌(即含T-DNA载体的农杆菌),使用的材料为“秀水-134”背景的rts基因突变株系的种子。其它都跟实施例1一致。
转基因品系的筛选:
通过上述方法,获得含转化载体OsTWS的转基因水稻植株(命名为OsTWS)。将获得的625个OsTWS转基因T0代植株移栽到转基因试验田中,收获T0代种子。然后,播种T0代种子,从中筛选出220个大约50%的花粉可育,50%的花粉不育的单拷贝、插入位点稳定,清晰、目的蛋白表达量合适的品系。然后将这些品系。再对这些近等位基因系的草甘膦抗性和苯达松抗性进行比较分析,我们从上述220个OsTWS植株中筛选到105个草甘膦抗性良好且对烟嘧磺隆敏感的植株。最后,根据对株高、生长势、分蘖、产量、生育期、生长周期,结实率等性状的统计分析结果,筛选出5个品系用于产业化研究。
实施例10、水稻不育系的转育
把实施例8筛选的RTS基因被敲除的不育系和优良母本自交系进行杂交,然后再经过连续回交,获得优良母本自交系的近等位基因系,即完成了不育系的转育。具体的,将“秀水-134”背景的不育系和另一个优良自交系“9311”杂交,再经过6轮回交,筛选出“9311”的近等位基因不育系,即完成了该不育系的转育。
实施例11、水稻保持系的转育
为了把TWS片段转育到其它不育系中,需要把保持系和不育系进行连续的回交,然后再通过连续自交获得稳定的保持系。把实施例9中获得的“秀水-134”背景的保持系和实施例10中获得的“9311”背景的不育系杂交,然后经过6轮回交,再经过3轮自交后筛选到稳定的“9311”近等位基因不育系,即完成了该保持系的转育。
实施例12、水稻保持系的扩繁
播种实施例11中获得的“秀水-134”背景的保持系种子,然后对播种后约20天,即两叶一心期的保持系植株喷施1:200稀释的农达(孟山都公司),杀灭不含有TWS片段的非转基因植株,再让保持系植株自交,收获保持系种子。移栽保持系植株,收获的这些保持系种子中有50%的转基因种子和50%的非转基因种子,可用于保持系和不育系的扩繁(图8)。
实施例13、水稻不育系的扩繁
播种实施例9中获得的“秀水-134”背景保持系种子和实施例8中获得的“秀水-134”背景不育系种子。然后对播种后约20天,即两叶一心期的保持系植株喷施1:200稀释的农达(孟山都公司),杀灭不含有TWS片段的非转基因植株,再让保持系植株自交,收获保持系种子。把“秀水-134”背景的保持系种子和不育系种子以2:5的比例间隔种植。让保持系植株产生花粉给不育系植株授粉。收获不育系植株的种子,这些种子都是不育系种子,可用于杂交种的制备和不育系的扩繁。
实施例14、水稻杂交体系的及其应用
播种实施例8中获得的“秀水-134”背景的不育系种子和“9311”种子。然后对播种后约20天,即两叶一心期的秧苗喷施田间正常使用浓度的选择性除草剂苯达松用于除草,同时还可以起到除杂的作用,杀灭可能存在的极个别含有TWS片段的转基因植株。把“秀水-134”背景的不育系种子和“9311”以5:2的比例间隔种植。让“9311”植株产生花粉给不育系植株授粉。收获不育系植株的种子,即为杂交种。
- 还没有人留言评论。精彩留言会获得点赞!