绿盲蝽V‑ATPaseE基因及其在RNAi介导的害虫防治方面的应用的制作方法
本发明涉及昆虫基因工程技术领域,具体涉及一种绿盲蝽V-ATPaseE基因及其在RNAi介导的害虫防治方法的应用。
背景技术:
在过去十几年,Bt转基因棉花在中国北方各省种植面积已达90%以上,转基因Bt棉花的大面积种植有效控制了以前棉花头号敌人的棉铃虫Helicoverpaarmigera(Hubner),使得用于棉田的农药量大量减少而获得了明显的经济效果和害虫防治效果。然而农药喷施量的减少导致处于次要地位的害虫绿盲蝽Apolygus lucorum(Meyer-Dur)越来越猖獗。每年长江和黄河流域因绿盲蝽所产生的经济损失对农业生产产生了很大的影响。至今绿盲蝽的防治由于缺乏有效的Bt蛋白,而主要依靠传统的化学防治,农药使用量的增多严重污染了环境。因此,发展一种环境友好,经济效益高的新的害虫防治策略是时代趋势。
双链RNA(dsRNA)介导的基因沉默通常被称为RNA干扰(RNAi),当外源双链dsRNA(长双链RNA)或siRNA(小干扰RNA)被转入到细胞或组织时在体内产生内源靶标互补mRNA的序列的特异性降解并阻断转录,抑制翻译的现象。在这个过程中首先dsRNA被Dicer酶切割成21-23bp长度的小分子RNA即siRNA,然后RNA在诱导沉默复合体(RNA-induced silencing complex,RISC)的作用下siRNA被解旋成单链,反义链特异性地与同源mRNA(靶标)结合并引导RISC使mRNA发生断裂而导致基因表达沉默。RNAi的发现在生物领域彻底改变了研究方法和思考模式。通过将近20年的研究实际RNAi已变成了非常成熟的反向遗传学研究基因功能的巧妙工具。至今RNAi在医学,作物改良,农业,畜牧业,园艺,农业等方面取得了很大的进展。理论上讲我们通过RNAi也可沉默任何一个对我们不利基因。至今研究人员在这些方面做了大量研究筛选出大量的靶标基因,并实际应用取得了令人兴奋地突破。比如Baum等(Baum,J.A.et al.(2007)Control of coleopteran insect pests throughRNA interference.Nat.Biotechnol.25,1322–1326)等通过饲喂方法在西方玉米根虫(WCR)中一共筛选将近300种基因并最后证明14个能够在低浓度dsRNA的情况下引起相应靶标基因的下调并在昆虫中产生迟育,死亡等症状。其中最有效的dsRNA是针对于V-ATPaseA基因,即其在低浓度dsRNA处理24h后RNAi仍然有效。
对大多数多细胞生物来说内部pH的稳定性是很多生命活动的最基本的保障。V-H+-ATPase作为持家基因广泛存在于真核细胞的胞质膜及细胞管泡膜膜系统中,能依赖分解ATP产生的能量作为动力,逆浓度梯度地将H+质子泵出细胞外或泵入细胞管泡腔内,维持细胞胞质的pH值。V-ATPase与骨质的吸收,尿液或胃液酸化,精子成熟和运动,胚泡的植入等生理过程密切相关。V-ATPase是由跨膜和细胞内的V0和V1两种大亚基组成的。V0亚基是H+的运输通道,V1的主要作用是分解ATP,为H+运输提供能量。其中E小亚基属于V1大亚基与ATP讲解相关。
技术实现要素:
本发明的目的提供一种绿盲蝽V-ATPaseE基因,在绿盲蝽生长发育和生理过程中起着非常重要的作用,沉默该基因后,对绿盲蝽个体发育造成的影响。
本发明的另一个目的提供一种绿盲蝽V-ATPaseE基因在RNAi介导的害虫防治方面的应用。
绿盲蝽V-ATPaseE基因,其核苷酸序列如序列表SEQ ID NO:1所示。
绿盲蝽V-ATPaseE基因在RNAi介导的害虫防治方面的应用。
所述RNAi介导中,合成的dsRNA通过注射或饲喂进入绿盲蝽体内。
所述dsRNA所对应的靶标片断的核苷酸序列如SEQ ID NO:2、SEQ ID NO:3或SEQ ID NO:4所示。
所述dsRNA所对应的靶标片断的核苷酸序列如SEQ ID NO:2。
所述注射体积为41.6nl,注射dsRNA浓度为10μg/μl,注射部位为绿盲蝽的后胸与腹部节间膜的最外侧。
所述饲喂的饲料总体积200ul,dsRNA浓度0.5ug/ul。
所述绿盲蝽为三龄绿盲蝽。
本发明筛选到绿盲蝽V-ATPaseE基因,为一看家基因,为绿盲蝽生长发育重要基因,针对该基因选择了三个靶标片断,合成了三段dsRNA,并分别命名为dsVA-EF1,dsVA-EF2,dsVA-EF3,绿盲蝽VA-E基因序列是通过转录组测序获得,其基因和三个片段序列分别在SEQ ID NO.1,NO.2,NO.3,NO.4所示。然后所合成的dsRNA通过显微注射方法传递绿盲蝽三龄幼虫。绿色荧光蛋白(GFP)作为阳性对照。统计注射后7天的存活率,结果三个片段7天后存活率分别是55%,70%,68%,即第一片段VA-EF1显微注射RNAi效果最好。同时实时荧光定量PCR结果也证实了靶标基因明显的被沉默。为了将来田间应用我们发展了一种dsRNA饲喂传递方法并把第一片段dsVA-EF3进行饲喂验证。结果7天后的存活率为65%。本发明为将来绿盲蝽RNA干扰(RNAi)介导的害虫防治策略提供了效果较好的候选基因并验证。
附图说明
图1绿盲蝽ApoV-ATPaseE三个片段dsRNA凝胶电泳结果图:
其中A为VA-ERNAi实验总RNA琼脂糖凝胶电泳,B为Qpcr总RNA检测琼脂糖凝胶结果,C为VA-EF1dsRNA凝胶电泳结果,D为VA-EF2dsRNA凝胶电泳结果,E为VA-EF3dsRNA凝胶电泳结果。
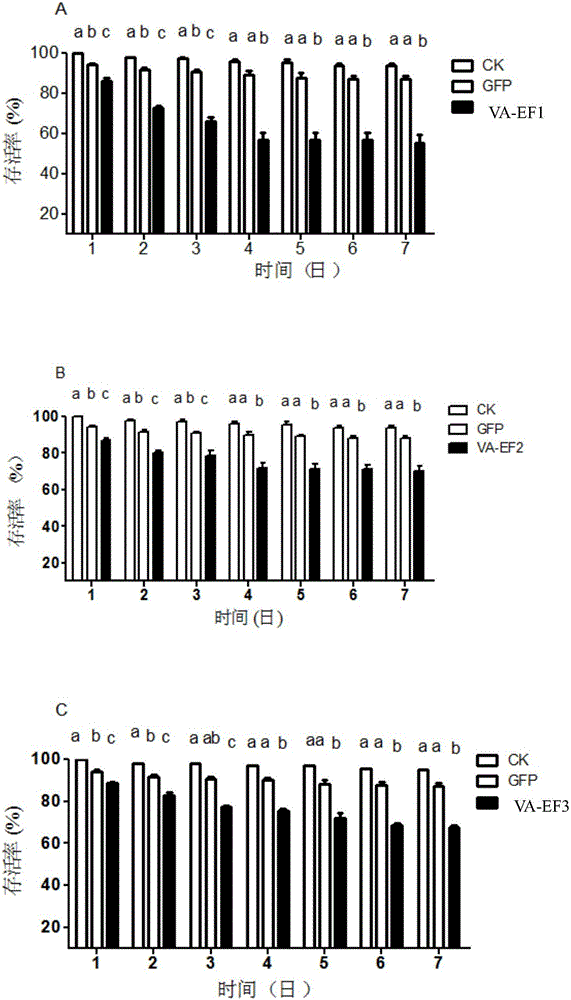
图2绿盲蝽ApoV-ATPaseE三个片段dsRNA注射7天存活率;
其中A、B、C分别表示VA-EF1、VA-EF2、VA-EF3片段。
图3绿盲蝽ApoV-ATPaseE三个片段dsRNA注射实验对靶标基因表达量的影响;
其中A、B、C分别表示VA-EF1、VA-EF2、VA-EF3片段。
图4绿盲蝽VA-EF1片段饲喂7天存活率;
图5绿盲蝽VA-EF1片段饲喂RNAi实验对靶标基因表达量的影响。
具体实施方式
下面通过具体实施例进一步说明本发明。以下实施例用于说明本发明,但不用来限制本发明的范围。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的实验材料,如无特殊说明,均为市售常规生化试剂。
实施例1ApoV-ATPaseE基因克隆,ApoV-ATPase的具备,dsRNA的显微注射和饲喂实验
绿盲蝽的转绿组测序和ApoV-ATPaseE基因的生物信息学分析。
本实验室事前对绿盲蝽进行转绿组测序,成功得到绿盲蝽63029条基因序列,并注释了其中25760条基因序列。利用生物信息学技术及相关在线软件对绿盲蝽转录组数据进行初步的分析,通过在线程序NCBI Blast等程序的帮助下确定了绿盲蝽ApoV-ATPaseE基因。
测序结果见SEQ ID NO:1所示。
2.供试昆虫及组织收集
绿盲蝽为中国农业科学院植物保护研究所使用新鲜玉米(ZeamaysL)及四季豆(Phaseolus vulgaris L.)饲养,饲养温度为25-28℃,相对湿度为60%-70%,光照为16:8(L:D)。
3.RNA的提取
昆虫总RNA提取的全部过程在无RNase条件下进行。整个提取步骤如下所示:
1)取-70℃保存的昆虫组织,加入已经用液氮预冷的玻璃匀浆器中,立即向匀浆器内加入1mL Trizol试剂,将组织充分研磨磨碎;将研磨好的组织溶液用无RNA酶的枪头转移到无RNA酶的1.5mL离心管中,暂时至于冰上。
2)4℃,12000g离心15min,将上清转移到新的无RNA酶的1.5mL离心管中。
3)将上清在室温下放置5min后,向离心管中加入0.2mL氯仿,用手剧烈震荡15s,再室温静置2-3min。
4)4℃,12000g离心15min,混合物在此后分层,下层为有机相,上层为水相(RNA就在水相中),用无RNA酶的枪头将上层水相转移到新的无RNA酶的1.5mL离心管中,注意尽量不要吸到中间层,以免造成蛋白质或DNA污染。
5)加入0.5mL异丙醇,混匀后,室温静置10min来沉淀RNA。
6)4℃,12000g离心10min后,观察到的沉淀即为RNA,弃上清(尽量吸净),加入1mL 75%的乙醇(用DEPC水配置,现用现配),轻轻震荡离心管悬浮沉淀,洗涤沉淀。
7)4℃,7500g离心10min后,弃上清(尽量吸净),超净台中干燥沉淀5-10min。
8)加入10-20μL RNA-free水(根据RNA量而定),轻弹离心,使沉淀充分溶解。
9)55-60℃温育后,取1μL样品稀释至5μL,其中2.5μL进行电泳检测,2.5μL用NanoDrop仪器检测;剩余的样品用于cDNA合成或者保存于-70℃冰箱。
5.第一链cDNA的合成
整个反转录过程在无RNA酶污染的条件下进行,操作步骤按Revert Aid First Strand cDNA Synthesis Kit进行,具体如下:
1)在无RNA酶的PCR管中依次加入:2μg RNA(根据NanoDrop定量的结果计算应该加入RNA的体积数),DNaseⅠ1μL,1μL Ribolock RNase Inhibitor,1μL 10×Reaction Buffer with MgCl2,用RNA-free水将体系补足到10μL;轻微震荡后离心;
2)37℃温育30min后,向体系内加入1μL 50mM EDTA,震荡后离心,然后65℃温育10min,以去除DNA酶I;
3)加入1μLoligo-dT,用RNA-free水补至12μL;
4)65℃温育5min后,立即置于冰上;
5)依次加入下列试剂,使体系达到20μL:4μL的5×Reaction buffer;2μL的dNTP Mix(10mM);1μL的Revert Aid Reverse Transcriptase和1μL的Ribolock RNase Inhibitor;简单混匀离心;
6)42℃温育1h,然后再70℃温育5min;
7)合成后存于-20℃或者-70℃冰箱,使用前按情况稀释若干倍。
3、靶标基因的克隆
本发明选取了该基因三个片段,通过注射法研究其对昆虫的影响,GFP基因(SEQ ID NO:5所示)上的片段作为对照。持家基因又称管家基因,是指所有细胞中均要表达的一类基因,其产物是对维持细胞基本生命活动所必需的;而能量代谢相关基因和细胞凋亡相关基因也在绿盲蝽生长发育和生理过程中起着非常重要的作用。本发明选取此类基因上的片段,利用注射法进行RNAi将其沉默,研究观察沉默该基因后,对绿盲蝽个体发育造成的影响。GFP即绿色荧光蛋白,在昆虫体内并不存在,故大量研究中将其作为对照基因合成dsRNA。
1.靶标基因引物的设计:
(1)利用BLAST检索数据库,搜索绿盲蝽的相近物种同一靶标基因的蛋白或者cDNA编码的氨基酸序列,用绿盲蝽成虫若虫转录组组建的本地BLAST库进行比对查询,确定所选基因的序列。
(2)根据靶标基因的片段,用Primer Premier 5.0软件设计带T7启动子的引物,引物设计原则如下:
a.引物设计的区间要在靶标基因的编码区,中间片段大小在400-500bp左右。
b.中间片段尽量选在靶标基因的特异区域。
c.引物之间不能形成引物二聚体,交叉二聚体。
2.根据以上引物设计原则设计引物后,送至华大基因进行引物合成。
3.相关靶标基因的引物序列见表1
表1.实验所用引物
4、目的片段的PCR扩增、测序及序列分析
1.以绿盲蝽cDNA为模板,用ExTaq酶扩增表1中基因。反应体系为25μl:17μl重蒸水,2.5μl 10×反应缓冲液,2μl dNTPs(2.5mM),1μl cDNA,1μl F引物(10mM),1μl R引物(10mM)和0.5μl DNA聚合酶。反应条件为:94℃预变性3min;94℃变性30s,60-65℃退火30s,72℃延伸30s,35个循环;最后72℃延伸10min。
2.PCR产物用溶解在1×TAE缓冲液的1%琼脂糖凝胶电泳进行检测。检测正确的PCR产物,用琼脂糖凝胶回收试剂盒进行回收(操作步骤按试剂盒内附带的说明书进行),回收的片段连接到pGME-T载体上(体系为8μl胶回收产物、1μl 10×T4链接反应缓冲液、0.5μl pGME-T载体和0.5μl T4连接酶,16℃条件下连接过夜),连接体系转化Top10感受态细胞(转化步骤按感受态细胞附带的说明书进行),培养过夜后,挑取8个阳性克隆进行PCR验证(体系和条件同上),将检测正确的克隆用液体LB培养基(含氨苄抗生素)培养过夜检验目的片段序列。
3.根据测序结果,将正确的菌株加入含有氨苄抗生素的新鲜LB培养基重新摇菌,获得新鲜的菌液,将1ml菌液和百分之八十的甘油按照9:1比例混合,存于-80℃低温冰箱保存。将剩余的菌液进行质粒提取。序列结果见序列表。(见SEQ ID NO2、NO3、NO4)
5、dsRNA模板的制备
以带有靶标基因片段的质粒为模板,用聚合酶扩增。反应体系为25μl:17μl重蒸水,2.5μl 10×反应缓冲液,2μl dNTPs(2.5mM),1μl载有靶标基因片段的质粒,1μl正向(F)引物(10mM),1μl反向(R)引物(10mM)和0.5μl DNA聚合酶。反应条件为:94℃预变性3min;94℃变性30s,55-60℃退火45s,72℃延伸1min,35个循环;最后72℃延伸10min。
将1μl PCR产物用溶解在1×TAE缓冲液的1%琼脂糖凝胶电泳进行检测。如果所得条带长度与目的片段长度一致,并且结果显示为单一明亮的条带,则将剩余的PCR产物进行酚氯仿抽提与纯化。
PCR产物的酚氯仿抽提的步骤:
1.将需要纯化的PCR产物用无RNA酶的H2O定容至200μl
2.加入等体积(200μl)的酚氯仿试剂(一定取酚氯仿试剂的下层,并且拿试剂瓶时要平稳,不能晃动)。
3.温和混匀,在4℃离心机下离心(12000rpm,4℃)15min.
4.4.取上清,加入1/10体积(20μl)的3M乙酸钠(pH5.2)和2倍体积(400μl)的100%乙醇(-20℃贮存),温和混匀后放于-20℃静置沉淀至少3小时或者过夜。
5.在4℃离心机下离心(12000rpm,4℃)30min.
6.白色沉淀积于离心管底部,弃上清液(为防止沉淀一起被吸出,可保留些许上清液),加入75%乙醇(-20℃贮存)轻轻混匀,洗涤沉淀
7.在4℃离心机下离心(7500rpm,4℃)5min.
8.将乙醇慢慢吸出(注意不要吸出沉淀),接近沉淀的残留液体用10μl移液枪慢慢吸出。将离心管开盖放入37℃恒温培养箱干燥,10min左右,待乙醇全部挥发。
9.加入5μl RNase–free H2O轻弹管底,让沉淀充分均匀溶解于无RNA酶的H2O。
10.取1μl溶液溶于4μl无RNA酶的H2O中,用浓度测量仪器检测浓度和OD值。用凝胶电泳检测产物单一性,如果检测条带是单一明亮的条带,并且其OD值为:
260/280:1.8-2.0
260/230:1.8-2.0
则说明PCR产物质量良好,可以作为下一步合成dsRNA的模板使用。
6、dsRNA的合成
1.将ATP,CTP,GTP,UTP(100mM)放于冰上慢慢融化,5×反转录缓冲液室温融化,T7RNA聚合酶放于-20℃贮存,随用随拿,用完立即放入-20℃环境下贮存。溶解以后轻弹管底,瞬时离心,将试剂离心到管底。
2.按以下比例将试剂混合:
轻弹混匀,瞬时离心。放入37℃金属浴中4小时。
3.从金属浴中取出离心管,放入75℃金属浴中5min,然后放置室温冷却(切勿放在冰上)。吸出1μl,稀释5倍,凝胶电泳检测产物条带。
4.去除DNA和dsRNA.按照比例加入下列试剂:
充分混匀,轻弹管底,瞬时离心后,放入金属浴37℃30min,加入EDTA试剂1μl,65℃金属浴中放置5min终止反应。取1μl产物,稀释5倍,凝胶电泳检测产物单一性,浓度检测仪器检测浓度和OD值。如果检测条带是单一明亮的条带,并且其OD值为:
260/280:1.8-2.0
260/230:1.8-2.0
则说明dsRNA质量良好,可以进行下一步dsRNA酚氯仿抽提。
7、dsRNA的酚氯仿抽提
1.将需要纯化的dsRNA(~60μl)用无RNA酶的H2O定容至200μl(可根据实际需要等比例扩大体系)。
2.加入1/2体积(100μl)的水饱和酚试剂(一定取水饱和酚试剂的下层,并且拿试剂瓶时要平稳,不能晃动)和1/2体积的氯仿(100μl)。
3.轻轻混匀,在4℃离心机下离心(12000rpm,4℃)15min。
4.取上层水相,加入的等体积氯仿(200μl),轻轻混匀,在4℃离心机下离心(12000rpm,4℃)15min。
5.取上层水相,加入1/10体积(20μl)的3M乙酸钠(pH5.2)和2.5倍体积(500μl)的100%乙醇(-20℃贮存),温和混匀后放于-20℃静置沉淀至少3小时或者过夜。
6.在4℃离心机下离心(12000rpm,4℃)30min。
7.白色沉淀积于离心管底部,弃上清液(为防止沉淀一起被吸出,可保留些许上清液),加入80%乙醇(-20℃贮存)轻轻混匀,洗涤沉淀。
8.在4℃离心机下离心(7500rpm,4℃)5min。
9.将乙醇慢慢吸出(注意不要吸出沉淀),接近沉淀的残留液体用10μl移液枪慢慢吸出。将离心管开盖放入37℃恒温培养箱干燥,10min左右,待乙醇全部挥发。
10.加入5μl无RNA酶的H2O轻弹管底,让沉淀充分均匀的溶解于无RNA酶的H2O中。
11.取1μl溶解的dsRNA产物稀释于4μl DEPC H2O中,用凝胶电泳检测产物单一性,并用浓度检测仪器检测浓度和OD值。如果检测的条带是单一明亮的条带,并且其OD值为:
260/280:1.8-2.0
260/230:1.8-2.0
则证明dsRNA质量良好,可以进行绿盲蝽体内注射RNAi实验。
8、实时荧光定量PCR与分析
实验采用的是2-ΔΔCT法进行相对定量,即通过内参基因校准不同样品的模板加入总量的差异。ΔΔCT=(CT目的基因-CT内参基因)实验组-(CT目的基因-CT内参基因)对照组,2-ΔΔCT的意义即为:实验组的目的基因相对于对照组的目的基因的倍数,由此即可得到相对表达量。本实验所用的引物如表2所示
表2实时荧光PCR实验所用引物
本实验中,以α-tubulin,GADPH为内参基因,按照TakaRa公司的SYBR PRemix Ex TaqTM试剂盒说明书对绿盲蝽对照组和实验组进行Real Time PCR反应,以实验的三组基因的第1d、2d、3d、4d、5d样品的cDNA模板。反应体系以及反应条件如下:
反应体系为20μL
反应条件:
第1阶段预变性95℃,2min
第2阶段PCR扩增95℃,10s;55℃,10s
第3阶段:溶解曲线分析
温度以0.5℃/s的速度从55℃增加到95℃,连续测定样品的荧光强度以获得溶解曲线。
9.3龄(3L)绿盲蝽的准备
本发明中所选绿盲蝽为3L若虫,现以3L若虫的收集方法如下:收集1L初孵若虫(200~300头),放入养虫盒中,盒中放入干净滤纸和一根去皮的新鲜玉米,约4天后所有1L若虫成长为3L若虫,准备铺好滤纸和7~8粒新鲜玉米粒的塑料培养皿,每个培养皿里放15只3L若虫,放若虫时,用软毛刷轻轻挑取,以免对若虫造成不必要的机械损伤。
9.1dsRNA显微注射法筛选VA-E基因不同片段的位置效应
合成完VA-EdsRNA三个片段后以后先用注射法传递dsRNA,dsGFP和没注射组分别作为对照。注射法使用3L绿盲蝽,注射参数如下:注射体积为41.6nl,注射dsRNA浓度为10μg/μl,注射部位为绿盲蝽的后胸与腹部节间膜的最外侧。结果图1所示。结果显示与F2,F3片段相比,F1片段的RNAi效果明显的高并有显著性差异(P<0.05)。
表3.绿盲蝽三个片段注射7天内的存活率
9.2饲喂筛选VA-EF的各dsRNA基因片段的dsRNA对绿盲蝽生长发育的影响
三龄绿盲蝽的准备和人工饲料的配制
为饲喂实验所准备的绿盲蝽前期准备阶段与注射实验一样然而最后开始做实验前饥饿处理两个小时。
人工饲料是按照中国农业科学院植物保护研究所棉花害虫研究组所提供的配方来配制的(棉虫组已经在人工饲料的配制和实际应用方面通过了实验验证)
饲料总体积200ul,dsRNA浓度0.5ug/ul。结果如表4所示。
表4.绿盲蝽VA-E基因F1片段饲喂RNAi 7天内的存活率
- 还没有人留言评论。精彩留言会获得点赞!