人附睾蛋白4基因序列、HE4蛋白及制备方法与流程
本发明涉及生物技术领域,特别是涉及一种人工合成的人附睾蛋白4基因序列、HE4蛋白及制备方法。
背景技术:
人附睾蛋白4(Human epididymis protein,HE4)是Kirchhoff等1991年从人附睾远端上皮内发现的,是一种与精子成熟相关的小分子分泌蛋白,属于乳清酸性蛋白及4-二硫键形成的核心结构域蛋白家族的成员,由两个“乳清酸性蛋白(Whey a-cidic proteins,WAP)域”和一个“4-二硫键核心域(WFDC)”组成,相对分子质量为13KD左右。
HE4是近年来研究较热门的一种新型肿瘤血清学的强有力的标志物,检测HE4是鉴别卵巢良、恶性肿瘤的一种更有效的指标,并且其在早期卵巢癌的诊断中敏感度明显高于CA125,HE4在卵巢癌组织中存在过表达现象,目前主要作为诊断卵巢癌的血清学肿瘤标志物。检测体内HE4对卵巢癌的鉴别、早期诊断、治疗、预后及监测复发等方面具有重要意义。
人附睾蛋白4的检测需要相应的抗体,而高质量、稳定的人附睾蛋白4是制备人附睾蛋4单克隆抗体必不可少的原料。现有技术中,为了获得HE4蛋白,采用的方法是:根据基因库(GenBank)中HE4基因的序列,设计合成引物,应用聚合酶链式反应(Polymerase Chain Reaction,PCR)扩增HE4基因后,构建包含扩增后的HE4目的基因的表达载体,并表达获得HE4蛋白。
但是,上述采用PCR扩增所获得的HE4片段存在突变的因素,获得的HE4蛋白并不稳定,且表达量少、溶解性低、不容易纯化。
技术实现要素:
本发明主要解决的技术问题是提供一种人工合成的人附睾蛋白4基因序列、HE4蛋白及制备方法,能够获得稳定的人附睾蛋白4蛋白,且表达量多、溶解性好、易纯化。
为解决上述技术问题,本发明采用的一个技术方案是:提供一种人工合成的人附睾蛋白4基因序列,所述HE4基因序列包括SEQ ID NO:1。
为解决上述技术问题,本发明采用的另一个技术方案是:提供一种HE4蛋白,所述HE4蛋白是通过人工合成的HE4基因序列表达而获得的,所述HE4基因序列包括SEQ ID NO:1。
其中,所述HE4蛋白是采用CHO细胞、对包含所述HE4基因序列的表达载体进行表达而获得的。
为解决上述技术问题,本发明采用的又一个技术方案是:提供一种HE4蛋白的制备方法,所述方法包括:人工合成HE4基因序列,其中,所述HE4基因序列包括SEQ ID NO:1;构建包含所述HE4基因序列的表达载体;表达包含所述HE4基因序列的表达载体,获得所述HE4蛋白。
其中,所述表达包含所述HE4基因序列的表达载体,获得所述HE4蛋白的步骤,包括:采用CHO细胞表达包含所述HE4基因序列的表达载体,获得所述HE4蛋白。
其中,所述表达载体为pCMV-EGFP质粒。
其中,所述表达包含所述HE4基因序列的表达载体,获得所述HE4蛋白的步骤之后,包括:采用镍琼脂糖凝胶Ni Sepharose亲和层析柱纯化所述HE4蛋白。
本发明的有益效果是:区别于现有技术的情况,本发明采用经过专门设计的、采用人工方式合成HE4基因序列,稳定性好;该基因序列删除原始序列上的跨膜区序列,使得HE4蛋白分泌到细胞溶液中,提高了溶解性;该基因序列设计有Kozak序列,能够促进表达,使得蛋白产量提高;该基因序列设计有纯化标签,有利于表达的HE4蛋白的纯化。
附图说明
图1是基因的酶切鉴定图谱;
图2是推导HE4蛋白氨基酸信号肽的分析示意图;
图3是通过合成的HE4基因序列表达而获得的HE4蛋白的SDS电泳图谱示意图;
图4是转染细胞培养的荧光状况示意图。
具体实施方式
在详细说明本发明之前,先介绍一下与本发明相关的基本概念。
HE4高度保守的结构域含有一个抑制蛋白酶功能的环结构,属于抑蛋白酶基因家族。最初认为HE4是一种与精子成熟相关的蛋白酶抑制剂,具有保护免疫系统的功能。HE4主要分布于生殖系统上皮,如附睾、曲细精管、输精管上皮、输卵管上皮和子宫内膜等组织。Wang等研究了不同卵巢组织中HE4的表达情况,结果显示HE4在卵巢恶性肿瘤组织中高表达而在正常卵巢组织和癌旁组织中不表达。Hellstrom等于2003年首先报道其可作为卵巢癌血清肿瘤标志物。Drapkin等研究结果表明卵巢恶性肿瘤分泌的HE4是N-糖基化的分泌型蛋白,其相对分子质量小于CA125,故HE4比CA125在卵巢恶性肿瘤早期更易分泌入血,Drapkin用免疫组织化学方法描述了HE4在不同组织类型卵巢恶性肿瘤的表达,发现HE4在50%卵巢透明细胞癌、93%的卵巢浆液性癌及100%卵巢子宫内膜样癌表达,而在卵巢黏液性癌及正常卵巢组织中不表达。尽管没有组织特异性,大量的芯片研究证实,HE4是卵巢癌最有效标志物之一。因此国外许多国家已将HE4作为卵巢癌早期筛查的最佳指标。HE4mRNA在卵巢恶性肿瘤组织中高表达,而在良性卵巢疾病组织中不表达,对于鉴别卵巢良性肿瘤和卵巢恶性肿瘤患者,HE4为最佳单用标志物。多项研究表明HE4在鉴别女性盆腔包块良恶性优于CA125。
近年来,妇科肿瘤的发病率有上升的趋势,严重危害到女性的身心健康。常见的妇科恶性肿瘤主要包括宫颈癌、子宫内膜癌、卵巢癌等,根据细胞来源妇科恶性肿瘤分为鳞状细胞癌(鳞癌)和腺癌。临床上由于缺乏有效的筛选方法,70%的患者就诊时已属晚期,妇科恶性肿瘤行脏器切除术后的5年生存率约为30%,疗效不显著。因此提高检出率对妇科恶性肿瘤治疗意义重大。卵巢癌特异性肿瘤标志物HE4应用于卵巢癌和子宫内膜癌的诊断及肿瘤复发评估。
上皮性卵巢癌(Epithelial ovarian cancer,EOC)是发生于卵巢组织的恶性肿瘤,病死率高居女性生殖系统肿瘤首位,其恶性程度最高,极易早期发生盆腔和腹腔的广泛转移。卵巢癌早期症状无异常,大多数患者发现时已是晚期,提高卵巢癌早期诊断及为重要。糖类抗原125(Carbohydrate antigen 125,CA125)是FDA批准的第一个卵巢上皮性癌生物标记物,CA125在80%的晚期卵巢癌患者中升高(>35U/mL),但在早期患者不足50%升高,其诊断的敏感性较高,但特异性较差。HE4作为新的卵巢癌肿瘤标志物,在识别卵巢癌的早期阶段具有很高的灵敏度和特异度,在卵巢癌早期筛选上有很大潜力。Montagnana等研究发现HE4的释放要比CA125早,HE4水平在早期卵巢恶性肿瘤中已有明显增高,HE4在早期卵巢恶性肿瘤中诊断的敏感度远高于CA125(82.7%/45.9%)。
有研究显示在确诊卵巢癌前1年,即可检测出HE4血清水平的变化,Kalapotharakos等报道术前血清HE4高水平是卵巢癌预后不良的独立标志物,其总生存较短(P=0.003),同时还发现术前HE4水平在高级别浆液腺癌中较高,并且HE4水平高的浆液性腺癌的预后最差。作为预后判断的指标,联合检测CA125及HE4优于单独检测CA125或HE4,并能优化术后肿瘤残余高风险分组。采用400U/mL及75pmol/L作为CA125及HE4的参考值,当患者两种标志物均为阴性时,达到了100%的阴性预测值,当患者有一项或两项同为阳性时,术后肿瘤残余风险为28.6%~35.3%。2010年美国食品与药品管理局(FDA)已批准HE4用于诊断及监测晚期卵巢上皮癌和复发的卵巢癌。2011年美国临床化学学会年度会议上提出,将人附睾蛋白4认定为敏感性最高且最有前途的卵巢癌标志物。
目前血清HE4在卵巢癌早期诊断、风险评估及随访监测中的价值已得到肯定,在子宫内膜癌(Endometrial carcinoma,EC)中正得到广泛研究。EC组织中90%HE 4表达都是强阳性的,并且与组织病理类型无关,这一发现提示HE4可能是子宫内膜癌的标记物。近来研究表明HE4在EC患者血清及癌组织中呈高表达,对EC早期诊断、预后评估价值优于CA125。另外,HE4在肺癌中也表现出了较高的特异性,对于肺癌(特别是男性肺癌患者)是一种具有一定诊断价值的新型肿瘤标志物。
总之,HE4是近年来研究较热门的一种新型肿瘤血清学的强有力的标志物,检测HE4是鉴别卵巢良、恶性肿瘤的一种更有效的指标,并且其在早期卵巢癌的诊断中敏感度明显高于CA125,HE4在卵巢癌组织中存在过表达现象,目前主要作为诊断卵巢癌的血清学肿瘤标志物。检测体内HE4对卵巢癌的鉴别、早期诊断、治疗、预后及监测复发等方面具有重要意义。
人附睾蛋白4的检测需要相应的抗体,而高质量、稳定的人附睾蛋白4是制备人附睾蛋4单克隆抗体必不可少的原料。现有技术为了获得人附睾蛋白4蛋白,采用的方法是:根据GenBank中HE4基因的序列,设计合成引物,应用PCR扩增HE4基因后,构建包含扩增后的HE4基因的表达载体,并表达获得HE4蛋白。但是,采用PCR扩增所获得的HE4基因片段存在突变的因素,获得的HE4蛋白并不稳定,且表达量少、溶解性低、不容易纯化。
本发明提供一种人工合成的HE4基因序列、HE4蛋白及制备方法,采用经过专门设计的、采用人工方式合成HE4基因序列,稳定性好;该基因序列删除原始序列上的跨膜区序列,使得HE4蛋白分泌到细胞溶液中,提高了溶解性;该基因序列设计有Kozak序列,能够促进表达,使得蛋白产量提高;该基因序列设计有纯化标签,有利于表达的HE4蛋白的纯化。
下面结合附图和实施方式对本发明进行详细说明。
本发明提供一种人工合成的HE4基因序列,该HE4基因序列包括SEQ ID NO:1。
Genbank中定义的编码人HE4的序列之一SEQ ID NO:2为:
(版本VERSION:AY212888.1,Genbank ID号GI:28894242,全长486bp)
tgagagaaag cggccgcacc ccgcccggca tagcaccatg cctgcttgtc gcctaggccc 60
gctagccgcc gccctcctcc tcagcctgct gctgttcggc ttcaccctag tctcaggcac 120
aggagcagag aagactggcg tgtgccccga gctccaggct gaccagaact gcacgcaaga 180
gtgcgtctcg gacagcgaat gcgccgacaa cctcaagtgc tgcagcgcgg gctgtgccac 240
cttctgctct ctgcccaatg ataaggaggg ttcctgcccc caggtgaaca ttaactttcc 300
ccagctcggc ctctgtcggg accagtgcca ggtggacagc cagtgtcctg gccagatgaa 360
atgctgccgc aatggctgtg ggaaggtgtc ctgtgtcact cccaatttct gagctccggc 420
caccaccagg ctgagcagtg aagatagaaa gtttctgcct ggccctgcag cgtgttacag 480
cccacc 486
本发明实施方式中,SEQ ID NO:1的序列如下:
cccaagctta gatctgccac catgcctgct tgtcgcctag gcccgctagc cgccgccctc 60
ctcctcagcc tgctgctgtt cggcttcacc ctagtctcag gcacaggagc agagaagact 120
ggcgtgtgcc ccgagctcca ggctgaccag aactgcacgc aagagtgcgt ctcggacagc180
gaatgcgccg acaacctcaa gtgctgcagc gcgggctgtg ccaccttctg ctctctgccc 240
aatgataagg agggttcctg cccccaggtg aacattaact ttccccagct cggcctctgt 300
cgggaccagt gccaggtgga cagccagtgt cctggccaga tgaaatgctg ccgcaatggc 360
tgtgggaagg tgtcctgtgt cactcccaat ttccaccacc accaccacca ctaaggatcc 420
gcg 423
SEQ ID NO:1的氨基酸序列:
MPACRLGPLAAALLLSLLLFGFTLVSGTGAEKTGVCPELQADQNCTQECVSDSECADNLKCCSAGCATFCSLPNDKEGSCPQVNINFPQLGLCRDQCQVDSQCPGQMKCCRNGCGKVSCVTPNFHHHHHH*
比较上述的SEQ ID NO:1与SEQ ID NO:2,可以发现:相较于Genbank中定义的编码人HE4的序列SEQ ID NO:2,在本发明的SEQ ID NO:1的序列中:
第一、SEQ ID NO:1人工合成而来,不是采用引物进行PCR反应而来,这样能够避免基因突变的问题,有助于编码蛋白HE4蛋白的稳定性。
第二、将SEQ ID NO:2中后面C端的编码跨膜区(SEQ ID NO:2序列中划线部分的序列)的序列删除了。删除之后,SEQ ID NO:1编码的蛋白HE4蛋白可以直接分泌到细胞外的溶液中,这样可以提高编码蛋白HE4蛋白的溶解性;
第三、在C端的末端连接了用于纯化编码蛋白的6个组氨酸His标签:caccaccaccaccac,这样可以通过亲和层析柱纯化编码蛋白HE4蛋白;
第四、在N端连接了Kozak序列:gccaccatg,能够提高转录和翻译的效率,提高编码蛋白HE4蛋白的表达量。
第五、在N端设计了两个酶切位点,分别是Hand III(aagctt)和Bgl II(agatct),在C端设计了一个酶切位点Bam H I(ggatcc),这样方便在表达的时候,能够根据不同的需要,根据表达载体上的酶切位点,从而选择不同的表达载体。
第六、在N端具有引导表达的氨基酸信号肽的基因序列,氨基酸信号肽能够引导HE4蛋白分泌到细胞膜外,方便收集表达后的HE4蛋白。
本发明还提供一种HE4蛋白,该HE4蛋白是通过上述的HE4基因序列表达而获得的。
在实际应用中,人工合成上述的HE4基因序列后,可以通过现有的技术构建包含目的基因的表达载体,然后表达获得HE4蛋白。
其中,在一实施方式中,HE4蛋白是采用CHO细胞、对包含HE4基因序列的表达载体进行表达而获得的。
中国仓鼠卵巢细胞(Chinese Hamster Ovary,CHO),1957年美国科罗拉多大学Dr.Theodore T.Puck从一成年雌性仓鼠卵巢分离获得,为上皮贴壁型细胞,是生物工程上广泛使用的细胞系。该细胞具有不死性,可以传代百代以上。另外CHO细胞在基因工程使用中还有一个优点,该细胞属于成纤维细胞(Fibroblast),是一种非分泌型细胞,它本身很少分泌CHO内源蛋白,因此对目标蛋白分离纯化工作十分有利。可形成有活性的二聚体,具有糖基化的功能,CHO为表达复杂生物大分子的理想宿主。用CHO细胞表达重组的HE4基因序列,获得的HE4蛋白具有与人自然产生的蛋白完全相似的生物学特性。
参见图1,图1是合成基因的酶切鉴定图谱,其中,从左往右,第1道为连接上合成基因后的质粒未经过酶切的电泳图谱,第2道为连接上合成基因后的质粒经过酶切后的酶切电泳图谱,第3道为DNA标准品DNA ladder,从上往下代表的DNA分子量大小分别是:5000bp、3000bp、2000bp、1000bp、750bp、500bp、250bp、100bp。酶切结果显示,第二道的小基因片段大小为0.4kb左右(第二道从上往下箭头对应条带的位置),与目的基因大小相符。
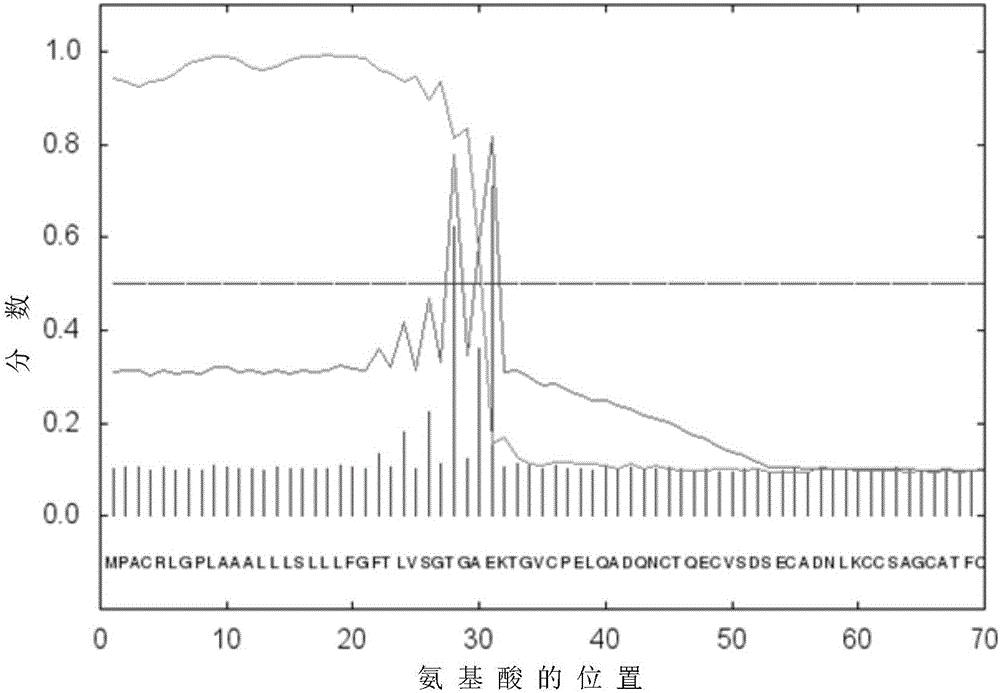
参见图2,图2是推导HE4蛋白氨基酸信号肽的分析示意图,应用SignalP 4.1Server信号肽分析软件,将HE4基因序列推导出来的氨基酸序列的N端100个氨基酸输入序列框内,提交分析结果呈现,结果如图2所示,横坐标代表氨基酸的位置,纵坐标代表计算出来的分数,其中,分数大于0.5才可以被切割,分数越高切割就越好。从图2可知,HE4分子在第28-31之间被切割开。
参见图3,图3是通过上述合成的HE4基因序列表达而获得的HE4蛋白的SDS电泳图谱示意图(原始图片为彩色图片)。其中,第1道为蛋白质分子量标准品Marker的SDS电泳图谱,从上往下代表的蛋白分子量大小分别是:150kD、100kD、80kD、46kD、30kD、23kD、17kD、7kD,第二道是纯化后的HE4蛋白的SDS电泳图谱。SDS电泳图谱结果显示,纯化后只有一条带,大小约为13kD,与目的蛋白大小相同。
本发明还提供一种HE4蛋白的制备方法,该方法包括:
步骤一、人工合成HE4基因序列,其中,HE4基因序列包括SEQ ID NO:1;
步骤二、构建包含HE4基因序列的表达载体;
步骤三、表达包含HE4基因序列的表达载体,获得HE4蛋白。
本发明实施方式采用经过专门设计的、采用人工方式合成HE4基因序列,稳定性好;该基因序列删除原始序列上的跨膜区序列,使得HE4蛋白分泌到细胞溶液中,提高了溶解性;该基因序列设计有Kozak序列,能够促进表达,使得蛋白产量提高;该基因序列设计有纯化标签,有利于表达的HE4蛋白的纯化。
其中,步骤三具体可以是:采用CHO细胞表达包含HE4基因序列的表达载体,获得HE4蛋白。
用CHO细胞表达重组的HE4基因序列,获得的HE4蛋白具有与人自然产生的蛋白完全相似的生物学特性。
其中,表达载体为pCMV-EGFP质粒。
该表达载体包含增强绿色荧光蛋白(Enhanced Green Fluorescent Protein,EGFP)标签的融合蛋白。该质粒含有CMV启动子,可以高效启动目的基因在细胞中的表达。在多克隆位点的后面有一个EGFP的完整编码序列,因此在多克隆位点根据阅读框插入目的基因就可以表达含有EGFP标签的融合蛋白。利用EGFP的荧光特性可以比较容易地观察融合蛋白的表达水平和细胞内定位,也可以利用EGFP抗体来检测或免疫沉淀融合蛋白。该质粒为卡那霉素抗性。
在本发明实施方式中,将人工合成的HE4基因序列置于哺乳动物细胞表达的启动子下游,在转录起始点处添加用来增强真核基因的翻译效率的Kozak序列、HE4序列、纯化标签和终止密码,以Bgl II和BamH I为酶切位点,克隆至哺乳动物细胞表达载体pCMV-EGFP的多克隆位点(Multiple cloning site,MCS)内,后面连接了内部核糖体进入位点(internal ribosome entry site,IRES)和EGFP序列及SV40 polyA,通过双酶切鉴定和测序鉴定证明pCMV-HE4-EGFP表达载体构建完全正确。
其中,步骤三之后,还可以包括:采用镍琼脂糖凝胶Ni Sepharose亲和层析柱纯化HE4蛋白。
下面通过具体的实验步骤来说明上述方法,需要说明的是,下述的步骤仅仅只是一个具体的实验步骤,并不用来限定本发明的方法,例如:表达载体、表达的宿主细胞、具体的实验条件等均可以采用现有技术中的其他表达载体、其他表达的宿主细胞、其他具体的实验条件等。
总体来说,本发明的方法具体包括如下步骤:
(1)HE4基因的克隆和序列分析
本发明应用的基因是根据Genbank中人源HE4分子序列分析比较后,对HE4信号肽序列、跨膜区序列、影响体内可溶性的膜内区、酶切位点、G+C含量和纯化标签等大量序列信息进行序列优化设计后,由南京金斯瑞公司直接合成HE4(质粒为C6615BH190-2)。
Genbank中可溶性人源HE4序列为SEQ ID NO:2,优化设计后的HE4序列为SEQ ID NO:1。
(2)哺乳动物细胞表达载体的构建和鉴定
用无菌接种环直接从本实验室冻存的DH5α感受态细胞(Solarbio,C1100)在培养基表面划线,于37℃倒置培养16~20小时(h),挑取一个单菌落扩展培养制备实验所需的感受态细胞,将合成的含有目的基因的pUC57-HE4及pCMV-EGFP质粒,转化DH5α感受态细胞,从琼脂平板上挑取转化pUC57-HE4的一个单菌落,接种到含有氨苄青霉素的液体培养基中生长。同时挑取pCMV-EGFP的一个单菌落,接种到含有氨苄卡那霉素的液体培养基中生长,于37℃转速为180转每分钟(rpm)振荡培养扩增至一定密度,使用AxyPrep质粒DNA小量试剂盒(AP-MN-P-50)提取质粒,用Bgl II和BamH I同时双酶切,使用AxyPrepDNA凝胶回收试剂盒(AP-GX-50),回收目的基因HE4基因和目的质粒pCMV-EGFP,使用T4噬菌体DNA连接酶于16℃温育12~16h,进行连接,将目的基因克隆到pCMV-EGFP多克隆位点Bgl II和BamH I之间。将连接产物全部转化大肠杆菌感受态细胞,涂布含有卡那霉素的平板,于37℃过夜后,挑取5个菌落,置于5毫升(mL)含卡那霉素的LB培养基中培养16h,提取质粒。将质粒纯化后用Bgl II和BamH I双酶切,能够切得423bp片段的克隆(如图1所示),进行序列测定,再次进行目的基因的确定。将测定的序列用DNAMANV6进行序列分析。
将构建的载体进行序列测定,结果显示与设计的完全相符,应用DNAMAN6分析软件,与Genbank中登录的HE4基因序列进行了序列比对,结果显示完全相同。
(3)CHO细胞的转染
将(2)中构建的pCMV-HE4-EGFP,经过转化、细菌增殖和质粒的提取、核酸测定仪(Nanodrop One)测定浓度及纯度后,用TurboFect Transfection Reagent(Thermo)直接转染生长状态良好的用无血清培养基培养的CHO细胞中,置于37℃,5%CO2培养箱中培养6~8h后,将转染孔换成含有5%胎牛血清(Fetal Bovine Serum,FBS)的DMEM/F12(Dulbecco's Modified Eagle Media:Nutrient Mixture F-12)细胞生长液,继续培养观察荧光信号。转染36h后原培养基弃去,加CHO细胞无血清无蛋白化学培养基,继续观察荧光状况(参见图4,原始图片为彩色图片)。将需扩大培养或传代的转染细胞原孔中的培养基吸出,加入胰酶清洗一遍后再加入胰酶消化30秒(s),将胰酶吸弃,加入培养基吹散细胞,将细胞转入至T-75的培养瓶中,添适量CHO细胞无血清无蛋白化学培养基,置37℃,在5%CO2培养箱中培养扩增。
将构建的pCMV-HE4-EGFP载体转染CHO细胞后,48h后显微镜观察即可见荧光蛋白的表达,转染72h后显示50%以上的细胞有较强的绿色荧光,见图4所示。因为荧光蛋白基因和目的基因HE4在同一个开放阅读框(Open Reading Frame,ORF),只是用IRES将两者隔开,理论上位于GFP上游的HE4基因应该表达。
(4)重组HE4的纯化检验
由(3)转染的细胞转染后24h、48h、72h观察细胞生长状态和荧光蛋白表达强度,在转染后72h收集细胞上清,在转速为5000rpm,4于℃下离心15分钟(min)以上,弃掉细胞碎片后,上清液直接用Ni Sepharose亲和层析柱纯化表达的HE4蛋白,流速控制在15毫升每小时(mL/h)左右,收集纯化后的HE4蛋白进行SDS-PAGE电泳鉴定(如图3所示)。
在一实施方式中,具体的实验步骤和实验过程如下:
(一)HE4基因真核表达载体的构建
1.1 DH5α感受态细胞的制备
用无菌接种环直接从冻存的DH5α感受态细胞在培养基表面划线,于37℃倒置培养16~20h,挑取一个单菌落于1mL LB(无抗生素)培养基中,制作2~3管,于37℃,转速为180rpm振荡使其分散,然后加入到30~100mL LB(无抗生素)培养基中稀释培养,于37℃,转速为200rpm下,培养大约2.5~3h,检测培养物的生长情况。取培养物置于40mL的灭菌的一次性的冰预冷的离心管中,冰浴10min,使培养物冷却至0℃,在转速4000rpm下,于4℃离心10min,弃上清。每50mL初始培养液重悬于30mL预冷的0.1mol/L CaCl2-MgCl2溶液(80mmol/L MgCl2,20mmol/L CaCl2)中,轻吹,冰浴10min,在转速4000rpm下,于4℃离心10min,弃上清。每50mL初始培养液重悬于2mL预冷的0.1mol/LCaCl2溶液,轻吹,每2mL重悬细胞液加70微升(μL)二甲基亚砜(Dimethyl Sulphoxide,DMSO),轻轻旋转混匀,将悬液置于冰上15min。每份悬液再加70μL DMSO,轻轻旋转混匀,将悬液置于冰上15min。迅速将悬液分装到预冷的无菌微量离心管中,封口,投入液氮中快速冰冻感受态细胞,于-70℃下保存,需要时从-70℃中取出。
1.2 pCMV-HE4-EGFP载体的构建
将合成的含有目的基因的pUC57-HE4,转化DH5α感受态细胞,提取质粒,用Bgl II和BamH I双酶切,回收目的基因,克隆到pCMV-EGFP多克隆位点Bgl II和BamH I之间。
1.2.1 pUC57-HE4转化DH5α感受态细胞
将感受态细胞(100μL)置于冰上融化。向感受态细胞悬液中加入需转化的pUC57-HE4,加入体积≤1μL。轻轻旋转离心管以混匀内容物,冰浴放置30min。将离心管置于42℃水浴中热冲击60~90s,不要摇动管,然后快速转移到冰浴中冷却2~3min,注意不要摇动离心管。向离心管中加入500μL无菌无抗生素的LB培养基,于37℃下,转速为180rpm振荡培养1h,取适量已转化的感受态细胞涂布含相应抗生素的LB平板,于37℃倒置培养12~16h。涂布剩余的菌液可4℃保存,如果次日的转化菌落数过少,可以将剩下的菌液再涂布新的平板。
1.2.2 pUC57-HE4质粒的提取
从琼脂平板上挑取转化的pUC57-HE4的一个单菌落,接种到含有氨苄青霉素的液体培养基中,生长到对数晚期,就可以大量提纯质粒。使用AxyPrep质粒DNA小量试剂盒(AP-MN-P-50,包含Buffer S1、S2、S3、W1、W2)。取30mL在LB培养基中培养过夜的菌液(若使用丰富培养基,菌液体积应减半或更少),在离心力为12,000g下,离心1min,弃尽上清;加250μL Buffer S1悬浮细菌沉淀,悬浮需均匀,不应留有小的菌块;加250μL Buffer S2,温和并充分地上下翻转4~6次混合均匀使菌体充分裂解,直至形成透亮的溶液;加350μL Buffer S3,温和并充分地上下翻转混合6~8次,在离心力12,000g下,离心10min;吸取离心后的上清液并转移到制备管,在离心力12000g下,离心1min。加500μL Buffer W1,在离心力12000g下,离心1min,加700μL Buffer W2,在离心力12000g下,离心1min,以同样的方法再用700μL Buffer W2洗涤一次,弃滤液;在离心力12000g下,离心1min,将制备管移入新的1.5mL离心管中,加Eluent或去离子水60μL,室温静置1min,在离心力12000g下,离心1min收集,可得到极高纯度的质粒。
1.2.3 载体酶切、片段回收
将提取的含有目的基因的质粒pUC57-HE4和表达质粒pCMV-EGFP按照下列体系分别酶切:
37℃酶切2h后电泳,在紫外灯下切下含有目的DNA的琼脂糖凝胶,分别回收pUC57-HE4中423bp和pCMV-EGFP的5320bp的片段。使用AxyPrepDNA凝胶回收试剂盒(AP-GX-50,包含Buffer DE-A、DE-B、W1、W2),用纸巾吸尽凝胶表面液体并切碎。计算凝胶重量(提前记录1.5mL离心管重量),该重量为一个凝胶体积(如100mg=100μL体积)。加入3个凝胶体积的Buffer DE-A,混合均匀后于75℃加热,间断混合,直至凝胶块完全熔化(约6~8min)。加0.5个Buffer DE-A体积的Buffer DE-B,混合均匀。转DNA制备管,在离心力12000g下,离心1min。加500μL Buffer W1,在离心力12000g下,离心30s,加700μL Buffer W2,在离心力12000g下,离心30s,以同样的方法再用700μL Buffer W2洗涤一次,弃滤液;在离心力12000g下,离心1min,将制备管移入新的1.5mL离心管中,加Eluent或去离子水15μL,室温静置1min,12000g,离心1min收集。
1.2.4 片段的连接、转化和鉴定
将2μL回收酶切的pCMV-EGFP载体DNA片段及回收的HE4基因片段转移到无菌微量离心管中。加水5μL,于45℃加温5min以使粘端解链,将混合物冷却到0℃。加入10xT4噬菌体DNA连接酶缓冲液2μL、1μL T4噬菌体DNA连接酶0.1Weiss单位、5mmol/L ATP 1μL,然后于16℃温育1~4h。将连接产物全部转化大肠杆菌感受态细胞,涂布含有卡那霉素的平板,37℃过夜后,挑取5个菌落于5mL含卡那霉素的LB培养基中培养16h,提取质粒。将质粒纯化后用Bgl II和BamH I双酶切,能够切除423bp片段的克隆,进行序列测定。
(二)细胞转染
2.1 配制转染试剂
每孔加入100μL DMEM/F12、2微克(μg)pCMV-HE4-EGFP质粒及4μL转染试剂,缓慢吸打混匀,室温静置20min。
2.2 处理细胞板
用24孔CHO细胞板长满70~80%时进行转染,pCMV-HE4-EGFP质粒转2孔,先用500μL无血清DMEM洗2个细胞孔,每孔洗两次,为待转染孔,每个待转染孔加入300μL无血清DMEM备用。
2.3 CHO细胞的转染
将静置好的转染复合物缓慢吸打1~2次后取100μL/孔均匀滴加至待转染孔中,将24孔板置于37℃,5%CO2培养箱中培养6~8h后将转染孔换细胞生长液DMEM/F12含5%FBS,继续培养观察荧光信号。转染36h后原培养基弃去,加CHO细胞无血清无蛋白化学培养基,继续观察荧光状况。
2.4 转染细胞传代、换液:
将需扩大培养或传代的转染细胞原孔中的培养基吸出,加入胰酶清洗一遍后再加入胰酶消化30s,将胰酶吸弃,加入培养基吹散细胞,将细胞转入至T-75的培养瓶中,添适量CHO细胞无血清无蛋白化学培养基,置37℃,5%CO2培养箱中培养。
(三)重组HE4的纯化
3.1 细胞上清的收集和保存
将转染pCMV-HE4-EGFP的CHO细胞用无血清无蛋白化学培养基的培养72h,收集细胞上清,5000rpm/min,4℃离心15min以上。取上清,置于冰上备用或-20℃保存。
3.2 层析
将NTA树脂装入合适的层析柱,层析用10倍NTA体积的NTA-0Buffer洗。将样品加到NTA层析柱中,流速控制在15mL/h左右,收集穿透部分,用于SDS-PAGE分析蛋白质的结合情况。层析用5倍NTA体积的NTA-0Buffer洗,流速控制在30mL/h左右。分别用5倍NTA体积的NTA-20,NTA-40,NTA-60,NTA-80,NTA-100,NTA-200,NTA-1000Buffer洗脱,流速控制在15mL/h左右,收集洗脱液,每管收集一个NTA体积。确定目标蛋白质在洗脱液中的分布情况,然后用SDS-PAGE分析蛋白质的分布。
其中,层析溶液配方如下:
NTA-0Buffer:20mM Tris-HCl,pH为7.9,0.5M NaCl,10%Glycerol;
NTA-20Buffer:20mM Tris-HCl,pH为7.9,0.5M NaCl,10%Glycerol,20mM咪唑(Imidazole);
NTA-40Buffer:20mM Tris-HCl,pH为7.9,0.5M NaCl,10%Glycerol,40mM Imidazole;
NTA-60Buffer:20mM Tris-HCl,pH为7.9,0.5M NaCl,10%Glycerol,60mM Imidazole;
NTA-80Buffer:20mM Tris-HCl,pH为7.9,0.5M NaCl,10%Glycerol,80mM Imidazole;
NTA-100Buffer:20mM Tris-HCl,pH为7.9,0.5M NaCl,10%Glycerol,100mM Imidazole;
NTA-200Buffer:20mM Tris-HCl,pH为7.9,0.5M NaCl,10%Glycerol,200mM Imidazole;
NTA-1000Buffer:20mM Tris-HCl,pH为7.9,0.5M NaCl,10%Glycerol,1000mM Imidazole。
以上所述仅为本发明的实施方式,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
SEQUENCE LISTING
<110> 奥普金生物科技(深圳)有限公司
<120> 人附睾蛋白4基因序列、HE4蛋白及制备方法
<160> 3
<210> 1
<211> 423
<212> DNA
<213> 人工序列
<220>
<221> misc_difference
<222> (1)…(423)
<400> 1
cccaagctta gatctgccac catgcctgct tgtcgcctag gcccgctagc cgccgccctc 60
ctcctcagcc tgctgctgtt cggcttcacc ctagtctcag gcacaggagc agagaagact 120
ggcgtgtgcc ccgagctcca ggctgaccag aactgcacgc aagagtgcgt ctcggacagc 180
gaatgcgccg acaacctcaa gtgctgcagc gcgggctgtg ccaccttctg ctctctgccc 240
aatgataagg agggttcctg cccccaggtg aacattaact ttccccagct cggcctctgt 300
cgggaccagt gccaggtgga cagccagtgt cctggccaga tgaaatgctg ccgcaatggc 360
tgtgggaagg tgtcctgtgt cactcccaat ttccaccacc accaccacca ctaaggatcc 420
gcg 423
<210> 2
<211> 486
<212> DNA
<213> human
<220>
<221> gene
<222> (1)…(486)
<400> 2
tgagagaaag cggccgcacc ccgcccggca tagcaccatg cctgcttgtc gcctaggccc 60
gctagccgcc gccctcctcc tcagcctgct gctgttcggc ttcaccctag tctcaggcac 120
aggagcagag aagactggcg tgtgccccga gctccaggct gaccagaact gcacgcaaga 180
gtgcgtctcg gacagcgaat gcgccgacaa cctcaagtgc tgcagcgcgg gctgtgccac 240
cttctgctct ctgcccaatg ataaggaggg ttcctgcccc caggtgaaca ttaactttcc 300
ccagctcggc ctctgtcggg accagtgcca ggtggacagc cagtgtcctg gccagatgaa 360
atgctgccgc aatggctgtg ggaaggtgtc ctgtgtcact cccaatttct gagctccggc 420
caccaccagg ctgagcagtg aagatagaaa gtttctgcct ggccctgcag cgtgttacag 480
cccacc 486
<210> 3
<211> 130
<212> PRT
<213> 未知
<220>
<221> VARIANT
<222> (1)…(130)
<400> 3
Met Pro Ala Cys Arg Leu Gly Pro Leu Ala Ala Ala Leu Leu Leu
1 5 10 15
Ser Leu Leu Leu Phe Gly Phe Thr Leu Val Ser Gly Thr Gly Ala
20 25 30
Glu Lys Thr Gly Val Cys Pro Glu Leu Gln Ala Asp Gln Asn Cys
35 40 45
Thr Gln Glu Cys Val Ser Asp Ser Glu Cys Ala Asp Asn Leu Lys
50 55 60
Cys Cys Ser Ala Gly Cys Ala Thr Phe Cys Ser Leu Pro Asn Asp
65 70 75
Lys Glu Gly Ser Cys Pro Gln Val Asn Ile Asn Phe Pro Gln Leu
80 85 90
Gly Leu Cys Arg Asp Gln Cys Gln Val Asp Ser Gln Cys Pro Gly
95 100 105
Gln Met Lys Cys Cys Arg Asn Gly Cys Gly Lys Val Ser Cys Val
110 115 120
Thr Pro Asn Phe His His His His His His
125 130
- 还没有人留言评论。精彩留言会获得点赞!
- 人s100蛋白(s-100)定量测定试剂盒及其检测方法
- 人附睾蛋白4检测试剂盒的制作方法
- 人类附睾表达精子结合蛋白hel-215及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-178及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-172及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-122及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-214及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-207及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-18及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-38及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-172及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-122及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-214及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-207及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-18及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-38及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-43及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-9及其编码基因与应用的制作方法
- 一种针对人Tudor-SN蛋白T73位点的应激磷酸化抗体制备方法
- 一种针对人Tudor-SN蛋白T103位点的应激磷酸化抗体制备方法
- 人类附睾表达精子结合蛋白hel-207及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-18及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-38及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-43及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-9及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-192及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-78及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-65及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-59及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-190及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-18及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-38及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-43及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-9及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-192及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-78及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-65及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-59及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-190及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-169及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-172及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-122及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-214及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-207及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-18及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-38及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-43及其编码基因与应用的制作方法
- 人类附睾表达精子结合蛋白hel-9及其编码基因与应用的制作方法
- 一种针对人Tudor-SN蛋白T73位点的应激磷酸化抗体制备方法
- 一种针对人Tudor-SN蛋白T103位点的应激磷酸化抗体制备方法