一种基于类弹性蛋白标签制备重组N‑端脑钠肽前体的方法与流程
本发明属于生物技术领域,涉及一种利用类弹性蛋白标签通过非色谱方法制备重组N-端脑钠肽前体的方法。
背景技术:
B-型脑钠肽(B-type natriuretic peptide,BNP)首先由日本学者在1988年从猪脑分离出来因而得名,后来研究发现其主要是由心肌细胞合成分泌。人类BNP基因编码134个氨基酸残基组成的pro-BNP前体,脱去26个氨基酸组成的信号肽后形成末端脑钠肽(pro-BNP),再由蛋白水解酶裂解成为含有76个氨基酸无活性的N-端脑钠肽前体(NT-proBNP)及含有32个氨基酸具有生理活性的BNP。心肌受到牵拉时pro-BNP被释放,并进一步分解为NT-proBNP和BNP。目前,NT-proBNP被广泛地应用于心血管疾病的诊断治疗及预后应用中。NT-proBNP作为检测抗原标准品的来源包括化学合成、大肠杆菌重组、真核细胞重组和心衰患者血浆分离等。由于其它几种来源成本较高,或者稳定性较差,目前主要来源为大肠杆菌重组获得。大肠杆菌一直是基因工程中发展最完善、应用最广泛的表达系统,它的优点有产量高,生产成本低,周期短,安全性好,可以高效表达不同外源基因产物等。然而利用大肠杆菌表达系统生产的NT-proBNP需要细胞裂解、亲和层析等分离纯化步骤,导致耗时大、成本高。
类弹性蛋白(elastin-like polypeptide,ELP)是一种独特的重组蛋白分离纯化标签,主要结构由五肽重复序列单元(VPGXG)n串联组成,其中客座残基X可以是除脯氨酸以外的任一氨基酸,n代表ELP链中五肽重复次数。ELP具有温度诱导的可逆相变性质,当溶液温度低于相变温度(inverse temperature transition,Tt)时,ELP以单体形式溶于水溶液中;若温度高于Tt,ELP呈聚集态并从水溶液中析出;但当温度恢复到Tt以下时,ELP又会重新溶解,并且溶液温度只改变2-3℃即可发生两相之间的转变。ELP与目的蛋白融合后,赋予重组蛋白类似的可逆相变性质,多次可逆相变循环(inverse transition cycling,ITC)之后,就可以从蛋白混合液中选择性地分离出ELP融合蛋白。
目前使用的ELISA检测试剂盒都需要特定的抗原作为标准品,其中的蛋白质类抗原占有很大的比例。如何低成本、高效生产蛋白质类抗原蛋白,是该类产品的一个技术关键。
技术实现要素:
本发明目的是利用ELP可逆相变性质,提供一种基于类弹性蛋白标签制备重组N-端脑钠肽前体的方法,降低生产成本,实现简单、快速和大规模分离制备重组N-端脑钠肽前体。
本发明的技术方案为:将N-端脑钠肽前体(NT-proBNP)基因克隆到pET28a(+)/ELP[I]40原核表达载体上,利用大肠杆菌表达系统高效表达具有和脑钠肽前体的抗原活性相当的融合蛋白。具体步骤如下:
1.构建NT-proBNP融合表达载体pET28a(+)/ELP[I]40/NT-proBNP:
基于人源BNP基因序列(EMBL登入号码AB037521.1),设计优化合成N-端脑钠肽前体(NT-proBNP)基因,其核苷酸序列为Seq ID.NO.1,其长度为228个核苷酸;
基于类弹性蛋白标签的制备重组N-端脑钠肽前体方法,包括以下步骤:
(1)在N-端脑钠肽前体(NT-proBNP)基因两端引入酶切位点EcoRⅠ/XhoⅠ;
(2)将N-端脑钠肽前体(NT-proBNP)基因克隆到pET28a(+)/ELP[I]40原核表达载体上,构建成融合表达载体pET28a(+)/ELP[I]40-NT-proBNP。
所述的融合表达载体pET28a(+)/ELP[I]40-NT-proBNP的核苷酸序列为Seq ID.NO.2,其长度为6217个核苷酸。
2.利用大肠杆菌表达重组蛋白:
将构建的融合表达载体转化到大肠杆菌工程菌株,筛选得到阳性克隆,将鉴定过的阳性转化子进行自诱导表达,培养基中添加与表达载体所带抗性基因相应的抗生素,具体步骤为:
将构建好的表达载体pET28a(+)/ELP[I]40-NT-proBNP电击转化到大肠杆菌菌株,将鉴定过的转化子接种到10毫升含有硫酸卡那霉素(Kanamycin Sulfate,Kan)的LB培养基中,过夜培养;次日,以1:100接种到500毫升含有Kan的LB培养基的2升三角瓶中,200rpm、37℃振荡培养,直至OD600达到0.6;在25℃-30℃、200rpm条件下添加1毫摩尔的IPTG(Isopropylβ-D-1-Thiogalactopyranoside)进行诱导表达3-6小时,在此过程,在大肠杆菌胞内表达重组蛋白;其中,LB培养基的配方如下:胰蛋白胨(Tryptone)10g/L,酵母提取物(Yeastextract)5g/L,氯化钠(NaCl)10g/L;硫酸卡那霉素的浓度为50微克每毫升,即每毫升LB培养基中含有50微克硫酸卡那霉素。
3.收集菌体:
表达重组蛋白后,加入PBS重悬,置冰浴中超声破碎,超声破碎条件为:80W,破碎时间2s,破碎间隔3s,总时间25min,超声破碎后,离心去除不溶物质,将上清移入新管。上清中加入DNase(DNA酶),DNase在溶液中的最终浓度为50μg/mL,冰浴20min,离心力12000g离心15min,弃沉淀,将上清移入新管。利用ITC方法纯化重组蛋白,ITC纯化步骤为:
(1)向上清液中添加NaCl,浓度最终达到为2mol/L,37℃水浴、20分钟,离心力12000g离心15min,弃上清;
(2)加入20mL预冷的PBS重悬沉淀,冰浴20分钟,离心力10000g于4℃离心15分钟,弃沉淀,将上清移入新管,此即为一轮ITC循环。
所得上清继续进行ITC纯化,经过3轮ITC纯化重组蛋白,该蛋白即为ELP[I]40-NT-proBNP重组蛋白。
4、检测ELP[I]40/NT-proBNP重组蛋白的性质:
根据蛋白UV定量法测定ELP[I]40/NT-proBNP重组蛋白的浓度;
将重组蛋白ELP[I]40/NT-proBNP通过ELISA方法测定免疫血清的效价以及其在人血浆中免疫反应稳定性。
本发明的有益效果:本方法可以高效、快速、简单的制备具有与抗NT-proBNP抗体结合活性的融合蛋白,融合表达蛋白回收纯度可达到90%以上,为高效低成本制备具有NT-proBNP抗原性的标准品奠定基础。本发明不仅适用于N-端脑钠肽前体的制备,也适用于其它重组蛋白质的快速大量制备。因此,本发明在大规模制备NT-proBNP重组蛋白和其它重组多肽的生产中具有较高实用价值。
附图说明
图1是本发明的NT-proBNP基因结构图。
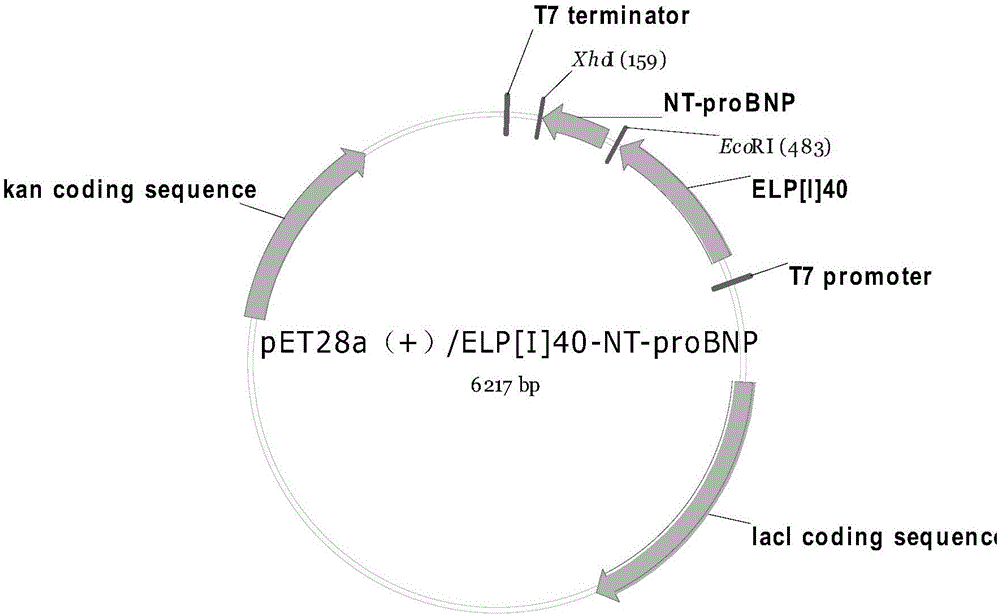
图2是本发明的融合表达载体pET28a(+)/ELP[I]40-NT-proBNP结构图谱。
图3是为经过3轮ITC纯化后的重组蛋白ELP[I]40-NT-proBNP的SDS-PAGE电泳图,其中:1、2、3分别表示实施例一、二、三分离纯化的NT-proBNP重组蛋白,M表示标准蛋白质。
图4为实施例一、二、三中的重组蛋白ELP[I]40-NT-proBNP的相变温度。
图5为ELISA法检测实施例一、二、三中所产出的重组蛋白ELP[I]40-NT-proBNP的免疫活性图。
图6为实施例一、二、三中所产出的重组蛋白ELP[I]40-NT-proBNP在人血浆中免疫反应稳定性示意图。
具体实施方式
下面结合附图及具体实施方式对本发明作进一步的说明,但并不影响本发明的保护范围。
实施例一
1.构建NT-proBNP融合表达载体pET28a(+)/ELP[I]40/NT-proBNP。基于人源BNP基因序列(EMBL登入号码AB037521.1)设计优化NT-proBNP基因,委托南京金斯瑞生物科技有限公司按照Seq ID.NO.1合成NT-proBNP基因,基因结构如图1所示。利用基因两端的EcoRⅠ和XhoⅠ酶切位点将NT-proBNP基因克隆到pET28a(+)/ELP[I]40载体上,形成NT-proBNP融合表达载体pET28a(+)/ELP[I]40/NT-proBNP,其核苷酸序列为Seq ID.NO.2,融合表达载体结构如图2所示。
2.将构建好的表达载体电击转化BL21(DE3)大肠杆菌菌株(购置于宝生物工程(大连)有限公司),将鉴定过的转化子接种到10毫升含有硫酸卡那霉素(Kan)50微克每毫升的LB培养基中,过夜培养。次日,以1:100接种到500毫升含有Kan50微克每毫升LB培养基的2升三角瓶中,200rpm、37℃振荡培养,直至OD600达到0.6。然后,在25℃、200rpm条件下添加1毫摩尔的IPTG进行诱导表达3小时,在此过程,在大肠杆菌胞内表达重组蛋白。LB培养基的配方如下:胰蛋白胨(Tryptone)10g/L,酵母提取物(Yeast extract)5g/L,氯化钠(NaCl)10g/L。
3.离心力为4000g离心6分钟收集菌体,加入25mL PBS重悬,置冰浴中超声破碎(条件为:功率80W,破碎时间2秒,破碎间隔3秒,总时间25分钟),离心力为10000g离心15分钟,弃沉淀,将上清移入新管。上清中加入DNase(DNA酶),其在溶液中的最终浓度为50μg/mL,冰浴20分钟,离心力12000g离心15分钟,弃沉淀,将上清移入新管。ITC纯化步骤:(1)向上清液中添加NaCl至终浓度为2mol/L,37℃水浴、20分钟,离心力12000g离心15min,弃上清;(2)加入20mL预冷的PBS重悬沉淀,冰浴20分钟,离心力10000g于4℃离心15分钟,弃沉淀,将上清移入新管。此即为一轮ITC循环。所得上清继续进行ITC纯化。经过3轮ITC纯化处理后,由SDS-PAGE电泳证明获得90%以上纯度的ELP[I]40/NT-proBNP重组蛋白,结果如图3所示。
4.根据蛋白UV定量法测定步骤3获得的ELP[I]40/NT-proBNP重组蛋白浓度,用PBS稀释成25μmol/L浓度,以1℃为梯度测定从16℃到40℃重组蛋白溶液在350nm处的吸光度值,当某个温度下OD350是最大吸光值一半时,该温度为相变温度Tt。通过上述方法确定NT-proBNP重组蛋白的相变温度为31℃,结果如图4所示。
5.将步骤3获得的重组蛋白ELP[I]40/NT-proBNP通过ELISA方法测定免疫血清的效价。ELP[I]40/NT-proBNP重组蛋白经逐级稀释后包被96孔酶标板,经过封闭液封闭后,加入HyTest公司生产的鼠源抗NT-proBNP13-20氨基酸残基的单克隆抗体13G12(1:2500稀释),用血清白蛋白作空白对照。二抗为辣根过氧化酶标记羊抗小鼠IgG抗体(1∶5000),底物为TMB,显色10分钟后用2M的硫酸终止,测定波长450nm处的OD值,结果如图5所示,重组蛋白ELP[I]40/NT-proBNP具有良好的与鼠源抗NT-proBNP13-20氨基酸残基的单克隆抗体13G12结合能力。
6.ELISA方法测定重组蛋白ELP[I]40/NT-proBNP在人血浆中免疫反应稳定性。方法同步骤5,将10pmol/ml ELP[I]40/NT-proBNP重组蛋白与人血浆共孵育0h、1h、3h、5h、24h、48h和72h,测定波长450nm处的OD值。结果如图6所示,0h至5h重组蛋白ELP[I]40/NT-proBNP在人血浆中免疫反应活性从100%下降到70%左右,从5h至72h免疫反应活性基本保持不变。
实施例二
1.构建NT-proBNP融合表达载体pET28a(+)/ELP[I]40/NT-proBNP。基于人源BNP基因序列(EMBL登入号码AB037521.1)设计优化NT-proBNP基因,委托南京金斯瑞生物科技有限公司按照Seq ID.NO.1合成NT-proBNP基因,基因结构如图1所示。利用基因两端的EcoRⅠ和XhoⅠ酶切位点将NT-proBNP基因克隆到pET28a(+)/ELP[I]40载体上,形成NT-proBNP融合表达载体pET28a(+)/ELP[I]40/NT-proBNP,其核苷酸序列为Seq ID.NO.2,融合表达载体结构如图2所示。
2.将构建好的表达载体电击转化BL21(DE3)大肠杆菌菌株(购置于宝生物工程(大连)有限公司),将鉴定过的转化子接种到10毫升含有硫酸卡那霉素(Kan)50微克每毫升的LB培养基中,过夜培养。次日,以1:100接种到500毫升含有Kan50微克每毫升LB培养基的2升三角瓶中,200rpm、37℃振荡培养,直至OD600达到0.6。然后,在30℃、200rpm条件下添加1毫摩尔的IPTG进行诱导表达3小时,在此过程,在大肠杆菌胞内表达重组蛋白。LB培养基的配方如下:胰蛋白胨(Tryptone)10g/L,酵母提取物(Yeast extract)5g/L,氯化钠(NaCl)10g/L。
3.离心力为4000g离心6分钟收集菌体,加入25mL PBS重悬,置冰浴中超声破碎(条件为:功率80W,破碎时间2秒,破碎间隔3秒,总时间25分钟),离心力为10000g离心15分钟,弃沉淀,将上清移入新管。上清中加入DNase(DNA酶),其在溶液中的最终浓度为50μg/mL,冰浴20分钟,离心力12000g离心15分钟,弃沉淀,将上清移入新管。ITC纯化步骤:(1)向上清液中添加NaCl至终浓度为2mol/L,37℃水浴、20分钟,离心力12000g离心15min,弃上清;(2)加入20mL预冷的PBS重悬沉淀,冰浴20分钟,离心力10000g于4℃离心15分钟,弃沉淀,将上清移入新管。此即为一轮ITC循环。所得上清继续进行ITC纯化。经过3轮ITC纯化处理后,由SDS-PAGE电泳证明获得90%以上纯度的ELP[I]40/NT-proBNP重组蛋白,结果如图3所示。
4.根据蛋白UV定量法测定步骤3获得的ELP[I]40/NT-proBNP重组蛋白浓度,用PBS稀释成25μmol/L浓度,以1℃为梯度测定从16℃到40℃重组蛋白溶液在350nm处的吸光度值,当某个温度下OD350是最大吸光值一半时,该温度为相变温度Tt。通过上述方法确定NT-proBNP重组蛋白的相变温度为31℃,结果如图4所示。
5.将步骤3获得的重组蛋白ELP[I]40/NT-proBNP通过ELISA方法测定免疫血清的效价。ELP[I]40/NT-proBNP重组蛋白经逐级稀释后包被96孔酶标板,经过封闭液封闭后,加入HyTest公司生产的鼠源抗NT-proBNP13-20氨基酸残基的单克隆抗体13G12(1:2500稀释),用血清白蛋白作空白对照。二抗为辣根过氧化酶标记羊抗小鼠IgG抗体(1∶5000),底物为TMB,显色10分钟后用2M的硫酸终止,测定波长450nm处的OD值,结果如图5所示,重组蛋白ELP[I]40/NT-proBNP具有良好的与鼠源抗NT-proBNP13-20氨基酸残基的单克隆抗体13G12结合能力。
6.ELISA方法测定重组蛋白ELP[I]40/NT-proBNP在人血浆中免疫反应稳定性。方法同步骤5,将10pmol/ml ELP[I]40/NT-proBNP重组蛋白与人血浆共孵育0h、1h、3h、5h、24h、48h和72h,测定波长450nm处的OD值。结果如图6所示,0h至5h重组蛋白ELP[I]40/NT-proBNP在人血浆中免疫反应活性从100%下降到70%左右,从5h至72h免疫反应活性基本保持不变。
实施例三
1.构建NT-proBNP融合表达载体pET28a(+)/ELP[I]40/NT-proBNP。基于人源BNP基因序列(EMBL登入号码AB037521.1)设计优化NT-proBNP基因,委托南京金斯瑞生物科技有限公司按照Seq ID.NO.1合成NT-proBNP基因,基因结构如图1所示。利用基因两端的EcoRⅠ和XhoⅠ酶切位点将NT-proBNP基因克隆到pET28a(+)/ELP[I]40载体上,形成NT-proBNP融合表达载体pET28a(+)/ELP[I]40/NT-proBNP,其核苷酸序列为Seq ID.NO.2,融合表达载体结构如图2所示。
2.将构建好的表达载体电击转化BL21(DE3)大肠杆菌菌株(购置于宝生物工程(大连)有限公司),将鉴定过的转化子接种到10毫升含有硫酸卡那霉素(Kan)50微克每毫升的LB培养基中,过夜培养。次日,以1:100接种到500毫升含有Kan50微克每毫升LB培养基的2升三角瓶中,200rpm、37℃振荡培养,直至OD600达到0.6。然后,在25℃、200rpm条件下添加1毫摩尔的IPTG进行诱导表达6小时,在此过程,在大肠杆菌胞内表达重组蛋白。LB培养基的配方如下:胰蛋白胨(Tryptone)10g/L,酵母提取物(Yeast extract)5g/L,氯化钠(NaCl)10g/L。
3.离心力为4000g离心6分钟收集菌体,加入25mL PBS重悬,置冰浴中超声破碎(条件为:功率80W,破碎时间2秒,破碎间隔3秒,总时间25分钟),离心力为10000g离心15分钟,弃沉淀,将上清移入新管。上清中加入DNase(DNA酶),其在溶液中的最终浓度为50μg/mL,冰浴20分钟,离心力12000g离心15分钟,弃沉淀,将上清移入新管。ITC纯化步骤:(1)向上清液中添加NaCl至终浓度为2mol/L,37℃水浴、20分钟,离心力12000g离心15min,弃上清;(2)加入20mL预冷的PBS重悬沉淀,冰浴20分钟,离心力10000g于4℃离心15分钟,弃沉淀,将上清移入新管。此即为一轮ITC循环。所得上清继续进行ITC纯化。经过3轮ITC纯化处理后,由SDS-PAGE电泳证明获得90%以上纯度的ELP[I]40/NT-proBNP重组蛋白,结果如图3所示。
4.根据蛋白UV定量法测定步骤3获得的ELP[I]40/NT-proBNP重组蛋白浓度,用PBS稀释成25μmol/L浓度,以1℃为梯度测定从16℃到40℃重组蛋白溶液在350nm处的吸光度值,当某个温度下OD350是最大吸光值一半时,该温度为相变温度Tt。通过上述方法确定NT-proBNP重组蛋白的相变温度为31℃,结果如图4所示。
5.将步骤3获得的重组蛋白ELP[I]40/NT-proBNP通过ELISA方法测定免疫血清的效价。ELP[I]40/NT-proBNP重组蛋白经逐级稀释后包被96孔酶标板,经过封闭液封闭后,加入HyTest公司生产的鼠源抗NT-proBNP13-20氨基酸残基的单克隆抗体13G12(1:2500稀释),用血清白蛋白作空白对照。二抗为辣根过氧化酶标记羊抗小鼠IgG抗体(1∶5000),底物为TMB,显色10分钟后用2M的硫酸终止,测定波长450nm处的OD值,结果如图5所示,重组蛋白ELP[I]40/NT-proBNP具有良好的与鼠源抗NT-proBNP13-20氨基酸残基的单克隆抗体13G12结合能力。
6.ELISA方法测定重组蛋白ELP[I]40/NT-proBNP在人血浆中免疫反应稳定性。方法同步骤5,将10pmol/ml ELP[I]40/NT-proBNP重组蛋白与人血浆共孵育0h、1h、3h、5h、24h、48h和72h,测定波长450nm处的OD值。结果如图6所示,0h至5h重组蛋白ELP[I]40/NT-proBNP在人血浆中免疫反应活性从100%下降到70%左右,从5h至72h免疫反应活性基本保持不变。
本发明实施方式不限此,根据本发明的上述内容,按照本领域的普通技术知识和通用方法,在不脱离本发明上述基本技术思想前提下,本发明还可以有其它的实施方式。如可以用其它的大肠杆菌胞内表达载体等表达该类型的重组蛋白。因此,本发明还可以做出其它多种形式的修改、替换或变更,均落在本发明权利保护范围之内。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
参考文献:
1.林衡,李军明,葛高顺,张立超,孙利慧,胡学军*.聚乙二醇对ELP[I]40相变温度的影响.中国生物工程杂志.2013,33(5):81-85。
<110> 大连大学
<120> 一种基于类弹性蛋白标签制备重组N-端脑钠肽前体的方法
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 228
<212> DNA
<213> 人工合成
<400> 1
cacccgctgg gcagccccgg ttcagcctcg gacttggaaa cgtccgggtt acaggagcag 60
cgcaaccatt tgcagggcaa actgtcggag ctgcaggtgg agcagacatc cctggagccc 120
ctccaggaga gcccccgtcc cacaggtgtc tggaagtccc gggaggtagc caccgagggc 180
atccgtgggc accgcaaaat ggtcctctac accctgcggg caccacga 228
<210> 2
<211> 6217
<212> DNA
<213> 人工合成
<400> 2
atccggatat agttcctcct ttcagcaaaa aacccctcaa gacccgttta gaggccccaa 60
ggggttatgc tagttattgc tcagcggtgg cagcagccaa ctcagcttcc tttcgggctt 120
tgttagcagc cggatctcag tggtggtggt ggtggtgctc gagttatcaa cgcggagcac 180
gcagggtgta caggaccatt ttacggtgac cacggatgcc ttccgtggca acttcgcgac 240
ttttccacac gccggtcgga cgcggggatt cttgcagcgg ttccagactc gtttgttcga 300
cctgcagttc gctcagttta ccctgcagat ggttacgttg ttcctgcagg cccgaggttt 360
ccagatcaga cgcgctaccc ggtgagccca gcgggtgact tgacgacgac gagcctgaga 420
tgcgaccttc gatacccaga ttattattat tattattatt attattgttt gacgagacca 480
ggaattctgg cccgcccggc ccaatacctg gcacaccaat acctggaaca ccgatacctg 540
gcacaccaat acctggtaca ccaataccag gaacaccaat acctggcaca ccgataccag 600
gcacaccgat accaggaaca ccaataccag gcacaccaat accaggcacg cccggcccaa 660
tacctggcac accaatacct ggaacaccga tacctggcac accaatacct ggtacaccaa 720
taccaggaac accaatacct ggcacaccga taccaggcac accgatacca ggaacaccaa 780
taccaggcac accaatacca ggcacgcccg gcccaatacc tggcacacca atacctggaa 840
caccgatacc tggcacacca atacctggta caccaatacc aggaacacca atacctggca 900
caccgatacc aggcacaccg ataccaggaa caccaatacc aggcacacca ataccaggca 960
cgcccggccc aatacctggc acaccaatac ctggaacacc gatacctggc acaccaatac 1020
ctggtacacc aataccagga acaccaatac ctggcacacc gataccaggc acaccgatac 1080
caggaacacc aataccaggc acaccaatac caggcacgcc gtgacccatt gaaccgtcca 1140
aacccatggt atatctcctt cttaaagtta aacaaaatta tttctagagg ggaattgtta 1200
tccgctcaca attcccctat agtgagtcgt attaatttcg cgggatcgag atctcgatcc 1260
tctacgccgg acgcatcgtg gccggcatca ccggcgccac aggtgcggtt gctggcgcct 1320
atatcgccga catcaccgat ggggaagatc gggctcgcca cttcgggctc atgagcgctt 1380
gtttcggcgt gggtatggtg gcaggccccg tggccggggg actgttgggc gccatctcct 1440
tgcatgcacc attccttgcg gcggcggtgc tcaacggcct caacctacta ctgggctgct 1500
tcctaatgca ggagtcgcat aagggagagc gtcgagatcc cggacaccat cgaatggcgc 1560
aaaacctttc gcggtatggc atgatagcgc ccggaagaga gtcaattcag ggtggtgaat 1620
gtgaaaccag taacgttata cgatgtcgca gagtatgccg gtgtctctta tcagaccgtt 1680
tcccgcgtgg tgaaccaggc cagccacgtt tctgcgaaaa cgcgggaaaa agtggaagcg 1740
gcgatggcgg agctgaatta cattcccaac cgcgtggcac aacaactggc gggcaaacag 1800
tcgttgctga ttggcgttgc cacctccagt ctggccctgc acgcgccgtc gcaaattgtc 1860
gcggcgatta aatctcgcgc cgatcaactg ggtgccagcg tggtggtgtc gatggtagaa 1920
cgaagcggcg tcgaagcctg taaagcggcg gtgcacaatc ttctcgcgca acgcgtcagt 1980
gggctgatca ttaactatcc gctggatgac caggatgcca ttgctgtgga agctgcctgc 2040
actaatgttc cggcgttatt tcttgatgtc tctgaccaga cacccatcaa cagtattatt 2100
ttctcccatg aagacggtac gcgactgggc gtggagcatc tggtcgcatt gggtcaccag 2160
caaatcgcgc tgttagcggg cccattaagt tctgtctcgg cgcgtctgcg tctggctggc 2220
tggcataaat atctcactcg caatcaaatt cagccgatag cggaacggga aggcgactgg 2280
agtgccatgt ccggttttca acaaaccatg caaatgctga atgagggcat cgttcccact 2340
gcgatgctgg ttgccaacga tcagatggcg ctgggcgcaa tgcgcgccat taccgagtcc 2400
gggctgcgcg ttggtgcgga tatctcggta gtgggatacg acgataccga agacagctca 2460
tgttatatcc cgccgttaac caccatcaaa caggattttc gcctgctggg gcaaaccagc 2520
gtggaccgct tgctgcaact ctctcagggc caggcggtga agggcaatca gctgttgccc 2580
gtctcactgg tgaaaagaaa aaccaccctg gcgcccaata cgcaaaccgc ctctccccgc 2640
gcgttggccg attcattaat gcagctggca cgacaggttt cccgactgga aagcgggcag 2700
tgagcgcaac gcaattaatg taagttagct cactcattag gcaccgggat ctcgaccgat 2760
gcccttgaga gccttcaacc cagtcagctc cttccggtgg gcgcggggca tgactatcgt 2820
cgccgcactt atgactgtct tctttatcat gcaactcgta ggacaggtgc cggcagcgct 2880
ctgggtcatt ttcggcgagg accgctttcg ctggagcgcg acgatgatcg gcctgtcgct 2940
tgcggtattc ggaatcttgc acgccctcgc tcaagccttc gtcactggtc ccgccaccaa 3000
acgtttcggc gagaagcagg ccattatcgc cggcatggcg gccccacggg tgcgcatgat 3060
cgtgctcctg tcgttgagga cccggctagg ctggcggggt tgccttactg gttagcagaa 3120
tgaatcaccg atacgcgagc gaacgtgaag cgactgctgc tgcaaaacgt ctgcgacctg 3180
agcaacaaca tgaatggtct tcggtttccg tgtttcgtaa agtctggaaa cgcggaagtc 3240
agcgccctgc accattatgt tccggatctg catcgcagga tgctgctggc taccctgtgg 3300
aacacctaca tctgtattaa cgaagcgctg gcattgaccc tgagtgattt ttctctggtc 3360
ccgccgcatc cataccgcca gttgtttacc ctcacaacgt tccagtaacc gggcatgttc 3420
atcatcagta acccgtatcg tgagcatcct ctctcgtttc atcggtatca ttacccccat 3480
gaacagaaat cccccttaca cggaggcatc agtgaccaaa caggaaaaaa ccgcccttaa 3540
catggcccgc tttatcagaa gccagacatt aacgcttctg gagaaactca acgagctgga 3600
cgcggatgaa caggcagaca tctgtgaatc gcttcacgac cacgctgatg agctttaccg 3660
cagctgcctc gcgcgtttcg gtgatgacgg tgaaaacctc tgacacatgc agctcccgga 3720
gacggtcaca gcttgtctgt aagcggatgc cgggagcaga caagcccgtc agggcgcgtc 3780
agcgggtgtt ggcgggtgtc ggggcgcagc catgacccag tcacgtagcg atagcggagt 3840
gtatactggc ttaactatgc ggcatcagag cagattgtac tgagagtgca ccatatatgc 3900
ggtgtgaaat accgcacaga tgcgtaagga gaaaataccg catcaggcgc tcttccgctt 3960
cctcgctcac tgactcgctg cgctcggtcg ttcggctgcg gcgagcggta tcagctcact 4020
caaaggcggt aatacggtta tccacagaat caggggataa cgcaggaaag aacatgtgag 4080
caaaaggcca gcaaaaggcc aggaaccgta aaaaggccgc gttgctggcg tttttccata 4140
ggctccgccc ccctgacgag catcacaaaa atcgacgctc aagtcagagg tggcgaaacc 4200
cgacaggact ataaagatac caggcgtttc cccctggaag ctccctcgtg cgctctcctg 4260
ttccgaccct gccgcttacc ggatacctgt ccgcctttct cccttcggga agcgtggcgc 4320
tttctcatag ctcacgctgt aggtatctca gttcggtgta ggtcgttcgc tccaagctgg 4380
gctgtgtgca cgaacccccc gttcagcccg accgctgcgc cttatccggt aactatcgtc 4440
ttgagtccaa cccggtaaga cacgacttat cgccactggc agcagccact ggtaacagga 4500
ttagcagagc gaggtatgta ggcggtgcta cagagttctt gaagtggtgg cctaactacg 4560
gctacactag aaggacagta tttggtatct gcgctctgct gaagccagtt accttcggaa 4620
aaagagttgg tagctcttga tccggcaaac aaaccaccgc tggtagcggt ggtttttttg 4680
tttgcaagca gcagattacg cgcagaaaaa aaggatctca agaagatcct ttgatctttt 4740
ctacggggtc tgacgctcag tggaacgaaa actcacgtta agggattttg gtcatgaaca 4800
ataaaactgt ctgcttacat aaacagtaat acaaggggtg ttatgagcca tattcaacgg 4860
gaaacgtctt gctctaggcc gcgattaaat tccaacatgg atgctgattt atatgggtat 4920
aaatgggctc gcgataatgt cgggcaatca ggtgcgacaa tctatcgatt gtatgggaag 4980
cccgatgcgc cagagttgtt tctgaaacat ggcaaaggta gcgttgccaa tgatgttaca 5040
gatgagatgg tcagactaaa ctggctgacg gaatttatgc ctcttccgac catcaagcat 5100
tttatccgta ctcctgatga tgcatggtta ctcaccactg cgatccccgg gaaaacagca 5160
ttccaggtat tagaagaata tcctgattca ggtgaaaata ttgttgatgc gctggcagtg 5220
ttcctgcgcc ggttgcattc gattcctgtt tgtaattgtc cttttaacag cgatcgcgta 5280
tttcgtctcg ctcaggcgca atcacgaatg aataacggtt tggttgatgc gagtgatttt 5340
gatgacgagc gtaatggctg gcctgttgaa caagtctgga aagaaatgca taaacttttg 5400
ccattctcac cggattcagt cgtcactcat ggtgatttct cacttgataa ccttattttt 5460
gacgagggga aattaatagg ttgtattgat gttggacgag tcggaatcgc agaccgatac 5520
caggatcttg ccatcctatg gaactgcctc ggtgagtttt ctccttcatt acagaaacgg 5580
ctttttcaaa aatatggtat tgataatcct gatatgaata aattgcagtt tcatttgatg 5640
ctcgatgagt ttttctaaga attaattcat gagcggatac atatttgaat gtatttagaa 5700
aaataaacaa ataggggttc cgcgcacatt tccccgaaaa gtgccacctg aaattgtaaa 5760
cgttaatatt ttgttaaaat tcgcgttaaa tttttgttaa atcagctcat tttttaacca 5820
ataggccgaa atcggcaaaa tcccttataa atcaaaagaa tagaccgaga tagggttgag 5880
tgttgttcca gtttggaaca agagtccact attaaagaac gtggactcca acgtcaaagg 5940
gcgaaaaacc gtctatcagg gcgatggccc actacgtgaa ccatcaccct aatcaagttt 6000
tttggggtcg aggtgccgta aagcactaaa tcggaaccct aaagggagcc cccgatttag 6060
agcttgacgg ggaaagccgg cgaacgtggc gagaaaggaa gggaagaaag cgaaaggagc 6120
gggcgctagg gcgctggcaa gtgtagcggt cacgctgcgc gtaaccacca cacccgccgc 6180
gcttaatgcg ccgctacagg gcgcgtccca ttcgcca 6217
- 还没有人留言评论。精彩留言会获得点赞!